Gepersonaliseerd behandelplan
Uitgangsvraag
Wanneer wordt dosisreductie/verlenging of dosisverhoging/interval verkorting van omalizumab, dupilumab (nog geen vergoedingsstatus) of ciclosporine aanbevolen bij de behandeling van chronische urticaria?
Aanbeveling
- Bepaal in overleg met de patiënt de mogelijke en gewenste behandeldoelen voor een gepersonaliseerd behandelplan. Gebruik het ‘Figuur 1. Stepped-care model’
- Beoordeel zorgvuldig of zelfinjectie geschikt is voor de patiënt, vooral bij patiënten met (onvoldoende gecontroleerde) astma, een verhoogd risico op ernstige allergische reacties of gebruik van andere immunomodulerende medicatie die extra monitoring vereist.
- Hanteer bij de start van omalizumab één priksinstructie onder begeleiding van een verpleegkundige, met een observatietijd van 30 minuten. Plan een extra instructiemoment indien de patiënt aanvullende begeleiding nodig heeft om zelfinjectie veilig en met vertrouwen uit te voeren.
- Overweeg dosisverhoging naar 450-600 mg per 4 weken bij onvoldoende ziektecontrole na meer dan 3 maanden behandeling met omalizumab standaarddosis (300 mg per 4 weken).
- Staak de behandeling met omalizumab indien na 3 maanden behandeling met de verhoogde dosering (600 mg elke 4 weken) geen verbetering is opgetreden.
- Overweeg bij partiële verbetering met omalizumab de toevoeging van ciclosporine (off-label). De startdosering is afhankelijk van comorbiditeiten, de voorkeur van de patiënt, de ziekteactiviteit, de initiële respons op omalizumab en het risico op bijwerkingen.
- Wees ervan bewust dat een lage dosis van ciclosporine (2-3 mg/kg/dag) effectief kan zijn bij de behandeling van CU, zowel als monotherapie als in combinatie met andere behandelingen.
- Overweeg bij goede ziektecontrole na dosisverhoging van omalizumab de dosering af te bouwen naar 300 mg per 4 weken.
- Overweeg bij complete ziektecontrole gedurende minimaal 3 maanden onder behandeling met omalizumab het behandelinterval stapsgewijs met 1 week per interval te verlengen.
- Staak de behandeling bij een complete ziektecontrole bij interval van 8 weken.
- Hanteer bij een recidief klachten het langste interval waarbij de ziekte onder controle was.
- Overweeg op een later moment, bij stabiele ziektecontrole, opnieuw het interval te verlengen of de behandeling te staken.
- Overweeg bij complete ziektecontrole gedurende minimaal 3 maanden onder behandeling met dupilumab (CSU) het behandelinterval te verlengen naar 4 tot 6 weken (nog geen vergoedingsstatus, januari 2026).
- Overweeg, bij een sterke wens van de patiënt of bij hinderlijke bijwerkingen, om antihistaminica af te bouwen of te stoppen, mits de aanvullende therapie voldoende effect heeft.
Disclaimer: er is tot op heden (januari 2026) in Nederland nog geen vergoedingsstatus beschikbaar voor dupilumab bij chronische spontane urticaria
Let op: Wanneer een off-label medicament wordt voorgeschreven, dient gehandeld te worden volgens de bijbehorende voorwaarden (zie voorwaarden van de IGJ).
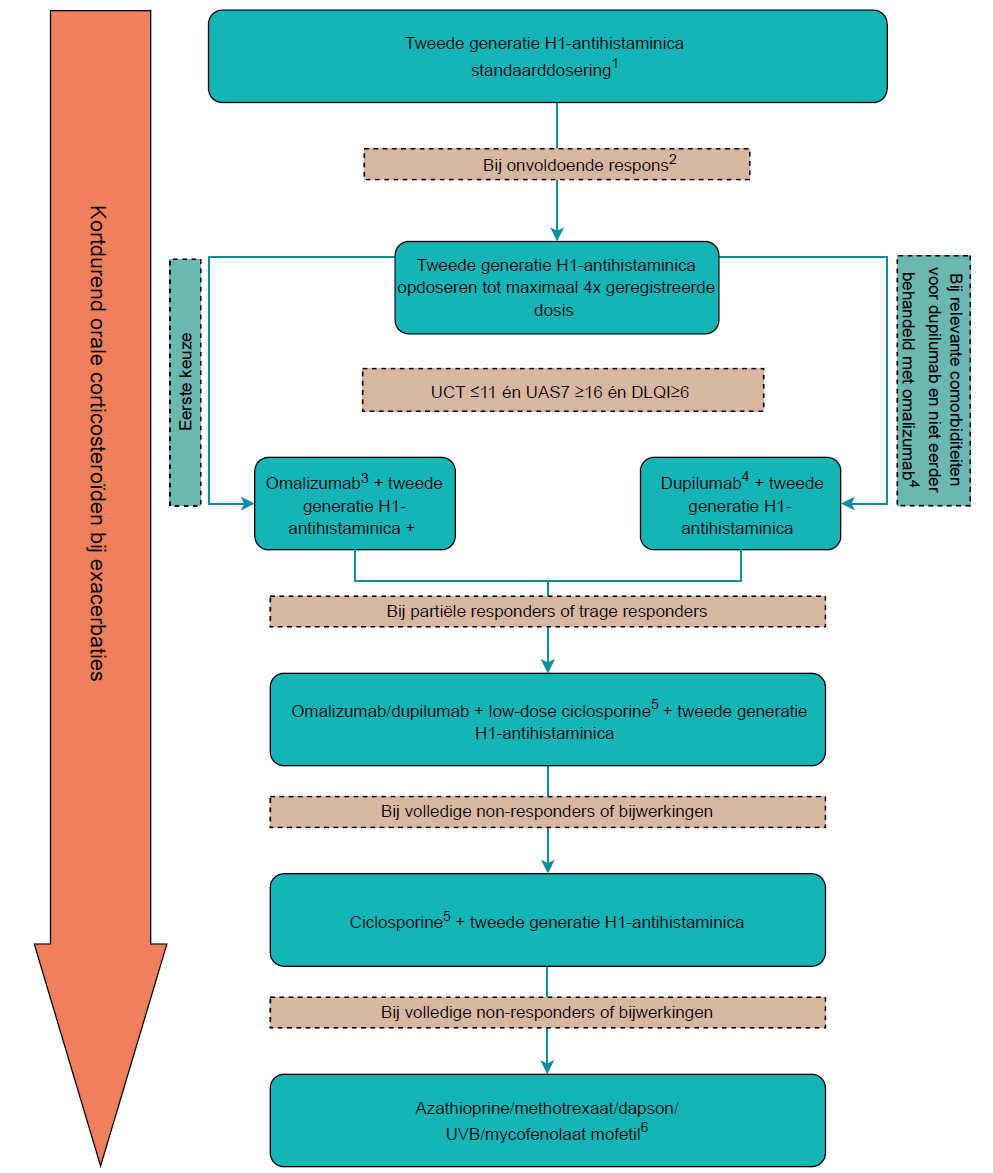
Figuur 1. Stepped-care model voor behandeling van chronische urticaria
1. Bij ineffectiviteit, sedatie of bijwerkingen switchen naar een andere tweede generatie H1-AH.
2. Evalueer het effect van tweede generatie H1-antihistaminca steeds na 2-4 weken.
3. Omalizumab 300 mg per 4 weken. Evalueer het effect na 3-6 maanden. Overweeg respectievelijk dosisverlaging of -verhoging bij goede dan wel onvoldoende ziektecontrole. Overweeg bij onvoldoende ziektecontrole de dosis te verhogen naar 450 mg of 600 mg per 4 weken.
4. Dupilumab 300 mg per 2 weken. Evalueer het effect na 3-6 maanden. De behandeling middels omalizumab zal eerste keus blijven voor patiënten met matig tot ernstige CSU die onvoldoende reageren op opgehoogde H1-anthistaminica. Overweeg bij patiënten met CSU én relevante comorbiditeiten waarvoor dupilumab een geregistreerde behandeling is, die onvoldoende reageren op opgehoogde H1-anthistaminica en nog geen behandeling middels omalizumab hebben gehad, behandeling met dupilumab te starten. Let op: nog geen vergoedingsstatus (januari 2026). Zie ook Dupixent | European Medicines Agency (EMA).
5. Ciclosporine 2-3 mg/kg/dag als aanvullende behandeling (off-label). Overweeg bij partiële responders voor ciclosporine als aanvullende behandeling aan omalizumab/dupilumab en opgehoogde dosering H1-antihistaminica. Bij volledige non-responders switchen van omalizumab of dupilumab naar ciclosporine als aanvullende behandeling in combinatie met opgehoogde dosering H1-antihistaminica. Evalueer het effect na 4-12 weken.
6. Keuze afhankelijk van co-morbiditeit (off-label).
NB1: deze figuur hoort bij de module ‘gepersonaliseerd behandelplan’ van de richtlijn ‘chronische urticaria’. Lees altijd de overwegingen en aanbevelingen van de betreffende module voor nuances, eventuele afwijkende situaties en extra achtergrondinformatie.
NB2: betrek de patiënt bij de besluitvorming.
Let op: er is tot op heden (jan 2026) nog geen vergoedingsstatus beschikbaar voor dupilumab bij CSU. Zie ook Dupixent | European Medicines Agency (EMA).
Overwegingen
Kwaliteit van het bewijs
Voor deze vraag is geen systematische literatuuranalyse verricht. De overwegingen en aanbevelingen zijn gebaseerd op expert opinion. Voor de uitwerking is gebruik gemaakt van enkele losse ondersteunende artikelen. Sussman (2020) en Yuan (2022) zijn meegenomen uit het systematisch literatuuronderzoek van andere uitgangsvragen, terwijl de overige studies zijn aangeleverd door de werkgroep. De werkgroep heeft op basis van de zeer beperkte literatuur en haar expert opinion geprobeerd om de aanbevelingen te formuleren.
Balans van gewenste en ongewenste effecten
Omalizumab
Dosisverhoging van omalizumab kan leiden tot verbeterde ziektecontrole, vooral bij patiënten die niet adequaat reageren op de standaarddosis. Hoewel de bijwerkingen vergelijkbaar zijn met die bij lagere doseringen, kunnen patiënten met een hoog BMI een hogere dosis nodig hebben om een therapeutisch effect te bereiken (Metz, 2020; Curto-Barredo, 2018; Kocatürk, 2018). Daarnaast vormen de hoge kosten van een dosisverhoging een belangrijke overweging bij de beslissing om de dosering te verhogen.
Dosisreductie kan zorgverbruik en -kosten verlagen, wat de beschikbaarheid van omalizumab vergroot. Minder frequente doses kunnen het gebruiksgemak en de therapietrouw verbeteren, vooral bij patiënten die moeite hebben met een vast schema. Echter, een lagere dosis kan de effectiviteit verminderen en klachten doen toenemen, waardoor nauwkeurige monitoring en mogelijk meer ziekenhuisbezoeken nodig zijn om de ziekte onder controle te houden.
Ciclosporine (off-label)
Ciclosporine heeft een breder en ernstiger bijwerkingenprofiel, waardoor patiënten regelmatig stoppen met de behandeling vanwege bijwerkingen, die soms ernstig kunnen zijn. Derhalve is het belangrijk om de minimale effectieve dosis te hanteren en de behandeling nauwkeurig te monitoren op tekenen van toenemende toxiciteit, met name voor afname van de nierfunctie, ontwikkeling van hypertensie of ontwikkeling van huidmaligniteiten (zie NVDV richtlijn Constitutioneel Eczeem, 2019). De minimale effectieve dosis is afhankelijk van de patiënt en van de indicatie. Een dosis hoger dan 5mg/kg is niet onderzocht of geadviseerd en het gebruik van ciclosporine ≥ 3mg/kg als onderhoudsdosering wordt ook niet aanbevolen. Het effect van ciclosporine kan na 4 tot 12 weken worden geëvalueerd.
Het vinden van de optimale dosering voor zowel omalizumab als ciclosporine vereist daarom een zorgvuldige afweging van de gewenste en de ongewenste effecten, waarbij frequente monitoring en aanpassing van de behandeling noodzakelijk zijn om een balans te bereiken die zowel effectief als veilig is voor de patiënt.
Professioneel perspectief
Bij de behandeling van CU is een gepersonaliseerde aanpak essentieel. De keuze en opbouw van de behandeling moeten worden afgestemd op de specifieke situatie, voorkeuren en behandeldoelen van de patiënt. Dit vereist een zorgvuldige afweging van effectiviteit, veiligheid en gebruiksgemak, waarbij zowel de voordelen als de mogelijke bijwerkingen en risico’s worden meegenomen. Daarnaast is het belangrijk om onnodig medicijngebruik te vermijden en het behandelplan te personaliseren.
De werkgroep adviseert dat zelfinjectie met omalizumab patiënten meer autonomie biedt, maar niet voor iedereen geschikt is. Er wordt aanbevolen om bij patiënten met onvoldoende gecontroleerd astma, een verhoogd risico op ernstige allergische reacties of bij gelijktijdig gebruik van andere immunomodulerende medicatie extra monitoring toe te passen en behandeling in een klinische setting te overwegen (gehele behandelduur met omalizumab). Bij de start van omalizumab dient een prikinstructie onder begeleiding van een verpleegkundige plaats te vinden, met een observatietijd van 30 minuten. Indien nodig kan een extra instructiemoment worden ingepland om de patiënt voldoende vertrouwd te maken met zelfinjectie.
De dosering van omalizumab kan worden aangepast op basis van de behandelingsrespons. Bij onvoldoende ziektecontrole na drie maanden behandeling met de standaarddosering (300 mg per 4 weken) kan een dosisverhoging naar 450 mg of 600 mg per 4 weken worden overwogen. Indien er ondanks deze verhoging geen verbetering optreedt, dient de behandeling te worden gestaakt.
Bij partiële verbetering kan toevoeging van ciclosporine worden overwogen, waarbij de startdosering afhankelijk is van factoren zoals comorbiditeiten, ziekteactiviteit en de initiële respons op omalizumab. Lage doses ciclosporine (2-3 mg/kg/dag) kunnen effectief zijn als monotherapie of in combinatie met andere behandelingen, met een maximale dosering van 5 mg/kg en of maximaal 400 mg/dag. Vanwege de vaak snelle werking van ciclosporine (2-4 weken) kan bij een goede respons worden afgebouwd of bij een onvolledige respons de dosering worden verhoogd.
De werkgroep adviseert dat bij patiënten met stabiele ziektecontrole na dosisverhoging van omalizumab overwogen wordt de dosering weer af te bouwen naar 300 mg per 4 weken. Indien gedurende minimaal drie maanden complete ziektecontrole wordt bereikt, kan het behandelinterval stapsgewijs met één week per interval worden verlengd. Bij een interval van acht weken zonder terugkeer van klachten kan de behandeling op proef worden gestaakt. Mocht er sprake zijn van een relaps, dan dient het behandelinterval te worden teruggebracht naar de langste periode waarin de ziekte onder controle was. Bij stabiele ziektecontrole kan later opnieuw worden geprobeerd het interval te verlengen of de behandeling volledig te stoppen.
Bij patiënten die worden behandeld met dupilumab en minimaal drie maanden complete ziektecontrole hebben, adviseert de werkgroep het behandelinterval te verlengen naar 3 tot 6 weken. Dit vermindert de medicatielast en draagt bij aan een efficiëntere inzet van de behandeling, zonder afbreuk te doen aan de effectiviteit.
De werkgroep adviseert om aan kinderen, zwangere en lacterende vrouwen zo min mogelijk medicatie voor te schrijven, vooral als dit niet noodzakelijk is. Dit geldt ook bij het toevoegen van omalizumab/ciclosporine als aanvullende therapieën, wanneer viermaal de standaarddosering van tweede generatie antihistaminica onvoldoende effect heeft. De behandelaar dient daarbij kritisch te beoordelen of de antihistaminica nog toegevoegde waarde hebben en moet onnodig medicijngebruik vermijden door deze medicatie indien mogelijk te stoppen of af te bouwen.
Verder dient de behandelaar het Kinderformularium te raadplegen voor de actuele doseringen en op basis van de mogelijke en gewenste behandeldoelen van de kinderen het behandelplan te personaliseren. Zie voor aanvullende informatie de module Behandeling van CU bij kinderen en module Behandeling van CU tijdens de kinderwens (ook bij mannen), zwangerschap en lacterende vrouw.
Waarden en voorkeuren van patiënten
Voor patiënten is het belangrijk om hun klachten goed te kunnen monitoren en het medicatiegebruik zorgvuldig op te volgen. Aangezien het effect van de behandelopties kan variëren, is het van belang dat het behandelplan aangepast kan worden aan de ernst van de klachten en de wensen van de patiënt. Hierbij dient ook rekening te worden gehouden met individuele omstandigheden, zoals de impact van chronische urticaria is op hun dagelijks leven, werk en hobby’s.
Tevens kunnen patiënten verschillende prioriteiten hebben zoals het verminderen van bijwerkingen en het behouden van een hoge kwaliteit van leven. Sommige patiënten geven mogelijk de voorkeur aan een hogere dosis om snel en effectief klachtenvrij te worden, ondanks het verhoogde risico op bijwerkingen. Terwijl anderen juist kunnen kiezen voor een lagere dosis om bijwerkingen te minimaliseren. Deze verschillen in behandelwensen en -doelen vragen om maatwerk in de behandeling. Patiënten met goede ziekte respons op een aanvullende therapie kunnen aarzelen om het interval te verlengen uit angst voor ziekteverergering.
Voor de behandeld arts is het cruciaal om deze waarden en voorkeuren van de patiënten te begrijpen en mee te nemen in hun behandelplan. De behandeling moet aansluiten op de individuele behoeften en verwachtingen van de patiënt. Een goede afstemming en, indien nodig, tussentijdse bijstelling van de behandeling dragen bij aan een optimaal resultaat.
Aanvaardbaarheid en haalbaarheid
Dosisverhoging van omalizumab gaat gepaard met substantiële stijgingen in de zorgkosten door het gebruik van meer (dure) geneesmiddelen. Hoewel deze kosten momenteel door de zorgverzekeraar worden vergoed, is het van essentieel belang dat de behandelaars zich bewust zijn van de kosten en hun verantwoording nemen. Doelmatig gebruik van het middel staat centraal.
Aan de andere kant kan het verlengen van de intervallen tussen omalizumab giften en staken van de behandeling bij het bereiken van een 8-weken klachtenvrij interval leiden tot aanzienlijke kostenbesparingen door vermindering van de uitgaven aan het (duurdere) geneesmiddel.
Bij dosisaanpassingen in de behandeling met ciclosporine is er daarentegen nauwelijks invloed op de geneesmiddelenkosten of overige zorgkosten. Dit maakt dosisaanpassingen relatief kosteneffectief zonder veel extra kosten voor het zorgsysteem.
Onderbouwing
Achtergrond
Chronische urticaria is een heterogene aandoening, wat betekent dat de oorzaak, het beloop en de klachten sterk kunnen variëren tussen individuen. Dit vraagt om een gepersonaliseerd behandelplan door middel van doseringsoptimalisatie. Dit kan zowel een dosisverhoging of verkorting van het interval, als een dosisreductie of verlenging van het interval betekenen. Het centraal stellen van de autonomie van de patiënt en het hanteren van ‘shared decision making’ zijn cruciaal in dit proces. Het is van belang om samen met de patiënt de behandeldoelen duidelijk te bespreken en vast te stellen, afgestemd op de mogelijkheden en persoonlijke voorkeuren. Hierdoor wordt niet alleen gewerkt aan het verminderen van klachten, maar wordt er ook rekening gehouden met wat voor de patiënt haalbaar en wenselijk is.
Omalizumab
Omalizumab is een monoklonaal antilichaam dat selectief bindt aan humaan immunoglobuline E (IgE). Het complex dat zich vormt, voorkomt binding IgE aan de hoog-affiene IgE receptor (FcɛRI) op het oppervlak van o.a. mestcellen en basofiele granulocyten. Hierdoor neemt de hoeveelheid vrije IgE die beschikbaar is af en wordt tevens de receptorexpressie verminderd. Het precieze werkingsmechanisme is echter niet volledig opgehelderd. Omalizumab is sinds 2005 in Europa geregistreerd voor astma en sinds februari 2014 is dit middel ook geregistreerd als add-on therapie voor de behandeling van chronische spontane urticaria (CSU) bij volwassen en adolescente (12 jaar en ouder) patiënten die onvoldoende reageren op behandeling met H1-antihistaminica met een standaard dosis van 300 mg per 4 weken.
Beoordeel zorgvuldig of zelfinjectie geschikt is voor de patiënt, vooral bij patiënten met (onvoldoende gecontroleerde) astma, een verhoogd risico op ernstige allergische reacties.
Acute reacties binnen enkele uren na toediening van omalizumab zijn beschreven bij patiënten die dit middel gebruikten voor ernstig astma, vaak in de vorm van een astma-exacerbatie. Bij patiënten zonder astma is het risico op een acute reactie na toediening van omalizumab verwaarloosbaar, ook in combinatie met andere medicatie.
Ciclosporine (off-label)
Ciclosporine A is een calcineurine remmer, een cyclisch peptide bestaande uit 11 aminopeptiden met een immunosuppressief effect. De immunosuppressieve werking van ciclosporine kan verklaard worden door remming van de transcriptie van T-cel cytokine genen. Naast remming van interleukine-2 (IL-2), is ook een remmend effect op IL-3, IL-4, GM-CSF, TNF-alpha en IFN-gamma expressie beschreven. Ciclosporine is in Nederland onder andere geregistreerd voor de behandeling van psoriasis en ernstig constitutioneel eczeem. Het voorschrijven van ciclosporine voor CU in Nederland is off-label. Ciclosporine wordt standaard gebruikt bij andere aandoeningen inclusief dermatosen zoals atopisch eczeem, waarbij doseringen rond 3 mg/kg lichaamsgewicht gebruikelijk zijn. De startdosis verschilt per individu, variërend van 2mg tot 3mg/kg lichaamsgewicht.
Omalizumab en ciclosporine zijn gericht op het moduleren van het immuunsysteem om de ziektecontrole te verbeteren. CU is een complexe aandoening en niet iedereen bereikt adequate ziektecontrole met standaardtherapie (zie Figuur 1. Stepped-care model).
Samenvatting literatuur
Beschrijving van de resultaten
Omalizumab
In een fase-IIIb gerandomiseerde open-label studie (OPTIMA) van Sussman et al. (2020) werden 314 patiënten met refractaire CSU in twee groepen verdeeld: 178 patiënten kregen met 150 mg en 136 patiënten met 300 mg elke 4 weken, gedurende 24 weken. Bij onvoldoende controle na 8 weken op 150 mg werd de dosis verhoogd naar 300 mg. Na 24 weken werden patiënten ingedeeld o.b.v. hun respons: 1) 8 weken stopfase (bij goede controle); 2) verhoging naar 300 mg gedurende 12 weken (bij onvoldoende controle op 150 mg); 3) behandeling verlengen gedurende 12 weken (bij onvoldoende controle op 300 mg). Patiënten in de stopfase werden gemonitord en bij recidief opnieuw behandeld met de initiële dosis gedurende 12 weken. 115 van 314 patiënten (36,6%) bereikten adequate ziektecontrole na de initiële 24 weken behandeling. Van de 56 patiënten die na een recidief opnieuw behandeld werden, bereikte 87,8% adequate controle.
Verhoging van de dosis bij 141 van 178 patiënten van 150 mg naar 300 mg verbeterde de UAS7-score met 9,5 punten (95% CI; 7,6-11,3). Bijwerkingen, vooral hoofdpijn (3,8%), werden bij 41 patiënten (13,1%) gerapporteerd, en 13 patiënten stopten vanwege bijwerkingen. De studie concludeerde dat het ophogen van omalizumab naar 300 mg bij een groter deel van de patiënten bijdraagt aan het bereiken van goede ziektecontrole en dat herbehandeling met omalizumab net zo effectief is als de initiële therapie.
Yuan et al. (2022) voerden een dubbelblinde, gerandomiseerde gecontroleerde studie (RCT) uit naar de effectiviteit van verschillende doseringen van omalizumab als add-on therapie bij antihistaminica. In totaal werden 403 patiënten gerandomiseerd in drie groepen: omalizumab 300 mg (n=168), omalizumab 150 mg (n=167) en placebo (n=83). De interventie duurde 12 weken, gevolgd door een follow-up van acht weken zonder interventie. De onderzoeksgroep beoordeelde de volgende uitkomsten: Itch Severity Score (ISS7), UAS7, complete respons (UAS7 = 0), gedeeltelijke respons (UAS7 < 6), wekelijkse hives score (HHS7), de dermatologische kwaliteit van leven (DLQI) en bijwerkingen. Deze studie laat zien dat na 12 weken de ISS7-score in de omalizumab 300 mg groep verbeterde met 4,23 punten ten opzichte van de placebogroep, terwijl de verbetering in de 150 mg groep 3,79 punten was. Na 12 weken verbeterde de gemiddelde UAS7 bij omalizumab 300mg 10,19 (p<0,001) ten opzicht van de placebogroep en 9,12 (p<0,001) bij omalizumab 150mg. In totaal bereikten 62 patiënten (36,9%) in de 300 mg groep een complete respons (UAS7=0), 39 patiënten (23,3%) in de 150 mg groep en 4 patiënten (4,8%) in de placebogroep. Een gedeeltelijke respons (UAS7 ≤ 6) werd gezien bij 81 patiënten (48,2%) in de 300 mg groep, 79 patiënten (47,3%) in de 150 mg groep en 9 patiënten (10,8%) in de placebogroep. De DLQI-score verbeterde na 12 weken met 4 punten in de 300 mg groep ten opzichte van de placebogroep, en met 3,5 punten in de 150 mg groep. Bijwerkingen kwamen iets vaker voor in de 300 mg groep. Er werd één ernstige bijwerking gemeld in de omalizumab 150 mg groep, namelijk een bekkenontsteking.
Ciclosporine
Deze review omvat zowel vergelijkende als niet-vergelijkende studies.
De systematische review van Kulthanan et al. (2018) onderzocht de effectiviteit en veiligheid van ciclosporine in CSU patiënten en voerden een meta-analyse uit. In totaal werden er 18 studies (n=909), inclusief 2 RCT’s, geïncludeerd. Van de 909 patiënten kregen respectievelijk 125, 363 en 266 patiënten zeer lage (<2 mg/kg/dag), lage (van 2 tot <4 mg/kg/dag) en matige (4-5 mg/kg/dag) doses ciclosporine. Na 4 weken was de gemiddelde relatieve verandering in de UAS-score van met ciclosporine behandelde patiënten -17,89, terwijl die van de controlegroep -2,3 was. Het algemene responspercentage op ciclosporinebehandeling met lage tot matige doses na 4, 8 en 12 weken was respectievelijk 54%, 66% en 73%. Geen enkele studie over zeer lage doses ciclosporine evalueerde de responspercentages na 4, 8 en 12 weken. Onder de patiënten die behandeld werden met zeer lage, lage en matige doses ciclosporine, rapporteerde respectievelijk 6%, 23% en 57% één of meer bijwerkingen. De resultaten dienen met voorzichtigheid te worden geïnterpreteerd. ciclosporine is effectief bij lage tot matige doses. Bijwerkingen lijken dosisafhankelijk te zijn en komen voor bij meer dan de helft van de patiënten die met matige doses ciclosporine worden behandeld. De studie suggereerde dat de geschikte dosering van ciclosporine voor CSU kan variëren van 1 tot 5 mg/kg/d en 3 mg/kg/d is een redelijke startdosis voor de meeste patiënten.
Risk of bias
De systematische review van Kulthanan et al. (2018) had een methodologisch goede opzet en heeft een laag risico op bias. De studies van Sussman et al. (2020) en Yuan (2022) hebben beiden een matige risico op bias. Zie evidence tabellen.
Omalizumab
De onderstaande studies zijn aangeleverd door de werkgroep en zijn geen vergelijkende studies. Het is van belang op te merken dat ze niet bijdragen aan het bewijsniveau. Desondanks kunnen ze wel ter ondersteuning dienen van de aanbevelingen.
Aghdam et al. (2019) voerden een retrospectieve cohortstudie uit naar de effectiviteit en veiligheid van dosisverhoging bij omalizumab als add-on therapie bij antihistaminica (viermaal standaarddosering) bij 166 patiënten. Van deze patiënten ontvingen 122 de standaarddosis van 300 mg per vier weken, terwijl 44 patiënten een hogere dosering kregen (450 mg bij 11 patiënten en 600 mg bij 33 patiënten). Bij 9 patiënten in de dosisverhogingsgroep werd het dosisinterval ingekort tot 2 tot 3 weken, wat resulteerde in een totale dosis van meer dan 600 mg per vier weken. Na gemiddeld 8,3 standaardtoedieningen werden hogere doses toegediend. De UAS7 scores vertoonden een significante verbetering bij het vergelijken van UAS7 vóór de dosisverhoging (mediaan 20,0; IQR 10,5-26,0) met het einde van de dosisverhoging (mediaan 4,3; IQR 0-14,0) (p<0,0001). De meest gerapporteerde bijwerkingen tijdens de dosisverhoging waren hoofdpijn, koortsachtig gevoel en vermoeidheid, zonder toename vergelijken met de standaardbehandeling. De studie concludeerde dat dosisverhoging bij 61% van de patiënten tot klinische verbetering leidde.
De studie van Aghdam et al. (2020) onderzocht het optimale behandelinterval voor omalizumab bij CU patiënten (81% CSU). In totaal werden er 132 patiënten gevolgd over 16 maanden: 1) 38 patiënten stopten met behandeling vanwege goede respons (GR-stop); 2) 26 patiënten herstartten de behandeling na een recidief (GR-RS); 3) 58 patiënten bleven continu behandeld (CT) en 4) 10 patiënten stopten vanwege slechte respons (PR). Voor de GR-RS-groep werden twee periodes onderscheiden: vóór en na herstart van omalizumab (GR-RS1 en GR-RS2).
Alle patiënten begonnen met omalizumab 300 mg per 4 weken. Bij goede controle werd het interval na 6 toedieningen verlengd met een week per gift, tot een maximum van 8 weken.Bij klachten tijdens een verlengd behandelinterval werd het interval verkort naar het laatste klachtenvrije interval. Het maximale effectieve interval werd bepaald door het steady-state interval, gedefinieerd als het langste interval met goede controle (UCT ≥ 12 of UAS7 ≤ 6) gedurende ten minste 2 achtereenvolgende giften. Het mediane steady-state interval was 7 weken (IQR 5-8), langer bij GR-RS2 (8 weken) dan bij CT (6 weken) (p<0,001). 60% van de patiënten met actieve ziekte bereikte een steady-state interval ≥6 weken en 25% een interval ≥8 weken. In de GR-RS2-groep bereikte 39% een interval van 8 weken of langer, versus 19% in de CT-groep (p=0,005). Bij 73% van de patiënten die voor het eerst met omalizumab startten, werd een steady-state interval van 6 weken of langer worden bereikt en bij 57% een interval van 8 weken of langer. Patiënten met een vroege goede klinische respons op omalizumab behandeling (UCT≥12 binnen een maand) hadden meer kans op een steady-state interval van 6 weken of langer vergeleken met patiënten met een late respons (87% versus 70%, p=0,023). De studie concludeerde dat intervalverlenging het meest succesvol is bij vroege responders en bij patiënten die na beëindiging opnieuw met omalizumab zijn gestart.
De studie van Buters et al. (2021) onderzocht de effectiviteit en verdraagbaarheid van een gepersonaliseerd behandelplan met omalizumab bij 44 patiënten met verschillende subtypes van CIndU. Vóór de behandeling met omalizumab hadden 31 patiënten geen ziektecontrole en 13 patiënten gedeeltelijke controle. De patiënten kregen drie giften van 300mg omalizumab per 4 weken. Na 12 weken hadden 6 patiënten (14%) volledige controle, 16 (36%) goede controle, 14 (32%) partiële controle, en 8 (18%) geen controle. Vervolgens werd de behandeling voortgezet volgens het gepersonaliseerd behandelplan. 37% van de patiënten kozen voor dosisverhoging, wat resulteerde in volledige controle bij 25%, goede controle bij 41%, partiële controle bij 25%, en geen controle bij 9%. 9 patiënten konden het interval tussen de giften verlengen tot 6 of 7 weken, en 4 konden stoppen na 8 weken, hoewel 3 van hen een terugval kregen binnen 12 weken en weer snel reageerden op herbehandeling. Vertraagde drukurticaria, het meest voorkomende subtype, toonde de beste respons met 10 van de 13 patiënten die volledige of goede controle bereikten. Bijwerkingen, die door 32 patiënten werden gemeld, waren mild en omvatten vermoeidheid, gewrichtspijn, hoofdpijn, en gewichtstoename. Dosisverhoging leidde tot slechts 3 nieuwe bijwerkingen (hoofdpijn) zonder verergering van bestaande bijwerkingen.
De studie van Niemeyer-van der Kolk et al. (2018) onderzocht een gepersonaliseerd behandelalgoritme met omalizumab bij 63 patiënten met CSU. Alle patiënten kregen drie doses van 300 mg omalizumab per 4 weken. Na 12 weken werd de effectiviteit geëvalueerd. Bij volledige remissie werd het dosisinterval geleidelijk verlengd tot maximaal 8 weken, zolang de remissie aanhield. De behandeling werd gestopt als de patiënt na 4 extra doses nog steeds in remissie was. Bij recidief werd het dosisinterval aangepast aan de duur van de symptoomvrije periode. Bij aanhoudende partiële respons werd de dosis verhoogd naar 450 mg per 4 weken of werd het interval verkort naar 3 weken als de klachten in de vierde week verergerden. Indien nodig werden doses verhoogd tot 600 mg per 3-4 weken om volledige remissie te bereiken. Niet-responders na 3 doses kregen direct een dosisverhoging naar 450 mg. Na 12 weken bereikten 34 patiënten (54%) volledige respons, 25 patiënten (40%) partiële respons en 1 patiënt (1,6%) geen respons. Drie patiënten stopten wegens bijwerkingen. Van de 25 patiënten met partiële respons bereikten 14 (56%) volledige respons met een gepersonaliseerd plan. Elf patiënten (44%) hadden een partiële respons na het gepersonaliseerd behandelplan. Van de 24 patiënten bij wie het dosisinterval werd verlengd tot 8 weken, bleven 14 (58%) symptoomvrij. Bij 10 patiënten trad een recidief op na stopzetting van de behandeling, maar de behandeling werd meestal succesvol hervat. Deze studie benadrukt het klinische voordeel van dosisoptimalisatie van omalizumab bij patiënten met refractaire CSU.
De literatuur review door Metz et al. (2020) onderzocht het opdoseren van omalizumab bij patiënten met refractaire CSU. Zij concluderen dat het verhogen van omalizumab kan leiden tot verbeteringen in UAS7, UCT en kwaliteit van leven bij patiënten die onvoldoende reageren op de standaarddosis omalizumab. Deze conclusie is gebaseerd op data uit negen studies, waarvan alle studies een retrospectieve opzet hadden. De startdosering van omalizumab varieerde tussen de studies en was niet standaard 300 mg per 4 weken, soms werd zelfs 150 mg per 3 of 4 weken gebruikt. Ook de verhoging van de dosis verschilde tussen de studies, variërend van 375 tot 600 mg.
De retrospectieve studie van Simons et al. (2024) onderzochten de effectiviteit van dosisverhoging omalizumab bij 104 CU patiënten die onvoldoende reageerden op de standaarddosis van 300 mg per 4 weken. Van deze patiënten vertoonde 51,9% (n=54) vertoonde een volledige of goede respons, 15,4% (n=16) een gedeeltelijke respons een partiële respons en 32,7% (n=34) geen respons. De mediane tijd van dosisverhoging was 8 maanden. De belangrijkste redenen voor het stoppen van behandeling waren goed gecontroleerde ziekte (48%) en ineffectiviteit (43%). Bij 12,4% van de patiënten (n=11) werd de behandeling gestaakt vanwege bijwerkingen zoals haaruitval, hoofdpijn en vermoeidheid. De studie identificeert partiële respons als voorspeller van effectiviteit voor dosis verhoging en benadrukt het belang van het overwegen van dosisverhoging van omalizumab voor patiënten met CU die slechts een gedeeltelijke respons op de standaarddosis vertonen.
Zoeken en selecteren
Voor deze vraag zijn de systematische review Kulthanan et al. (2018) en de studies van Sussman (2020) en Yuan (2022) uitgewerkt. Er is geen aanvullende systematische literatuuranalyse verricht, aangezien de werkgroep geen nieuwe relevante literatuur verwachtte te vinden na de publicatie van de internationale richtlijn door Zuberbier et al. (2022).
De overwegingen en aanbevelingen zijn gebaseerd op basis van expert opinion. Daarnaast zijn er enkele losse ondersteunende artikelen, aangedragen door de werkgroep (Aghdam, 2019; Aghdam 2020; Buters; 2021; Niemeyer-van der Kolk, 2018; Metz, 2020 en Simons, 2023).
Referenties
- Alizadeh Aghdam, M., Pieterse, R. H., Kentie, P. A., Rijken, F., Knulst, A. C., & Röckmann, H. (2020). Effective omalizumab interval prolongation in the treatment of chronic urticaria. The journal of allergy and clinical immunology. In practice, 8(10), 3667–3668.e1. https://doi.org/10.1016/j.jaip.2020.06.056.
- Alizadeh Aghdam, M., van den Broek, F., Rijken, F., Knulst, A. C., & Röckmann, H. (2020). High-dose omalizumab use in patients with chronic spontaneous urticaria. The journal of allergy and clinical immunology. In practice, 8(4), 1426–1427.e1. https://doi.org/10.1016/j.jaip.2019.10.018.
- Buters, T. P., van der Velden, W. A. C., Abdisalaam, I., van Maaren, M. S., & van Doorn, M. B. A. (2021). Effectiveness and tolerability of personalized omalizumab treatment in patients with chronic inducible urticaria. The journal of allergy and clinical immunology. In practice, 9(8), 3227–3229. https://doi.org/10.1016/j.jaip.2021.04.034.
- Curto-Barredo L, Spertino J, Figueras-Nart I, et al. Omalizumabupdosing allows disease activity control in patients with refractorychronic spontaneous urticaria. Br J Dermatol. 2018;179(1):210-212. Doi:10.1111//bjd.16379.
- Finlay, A. Y., Kaplan, A. P., Beck, L. A., Antonova, E. N., Balp, M. M., Zazzali, J., Khalil, S., & Maurer, M. (2017). Omalizumab substantially improves dermatology-related quality of life in patients with chronic spontaneous urticaria. Journal of the European Academy of Dermatology and Venereology : JEADV, 31(10), 1715–1721. https://doi.org/10.1111/jdv.14384.
- Het Kinderformularium, ciclosporine. Geraadpleegd op 18-09-2024 via https://www.kinderformularium.nl/geneesmiddel/80/ciclosporine.
- Het Kinderformularium, omalizumab. Geraadpleegd op 18-09-2024 via https://www.kinderformularium.nl/geneesmiddel/523/omalizumab.
- Kulthanan, K., Chaweekulrat, P., Komoltri, C., Hunnangkul, S., Tuchinda, P., Chularojanamontri, L., & Maurer, M. (2018). Cyclosporine for Chronic Spontaneous Urticaria: A Meta-Analysis and Systematic Review. The journal of allergy and clinical immunology. In practice, 6(2), 586–599. https://doi.org/10.1016/j.jaip.2017.07.017.
- Kocatürk E, Deza G, Kızıltaç K, Giménez-Arnau AM. Omalizumabupdosing for better disease control in chronic spontaneous urticaria patients. Int Arch Allergy Immunol. 2018;177(4):360-364. Doi:10.1159/000491530.
- LaCava, A. F., & Fadugba, O. O. (2023). Cyclosporine for omalizumab-refractory chronic urticaria: a report of five cases. Allergy, asthma, and clinical immunology : official journal of the Canadian Society of Allergy and Clinical Immunology, 19(1), 78. https://doi.org/10.1186/s13223-023-00820-4.
- Maoz-Segal, R., Levy, T., Haj-Yahia, S., Offengenden, I., Iancovich-Kidon, M., & Agmon-Levin, N. (2020). Combination therapy with omalizumab and an immune-suppressive agent for resistant chronic spontaneous rrticaria - A real-life experience. The World Allergy Organization journal, 13(8), 100448. https://doi.org/10.1016/j.waojou.2020.100448.
- Mateu-Arrom, L., Giménez-Arnau, A. M., Expósito-Serrano, V., Bonfill-Ortí, M., Serra-Baldrich, E., Yélamos, O., & Spertino, J. (2024). Cyclosporine for the treatment of chronic spontaneous urticaria refractory to antihistamines and omalizumab: a case series. International journal of dermatology, 10.1111/ijd.17358. Advance online publication. https://doi.org/10.1111/ijd.17358.
- Maurer, M., Kaplan, A., Rosén, K., Holden, M., Iqbal, A., Trzaskoma, B. L., Yang, M., & Casale, T. B. (2018). The XTEND-CIU study: Long-term use of omalizumab in chronic idiopathic urticaria. The Journal of allergy and clinical immunology, 141(3), 1138–1139.e7. https://doi.org/10.1016/j.jaci.2017.10.018.
- Maurer, M., Sofen, H., Ortiz, B., Kianifard, F., Gabriel, S., & Bernstein, J. A. (2017). Positive impact of omalizumab on angioedema and quality of life in patients with refractory chronic idiopathic/spontaneous urticaria: analyses according to the presence or absence of angioedema. Journal of the European Academy of Dermatology and Venereology : JEADV, 31(6), 1056–1063. https://doi.org/10.1111/jdv.14075.
- Metz, M., Vadasz, Z., Kocatürk, E., & Giménez-Arnau, A. M. (2020). Omalizumab Updosing in Chronic Spontaneous Urticaria: an Overview of Real-World Evidence. Clinical reviews in allergy & immunology, 59(1), 38–45. https://doi.org/10.1007/s12016-020-08794-6.
- Nederlands Tijdschrift voor Dermatologie en Venereologie. (2021). Intervalverlenging bij omalizumab behandeling van patiënten met chronische urticaria. Nederlands Tijdschrift voor Dermatologie en Venereologie, 31(7), Supplement augustus 2021.
- Niemeyer-van der Kolk, T., evan Maaren, M. S., & van Doorn, M. B. A. (2018). Personalized omalizumab treatment improves clinical benefit in patients with chronic spontaneous urticaria. The Journal of allergy and clinical immunology, 142(6), 1992–1994. https://doi.org/10.1016/j.jaci.2018.07.032.
- NVDV Richtlijn Constitutioneel Eczeem 2019. Geraadpleegd op 24-07-2024 via: https://richtlijnendatabase.nl/richtlijn/constitutioneel_eczeem/constitutioneel_eczeem_-_korte_beschrijving.html.
- Metz M, Vadasz Z, Kocatürk E, Giménez-Arnau AM. Omalizumabupdosing in chronic spontaneous urticaria: an overview of real-world evidence. Clin Rev Allergy Immunol. 2020;59(1):38- 45.doi:10.1007/s1201 6- 020- 08794-6120.
- Sánchez, J., Alvarez, L., & Cardona, R. (2020). Cyclosporine and omalizumab together: A new option for chronic refractory urticaria. The journal of allergy and clinical immunology. In practice, 8(6), 2101–2103. https://doi.org/10.1016/j.jaip.2020.02.012.
- Simons, J. V. L., Soegiharto, R., Knulst, A. C., van den Reek, J. M. P. A., & Röckmann, H. (2024). Performance of high-dose omalizumab in chronic urticaria is predicted by initial improvement to standard dose. The journal of allergy and clinical immunology. In practice, S2213-2198(24)00637-8. Advance online publication. https://doi.org/10.1016/j.jaip.2024.06.014.
- Staubach, P., Metz, M., Chapman-Rothe, N., Sieder, C., Bräutigam, M., Canvin, J., & Maurer, M. (2016). Effect of omalizumab on angioedema in H1 -antihistamine-resistant chronic spontaneous urticaria patients: results from X-ACT, a randomized controlled trial. Allergy, 71(8), 1135–1144. https://doi.org/10.1111/all.12870.
- Summary of Product Characteristics – Xolair (omalizumab).Novartis Europharm Limited. [Date of issue of marketing authori-sation 25 Oct 2005].
- Sussman, G., Hébert, J., Gulliver, W., Lynde, C., Yang, W. H., Papp, K., Gooderham, M., Chambenoit, O., Khalil, S., DeTakacsy, F., Vieira, A., & Rihakova, L. (2020). Omalizumab Re-Treatment and Step-Up in Patients with Chronic Spontaneous Urticaria: OPTIMA Trial. The journal of allergy and clinical immunology. In practice, 8(7), 2372–2378.e5. https://doi.org/10.1016/j.jaip.2020.03.022.
- Yuan, W., Hu, S., Li, M., Yang, L., Liu, L., Zheng, M., Guo, Z., Song, Z., Zhang, C., Diao, Q., Xu, J., Richard, A., Patwardhan, M., Lyu, T., Uddin, A., Fogel, R., Ligueros-Saylan, M., & Zheng, J. (2022). Efficacy and safety of omalizumab in Chinese patients with anti-histamine refractory chronic spontaneous urticaria. Dermatologic therapy, 35(4), e15303. https://doi.org/10.1111/dth.15303.
- Zuberbier, T., Abdul Latiff, A. H., Abuzakouk, M., Aquilina, S., Asero, R., Baker, D., Ballmer-Weber, B., Bangert, C., Ben-Shoshan, M., Bernstein, J. A., Bindslev-Jensen, C., Brockow, K., Brzoza, Z., Chong Neto, H. J., Church, M. K., Criado, P. R., Danilycheva, I. V., Dressler, C., Ensina, L. F., Fonacier, L., … Maurer, M. (2022). The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy, 77(3), 734–766. https://doi.org/10.1111/all.15090.
Evidence tabellen
Beoordeling risk of bias door middel van Cochrane collaboration tool
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Random sequence generation (selection bias)
(high/unclear/low risk) |
Allocation concealment (selection bias)
(high/unclear/low risk) |
Blinding of participants and personnel (performance bias) All outcomes
(high/unclear/low risk) |
Blinding of outcome assessor (detection bias) All outcomes
(high/unclear/low risk) |
Incomplete outcome data (attrition bias) All outcomes
(high/unclear/low risk) |
Selective reporting (reporting bias)
(high/unclear/low risk) |
Other bias
(high/unclear/low risk) |
|
Sussman, 2020 |
An interactive response technology provider using a validated system that automated the random assignment of patient numbers to randomization numbers. |
Low |
Unclear |
High |
High |
Low |
Low |
Low |
|
Yuan, 2021 |
Randomisatie methode niet beschreven |
Unclear
|
Unclear |
Low (double blind studie) |
Low (double blind studie) |
Low <10% lost to follow up, redenen genoemd.
|
Low |
Low |
Systematische review- Beoordeling risk of bias door middel van AMSTAR
|
Study
First year, author |
Appropriate and clearly focused question? 1
Yes/no |
Comprehensive and systematic literature search?2
Yes/partial yes/ no |
Description of included and excluded studies?3
Yes/partial yes/ no |
Description of relevant characteristics of included studies?4
Yes/partial yes/no |
Assessment of scientific quality of included studies?5
Yes/partial yes/no |
Enough similarities between studies to make combining them reasonable?6 Yes/partial yes/ no |
Potential risk of publication bias taken into account?7
Yes/partial yes/ no |
Potential conflicts of interest reported?8
Yes/partial yes/ no |
|
Kulthanan, 2018 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-01-2026
Beoordeeld op geldigheid : 28-01-2026
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep grotendeels in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update).
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn Chronische Urticaria (CU) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Aanleiding en afbakening onderwerp
Op initiatief van de Nederlandse Vereniging voor Dermatologie en Venereologie is de richtlijn chronische urticaria in 2023-2024 modulair herzien. De herziening betreft overwegend de toevoeging van nieuwe modules met klinische relevante onderwerpen welke ontbraken of toe waren aan herziening: classificatie, monitoring van ziekteactiviteit, ziektecontrole en ziektelast, behandeling van CSU en CIndU bij volwassenen, behandeling bij kinderen, behandeling tijdens zwangerschap, borstvoeding en kinderwens, organisatie van zorg en gepersonaliseerd behandelplan.
Financiering
De ontwikkeling van deze richtlijn is gefinancierd door de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De SKMS ondersteunt medisch-specialistische beroepsverenigingen bij het bevorderen van de kwaliteit van zorg. De financiering heeft geen invloed gehad op de inhoudelijke totstandkoming van de richtlijn. De werkgroep heeft onafhankelijk gewerkt conform de geldende methodologische standaarden.
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen over begeleiding en behandeling van patiënten met chronische urticaria.
Doelgroep
De richtlijn is bestemd voor leden van de medische en paramedische beroepsgroep. Daartoe behoren onder andere: Dermatologen, verpleegkundig specialisten, physician assistants, Secundair kan de richtlijn nuttig zijn voor internisten, allergologen, kinderartsen, huisartsen en apothekers. Voor patiënten werd informatie op thuisarts.nl en een patiënten folder ontwikkeld.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. Naast de afgevaardigden van de verschillende beroepsgroepen is er ook een patiëntvertegenwoordiger betrokken geweest bij de ontwikkeling van de richtlijn.
|
Werkgroepleden |
Vereniging |
|
Dr. H. Röckman, dermatoloog (voorzitter) |
NVDV |
|
Dr. M.B.A. van Doorn, dermatoloog |
NVDV |
|
Drs. B. Peters, dermatoloog |
NVDV |
|
Drs. M. Stadermann, kinderarts-allergoloog |
NVK |
|
Dr. J.N.G. Oude Elberink, internist-allergoloog |
NVvAKI |
|
P.A. Kentie, verpleegkundig specialist |
V&VN |
|
Prof. Dr. E.P. van Puijenbroek, arts, klinisch farmacoloog |
Lareb |
|
P. van den Broek, patiëntvertegenwoordiger |
HN |
|
C. Berkhof, patiëntvertegenwoordiger |
PU |
|
Ondersteuning werkgroep |
Vereniging |
|
Drs. T. M. Nlgisang, arts-onderzoeker (vanaf juni 2023) |
NVDV |
|
Drs. L.J. van den Oord, arts-onderzoeker (vanaf april 2024) |
NVDV |
|
Dr. W.A. van Enst, klinisch epidemioloog & directeur NVDV |
NVDV |
|
Drs. M.R. Masselink, arts-onderzoeker (vanaf april 2025) |
NVDV |
|
Drs. T. A. Teunissen, arts-onderzoeker (vanaf april 2025) |
NVDV |
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciëring) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroeplid |
Hoofdfunctie(s) |
Nevenfunctie(s) |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Acties (voorstel) |
|
Mw. Dr. H. Röckman, (voorzitter) |
Dermatoloog (UMC Utrecht) |
Geen |
(nationale) global adviesraad Novartis Sanofi
Research Roundup ThirdHarmonic
Spreker vergoeding Novartis |
Geen |
Geen |
Geen |
Geen |
16-4-2023 |
Geen |
|
Dhr. Dr. M.B.A. van Doorn |
Dermatoloog-klinisch farmacoloog (Erasmus MC) 0,8 fte
Dermatoloog-klinisch farmacoloog (Centre for Human Drug Research) 0,2 fte |
Spreker, deelname aan adviesraden en organisatie van nascholingen i.s.m. de farmaceutische industrie waarvoor financiële vergoeding (Novartis, AbbVie, Pfizer, LEO pharma, Sanofi, Lilly, Janssen, UCB, BMS, Celgene, Third Harmonic) |
Adviseur voor Novartis (deelname adviesraden) |
Geen |
Uitvoering/deelname aan verschillende extern gefinancierde clinical trials op gebied van chronische urticaria (Novartis, Sanofi, ThirdHarmonic) |
Geen |
Geen |
25-09-2023 |
Geen |
|
Dhr. Drs. B. Peters |
Dermatoloog (Rijnstate) |
|
|
|
|
|
|
|
|
|
Mw. Drs. M. Stademann |
Kinderarts-allergoloog (UMC Utrecht en Diakonessenhuis Utrecht)
Adviseur Allergie team (Kinderkliniek Almere) |
Bestuursectie KinderAllergologie (NVK)
Organisator basiscurcus kinderallergologie |
Geen |
Geen |
Geen |
Geen |
Geen |
16-11-2023 |
Geen |
|
Mw. Dr. J.N.G. Oude Elberink |
Internist-allergoloog (UMCG) |
|
|
|
|
|
|
|
|
|
Mw. P.A. Kentie |
Verpleegkundig specialist allergologie (UMC Utrecht) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
23-09-2023 |
Geen |
|
Dhr. Prof. Dr. E.P. van Puijenbroek |
Senior adviseur Bijwerkingen centrum Lareb |
Verbonden aan Rijksuniversiteit Groningen waarvan tot 1 maart 2024 als bijzonder hoogleraar |
Geen |
Geen |
Geen |
Geen |
Geen |
29-72024 |
Geen |
|
Dhr. P. van den Broek |
Eigenaar Van den Broek Advies & Interim
Adviseur/projectleider voor Huid Nederland
Een deel van die activiteiten wordt mede mogelijk gemaakt door externe financiëring van Novartis (publicatie naar patiënten in kader van Wereldnetelroosdag, informatie over urticaria op de websittes Patiëntenplatform Urticaria en Huid Nederland). Die activiteiten staan los van de inzet in het kader van de richtlijnen
|
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
22-09-2023 |
Geen |
|
Dhr. C. Berkhof |
Patiëntenvertegenwoordiger
Key Accountmanager Benelux Sunrise Medical BV |
Beheerder van de Facebook Pagina Urticaria NL/BE; met 800+ leden.
Eigenaar van de website www.urticaria.nl
Alle werkzaamheden zijn onbetaald vanuit een derde partij; dit wordt betaald uit eigen (privé) middelen.
EMA; soms meedenken of deelname over het uitvoeren van nieuwe studies |
Geen |
Geen |
Geen |
Geen |
Geen |
22-09-2023 |
Geen |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiënten perspectief in alle modules van de herziende richtlijn Chronische Urticaria door de zitting neming van afgevaardigden van Huid Nederland (HN) en Patiëntenplatform Urticariapatiënt (PU) in de werkgroep en de opname van een module over patiëntenvoorlichting. conceptrichtlijn is tevens voor commentaar voorgelegd aan HN en PU.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (gebaseerd op het stroomschema ontwikkeld door FMS).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst Raming |
Toelichting |
|
Gepersonaliseerd behandelplan |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens zal een samenvatting worden gemaakt. De voorlichtingsfolder van de NVDV zal worden afgestemd op de richtlijn. Het volledige implementatieplan is opgenomen in het bijlagedocument.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Onderstaand is de methode stapsgewijs beschreven.
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. In deze bijeenkomst zijn knelpunten aangedragen door de werkgroepleden en gemandateerde van verschillende (wetenschappelijke) verenigingen en stakeholders.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse heeft de werkgroep uitgangsvragen opgesteld. Daarbij inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen en consultatie van experts. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. Literatuur is geselecteerd op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden bij de Zoekverantwoording.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen zijn overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs (2021)
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog
|
|
|
Redelijk
|
|
|
Laag
|
|
|
Zeer laag
|
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overkoepelende bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk. Door gebruik te maken van de Guideline Development Tool werd het Evidence to decision framework conform GRADE methodiek toegepast. Alle werkgroepleden hebben systematisch antwoord gegeven op vragen over de grootte van het effect en grootte van negatieve consequenties, waarden en voorkeuren van de patiënt, kosten en kosteneffectiviteit, beschikbaarheid van voorzieningen, aanvaardbaarheid, en overwegingen voor subgroepen in de patiëntenpopulatie. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie bijlagen bij de modules).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt. Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt) organisaties en stakeholders voorgelegd ter commentaar (zie ook tabel 1). De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter autorisatie.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from www.handbook.cochrane.org.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/ Laatst geraadpleegd op [DATUM geraadpleegd voor concepttekst].
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.