Evaluatie van spasticiteit
Uitgangsvraag
Hoe dient spasticiteit geëvalueerd te worden in termen van functies, activiteiten en participatie?
Aanbeveling
Houd bij de evaluatie van spasticiteit rekening met de volgende factoren:
- Er zijn verschillen in de rol en mate van spasticiteit tussen passieve condities (waarbij de spier door een externe kracht wordt bewogen) en actieve condities (waarbij de spier door de persoon zelf wordt aangespannen).
- Het onderscheid tussen (de mate van) spasticiteit ten opzichte van andere componenten van spastische parese, zoals verlies van spierkracht/selectiviteit en bijkomende weefselveranderingen zoals verkorting en verstijving, is moeilijk te maken met klinische testen alleen.
Bepaal de (mate van) spasticiteit aan de hand van het behandeldoel:
- Bij passieve behandeldoelen (bijv. verzorgbaarheid): kwantificeer de spasticiteit met passieve testen en breng de (mate van) secundaire klachten in kaart (zie tabel 1 en 2).
- Bij behandeldoelen op vaardigheidsniveau of bij ledematen met (rest-)functie: verricht aanvullend ook:
- kwantificatie van de spastische parese met actieve motorische testen (spierkracht, selectieve motoriek, en actief bewegingsbereik).
- basis neurologisch en orthopedisch onderzoek voor het bepalen van factoren die bijdragen aan de motorische controle.
- vaardigheidstesten (b.v. Action Research Arm Test / ARAT, Stroke Upper Limb Capacity Scale/SULCS).
- bij een individueel bepaalde vaardigheid of behandeldoel kunnen de Canadian Occupational Performance Measure (COPM) of Goal Attainment Scaling (GAS). worden gebruikt voor en na een behandeling.
- bij de onderste extremiteit: gangbeeldanalyse met dynamisch oppervlakte EMG is over het algemeen noodzakelijk indien chirurgische behandeling wordt overwogen met tevens een risico op achteruitgang in (loop)vaardigheid door de behandeling.
Overwegingen
De keuze voor een meetinstrument om spasticiteit in kaart te brengen, hangt sterk af van het doel van de meting. Hierbij onderscheiden we de volgende hoofddoelen:
- Neurologische diagnostiek.
- Kwantificeren van spasticiteit en van de gevolgen ervan op verschillende ICF-domeinen:
- stoornisniveau (bv. verhoogde spiertonus, reflexactiviteit; spier- en gewrichtseigenschappen).
- activiteiten en participatieniveau, bijvoorbeeld invloed op lopen, handfunctie, ADL).
- Vaststellen van de relatie tussen spasticiteit en de hulpvraag/secundaire klachten.
Bovenstaande doelen zullen achtereenvolgend aan bod komen.
1. Neurologische diagnostiek
In het kader van neurologische diagnostiek is de aanwezigheid van spasticiteit relevant om vast te stellen of er sprake is van centraal neurologische schade. Voor dat doel is een dichotome uitkomst (wel/geen aanwezigheid van spasticiteit) voldoende. Met een passieve rektest kan onderscheid worden gemaakt tussen spasticiteit en andere oorzaken van onwillekeurige spieractiviteit of biomechanische veranderingen, door het snelheidsafhankelijke karakter van de ervaren weerstand tegen passief bewegen. Het knipmesfenomeen (‘catch and release’) is kenmerkend voor spasticiteit, maar is bij ernstige vormen meestal niet meer waarneembaar. Het is met name de combinatie van snelheidsafhankelijke weerstand met de aanwezigheid van verhoogde of pathologische reflexen, zoals de vingerknipreflex of Babinski-reflex, die wijst op hyperreflexie en spasticiteit in het kader van een UMN-syndroom. Aangezien de uitkomsten dichotoom worden geïnterpreteerd, zijn de klinische en methodologische beperkingen van passieve rektesten (zoals beschreven onder ‘Literatuurselectie’) hier in mindere mate van toepassing.
2a. Kwantificeren van spasticiteit op stoornisniveau (functies en anatomische eigenschappen)
Klinische meetmethoden zijn eenvoudig toepasbare instrumenten die vaak worden gebruikt in de dagelijkse praktijk, maar ook in wetenschappelijke literatuur, voor het vaststellen van de mate van spasticiteit (tabel 1, domeinen 1 en 2). Veel gebruikt zijn rektesten die worden gedaan onder passieve condities (waarbij de patiënt op een onderzoeksbank ligt en wordt gevraagd zich zoveel mogelijk te ontspannen).
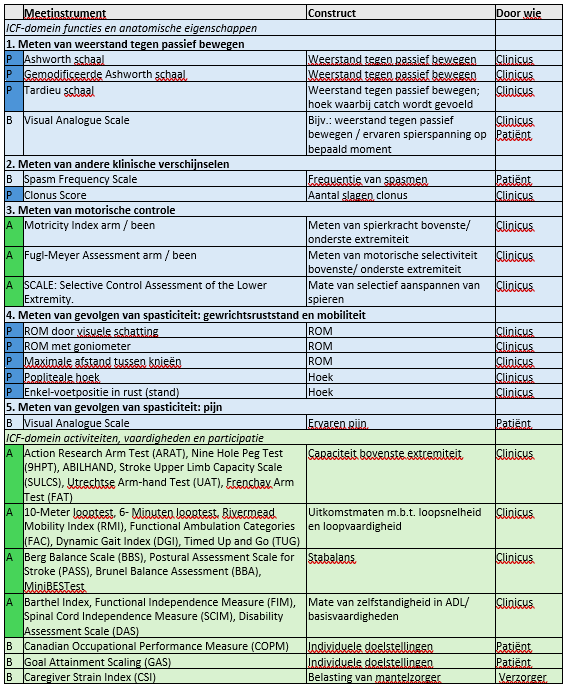
Tabel 1. Voorbeelden van meetmethoden voor (de mate en gevolgen van) spasticiteit op meerdere ICF-domeinen
Het bovenste gedeelte (blauw) betreft het ICF-domein functies en anatomische eigenschappen, het onderste gedeelte (groen) betreft het ICF-domein activiteiten en participatie. De letters in de eerste kolom geven aan of het meetinstrument in het passieve domein (P), in het actieve domein (A), of in beide domeinen (B) toegepast kan worden.
Voorbeelden van veel gebruikte passieve rektesten zijn de (gemodificeerde) Ashworth Schaal (Ashworth, 1964; Bohannon & Smith, 1987) op een schaal van 0 tot 4 (of inclusief een 1+ niveau of een 0-5 schaal in gemodificeerde versies), en de Tardieu test (Haugh, 2006). Zoals voorgaand beschreven, is hun betrouwbaarheid en validiteit beperkt. De uitkomst representeert niet sec spasticiteit (het beoogde construct), maar vaak ook veranderde weefseleigenschappen, die samen de ervaren weerstand tegen passief bewegen bepalen. Daarom wordt aanbevolen bij gebruik van deze meetschalen niet te spreken over “spasticiteit”, maar de uitkomst te beschrijven als “ervaren weerstand bij passief bewegen” (“perceived resistance to passive movement, PRPM”), dus in een 5-punts schaal van 0 (geen verhoogde weerstand) tot 4 (geen beweging ledemaat mogelijk) (Fleuren, 2014), analoog aan de items van de Ashworth scale. Een (zoveel mogelijk) gestandaardiseerde uitvoering wordt aanbevolen (Platz, 2008), zoals in tabel 2 weergegeven. Aanvullend geldt dat de mate van weerstand die gevoeld wordt onder passieve (test) condities weinig voorspellend is voor de mate van spasticiteit onder actieve condities, zoals bijvoorbeeld tijdens lopen of reiken.
Tabel 2. Ervaren weerstand bij passief bewegen (‘PRPM’) (Fleuren, 2018)
|
Perceived Resistance to Passive Movement (PRPM) test (Ervaren weerstand bij passief bewegen; afgeleid van Ashworth Schaal; Ashworth,1964) |
|
|
Score |
|
|
0 |
Geen verhoogde weerstand |
|
1 |
Lichte toename in weerstand, met een ‘catch’ tijdens bewegen van ledemaat in flexie of extensie |
|
2 |
Iets duidelijkere toename in weerstand, maar ledemaat kan makkelijk worden bewogen |
|
3 |
Duidelijke toename in weerstand, passief bewegen moeilijk |
|
4 |
Geen beweging ledemaat mogelijk |
|
Uitvoering: Patiënt in rug- of zijligging, zoveel mogelijk ontspannen. Patiënt wordt geïnstrueerd niet mee of tegen te werken met de beweging. Eerst wordt met een langzame beweging de PROM van het betreffende gewricht getest. Dan wordt de weerstand tegen bewegen in de gehele range vastgesteld met een beweging van ± 1 sec. Wordt maximaal 2x herhaald (laagste score noteren). |
|
In tabel 1 zijn zowel min of meer directe spasticiteitsmaten opgenomen, als ook meetinstrumenten voor het meten van de gevolgen van spasticiteit op alle niveaus van de ICF en bijkomende factoren (onderdelen 1, 2 en 3). De uitkomsten van deze laatste niveaus zijn vooral relevant in relatie tot de hulpvraag van de patiënt en ter evaluatie van een behandeling.
2b. Kwantificeren van spasticiteit op vaardigheids-, activiteiten- en participatieniveau
Verbetering van dagelijks functioneren is vaak een belangrijk doel van spasticiteitbehandeling. Er zijn verschillende meetinstrumenten voor verschillende vaardigheden: bijvoorbeeld de Action Research Arm Test (ARAT) voor arm/handvaardigheid. Voor loopvaardigheid zijn de 10-meter looptest of 6-minuten wandeltest voorbeelden voor het meten van loopsnelheid en -afstand, maar deze testen zeggen niets over de kwaliteit van het beweegpatroon en weinig over de rol van spasticiteit daarin. Als men geïnteresseerd is in dit laatste, is het raadzaam om aanvullend gangbeeldanalyse te doen in een bewegingslaboratorium. Het gebruik van dynamisch (oppervlakte) EMG tijdens de analyse wordt sterk aanbevolen, om vast te stellen of er sprake is van spasticiteit en of deze mogelijk problematisch is: overmatige spieractiviteit die de voorwaarden voor het lopen negatief beïnvloedt. Zeker indien invasieve en chirurgische behandeling wordt overwogen, is geïnstrumenteerde bewegingsanalyse en bespreking in een ervaren multidisciplinair team een voorwaarde.
Vergelijkbaar geïnstrumenteerd bewegingsonderzoek is nog niet beschikbaar voor de bovenste extremiteit. Daarbij blijven dus klinische testen en vaardigheidsonderzoek aanbevolen, eventueel in combinatie met (gestandaardiseerde) video-opnames, om de kwaliteit van bewegen vast te leggen.
Op participatieniveau moeten andere instrumenten worden gekozen, zoals de Canadian Occupational Performance Measure (COPM) of Goal Attainment Scaling (GAS). Dit zijn meetmethoden om vast te leggen wat de door de patiënt ervaren problemen tijdens dagelijkse handelingen zijn, of de verandering hierin. Deze meetinstrumenten kunnen ook duidelijkheid geven over het verwachtingspatroon van de patiënt en de haalbaarheid van de doelen. Er bestaan ook algemene vragenlijsten gericht op kwaliteit van leven.
3. Vaststellen van de relatie tussen spasticiteit en de hulpvraag/secundaire klachten
Spasticiteit kan negatieve gevolgen hebben, waarvoor het wenselijk kan zijn om behandeling in te zetten. De patiënt kan pijn of verminderde cosmetiek ervaren, of spasticiteit kan leiden tot andere secundaire problemen zoals decubitus, beperkingen in ROM (“contracturen”) of een inadequate zit- of lighouding. Deze kunnen op hun beurt weer gevolgen hebben voor de verzorging (hygiëne, aankleden, katheteriseren) of leiden tot vermindering van vaardigheid (bijvoorbeeld reiken, loopvaardigheid).
Het doel van evaluatie (en behandeling) hangt veelal nauw samen met de hulpvraag van de patiënt. Dit doel kan in verschillende domeinen liggen: zowel in het passieve domein (bijvoorbeeld houding, pijn, verzorgbaarheid) als ook in het actieve domein (motorische controle en vaardigheden/activiteiten; bijvoorbeeld verbetering van het staan of lopen). De keuze van meetinstrumenten dient hierop aangepast te worden (zie tabel 1).
Het klinische belang ligt vooral in het vaststellen van de rol van spasticiteit, biomechanische/weefselfactoren en andere componenten van de spastische parese, in samenhang met de hulpvraag. Heeft spasticiteit een relevante negatieve impact op het (ervaren) probleem? Men moet zich realiseren dat spasticiteit soms ook positieve gevolgen kan hebben, zoals houdingshandhaving door ondersteuning van de strekfunctie van het been of behoud van spiermassa. Meestal wordt echter geen onderscheid gemaakt tussen de ervaren mate van spasticiteit en het ervaren ongemak als gevolg van spasticiteit, hoewel deze maar beperkt met elkaar samen lijken te hangen (Fleuren, 2009). Het kan voor de patiënt moeilijk zijn hier onderscheid in te maken, omdat diens oordeel over de spasticiteit mede wordt beïnvloed door persoonlijke factoren (bijv. cognities of copingstrategie) en door externe omstandigheden waarin de spasticiteit optreedt. Een zelfscore, bijvoorbeeld door middel van een Visual Analogue Scale (VAS), kan desondanks waardevolle informatie geven. Deze afwegingen dienen meegenomen te worden in de besluitvorming voor een eventuele behandeling samen met de patiënt.
Waarden en voorkeuren van patiënten
In principe zijn klinische testen snel en makkelijk uitvoerbaar, en over het algemeen weinig belastend voor de patiënt. Geïnstrumenteerde meetmethoden en/of EMG kosten meer tijd voor de patiënt, maar zijn in het algemeen niet invasief. Het is belangrijk om met de patiënt te bespreken wat de persoonlijke doelen zijn (hulpvraag) en wat een eventuele behandeling zou kunnen zijn, en hierop de (belasting van de) testen afstemmen.
Bijvoorbeeld: een hulpvraag omtrent vaardigheidsbehoud/verbetering zal een uitgebreidere meetset rechtvaardigen met multidisciplinaire analyse, zeker wanneer bijvoorbeeld invasief ingrijpen overwogen wordt (zie ook de module Chirurgische behandeling aan de bovenste en onderste extremiteit).
Vooral bij herhaalde behandeling (bijv. botulinetoxine injecties) of langdurige behandeling (bijv. intrathecale baclofen) is het van belang om de impact van de spasticiteit en de behandeling ervan te monitoren in de tijd, op basis van vooraf vastgestelde maten die voor de individuele patiënt relevant zijn. Hierbij kan digitale technologie uitkomst bieden, zoals een monitoring app (Kerstens, 2023).
Kosten en middelenbeslag
De kosten van diagnostiek zijn laag in vergelijking met de kosten van behandelingen, en zijn daarom gerechtvaardigd; de kosten van een niet-effectieve behandeling liggen immers veel hoger. De voornaamste kosten voor metingen zijn gerelateerd aan inzet van personeel dat de testen moet uitvoeren (bijv. bij de analyse van gegevens van gangbeeldonderzoek). Uiteraard zijn de kosten van aanschaf van een gangbeeldanalysesysteem aanzienlijk. Het is dus wenselijk om de in te zetten diagnostiek te koppelen aan het behandeldoel.
Gelijkheid
De toegang tot diagnostiek in Nederland is over het algemeen goed georganiseerd. Veelal worden geïnstrumenteerde testen, zoals gangbeeldanalyse, in centra met specifieke expertise gedaan, maar het netwerk in Nederland biedt hier voldoende toegankelijkheid toe. Er worden landelijke cursussen georganiseerd om kennis bij professionals op peil te houden. Als probleem kan worden aangemerkt dat er beperkte mogelijkheden tot (gestandaardiseerde) data-uitwisseling zijn.
Haalbaarheid en implementatie
In principe is diagnostiek van spasticiteit, zoals hierboven beschreven, al dagelijkse praktijk. Er worden geen barrières voorzien in de toepassing van deze diagnostiek. Op het niveau van de behandelaar is het belangrijk dat men wel kritisch blijft tegenover de resultaten van passieve rektesten. De meerwaarde van geavanceerde neuromechanische analyse voor de klinische praktijk dient nog te worden aangetoond. Helaas ontbreekt nog (wetenschappelijke) standaardisatie van testen en assessments op vaardigheidsniveau.
Rationale van de aanbevelingen
Bij problematische spasticiteit, waarbij behandeling overwogen wordt, dient altijd evaluatie van de mate van spasticiteit plaats te vinden, indien mogelijk in meerdere ICF-domeinen. De invulling hiervan hangt deels af van het behandeldoel.
- Bij doelen in het passieve domein (bijv. verzorgbaarheid) kan veelal volstaan worden met metingen onder passieve condities, zoals passieve bewegingsbereik, het vaststellen van ervaren weerstand (Perceived Resistance to Passive Movement), eventueel aangevuld met een zelfscore door de patiënt (of zijn naasten/verzorgenden) met een VAS schaal. Als een spasmolytische behandeling wordt overwogen, dient een inschatting te worden gemaakt van de neurogene component ten opzichte van de weefselcomponent. Dit kan door bijvoorbeeld gebruik te maken van verschillende gewrichtsmanipulatiesnelheden en vaststellen van catch en clonus.
- Bij doelen in het actieve domein (gericht op verbeteren van vaardigheid) moet aanvullend onderzoek worden verricht onder actieve condities en op vaardigheidsniveau (bijvoorbeeld Action Research Arm Test of 10-meter looptest). Indien chirurgische behandeling wordt overwogen aan de onderste extremiteit, of indien er een risico bestaat op een langdurige vaardigheidsvermindering door behandeling van de onderste extremiteit, moet altijd geïnstrumenteerde gangbeeldanalyse worden verricht (voor en na de ingreep), inclusief dynamisch EMG vooraf.
Onderbouwing
Achtergrond
Cerebral and/or spinal spasticity is a consequence of damage to the brain or spinal cord and is characterized by increased muscle tone and impaired coordination of movements. Spastic paresis is a manifestation of the Upper Motor Neuron (UMN) syndrome, in which both positive symptoms (such as spasticity and exaggerated reflex activity) and negative symptoms (such as muscle weakness and impaired motor control) jointly contribute to disrupted motor function.
When assessing spasticity / spastic paresis, it is essential to distinguish between neural components (such as excessive reflex activity and muscle tone) and non-neural components (such as changes in tissue properties, often resulting from prolonged inactivity). This differentiation is crucial for accurately identifying the cause of motor dysfunction and selecting an appropriate treatment strategy.
Spasticity assessment may serve different purposes:
- Neurological diagnosis: The presence of spasticity is a clinical sign of central nervous system damage. Identifying its presence is therefore a part of the neurological diagnostic process. In this context, a binary outcome (presence or absence of spasticity) is sufficient. The velocity-dependent nature of spasticity may help to differentiate it from other types of involuntary muscle activity, such as rigidity or dystonia, as well as from non-neurogenic factors, but is not always present.
- Evaluation of secondary complaints: When spasticity leads to complications such as pain, skin breakdown, or limitations in activity or function, it becomes important to assess the severity of spasticity and distinguish it from other contributing factors, such as paresis or non-neural tissue alterations.
Various assessment tools are available for evaluating spasticity and its consequences, aligned with different domains of the ICF framework: body functions and structures, activities and skills, and participation. However, scientific consensus is still lacking regarding the most suitable measurement method for each clinical context. This module explores the available assessment instruments and the considerations involved in choosing among them, depending on the purpose of evaluation and the complexity of treatment.
Conclusies / Summary of Findings
As no systematic search was conducted, no conclusions based on GRADE are drawn. See the “overwegingen” for considerations on the evaluation of spasticity.
Zoeken en selecteren
In order to address the primary question, no systematic literature review was conducted, as there is no gold standard for the evaluation of spasticity, making it impossible to investigate the confirmation or exclusion of spasticity with high-level evidence. Consequently, consensus literature and the expertise of the working group were considered.
Results
The following section describes the validation of several diagnostic tests used in practice, broken down into clinical tests, neurophysiological tests, and biomechanical and neuromechanical tests.
1. Clinical tests
Clinical tests mainly address the passive condition. In both clinical practice and research settings, passive stretch tests are frequently used to measure spasticity. Examples include the Ashworth Scale and its modified version (Ashworth, 1964; Bohannon & Smith, 1987) as well as the Tardieu Test (Haugh, 2006). The Ashworth Scale rates the observed resistance (expressed as “(increase in) tone”) during passive joint movement on an ordinal scale from 0 to 4 (Ashworth, 1964). In addition to the neural component (associated with hyperactive reflexes), biomechanical factors also play a role, such as the reduction and shortening of sarcomeres (Dietz & Sinkjaer, 2007; Lieber, 2004). Therefore, the Ashworth score does not solely reflect the neural component, although clonus clearly is a neurogenic response (Van den Noort, 2017). Moreover, the outcome of the Ashworth test can be influenced by how relaxed the patient is during its execution (Fleuren, 2009). Numerous studies have evaluated the clinimetric properties of the (modified) Ashworth Scale, yielding mixed results (Platz, 2005; Fleuren, 2010). As a result, its validity and inter-rater reliability remain questionable.
Patient positioning and movement speed were not originally standardized in the Ashworth Scale. However, later studies have advocated for movement across the full range of motion within one second (Platz, 2008). Nevertheless, the imposed angular velocity remains dependent on the individual examiner’s execution.
Under active conditions, involuntary muscle activity manifests differently than under passive testing conditions (Dietz, 2000). The paresis component becomes more prominent during voluntary movement (Kamper, 2006; Meskers, 2009) and some suggest that spasticity decreases during active movement because of changes in baseline activation (Burne, 2005). Additionally, in hemiparetic conditions, compensation by the unaffected limb plays a crucial role (De Haart, 2004; Asseldonk, 2006; Van Kordelaar, 2013). Therefore, the level of resistance assessed during passive movement provides limited insight into the degree and impact of spasticity or muscle overactivity in general during activities such as grasping or walking (Tenniglo, 2021). While it is generally assumed that more spasticity is associated with higher levels of impairment, the precise relationship between clinically observed spasticity and motor control deficits remains unclear (Ada, 1998).
Self-assessment, for example, using a Visual Analogue Scale (VAS), can additionally provide valuable information for the clinician. A clear and unambiguous formulation of the question used for completing the VAS-scale is crucial in this context. The clinimetric properties of the VAS for measuring the (perceived) degree of spasticity or the (perceived) level of discomfort caused by spasticity have not yet been sufficiently studied.
2. Neurophysiological measurement methods
Various neurophysiological measurement methods have demonstrated added value in research settings, but their clinical relevance appears to be limited, e.g. the Hoffmann reflex, an electrical equivalent of the mechanical tendon reflex (Voerman, 2005).
The use of surface electromyography (EMG) to measure muscle activity under passive conditions or during activity can also be a valuable method when applied in a standardized manner (Hermens, 2000). Its construct validity appears to be potentially strong, as the measurement closely aligns with the definition of spasticity. However, adequate reference data for comparison are sparse. Surface EMG under passive conditions is not widely used in clinical practice, partly due to limited availability and time constraints, but mainly due to insufficient knowledge regarding data interpretation.
Dynamic surface EMG during walking, however, has high added value in gait analysis. In this context, the timing of muscle activity provides insight into motor control during walking, allowing comparisons with adaptive patterns observed in healthy individuals. The focus here is not so much on the amplitude of EMG activity, as spastic reflex activity is rarely distinguishable from voluntary muscle activation based on amplitude alone. Overactivity is identified when a muscle is active during a phase of the gait cycle in which it would normally remain inactive. However, the cause of this overactivity—whether due to spasticity, pathological co-contraction (lack of selective muscle contraction), or a compensatory mechanism (Van Kordelaar, 2013)—cannot be determined solely by EMG and needs additional clinical argumentation. Relating overactivity to the prerequisites of gait, such as stability during stance phase and adequate foot clearance in the swing phase, can help determine its relevance for safe ambulation (Perry, 2010).
Not all relevant muscle groups can be assessed using surface EMG alone, making clinical examination and video observation essential complementary methods. Fine wire EMG, to assess muscle activity of deeply located muscles in the leg during gait, has too many technical drawbacks so far for clinical application.
Due to the extensive range of functional possibilities in the upper extremity (compared to the relatively automated movement patterns involved in walking) and the large range of possible motion in the upper limb joints, standardization of dynamic movement analysis for the arm and hand is much more complex. As a result, comparable movement analysis techniques are not yet available for routine clinical practice.
3. Biomechanical and neuromechanical measurement methods
Biomechanical and neuromechanical methods indirectly assess muscle activation by calculating the required force (or torque) for passive joint movement. This can be done, for example, using a dynamometer. A limitation of relying solely on a biomechanical approach is the inability to distinguish between neural and non-neural components of spasticity. Therefore, a combination of biomechanical and neurophysiological measurement methods is recommended (Burridge, 2005). Such combined instrumented assessment allows for measuring joint resistance at different speeds, which can help to differentiate between the neural component (spasticity) and the non-neural, tissue component (elasticity, viscosity), which results in increased resistance at higher speeds). However, given the strong interaction between these components, this differentiation remains incomplete (de Vlugt, 2012). Biomechanical and neuromechanical measurement methods (e.g. haptic robots), when combined with modeling techniques, enable the standardization of measurement conditions (De Vlugt, 2010). This allows for a more precise distinction between neural and non-neural components of velocity-dependent joint stiffness (De Gooijer-van de Groep, 2013; Sloot, 2015).
The initially commercially available NeuroFlexor made it relatively simple and reliable to differentiate between the neural and non-neural components of spasticity in clinical practice, without the need for additional EMG measurements (Gäverth, 2013; Gäverth, 2014; Andringa, 2019; Andringa, 2021). However, a systematic review concluded that, for the implementation of robotic equipment in clinical practice, evidence regarding diagnostic accuracy (evidence level III) and added value (level IV) is still lacking (Van der Velden, 2022).
Referenties
- Ada W, Vattanasilp N, O'Dwyer, Crosbie J. Does spasticity contribute to walking dysfunction after stroke? J Neurol Neurosurg Psychiatry. 1998;64(5):628–635.
- Ashworth B. Preliminary trial of carisoprodol in multiple sclerosis. Practitioner 1964;192:540-542.
- Andringa A, van Wegen E, van de Port I, Kwakkel G, Meskers C. Measurement Properties of the NeuroFlexor Device for Quantifying Neural and Non-neural Components of Wrist Hyper-Resistance in Chronic Stroke. Front Neurol. 2019.
- Andringa A, Meskers C, van de Port I, Zandvliet S, Scholte L, de Groot J, Kwakkel G, van Wegen E. Quantifying neural and non-neural components of wrist hyper-resistance after stroke: Comparing two instrumented assessment methods. Med Eng Phys. 2021 Dec;98:57-64.
- Bohannon RW, Smith MB. Interrater reliability of a modified Ashworth scale of muscle spasticity. Phys Ther. 1987;67(2):206-7. PubMed PMID: 3809245.
- Burne JA, Carleton VL, O'Dwyer NJ. The spasticity paradox: movement disorder or disorder of resting limbs? J Neurol Neurosurg Psychiatry. 2005;76(1):47-54. PubMed PMID: 15607994.
- Burridge JH, Wood DE, Hermens HJ, et al. Theoretical and methodological considerations in the measurement of spasticity. Disabil Rehabil. 2005;27(1-2):69-80. Review. PubMed PMID: 15799144.
- de Gooijer-van de Groep KL, de Vlugt E, de Groot JH, et al. Differentiation between non-neural and neural contributors to ankle joint stiffness in cerebral palsy. J Neuroeng Rehabil. 2013;10:81. PubMed PMID: 23880287.
- de Haart M, Geurts AC, Huidekoper SC, et al. Recovery of standing balance in postacute stroke patients: a rehabilitation cohort study. Arch Phys Med Rehabil. 2004;85(6):886-95. PubMed PMID: 15179641.
- de Vlugt E, de Groot JH, Schenkeveld KE, et al. The relation between neuromechanical parameters and Ashworth score in stroke patients. J Neuroeng Rehabil. 2010;7:35. PubMed PMID: 20663189.
- Dietz V, Sinkjaer T. Spastic movement disorder: impaired reflex function and altered muscle mechanics. Lancet Neurol. 2007;6(8):725-33. Review. PubMed PMID: 17638613.
- Dietz V. Spastic movement disorder. Spinal Cord. 2000;38(7):389-93. PubMed PMID: 10962597.
- Fleuren JF, Snoek GJ, Voerman GE, et al. Muscle activation patterns of knee flexors and extensors during passive and active movement of the spastic lower limb in chronic stroke patients. J Electromyogr Kinesiol. 2009;19(5). PubMed PMID: 18511298.
- Fleuren JF, Voerman GE, Erren-Wolters CV, et al. Stop using the Ashworth Scale for the assessment of spasticity. J Neurol Neurosurg Psychiatry. 2010;81(1):46-52. PubMed PMID: 19770162.
- Fleuren JF, Voerman GE, Snoek GJ, et al. Perception of lower limb spasticity in patients with spinal cord injury. Spinal Cord. 2009;47(5):396-400. PubMed PMID: 19065149.
- Fleuren JFM, Buurke, JH, Geurts AC. Clinical Management of Spasticity and Contractures in Stroke. In: Pandyan AD, Hermens HJ, Conway BA., editors. Neurological rehabilitation. Spasticity and Contractures in clinical Practice and Research. CRC Press. Taylor & Francis Group; 2018.
- Gäverth J, Eliasson AC, Kullander K, et al. Sensitivity of the NeuroFlexor method to measure change in spasticity after treatment with botulinum toxin A in wrist and finger muscles. J Rehabil Med. 2014;46(7):629-34. doi: 10.2340/16501977-1824.
- Gäverth J, Sandgren M, Lindberg PG, et al. Test-retest and inter-rater reliability of a method to measure wrist and finger spasticity.J Rehabil Med. 2013;45(7):630-6. doi: 10.2340/16501977-1160.
- Haugh AB, Pandyan AD, Johnson GR. A systematic review of the Tardieu Scale for the measurement of spasticity. Disability and Rehabilitation. 2006;28(15), 899-907.
- Hermens HJ, Freriks B, Disselhorst-Klug C, Ret alG. Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 2000;10(5):361-74.
- Johnson GR. Editorial. Disabil Rehabil. 2005;27(1-2):1.
- Kamper DG, Yasukawa AM, Barrett KM, et al. Effects of neuromuscular electrical stimulation treatment of cerebral palsy on potential impairment mechanisms: a pilot study. Pediatr Phys Ther. 2006;18(1):31-8. PubMed PMID: 16508532.
- Kerstens HCJW. Smoothening the waves of spasticity: the value of personalized monitoring. PhD Thesis, Radboud University, 2023 (ISBN: 978-94-6469-187-0).
- Lieber RL, Steinman S, Barash IA, et al. Structural and functional changes in spastic skeletal muscle. Muscle Nerve. 2004;29(5):615-27. PubMed PMID: 15116365.
- Meskers CG, Schouten AC, de Groot JH, et al. Muscle weakness and lack of reflex gain adaptation predominate during post-stroke posture control of the wrist. J Neuroeng Rehabil. 2009;6:29. PubMed PMID: 19627607.
- Perry JM, Burnfield. Gait Analysis, Normal and Pathological Function. 2nd ed. J., Slack Inc., 576 pages, ISBN 978-1-55642r.
- Platz T, Eickhof C, Nuyens G, et al. Clinical scales for the assessment of spasticity, associated phenomena, and function: a systematic review of the literature. Disabil Rehabil. 2005;27(1-2):7-18. PubMed PMID: 15799141.
- Platz T, Vuadens P, Eickhof C, Arnold P, Van Kaick S, Heise K. REPAS, a summary rating scale for resistance to passive movement: item selection, reliability and validity. Disabil Rehabil. 2008;30(1):44-53. doi: 10.1080/09638280701191743. PMID: 17852258.
- Sloot LH, Houdijk H, Harlaar J. A comprehensive protocol to test instrumented treadmills. Med Eng Phys. 2015;37(6):610-6. PubMed PMID: 25921721.
- Tenniglo MJB, Nederhand MJ, Fleuren JF, Rietman JS, Buurke JH, Prinsen EC. Does the Duncan-Ely test predict abnormal activity of the rectus femoris in stroke survivors with a stiff knee gait? J Rehabil Med 2022 Jan 3;54.
- van Asseldonk EH, Buurke JH, Bloem BR, et al. Disentangling the contribution of the paretic and non-paretic ankle to balance control in stroke patients. Exp Neurol. 2006. PubMed PMID: 16814283.
- van den Noort JC, Bar-On L, Aertbeliën E, Bonikowski M, Braendvik SM, Broström EW, Buizer A1, Burridge JH, van Campenhout A, Dan B, Fleuren JF, Grunt S, Heinen F, Horemans HL, Jansen C, Kranzl A, Krautwurst BK, van der Krogt M, Lerma Lara S, Lidbeck CM, Lin JP, Martinez I, Meskers C, Metaxiotis D, Molenaers G, Patikas DA, Rémy-Néris O, Roeleveld K, Shortland AP, Sikkens J, Sloot L, Vermeulen RJ, Wimmer C, Schröder AS, Schless S, Becher JG, Desloovere K, Harlaar J. European consensus on the concepts and measurement of the pathophysiological neuromuscular responses to passive muscle stretch. Eur J Neurol. 2017 Jul;24(7):981-e38.
- van Kordelaar J, van Wegen EE, Nijland RH, et al. Understanding adaptive motor control of the paretic upper limb early poststroke: the EXPLICIT-stroke program. Neurorehabil Neural Repair. 2013;27(9):854-63. PubMed PMID: 23884015.
- van der Velden LL, de Koff MAC, Ribbers GM, Selles RW. The diagnostic levels of evidence of instrumented devices for measuring viscoelastic joint properties and spasticity; a systematic review. J Neuroeng Rehabil. 2022 Feb 11;19(1):16.
- de Vlugt E, de Groot JH, Wisman WH, Meskers CG. Clonus is explained from increased reflex gain and enlarged tissue viscoelasticity. J Biomech. 2012 Jan 3;45(1):148-55.
- Voerman GE, Erren-Wolters CV, Fleuren JF, et al. Perceived spasticity in chronic spinal cord injured patients: associations with psychological factors. Disabil Rehabil. 2010;32(9):775-80. PubMed PMID: 20302444.
- Voerman GE, Fleuren JF, Kallenberg LA, et al. Patient ratings of spasticity during daily activities are only marginally associated with long-term surface electromyography. J Neurol Neurosurg Psychiatry. 2009;80(2):175-81. PubMed PMID: 18948361.
- Voerman GE, Gregoric M, Hermens HJ. Neurophysiological methods for the assessment of spasticity: the Hoffmann reflex, the tendon reflex, and the stretch stretch reflex. Disabil Rehabil. 2005;27(1-2):33-68. PubMed PMID: 15799143.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-01-2026
Beoordeeld op geldigheid : 06-01-2026
De Nederlandse Vereniging van Revalidatieartsen geeft bestuurlijke goedkeuring onder voorwaarde van autorisatie door de ALV van 17 april 2026.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2023 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met Cerebrale en/of spinale spasticiteit.
Werkgroep
- prof. dr. A.C.H. Geurts (voorzitter), hoogleraar neurorevalidatie, Radboud UMC en Sint Maartenskliniek, namens de Nederlandse Vereniging voor Revalidatieartsen
- drs. A.M.V. Dommisse, revalidatiearts, Isala Klinieken Zwolle, namens de Nederlandse Vereniging voor Revalidatieartsen
- drs. P.J. van Dongen, patiëntvertegenwoordiger bij Hersenletsel.nl
- Dr. M. van Eijk, specialist ouderengeneeskunde, Marnix Medisch B.V., namens Verenso
- dr. J.F.M. Fleuren, revalidatiearts, Jeroen Bosch Ziekenhuis / Tolbrug, ‘s Hertogenbosch, namens de Nederlandse Vereniging voor Revalidatieartsen
- F. van Gorp-Swart, MSc, ziekenhuisapotheker, Diakonessenhuis, Utrecht/Zeist/Doorn, namens de Nederlandse Vereniging voor Ziekenhuisapothekers
- prof. dr. G. Kwakkel, hoogleraar neurorevalidatie, Amsterdam UMC, Amsterdam, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie
- drs. E. Kurt, neurochirurg, Radboud UMC en Canisius Wilhelmina Ziekenhuis, Nijmegen, namens de Nederlandse Vereniging voor Neurochirurgie
- Prof. dr. C.G.M. Meskers, hoogleraar revalidatiegeneeskunde, Amsterdam UMC, Amsterdam, namens de Nederlandse Vereniging voor Revalidatieartsen
- dr. H.A. Moser, anesthesioloog, Radboud UMC, Nijmegen en Care4homecare, Bladel, namens de Nederlandse Vereniging voor Anesthesiologie
- drs. W.P. Polomski, revalidatiearts (gepensioneerd), voorheen in Spaarne Gasthuis, Hoofddorp, namens de Nederlandse Vereniging voor Revalidatieartsen
- drs. M.N. Ruissen-Eversdijk, ergotherapeut en bewegingswetenschapper, Reade, Amsterdam, namens Ergotherapie Nederland
- dr. A.V.C.M. Zeegers, orthopedisch chirurg, Medisch Spectrum Twente, Enschede, namens de Nederlandse Orthopaedische Vereniging
- dr. J.M. Zuidam, plastisch chirurg, Erasmus MC, namens de Nederlandse Vereniging voor Plastische Chirurgie
Klankbordgroep
- P.M. van Lamoen, gepensioneerd, namens Dwarslaesieorganisatie Nederland
- M. Pol, Dwarslaesie Organisatie Nederland, tot september 2024*
- Dr. A.E. Tigchelaar, Dwarslaesie Organisatie Nederland, vanaf september 2024
- Dr. W.J. Kruithof, revalidatiearts, Universitair Medisch Centrum Utrecht
- Dr. I.H. Zaal-Schuller, arts verstandelijk gehandicapten/kaderarts palliatieve zorg
*Overleden
Met ondersteuning van
- Dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.M.J. van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten via secretariaat@kennisinstituut.nl.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Geurts (voorzitter) |
Hoogleraar neurorevalidatie, Radboud UMC, Nijmegen en Sint Maartenskliniek |
|
Geen. |
Geen restricties. |
|
Dommisse |
Revalidatiearts, Vogellanden |
Geen |
Speakerfee bij Ipsen farmaceutica voor:
|
Geen restricties; e-learning en presentaties betreffen de volle breedte van de behandel opties |
|
van Dongen |
Patiëntvertegenwoordiger Hersenletsel.nl |
Deelname andere werkgroepen |
Geen |
Geen restricties. |
|
van Eijk |
Specialist Ouderengeneeskunde, Marnix Medisch B.V |
|
Extern gefinancierd onderzoek over heupfracturen: 1. FITHIP; onderzoek naar valangst bij patienten met heupfractuur 2. GR HIP; onderzoek naar herstel na heupfractuur 3. HIPCARE; onderzoek naar herstel en biomarkers bij heupfractuur |
Geen restricties; De webinars waren gericht op samenwerking specialisten ouderengeneeskunde en revalidatieartsen |
|
Fleuren |
Revalidatiearts, Tolbrug |
Bestuurslid VRA (onbetaald) |
Geen. |
Geen restricties. |
|
van Gorp |
Ziekenhuisapotheker |
Lid werkgroep interacties KNMP |
Geen. |
Geen restricties. |
|
Kwakkel |
Hoogleraar neurorevalidatie, Amsterdam UMC, locatie VUMC |
|
Geen |
Geen restricties. |
|
Kurt |
Neurochirurg, Radboud UMC, Nijmegen |
Geen |
Geen |
Geen restricties. |
|
Meskers |
Revalidatiearts, Amsterdam UMC locatie VUMC |
Geen |
Geen. |
Geen restricties. |
|
Moser |
Anesthesioloog, Radboud UMC, Nijmegen en Care4homecare, Bladel |
Geen |
Geen |
Geen restricties. |
|
Polomski |
Revalidatiearts Spaarne Gasthuis (gepensioneerd vanaf 1 mei 2023). |
Geen |
Lid Adviesraad Merz Benelux, raakt niet aan de modules |
Restrictie ten aanzien van besluitvorming met betrekking tot botulinetoxine |
|
Ruissen-Eversdijk |
Ergotherapeut bij Reade Revalidatie. |
Geen. |
Geen. |
Geen restricties. |
|
Zeegers |
Orthopedisch chirurg, Medisch Spectrum Twente, Enschede (tot 1-6-2025), en UMCG (vanaf 1-6-2025) |
|
Geen. |
Geen restricties. |
|
Zuidam |
Plastisch chirurg, Erasmus MC Rotterdam |
Geen. |
Geen. |
Geen restricties. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Hersenletsel.nl en Dwarslaesie Organisatie Nederland (DON) bij de schriftelijke knelpuntenanalyse. DON heeft een enquête bij hun achterban uitgezet, en knelpunten werden meegenomen in het proces. Het verslag van deze enquête is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. In de werkgroep heeft een vertegenwoordiger van Hersenletsel.nl deelgenomen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hersenletsel.nl, DON, MS Nederland en Spierziekten Nederland.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase). Uit deze kwalitatieve raming bleek dat er geen grote financiële gevolgen te verwachten zijn.
|
Module |
Uitkomst raming |
Toelichting |
|
Evaluatie van spasticiteit |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Werkwijze
Voor meer details over de gebruikte richtlijnmethodologie verwijzen wij u naar de Werkwijze. Relevante informatie voor de ontwikkeling/herziening van deze richtlijnmodule is hieronder weergegeven.