Behandeling lipiden CVRM
Uitgangsvraag
Wat is het effect van ezetimib en PCSK9-antilichamen op het krijgen van hart- en vaatziekte bij patiënten met verhoogd risico op hart- en vaatziekte die worden behandeld met een statine?
Aanbeveling
Patiënten met hart- en vaatziekten ≤70 jaar
Start intensieve lipidenverlaging bij voorkeur met een hoge dosis statine of anders met een combinatie van een statine met ezetimib indien het LDL-C ≥1,8 mmol/l.
Intensiveer de lipidenverlagende therapie (een hogere dosis statine of sterker werkende statine en/of combinatie van statine en ezetimib) indien het LDL-C na drie maanden nog steeds ≥1,8 mmol/l is.
Verder intensivering van lipidenverlagende therapie (hogere dosis statine en/of combinatie van statine en ezetimib) kan op individuele basis en in overleg met een patiënt ook worden overwogen indien, ondanks het bereiken van LDL-C <1,8 mmol/l, een patiënt gemotiveerd is en de behandeling goed verdraagt.
Behandeling met PCSK9-antilichamen, in combinatie met maximaal verdraagbare orale lipidenverlagende therapie, kan worden overwogen bij patiënten met een hooggeschat recidief risico op hart- en vaatziekten (zoals patiënten met uitgebreid of progressief vaatlijden, patiënten met diabetes mellitus met een hart- en vaatziekte en patiënten met Familiaire Hypercholesterolemie met een hart- en vaatziekte) die de genoemde LDL-C streefwaarden niet bereiken met optimale/maximale verdraagbare orale lipidenverlagende medicatie. Hiervoor gelden specifieke vergoedingscriteria.
Patiënten zonder eerdere hart- en vaatziekten ≤70 jaar, maar met een hoog of zeer hoog cardiovasculair risico en/of met diabetes mellitus en/of chronische nierschade
Start met een statine indien het risico op hart- en vaatziekten zeer hoog is en het LDL-C ≥2,6 mmol/l is.
Overweeg te starten met een statine indien het risico op hart- en vaatziekten hoog is en het LDL-C ≥2,6 mmol/l is.
Intensiveer de lipidenverlagende therapie (een hogere dosis statine of sterker werkende statine) indien het LDL-C na drie maanden ≥2,6 mmol/l is. Indien dat niet mogelijk is, overweeg dan een combinatie van statine en ezetimib
Intensieve(re) lipidenverlagende therapie (hoge dosis of sterker werkende statine en/of combinatie van statine en ezetimib) kan op individuele basis en in overleg met een patiënt worden overwogen indien, ondanks het bereiken van LDL-C <2,6 mmol/l, een patiënt gemotiveerd is en de behandeling goed verdraagt.
Behandeling met PCSK9-antilichamen, in combinatie met maximaal verdraagbare orale lipidenverlagende therapie, kan worden overwogen bij specifieke patiëntengroepen (met name patiënten met Familiaire Hypercholesterolemie) die ondanks optimale orale lipidenverlagende therapie de streefwaarden voor LDL-C niet bereiken. Hiervoor gelden specifieke vergoedingscriteria.
Overwegingen
Medicatie voor verlaging van LDL-C
Verlaging van het LDL-C is een effectieve strategie om het risico op hart- en vaatziekten te verlagen. Behandeling met statine is de hoeksteen van LDL-C-verlagende therapie, maar wanneer LDL-C-streefwaarden niet worden bereikt dan kan additionele therapie worden overwogen. In eerste instantie cholesterolabsorptieremming met ezetimib en als dan de LDL-C-streefwaarde niet wordt bereikt, kan ook toevoegen van PCSK9-antilichamen worden overwogen bij specifieke groepen patiënten.
Bij patiënten met hart- en vaatziekten wordt geadviseerd om met intensieve lipidenverlaging te behandelen vanwege uitkomsten van klinische trials waarin intensieve lipidenverlaging is vergeleken met minder intensieve lipidenverlaging (zie de module ‘Streefwaarden van LDL-C’). Met intensieve lipidenverlaging wordt bedoeld een hoge dosis van een sterkwerkende statine: atorvastatine 40 of 80 milligram, rosuvastatine 10, 20 of 40 mg al dan niet in combinatie met ezetimib. Een andere vorm van intensieve lipidenverlagende therapie is de combinatie van minder sterkwerkende statine (simvastatine, fluvastatine of pravastatine) in combinatie met ezetimib of een lage dosis van een sterkwerkende statine (atorvastatine 10 of 20 milligram of rosuvastatine 5 milligram) in combinatie met ezetimib. Met hoge doses statine is meer onderzoek gedaan dan met de combinatie van een statine met ezetimib. Verder intensivering met PCSK9-antilichamen kan worden overwogen in specifieke groepen patiënten in specifieke omstandigheden (kijk voor de vergoedingscriteria op www.zorginstituutnederland.nl).
Statines verminderen de morbiditeit en mortaliteit van hart- en vaatziekten, en de noodzaak van kransslagaderinterventies, doordat ze LDL-C-verlagend werken (Colhoun, 2004; Collins, 2003). Ze zijn daarom het geneesmiddel van eerste keuze bij patiënten met een indicatie om het LDL-C te verlagen. Ook is er onder huisartsen en medisch specialisten inmiddels veel ervaring met statines.
Bij een behandeling met statines treden soms verhoogde leverwaarden of creatinekinase (CK) in plasma op; in de meeste gevallen is dit omkeerbaar. Routinecontrole van lever- of CK-waarden is niet geïndiceerd. Daarnaast klagen 5 tot 10% van patiënten die statines gebruiken over myalgie, maar rhabdomyolyse is zeer zeldzaam. In gerandomiseerde dubbelblinde, placebogecontroleerde studies wordt geen verschil gezien in het optreden van bijwerkingen van statines in de statine-behandelde of placebo-behandelde patiënten. Het risico op myopathie (ernstige spiersymptomen) kan worden geminimaliseerd door identificatie van kwetsbare patiënten en/of door vermijding van statine-interacties met specifieke geneesmiddelen (Stroes, 2015) (zie tabel 1). Omdat statines worden voorgeschreven voor langetermijngebruik, verdienen mogelijke interacties met andere geneesmiddelen extra en voortdurende aandacht, aangezien een groot aantal patiënten een farmacologische behandeling ondergaat voor concomitante aandoeningen (Reiner, 2005). In de praktijk zal het beleid ten aanzien van een patiënt met myalgie maar zonder een sterke verhoging van creatininekinase gebaseerd zijn op trial-and-error waarbij verschillende statines worden uitgeprobeerd of een zeer lage dosis gedurende meerdere dagen per week en een geleidelijke verhoging van de dosering (Stroes, 2015) (voor meer informatie zie module Statinegerelateerde bijwerkingen uit de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn).
Tabel 1 Geneesmiddelen/substraten met een verhoogd risco op myopathie en rabdomyolyse bij gelijktijdig gebruik van een statine
|
CYP3A4-remmers/substraten |
Andere |
|
Ciclosporine, tacrolimus, sirolimus |
Digoxine |
|
Macroliden (azitromycine, claritromycine, erytromycine) |
Fibraten (gemfibrozil) |
|
Triazolen (fluconazol, itraconazol, ketoconazol, posaconazol) |
|
|
Calciumantagonisten (diltiazem, verapamil) |
|
|
HIV proteaseremmers (atazanavir, darunavir, fosamprevanir, indinavir, lopinavir, ritonavir, saquinavir) |
|
|
Hepatitis C virus proteaseremmers (boceprevir, telaprevir) |
|
|
Danazol |
|
|
Amiodaron |
|
|
Grapefruit en daarop lijkende vruchten |
|
|
Sildenafil |
|
Het veiligheidsprofiel van statines is over het algemeen acceptabel en eerdere bevindingen dat lipidenverlagende behandelingen kunnen bijdragen aan een verhoging van de mortaliteit niet ten gevolge van hart- en vaatziekten (bijvoorbeeld kanker, zelfmoord, depressie) of psychische stoornissen zijn in een grote meta-analyse niet bevestigd (Emberson, 2012). Verhoogde spiegels van bloedglucose en geglyceerd hemoglobine (HbA1c) (dat wil zeggen verhoogd risico op type 2 diabetes mellitus) treden op na behandeling met statines en zijn dosisafhankelijk, en deels geassocieerd met een heel lichte gewichtstoename, maar de voordelen van statinegebruik wegen bij het overgrote merendeel van de patiënten ruim op tegen de risico's (Reiner, 2005; Emberson, 2012; Waters, 2011). Bij het voorschrijven van statines, moeten patiënten eraan herinnerd worden dat het naleven van veranderingen in leefstijl een licht risico op diabetes mellitus kan tegengaan (Waters, 2011; Culver, 2012; Sattar, 2010, Swerdlow, 2015).
Cholesterolabsorptieremming (ezetimib) wordt meestal niet gebruikt als monotherapie om het LDL-C te verlagen, tenzij een patiënt geen statines verdraagt. Cholesterolabsorptieremming wordt meestal toegevoegd aan een statine wanneer de LDL-C streefwaarde niet wordt bereikt, ondanks een maximaal getolereerde dosis van een statine.
Ook galzuurbindende harsen verlagen het totaalcholesterol en LDL-C maar worden slecht verdragen en leiden vaak tot een verhoging van de plasmatriglycerideconcentraties. Ze worden daarom niet aanbevolen voor routinegebruik bij de preventie van hart- en vaatziekten.
Fibraten worden primair gebruikt voor verlaging van triglyceriden en verhoging van HDL-C, en visolie (n-3-vetzuren) in doses van 2 tot 4 g/dag worden gebruikt voor triglycerideverlaging (Fruchart, 2008). Uit klinische trials blijkt dat fibraten of visolie het hart- en vaatziektenrisico niet verlagen. Fibraten hebben mogelijk wel een effect bij patiënten met diabetes mellitus met een dyslipidemie (verhoogde triglyceriden en laag HDL-C). Gezien de sterke effecten van statines op plasma lipiden en op reductie van hart- en vaatziekten, wordt het routinematig gebruik van fibraten of visolie voor preventie van hart- en vaatziekten niet aanbevolen. Ter voorkoming van pancreatitis, wordt geadviseerd om de plasmatriglyceridenconcentratie te verlagen indien deze >10 mmol/l zijn; hiervoor moeten niet alleen geneesmiddelen worden gebruikt, maar ook alcoholrestrictie, behandeling van diabetes mellitus, stopzetten van oestrogeentherapie, enzovoort. Bij de zeldzame patiënten met ernstige en/of onverklaarde hypertriglyceridemie, wordt verwijzing naar een centrum aanbevolen (zie richtlijn (erfelijke) dyslipidemie in de 2e en 3e lijn).
Geneesmiddelcombinaties
Patiënten met hart- en vaatziekten, diabetes mellitus of personen met een verhoogd vasculair risico, zullen niet altijd de LDL-C streefwaarden bereiken met de hoogst getolereerde dosis statine. Een combinatiebehandeling van statine met ezetimib en/of PCSK9-antilichaam is dan aangewezen bij zeer hoogrisicopatiënten (Cannon, 2015; Sabatine, 2017).
De SHARP-trial voldoet strikt genomen niet aan de zoekcriteria omdat de toegevoegde waarde van ezetimib bovenop een statine niet is onderzocht. Toch is dit een relevante studie omdat een lage dosis statine in combinatie met ezetimib is vergeleken met placebo in een relevante groep patiënten. In de SHARP-trial werden patiënten geïncludeerd met chronische nierschade (CNS) met of zonder dialyse waarbij de combinatie simvastatine/ezetimib 20mg/10mg is vergeleken met placebo. Het overall resultaat was een 17% (HR 0,83, 95%CI 0,74 tot 0,94) lager risico op hart- en vaatziekten. Bij de groep patiënten met CNS (mannen kreat >150 micromol/l, vrouwen kreat >130 micromol/l) zonder dialyse werd 22% (HR 0,78, 95%CI 0,67 tot 0,91) lager risico geobserveerd en bij de dialyse patiënten 10% lager risico (HR 0,90, 95%CI 0,75 tot 1,08) waargenomen.
Combinaties van niacine en een statine verhogen HDL-C en verlagen triglyceriden beter dan een van beide geneesmiddelen alleen, maar niacine heeft als belangrijkste bijwerking het optreden van opvliegers, wat de therapietrouw kan beïnvloeden. Het klinisch voordeel van deze combinatie is bovendien niet aangetoond (Boden, 2011).
Fibraten, in het bijzonder fenofibraat, kan nuttig zijn, niet alleen om hoge triglycerideconcentraties te verlagen en een laag HDL-C te verhogen, maar ook om LDL-C verder te verlagen in combinatie met een statine. Er is beperkt bewijs voor deze combinatie voor het verminderen van het aantal hart- en vaatziekten bij een subgroep van patiënten met diabetes mellitus type 2 met verhoogde triglyceriden en een laag HDL-cholesterol (FIELD- en ACCORD-trials) (Keech, 2007; Ginsberg, 2010). Voor fibraten is nog wel plaats in de behandeling van patiënten met specifieke erfelijke lipidenstoornissen zoals patiënten met familiaire dysbètalipoproteïnemie (zie richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn).
Combinatietherapie met ezetimib is veilig en effectief (ongeveer 9 tot 20% LDL-C-reductie), maar het additionele risicoverlagende effect is beperkt (relatieve risicoreductie 7 tot 8%). De kosten van ezetimib zijn laag, vanwege het recente patentverlies (begin 2018) en vanwege de beschikbaarheid in combinatie tabletten met statines is de belasting voor de patiënt laag.
Behandeling met PCSK9-antilichamen is de nieuwste vorm van LDL-C-verlaging, middels een subcutane injectie 1x per 2 weken, waarmee een LDL-C-reductie ongeveer 53% wordt bereikt en een relatieve risicoreductie van 15 tot 20% voor hart- en vaatziekten. De exacte kosten van PCSK9-antilichamen zijn niet bekend vanwege het prijsarrangement tussen de overheid en producenten, maar zijn naar verluid hoog. De kosten zijn voor het Zorginstituut Nederland (ZiN), aanleiding geweest om specifieke vergoedingsvoorwaarden in te stellen voor PCSK9-antilichamen middels een machtiging structuur (www.zorginstituutnederland.nl). De ervaring met PCSK9-antilichamen in de praktijk is nog gering en de veiligheid is onderzocht in trials met een beperkte mediane follow up (1 tot 2 jaar). Over lange termijn veiligheid is nog weinig bekend, maar in observationele studies met langere follow up (ongeveer 4 jaar) worden geen ernstige bijwerkingen gerapporteerd (Koren, 2017).
Update 2024
Zeer recent zijn resultaten over langetermijnuitkomsten van het middel bempedoïnezuur als orale cholesterolverlagende therapie bekend geworden (Nissen, 2023), naast eerder gepubliceerde RCT’s over de effectiviteit op de kortere termijn. De gerandomiseerde klinische placebo-gecontroleerde trial bij statine-intolerante patiënten van Nissen (2023) liet een reductie van 13% in het optreden van hart- en vaatziekten zien na een mediane follow-up van 40,6 maanden. Gezien het huidige traject waar een aantal modules worden herzien (en niet de gehele richtlijn), wordt de plaatsbepaling van bempedoïnezuur op basis van langetermijnuitkomsten in een volgende herzieningscyclus meegenomen.
Kijk voor de huidige vergoedingscriteria op www.zorginstituutnederland.nl.
Onderbouwing
Achtergrond
Cholesterol is een belangrijke risicofactor voor het ontwikkelen van hart- en vaatziekten, en cholesterolverlagende therapie leidt tot een lager risico op hart- en vaatziekten. In de behandeling zijn statines het middel van eerste keuze. In de afgelopen jaren zijn nieuwe cholesterolverlagende therapieën beschikbaar gekomen die via andere mechanismen dan HMG-CoA-reductase remming het cholesterol verlagen. De vraag is wat de plaats is van die nieuwere cholesterolverlagende geneesmiddelen en voor wie en wanneer die ingezet kunnen worden.
Conclusies / Summary of Findings
Ezetimibe
LDL-C (statine met of zonder ezetimib)
|
Redelijk GRADE |
Ezetimib en statine resulteert waarschijnlijk in een LDL-C-daling tussen 9% en 20% vergeleken met alleen statine bij patiënten met hart- en vaatziekten.
Bronnen (Feldman, 2004; IMPROVE-IT; Masuda, 2015; West, 2011) |
Hart- en vaatziekten (statine met of zonder ezetimib)
|
Redelijk GRADE |
Ezetimib en statine verlaagt waarschijnlijk het risico op nieuwe hart- en vaatziekten bij patiënten met hart- en vaatziekten vergeleken met alleen statine.
Bronnen (IMPROVE-IT) |
Mortaliteit (statine met of zonder ezetimib)
|
Hoog GRADE |
Ezetimib en statine verlagen niet het risico om te overlijden ten gevolge van hart- en vaatziekten, gedurende de looptijd van de trial, bij patiënten met hart- en vaatziekten vergeleken met statine.
Bronnen (Nuβbaumer, 2016) |
Bijwerkingen
|
Hoog GRADE
Zeer laag GRADE |
Het risico op een bijwerking is niet verschillend tussen ezetimib met statine versus statine bij patiënten met hyperlipidemie en artherosclerose en/of diabetes mellitus.
Bronnen (Nuβbaumer, 2016)
Het is onzeker wat het risico op een bijwerking is van ezetimib met statine versus statine bij patiënten met hyperlipidemie en artherosclerose en/of diabetes mellitus.
Bronnen (Nuβbaumer, 2016) |
Bijwerkingen die resulteren in het stoppen van behandeling
|
Zeer laag GRADE
Zeer laag GRADE |
Het is onzeker wat risico op een bijwerking resulterend in het stoppen van behandeling is van ezetimib met statine versus statine bij patiënten met hyperlipidemie en artherosclerose en/of diabetes mellitus.
Bronnen (Nuβbaumer, 2016)
Het is onzeker wat risico op een bijwerking resulterend in het stoppen van behandeling is van ezetimib met statine versus statine bij patiënten met hyperlipidemie en artherosclerose en/of diabetes mellitus.
Bronnen (Nuβbaumer, 2016) |
PCSK9-antilichamen
LDL-C
|
Hoog GRADE |
Gemiddelde LDL-C-daling is procentueel gemiddeld 53% groter bij een behandeling met een PCSK9-antilichaam in vergelijking met placebo bovenop een statine (met of zonder ezetimib) bij patiënten met een hoog risico op hart- en vaatziekten.
Bronnen (Schmidt, 2017) |
Hart- en vaatziekten
|
Hoog GRADE |
Het risico op hart- en vaatziekten is 14% lager bij een behandeling met een PCSK9-antilichaam in vergelijking met placebo bovenop een statine (met of zonder ezetimib) bij patiënten met hart- en vaatziekten.
Bronnen (Schmidt, 2017) |
Mortaliteit
|
Redelijk GRADE |
Het risico om te overlijden ten gevolge van hart- en vaatziekten is waarschijnlijk gelijk bij een behandeling met PCSK9-antilichamen in vergelijking met placebo bovenop een statine (met of zonder ezetimib), gedurende de looptijd van de trials, bij patiënten met hart- en vaatziekten.
Bronnen (Schmidt, 2017) |
Bijwerkingen
|
Hoog GRADE |
Het risico op een bijwerking bij behandeling met een PCSK9-antilichaam is vergelijkbaar met placebo bovenop behandeling met statine (met of zonder ezetimib), gedurende de looptijd van de trials, bij patiënten met een hoog risico op hart- en vaatziekten.
Bronnen (Schmidt, 2017) |
Samenvatting literatuur
Ezetimib
Nuβbaumer (2016) ondernam een systematische review naar de effectiviteit en veiligheid van ezetimib toegevoegd aan statine voor het voorkomen van hart- en vaatziekten events in patiënten met hyperlipidemie en atherosclerose en/of diabetes mellitus. Medline, EMBASE en de Cochrane Library werden tot juli 2015 doorzocht voor relevante artikelen. In totaal kwamen negen gerandomiseerde gecontroleerde trials in aanmerking. Alle RCT’s vergeleken ezetimib (10 milligram) bovenop een statine met alleen een statine.
Resultaten
1. LDL-C
De auteurs hebben de resultaten over het effect op LDL-C niet gerapporteerd. Gegevens over bereikt LDL-C-niveau is uit de publicaties van de individuele trials gehaald. De wijze waarop de resultaten waren gerapporteerd, maakte een meta-analyse niet mogelijk. Daarom is ervoor gekozen om de resultaten in een tabel (tabel 1) weer te geven.
Voor het evalueren van het effect van ezetimib op LDL-C worden alleen de trials bekeken waar de dosering statine in de interventiearm gelijk is aan de dosering in de controlearm. Een aantal trials hebben niet de percentuele daling in LDL-C gerapporteerd. Om een indicatie te krijgen van deze daling is ervoor gekozen om deze, op basis van de gerapporteerde gemiddelde LDL-C-niveaus, te berekenen (weergegeven in italics). De daling in LDL-C bij ezetimib met statine is tussen de 9% en 20% groter dan bij alleen statine.
Tabel 1 Overzicht van gegevens over LDL-C-waardes per trial
|
Trial |
Interventie (I) /controle (C) |
N patiënten |
Initieel LDL-C(mmol/l) |
Gemiddelde LDL-C tijdens behandeling (mmol/l) |
Percentage verandering ten opzichte van baseline |
Verschil tussen interventie en controle* |
|
Vergelijking: Statine met of zonder ezetimib |
||||||
|
Arimura, 2012 |
I: Ezetimib 10 mg + atorvastatine 10 mg |
25 |
- |
1,55 (SD 0,44) |
- |
-0,34 (SE 0,12) |
|
|
C: Atorvastatine 10 mg |
25 |
- |
1,89 (SD 0,41) |
- |
|
|
Feldman, 2004 |
I1: Simvastatine 10 mg + ezetimib 10 mg |
251 |
4,27 (SD 0,89) |
- |
-47% (SE 0,8) |
-9% (SE 1,13) |
|
|
C: Simvastatine 10 mg |
253 |
4,49 (SD 1,16) |
- |
-38% (SE 0,8) |
|
|
IMPROVE-IT |
I: Simvastatine 40 mg + ezetimib 10 mg |
9067 |
2,43 |
1,38 |
-43% |
-0,43 (SE?); -17% |
|
|
C: Simvastatine 40 mg |
9077 |
2,43 |
1,81 |
-26% |
|
|
Masuda, 2015 |
I: Rosuvastatine 5 mg + ezetimib 10 mg |
21 |
3,40 (SD 0,66) |
1,48 (SD 0,52) |
-55,8% (SD 18,9) |
-0,46 (SE 0,17); -19% (SE 5,98) |
|
|
C: Rosuvastatine 5 mg |
19 |
3,18 (SD 0,70) |
1,94 (SD 0,55) |
-36,8% (SD 18,9) |
|
|
West, 2011 |
I1: Ezetimib 10 mg + Simvastatine 40 mg |
22 |
3,05 (SE 0,23) |
1,73 (SE 0,26) |
-43% |
-0,62 (SE 0,38); -20% |
|
|
C: Simvastatine 40 mg |
22 |
3,05 (SE 0,26) |
2,35 (SE 0,28) |
-23% |
|
|
Vergelijking: Ezetimib + lage dosis statine versus hoge dosis statine |
||||||
|
Dagli, 2007 |
I: Pravastatine 10 mg + ezetimib 10 mg |
50 |
4,09 (SD 1,23) |
3,02 (SD 0,68) |
- |
-0,43 (SE 0,14) |
|
|
C: Pravastatine 40 mg |
50 |
4,28 (SD 0,77) |
3,45 (SD 0,69) |
- |
|
|
Gaudiani, 2005 |
I: Simvastatine 20 mg + ezetimib |
103 |
2,43 (SD 0,74) |
- |
-20,8% (SD 22,3) |
-20,5% (SE 3,11) |
|
|
C: Simvastatine 40 mg |
107 |
2,37 (SD 0,63) |
- |
-0,3% (SD 22,8) |
|
|
Meaney, 2009 |
I: Ezetimib 10 mg + simvastatine 20/40 mg |
30 |
3,39 (SD 1,01) |
1,24 (SD 0,80) |
- |
0,08 (SE 0,23) |
|
|
C: simvastatine 40/80 mg |
30 |
3,36 (SD 0,85) |
1,16 (SD 0,96) |
- |
|
|
Nakamura, 2012 |
I: Ezetimib 10 mg + statine |
29 |
3,10 |
2,38 |
-23,8% (SD 15,7) |
-2,9% (SE 4,51) |
|
|
C: Dubbele dosering statine |
28 |
3,13 |
2,48 |
-20,9% (SD 18,3) |
|
* Gemiddeld verschil in mmol/l, tenzij anders aangegeven
2. Hart- en vaatziekten
Van de negen geïncludeerde RCT’s rapporteerden vier RCT’s gegevens over hart- en vaatziekten morbiditeit. De auteurs van de review hadden geen meta-analyse uitgevoerd vanwege verschillende definities van hart- en vaatziekten of vanwege het ontbreken van gegevens om risico ratio’s te kunnen berekenen.
Tabel 2 Overzicht van trials met een gerapporteerd resultaat over morbiditeit van hart- en vaatziekten
|
Trial |
Uitkomst |
Ezetimib (+statine) n/N |
Statine n/N |
Effectschatter (95%BI) |
|
Arimura, 2012 |
Niet-fatale MI |
0/25 |
0/25 |
- |
|
IMPROVE-IT |
Samengesteld eindpunt* |
2572/9067 (33%) |
2742/9077 (35%) |
HR 0,94 (0,89 tot 0,99) |
|
Masuda, 2015 |
MI |
0/26 |
0/25 |
- |
|
|
Coronaire revascularisatie |
1/26 (4%) |
1/25 (4%) |
- |
|
West, 2011 |
MACE** |
4/22 (18%) |
2/22 (10%) |
RR 2,22 (0,36 tot 13,62) |
MI, myocardinfarct
* Cardiovasculaire dood, MI, onstabiele AP met ziekenhuisopname tot gevolg, coronaire revascularisatie en beroerte
** Dood, MI, beroerte, TIA
In tabel 2 is kort weergegeven de resultaten van de trials die de uitkomst morbiditeit van hart- en vaatziekten rapporteerde. De vier trials uit tabel 2 hadden allen statine met of zonder ezetimib vergeleken. Uiteindelijk heeft een trial voldoende power om een effect op morbiditeit van hart- en vaatziekten te observeren, namelijk de IMPROVE-IT-trail. Het risico op hart- en vaatziekten was 6% lager bij een behandeling van ezetimib en statine vergeleken met alleen statine (HR 0,94 95%BI:0,89 tot 0,99). De absolute risico reductie betrof 2% (NNT = 50) in het voordeel van ezetimib en statine na zeven jaar.
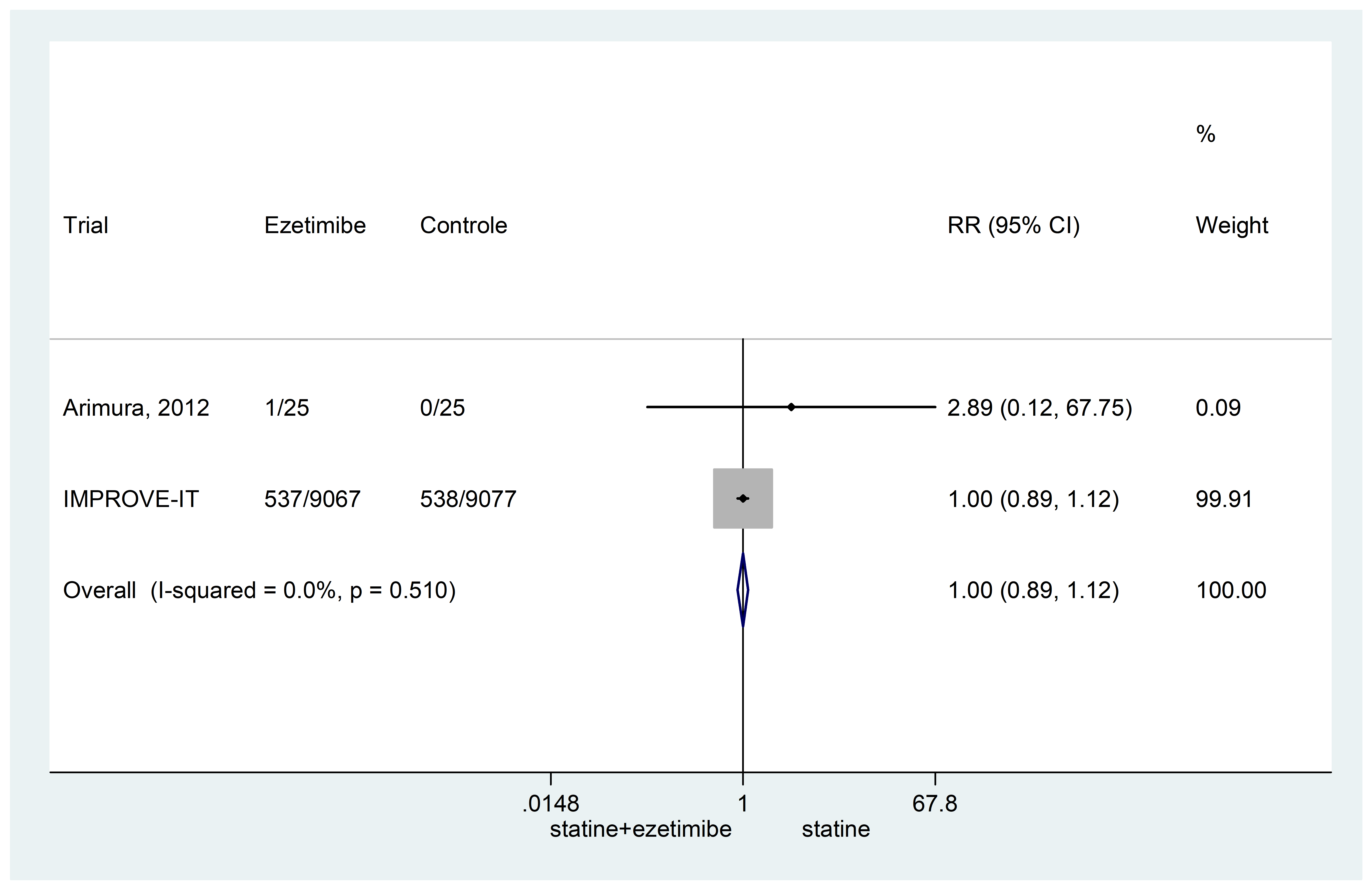
3. Hart- en vaatziekten mortaliteit
Twee RCT’s rapporteerden gegevens over het risico om te overlijden ten gevolge van hart- en vaatziekten en maakte daarmee een meta-analyse mogelijk. Beide trials vergeleken statine plus ezetimib met statine zonder ezetimib. Het risico was gelijk tussen de groepen (RR 1,00 95%BI: 0,89 tot 1,12). De forestplot wordt weergegeven in figuur 1.
Figuur 1 Meta-analyse van de resultaten over mortaliteit ten gevolge van hart- en vaatziekten (overgenomen uit Nuβbaumer, 2016)
4. Bijwerkingen
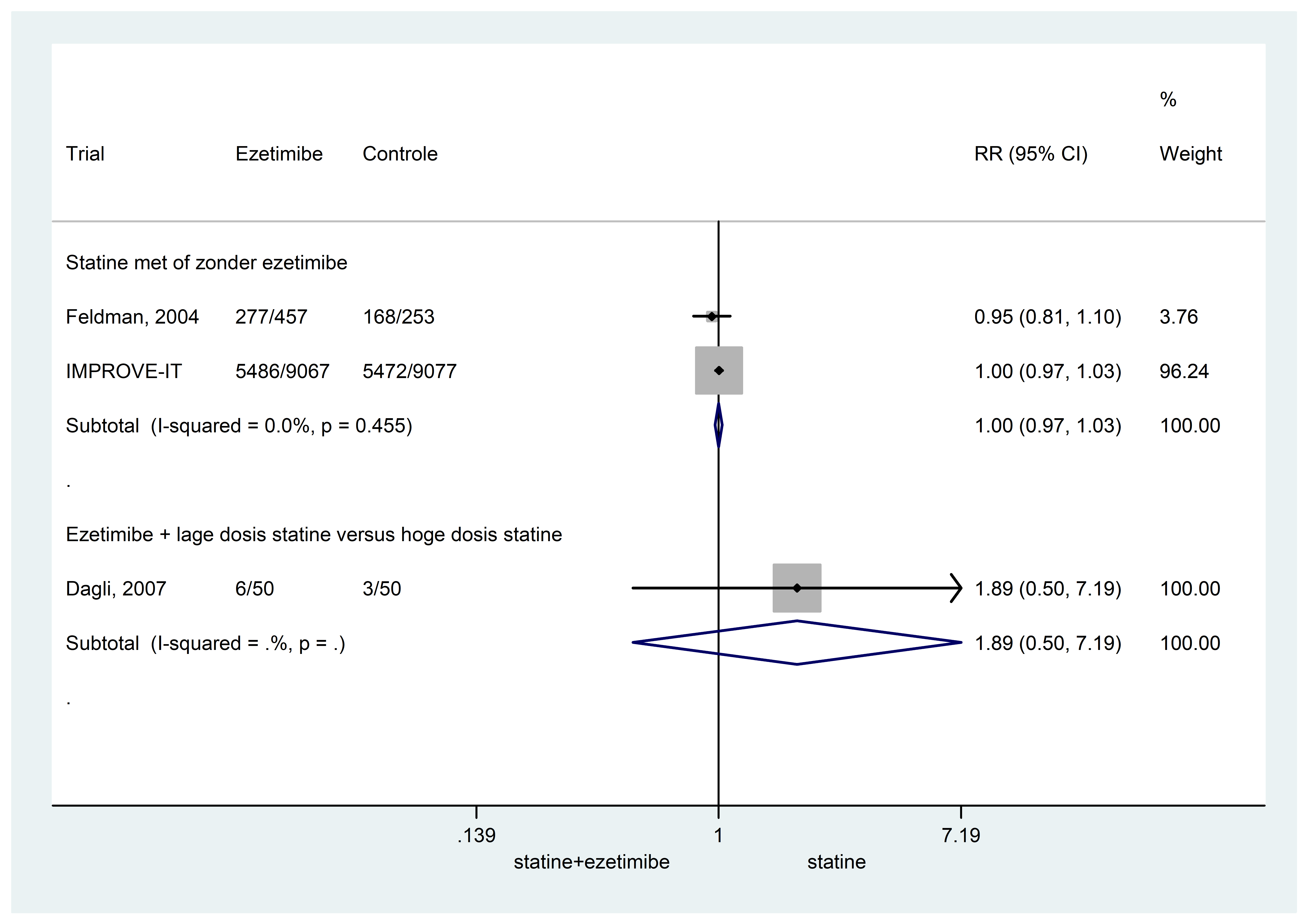
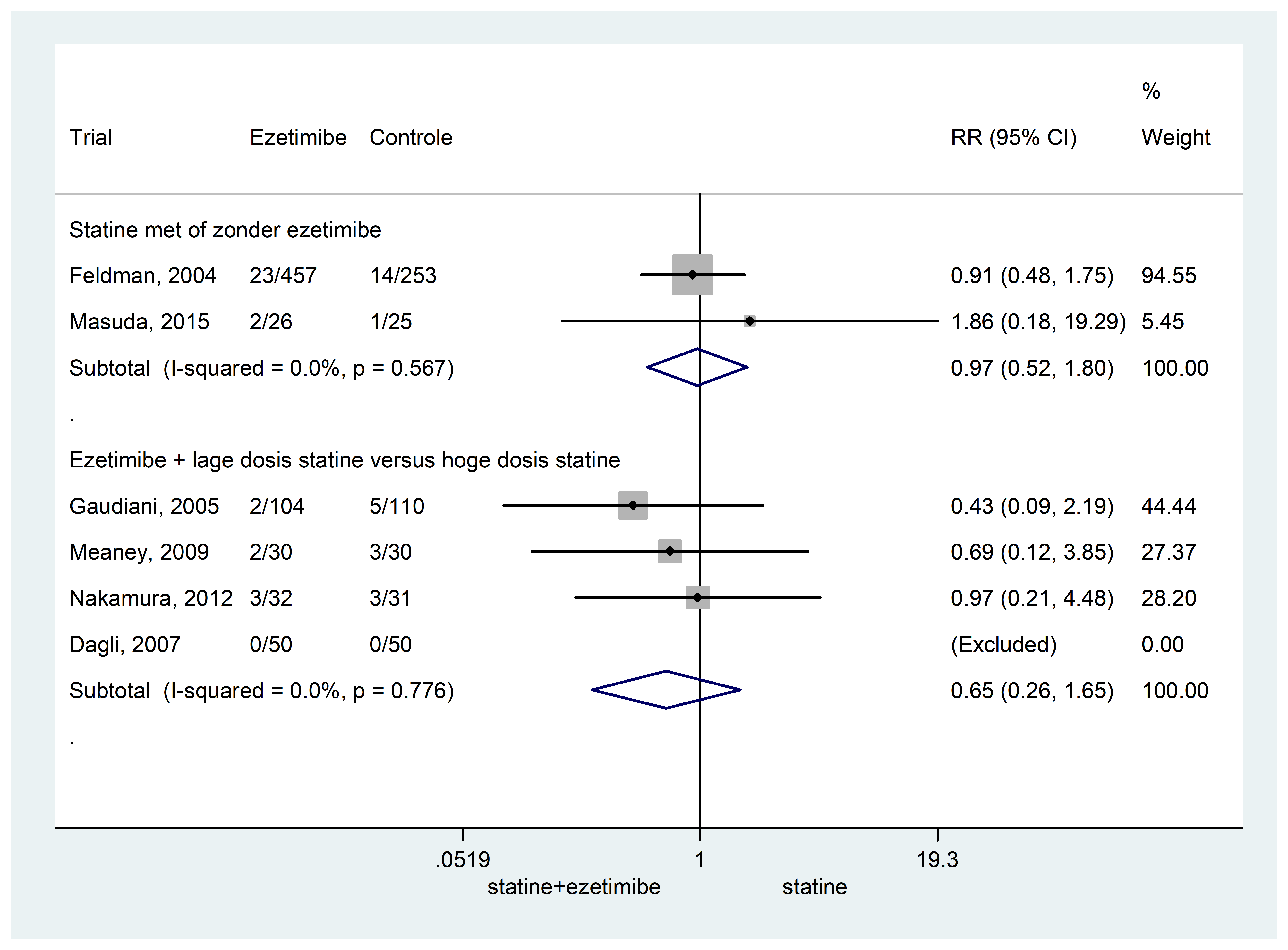
Drie RCT’s rapporteerden mogelijke bijwerkingen bij gebruik van statine of ezetimib en statine. Het risico op een bijwerking was niet verschillend tussen ezetimib bovenop statine versus een statine (RR 0,98 95%BI: 0,89 tot 1,07) (Figuur 2). Het risico op een bijwerking met als gevolg het stoppen van behandeling was 15% lager bij gebruik van ezetimib met statine vergeleken met alleen statine (RR 0,85 95%BI: 0,51 tot 1,43) (Figuur 3).
Figuur 2 Meta-analyse van het risico op een bijwerking tussen ezetimib met statine en statine alleen (overgenomen uit Nuβbaumer, 2016)
Figuur 3 Meta-analyse van het risico op een bijwerking die resulteert in het stoppen met de behandeling tussen ezetimib met statine en statine alleen (overgenomen uit Nuβbaumer, 2016)
Bewijskracht van de literatuur
LDL-C: De bewijskracht voor de uitkomstmaat LDL-C is met 1 niveau verlaagd vanwege imprecisie (ontbreken van een spreidingsmaat voor het berekenen van een betrouwbaarheidsinterval).
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met 1 niveau verlaagd vanwege imprecisie (betrouwbaarheidsinterval overschrijdt de grenzen van klinische besluitvorming).
Mortaliteit: De bewijskracht voor de uitkomstmaat hart- en vaatziekten mortaliteit is niet verlaagd.
Bijwerkingen:
- Statine met of zonder ezetimib
De bewijskracht voor de uitkomstmaat bijwerkingen is niet verlaagd.
De bewijskracht voor de uitkomst bijwerkingen resulterend in het stoppen van behandeling is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; geen adequate randomisatie (Feldman, 2004) en het ontbreken van blindering en meer dan 20% drop-out (Masuda, 2015)), imprecisie (minder dan 50 events) en inconsistentie (verschil in effect).
- Ezetimib + lage dosis statine versus hoge dosis statine
De bewijskracht voor de uitkomstmaat bijwerkingen is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (Risk of Bias; onduidelijkheid over randomisatieprocedure en allocation concealment) en imprecisie (minder dan 10 events).
PCSK9-antilichamen
Beschrijving studies
Schmidt (2017) kwantificeerde de korte- en langetermijneffecten van PCSK9-antilichamen op plasma-lipiden en de incidentie van hart- en vaatziekten. De auteurs doorzochten tot mei 2016 CENTRAL, Medline, Embase en Web of Science. Lopende studies werden tijdens de selectie geïdentificeerd, waarvan drie in maart 2017 gepubliceerd waren. Deze studies zijn aan de review toegevoegd. Alleen gerandomiseerde, gecontroleerde trials met een follow-up tijd van tenminste 24 weken kwamen in aanmerking. In totaal werden 19 studies geïncludeerd en beschreven. Van deze 19 studies bleken vijf studies alleen gepubliceerd te zijn als een congresabstract. Deze vijf studies zijn verder buiten beschouwing gelaten.
Het merendeel van de geïncludeerde studies naar het effect op plasma-lipiden zijn verricht met alirocumab en evolocumab. Acht studies evalueerden het effect van alirocumab, vier studies van evolocumab en twee van bococizumab. Ondanks dat niet altijd duidelijk wordt beschreven in de originele publicatie wat de achtergrondtherapie is, wordt echter wel in de studieprotocollen beschreven dat de achtergrondtherapie altijd leefstijladviezen met statine en/of ezetimib is. De resultaten worden daarom niet per vergelijking (versus placebo of ezetimib) apart beschreven, maar gepoold. De looptijd van de trials liep van 24 weken tot 157 weken.
Resultaten
1. LDL-C
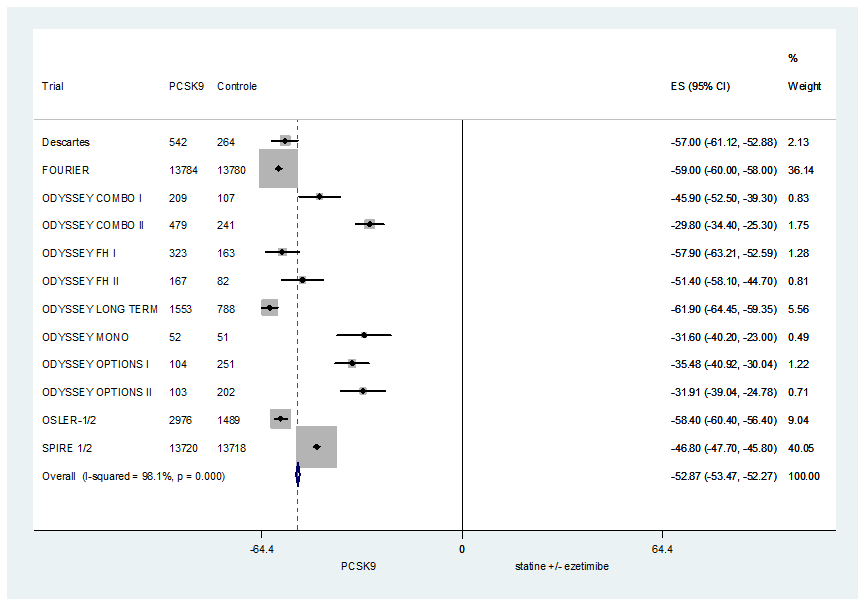
Alle veertien trials hebben het effect op LDL-C in percentages beschreven. De resultaten van de OSLER-1 zijn reeds meegenomen onder de trial OSLER-1/2 en wordt daarom niet apart in de analyse meegenomen. De resultaten van de LDL-C-verandering aan het einde van de trial zijn in figuur 4 weergegeven. Aan het eind van de trial resulteerde een behandeling met een PCSK9-antilichaam in een ruim 50% daling in LDL-C vergeleken met de controle, statine met of zonder ezetimib (gemiddeld verschil -53% 95%BI: -53% tot -52%).
Figuur 4 Meta-analyse van PCSK9-antilichaam in aanvulling op statine (met of zonder ezetimib) vergeleken met statine (met of zonder ezetimib) op de percentueele verandering in LDL-C ten opzichte van baseline

2. Hart- en vaatziekten
In totaal rapporteerden negen trials het risico op hart- en ziekten. Echter, alleen de FOURIER en SPIRE-1/2-trials hadden als primair eindpunt hart- en vaatziekten en waren gepowerd om een effect van een PCSK9-antilichaam op hart- en vaatziekten te detecteren. Ondanks het gebrek in power is er wel voor gekozen om alle gegevens mee te nemen in de meta-analyse. De resultaten zijn in figuur 5 weergegeven. Het risico op een hart- en vaatziekte event is 14% lager bij gebruik van een PCSK9-antilichaam vergeleken met een statine (met of zonder ezetimib) (OR 0,86 95%BI: 0,81 tot 0,92). Een sensitiviteitsanalyse van trials die als primaire uitkomst hart- en vaatziekten hadden benoemd, leverde hetzelfde resultaat op (OR 0,87 95%BI: 0,81 tot 0,93).
Figuur 5 Meta-analyse van het risico op hart- en vaatziekten van PCSK9-antilichamen in aanvulling op statine (met of zonder ezetimib) vergeleken met statine (met of zonder ezetimib)

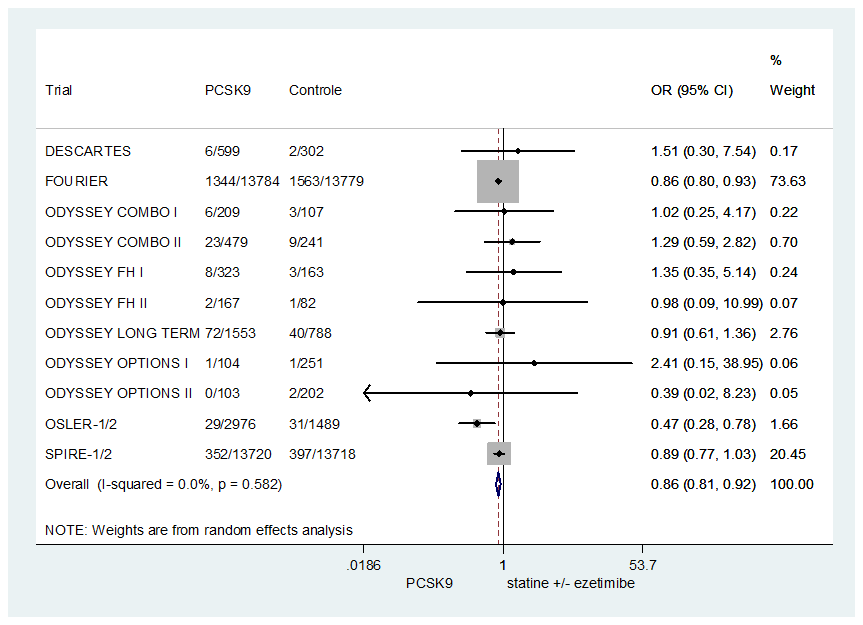
3. Mortaliteit ten gevolge van hart- en vaatziekten
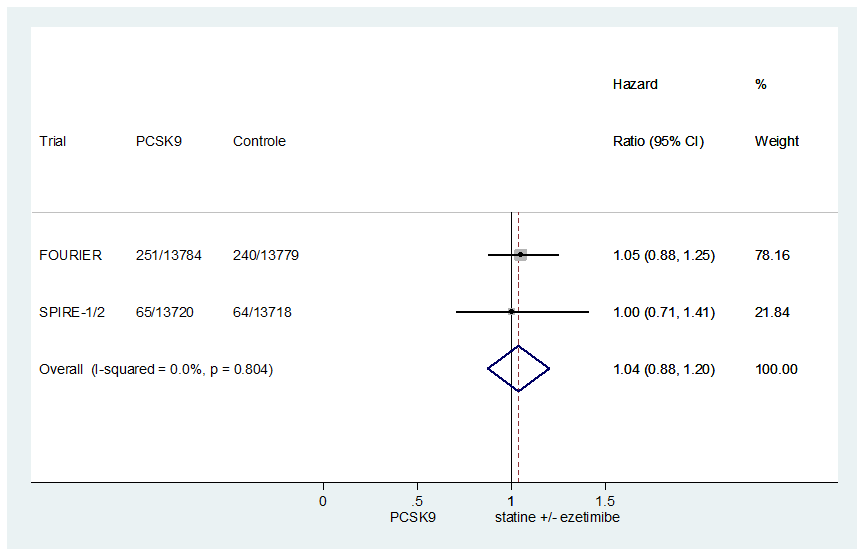
Van de veertien trials beschreven in de review van Schmidt (2017), rapporteerden twee ook de resultaten over het risico om te overlijden aan hart- en vaatziekten. Aangezien dit de grootste trials uit de review betroffen, is een meta-analyse uitgevoerd (figuur 6). De hazard ratio om te overlijden ten gevolge van hart- en vaatziekten gedurende follow-up was 1,04 bij een behandeling met een PCSK9-antilichaam vergeleken met een statine (met of zonder ezetimib) (HR 1,04 95%BI: 0,88 tot 1,20).
Figuur 6 Meta-analyse van het risico om te overlijden gedurende follow-up bij een behandeling met PCSK9-antilichamen in aanvulling op statine (met of zonder ezetimib) vergeleken met statine (met of zonder ezetimib)

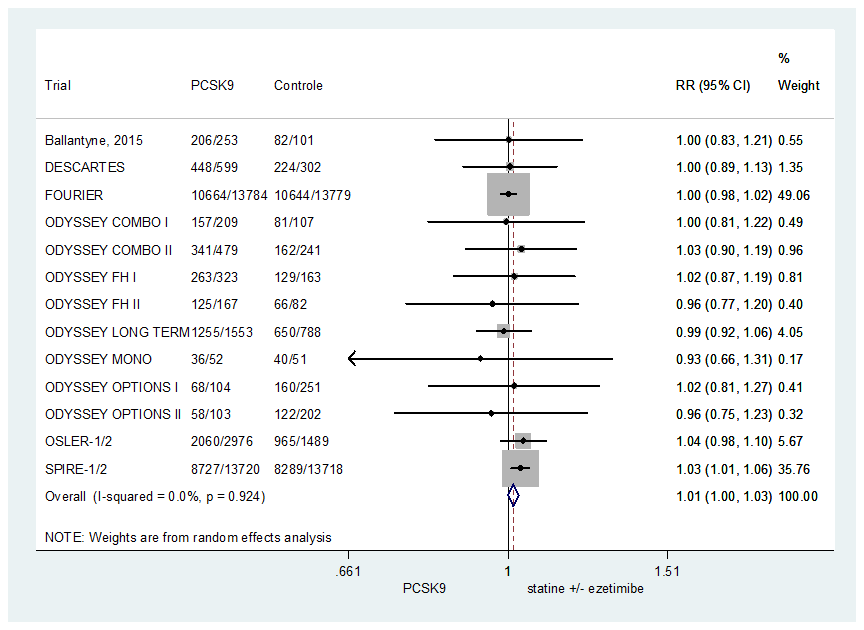
4. Bijwerkingen
Alle trials hebben het risico op een bijwerking gerapporteerd. De resultaten zijn in figuur 7 weergegeven. Het risico op een bijwerking was vergelijkbaar bij een behandeling met een PCSK9-antilichaam of een statine (met of zonder ezetimib) (RR 1,01 95%BI: 1,00 tot 1,03).
Figuur 7 Meta-analyse van het risico op bijwerkingen van PCSK9-antilichamen in aanvulling op statine (met of zonder ezetimib) vergeleken met statine (met of zonder ezetimib)

Bewijskracht van de literatuur
De bewijskracht van RCT’s voor een therapeutische uitgangsvraag starten op hoog.
LDL-C: De bewijskracht voor de uitkomstmaat LDL-C is niet verlaagd. Ondanks een hoge I2 van 98% liggen de effectschattingen met betrouwbaarheidsintervallen geheel links van het klinisch relevant verschil. Om deze reden is niet voor heterogeniteit afgetrokken.
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is niet verlaagd. Ondanks dat vier trials potentieel Risk of Bias vanwege incomplete outcome data hadden, is niet voor Risk of Bias afgetrokken aangezien de grootste trials (met het grootste gewicht in de meta-analyse) geen Risk of Bias hadden.
Mortaliteit: De bewijskracht voor de uitkomstmaat mortaliteit ten gevolge van hart- en vaatziekten is met een niveau verlaagd vanwege imprecisie (het betrouwbaarheidsinterval overlapt de grenzen van klinische besluitvorming).
Bijwerkingen: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is niet verlaagd. Ook hier is niet afgetrokken voor Risk of Bias in vier trials, aangezien de trials met het grootste gewicht in de meta-analyse geen Risk of Bias hadden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat zijn de (on)gunstige effecten van ezetimib vergeleken met placebo of reguliere zorg bij patiënten reeds behandeld met een statine?
P: patiënten behandeld met een statine;
I: ezetimib;
C: placebo of reguliere zorg;
O: LDL-C-concentratie, morbiditeit en mortaliteit van hart- en vaatziekten, bijwerkingen.
Wat zijn de (on)gunstige effecten van PCSK9-antilichamen vergeleken met placebo of reguliere zorg bij patiënten reeds behandeld met een statine?
P: patiënten behandeld met een statine;
I: PCSK9-antilichamen;
C: placebo of reguliere zorg;
O: LDL-C-concentratie, morbiditeit en mortaliteit van hart- en vaatziekten, bijwerkingen.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten en bijwerkingen voor de besluitvorming kritieke uitkomstmaten; en LDL-C-concentratie en mortaliteit van hart- en vaatziekten voor de besluitvorming belangrijke uitkomstmaten.
Hart- en vaatziekten en mortaliteit: De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. De werkgroep definieerde 2% absolute risicoreductie (NNT = 50) van hart- en vaatziekte morbiditeit en mortaliteit over 10 jaar als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 26 oktober 2017 met relevante zoektermen gezocht naar systematische reviews. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 201 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriterium:
- Systematische review van RCT’s met de vergelijking tussen PCSK9-antilichamen en placebo of ezetimib en placebo met een gedetailleerde zoekstrategie en evidence-tabellen.
Op basis van titel en abstract werden in eerste instantie 37 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 35 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en twee studies definitief geselecteerd.
Een systematische review (Nuβbaumer, 2016) over ezetimib en een systematische review (Schmidt, 2017) over PCSK9-antilichamen zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Referenties
- Arimura T, Miura S, Ike A, et al. Comparison of the efficacy and safety of statin and statin/ezetimibe therapy after coronary stent implantation in patients with stable angina. J Cardiol. 2012 Aug;60(2):111-8.
- Boden WE, Probstfield JL, Anderson T, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011;365:22552267.
- Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372:23872397.
- Colhoun HM, Betteridge DJ, Durrington PN, et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebocontrolled trial. Lancet. 2004;364:685696.
- Collins R, Armitage J, Parish S, et al. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomized placebo-controlled trial. Lancet. 2003;361:20052016.
- Culver AL, Ockene IS, Balasubramanian R, et al. Statin use and risk of diabetes mellitus in postmenopausal women in the Womens Health Initiative. Arch Intern Med. 2012;172:144152.
- Dagli N, Yavuzkir M, Karaca I. The effects of high dose pravastatin and low dose pravastatin and ezetimibe combination therapy on lipid, glucose metabolism and inflammation. Inflammation. 2007 Dec;30(6):230-5.
- Emberson JR, Kearney PM, Blackwell L, et al. Lack of effect of lowering LDL cholesterol on cancer: meta-analysis of individual data from 175,000 people in 27 randomised trials of statin therapy. PLoS One. 2012;7:e29849.
- Feldman T, Koren M, Insull W Jr, et al. Treatment of high-risk patients with ezetimibe plus simvastatin co-administration versus simvastatin alone to attain National Cholesterol Education Program Adult Treatment Panel III low-density lipoprotein cholesterol goals. Am J Cardiol. 2004 Jun 15;93(12):1481-6.
- Fruchart JC, Sacks F, Hermans MP, et al. The Residual Risk Reduction Initiative: a call to action to reduce residual vascular risk in patients with dyslipidemia. Am J Cardiol. 2008;102(10 Suppl):1K34K.
- Ginsberg HN, Elam MB, Lovato LC, et al. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med. 2010;362:(17):1563-74. doi: 10.1056/NEJMoa1001282. Epub 2010 Mar 14. Erratum in: N Engl J Med. 2010 May 6;362(18):1748. PubMed PMID: 20228404; PubMed Central PMCID: PMC2879499.
- Gaudiani LM, Lewin A, Meneghini L, et al. Efficacy and safety of ezetimibe co-administered with simvastatin in thiazolidinedione-treated type 2 diabetic patients. Diabetes Obes Metab. 2005 Jan;7(1):88-97.
- Keech AC, Mitchell P, Summanen PA, et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomized controlled trial. Lancet. 2007;370(9600):1687-97. Epub 2007 Nov 7. PubMed PMID: 17988728.
- Koren MJ, Sabatine MS, Giugliano RPet al. Long-term Low-Density Lipoprotein Cholesterol-Lowering Efficacy, Persistence, and Safety of Evolocumab in Treatment of Hypercholesterolemia: Results Up to 4 Years From the Open-Label OSLER-1 Extension Study. JAMA Cardiol. 2017;2(6):598-607. doi: 10.1001/jamacardio.2017.0747. PubMed PMID: 28291870.
- Masuda J, Tanigawa T, Yamada T, et al. Effect of combination therapy of ezetimibe and rosuvastatin on regression of coronary atherosclerosis in patients with coronary artery disease. Int Heart J. 2015 May 13;56(3):278-85.
- Meaney A, Ceballos G, Asbun J, et al. The VYtorin on Carotid intima-media thickness and overall arterial rigidity (VYCTOR) study. J Clin Pharmacol. 2009 Jul;49(7):838-47.
- Nakamura T, Hirano M, Kitta Y, et al. A comparison of the efficacy of combined ezetimibe and statin therapy with doubling of statin dose in patients with remnant lipoproteinemia on previous statin therapy. J Cardiol. 2012 Jul;60(1):12-7.
- Nissen SE, Menon V, Nicholls SJ, et al. Bempedoic Acid for Primary Prevention of Cardiovascular Events in Statin-Intolerant Patients. JAMA. 2023 Jul 11;330(2):131-140. doi: 10.1001/jama.2023.9696.
- Nußbaumer B, Glechner A, Kaminski-Hartenthaler A, et al. Ezetimibe-Statin Combination Therapy. Dtsch Arztebl Int. 2016;113(26):445-53. doi: 10.3238/arztebl.2016.0445. PubMed PMID: 7412989; PubMed Central PMCID: PMC4946327.
- Reiner Z, Galic M, Hanzevacki M, et al. (Concomitant use of statins and cytochrome P 450 inhibitors in Croatia). Lijecnicki vjesnik. 2005;127:6568.
- Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713-1722. doi: 10.1056/NEJMoa1615664. Epub 2017 Mar 17. PubMed PMID: 28304224.
- Sattar N, Preiss D, Murray HM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet. 2010;375:735742.
- Schmidt AF, Pearce LS, Wilkins JT, et al. PCSK9 monoclonal antibodies for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2017;4:CD011748. doi: 10.1002/14651858.CD011748.pub2. Review. PubMed PMID: 28453187.
- Stam-Slob MC, van der Graaf Y, de Boer A, et al. Cost-effectiveness of PCSK9 inhibition in addition to standard lipid-lowering therapy in patients at high risk for vascular disease. Int J Cardiol. 2018;253:148-154. doi: 10.1016/j.ijcard.2017.10.080. PubMed PMID: 29306457.
- Stroes ES, Thompson PD, Corsini A, et al. Statin-associated muscle symptoms: impact on statin therapyEuropean Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J. 2015;36:10121022.
- Swerdlow DI, Preiss D, Kuchenbaecker KB, et al. HMG-coenzyme A reductase inhibition, type 2 diabetes, and bodyweight: evidence from genetic analysis and randomised trials. Lancet. 2015;385:351361.
- Waters DD, Ho JE, DeMicco DA, et al. Predictors of new-onset diabetes in patients treated with atorvastatin: results from 3 large randomized clinical trials. J Am Coll Cardiol. 2011;57:15351545.
- West AM, Anderson JD, Meyer CH, et al. The effect of ezetimibe on peripheral arterial atherosclerosis depends upon statin use at baseline. Atherosclerosis. 2011 Sep;218(1):156-62.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
PCSK9-inhibtors |
|||||||
|
Schmidt, 2017
(individual study characteristics deduced from Schmidt, 2017 )
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to May 2016
A: Ballantyrne, 2015 B: Descartes D: FOURIER H: ODYSSEY COMBO I I: ODYSSEY COMBO II J: ODESSEY FH I K: ODESSEY FH II M: ODYSSEY Long Term N: ODYSSEY MONO O: ODYSSEY OPTIONS I P: ODYSSEY OPTIONS II Q: OSLER 1/2 R: OSLER-1 S: SPIRE 1/2
Study design: All were RCTs
Setting: For all: outpatient care
Source of funding: All RCTs were funded by pharmaceutical companies.
|
Inclusion criteria SR:
Exclusion criteria SR:
20 studies included, of which five studies were only published as conference abstracts. These studies were excluded.
Important patient characteristics at baseline:
N, mean age A: 354 patients, 59 (SD 11) yrs B: 905 patients, 56 (SD 11) yrs D: 27564 patients, 63 (SD 9) yrs H: 316 patients, 63 (SD 9) yrs I: 720 patients, 62 (SD 9) yrs J: 486 patients, 52 (SD 13) yrs K: 249 patients, 53 (SD 17) yrs M:2341 patients, 63 (SD 11) yrs N: 103 patients, 60 (SD 5) yrs O: 355 patients, 63 (SD 10) yrs P: 305 patients, 61 (SD 10) yrs Q: 4465 patients, 58 (SD 11) yrs R: 1104 patients, 56 (SD 12) yrs S: 27438 patients, 63 (SD 9) yrs
Sex: A: 49% Male B: 49% Male D: 75% Male H: 66% Male I: 74% Male J: 56% Male K: 53% Male M: 62% Male N: 53% Male O: 65% Male P: 61% Male Q: 51% Male R: 45% Male S: 70% Male
History of CVD: A: NA B: 136 (15%) D: 27564 (100%) H: 247 (78%) I: 649 (90%) J: 225 (46%) K: 89 (36%) M: 1607 (68%) N: 103 (100%) O: 200 (56%) P: 177 (58%) Q: NA R: 210 (19%) S: 23198 (85%)
Participants with FH: A: NA B: NA D: NA H: 0 I: 0 J: 485 (100%) K: 249 (100%) M: 415 (18%) N: 0 O: 31 (9%) P: 41 (13%) Q: NA R: 414 (38%) S: 1072 (4%) |
A: Bococizumab B: Evolocumab D: Evolocumab H: Alirocumab I: Alirocumab J: Alirocumab K: Alirocumab M: Alirocumab N: Alirocumab O: Alirocumab P: Alirocumab Q: Evolocumab R: Evolocumab S: Bococizumab
Background therapy: A: Statin therapy B: Standard of care (Diet only, daily atorvastatin +/- ezetimib) D: Statin therapy H: Maximal tolerated dose of statin I: Maximal tolerated dose of statin J: Maximal tolerated dose of statin and possible of other lipid-lowering therapies K: Maximal tolerated dose of statin and possible of other lipid-lowering therapies M: Standard of care N: Diet O: 24 weeks 20 or 40 mg of baseline atorvastatin and diet P: 24 weeks 10 or 20 mg of baseline rosuvastatin and diet Q: Standard of care R: Standard of care S: Statins and/or ezetimib
|
A: Placebo B: Placebo D: Placebo H: Placebo I: Ezetimib J: Placebo K: Placebo M: Placebo N: Ezetimib O: Ezetimib P: Ezetimib Q: Standard of care R: Standard of care S: Placebo
|
End-point of follow-up:
A: 24 weeks B: 52 weeks D: 157 weeks H: 52 weeks I: 104 weeks J: 78 weeks K: 52 weeks M: 78 weeks N: 24 weeks O: 24 weeks P: 24 weeks Q: 52/48 weeks R: 52 weeks S: 143 weeks
For how many participants were no complete outcome data available? (intervention/control) A: NA B: 134 D: Unclear H: 30 I: 13 J: 1 K: 2 M: 247 N: 0 O: 10 P: 7 Q: 738 R: 169 S: Unclear
|
Outcome measure-1 Defined as LDL
Six months – compared with placebo Pooled effect (random effects model): mean difference -58.73% (95% CI -60.80 to -56.67) favoring PCSK9 inhibitors Heterogeneity (I2): 88.1% One year – compared with placebo Pooled effect (random effects model): mean difference -52.87% (95% CI -60.03 to -45.72) favoring PCSK9 inhibitors
Six months – compared with ezetimib or statin Pooled effect (random effects model): mean difference -54.13% (95% CI -55.95 to -52.32) favoring PCSK9 inhibitors Heterogeneity (I2): 98.0%
Outcome measure-2 Defined as CVD
Compared with placebo Pooled effect (fixed effects model): OR 0.86 (95% CI 0.80 to 0.92) favoring PCSK9 inhibitors Heterogeneity (I2): not reported
Outcome measure-3 Defined as mortality due to CVD
Not reported
Outcome measure-4 Defined as adverse events
Compared with placebo Pooled effect (fixed effects model): OR 1.08 (95% CI 1.04 to 1.12) favoring placebo Heterogeneity (I2): not reported
Compared with ezetimib and statin Pooled effect (fixed effects model): OR 1.18 (95% CI 1.05 to 1.34) favoring Ezetimib and statins Heterogeneity (I2): not reported
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis)
S: Many participants were lost to follow-up due to antidrug antibody response |
|
Ezetimib |
|
|
|
|
|
|
|
|
Nusbaumer, 2016
(individual study characteristics deduced from Nusbaumer, 2016 )
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
See the full article for all relevant information |
|
|
|
|
|
|
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Schmidt, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Nuβbaumer, 2016 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, Risk of Bias table et cetera)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-06-2021
Uiterlijk in 2020 bepalen het bestuur van het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt van de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie zijn regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Nederlands Huisartsen Genootschape en het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd door het Nederlands Huisartsen Genootschap en de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze multidisciplinaire richtlijn is het optimaliseren van de preventie van hart- en vaatziekten met specifieke focus op individuen met een verhoogd risico op hart- en vaatziekten.
Doelgroep
Deze multidisciplinaire richtlijn is geschreven voor alle zorgverleners die betrokken zijn bij cardiovasculair risicomanagement
Samenstelling werkgroep
In 2016 is een multidisciplinaire werkgroep ingesteld, bestaand uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de preventie van hart- en vaatziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. A.W. (Arno) Hoes, klinisch epidemioloog, werkzaam in het Julius Centrum van het UMC Utrecht te Utrecht (voorzitter)
- Dr.ir. I. (Ineke) van Dis, epidemioloog en voedingswetenschapper, werkzaam bij de Hartstichting te Den Haag, Hartstichting
- Y.A. (Yvette) Henstra, verpleegkundig specialist vasculaire geneeskunde, werkzaam in het OVLG te Amsterdam, NVHVV
- Dr. H.M. (Heleen) den Hertog, neuroloog, werkzaam in het Isala Ziekenhuis te Zwolle, NVN
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij Hartenraad te Den Haag, Harteraad
- Dr. A.H. (AnHo) Liem, cardioloog, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVVC
- Dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Deventer Ziekenhuis te Deventer, NVVC
- Prof. dr. Y.M. (Yvo) Smulders, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. A. (Anne-Margreet) Strijbis, relatiemanager zorg, werkzaam bij Harteraad te Den Haag, Harteraad
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
Met ondersteuning van:
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, NHG
- Dr. W. (Wouter) de Ruijter, wetenschappelijk medewerker, NHG tot augustus 2017
- Drs. M. (Martijn) Sijbom, wetenschappelijk medewerker, NHG vanaf augustus 2017
- Dr. I.M. (Iris) Wichers, wetenschappelijk medewerker, NHG
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van FMS
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van FMS tot april 2018
- Dr. A. (Aleid) Wirix, adviseur, Kennisinstituut van FMS vanaf april 2018
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van FMS tot januari 2018
- J. (Jill) Heij, junior projectsecretaresse, Kennisinstituut van FMS vanaf februari 2018
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hoes (voorzitter) |
|
|
- |
Geen |
|
Konings |
Kaderhuisarts hart- en vaatziekten |
- |
- |
Geen |
|
Tjin-A-Ton |
Kaderhuisarts hart- en vaatziekten |
|
- |
Geen |
|
Visseren |
|
|
Deelname aan fase II en II multicenter trials oer PSCK9-antilichamen. Betrokken bij patiënteninclusie, geen data-analyse |
Geen |
|
Smulders |
|
|
- |
Geen |
|
Liem |
|
|
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Martens |
Cardioloog |
Bestuurslid Werkgroep Cardiologische centra Nederland (WCN) |
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Den Hertog |
Neuroloog |
|
- |
Geen |
|
Henstra |
Verpleegkundig Specialist Vasculaire geneeskunde |
- |
Advies aan industrie lancering nieuwe medicatie bij FH |
Geen; valt buiten het bestek van de richtlijn |
|
Strijbis |
Relatiemanager Hartenraad |
Werkgroeplid Hypertensie in de tweede en derde lijn |
- |
Geen |
|
Van Laarhoven |
|
Werkgroeplid (erfelijke) dyslipidemie in de tweede en derde lijn |
- |
Geen |
|
Van Dis |
|
Lid van de werkgroep Voeding van de European Heart Network |
Hartstichting heeft een samenwerkingscontract met Unilever |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardiging van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hartenraad en Hartstichting.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. CVRM-indicatoren zijn separaat aan de herziening van deze richtlijn ontwikkeld en te vinden op https://www.nhg.org/themas/publicaties/download-indicatoren-archief.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stapsgewijze beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Voor het herzien van de Nederlandse multidisciplinaire richtlijn CVRM heeft de werkgroep besloten uit te gaan van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016. Deze richtlijn was op het moment van starten de meest recente richtlijn met de meest recente evidence. De werkgroep beoordeelde de aanbevelingen uit de eerder genoemde richtlijn op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens een Invitational conference door Diabetesvereniging Nederland, IGZ, FMCC, Hartenraad (voorheen De Hart&Vaatgroep), KNGF, KNMP, NHG, NVAB, NVALT, NVR, NVVC, Verenso en InEen. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, en (3) de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse hebben de voorzitter en de ondersteuners concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming over aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep in ieder geval voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar onderzoeken aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar onderzoeken met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. Deze geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënte perspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele onderzoeken
Individuele onderzoeken werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende onderzoeksresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de ‘Risk of Bias’ (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottawa – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal onderzoeken en overeenkomstigheid (homogeniteit) tussen de onderzoeken werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor Risk of Bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De uiteindelijke bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling worden naast (de kwaliteit van) het wetenschappelijke bewijs ook andere belangrijke aspecten meegewogen, zoals de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken deel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en heeft de werkgroep de richtlijn definitief vastgesteld. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) |
1 exp *Cardiovascular Diseases/ or (cardiovascular disease* or CVD or vascular disease* or vascular event* or coronary heart disease or CHD).ti,ab,kf. (2068799) 2 *Cholesterol, LDL/ or ((LDL or low-density lipoprotein) adj3 (C or cholesterol)).ti,ab,kf. (56329) 3 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (358689) 4 randomized controlled trial.pt. or random*.ti. (566848) 5 Anti-PCSK9 antibody effectively lowers cholesterol in patients with statin intolerance: the GAUSS-2 randomized, placebo-controlled phase 3 clinical trial of evolocumab.m_titl. (1) 6 (Effects of AMG 145 on low-density lipoprotein cholesterol levels: results from 2 randomized, double-blind, placebo-controlled, ascending-dose phase 1 studies in healthy volunteers and hypercholesterolemic subjects on statins).m_titl. (1) 7 AMG 145, a monoclonal antibody against PCSK9, facilitates achievement of national cholesterol education program-adult treatment panel III low-density lipoprotein cholesterol goals among high-risk patients: an analysis from the LAPLACE-TIMI 57 trial.m_titl. (1) 8 "Safety and efficacy of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease, SAR236553/REGN727, in patients with primary hypercholesterolemia receiving ongoing stable atorvastatin therapy".m_titl. (2) 9 5 or 6 or 7 or 8 (5) 10 exp *ezetimibe/ or ezetimibe*.ti,ab,kf. or PCSK9.ti,ab,kf. or *Proprotein Convertase 9/ or *Serine Endopeptidases/ or *Proprotein Convertases/ (18736) Annotation: Vanaf 2017 volstaat *Proprotein Convertase 9/ als MESh term voor PCSK9 11 (alirocumab or evolocumab).ti,ab,kf. (438) 12 10 or 11 (18821) 13 (1 or 2) and 12 (3714) 14 limit 13 to (yr="2005 -Current" and (dutch or english)) (3073) 15 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (358689) 16 14 and 15 (174) – 152 uniek 17 randomized controlled trial.pt. or random*.ti. (566848) 18 14 and 17 (572) 19 9 and 18 (5) 20 18 not 16 (555) – 458 uniek |
781 |
|
Embase (Elsevier) |
((('low density lipoprotein cholesterol'/exp/mj OR 'very low density lipoprotein cholesterol'/exp/mj OR (((ldl OR 'low-density lipoprotein*') NEAR/3 (c OR cholesterol)):ti,ab) OR 'cardiovascular disease'/exp/mj OR 'cardiovascular disease*':ti,ab OR cvd:ti,ab OR 'vascular disease*':ti,ab OR 'vascular event*':ti,ab OR 'coronary heart disease':ti,ab OR chd:ti,ab)
AND (('ezetimibe'/exp/mj OR 'proprotein convertase 9'/exp OR 'evolocumab'/exp/mj OR 'alirocumab'/exp/mj) OR (ezetimibe*:ti,ab OR pcsk9:ti,ab OR alirocumab:ti,ab OR evolocumab:ti,ab))
AND ((dutch)/lim OR (english)/lim) AND (embase)/lim AND (2005-2017)/py NOT 'conference abstract':it)
AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) (159) – 29 uniek
AND ((random*:ti OR 'randomized controlled trial'/exp) NOT 'conference abstract':it)) (465) – 122 uniek |
|
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Toth, 2017 |
Netwerk meta-analyse, gezocht tot augustus 2016 |
|
Toth, 2017 |
Recentere review beschikbaar |
|
Squizzato, 2017 |
Recentere review beschikbaar |
|
Soran, 2017 |
Intensief versus niet intensief, alleen gezocht in pubmed |
|
Qian, 2017 |
Recentere review beschikbaar |
|
Li, 2017 |
Recentere review beschikbaar |
|
Khan, 2017 |
Recentere review beschikbaar |
|
He, 2017 |
Verschillende doseringen |
|
Eslami, 2017 |
Recentere review beschikbaar |
|
AlHajri, 2017 |
Recentere review beschikbaar |
|
Mueller, 2016 |
Recentere review beschikbaar |
|
Cheng, 2016 |
Recentere review beschikbaar |
|
Peng, 2016 |
Recentere review beschikbaar |
|
Milionis, 2016 |
Recentere review beschikbaar |
|
McDonagh, 2016 |
Recentere review beschikbaar |
|
Lipinski, 2016 |
Recentere review beschikbaar |
|
Gouni-Berthold, 2016 |
Recentere review beschikbaar |
|
Araya, 2016 |
Geen toegang tot fultekst, deels geschreven in het Spaans |
|
Battaggia, 2015 |
Recentere review beschikbaar |
|
Descamps, 2015 |
Geen zoekactie uitgevoerd. |
|
Savarese, 2015 |
Recentere review beschikbaar |
|
Thomopoulos, 2015 |
Recentere review beschikbaar |
|
Zhang, 2015 |
Recentere review beschikbaar |
|
Navarese, 2015 |
Recentere review beschikbaar |
|
Li, 2015 |
Recentere review beschikbaar |
|
Gudzune, 2014 |
Recentere review beschikbaar |
|
Ambegaonkar, 2014 |
Recentere review beschikbaar |
|
Gudzune, 2014 |
Recentere review beschikbaar |
|
Stein, 2014 |
Recentere review beschikbaar |
|
Abramson, 2011 |
Recentere review beschikbaar |
|
Guyton, 2011 |
Recentere review beschikbaar |
|
Mikhailidis, 2011 |
Recentere review beschikbaar |
|
Angelopoulos, 2009 |
Recentere review beschikbaar |
|
Mikhailidis, 2007 |
Recentere review beschikbaar |
|
Catapano, 2005 |
Recentere review beschikbaar |
