Initiële behandeling acute VTE
Uitgangsvraag
Wat is het beste beleid voor de initiële behandeling van veneuze trombo-embolie?
Aanbeveling
Behandel patiënten met objectief aangetoonde VTE met anticoagulantia.
Overweeg patiënten met een hoge klinische verdenking op VTE in afwachting van bevestiging van de diagnose met objectieve testen, te behandelen.
Behandel diepe veneuze trombose, van het been of de arm, of longembolie initieel bij voorkeur met een DOAC met of zonder voorafgaande behandeling met LMWH, op basis van samenvatting producteigenschappen (bijsluiter).
Behandel patiënten met een diep veneuze trombose of longembolie met een onderliggende maligniteit met LMWH.
Behandel diepe veneuze trombose en longembolie met LMWH gevolgd door vitamine K antagonisten (therapeutische INR range 2,0 tot 3,0) indien geen DOAC kan worden voorgeschreven.
Gebruik geen DOAC bij VTE patiënten met ernstige nierinsufficiëntie (eGFR<30 ml/min). Bij matige nierinsufficiëntie (eGFR 30 tot 49 ml/min) moet dosis aanpassing worden toegepast (dabigatran, edoxaban) of voorzichtigheid worden betracht (rivaroxaban/apixaban).
Start, indien wordt gekozen voor VTE behandeling met VKA, ook LMWH.
Staak de LMWH indien de INR stabiel is en twee dagen boven de 2,0 (met een minimale LMWH behandeling van vijf dagen).
Meet niet routinematig anti-Xa spiegels bij patiënten met VTE die met LMWH worden behandeld.
Controleer bij gebruik van LMWH bij patiënten met extreme obesitas (BMI >50 kg/m2) de anti-Xa spiegel.
Gebruik bij patiënten met een ernstige nierinsufficiëntie (eGFR <30 ml/min) bij voorkeur intraveneus ongefractioneerde heparine in plaats van LMWH. Streef hierbij naar een therapeutische APTT range.
Indien voor LMWH wordt gekozen bij nierinsufficiëntie, pas dan de dosering aan en meet anti-Xa spiegels (zie modules over laboratoriumtesten bij antistollingsmiddelen.)
Overwegingen
Uit de beschreven meta-analyses blijkt dat de effectiviteit in het voorkomen van recidief diepe veneuze trombose en longembolie tijdens antistollingsbehandeling gelijk was tussen de onderzochte DOACs, al dan niet voorafgegaan door enkele dagen LMWH, en de behandeling met de VKA warfarine voorafgegaan door enkele dagen LMWH (Castellucci, 2014). In de meta-analyses is ook de veiligheid onderzocht van de DOACs vergeleken met de VKA, waarbij de nadruk ligt op het risico op ernstige bloedingen. In de meta-analyse van van Es van patiënten met veneuze trombose was er ook een significante reductie van ernstige bloedingen bij DOACs ten opzichte van VKA (Van Es, 2014). Intracraniële bloedingen en fatale bloedingen traden significant minder vaak op in de DOACs behandelde VTE patiënten (Van Es, 2014). Er werd geen verhoogd risico van gastro-intestinale bloedingen gevonden bij patiënten die voor VTE werden behandeld (Van Es, 2014). In een eerdere meta-analyse werd gesuggereerd dat DOACs in de subgroep van VTE patiënten een iets hoger risico op gastro-intestinale bloedingen geven, maar in die meta-analyse waren slechts gegevens van twee van de VTE studies meegenomen (Holster, 2013). Fatale bloedingen kwamen in de studies weinig voor (0,14%) (Castelluci, 2014). De totale mortaliteit in de VTE studies was niet verschillend tussen patiënten behandeld met DOACs of VKA (Van Es, 2014). Belangrijk is dat op basis van de meest recente meta-analyse de uitkomsten met betrekking tot effectiviteit en veiligheid werden gevonden voor alle geanalyseerde patiënten subgroepen, zoals ouderen (> 75 jaar), patiënten met overgewicht (>100 kg) en matige nierinsufficiëntie (in de studies gedefinieerd als kreatinine klaring tussen 30 tot 49 ml/min) (van Es, 2014).
Er zijn geen directe vergelijkende onderzoeken verricht naar de effectiviteit en veiligheid van de verschillende DOACs bij VTE patiënten ten opzichte van elkaar. Gebaseerd op de studies waarin de DOACs zijn vergeleken met VKA, lijkt er geen verschil te zijn in effectiviteit. Mogelijk is het risico van bloedingen lager bij apixaban en rivaroxaban dan bij edoxaban en dabigatran, gezien het significant lagere relatief risico op bloedingen bij deze middelen ten opzichte van de VKA behandelde patiënten in de studies, maar dit verschil tussen DOACs onderling zou onderzocht moeten worden in vergelijkende onderzoeken (Castellucci, 2014).
In de literatuur is discussie ontstaan of de uitkomsten van de vergelijkende studies tussen DOACs en VKA afhankelijk zijn van de kwaliteit van de instelling op VKA. In een populatie van VKA-behandelde patienten die goed ingesteld zijn op basis van de INR (hoge Time in Therapeutic Range, TTR), zou het voordeel van DOACs ten opzichte van VKA kunnen wegvallen. In Nederland is er een hoge TTR, echter de TTR in de studies is niet volledig te vergelijken met de Nederlandse situatie omdat in Nederland tot op heden gebruik gemaakt wordt van een INR streefwaarde van 2.5-3.5, terwijl dit in de studies 2.0-3.0 was. De enige studie die is uitgevoerd over de waarde van de in Nederland gebruikte TTR, toont aan dat 74% van de test results en 77% van de "person-time" in de therapeutische range (2.0-3.5) waren. Met een smallere range (2.5-3.5) wordt dat percentage respectievelijk 59% en 61%. Dit geeft aan dat het niet per definitie zo is dat de trombosediensten in Nederland het veel beter doen dan de TTR die in de VTE studies werd behaald.(Bezemer I, Neth J Med, 2013 ). De auteurs van dit artikel concluderen dat de controle van antistolling in een representatieve Nederlandse database (een trombosedienst met meer dan 5400 patienten) vergelijkbaar is met de recente trials van VKA in AF. De TTR is in de verschillende studies van patienten met VTE vergelijkbaar (rond de 60%). Er zijn geen analyses gedaan naar de uitkomsten van de VTE studies met DOACs en VKA in relatie tot de gevonden TTR in de VKA groep.
Op dit moment worden DOACs afgeraden bij de behandeling van maligniteit-gerelateerde VTE. Er zijn op dit moment onvoldoende gegevens bekend om DOACs in deze situatie toe te passen. De voorkeur gaat daarbij uit naar LMWH in een therapeutische dosering. Er zijn inmiddels vergelijkende studies gaande bij patiënten met VTE en een onderliggende maligniteit waarbij behandeling met LMWH wordt vergeleken met DOACs.
Een nadeel van sommige DOACs is het ontbreken van een specifiek antidotum in geval van een ernstige bloeding of in geval van noodzaak van een acute ingreep of operatie. Ondanks het ontbreken van een specifiek antidotum voor de DOAC tijdens de uitvoering van de studies werden significant minder fatale bloedingen gezien in de DOAC behandelde VTE patientengroep dan in de VKA-groep (Van Es, 2014). Inmiddels is voor dabigatran een antidotum (idarucizumab) in Nederland geregistreerd en beschikbaar en er zijn inmiddels ook specifiek werkende antidota voor de directe factor Xa remmers ontwikkeld, die nu worden getest in klinisch onderzoek (Schiele, 2013; Lu, 2013; Pollack, 2015). Voor het couperen van DOACs in geval van bloedingen zie het betreffende hoofdstuk van deze richtlijn (zie module bloeding of ingreep bij DOACs). Een ander mogelijk nadeel van DOACs is dat, door het ontbreken van regelmatige controle van patiënten door de trombosedienst, de therapietrouw afneemt. Recent zijn hierover data beschikbaar gekomen van internationale studies en registries bij gebruik van DOACs bij atriumfibrillatie (AF) (Shore, 2014; Gorst-Rasmussen, 2015). Shore et al vonden in een groep van >5000 patienten met AF dat gemiddeld 84% van de patienten dagelijks de DOACs innamen. Bij 27% van de patienten was de inname geduid als non-adherent, op basis van het feit dat <80% van de dagen medicatie werd gebruikt. In een recentere Deense studie werd onderzocht over een periode van een jaar hoevaak dagelijks medicatie werd ingenomen. Hierbij werd gevonden dat 84% van de patienten dagelijks DOACs innamen.Sommige studies bij AF patienten toonden een lagere adherentie (Zhou, et al J Manag Care Spec Pharm 2015) In een studie van Zalasek waren AF patienten meer trouw aan dabigatran dan aan VKA en zij toonden aan dat patienten met een lager risico op ischemisch hersenifarct minder trouw waren in de inname van hun medicatie . (Zalesak, M et al , Circulation Cardiovasc Quality Outcomes 2013 sep). Gegevens over de adherentie bij VTE patienten ontbreken nog.
Ook is het van belang om bij behandeling met DOAC rekening te houden met de nierfunctie. De nierfunctie wordt uitgedrukt in de geschatte glomerulaire filtratiesnelheid (eGFR)in ml/min/1.73m2. Dit wordt in deze richtlijn overal verkort weergegeven door eGFR in ml/min. Bij een ernstige nierinsufficiëntie (geschatte glomerulaire filtratiesnelheid (eGFR) <30 ml/min<30 ml/min) is dabigatran gecontra-indiceerd en worden de andere DOACs niet aanbevolen (Leidraad DOACs). De werkgroep raadt, gezien de beperkte gegevens over VTE behandeling met de directe Xa remmers bij patiënten met een nierinsufficiëntie het gebruik bij een eGFRvan <30 ml/min sterk af. Bij patiënten met milde of matige nierinsufficiëntie dient de dosering van de DOACs te worden aangepast, afhankelijk van de ernst van de nierfunctiestoornis en het voorgeschreven medicament. De doseringsadviezen zijn samengevat in tabel 6.1. Het advies is om voor de start de nierfunctie te bepalen en deze - bij langdurig gebruik van DOACs – vervolgens jaarlijks te controleren (Werkgroep DOACs, 2014).
|
Tabel 6.1 Doseringsadviezen VTE behandeling met DOAC (mede gebaseerd op aanbevelingen in Leidraad DOACs)
|
||||
|
DOAC |
Behandelschema VTE |
Geregistreerde indicatie |
Beleid bij nierschade of insufficiëntie |
Aanvullende opmerkingen / dosisaanpassing |
|
Dabigatran |
Eerst tenminste vijf dagen parenterale antistolling, daarna 2 dd 150 mg |
DVT en longembolie |
Voor start behandeling nierfunctie bepalen en vervolgens jaarlijks controleren. Bij ernstige nierschade of insufficiëntie (Stadium IV, V; eGFR <30 ml/min) gecontra-indiceerd. Bij matig ernstige nierschade (stadium IIIb of eGFR 30 tot 50 ml/min) 2 dd 110 mg overwegen) |
Bij ouderen >80 jaar of bij gebruik van verapamil dosering aanpassen: 2 dd 110 mg.
|
|
Rivaroxaban |
Gedurende dag één tot 21: 2 dd 15 mg Vanaf dag 22: 1 dd 20 mg. |
DVT en longembolie |
Niet aanbevolen bij ernstige nierschade of insufficiëntie (stadium IV of V; eGFR <30 ml/min) |
Niet onderzocht bij LE patiënten die hemodynamisch instabiel zijn en mogelijk trombolyse gaan krijgen. Voorzichtigheid in combinatie met sterke CYP3A4–remmers
|
|
Apixaban |
Gedurende één week 2 dd 10 mg; daarna 2 dd 5 mg |
DVT en longembolie |
Niet aanbevolen bij ernstige nierschade of insufficiëntie (stadium IV of V; eGFR <30 ml/min) |
Niet gebruiken bij LE patiënten die hemodynamisch instabiel zijn en mogelijk trombolyse gaan krijgen. |
|
Edoxaban |
Eerst tenminste vijf dagen parenterale antistolling, daarna 1 dd 60 mg |
DVT en longembolie |
Niet aanbevolen bij ernstige nierschade of insufficiëntie (stadium IV of V; eGFR <30 ml/min) Bij matig ernstige nierschade of insufficiëntie (stadium IIIb of eGFR 30 tot 50 ml/min) 1 dd 30 mg. |
Lichaamsgewicht ≤60 Kg of bij gelijktijdig gebruik van PgP remmers, dosering 1 dd 30 mg
|
ACCP en ESC standpunt over DOACs:
Ten tijde van het uitkomen van de meest recente ACCP richtlijn in 2012 waren er nog weinig VTE studies verricht met DOACs (Kearon, 2012). Bij het opstellen van de ACCP richtlijn 2012 waren er ook nog geen post-marketing resultaten beschikbaar. In de ACCP richtlijn wordt geadviseerd om bij patiënten met VTE (zonder onderliggende maligniteit) VKA te geven boven LMWH als langetermijnbehandeling (graad 2C) (Kearon, 2014). Bij patiënten met VTE (zonder onderliggende maligniteit), die niet met VKA worden behandeld gaat de voorkeur uit naar LMWH boven dabigatran of rivaroxaban voor de langetermijnbehandeling. Er wordt geen uitspraak gedaan of er een verschil is in keuze voor dabigatran of rivaroxaban (Kearon, 2014). In de meest recente richtlijn van de European Society of Cardiology voor de behandeling van longembolie wordt op basis van evaluatie van alle studies waarin DOACs zijn vergeleken met (LMWH+) warfarine gesteld dat de DOACS kunnen worden gezien als een gelijkwaardig alternatief voor de huidige standaardbehandeling (ESC, 2014). De werkgroep heeft besloten van de bovenstaande richtlijnen af te wijken op basis van de recente systematic reviews (zie bovenstaand) en de beschikbaarheid van meer post-marketing gegevens in de internationale literatuur over het gebruik van DOACs, die ook benoemd zijn in de overwegingen.
Initiele behandeling met LMWH en VKA
Indien wordt gekozen voor de combinatie van laag moleculair gewichtsheparine (LMWH) en tegelijkertijd starten van VKA, dient de LMWH tenminste vijf dagen te worden gecontinueerd en kan deze worden gestaakt indien de International Normalized Ratio (INR) stabiel is en gedurende twee dagen boven de 2,0 is. De therapeutische range van de INR is 2,0 tot 3,0. De werkgroep heeft besloten om deze internationaal gangbare therapeutische range van de INR van 2,0 tot 3,0 te hanteren.
Initiele behandeling met LMWH versus ongefractioneerde heparine
LMWH heeft een betere voorspelbare farmacokinetiek en biologische beschikbaarheid dan ongefractioneerde heparine. Hierdoor is het mogelijk om effectief en veilig LMWH, in een dosering aangepast aan het lichaamsgewicht, een- of tweemaal daags toe te dienen zonder laboratorium controle (Dolovich, 2000; Columbus investigators, 1997; Van Dongen, 2005). Er zijn geen verschillen aangetoond in effectiviteit van een- of tweemaaldaagse toediening. Er kan gekozen worden voor eenmaal daags op grond van gebruikersgemak en voor tweemaal daags in geval van een verhoogd bloedingsrisico, waarbij langdurige therapeutische antistolling minder gewenst is, bijvoorbeeld in geval van trombocytopenie. Overigens zijn er geen aanwijzingen uit onderzoek dat er een verschil is in de frequentie van bloedingen tussen een- en tweemaal daags doseren. Een van de grote voordelen van LMWH is dat het ook eenvoudig en veilig in de thuissituatie kan worden toegepast bij patiënten met een acute DVT of geselecteerde patiënten met een longembolie (Columbus investigators, 1997; Zondag, 2011). Dit heeft belangrijke voordelen voor de patiënt, die niet hoeft te worden opgenomen in het ziekenhuis. Voor de voorwaarden van thuisbehandeling van DVT en longembolie wordt verwezen naar de module thuisbehandeling bij DVT.
In diverse studies waarin intraveneuze ongefractioneerde heparine (UFH) werd vergeleken met LMWH bleek dat UFH niet adequaat werd gecontroleerd door middel van een op de anti-Xa-activiteit gebaseerde verlenging van de APTT) (Raschke, 2003). Bij start van de behandeling wordt een oplaaddosis gegeven gevolgd door continue intraveneuze toediening. Daarbij is het streven zo snel mogelijk een APTT verlenging te verkrijgen tot in de therapeutische range (1,5 tot 2,5 x de basiswaarde APTT). Zie voor verdere details het hoofdstuk laboratorium diagnostiek (zie hoofdstuk laboratoriumdiagnostiek), Goede controle met de APTT of een anti-Xa spiegelbepaling noodzakelijk voor een optimale werkzaamheid en veiligheid. Bij patiënten bij wie ondanks een hoge dosis UFH geen therapeutische APTT wordt bereikt, is het advies om anti-Xa spiegels te meten (therapeutische range 0,3 tot 0,7 IU/ml) (Levine, 1994).
Het is niet nodig om routinematig anti-Xa spiegels te controleren bij het gebruik van LMWH. Bij sommige patiënten met VTE is controle van spiegels wel noodzakelijk, bijvoorbeeld in geval van nierschade of insufficiëntie, zwangerschap of extreme obesitas. Zie hiervoor het hoofdstuk laboratorium diagnostiek. Bij nierinsufficiëntie is de klaring van LMWH afgenomen en kan accumulatie van LMWH optreden. Dit is niet volledig te voorspellen op basis van de creatinineklaring en is mede afhankelijk van de soort LMWH. Daarom gaat bij patiënten met een ernstige nierschade of insufficiëntie (in deze richtlijn gedefinieerd als een creatinineklaring <30 ml/min) de voorkeur uit naar UFH (Nagge, 2002). Indien toch LMWH wordt toegediend bij ernstige nierinsufficiëntie is het advies om de dosering aan te passen en is het noodzakelijk om anti-Xa spiegels te controleren, conform de huidige richtlijn van de Nederlandse Vereniging van Nefrologie (Link richtlijn "antistolling met LMWH bij nierinsufficientie (2012)". Bij patiënten met extreme obesitas (BMI > 50 kg/m2) dient tenminste eenmalig een anti-Xa spiegel te worden afgenomen om overdosering te voorkomen. De anti-Xa top spiegel dient te worden afgenomen vier uur na toediening en de streefwaarde is bij eenmaal daagse toediening 1,0 tot 2,0 U/ml en bij tweemaal daagse toediening 0,6 tot 1,0 anti-Xa U/ml.
Bij een sterke klinische verdenking op VTE kan worden overwogen om de behandeling met anticoagulantia te starten alvorens de diagnostiek is afgerond, bijvoorbeeld indien de diagnostiek niet binnen enkele uren kan worden verricht. Het risico van bloedingen tijdens de (achteraf soms onnodig toegediende) kortdurende behandeling met anticoagulantia is waarschijnlijk kleiner dan het risico op progressie en/of embolisatie bij patiënten met uiteindelijk geobjectiveerde VTE die niet met anticoagulantia behandeld zijn.
Onderbouwing
Achtergrond
De vraag wat het beste beleid voor de initiële behandeling van veneuze trombo-embolie is bestaat uit verschillende subvragen:
- Is LMWH vergelijkbaar met ongefractioneerde heparine (UFH)?
- Wat is de waarde van de DOACs bij behandeling van diepe veneuze trombose (DVT) en longembolie, in vergelijking met de huidige behandeling met LMWH en VKA?
Voor de uitwerking van deze subvragen is gekozen voor een verschillende methodologie. Deze wordt beschreven onder de kop “zoeken en selecteren”.
Voor de behandeling van DVT van het been en de arm met trombolyse wordt verwezen naar de modules “Trombolyse bij behandeling DVT been" en "Trombolyse bij de behandeling DVT van de arm” van deze richtlijn. Voor de optimale behandelingsduur met antistolling wordt verwezen naar de module “Continueren antistolling na VTE“ van deze richtlijn.
De module behandeling longembolie middels trombolyse uit de CBO richtlijn van 2008 is niet herzien.
Antistollingsbehandeling is de belangrijkste therapie voor acute diepe veneuze trombose (DVT) van het been en de arm en voor een longembolie, gezamenlijk aangeduid als veneuze trombo-embolie (VTE). Dit wordt gezien als eenzelfde ziektebeeld, immers de meerderheid van patiënten met een proximaal gelokaliseerd trombosebeen heeft ook een longembolie (symptomatisch of asymptomatisch) en omgekeerd. Het doel van antistollingsbehandeling is zowel het voorkomen van uitbreiding van het stolsel als het optreden van vroege en late recidieven van DVT en (recidief) longembolie. In diverse gerandomiseerde en ongecontroleerde studies is aangetoond dat onthouden van antistolling de mortaliteit verhoogt (Barrit, 1960; Kernohan, 1966; Kanis, 1974; Kearon, 2012). Dit betekent dat patiënten met VTE dienen te worden behandeld met antistolling, zodra de diagnose is gesteld met behulp van objectieve diagnostiek. In 2015 is NHG standaard DVT en longembolie uitgekomen, waarin het beleid met betrekking tot diagnostiek en behandeling in de eerste lijn is beschreven.
In de afgelopen jaren zijn nieuwe orale antistollingsmiddelen ontwikkeld die gericht zijn tegen trombine (IIa) of geactiveerd factor X. Deze directe trombineremmer (dabigatran) en Factor Xa remmers (onder andere rivaroxaban, apixaban en edoxaban) (aangeduid als Directe Orale Anti Coagulantia, DOACs) zijn inmiddels onderzocht in meerdere gerandomiseerde studies voor de behandeling van veneuze trombose (veneuze trombo-embolie, VTE) (Schulman, 2009; EINSTEIN investigators, 2010; EINSTEIN investigators, 2012; Agnelli, 2013 AMPLIFY investigators; Schulman, 2014 RECOVER investigators; Buller, 2014 HOKUSAI investigators).
In dit hoofdstuk worden aanbevelingen gegeven over de initiële behandeling van veneuze trombo-embolie. Dit kan bestaan uit DOACs al dan niet voorafgegaan door laag moleculair gewicht heparine (LMWH), LMWH gevolgd door VKA, of langdurig LMWH.
Conclusies / Summary of Findings
|
Hoog GRADE |
Het is waarschijnlijk dat recidief VTE, inclusief VTE gerelateerd overlijden, bij patiënten die worden behandeld voor VTE even vaak voorkomt tijdens het gebruik van DOAC en VKA.
Bronnen (Van Es, 2014; Fox, 2012; Van der Hulle, 2014; Castellucci, 2014) |
|
Matig GRADE |
Het is waarschijnlijk dat majeure bloedingen bij patiënten die worden behandeld voor VTE minder vaak voorkomen tijdens het gebruik van DOACs in vergelijking met VKA.
Bronnen (Van Es, 2014; Fox, 2012; Van der Hulle, 2014; Castellucci, 2014) |
|
Hoog GRADE |
Intracraniale bloedingen bij patiënten met VTE komen minder vaak voor tijdens het gebruik van DOACs in vergelijking met VKA.
Bronnen (Van Es, 2014; Fox, 2012; Van der Hulle, 2014; Castellucci, 2014) |
|
Laag GRADE |
Een verschil in het risico op ernstige gastro-intestinale bloedingen bij patiënten met VTE bij het gebruik van DOACs en VKA kon niet worden aangetoond noch uitgesloten.
Bronnen (Van Es, 2014; Fox, 2012; Van der Hulle, 2014; Castellucci, 2014) |
|
Hoog GRADE |
Fatale bloedingen bij patiënten die worden behandeld voor VTE komen minder vaak voor bij het gebruik van DOACs in vergelijking met VKA.
Bronnen (Van Es, 2014; Fox, 2012; Van der Hulle, 2014; Castellucci, 2014) |
|
Matig GRADE |
Het is waarschijnlijk dat klinisch relevante niet-ernstige bloedingen bij patiënten die worden behandeld voor VTE minder vaak voorkomen tijdens het gebruik van DOACs in vergelijking met VKA.
Bronnen (Van Es, 2014; Fox, 2012; Van der Hulle, 2014; Castellucci, 2014) |
Samenvatting literatuur
Recent zijn vier meta-analyses uitgevoerd van de VTE studies (Fox, 2012; Van der Hulle, 2014; Van Es, 2014; Castellucci, 2014). De resultaten van de meta-analyse met de meeste data-presentatie (Van Es, 2014) worden hier beschreven. Voor het review van Van Es werd een systematische search gedaan naar fase drie RCT’s waarin DOACs met VKA werden vergeleken voor de behandeling van acute symptomatische DVT, longembolie of beide. De zoekdatum wordt in deze publicatie niet vermeld, echter in de review van Castellucci wordt gezocht tot 28 februari 2014, en worden geen nieuwere studies gevonden (Castelluci, 2014; van Es, 2014). In totaal werden zes gerandomiseerde studies geïncludeerd waarin dabigatran (RE-COVER and RE-COVER II studies) (Schulman, 2009; Schulman, 2014,) rivaroxaban (EINSTEIN-DVT and EINSTEIN-PE studies) (Bauersachs, 2010; Büller, 2012), apixaban (AMPLIFY study) (Agnelli, 2013) en edoxaban (Hokusai-VTE studie) (Büller, 2013) werden vergeleken met VKA bij patiënten met VTE (n=5) of longembolie (n=1). Fase 2 dose-finding studies werden geexcludeerd, net als studies die de behandeling met de trombine remmer ximelagatran onderzochten.
Initiële behandeling van VTE bij DOACs
De initiële behandeling van veneuze trombose, zowel diepe veneuze trombose (DVT) als longembolie, was verschillend voor de diverse DOACs. Rivaroxaban wordt gestart in een dosering van tweemaal daags 15mg en na 21 dagen behandeling wordt de dosering verlaagd naar 20mg eenmaal daags. Apixaban wordt gegeven in een dosering van 2 dd 10mg voor een week, gevolgd door 2 dd 5mg. Dabigatran wordt gegeven in een dosering van 2 dd 150mg na een initiële behandeling van vijf tot 11 dagen met LMWH. Edoxaban wordt gegeven in een dosering van 60 mg 1 dd na een initiële periode van LMWH gedurende tenminste vijf dagen.
In totaal werden 13.512 patiënten gerandomiseerd voor een DOAC (met/zonder voorafgaand LMWH afhankelijk van type DOAC) en 13.511 patiënten voor behandeling met LMWH en VKA met een streef INR range van 2,0 tot 3,0. De patiëntkarakteristieken van de individuele studies staan in de evidence tabel. De gemiddelde leeftijd van patiënten was 56 jaar, en 57% was man. Risico factoren voor herhaalde VTE waren gelijk verdeeld. De index event was DVT in het been voor 57% van de patiënten, en longembolie (zonder gelijktijdige aangetoonde DVT) in 43%. Het grootste deel van de patiënten (72%) ontving anticoagulantia voor zes maanden. De gemiddelde tijd binnen de therapeutische INR range (TTR) voor patiënten die VKA gebruikten varieerde van 57% tot 64% in de studies. Patiënten en artsen waren in de meeste studies (met uitzondering van beide EINSTEIN studies, die open label waren) geblindeerd voor de behandeling. De uitkomsten werden beoordeeld door een geblindeerde onafhankelijke centrale beoordelingscommissie in alle studies. In de RE-COVER, RE-COVER II en Hokusai-VTE studies werd de DOAC gestart na een initiële behandeling van LMWH van minimaal vijf dagen. Rivaroxaban (EINSTEIN studies) en apixaban (AMPLIFY) werden gegeven als monotherapie, met een hogere dosering in de eerste week (apixaban) of eerste drie weken (rivaroxaban). In EINSTEIN-DVT, EINSTEIN-PE en Hokusai-VTE studies werd de duur van de behandeling bepaald door de arts. In de Einstein-DVT studie werd 12% van de patiënten 3 maanden behandeld, 63% van de patiënten 6 maanden, 25% 12 maanden. In de Einstein-PE studie werd 5% van de patiënten 3 maanden behandeld, 57% voor 6 maanden en 37% voor 12 maanden. In de Hokusai studie werd 12% voor 3 maanden, 26% voor 3-6 maanden en 61% voor meer dan 6 maanden behandeld. In de andere studies werden patiënten zes maanden behandeld.
Recidief VTE
In totaal kwam recidief VTE, inclusief VTE-gerelateerd overlijden, voor bij 271 van 13.430 (2.0%) patiënten die DOACs kregen in vergelijking met 301 (13.442 (2,2%)) patiënten die een VKA kregen (RR 0,90, 95% BI 0,77 tot 1,06. I2: 0%, p=0,53). Dit percentage verschilde ook niet tussen DOAC of VKA behandelde patiënten in de subgroepen longembolie (+/- DVT) of DVT alleen (Van Es, 2014)
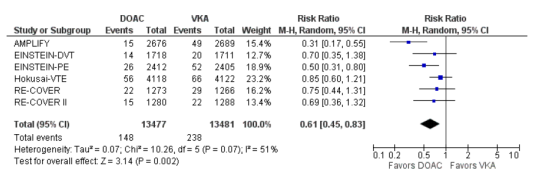
Ernstige (major) bloedingen
In totaal kwamen ernstige bloedingen voor bij 148 van 13.477 (1,1%) van de patiënten die een DOAC kregen in vergelijking met 238 van 13.481 (1,8%) van de patiënten in de VKA-groep (RR=0,61 [95% BI 0,45 tot 0,83], I2: 51%, p=0,002).
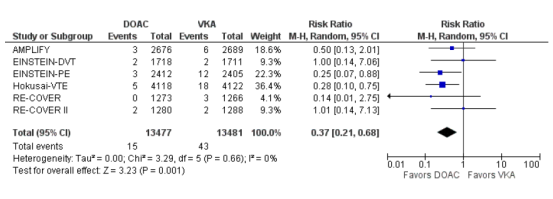
Intracraniale bloedingen
In totaal kwamen intracraniale bloedingen voor bij 15 van 13.477 (0,1%) van de patiënten die DOAC kregen in vergelijking met 43 van 13.841 (0,3%) patiënten die een VKA kregen (RR 0,37 (0,21 tot 0,68), I2=0%).
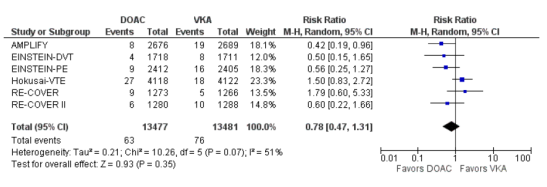
Ernstige gastro-intestinale bloedingen
In totaal kwamen gastro-intestinale bloedingen voor bij 63 van 13.477 (0,5%) van de patiënten die DOAC kregen in vergelijking met 76 van 13.841 (0,6%) patiënten die een VKA kregen (RR 0,78 (0,47 tot 1,31), I2=51%).
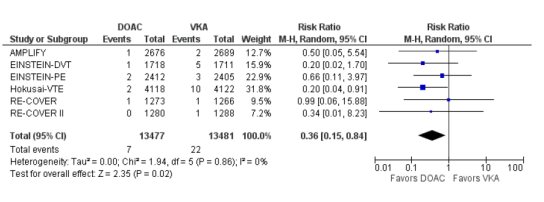
Fatale bloedingen
In totaal kwamen fatale bloedingen voor bij zeven van 13.477 (0,05%) van de patiënten die DOAC kregen in vergelijking met 22 van 13.841 (0,16%) patiënten die een VKA kregen (RR 0,36 (0,15 tot 0,84), I2=0%).
Klinisch relevante niet-ernstige bloeding
In totaal kwamen klinisch relevante niet-ernstige bloedingen voor bij 854 van 13.477 (6,5%) van de patiënten die DOAC kregen in vergelijking met 1.103 van 13.841 (8,0%) patiënten die een VKA kregen (RR 0,36 (0,15 tot 0,84) I2=85%).
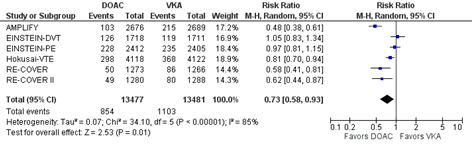
Gezien de eerder aangetoonde hoge effectiviteit van VKA in vergelijking met geen of inadequate behandeling, zijn alle studies opgezet als non-inferioriteitsstudies. De bewijskracht voor de uitkomstmaten VTE, intracraniale bloedingen, en fatale bloedingen, is hoog. Hoewel er sprake was van een laag aantal gevallen, is er gekozen niet te downgraden voor imprecisie omdat de studie populatie in beide groepen uit >2000 patiënten bestond. De bewijskracht voor de uitkomstmaten ernstige bloedingen, en klinisch relevante niet-ernstige bloedingen is met een niveau verlaagd naar matig gezien heterogeniteit. De bewijskracht voor ernstige gastro-intestinale bloedingen is met twee niveaus verlaagd naar laag gezien heterogeniteit, en het feit dat in het betrouwbaarheidsinterval zowel een mogelijk positief als mogelijk negatief klinisch relevant effect ligt (imprecisie). Daarnaast is het van belang te noteren dat in de meta-analyse de resultaten van zes studies zijn gepoold, terwijl er verschillen waren in het type DOAC, het initiële gebruik van LMWH, de dosering en duur van follow-up. Hoewel er in de meta-analyse geen sensitiviteitsanalyses zijn gedaan om de oorzaak van de heterogeniteit te onderzoeken, zou de klinische heterogeniteit tussen de studies hier een rol in kunnen spelen. De heterogeniteit tussen de verschillende studies is wisselend per uitkomstmaat. Zo werd een hoge heterogeniteit gezien voor klinisch relevante niet-ernstige bloeding, maar niet voor fatale bloeding of intracraniele bloeding. Gezien het feit dat geen van de studies een slechtere uitkomst liet zien qua uitkomstmaat bloeding is de heterogeniteit meer gelegen in de mate van bescherming tegen bloeding en niet in het feit dat sommige DOACs meer bloedingen veroorzaken.
We kunnen geen voorkeur uitspreken voor een van de DOACs op basis van het feit dat deze onderling niet zijn vergeleken.
Zoeken en selecteren
Voor het beantwoorden van de uitgangsvraag “Is LMWH vergelijkbaar met ongefractioneerde heparine (UFH)?” is de CBO richtlijn van 2008 is als basis voor deze module gebruikt. Er is geen additioneel literatuuronderzoek verricht.
Voor het beantwoorden van de uitgangsvraag “Is LMWH vergelijkbaar met ongefractioneerde heparine (UFH)?” is de CBO richtlijn van 2008 is als basis voor deze module gebruikt. Er is geen additioneel literatuuronderzoek verricht.
Voor het beantwoorden van de uitgangsvraag: Wat is de waarde van de DOACs bij behandeling van diepe veneuze trombose (DVT) en longembolie, in vergelijking met de huidige behandeling met LMWH en VKA? is de volgende wetenschappelijke vraag uitgewerkt:
Wat zijn de effecten van antistollingsbehandeling met DOACs (dabigatran, rivaroxaban, apixaban, edoxaban) vergeleken met LMWH en VKA voor patiënten met acute VTE (DVT of longembolie) wanneer men kijkt naar recidief trombose, recidief longembolie, mortaliteit en bloedingen?
Om de uitgangsvraag te kunnen beantwoorden zijn vier systematische reviews (een uit 2012 en drie uit 2014) als uitgangspunt genomen.
Relevante uitkomstmaten
De werkgroep achtte recidief trombose, recidief longembolie, mortaliteit en bloedingen voor de besluitvorming relevante uitkomstmaten. Effectiviteitsuitkomsten waren recidief VTE, fatale longembolie en mortaliteit. Veiligheidsuitkomsten waren ernstige (‘major’) bloedingen, niet-fatale ernstige bloeding op een kritische plaats, klinisch relevante niet ernstige bloeding, niet fatale intracraniële bloeding, ernstige gastro-intestinale bloeding en fatale bloeding tijdens behandeling met anticoagulantia. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Recidief symptomatische VTE omvat zowel fatale als niet fatale longembolie en DVT. Recidief VTE werd beschouwd als de doodsoorzaak indien er objectieve documentatie in de vorm van autopsie aanwezig is, of indien de dood niet door een andere gedocumenteerde oorzaak kan worden verklaard en longembolie niet uitgesloten kan worden. De definitie van ernstige bloeding waren gelijk in alle geïncludeerde studies en in overeenstemming met de criteria voorgesteld door de ISTH (Van Es, 2014). Een ernstige bloeding wordt gedefinieerd als een fatale bloeding, bloeding in kritisch gebied of orgaan of een bloeding die een daling in hemoglobine van meer dan 1.24mmol/l veroorzaakt. Klinisch relevante niet ernstige bloedingen werden gedefinieerd als duidelijke bloeding die niet aan de definitie van ernstige bloeding voldoet maar waarvoor wel een medische interventie, ongepland contact met arts, (tijdelijk) stop van studie behandeling nodig is of waardoor de patiënten klachten ervaart (pijn, beperkingen in dagelijkse activiteiten).
Zoeken en selecteren (Methode)
Voor deze uitgangsvraag is geen systematische search gedaan omdat er meerdere recente reviews van voldoende kwaliteit beschikbaar waren (n=4) ((Fox, 2012; Van der Hulle, 2014; Van Es, 2014; Castellucci, 2014)). In deze reviews is systematisch gezocht naar RCT’s waarin een DOAC wordt vergeleken met LMWH of VKA voor de behandeling van VTE. Deze meta-analyses hebben dezelfde onderzoeksvraag en includeren grotendeels (afhankelijk van de zoekdatum) dezelfde originele studies. De meest recente search werd uitgevoerd in de review van Castelluci (28 februari 2014). Omdat er meerdere reviews beschikbaar waren en de kwaliteit hiervan vergelijkbaar is, is er voor gekozen om de meest recente review met voldoende data presentatie van alle vier DOACs te selecteren (Van Es, 2014). Deze review is opgenomen in de literatuuranalyse.
Referenties
- Agnelli G, Buller HR, Cohen A, et al. Oral apixaban for the treatment of acute venous thromboembolism. N Engl J Med, 2013;369(9):799-808.
- Barrit DW, Jordan Sc. Anticoagulant drugs in the treatment of pulmonary embolism: a controlled trial. Lancet 1960;1:1309-1312.
- Buller HR. Edoxaban versus warfarin for venous thromboembolism. N Engl J Med, 2014;370(1):80-1.
- Castellucci LA, Cameron C, Le Gal G, et al. Clinical and safety outcomes associated with treatment of acute venous thromboembolism: a systematic review and meta-analysis. JAMA, 2014;312(11):1122-35.
- Dolovich LR, Ginsberg JS, Douketis JD, et al. A meta-analysis comparing low-molecular-weight heparins with unfractionated heparin in the treatment of venous thromboembolism: examining some unanswered questions regarding location of treatment, product type, and dosing frequency. Arch Intern Med 2000;160(2):181-8.
- ESC Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC), Konstantinides SV, Torbicki A, et al. ESC Guidelines on the diagnosis and management of acute pulmonary embolism: The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS). Eur Heart J, 2014.
- Holster IL, Valkhoff VE, Kuipers EJ, et al. New oral anticoagulants increase risk for gastrointestinal bleeding: a systematic review and meta-analysis. Gastroenterology, 2013;145(1):105-112 e15.
- Kanis JA. Heparin in the treatment of pulmonary thromboembolism. Thromb Diath Haemorrh 1974;32(2-3): 519-27.
- Kearon C, Akl EA, Comerota AJ et al. Antithrombotic therapy for VTE disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 2012;141(2 Suppl):e419S-94S.
- Kearon C, Akl EA, Comerota AJ, et al. Antithrombotic therapy for VTE disease ACCP 2012. Chest 2012;141:2e49S-494S.
- Kernohan RJ, Todd C. Heparin therapy in thromboembolic disease. Lancet 1966;1(7438):621-3.
- Levine MN, Hirsh J, Gent M, et al. A randomized trial comparing activated thromboplastin time with heparin assay in patients with acute venous thromboembolism requiring large daily doses of heparin. Arch Intern Med 1994;154(1): 49-56.
- Lu G, DeGuzman FR, Hollenbach SJ, et al. A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa. Nat Med. 2013;19(4):446-51. doi: 10.1038/nm.3102. Epub 2013 Mar 3.
- Nagge J, Crowther M, Hirsh J. Is impaired renal function a contraindication to the use of low-molecular-weight heparin? Arch Intern Med 2002;162(22): 2605-9.
- Pollack CV Jr, Reilly PA, Eikelboom J, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med. 2015;373:511-20.
- Raschke R, Hirsh J, Guidry JR. Suboptimal monitoring and dosing of unfractionated heparin in comparative studies with low-molecular-weight heparin. Ann Intern Med 2003;138(9): 720-3.
- Ruff CT, Giugliano RP, Braunwald E, et al. New oral anticoagulants in patients with atrial fibrillation - Authors'reply. Lancet, 2014;384(9937):25-6.
- Schulman S, Eriksson H, Goldhaber S, et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med, 2009;361(24):2342-52.
- Schulman S, Kakkar AK, Goldhaber SZ, et al. Treatment of acute venous thromboembolism with dabigatran or warfarin and pooled analysis. Circulation, 2014;129(7):764-72.
- Van Dongen CJ, Mac Gillavry MR, Prins MH. Once versus twice daily LMWH for the initial treatment of venous thromboembolism. Cochrane Database Syst Rev 2005(3):CD003074.
- Van Es N, Coppens M, Schulman S, et al. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood, 2014;124(12):1968-75.
- Werkgroep NOACs van de wetenschappelijke verenigingen en Orde van Medisch Specialisten. Leidraad begeleide introductie nieuwe orale antistollingsmiddelen. 2012.
- Zondag W, Mos IC, Creemers-Schild D, et al. Outpatient treatment in patients with acute pulmonary embolism: The Hestia Study. J Thromb Haemostas 2011;9:1500-1507.
- Shore S, Carey EP, Turakhia MP, Jackevicius CA, Cunningham F, Pilote L, Bradley SM, Maddox TM, Grunwald GK, Barón AE, Rumsfeld JS, Varosy PD, Schneider PM, Marzec LN, Ho PM. Adherence to dabigatran therapy and longitudinal patient outcomes: insights from the veterans health administration. Am Heart J. 2014 Jun;167(6):810-7. doi: 10.1016/j.ahj.2014.03.023.
- Gorst-Rasmussen A, Skjøth F, Larsen TB, Rasmussen LH, Lip GY, Lane DA. Dabigatran adherence in atrial fibrillation patients during the first year after diagnosis: a nationwide cohort study. J Thromb Haemost. 2015 Apr;13(4):495-504. doi: 10.1111/jth.12845. Epub 2015 Feb 12.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: DOAC vs. VKA
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Van Es, 2014
individual study characteristics deduced from review
authors of review received individual and research support fees from pharma |
SR and meta-analysis of RCTs
Search date not stated
A Amplify: Agnelli, 2013 B: RE-COVER 1 Schulman 2009 C: RE-COVER II Schulman, 2014 D: EINSTEIN-DVT Bauersachs, 2010 E: EINSTEIN-PE Büller, 2012 F: Hokusai Buller, 2013
Study design: RCT
Setting and Country: -
Source of funding: Not stated
|
Inclusion criteria SR: RCT comparing DOAC to VKA
Exclusion criteria SR: Phase 2 dose-finding studies, studies evaluating extended anticoagulant treatment, thrombin inhibitor ximelagatran were also excluded because this agent is unavailable for patient use
6 studies included
Important patient characteristics at baseline: N, mean age I vs. C A: 2691, 57.2; 2704, 56.7 B: 1273, 55.0; 1266, 54.4 C: 1280, 54.7; 1288, 55.1 D: 1731, 55.8; 1718; 56.4 E:2419, 57.9; 2413, 57.5 F: 4118, 55.7; 4122, 55.9
Type A: VTE B: VTE C: VTE D: DVT E: PE F: VTE
Duration of treatment, median months: A: 6 B: 6 C: 6 D: I: 6.4, C: 6.2 E: I: 7.1, C: 7 F: 8.2
Groups comparable at baseline? yes |
Describe intervention:
A: initial: apixaban 10mg bid for 7d Long term: apixaban 5mg bid B: ≥5 days: LMWH long term: dabigatran 150mg bid C: ≥5 days: LMWH long term: dabigatran 150 mg bid D: rivaroxaban 15mg bid for 3wks Long term: rivaroxaban 20mg od E: rivaroxaban 15mg bid for 3wks Long term: rivaroxaban 20mg od F: ≥5 days: LMWH long term: edoxaban 60mg
|
Describe control:
A: ≥5 days: LMWH long term: warfarin (INR 2-3) B: ≥5 days: LMWH long term: warfarin (INR 2-3) C: ≥5 days: LMWH long term: warfarin (INR 2-3) D: ≥5 days: LMWH long term: Any VKA (INR 2-3) E: ≥5 days: LMWH long term: Any VKA (INR 2-3) F: ≥5 days: LMWH long term: Warfarin (INR 2-3)
|
End-point of follow-up: Not described
For how many participants were no complete outcome data available? Not described
|
I vs. C
Recurrent VTE (first recurrent VTE or VTE related death) A: 59/2609 (2.3%) vs. 71/2635 (2.7%) B: 30/1274 (2.4%) vs, 27/1265 (2.1%) C: 30/1279 (2.3%) vs. 28/1289 (2.2%) D: 36/1731 (2.1%) vs. 51/1718 (3.0%) E: 50/2419 (2.1%) vs. 44/2413 (1.8%) F: 66/4118 (1.6%) vs. 80/4122 (1.9%)
Pooled effect (random effects model): 0.90 [95% CI 0.77 to1.06] favoring DOAC Heterogeneity (I2): 0%, p=0.53
Major bleeding episode A: 15/2676 (0.6%) vs, 49/2689 (1.8%) B: 22/1273 (1.7%) vs. 29/1286 (2.3%) C: 15/1280 (1.2%) vs. 22/1288 (1.7%) D: 14/1718 (0.8%) vs. 20/1711 (1.2%) E: 26/2412 (1.1%) vs. 52/2405 (2.2%) F: 56/4118 (1.4%) vs. 66/4122 (1.6%)
Overall: 148/13477 (1.1%) vs. 238/13481 (1.8%)
Pooled effect (random effects model): 0.61 [95% CI 0.45 to 0.83] favoring DOAC Heterogeneity (I2): 51%, p=0.07
Intracranial bleeding (pooled): 15/13477 (0.1%) vs. 43 (13841 (0.3%), RR 0.37 (0.21-0.68) p=0.001. I2=0%
Fatal bleeding (pooled) 7/12477 (0.1%) vs. 22/13481 (0.2%), RR 0.36 (0.15-0.84) p=0.02. I2==0%
Major GI bleeding (pooled): 63/13477 (0.5%) vs. 76 (13481 (0.6%), RR: 0.78 (0.47-1.31), p=0.35. I2==51%
CRNM bleeding (pooled): 854/13477 (6.5%) vs. 1103 (13481 (8.0%) RR:0.73 (0.58-0.93) p=0.01. I2==85% |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009,
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Van Es, 2014 |
Yes |
Unclear (date of search nog stated, search strategy not described) |
No (excluded studies not described) |
Yes |
Not applicable (only RCT’s included) |
No |
Yes |
No |
Yes |
PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 29-03-2016
Beoordeeld op geldigheid : 21-04-2016
Deze richtlijn is modulair herzien. Een aantal modules dienen binnen de tijdstermijn van 5 jaar herzien te worden. De NIV is daarom voornemens een deel van de werkgroep in stand te houden. Een nader uitgewerkt onderhoudsplan wordt tijdens de commentaarronde ter consultatie voorgelegd aan de NIV commissie richtlijnen en kwaliteitsmeting.
De NIV is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (https://www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Het doel is de multidisciplinaire nationale richtlijn Antitrombotisch beleid te herzien, waarbij er een duidelijke invulling komt van de gesignaleerde klinische knelpunten. Als voorbeeld wordt de hiaat met betrekking tot het beleid van perioperatief gebruik van antistolling herzien en wordt aandacht gegeven aan de introductie van DOACs.
Deze richtlijn is geschreven voor patiënten, trombosediensten, en alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met antitrombotische therapie.
Samenstelling werkgroep
- prof. dr. M.V. Huisman, internist-vasculaire geneeskunde, LUMC (voorzitter), NIV
- dr. R. Bakx, kinderchirurg, Emma Kinderziekenhuis AMC & VU, NVK
- dr. M. Coppens, internist-vasculaire geneeskunde, AMC, NIV
- dr. E.J. van Dijk, neuroloog, Radboudumc, NVN
- dr. E.A. Dubois, cardioloog, Erasmus MC, NVVC
- dr. L. van Erven, cardioloog, LUMC, NVVC
- dr. H. Ettema, orthopedisch chirurg, Isala, NOV
- dr. R. A. Faaij, klinisch geriater, Diakonessenhuis, NVKG
- dr. J.P. Frölke, traumachirurg, Radboudumc, NVVH
- dr. ir. Y.M.C. Henskens, klinisch chemicus, MUMC, NVKC
- prof. dr. P.W. Kamphuisen, internist-vasculaire geneeskunde, UMCG, NIV
- prof. dr. F.W.G. Leebeek, internist-hematoloog, Erasmus MC, NIV
- dr. J.J.C.M. van de Leur, arts klinische chemie, Isala Klinieken, VAL
- dr. W. A. M. Lucassen, huisarts, NHG
- dr. M. Kruip, internist-hematoloog, Erasmus MC, NIV
- dr. K. Meijer, internist-hematoloog, UMCG, NIV
- prof. dr. S. Middeldorp, internist-vasculaire geneeskunde, AMC, NIV
- dr. C.H. van Ommen, kinderarts, Erasmus MC, NVK
- dr. M. van Pampus, gynaecoloog, OLVG, NVOG
- prof. dr. J.A. Reekers, interventie radioloog, AMC/UVA, NVvR
- dr. S. Renes, anesthesioloog, Radboudumc, NVA
- drs. R.J. Snijder, longarts, St. Antoniusziekenhuis, NVALT
- dr. A.K. Stroobants, klinisch chemicus, AMC/UVA, NVKC
- drs. M.C. Struijk-Mulder, orthopeed, tot 1 februari 2014, NOV
- dr. R. Vink, internist-intensivist, Tergooiziekenhuis, NIV
- dr. A. Wiersema, vaatchirurg, Westfriesgasthuis, NVVH
- dr. E. Wildschut, kinderintensivist, Erasmus MC, NVK
- Drs. E. E. Volmeijer, adviseur, Kennisinstituut van Medisch Specialisten
- Ir. T. A. van Barneveld, directeur, Kennisinstituut van Medisch Specialisten
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medische Specialisten
Voor het ontwikkelen van de richtlijn is in 2013 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met antitrombotisch beleid te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte van september 2013 tot december 2015 aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Belangenverklaringen
|
Naam |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonslijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
Oordeel ten aanzien van besluitvorming DOACs |
|
Struijk-Mulder (Deelname tot januari 2014) |
Orthopedisch chirurg |
geen |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
|
Dubois |
Lid werkgroep tbv richtlijn antitrombotisch beleid, Cardioloog, staflid Erasmus MC |
geen |
nvt |
nvt |
gemeld in 2013, 2015 niet meer van toepassing: Voorzitter commissie kwaliteit NVVC |
nvt |
nvt |
nvt |
deelname besluitvorming |
|
Van Erven |
Cardioloog, senior staflid, Leids Universitair Medisch Centrum |
geen |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
deelname besluitvorming |
|
Huisman |
Internist, voorzitter werkgroep |
nvt |
nvt |
nvt |
nvt |
unrestricted grant voor wetenschappelijk onderzoek (GSK, Boehringer Ingelheim) |
nvt |
nvt |
geen deelname besluitvorming |
|
Middeldorp |
staf afdeling Vasculaire Geneeskunde AMC |
gemeld in 2013 Onbetaald |
nvt |
nvt |
nvt |
gemeld in 2013 - ALIFE Studie: Zon MW € 125.000/GSK €45.000/Medapharma, studie medicatie |
nvt |
nvt |
geen deelname besluitvorming |
|
Van Dijk |
Neuroloog, UMC st Radboud |
gemeld in 2013Bestuurslid Stafconvent, UMC st Radboud Op contractbasis advies gegeven aan firma Boehringer Ingelheim over gebruik Dabigatran bij patienten met herseninfarct en atriumfibrillatie. Financiële tegemoetkoming voor werkgever (UMC st Radboud in 2011 en 2012). Eenmalig onderwijs gegeven aan neurologen en cadiologen in de regio op uitnodiging van Boehringer Ingelheim. Financiel;e tegemoetkoming voor werkgever (UMC St Radboud in 2012) Totala tegemoetkoming <5Keuro voor werkgever. gemeld in 2015: geen |
|
|
Bestuurslid Stafconvent, UMC st radboud |
gemeld in 2013 Onderzoek voor ZonMw (GGG/VWS) naar effectiviteit en veiligheid van DOACs in Nederland; niet waarschijnlijk dat financier belangen heeft. Gemeld in 2015: geen |
nvt |
nvt |
deelname besluitvorming |
|
Snijder |
longarts |
voorzitter vereniging medische staf, st. Anthoniusziekenhuis nieuwegein |
nvt |
nvt |
nvt |
nvt |
nvt |
nvt |
deelname besluitvorming |
|
Van de Leur |
laboratorium arts |
n.v.t. |
n.v.t. |
n.v.t. |
Lid adviescommissie STIZAN, Bestuurslid FNT |
n.v.t. |
n.v.t. |
n.v.t. |
deelname besluitvorming |
|
Van Ommen |
Kinderarts-hematoloog EUZ AMC, Erasmus MC (vanaf 2015) |
1 - PI PIP-Edoxaban (daiichi-sankyo) |
n.t.v. |
n.t.v. |
n.t.v. |
Unrestricted grant voor wetenschappelijk onderzoek (Daiichi-Sankyo) |
n.t.v. |
n.t.v. |
deelname besluitvorming |
|
Henskens |
klinisch chemicus MUMC+, clusterhoofd Hemostase en Transfusie |
Alle functies zijn onbetaald: |
nvt |
nvt |
nvt |
Validatie van laboratoriumtesten voor DOACs, reagentia worden vaak gratis geleverd doorverschillende firma's.Deelname aan internationale studies m.b.t. anti-trombitica en invloed op laboratoriumtesten. |
nee |
nee |
deelname besluitvorming |
|
Renes |
Anesthesioloog-pijnbestrijder UMCN St. Radboud, full-time |
Deelname NVA richtlijn "neuraxisblokkade en antistolling" |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
deelname besluitvorming |
|
Vink |
Internist-intensivist |
Redactielid A&I, Nascholingtijdschrift voor anesthesiologen en intensivisten. Onbetaald. Eenmalig getuige-deskundige Rechtbank Maastricht. Betaald. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
deelname besluitvorming |
|
Faaij |
Klinisch geriater, Diakonessenhuis Utrecht-Zeist-Doorn (full-time) |
|
n.v.t. |
n.v.t. |
Vml. Voorzitter geneesmiddelencommissie van ons ziekenhuis. |
n.v.t. |
n.v.t. |
n.v.t. |
deelname besluitvorming |
|
Meijer |
Internist-hematoloog |
Alle onbetaald: secretaris Nederlandse Vereniging voor Hematologie |
n.v.t. |
n.v.t. |
n.v.t. |
gemeld in 2013Eerdere deelname aan fase 3 onderzoek met rivaroxaban (Einstein studie, lokale PI en lid steering committee), dabigatran (Resonate studie, lokale PI) en edoxaban (Hokusal studie, lokale PI en lid steering committee). |
n.v.t. |
Organisator van tweejaarlijks Groninger Stollingssymposium, dat gesponsord wordt door de meeste fabrikanten van antistolingsmiddelen. Als onderdeel daarvan de uitreiking van de tweejaarlijkse Jan van der Meer prijs, die gesponsord wordt door Bayer. Pilotstudie VKA vs DOAC in setting Trombosedienst, zonder extra financiering. |
deelname besluitvorming |
|
Kamphuisen |
Internist-vasculair geneeskundige UMCG |
n.v.t |
n.v.t |
n.v.t |
n.v.t |
Betrokken bij door farmacie gesponsord onderzoek (lipiden). Verder 1 investigator initiated onderzoek met financiele ondersteuning van farmaceutische industrie. Alle inkomsten gaan naar het UMCG. |
n.v.t. |
n.v.t. |
geen deelname besluitvorming |
|
Reekers |
Staf afdeling Radiologie AMC |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
deelname besluitvorming |
|
Leebeek |
Internist Hematoloog en internist vasculair geneeskundige |
Klankbordgroep Dasigatran 2013 (opstellen leidraad voor gesbruik in bijzondere situaties) 2 vergaderingen betaald, onkostenvergoeding naar Erasmus MC - afgesloten |
n.v.t. |
n.v.t. |
gemeld in 2013 id van bestuur van de Nederlandse Vereniging voor Hemtaologie |
gemeld in 2013 Onderzoek gefinancieerd door CSI Bekring, Baxter, Trombose stichting, Hstichting Haemophilia |
n.v.t. |
n.v.t. |
deelname besluitvorming |
|
Stroobants |
Klinisch chemicus |
n.v.t |
n.v.t. |
n.v.t. |
bestuurslid VHL (Vereniging Hematologisch Laboratorium onderzoek), voorzitter werkgroep Hemostase van de VHL, werkgroep DOACs 'leidraad begeleide introductie nieuwe orale antistollingsmiddelen', presentaties op symposia georganiseerd door diverse gremia (onder andere FNT, instrumentation laboratory, Roche Diagnostics, Stag, VHL, Boehringer Ingelheim Pradaxa |
Gratis levering aan het LAKC van reagenstia, comsumables, apparatuur voor het evalueren van stollingstesten met name in aanwezigheid van DOACs door diverse diagnostische firma's (oa Roche Diagnostics, Siemens, Instrumentation Laboratory en Stago) |
|
n.v.t. |
deelname besluitvorming |
|
Kruip |
internist-hematoloog Erasmus MC (0,8 FTE) |
gemeld in 2015: sprekers- en onkostenvergoeding van Janssen-Cilag, GlaxoSmithKline, gelden naar ErasmusMC |
n.v.t. |
n.v.t. |
secretaris antistollingscommissie ErasmusMC |
gemeld in 2015: onderzoek naar DDAVP en stollingsfactorenen bij hemofilie patienten gefinancieerd met ZonMW-GGG grant en unrestricted grant van Ferring Pharmaceuticals, unrestricted grant Pfizer naar looppatronen bij hemofiliepatienten, FondsNutsOhra grant voor onderzoek onverklaarde bloedingsneiging, unrestricted grant Star-MDC naar behandeling met Vitamine K antagonisten, unrestricted grants voor onderzoek naar implementatie LSKA van DSW Zorgverzekeraar |
n.v.t. |
n.v.t. |
geen deelname besluitvorming |
|
Coppens |
Internist-vasculaire |
Heeft de afgelopen 2 jaar vergoedingen |
n.v.t. |
n.v.t. |
n.v.t. |
Deelname aan onderzoek naar de rol |
n.v.t. |
n.v.t. |
geen deelname besluitvorming |
|
Bakx |
kinderchirurg, voltijds |
Bestuurslid SSHK, onbetaald |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
deelname besluitvorming |
|
Wildshut |
Kinderarts Intensivist |
nvt |
nvt |
nvt |
nvt |
mvt |
nvt |
nvt |
deelname besluitvorming |
|
Wiersema |
Vaatchirurg |
Bestuurslid Ned Ver v Vaatchirurgie, onbetaald |
geen |
geen |
geen |
geen |
geen |
geen |
deelname besluitvorming |
|
Lucassen |
Huisarts te Zwaag |
lid werkgroep NHG "herziening NHG-standaard DVT |
geen |
geen |
geen |
g |
geen |
geen |
deelname besluitvorming |
|
Van Pampus |
Gynaecoloog OLVG |
Voorzitter Kwaliteitsvisitaties NVOG, betaald |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
deelname besluitvorming |
|
Ettema |
Orthopedisch chirurg |
redactie Nederlands tijdschrift voor |
geen |
geen |
geen |
geen |
geen |
geen |
deelname besluitvorming |
|
Frolke |
Staflid traumachirurgie Radboudumc Nijmegen |
medisch expert letselschade |
geen |
geen |
geen |
geen |
geen |
geen |
deelname besluitvorming |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een search naar het patiënten perspectief. Daarnaast zal bij de richtlijn een zogenaamde ‘option grid’ worden ontwikkeld (keuzehulp voor patiënten en zorgverleners samen) voor het onderwerp continueren antistolling.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie indicatorenontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen (www.zorginstituutnederland.nl).
Doordat delen van de richtlijn niet herzien zijn, zijn door de evolutie van richtlijn ontwikkelmethodologie de gebruikte methodes verschillend voor verschillende delen.
De delen over diagnostiek bij diepe veneuze trombose, diagnostiek longembolie, aparte categorieën in kader van diagnostiek, arteriële preventie en bijzondere situaties veneuze preventie veneuze trombo-embolie uit de CBO richtlijn van 2008 zijn zo veel mogelijk in originele structuur en stijl behouden (hoewel er aan de structuur wijzigingen zijn gemaakt zodat deze teksten conform het richtlijnendatabase format zijn). De additionele secties over medicamenteuze behandeling van veneuze trombo-embolie, niet-medicamenteuze behandeling van veneuze trombo-embolie, bijzondere situaties veneuze trombo-embolie en preventie veneuze trombo-embolie bevatten nieuwe literatuur en aanbevelingen die werden ontwikkeld volgens nieuwe methodologie. Dit heeft onvermijdelijk geleid tot inconsistenties in de stijl. Bijvoorbeeld is de GRADE methodologie gebruikt in de nieuwe teksten om de kwaliteit en sterkte van de bewijskracht en aanbevelingen te graderen in de nieuwe stukken, waar in de oude stukken gebruik is gemaakt van de oudere EBRO methodologie, of gradering van de oude ACCP richtlijn (2004) is overgenomen. Daarnaast wordt in de oude delen van de richtlijn asymptomatische DVT als uitkomstmaat gehanteerd, maar meer recentelijk wordt zowel nationaal als internationaal deze uitkomstmaat niet meer gebruikt. In de nieuwe delen worden daarom alleen de resultaten met betrekking tot symptomatische DVT gerapporteerd.
De beschrijving van de methodologie bij de verschillende teksten bevatten een beschrijving van de details met betrekking tot de methodologie voor de betreffende module.
Het is van belang om te benadrukken dat hoewel de richtlijn methodologie is veranderd, ook de oudere aanbevelingen uit de CBO richtlijn 2008 onverminderd van kracht zijn.
Knelpuntenanalyse
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (CBO, 2008) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door NIV, NVvH, NVN, NVvC, Nefarma, Achmea, KNMP, NHG, De Hart&Vaatgroep, VAL, FNT, NVKC tijdens de invitational conference. Een verslag hiervan kunt u vinden in de bijlagen bij deze richtlijn. Genodigde partijen op de invitational conference waren: ZN, NPCD, De Hart&Vaatgroep, CVZ, IGZ, VWS, Trombosedienst, Nefarma, NFU, STZ, NVZ, NHG, NGIR, NIV, NVVC, NVN, NVvH, NVA, NVALT, VAL, NVKC, NVKG, VAGZ, KNMP. Een lijst van de aanwezigen is opgenomen in het verslag. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Hierbij zijn de volgende onderwerpen geprioriteerd:
- couperen van bloedingen / bij spoedingrepen;
- preventie VTE bij kinderen;
- het gebruik van antistolling bij kleppen;
- laboratoriumdiagnostiek;
- het onderbreken en overbruggen van antistolling;
- preventie VTE:
-
- risicostratificatie bij chirurgische patiënten;
- risicostratificatie bij niet-chirurgische patiënten;
- preventie VTE bij orthopedische patiënten;
- preventie VTE in de verloskunde en gynaecologie;
- keuze hormonale anticonceptie.
-
- therapie VTE:
-
- behandeling CVC gerelateerde trombose;
- behandeling kuitvene trombose;
- thuisbehandeling DVT en longembolie;
- trombolyse bij de behandeling van DVT;
- continueren antistollingsbehandeling;
- behandeling oppervlakkige tromboflebitis;
- behandeling toevallig gevonden trombose;
- DOACS bij de behandeling van VTE.
-
Een overzicht van de alle paragraven uit de CBO richtlijn, inclusief vragen die geen prioriteit voor herziening kregen kunt u vinden in bijlage 5 bij deze richtlijn.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor de kritieke en belangrijke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar systematische reviews [EMBASE, MEDLINE, Cochrane library]. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen schatten. Deze beoordelingen kunt u vinden in de Risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org) (Schünemann H, 2013).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van vertrouwen in de literatuurconclusie.
|
GRADE |
Definitie |
|
Hoog |
er is veel vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie; het is zeer onwaarschijnlijk dat de literatuurconclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd. |
|
Matig |
er is matig vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie; het is mogelijk dat de conclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd. |
|
Laag |
er is beperkt vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie; het is waarschijnlijk dat de conclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de conclusie worden toegevoegd. |
|
Zeer laag |
er is weinig vertrouwen dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt zoals vermeld in de literatuurconclusie; de conclusie is zeer onzeker. |
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
De GRADE methodiek is door de Nederlandse werkgroep GRADE-NL (nog) niet vastgesteld voor dit type vraagstelling. De bewijskracht van de conclusie is bepaald volgens de EBRO-methode (Van Everdingen, 2004).
Belangrijkste verschillen tussen de GRADE- en ACCP-indeling
- met de ACCP-indeling worden aanbevelingen gegradeerd, met de GRADE methodiek worden conclusies gegradeerd. In de ACCP-aanbevelingen wordt wel rekening gehouden met overige (meer subjectieve) overwegingen (bijwerkingen, kosten, gemak voor patiënt), maar dit is niet expliciet terug te vinden; dit komt terug in grootte van het effect (zie punt 2). In de GRADE methodiek worden de overige overwegingen (bijwerkingen, kosten, patiëntenperspectief, expert opinion) gewogen en transparant beschreven, deze overwegingen samen met de wetenschappelijke conclusies leiden tot de aanbevelingen;
- in de ACCP-indeling wordt onderscheid gemaakt tussen een duidelijk klinisch effect (1) en een klein of onduidelijk effect (2), volgens de GRADE-methodiek wordt vooraf benoemde klinische relevantie meegewogen in de gradering van de conclusies.
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische testen, over schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in één of meerdere conclusie(s), waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals criteria die van invloed zijn op de aanbeveling, de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. De richtlijn bevat geen organisatie van zorg hoofdstuk, omdat er over organisatie van zorg en samenwerking binnen de keten reeds documenten bestaan (bijvoorbeeld LSKA 2.0).
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de richtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (de indicatoren zijn te vinden in de aanverwante producten). Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek worden toegevoegd na de commentaarfase.
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
Voor deze uitgangsvraag is geen search uitgevoerd omdat er systematische reviews van voldoende kwaliteit beschikbaar waren. De meest recente search werd uitgevoerd voor de studie van Castelluci et al. Er werd in Medline gezocht met de onderstaande strategie (Castelluci, 2014).
Example of MeSH and key word terms used for the systematic search strategy. The search strategy below was used to conduct the MEDLINE review* exp Venous Thrombosis/
expVenous Thromboembolism/
Deep vein thrombosis.mp.
Pulmonary embolism.mp. or exp Pulmonary Embolism/
expWarfarin/
expAcenocoumarol/
Direct thrombin inhibitor.mp.
dabigatran.mp.
rivaroxaban.mp.
apixaban.mp.
directXainhibitor.mp.
Pradax$.mp.
xarelto.mp.
eliquis.mp.
coumadin.mp.
expHeparin, low molecular weight/
randomized controlled trial.pt.
controlled clinical trial.pt.
random allocation.sh.
double blind method.sh.
single-blind method.sh.
((singl$ or doubl$ or trebl$ or tripl$) adj (blind$ or mask$)).ti,ab.
random$.ti,ab.
