Continueren antistolling na acute veneuze tromboembolie
Uitgangsvraag
Hoelang dient antistollingsbehandeling na een VTE te worden gecontinueerd?
Aanbeveling
Behandel patiënten met een eerste episode van VTE na een tijdelijke risicofactor gedurende drie maanden met antistollingstherapie.
Behandel patiënten met een eerste episode van idiopathische VTE gedurende tenminste drie maanden met antistollingstherapie. Continueer behandeling na 3 maanden, tenzij een hoog bloedingsrisico aanwezig is. Bij deze beslissing dient de patiënt nadrukkelijk betrokken te worden.
Behandel patiënten met een eerste episode van een idiopathische VTE en een te hoog bloedingsrisico gedurende drie maanden met antistollingstherapie.
Bij gebruik van apixaban en rivaroxaban kan worden overwogen om de dosering na 6 maanden aan te passen naar een lagere dosering.
Indien de behandeling wordt voortgezet, wordt geadviseerd om ieder jaar een heroverweging te maken.
Behandel patiënten met een recidief (idiopathisch of uitgelokte) VTE levenslang met antistollingstherapie.
Behandel patiënten met een hoog bloedingsrisico en een recidief VTE ten minste gedurende drie maanden met antistollingstherapie.
Geef bij het continueren van behandeling van VTE orale antistollingstherapie (DOAC en/of VKA) en niet acetylsalicylzuur. Alleen bij een contra-indicatie voor orale antistollingstherapie (bijvoorbeeld ernstige bloeding) kan overwogen worden om (langdurig) acetylsalicylzuur te geven, als patiënten geen contra-indicatie tegen acetylsalicylzuur hebben.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit de literatuuranalyse kunnen we concluderen dat een langdurige behandeling met antistolling lijkt te resulteren in een klinisch relevante vermindering van recidief VTE, ten opzichte van een kortdurende behandeling. Dit geldt voor behandeling met een VKA, DOACs en aspirine. Vergeleken met placebo, werden er in de studies naar DOAC en VKA de grootste vermindering van een recidief VTE gezien. Echter, een langdurige behandeling met antistolling lijkt, met uitzondering van apixaban, ook te leiden tot een verhoogd risico op ernstige bloedingen, ten opzichte van een kortdurende behandeling. Dit verschil is klinisch relevant voor een langdurige behandeling met een VKA en DOAC. Langdurige behandeling met aspirine lijkt te leiden tot een niet-klinisch relevante vermeerdering van risico op ernstige bloedingen. Langdurige behandeling met antistolling lijkt geen invloed te hebben op mortaliteit ‘door alle oorzaken’. Dit geldt voor behandeling met een VKA, DOACs en aspirine.
De optimale behandelingsduur na acute VTE is van verschillende factoren afhankelijk. Tijdens behandeling is het optreden van recidief VTE erg laag (Boutitie, 2011). Daartegenover staat het risico op ernstige bloedingen tijdens gebruik van VKA van 3% per jaar (Iorio, 2010). Dit risico is lager bij gebruik van DOACs (van de Hulle, 2014). Het risico van recidief VTE na het stoppen van behandeling bedraagt 30% na vijf jaar en hangt niet af van de initiële duur van behandeling, mits deze tenminste drie maanden is gegeven (Prandoni, 2007; Middeldorp, 2014; Couturaud 2015). Wel is het risico van recidief VTE verhoogd bij een behandeling korter dan drie maanden (Boutitie, 2011). Zodoende is het advies om een idiopathische VTE gedurende tenminste drie maanden te behandelen. Na de eerste drie maanden behandeling dient een individuele afweging gemaakt te worden van het bloedingsrisico. Om een inschatting te maken van het bloedingsrisico kan gebruik worden gemaakt van tabel 1. Tabel 1 is met kleine aanpassingen overgenomen uit de ACCP-richtlijn uit 2012. Tabel 1 geeft tevens een vergelijking van de ACCP-tabel en een andere bloeding risicoscores, de VTE-BLEED score.
In de ACCP-richtlijn werd een onderverdeling gemaakt in laag of hoog bloedingsrisico op basis van het aantal risicofactoren. De werkgroep is van mening dat deze indeling onvoldoende onderbouwd is en niet gevalideerd. Het is wel aannemelijk dat het bloedingsrisico toeneemt met het aantal aanwezige risicofactoren. Deze tabel is een hulpmiddel voor de arts om de afweging om antistolling te continueren, namelijk de balans tussen kans op recidief trombose bij stoppen en kans op bloeding bij continueren van antistolling, beter te maken. Bij een hoog risico op bloedingen kan worden overwogen om de antistollingsbehandeling te staken. Bij het gebruik van deze tabel moet worden opgemerkt dat patiënten met een hoog bloedingsrisico (bijvoorbeeld gemetastaseerde maligniteit (2 RF)) vaak ook een verhoogd risico hebben op een recidief trombose bij staken van de antistolling. Het blijft dus een afweging van de arts per individuele patiënt en de beslissing zal in samenspraak met de patiënt worden genomen. Indien de antistollingsbehandeling wordt voortgezet, verdient het de aanbeveling om ieder jaar een heroverweging te maken.
De ACCP risico tabel is een opsomming van risicofactoren voor bloeden die de ACCP richtlijn commissie heeft geïdentificeerd in de bestaande literatuur (Klok, 2020). Dit is dus niet een score die als zodanig ontwikkeld is. In de ACCP richtlijn wordt uitgegaan van een ‘laag’ risico als geen van de risicofactoren aanwezig is, een ‘intermediair’ risico als 1 risicofactor aanwezig is en een ‘hoog’ risico als twee of meer risicofactoren aanwezig zijn. De VTE-BLEED score is ontwikkeld in patiënten uit de RE-COVER studies, waarin dabigatran werd vergeleken met warfarine in patiënten met veneuze trombo-embolie. De score is ontwikkeld om ernstige bloedingen te voorspellen tijdens ‘chronische’ antistollingsbehandeling. Van beide scores is aangetoond dat patiënten in de hoge risico categorieën inderdaad een hoger risico op bloedingen hebben, zowel in trialverband als in de klinische praktijk, en voor patiënten die worden behandeld met verschillende DOACs. Absolute risico’s zijn moeilijk tot niet te destilleren uit de literatuur. In de regel hebben patiënten in de hoog risico categorie een 2-3 keer verhoogd risico op bloedingen ten opzichte van patiënten in de laag risico categorie. De ACCP-risicotabel en VTE-BLEED zijn nooit in studieverband gebruikt om behandelbeslissingen te maken. Daarom kunnen geen van beide gebruikt worden om voortgezette antistolling te onthouden aan patiënten in de hoog risico categorie. De ACCP-risicotabel en VTE-BLEED kunnen een algemene indruk geven van het risico op bloedingen, en zijn daarnaast nuttig om moduleerbare risicofactoren te identificeren, zoals bijvoorbeeld hypertensie, die dan behandeld kunnen worden om het risico op een bloeding te verlagen (Klok, 2020).
Tabel 1 Risicofactoren voor bloedingen (naar ACCP-richtlijn en VTE-BLEED score)
|
|
ACCP risico tabel |
VTE-BLEED (Klok, 2018) |
|
Leeftijd ≥60 jaar |
|
1,5 punten |
|
Leeftijd >65 jaar |
1 |
|
|
Leeftijd >75 jaar |
1 |
|
|
Eerdere bloeding |
1 |
1,5 punten |
|
Actieve kanker |
1 |
2 punten |
|
Gemetastaseerde kanker |
1 |
|
|
Nierinsufficientie (eGFR < 60 ml/min |
1 |
1,5 punten |
|
Leverfalen |
1 |
|
|
Trombocytopenie |
1 |
|
|
Eerder herseninfarct |
1 |
|
|
Diabetes |
1 |
|
|
Anemie |
1 |
1,5 punten |
|
Gebruik plaatjesremmers |
1 |
|
|
Slechte controle antistolling |
1 |
|
|
Comorbiditeit en afgenomen vitaliteit |
1 |
|
|
Recent trauma of operatie |
1 |
|
|
Frequent vallen |
1 |
|
|
Alcohol abusus |
1 |
|
|
NSAID gebruik |
1 |
|
|
Man met ongecontroleerde hypertensie (systole > 140 mm Hg) |
|
1 punt |
|
Risicoclassificatie |
||
|
Laag risico |
0 risicofactoren |
<2 punten |
|
Intermediair risico |
1 risicofactor |
|
|
Hoog risico |
≥2 risicofactoren |
≥2 punten |
Bij een recidief VTE is het risico van een nieuwe VTE na het wederom staken van antistolling hoog. Onderzoek heeft laten zien dat het risico niet beïnvloed wordt door het interval tussen de twee episodes (Van der Hulle, 2015). Het advies na een tweede idiopathische VTE is dan ook eenduidig: continueren van antistollingstherapie.
Bij een idiopathische VTE is het recidief risico op VTE hoog, wat voor de werkgroep de reden is om antistolling voor langer dan 3 maanden te adviseren. Dit is onafhankelijk van een (mogelijke) onderliggende erfelijke trombofiliefactor. Het beleid om niet te testen op erfelijke trombofiliefactoren blijft van kracht. Ook het testen op antifosfolipiden antistoffen is met betrekking tot de vraagstelling van duur van antistolling niet zinvol bij een VTE, omdat dit op zich niet de behandelduur zal beïnvloeden. Bepalen van antifosfolipiden antistoffen is wel aangewezen indien een (voortgezette) behandeling met DOACs wordt overwogen (zie ook module antifosfolipiden en antistolling).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het doel van een langdurige behandeling met antistolling na het doormaken een VTE is het voorkomen van een recidiverende VTE. Het voordeel van deze behandeling voor de patiënt is dat de kans op recidief trombose afneemt. Een mogelijk nadeel van langdurige behandeling met antistolling is de toegenomen kans op bloedingen. Het is belangrijk om de voor- en nadelen van de behandeling met de patiënt te bespreken. Handreikingen hiervoor zijn te vinden in de module over communicatie met de patiënt (link: https://lta-antistollingszorg.nl/communicatie-met-patienten).
Aanvaardbaarheid, haalbaarheid en implementatie
De bewijskracht en de overwegingen komen veelal overeen met de vorige richtlijn (2016) en daarom worden er geen problemen verwacht met betrekking tot aanvaardbaarheid en implementatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Patiënt dient na initiële behandeling behandeld te worden met een DOAC of VKA daar er met die medicamenten de meeste ervaring is en de beste studie resultaten zijn. De duur van de behandeling is afhankelijk van meerdere factoren. Hierbij speelt de wens van de patiënt een belangrijke rol, maar het lijkt duidelijk dat een langdurige behandeling met een DOAC of VKA effectiever is dan een kortdurende behandeling. Een langdurige behandeling brengt wel meer risico met zich mee dat er een bloeding optreedt. Dit geldt niet voor apixaban. Deze bloedingen lijken echter niet levensbedreigend omdat het risico op overlijden tussen patiënten met een DOAC/VKA versus placebo niet duidelijk verschillen. Het gaat dan om patiënten met een 1e presentatie van een VTE.
Onderbouwing
Achtergrond
De behandelingsduur van een acute veneuze trombo-embolie (VTE) met antistollingstherapie is afhankelijk van verschillende factoren. Patiënten met een uitgelokte VTE door een (belangrijke) risicofactor, zoals een langdurige operatie, hebben een lage kans van recidief (minder dan 3% per jaar) als de behandeling na 3 maanden wordt gestaakt (Ioro, 2010; Boutitie, 2011; Kearon, 2016). Ondanks een behandeling van drie tot zes maanden is er bij patiënten met een idiopathische (niet uitgelokte) VTE nog steeds een hoge kans op recidief trombose van 5 tot 10% in het eerste jaar na het stoppen van de antistollingstherapie tot cumulatief 30% na vijf jaar. De voortgezette behandeling met orale antistollingsmiddelen (direct werkende orale anticoagulantia (DOACs) en vitamine K-antagonisten (VKA)) leidt, afhankelijk van de voorgeschreven antistolling, tot meer bloedingen, wat de reden is dat de antistolling na een eerste episode van idiopathische VTE niet standaard wordt gecontinueerd.
Conclusies / Summary of Findings
VKA
|
Redelijk GRADE |
Recidief VTE Gedurende antistollingstherapie is het risico op een recidief VTE laag. Het risico op een recidief VTE is waarschijnlijk verlaagd bij een langdurige behandeling (18 tot 24 maanden) met VKA vergeleken met een korte duur behandeling (3 tot 6 maanden).
Bronnen: (Middeldorp, 2014; Couturaud, 2015; Bradbury, 2019; Couturaud, 2019) |
|
Redelijk GRADE |
Ernstige bloedingen Het risico op een ernstige bloeding is waarschijnlijk verhoogd voor patiënten die een langdurige behandeling met VKA krijgen vergeleken met patiënten die een korte termijn behandeling krijgen.
Bronnen: (Middeldorp, 2014; Couturaud, 2015; Bradbury, 2019; Couturaud, 2019) |
|
Laag GRADE |
Mortaliteit Er lijkt geen verschil te zijn in het risico om te overlijden tussen patiënten met een lange of korte termijn behandeling met VKA.
Bronnen: (Middeldorp, 2014; Couturaud, 2015; Couturaud, 2019) |
DOACS
|
Hoog GRADE |
Recidief VTE Het risico op een recidief VTE is verlaagd bij een langdurige behandeling (6 tot 12 maanden) met een DOAC, vergeleken met een placebo.
Bronnen: (Agnelli, 2013; Schulman, 2013; EINSTEIN, 2010; Weitz, 2017) |
|
Laag GRADE |
Ernstige bloedingen Het risico van een ernstige bloeding is niet verhoogd voor patienten die een langdurige behandeling met apixaban krijgen, vergeleken met patienten die een korte termijn behandeling met apixaban krijgen. Het risico van een ernstige bloeding is verhoogd voor patienten die een langdurige behandeling met rivaroxaban of dabigatran krijgen, vergeleken met patiënten die een korte termijn behandeling met rivaroxaban of dabigatran krijgen.
Bronnen: (Agnelli, 2013; Schulman, 2013; EINSTEIN, 2010; Weitz, 2017) |
|
Laag GRADE |
Mortaliteit Er lijkt geen verschil te zijn in het risico om te overlijden tussen patiënten met een lange of korte termijn behandeling met DOACs.
Bronnen: (Agnelli, 2013; Schulman, 2013; EINSTEIN, 2010; Weitz, 2017) |
TAR
|
Redelijk GRADE |
Recidief VTE Het risico op een recidief VTE lijkt verlaagd te zijn bij een lange termijn behandeling met aspirine vergeleken met een placebo.
Bronnen: (Becattini, 2012; Brighton, 2012) |
|
Redelijk GRADE |
Ernstige bloedingen Het risico op een ernstige bloeding is enigszins verhoogd voor patiënten die een lange termijn behandeling met aspirine krijgen vergeleken met een placebo.
Bronnen: (Becattini, 2012; Brighton, 2012) |
|
Laag GRADE |
Mortaliteit Er lijkt geen verschil te zijn in het risico om te overlijden tussen patiënten met een lange behandeling met aspirine of een placebo.
Bronnen: (Becattini, 2012; Brighton, 2012) |
Samenvatting literatuur
Vitamine K-antagonisten
Beschrijving studies
Een systematische literatuur review (Middeldorp, 2014) had tot doel om de literatuur samen te vatten ten aanzien van de werkzaamheid en veiligheid van de verschillende duur van behandeling met Vitamine K-antagonisten (VKA) in patiënten met symptomatische veneuze trombo-embolie. Er is in deze review systematisch gezocht tot oktober 2013. Studies zijn geïncludeerd als ze voldeden aan de volgende criteria: gerandomiseerd, objectief vastgestelde VTE-patiënten, vergelijking tussen verschillende duur van behandeling met als uitkomst recidief trombose, ernstige bloedingen en mortaliteit, waarbij de uitkomst geblindeerd was vastgesteld. In totaal zijn er 11 gerandomiseerde trials geïncludeerd (Agnelli, 2001; Agnelli, 2003; Eischer, 2009; Kearon, 1999; Kearon, 2004; Levine, 1995; Pinede, 2001; Ridker, 2003; Schulman, 1995; Schulman, 1997).
Voor het beantwoorden van de huidige uitgangsvraag is er een extra criterium gesteld; de initiële periode van behandeling is tenminste drie maanden. Vijf trials voldeden aan dit criterium (Agnelli, 2001; Agnelli, 2003; Eischer, 2009; Kearon, 1999; Ridker, 2003). Vanwege het doel van de review waren alleen trials van behandeling met VKA geïncludeerd. In de studies werd een korte duur van behandeling (waarna VKA werd gestopt) vergeleken met een lange duur van behandeling (variërend van drie additionele maanden VKA, negen maanden VKA, twee jaar VKA of oneindige behandeling met VKA). Het effect van duur van behandeling werd beoordeeld in de periode van stoppen met antistolling na een korte duur tot het stoppen van antistolling in de lange arm. De follow-up periode van start met VKA in de trial tot het doorzetten van VKA met een langere duur varieerde van zes tot dertig maanden. Drie van de vijf geïncludeerde trials hebben alleen patiënten met een spontane veneuze tromboembolie geïncludeerd. Er waren geen trials die een subgroep analyse hebben uitgevoerd bij tweede recidief trombose of longembolie in patiënten met een eerste recidief trombose. Data over antistollingsbehandeling met acetylsalicylzuur was niet beschikbaar (in elke trial werd VKA gegeven).
Daarnaast onderzochten drie RCT’s de effecten van verlengde behandeling met VKA in patiënten die een eerste episode van niet uitgelokte VTE hebben doorgemaakt en behandeld zijn met antistolling voor ten minste 3 maanden. In de RCT van Couturaud (2015), de PADIS-PE studie, werden patiënten gerandomiseerd tot behandeling met warfarine (n=184) of placebo (n=187) voor de duur van 18 maanden, nadat ze gedurende 6 ononderbroken maanden met een Vitamine K-antagonist behandeld zijn geweest. In de EXACT-studie van Bradbury (2019), een niet-geblindeerde RCT, werden patiënten gerandomiseerd tot het continueren van de antistolling behandeling voor 24 maanden (n=139), of tot het staken van de antistolling behandeling (n=134), na een initiële behandeling van 3 maanden. In de dubbelblinde RCT van Couturaud (2019), de PADIS-DVT studie, werden patiënten gerandomiseerd tot behandeling met warfarine (n=50) of placebo (n=54) voor de duur van 18 maanden, na 6 maanden met een Vitamine K-antagonist behandeld te zijn geweest. Primaire uitkomstmaten in deze studies waren recidief VTE en ernstige bloedingen.
Resultaten
Recidief VTE
De vijf geïncludeerde trials in de review van Middeldorp (2014) (n=1297) hebben de uitkomst recidief VTE geëvalueerd. In totaal kregen 22 (3%) patiënten tijdens een lange duur van behandeling met VKA een recidief ten opzichte van 73 (11%) patiënten na een korte duur van behandeling. De kans op een recidief zes maanden tot 30 maanden na de VTE is 70% lager bij een lange duur van behandeling met VKA vergeleken met een korte duur (RR 0,30 (95%BI: 0,19 tot 0,48)). Drie trials includeerden alleen patiënten met een idiopathische VTE (n=937). Het effect was vergelijkbaar binnen deze subgroep (RR 0,29 (95%BI: 0,18 tot 0,48)).
Ook de studies van Bradbury (2019), Couturaud (2015) en Couturaud (2019) lieten zien dat een lange duur van behandeling met VKA, tussen 18 en 24 maanden, een klinisch relevante kleinere kans op recidief VTE geeft dan behandeling met placebo (RR 0,16 95%BI: 0,08 tot 0,33) (figuur 1).
Figuur 1 Kans op recidief VTE bij behandeling met VKA (18-24 maanden) vergeleken met placebo.
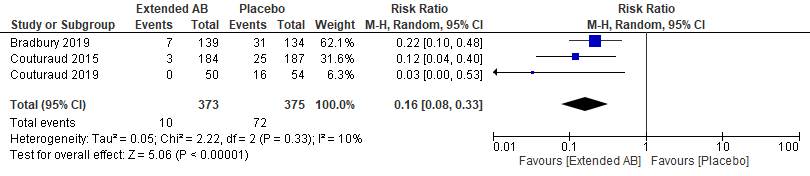
Ernstige bloedingen
Vier trials (n=971) geïncludeerd in de review van Middeldorp (2014) hebben ernstige bloedingen geëvalueerd. In totaal hebben 13 (3%) patiënten tijdens een lange duur van behandeling met VKA een ernstige bloeding gekregen ten opzichte van drie (1%) patiënten na een korte duur. Het risico op ernstige bloedingen is hoger bij een lange duur van behandeling (RR 3,51 (95%BI: 1,17 tot 10,56)). Drie trials (n=937) hadden alleen spontane VTE geïncludeerd. Aangezien het aantal patiënten voor de subgroep analyse bijna hetzelfde was, was het effect van lange duur van behandeling vergelijkbaar binnen patiënten met een idiopathische VTE (RR 3,59 (95%BI: 1,11 tot 11,63)).
Ook de studies Bradbury (2019) en Couturaud (2015) lieten zien dat een lange duur van behandeling met VKA, tussen 18 en 24 maanden, resulteert in een grotere kans op ernstige bloedingen dan behandeling met placebo (RR 3,16 (95%BI: 1,04 tot 9,55) (figuur 2).
Figuur 2 Kans op ernstige bloedingen bij behandeling met VKA (18-24 maanden) vergeleken met placebo
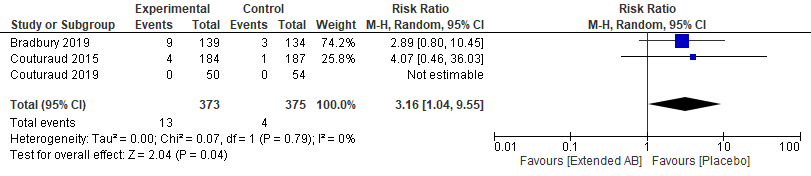
In de studie van Couturaud (2019) zijn er in de 18 maanden-durende behandelperiode geen bloedingen opgetreden in de zowel de interventie- als de placebogroep.
Mortaliteit
Twee trials (n=670) geïncludeerd in Middeldorp (2014) hebben data over het aantal overleden patiënten tijdens follow-up. Vijf (1%) patiënten tijdens lange duur van behandeling met VKA zijn overleden en 11 (3%) patiënten na korte duur van behandeling (RR 0,46 (95%BI: 0,16 tot 1,30)). Deze twee trials hebben alleen patiënten met idiopathische VTE geïncludeerd.
Couturaud (2015) rapporteerde na de 18 maanden behandelperiode twee sterfgevallen door andere oorzaken dan veneuze trombo-embolie of ernstige bloeding in de behandelgroep en twee in de placebogroep (HR 1,32 (95%BI: 0,19 tot 9,35)). In de studie van Couturaud (2019) is er na de 18 maanden-durende behandelperiode één sterfgeval door andere oorzaken dan veneuze trombo-embolie of ernstige bloeding in de placebogroep en geen in de behandelgroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat recidief VTE is met één niveau verlaagd naar redelijk, vanwege potentiële bias door open-label trials en imprecisie (breed betrouwbaarheidsinterval en laag aantal events). De bewijskracht voor ernstige bloedingen is met één niveau verlaagd naar redelijk, vanwege potentiële bias door open-label trials en imprecisie (breed betrouwbaarheidsinterval en laag aantal events). De bewijskracht voor mortaliteit is met twee niveaus verlaagd naar laag vanwege inconsistentie in de resultaten tussen trials en imprecisie (breed betrouwbaarheidsinterval en laag aantal events).
DOAC’s
Beschrijving studies
De dubbelblinde gerandomiseerde studie van Agnelli (2013) had tot doel de effectiviteit en veiligheid van apixaban te onderzoeken als verlengde behandeling voor VTE. Patiënten met VTE die een 6 tot 12 maanden durende antistollingstherapie hadden afgerond werden gerandomiseerd, in een 1:1:1 ratio, tot het ontvangen van 2,5 mg apixaban (n=840), 5 mg apixaban (n=813), of placebo (829), tweemaal daags gedurende 12 maanden. De belangrijkste uitkomstmaten waren recidief VTE en bloedingen.
In de studie van Schulman (2013) worden twee gerandomiseerde studies beschreven; één vergelijkt dabigatran met warfarine, en de andere studie vergelijkt dabigatran met placebo. In deze module zullen alleen de resultaten van de studie naar dabigatran versus placebo worden meegenomen. Patiënten met een VTE die voor tenminste 3 maanden met antistolling zijn behandeld, zijn gerandomiseerd tot behandeling met dabigatran (150 mg, tweemaal daags, n=681) of placebo (n=662), gedurende 6 maanden. De belangrijkste uitkomstmaten waren recidief VTE en bloedingen.
De dubbelblinde RCT EINSTEIN studie (Bauersachs, 2010) beschrijft twee gerandomiseerde studies: een vergelijking tussen rivaroxaban en enoxaparine gevolgd door een VKA, en een vergelijking tussen rivaroxaban en placebo (EINSTEIN–Extension study; the Continued Treatment Study). In deze module zullen alleen de resultaten van de laatstgenoemde vergelijking worden meegenomen. Patiënten met een bevestigde symptomatische DVT of longembolie die gedurende 6 of 12 maanden waren behandeld met een Vitamine K-antagonist of rivaroxaban, werden willekeurig toegewezen om de behandeling met rivaroxaban, 20 mg eenmaal daags (n=602) of placebo (n=594) voort te zetten gedurende 6 tot 12 maanden. De primaire uitkomstmaat was symptomatisch recidief VTE. De EINSTEIN CHOICE studie (Weitz, 2017) onderzocht de werkzaamheid en veiligheid van twee doses rivaroxaban in vergelijking met die van aspirine voor de langdurige behandeling van veneuze trombo-embolie tot 1 jaar na de eerste 6 tot 12 maanden behandeling. Patiënten werden willekeurig toegewezen aan behandeling met rivaroxaban 20mg (n=1107), rivaroxaban 10mg (n=1127), of aan behandeling met aspirine 100mg (n=1131), gedurende maximaal 12 maanden. De belangrijkste uitkomstmaten waren symptomatisch recidief VTE en bloedingen.
Resultaten
Recidief VTE
Drie studies onderzochten de kans op recidief VTE na verlengde behandeling met een DOAC, van 6 tot 12 maanden. Een verlengde behandeling met apixaban leidde tot een risicoreductie van 81% ten opzichte van placebo (dosis 2dd 2,5mg RR 0,19 (95%BI: 0,11 tot 0,33; dosis 2dd 5mg RR 0,20 (95%BI: 0,11 tot 0,34) (Agnelli, 2013). De kans op een recidief was 92% lager bij een lange duur van behandeling met dabigatran vergeleken met placebo (RR 0,08 95%BI: 0,02 tot 0,25) (Schulman, 2013). Ook verlengde behandeling met rivaroxaban leidde tot een (81%) lagere kans op symptomatisch recidief VTE in vergelijking met placebo (HR 0,19 (95%BI: 0,09 tot 0,40) (EINSTEIN, 2010).
Gezamenlijk leidden de DOACs tot een klinisch relevante risicoreductie van 82% (RR 0,18 (95%BI: 0,13 tot 0,25), zie figuur 3)
Figuur 3 Kans op recidief VTE bij verlengde behandeling met DOAC (6-12 maanden) vergeleken met placebo
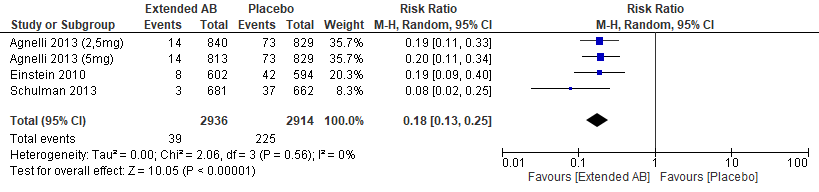
De EINSTEIN CHOICE studie (Weitz, 2017) vond een lagere kans op recidief VTE welke klinisch relevant is, bij behandeling met rivaroxaban (66% en 74% voor 20 en 10 mg rivaroxaban), dan bij behandeling met aspirine (HR rivaroxaban 20mg versus aspirine: 0,34; (95%BI: 0,20 tot 0,59); HR rivaroxaban 10mg versus aspirine: 0,26, (95%BI: 0,14 tot 0,47)).
Ernstige bloedingen
Drie studies onderzochten de kans op ernstige bloedingen na verlengde behandeling met een DOAC, van 6 tot 12 maanden. In de studie, waarin twee doses apixaban tegenover placebo werd onderzocht, werd bij geen van de doses apixaban een grotere kans op ernstige bloeding gezien in vergelijking tot placebo (Agnelli, 2013). Wel werd een grotere kans op niet ernstige bloeding gezien met apixaban dan met placebo. In de studies, waarin dabigatran en rivaroxaban respectievelijk werden vergeleken met placebo, werd een statistisch niet significant grotere kans op ernstige bloeding gezien. De verschillende DOACs gecombineerd leidde tot een niet significant grotere kans op ernstige bloedingen bij een verlengde behandeling in vergelijking met placebo (RR 1,72 (95%BI: 0,59 tot 4,98), zie figuur 4) (Agnelli, 2013; Schulman, 2013; EINSTEIN, 2010).
Figuur 4 Kans op ernstige bloedingen bij verlengde behandeling met DOAC (6-12 maanden) vergeleken met placebo
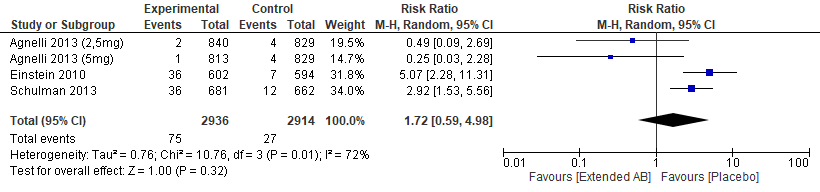
De EINSTEIN CHOICE studie (Weitz, 2017) vond geen verschil in kans op ernstige bloedingen tussen behandeling met rivaroxaban (20mg of 10mg eenmaal daags) en behandeling met aspirine (HR rivaroxaban 20mg versus aspirine: 2,01 (95%BI: 0,50 tot 8,04), HR rivaroxaban 10mg versus aspirine: 1,64, (95%BI: 0,39 tot 6,84)).
Mortaliteit
In de studie van Agnelli (2013) was het sterftecijfer, door welke oorzaak dan ook, lager in de behandelgroep (1,7% in de placebogroep, vergeleken met 0,8% en 0,5% in respectievelijk de 2,5 mg tweemaal daags en 5 mg tweemaal daags apixaban-groepen). Schulman (2013) rapporteerde 17 (1,2%) sterfgevallen in de dabigatran-groep en 19 (1,3%) in de placebogroep (HR 0,90 (95%BI 0,47 tot 1,72)). In de studie van EINSTEIN (2010) werd 1 (0,2%) sterfgeval gerapporteerd in de rivaroxaban-groep en 2 (0,3%) in de placebogroep.
In de EINSTEIN CHOICE studie (Weitz, 2017) was het sterftecijfer in de rivaroxaban 20mg-groep 0,7%, in de rivaroxaban 10mg-groep 0,2%, en in de aspirine-groep 0,6%.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat recidief VTE is niet verlaagd. De bewijskracht voor ernstige bloedingen is met twee niveaus verlaagd naar laag vanwege inconsistentie (tegenstrijdigheid in de resultaten tussen de trials) en imprecisie (breed betrouwbaarheidsinterval en laag aantal events). De bewijskracht voor mortaliteit is met twee niveaus verlaagd naar laag vanwege imprecisie (breed betrouwbaarheidsinterval en laag aantal events).
Aspirine (TAR)
Beschrijving studies
In de dubbelblinde studie van Becattini (2012) werden patiënten met de allereerste niet-uitgelokte VTE, die 6 tot 18 maanden behandeling met orale anticoagulantia hadden ondergaan, willekeurig toegewezen aan aspirine, 100 mg per dag (n=205) of placebo (n=197) gedurende 2 jaar, met de mogelijkheid tot verlenging van de studiebehandeling. De primaire uitkomstmaten waren recidief VTE en bloedingen.
In de RCT van Brighton (2012) werden patiënten die een initiële antistollingstherapie (≤ 26 weken of > 26 weken) hadden voltooid na een eerste episode van niet-uitgelokte veneuze trombo-embolie, willekeurig toegewezen aan aspirine, 100 mg per dag (n=411), of placebo (n=411) gedurende maximaal 4 jaar (minimaal 2 jaar). De primaire uitkomstmaat was een recidief VTE.
Resultaten
Recidief VTE
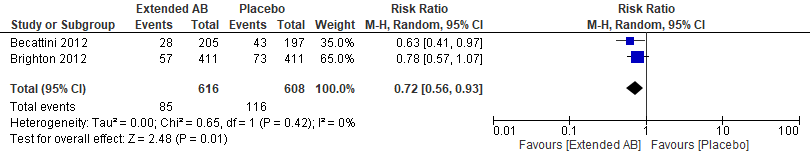
Een verlengde behandeling met aspirine (100mg) leidt tot een klinisch relevant lagere kans (28%) op recidief VTE in vergelijking met placebo (RR 0,72 (95%BI: 0,56 tot 0,93), zie figuur 5) (Becattini, 2012; Brighton, 2012).
Figuur 5 Kans op recidief VTE bij verlengde behandeling met aspirine (6-18 maanden) vergeleken met placebo
Ernstige bloedingen
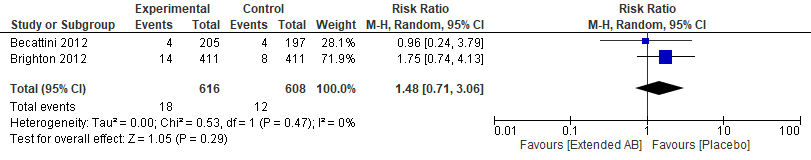
Verlengde behandeling met aspirine (100mg, gedurende 2 jaar) leidt tot een enigszins verhoogde kans op ernstige bloedingen in vergelijking met placebo (RR 1,48 (95%BI: 0,71 tot 3,06), zie figuur 6) (Becattini, 2012; Brighton, 2012).
Figuur 6 Kans op ernstige bloedingen bij verlengde behandeling met aspirine (2 jaar) vergeleken met placebo
Mortaliteit
In de studie van Becattini (2012) zijn 6 patiënten in de aspirine-groep (2,9%) en 5 patiënten in de placebogroep (2,5%) overleden gedurende de 24 maanden durende behandelperiode. Brighton (2012) rapporteerde 16 (3,9%) sterfgevallen in de aspirine-groep en 18 (4,3%) in de placebogroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat recidief VTE is met één niveau verlaagd naar redelijk vanwege het kleine aantal studies. De bewijskracht voor ernstige bloedingen is met één niveau verlaagd naar redelijk, vanwege imprecisie (breed betrouwbaarheidsinterval en laag aantal events). De bewijskracht voor mortaliteit is met twee niveaus verlaagd naar laag vanwege imprecisie (laag aantal events).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is een systematische literatuuranalyse verricht met de volgende wetenschappelijke vraagstelling:
Wat zijn de effecten van langdurige antistollingsbehandeling (continueren) in vergelijking met een antistollingsbehandeling van korte duur in patiënten met een eerste VTE op recidief trombose, bloedingen en mortaliteit?
P: patiënten met een eerste VTE;
I: continueren van antistollingsbehandeling > 3 maanden;
C: antistollingsbehandeling ≤ 3 maanden of placebo;
O: recidief VTE, bloedingen, mortaliteit.
Hierbij beschouwt men > 3 maanden als lange duur antistolling en ≤ 3 maanden als korte duur antistolling. Het effect van duur van antistollingsbehandeling zal binnen de volgende subgroepen worden geëvalueerd: patiënten met een idiopathische trombose, patiënten met een recidief trombose, en behandeling met acetylsalicylzuur.
Relevante uitkomstmaten
De werkgroep achtte symptomatische recidief veneuze trombo-embolie (VTE) en bloedingen (majeure/ernstige) voor de besluitvorming kritieke uitkomstmaten, en mortaliteit een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde de uitkomstmaten als volgt:
- recidief trombose: symptomen in combinatie met een toename van een intraluminaal vullingsdefect op een venogram; een nieuw intraluminaal vullingsdefect of een toename van tenminste 4 mm op een echo-duplex onderzoek, ten opzichte van een eerder echografisch onderzoek;
- recidief longembolie: symptomen in combinatie met een toename van een intraluminaal vullingsdefect op een CT pulmonalis angiografie; een nieuw perfusie-ventilatie mismatch defect op een V-Q longscan;
- bloedingen: bloedingen werden ingedeeld als ernstig bij intracraniale of retroperitoneale bloedingen, bloedingen waarvoor transfusie nodig was, of leidde tot interruptie van antistollingsbehandeling of operatie of fatale bloedingen. Alle andere bloedingen werden geclassificeerd als niet ernstige klinisch relevante bloedingen.
Een verschil van ten minste 25% in relatief risico werd gedefinieerd als een klinisch relevant verschil (per default, er was geen literatuur beschikbaar om de beslissing te onderbouwen).
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase en Cochrane is met relevante zoektermen op 29 januari 2015 gezocht naar reviews en RCT’s.
De literatuurzoekactie naar systematische reviews leverde 237 resultaten op. Studies werden geselecteerd op grond van de volgende selectiecriteria: reviews die systematisch hebben gezocht naar gerandomiseerde trials relevant voor de uitgangsvraag. Op basis van titel en abstract werden in eerste instantie 27 artikelen voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 26 artikelen geëxcludeerd (zie exclusietabel) en één artikel definitief geselecteerd. Een systematische review met 11 geïncludeerde trials is opgenomen in de literatuuranalyse (zie de evidence tabel).
De literatuurzoekactie naar RCTs leverde 416 resultaten op. Studies werden geselecteerd op grond van de volgende selectiecriteria: vergelijkend onderzoek naar duur van antistollingsbehandeling met een van de genoemde uitkomstmaten. Op basis van titel en abstract werden in eerste instantie drie studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens drie studies geëxcludeerd (zie exclusietabel), en geen studie definitief geselecteerd.
Aanvullend is er op 21 januari 2020 systematisch gezocht in de databases Medline (via OVID) en Embase (via Embase.com) met relevante zoektermen naar systematische reviews en RCT’s over de verlengde behandeling van VTE met antistolling die vanaf 2015 zijn verschenen. De literatuuractie naar systematische reviews leverde 271 resultaten op. Op basis van titel en abstract warden er geen systematische reviews geïncludeerd. Op basis van titel en abstract werden er 10 RCT’s voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 5 studies geëxcludeerd, en 5 studies definitief geïncludeerd. Tevens werden er 5 RCT’s geïncludeerd in de literatuuranalyse die in de oorspronkelijke module uit 2016 slechts in de overwegingen zijn beschreven. Deze studies adresseren de verlengde behandeling met DOAC’s en met aspirine. Uiteindelijk zijn er 1 systematische review en 10 RCT’s geïncludeerd in de literatuuranalyse.
Resultaten
11 onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Agnelli G, Buller HR, Cohen A, et al., Apixaban for extended treatment of venous thromboembolism. N Engl J Med 2013;368(8):699-708.
- Andreozzi, G. M., Bignamini, A. A., Davì, G., Palareti, G., Matuška, J., Holý, M.,... & Andrei, L. D. (2015). Sulodexide for the prevention of recurrent venous thromboembolism: the sulodexide in secondary prevention of recurrent deep vein thrombosis (SURVET) study: a multicenter, randomized, double-blind, placebo-controlled trial. Circulation, 132(20), 1891-1897.
- Becattini C, Agnelli G, Schenone A, et al. Aspirin for preventing the recurrence of venous thromboembolism. N Engl J Med 2012;366(21):1959-1967.
- Boutitie FP, Schulman S, Agnelli G, et al. Influence of preceding duration of anticoagulant therapy and initial presentation of venous thromboembolism on risk of recurrence after stopping therapy: analysis of individual participant’s data from seven trials. BMJ. 2011;342:d3036.
- Bradbury, C., Fletcher, K., Sun, Y., Heneghan, C., Gardiner, C., Roalfe, A.,... & Hobbs, F. R. (2020). A randomised controlled trial of extended anticoagulation treatment versus standard treatment for the prevention of recurrent venous thromboembolism (VTE) and post‐thrombotic syndrome in patients being treated for a first episode of unprovoked VTE (the ExACT study). British Journal of Haematology, 188(6), 962-975.
- Brighton TA, Eikelboom JW, Mann K, et al. Low-dose aspirin for preventing recurrent venous thromboembolism. N Engl J Med 2012;367(21):1979-1987.
- Buller HR, Edoxaban versus warfarin for venous thromboembolism. N Engl J Med, 2014;370(1):80-1.
- Couturand F, Sanchez O, Pernod G, et al. Two years versus six months of oral anticoagulation after a first episode of unprovoked pulmonary embolism. The PADIS-PE randomized clinical trial. JAMA 2015,314;31-40.
- Couturaud, F., Pernod, G., Presles, E., Duhamel, E., Jego, P., Provost, K.,... & Bressollette, L. (2019). Six months versus two years of oral anticoagulation after a first episode of unprovoked deep-vein thrombosis. The PADIS-DVT randomized clinical trial. haematologica, 104(7), 1493-1501.
- Eichinger S, Heinze G, Kyrle PA. D-dimer levels over time and the risk of recurrent venous thromboembolism: an update of the Vienna prediction model. J Am Heart Assoc. 2014;3(1):e000467.
- Einstein Investigators. (2010). Oral rivaroxaban for symptomatic venous thromboembolism. New England Journal of Medicine, 363(26), 2499-2510.
- ESC Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC), Konstantinides SV, Torbicki A, et al. ESC Guidelines on the diagnosis and management of acute pulmonary embolism: The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS). Eur Heart J, 2014.
- Francis CW, Kessler CM, Goldhaber SZ, Kovacs MJ, Monreal M, Huisman MV, Bergqvist D, Turpie AG, Ortel TL, Spyropoulos AC, Pabinger I, Kakkar AK. Treatment of venous thromboembolism in cancer patients with dalteparin for up to 12 months: the DALTECAN Study.J Thromb Haemost. 2015 Jun;13(6):1028-35. doi: 10.1111/jth.12923. Epub 2015 May 10)
- Iorio A, Kearon C, Filippucci E, et al. Risk of recurrence after a first episode of symptomatic venous thromboembolism provoked by a transient risk factor: a systematic review. Arch Intern Med. 2010;170(19):1710-1716.
- de Jong, L. A., Gout-Zwart, J. J., Stevanovic, J., Rila, H., Koops, M., Huisman, M. V., & Postma, M. J. (2018). Extended treatment with apixaban for venous thromboembolism prevention in the Netherlands: clinical and economic effects. TH open: companion journal to thrombosis and haemostasis, 2(3), e315.
- Kämpfen P, Méan M, Limacher A, Righini M, Jaeger K, Beer HJ, Osterwalder J, Frauchiger B, Matter CM, Kucher N, Cornuz J, Banyai M, Egloff M, Aschwanden M, Bounameaux H, Rodondi N, Aujesky D. Risk of falls and bleeding in elderly patients with acute venous thromboembolism. J Intern Med. 2014 Oct;276(4):378-86.
- Kearon, C., Akl, E. A., Ornelas, J., Blaivas, A., Jimenez, D., Bounameaux, H.,... & Moores, L. (2016). Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest, 149(2), 315-352.
- Klok, F. A., & Huisman, M. V. (2020). How I assess and manage the risk of bleeding in patients treated for venous thromboembolism. Blood, The Journal of the American Society of Hematology, 135(10), 724-734.
- Klok, F. A., Barco, S., & Konstantinides, S. V. (2018). Evaluation of VTE-BLEED for predicting intracranial or fatal bleeding in stable anticoagulated patients with venous thromboembolism. European Respiratory Journal, 51(4).
- Lee AY, Levine MN, Baker RI, Bowden C, Kakkar AK, Prins M, Rickles FR, Julian JA, Haley S, Kovacs MJ, Gent M; Randomized Comparison of Low-Molecular-Weight Heparin versus Oral Anticoagulant Therapy for the Prevention of Recurrent Venous Thromboembolism in Patients with Cancer (CLOT) Investigators. N Engl J Med. 2003 Jul 10;349(2):146-53.)
- Middeldorp S, Prins MH, Hutten BA. Duration of treatment with vitamin K antagonists in symptomatic venous thromboembolism. Cochrane Database Syst Rev. 2014;8:CD001367.
- Palareti G, Cosmi B, Legnani C, et al., D-dimer testing to determine the duration of anticoagulation therapy. N Engl J Med 2006;355(17):1780-1789.
- Palareti G, Legnani C, Lee A, et al. A comparison of the safety and efficacy of oral anticoagulation for the treatment of venous thromboembolic disease in patients with or without malignancy. Thromb Haemost. 2000;84(5):805-810.
- Prandoni P, Noventa F, Ghirarduzzi A, et al. The risk of recurrent venous thromboembolism after discontinuing anticoagulation in patients with acute proximal deep vein thrombosis or pulmonary embolism. A prospective cohort study in 1,626 patients. Haematologica. 2007;92(2):199-205.
- Rodger MA, Kahn SR, Wells PS, et al. Identifying unprovoked thromboembolism patients at low risk for recurrence who can discontinue anticoagulant therapy. CMAJ. 2008;179:417-426.
- Schulman S, Kearon C, Kakkar AK, et al., Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med 2013;368(8):709-718.
- Van der Hulle, T., Kooiman, J., Den Exter, P. L., Dekkers, O. M., Klok, F. A., & Huisman, M. V. (2014). Effectiveness and safety of novel oral anticoagulants as compared with vitamin K antagonists in the treatment of acute symptomatic venous thromboembolism: a systematic review and meta‐analysis. Journal of Thrombosis and Haemostasis, 12(3), 320-328.
- Van der Hulle T, Tan M, den Exter PL, et al. Recurrence risk after anticoagulant treatment of limited duration for late, second venous thromboembolism. Haematologica. 2015;100(2):188-93.
- Weitz, J. I., Lensing, A. W., Prins, M. H., Bauersachs, R., Beyer-Westendorf, J., Bounameaux, H.,... & Freitas, M. C. (2017). Rivaroxaban or aspirin for extended treatment of venous thromboembolism. New England Journal of Medicine, 376(13), 1211-1222.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Middeldorp et al, 2014 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
Yes |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Andreozzi, 2015 |
Allocation 1:1 ratio based on a computer-generated randomization list in blocks of 4 produced by an independent operating unit. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Couturaud, 2015 |
Patients were randomized using a central computerized Internet-based system. Using a computer algorithm, an independent statistician generated the assignment list in randomly permuted blocks of 4 or 6, with stratification by center |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Bradbury, 2019 |
Randomisation was performed within the web-based computerised clinical case report form. The software used random blocks randomisation (block size of 4) stratified by diagnosis (DVT or PE). |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
Couturaud, 2019 |
Patients were randomized using a central computerized Internet-based system. Using a computer algorithm, an independent statistician generated the assignment list in randomly permuted blocks of 4 or 6, with stratification by center |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Agnelli, 2013 |
Randomization was performed with the use of an interactive voice-response system |
Unlikely |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Schulman, 2013 |
Randomization was performed with the use of an interactive voice-response system |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Becattini, 2012 |
Not described |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Brighton, 2012 |
Randomization was performed through a central Web-based randomization system |
Unlikely |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Einstein, 2010 |
patients were randomly assigned with the use of a computerized voice–response system, with stratification by country |
Unlikely |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Weitz, 2017 |
Randomization with a block size of six was performed with the use of an interactive voice-response system and was stratified according to the index diagnosis (deep-vein thrombosis or pulmonary embolism) and country. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Exclusietabel
1e ronde: op basis van selectie door werkgroeplid
2de ronde: op basis van artikel
3de ronde: op basis van het lezen van fulltext
Systematische reviews en RCTs
|
Nummer in search |
Auteur, jaartal |
Inclusie/Exclusie |
Reden van exclusie |
|
Reviews |
|
|
|
|
1 |
Wu, 2015 |
Inclusie (systematisch gezocht tot sept 2014); 2de ronde: inclusie; 3de ronde: exclusie |
Vergeleken met trials geïncludeerd in Middendorp et al hebben geen duur van behandeling met elkaar vergeleken of het was niet af te leiden |
|
4 |
Akl, 2014 |
Exclusie |
Twee lange-termijn behandelingen worden met elkaar vergeleken |
|
5 |
Alotaibi, 2014 |
Twijfel; 2de ronde: exclusie |
Vergelijking tussen DOACS |
|
6 |
Becattini, 2014 |
Inclusie; 2de ronde: exclusie |
Niet systematisch gezocht |
|
7 |
Blickstein, 2014 |
Exclusie |
Betreft een Cochrane protocol |
|
9 |
Carrier, 2014 |
Inclusie (systematisch gezocht tot april 2014); 2de ronde: inclusie; 3de ronde: exclusie |
Vergelijking tussen behandelingen en niet met placebo voor mogelijke duur van behandeling |
|
11 |
Castellucci, 2014 |
Inclusie (systematisch gezocht tot februari 2014); 2de ronde: exclusie |
Verschillende types medicatie worden met elkaar vergeleken niet de duur van behandeling |
|
18 |
Donadini, 2014 |
Exclusie |
RVO als mogelijk risico factor voor een recidief |
|
23 |
Harel, 2014 |
Inclusie (systematisch gezocht tot maart 2013); 2de ronde: exclusie |
CKD patiënten en vergelijking van medicatie en niet duur van behandeling |
|
27 |
Lang, 2014 |
Exclusie |
Vergelijking tussen DOACs en warfarine |
|
30 |
Larsen, 2014 |
Inclusie (semi-systematisch gezocht tot april 2014); 2de ronde: exclusie |
Vergelijking van medicaties en niet duur van behandeling |
|
43 |
Vallakati, 2014 |
Exclusie |
Conference abstract |
|
44 |
Van der Hulle, 2014 |
Inclusie (systematisch gezocht tot mei 2014); 2de ronde: exclusie |
Vergelijking tussen medicaties (geen placebo) en geen duur van behandeling |
|
45 |
Van der Hulle, 2014 |
Inclusie (systematisch gezocht tot oktober 2013); 2de ronde: exclusie |
Vergelijking van medicatie en niet duur van behandeling |
|
46 |
Van Es, 2014 |
Twijfel, mogelijk een beschrijvende review; 2de ronde: exclusie |
Niet systematisch gezocht |
|
53 |
Yang, 2014 |
Exclusie |
Switchen naar een ander middel |
|
62 |
Becattini, 2013 |
Inclusie; 2de ronde: exclusie |
Geïncludeerde trials worden ook meegenomen in artikel door Wu, 2015 |
|
67 |
Castellucci, 2013 |
Inclusie (systematisch gezocht tot ongeveer mei 2013); 2de ronde: inclusie: 3de ronde: exclusie |
Alle relevante geïncludeerde artikelen zijn ook meegenomen in Wu, 2015 en OR berekend ipv RR |
|
99 |
Tan, 2013 |
Exclusie |
Alleen gekeken naar eerste drie maanden behandeling in patiënten met UEDVT |
|
104 |
Adam, 2012 |
Exclusie |
DOACs vergeleken met warfarine |
|
118 |
Janakiram, 2012 |
Exclusie |
Voorspellende waarde van RVO |
|
120 |
Les, 2012 |
Twijfel, mogelijk niet systematisch gezocht; 2de ronde: exclusie |
Niet systematisch gezocht en focus op APS patiënten |
|
135 |
Boutitie, 2011 |
Inclusie; 2de ronde |
Niet systematisch gezocht |
|
165 |
Baglin, 2010 |
Exclusie |
Niet gekeken naar duur van behandeling |
|
169 |
Carrier, 2010 |
Inclusie (systematisch gezocht tot september 2008); 2de ronde: inclusie; 3de ronde: exclusie |
Gaat om initiële behandeling direct na VTE event |
|
177 |
Douketis, 2010 |
Exclusie |
Usefulness of D-dimer testing |
|
RCT |
|
|
|
|
394 |
Becattini, 2012 |
Exclusie |
Trial al geïncludeerd in systematische review |
|
410 |
Di, 2012 |
Exclusie |
Patiënten met thromboflebitis |
|
498 |
Hamadah, 2011 |
Exclusie |
Baseline imaging versus geen baseline imaging |
Trials geïncludeerd in review van Wu en Middeldorp en toevoeging van studieselectie gepubliceerd na september 2014
|
Nummer in search |
Auteur, jaartal |
Inclusie/Exclusie |
Reden van exclusie |
|
Trials gepubliceerd na sept 2014 |
|||
|
238 |
Khan, 2015 |
Exclusie |
Cohort studie |
|
239 |
Prins, 2015 |
Exclusie |
Uitkomst: patiënt satisfaction |
|
240 |
Yinon, 2015 |
Exclusie |
Populatie: zwangere vrouwen en uitkomst: niveau van bloedwaarde |
|
241 |
Zahir, 2015 |
Exclusie |
Reversal v. ? |
|
242 |
Onbekend, 2014 |
Exclusie |
Populatie: patiënten met acute coronair syndroom |
|
243 |
Ageno, 2014 |
Exclusie |
Populatie: Patiënten met trombose in de milt & niet systematisch gezocht |
|
244 |
Ageno, 2014 |
Exclusie |
Studie protocol |
|
245 |
Amin, 2014 |
Exclusie |
Kosten analyse |
|
246 |
Amin, 2014 |
Exclusie |
Kosten analyse |
|
247 |
Asrar, 2014 |
Exclusie |
Populatie: Patiënten met ateriele trombose |
|
248 |
Bergmeijer, 2014 |
Exclusie |
Studie protocol |
|
249 |
Bonaca, 2014 |
Exclusie |
Uitkomst: stent trombose |
|
250 |
Bounameaux, 2014 |
Exclusie |
Populatie: Patiënten met atrium fibrilleren |
|
Trials geïncludeerd door Wu |
|||
|
|
EINSTEIN, 2010 |
Exclusie |
Twee opties van duur van behandeling binnen één arm |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-11-2021
Beoordeeld op geldigheid : 15-11-2021
Belangrijkste wijzigingenten opzichte van de vorige versie:
De modules over beleid bij bloedingen bij VKA en TARS zijn gewijzigd, evenals de modules over oppervlakkige tromboflebitis en het continueren van antistolling na een acute veneuze tromboembolie. De module over antifosfolipiden syndroom en antistolling is een nieuwe module.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule. Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met stollingsproblemen.
Kerngroep
- Prof. dr. M.V. (Menno) Huisman, internist-vasculaire geneeskunde, LUMC, NIV (voorzitter)
- Dr. M.J.H.A. (Marieke) Kruip, internist-hematoloog, ErasmusMC, NIV, NVvH (Hematologie)
- Dr. F.A. (Erik) Klok, internist-vasculaire geneeskunde, LUMC, NIV
- Dr. M.A. (Marc) Brouwer, cardioloog, RadboudUMC, NVVC
- Dr. H.B. (Harmen) Ettema, orthopedisch chirurg, Isala, NOV
- Drs. B. (Banne) Nemeth, aios orthopedie, LUMC, NOV
- Dr. A.M. (Arno) Wiersema, vaatchirurg, NVVH
- Dr. M.E. (Maarten) Tushuizen, maag-darm-leverarts, LUMC, NVMDL
- Dr. J.M. (Jonathan) Coutinho, neuroloog, AMC-UVA, NVN
- Drs. A. (Andrew) Oostindjer, huisarts/Kaderhuisarts HVZ, NHG
Klankbordgroep
- Dr. J.J.C.M. (Sjef) van de Leur, arts klinische chemie, Isala, NVKC
- Dr. A.W.M.M. (Ankie) Koopman - van Gemert, anesthesioloog, ASZ, NVA
- Dr. M.G. (Mariëlle) van Pampus, gynaecoloog, OLVG, NVOG
- Drs. R.J. (Repke) Snijder, longarts, Antoniusziekenhuis, NVALT
- Drs. R.J. (Rutger) Lely, radioloog, VUMC, NVVR
- Dr. C. (Bibi) van Montfrans, dermatoloog, ErasmusMC, NVDV
- Dr. R.A. (Richard) Faaij, klinisch geriater, Diakonessenhuis, NVKG
- Dr. B. (Bauke) van Minnen, kaakchirurg, UMCG, NVMKA
- Drs. A (Annemarie) Auwerda, beleidsadviseur, Harteraad
- Prof. dr. S (Saskia) Middeldorp, internist vasculaire-geneeskunde, Radboudumc, NIV
- M.J. (Jacqueline) Krol- van Straaten, internist - nefroloog, Hagaziekenhuis, NIV
- Dr. L. Jakulj, internist-nefroloog, Amsterdam UMC, NIV
- Dr. M. (Marcel) Schouten, internist - nefroloog, Tergooi, NIV
- Dr. N. (Nakisa) Khorsand, ziekenhuisapotheker, OLVG, NVZA
- Dr. M.F. (Margreet) Warlé-van Herwaarden, openbaar apotheker, KNMP
Met ondersteuning van
- Dr. S.R. (Sabine) Zwakenberg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- H. (Hanneke) Olthuis, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Kerngroep
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
prof. dr. M.V. (Menno) Huisman |
Internist vasculaire geneeskunde Leids Universitair Medisch Centrum |
- Voorzitter commissie herziening Antitrombotisch Beleid, onbetaald |
- Adviseur farmaceutische bedrijven die (nieuwe) antistollingsmiddelen maken (gelden gaan naar afdeling Interne Geneeskunde LUMC) - ZONMW grant Dutch-AF - registry met onderzoek op het gebied van antistolling bij patiënten met atriumfibrilleren (gelden gaan naar afdeling Interne Geneeskunde LUMC) - Research grants van farmaceutische bedrijven die (nieuwe) antistollingsmiddelen make; (gelden gaan naar afdeling Interne Geneeskunde LUMC) |
Deelname in werkgroep als voorzitter in verband met expertise op dit gebied. In verband met adviseur farmaceutische bedrijven: participeert niet bij besluitvorming middelen |
|
dr. M.J.H.A. (Marieke) Kruip |
Internist-hematoloog Erasmus MC |
Medisch leider trombosedienst Star-SHL, gedetacheerd vanuit het Erasmus MC |
- Anti-thrombotic stewardship S-team introduction (2015-2016) Boehringer-Ingelheim - 2016: Symposium over Richtlijn antitrombotisch beleid, internistendagen en bijscholing / Bayer / € 1169,- + € 129,-, € 224,- ten gunste van de afdeling hematologie |
In verband met belangen geen participatie besluitvorming keuze middelen |
|
dr. F.A. (Erik) Klok |
Internist Vasculair geneeskundige, LUMC, Leiden |
Adjunct Professor Universiteit van Mainz, Duitsland (onbetaald) |
Dr. F.A. Klok heeft financiële steun ontvangen voor studies (unrestricted research grants) van Bayer, BMS/Pfizer, Boehringer Ingelheim, Daiichi Sankyo, MSD, Actelion, Trombose Stichting Nederland, de Hartstichting en ZonMW. Dit betroffen allen studies naar diagnostiek van longembolie/DVT of voorkomen van lange termijn effecten (pulmonale hypertensie, lagere kwaliteit van leven et cetera). |
Geen, gesponsorde studies gaan over diagnostiek. Diagnostiek komt vooralsnog niet aan bod in deze richtlijn. Mocht dit het geval zijn belangen opnieuw bespreken. Geen actie nodig |
|
dr. M.A. (Marc) Brouwer |
Cardioloog, Radboudumc |
- Afgevaardigde van de NVVO bij LSKA (onbetaald) |
De researchafdeling cardiologie heeft voor verschillende projecten financiële ondersteuning ontvangen van: Astra Zeneca, BMS-Pfizer, Boehringer Ingelheim, Beyer, Daiichi Sankyo - Dutch AF registry |
Geen, ander onderwerp |
|
dr. H.B. (Harmen) Ettema |
Orthopedisch chirurg Isala Klinieken, Zwolle |
|
In verleden deelname verschillende RCT waarvan de laatste > 3 jaar gelden |
RCT's >3 jaar geleden, geen actie |
|
drs. B. (Banne) Nemeth |
AIOS Orthopedie LUMC Leiden PhD Klinische Epidemiologie en Orthopedie, LUMC Leiden |
|
|
geen |
|
dr. A.M. (Arno) Wiersema |
Vaatchirurg in het Westfriesgasthuis te Hoorn en AUMC, locatie Vumc |
Grant onderzoek ACT en heparine arteriële vaatingrepen Medtronic, geen onderwerp van deze richtlijn |
Grant onderzoek ACT en heparine arteriële vaatingrepen Medtronic, geen onderwerp van deze richtlijn |
geen |
|
dr. M.E. (Maarten) Tushuizen |
MDL-arts, staflid Leids Universitair Medisch Centrum, Leiden |
MDL-arts; DC-kliniek Almere, Almere, verrichten van endoscopie (betaald) |
|
geen |
|
dr. J.M. (Jonathan) Coutinho |
Neuroloog Amsterdam UMC |
|
RESPECT-CVT studie. Gefinancierd door Boehringer. Ondergetekende zit in het steering Committee van deze studie |
geen actie, studie gaat over andere patiëntpopulatie |
|
A. (Andrew) Oostindjer |
Huisarts - eigen praktijk in Oldenzaal. |
Als Kaderhuisarts HVZ: Consulent voor Pfizer - beoordelen van informatie materiaal bedoeld voor patiënten en medici. |
Momenteel wel lid van de antistollingscommissie van het Medisch Spectrum Twente (onbetaald) |
geen |
|
Klankbordgroep |
||||
|
dr. J.J.C.M. (Sjef) van de Leur |
Arts klinische chemie, Isala |
Bestuurslid FNT, onbetaald |
|
Geen |
|
dr. A.W.M.M. (Ankie) Koopman - van Gemert |
Anesthesioloog, opleider Albert Schweitzer ziekenhuis (pensioen 1-7-2019) 1-11-2019 – 1-2-2021 MM IC en VZ intensivisten ZGT Almelo |
- participatie richtlijnen: neuraxisblokkade, bloedtransfusie, ESA (vacatiegelden) tot 1-7-2019 - bestuur TRIP en vz hemovigilantiekamer (onbetaald) tot oktober - gebruikersgroep sanquin (onbetaald) – idem - VZ examencie NVA en ESA tot 1-1-2020
|
|
Geen |
|
dr. M.G. (Mariëlle) van Pampus |
Gynaecoloog OLVG |
|
|
Geen |
|
drs. R.J. (Repke) Snijder |
Longarts st. Antonius Ziekenhuis Nieuwegein |
|
|
Geen |
|
drs. R.J. (Rutger) Lely |
(Interventie)radioloog AUMC, locatie Vumc |
|
|
Geen |
|
dr. C. (Bibi) van Montfrans |
Dermatoloog Erasmus MC |
- Lid board European academy of dermatology and venereology (EADV) (onbetaald) |
|
Geen |
|
dr. R.A. (Richard) Faaij |
Klinisch geriater Diakonessenhuis Utrecht-Zeist-Doorn |
|
|
Geen |
|
dr. B. (Bauke) van Minnen |
Kaakchirurg UMCG |
|
|
Geen |
|
mw. A (Annemarie) Auwerda |
Beleidsadviseur, Harteraad |
|
|
Geen |
|
prof. dr. S (Saskia) Middeldorp |
Internist-vasculair geneeskundige, Radboudumc |
Onbetaald: NVTH-voorzitter, Stichting Haemophilia-bestuurslid, Stichting Amstol - bestuurslid Betaald: Diverse honoraria naar AMR Medical Research B.V. Bedrijven: Aspen - Bayer - BMS/Pfizer - Boehringer Ingelhei - Daiichi Sankyo - GKS - Portola - Sanquin -Sanofi. Voor lezingen/onderwijs |
Research support, wordt betaald aan AMC Medical Research B.V. Bedrijven: Aspen - Bayer - BMS/Pfizer - Boehringer lngelheim - Daiichi Sankyo - GSK - Portola - Sanquin - Highlow studie, GSK, overgenomen door Aspen, financiering voor investigator initiated trial, wordt gestort op AMC Medical Research B.V - Sanquin, financiering voor vrijwilligersstudie naar reversal van NOACs in gezonde vrijwilligers, wordt gestort op AMR Medical Research BV - BMS/Pfizer, financiering voor vrijwilligersstudie naar reversal van NOACs in gezonde vrijwillers, wrodt gestort op AMR Medical Research BV - Daiichi Sankyo, financiering voor investigator initiated study naar lange termijn gevolgen van VTE |
Participeert niet bij besluitvorming omtrent middelen. In rol van klankbordgroeplid is hier echter ook geen sprake van. Participatie wegens expertise. Openheid over deze belangen is voldoende. |
|
M.J. (Jacqueline) Krol- van Straaten |
Internist - Nefroloog Haga ziekenhuis, Den Haag |
Lid werkgroep KNMP Geneesmiddelen en Dialyse. Reis- en onkosten vergoeding (1-4x per jaar) Richtlijncommissie Nederlandse Federatie voor Nefrologie - betaald (vacatiegelden) |
|
Geen |
|
dr. M. (Marcel) Schouten |
Internist-nefroloog Tergooi |
Richtlijncommissie Nederlandse Federatie voor Nefrologie - betaald (vacatiegelden) |
|
Geen |
|
dr. N. (Nakisa) Khorsand |
Ziekenhuisapotheker, OLVG, Amsterdam |
Voorzitter special interest group hematologie van NVZA (onbetaald) |
|
Geen |
|
dr. M.F. (Margreet) Warlé- van Herwaarden |
Apotheker, Apotheek Groesbeek |
participeert af en toe in onderzoek (onbetaald) |
|
Geen |
|
Dr. L. Jakulj |
Internist-nefroloog Stichting Dianet Internist-nefroloog Amsterdam UMC locatie AMC” |
Lid richtlijnencommissie Nederlandse Federatie voor Nefrologie (onbetaald) |
|
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde patiëntenvereniging in de klankbordgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten middels een enquête. Naast de in de kern- en klankbordgroep vertegenwoordigde partijen werden de FNT, IGJ, KiMO, NHG, NFU, NVZ, STZ, V&VN, Verenso, VIG, VWS, ZiNL en ZN uitgenodigd deze enquête in te vullen.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
UitgangsvraagL Hoelang dient antistollingsbehandeling na een VTE te worden gecontinueerd? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 21-1-2020 |
|
Periode: 2015- |
Talen: Engels, Nederlands |
|
Toelichting:
De zoekstrategie van 2015 is volledig overgenomen voor de update van deze module. Het sleutelartikel werd gevonden.
Met vriendelijke groet, Ingeborg van Dusseldorp |
|
|
|
Inclusief dubbele referenties |
Ontdubbeld |
|
SR |
383 |
271 |
|
RCT |
860 |
455 |
Embase
|
No. |
Query |
Results |
|
#9 |
#5 AND #7 |
524 |
|
#8 |
#5 AND #6 |
182 |
|
#7 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2339215 |
|
#6 |
('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
473415 |
|
#5 |
#4 AND (1-1-2015)/sd NOT ('conference abstract'/it OR 'conference paper'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1369 |
|
#4 |
#1 AND #2 AND #3 |
7808 |
|
#3 |
('secondary prevention'/exp/mj OR 'recurrent disease'/exp/mj OR (((secondary OR secundary OR 'long term' OR 'follow up' OR recurren*) NEAR/3 (prevention OR treatment)):ab,ti) OR recurren*:ab,ti) AND ((dutch)/lim OR (english)/lim) AND (embase)/lim |
736653 |
|
#2 |
'anticoagulant agent'/mj OR 'blood clotting inhibitor'/mj OR 'low molecular weight heparin'/exp/mj OR 'low-molecular-weight heparin':ab,ti OR lmwh*:ab,ti OR dalteparin*:ab,ti OR enoxaparin*:ab,ti OR nadroparin*:ab,ti OR tinzaparin*:ab,ti OR pentasacharide*:ab,ti OR 'acetylsalicylic acid'/mj OR aspirin*:ab,ti OR 'acetylsalicylic acid':ab,ti OR rivaroxaban*:ab,ti OR dabigatran*:ab,ti OR apixaban*:ab,ti OR edoxaban*:ab,ti OR 'new oral anticoagulant':ab,ti OR 'new oral anticoagulants':ab,ti OR noac*:ab,ti OR 'novel oral anticoagulant':ab,ti OR 'novel oral anticoagulants':ab,ti OR 'blood clotting factor 10a inhibitor'/exp/mj OR 'vitamin k antagonists' OR 'anticoagulant agent'/exp/mj OR warfarin*:ab,ti OR coumarin*:ab,ti OR vka:ab,ti OR 'vitamin k antagonist':ab,ti OR 'vitamin k antagonists':ab,ti |
343325 |
|
#1 |
'thromboembolism':ab,ti OR ((venous NEAR/1 'thrombo embolism'):ab,ti) OR vte:ab,ti OR 'deep vein thrombosis':ab,ti OR dvt:ab,ti OR 'thrombo-embolic':ab,ti OR thromboembolic:ab,ti OR thromboembolism:ab,ti OR thromboembolism*:ab,ti OR 'pulmonary embolism':ab,ti OR 'blood clot':ab,ti OR 'blood coagulation':ab,ti OR 'thromboembolism'/exp/mj OR 'thromboembolism' |
346473 |
Ovid/Medline
1 "Venous thromboembolism".ti,ab,kw. (20125)
2 ("venous thrombo-embolism" or VTE).ti,ab,kw. (10496)
3 "deep vein thrombosis".ti,ab,kw. or exp Venous Thrombosis/ (61342)
4 DVT.ti,ab,kw. (9964)
5 ("thrombo-embolic" or thromboembolic).ti,ab,kw. (28418)
6 exp VENOUS THROMBOEMBOLISM/ or exp THROMBOEMBOLISM/ (55091)
7 "pulmonary embolism".ti,ab,kw. or exp Pulmonary Embolism/ (51352)
8 ("blood clot*" or "blood coagulation").ti,ab,kw. or exp Blood Coagulation/ (72529)
9 (thromboembolism or thromboembolism*).ti,ab,kw. (37278)
10 or/1-9 (234973)
11 "Anticoagulants"/ (73812)
12 exp heparin, low-molecular-weight/ or dalteparin/ or enoxaparin/ or nadroparin/ (12245)
13 ("low-molecular-weight heparin*" or LMWH* or dalteparin* or enoxaparin* or nadroparin* or tinzaparin* or pentasacharide*).ti,ab. (15654)
14 Aspirin/ or (aspirin* or "ACETYLSALICYLIC ACID*").ti,ab. (69456)
15 "Vitamin K"/ai or VKA.ti,ab. or "vitamin K".ti,ab. or (Coumarin* or 4-hydroxycoumarin* or warfarin*).ti,ab. or exp Coumarins/ or Warfarin/ (77362)
16 "Factor Xa"/ai (Antagonists & Inhibitors) (0)
17 Rivaroxaban*.ti,ab. (4587)
18 Dabigatran*.ti,ab. (4407)
19 Apixaban*.ti,ab. (2861)
20 Edoxaban*.ti,ab. (1205)
21 ("New Oral Anticoagulant*" or "Novel Oral Anticoagulant*" or NOAC*).ti,ab. (3851)
22 or/11-21 (201754)
23 10 and 22 (43927)
24 limit 23 to (yr="2015 -Current" and (dutch or english)) (9578)
25 11 or 14 or 15 or 16 or 17 or 18 or 19 or 20 or 21 (194684)
26 10 and 25 (40641)
27 limit 26 to (yr="2015 -Current" and (dutch or english)) (8991)
28 (Recurren* or "major bleeding" or mortality or QOL or PTS).ti,ab. (1269621)
29 Secondary Prevention/ (19827)
30 Recurrence/ (180042)
31 ((secondary or secundary or long-term or follow-up or recurren*) adj3 (prevention or treatment)).ti,ab. (123253)
32 recurren*.ti,ab. (532269)
33 29 or 30 or 31 or 32 (721071)
34 27 and 33 (1444)
35 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (429009)
36 (randomized controlled trial/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or randomized controlled trial.pt. or random*.ti,ab.) not (animals/ not humans/) (1205815)
37 34 and 35 (200)
38 34 and 36 (336)
39 from 37 keep 1-200 (200)
40 from 38 keep 1-336 (336)

