Lichte sedatie op de IC
Uitgangsvraag
Wat is de waarde van een licht sedatieniveau ten opzichte van een dieper sedatieniveau of geen sedatie bij patiënten op de IC?
Aanbeveling
Aanbeveling-1
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het toepassen van geen sedatie bij de comfortabele patiënt, of lichte sedatie om comfort te bereiken, geeft een verminderde beademingsduur en draagt daarmee bij aan een betere outcome vergeleken met diepe sedatie. De werkgroep is van mening dat dit voor de patiënten zonder contra-indicatie voor lichte/geen sedatie standaard beleid zou moeten zijn. Comfortabel wakker zijn geeft de patiënt daarnaast de kans een actieve bijdrage te leveren aan het eigen herstel. In deze richtlijn is gekozen voor da afkapwaarde RASS +1 tot -2. Deze afkapwaarden komen overeen met de internationale literatuur en wordt ook gebruikt in de internationale PADIS guidelines. RASS +1 tot -2 betekent van rusteloos maar niet geagiteerd tot gesedeerd maar wel wekbaar. Een rusteloze patiënt kan soms angstig zijn. Angst is onwenselijk. De oorzaken van angst zullen verkend en behandeld moeten worden.
Pas bij voorkeur lichte sedatie of geen sedatie (RASS +1 tot -2) toe bij patiënten op de IC.
Overweeg diepe(re) sedatie bijvoorbeeld bij patiënten:
- met verhoogde intracraniële druk
- met spierverslapping
- in buikligging
- met multitrauma
Aanbeveling-2
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
Wanneer er wel gebruik gemaakt moet worden van diepere sedatie, zal dit sedatieniveau dagelijks geëvalueerd moeten worden en zodra mogelijk bijgesteld naar een licht sedatieniveau of geen sedatie.
Evalueer dagelijks de indicatie wanneer diepe sedatie wordt toegepast en titreer dagelijks de sedatie naar het lichtst mogelijk sedatieniveau.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Gekeken naar de conclusies met betrekking tot de cruciale uitkomstmaat ventilatieduur, was er sprake van een klinisch relevant effect in het voordeel van lichte sedatie. Voor de cruciale uitkomstmaten mortaliteit en delirium was er geen sprake van een klinisch relevant effect van lichte sedatie in vergelijking met diepe sedatie. De bewijskracht voor deze conclusie was matig tot laag vanwege het klein aantal studies en de beperkingen in de studieopzet. Dit maakt de overall bewijskracht laag, waardoor er op basis van de cruciale uitkomstmaten kan wordt geconcludeerd dat lichte sedatie waarschijnlijk wenselijker is in vergelijking met diepe sedatie. Voor de belangrijke uitkomstmaten beademingsduur en complicaties waren geen data beschikbaar. Vanwege de zeer beperkt beschikbare data (een kleine single center studie) betreffende de belangrijke uitkomstmaat, lange termijn uitkomst PICS, kunnen hier geen uitspraak over gedaan worden. De bewijskracht van de gevonden belangrijke uitkomstmaten is laag vanwege beperkingen in de studieopzet, heterogeniteit en het beperkte aantal studies en/of patiënten waarvoor data beschikbaar was.
Er is grote praktijkvariatie in het toedienen van sedatie op de IC. Dat geldt zowel voor de gebruikte middelen als voor het gewenste sedatieniveau. Waarschijnlijk mede doordat een eenduidige definitie van licht sedatieniveau ontbreekt, zijn er interpretatieverschillen. Verder is er ook geen eenduidigheid in de duur van het gewenste sedatieniveau: soms wordt continue sedatie toegepast, tegenwoordig meestal in combinatie met een (dagelijks) sedatiepauze-moment (sedatiefreeze of sedatiestop). Hierbij wordt bij een lagere dan gewenste RASS-score de sedatie gehalveerd om binnen korte tijd de gewenste sedatiediepte (RASS-score) te bereiken. Als dit niet binnen de gestelde tijd gebeurt, wordt de sedatie volledig gestaakt. In andere situaties wordt een dagelijks spontaan wakker worden test (spontaneous awakening trial, SAT) toegepast: alle sedatie wordt gestaakt om te kijken of de wakkere patiënt nog enige vorm van sedatie nodig heeft. Vaak gebeurt dit in combinatie met een spontaan ademen test (spontaneous breathing trial, SBT), een test om te kijken of de patiënt zelfstandig kan ademen, eventueel met ondersteuning, in plaats van volledig de beademing door de machine overgenomen te houden. Al deze acties (bepalen sedatieniveau, sedatiefreeze en SAT) zijn er op gericht de hoeveelheid en duur van sedatie te beperken en de tijd van ondersteuning te verkorten, wat in overeenstemming is met de andere (wereld)richtlijnen en -literatuur.
In onze methode wordt enig voordeel (en geen nadeel) van het toepassen van lichte sedatie gevonden. Derhalve adviseert deze richtlijn een licht sedatieniveau. De rationale hierachter is dat we weten dat een patiënt spiermassa verliest met elke dag dat hij niet spontaan ademt (Levine, 2008). We weten ook dat een aantal voor sedatie gebruikte medicamenten een nadelige lange-termijn effect kunnen hebben. Het voorkomen van dat risico is wanneer mogelijk te prefereren, mede omdat het meest aannemelijke is dat lichte sedatie eerder bijdraagt tot minder spierverlies dan diepe sedatie (subsidiariteitsbeginsel). Deze aanbeveling is niet in zelfde mate toepasbaar op de kortdurende sedatie van postoperatieve patiënten.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voorkeuren van patiënten ten aanzien van het eigen sedatieniveau zijn niet makkelijk te geven. Wel zouden familieleden een voorkeur kunnen hebben voor lichte sedatie in het kader van mogelijkheden tot communicatie. Het comfort van de patiënt moet hierbij de eerste prioriteit hebben. Wellicht zou er bij gebrekkige informatie vanuit de zorgverleners over dit doel, vanuit familie voorkeur voor diepere sedatie kunnen zijn, met de argumentatie dat een patiënt die niet reageert op welke prikkel dan ook minder risico heeft om te lijden tijdens de behandeling. Het is zeer de vraag of familie voldoende zicht heeft op de risico’s ten gevolge van een langere beademingsduur door diepere sedatieniveaus. Uitleg door zorgverleners over de sedatiedoelen is hierin essentieel. In de gevonden studies is niet gekeken naar ervaring van patiënten en familieleden zelf. Hier is dus sprake van een kennislacune.
Minder of niet gesedeerde en dus wakkerdere patiënten kunnen niet alleen actiever meewerken in hun revalidatie, maar ook beter aangeven of er problemen zijn in pijnbestrijding, angst/stress management en slaappatroon, waardoor ze betere sturing krijgen over en een actieve bijdrage kunnen leveren aan hun eigen behandeling.
Kosten (middelenbeslag)
In het kader van kosteneffectiviteit heeft een behandeling met dezelfde mortaliteit en morbiditeit maar een kortere totale behandelduur de voorkeur. Het nastreven van lichte sedatie bij adequate pijnbestrijding betekent in concreet dus minder gebruik sedativa dus zal per definitie voor wat geneesmiddelen betreft goedkoper zijn. Daarnaast zijn er duidelijk aanwijzingen dat lichte sedatie leidt tot een kortere beademingsduur en als gevolg hiervan een kortere IC-opnameduur. Dit is wenselijk voor zowel de individuele patiënt, maar zeker ook in het licht van schaarste in beschikbare totale IC-capaciteit in Nederland. In het kader van kortere beademingsduur met daarmee kortere totale IC-opnameduur heeft lichte sedatie daarmee de voorkeur. De toepassing van lichte sedatie en vooral het dagelijks stoppen van sedatie, de sedatiefreeze, kan nog wel betekenen dat het personeel hiervoor extra getraind/geschoold moet worden. Dit zijn echter eenmalige extra kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Uitgaande van een lager sedatieniveau kan het nodig zijn om meer monitoring (bijvoorbeeld door camerabewaking) toe te passen om te signaleren wanneer een dieper sedatieniveau gewenst is, bijvoorbeeld bij dreigende autodetubatie of andere ongewenste/ongeplande mobilisatiepogingen. Ook andere dan medicamenteuze angst reducerende maatregelen (rooming-in, directe aanwezigheid zorgpersoneel) zouden bijdragend kunnen zijn. Mits de toepassing van lichte sedatie nog niet is doorgevoerd op een IC, kan dit betekenen dat hier wel een cultuurverandering voor nodig is. Wat maakt dat er een goed implementatie plan (met barriers en facilitator analyse) aan ten grondslag moet liggen wil deze werkwijze goed ‘ingeburgerd’ en doorgevoerd zijn.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het toepassen van geen sedatie bij de comfortabele patiënt, of lichte sedatie om comfort te bereiken, geeft een verminderde beademingsduur en draagt daarmee bij aan een betere outcome vergeleken met diepe sedatie. De werkgroep is van mening dat dit voor de patiënten zonder contra-indicatie voor lichte/geen sedatie standaard beleid zou moeten zijn. Comfortabel wakker zijn geeft de patiënt daarnaast de kans een actieve bijdrage te leveren aan het eigen herstel.
Wanneer er wel gebruik gemaakt moet worden van diepere sedatie, zal dit sedatieniveau dagelijks geëvalueerd moeten worden en zodra mogelijk bijgesteld naar een licht sedatieniveau of geen sedatie.
Onderbouwing
Achtergrond
Naast pijnstilling wordt op de intensive care (IC) bij patiënten regelmatig sedatie toegepast om een tijdelijke periode van instabiliteit (hemodynamisch en/of respiratoir en/of cerebraal) te overbruggen. Echter, in toenemende mate wordt de aanbeveling gegeven om deze periode van sedatie zo kort mogelijk te houden omdat sedativa negatieve effecten kunnen hebben op het herstel zoals: immobiliteit, delier, verlengde beademingsduur en opnameduur IC en daarnaast mogelijk ook is geassocieerd met nadelige effecten op de lange termijn. Belangrijk uitgangspunt is dat de patiënt zo pijnvrij mogelijk dient te zijn alvorens gestart wordt met toediening van sedativa. Deze sedatie moet volgens de meest recente inzichten dan vooral zo kort mogelijk zijn, en zo laag mogelijk gedoseerd waarbij doel is dat het sedatieniveau zodanig is dat de patiënt snel en makkelijk wekbaar is. Om dit te meten/vast te stellen gebruikt men een gevalideerde sedatieschaal zoals de Richmond Agitation and Sedation Scale (RASS) en streeft ernaar om een acceptabel niveau te bereiken (RASS score van +1 tot -2).
Conclusies
- Mortality (crucial)
|
Moderate GRADE |
Light sedation may result in little to no difference in mortality when compared with deep sedation in patients at the ICU.
Sources: Girard, 2010; Ruokonen, 2009; Treggiari, 2009; Shehabi, 2013 |
- Delirium (crucial)
|
Low GRADE |
Light sedation may result in little to no difference in delirium when compared with deep sedation in patients at the ICU.
Sources: Girard, 2008; Shehabi, 2013 |
- Duration of mechanical ventilation (crucial)
|
Low GRADE |
Light sedation may reduce duration of mechanical ventilation when compared with deep sedation in patients at the ICU.
Sources: Ruokonen, 2009; Shehabi, 2013; Treggiari, 2009. |
- Length of sedation duration (important)
|
No GRADE |
No evidence was found regarding the effect of light sedation on length of sedation duration when compared with deep in patients at the ICU.
Sources: - |
- Complications (important)
|
No GRADE |
No evidence was found regarding the effect of light sedation on complications when compared with deep in patients at the ICU. Sources: - |
- PICS (important)
|
Very low GRADE |
The evidence is very uncertain about the effect of light sedation on mental domain of PICS when compared with deep in patient at the ICU. No evidence was found regarding the physical and cognitive domains since this was not reported.
Sources:; Treggiari, 2009. |
Samenvatting literatuur
Description of studies
Porhomayon (2015) performed a systematic review and meta-analysis about the impact of deep sedation (defined as no response to voice, movement or eye opening with physical stimulation or unarousable) versus light sedation (defined as not fully alert, but sustained awakening to voice with possibility of restlessness or agitation) on cognitive dysfunction in ICU patients. Included studies were published between 1966 and March 2013, and were included in this review if they were original articles; the sample size was five or more; included adults; evaluated sedation by accepted standard scoring systems; evaluated PTSD/anxiety/stress depression/delirium by a validated standard method. Studies were excluded if the evaluated found place after ICU discharge; sedation scores were not reported; injury of the central nervous system was involved; patients had pre-existing psychological disorders/alcohol abuse/PTSD/depression/anxiety disorders. In total, 10 RCTs and one retrospective study were included in the review. To answer our clinical question and based on our selection criteria, we selected three RCTs for our meta-analysis (Girard, 2010; Ruokonen, 2009; Treggiari, 2009). The total sample comprised 145 patients at the medical ICU, the mixed ICU or the post anaesthesia care unit. The effects were evaluated on mortality, delirium, and PICS (assessed by posttraumatic stress disorder, anxiety or depression).
Shehabi (2013) performed a pilot study about the effect of goal-directed sedation in mechanically ventilated critically ill patients. A total of 37 patients (mean age 54.4y; 56% female) were randomly allocated to two groups. Patients in the intervention group (n=21) received dexmedetomidine, targeted to light sedation (RASS -2 to 1), and patients in the control group (n=16) received propofol and/or midazolam, targeted to clinically appropriate (most patients RASS ≤ -3). The effects were evaluated on mortality (at 90 days) and length of ICU stay.
|
Study |
Population |
Intervention |
Control |
Outcome |
|
|
Syst. Review: Porhomayon, 2015 |
|
|
|
|
|
|
Girard, 2010 |
N=366 Age 62y Multicentre ICU |
Daily spontaneous awakening trials in combination with spontaneous breathing trials. |
Sedation per usual care pus daily spontaneous breathing trials. |
28-day mortality 1-year mortality Delirium
|
|
|
Ruokonen, 2009 |
N=85 Age 66y MICU |
Dexmedetomidine (RASS 0 to -3) |
Standard care (midazolam or propofol) RASS -4 |
1-year mortality Duration of MV. |
|
|
Treggiari, 2009 |
N=137 Age 61.4y Medical ICU |
Light sedation (Ramsay 1-2) |
Deep seep sedation (Ramsay 3-4) |
45-day mortality Delirium Duration of MV |
|
|
Other RCTs |
|
|
|
|
|
|
Shehabi, 2013 |
N=37 Age 63.1y Medical ICU |
Early goal-directed sedation targeted to light sedation (RASS -2 to 1) |
Standard sedation (propofol and/or midazolam as clinically appropriate) |
90-day mortality Length of ICU stay
|
|
|
Abbreviations: ICU, intensive care unit; PICS, post intensive care syndrome; MICU, Mobiele Intensive Care Unit; RASS, Richmond Agitation and Sedation Scale; MV, mechanical ventilation. |
|||||
Results
- Mortality (crucial)
Mortality was described in four RCTs (Girard, 2010; Ruokonen, 2009; Treggiari, 2009; Shehabi, 2013), comprising 569 patients. Girard (2010) and Jackson (2014) assessed mortality after 1-year follow-up, while Ruokonen (2009), Treggiari (2009) and Shehabi (2013) assessed mortality after 45 days, four weeks and 90 days respectively. Data resulted in a Risk Ratio (RR) of 1.03 (95% Confidence Interval (CI) 0.66 to 1.59) in favour of deep sedation. This difference was just not clinically relevant. Results are shown in Figure 1.
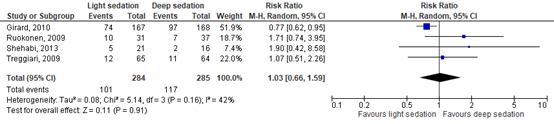
Figure 1. Forest plot comparing the effect of light sedation versus deep sedation on mortality.
The level of evidence in the literature
The level of evidence regarding the outcome mortality started at high as it was based on RCTs, but was downgraded by one level due to heterogeneity in follow-up periods (-1, risk of bias). The final level is moderate.
- Delirium (crucial)
Girard (2008) assessed the duration of delirium (n=335), from which data resulted in a duration of 2 days (0-5) in the intervention group, compared to 2 days (0-6) in the control group. Shehabi (2013) assessed incidence of delirium, resulting in an incidence of 8/21 (38%) in the intervention group, versus 6/16 (38) in the control group (RR of 1.02 (95% CI 0.44 to 2.34) in favour of the control group receiving deep sedation. These differences were not clinically relevant.
The level of evidence in the literature
The level of evidence regarding the outcome delirium started at high, because it was based on randomized controlled trials, but was downgraded by two levels due to lack of blinding (-1, risk of bias) and limited number of studies reporting on delirium incidence (-1, imprecision). The final level is low.
- Duration of mechanical ventilation (crucial)
Ruokonen (2009), Shehabi, 2013 and Treggiari (2009) assessed duration of mechanical ventilation (n=234).
Data of Ruokonen (2009) resulted a median duration of 77.2 hours (IQR 17.5 to 338.8) in the intervention group receiving dexmedetomidine for light sedation, compared to 110.6 hours (IQR 20.1-675) receiving standard care for deep sedation. For pooling, data was converted to mean (standard deviation) according to the method of Luo (2018) and Shi (2020). This resulted in a mean duration of 6.2 days (SD 10.2) in the intervention group and 11.4 days (SD 20.9) in the control group. This difference was clinically relevant in favour of the intervention group.
Data of Shehabi (2013) resulted in a mean duration of 3.3 days (SD 2.2) in the intervention group receiving ‘early goal directed sedation’ compared to 3.4 days (SD 2.3) in the control group receiving standard sedation. This difference was not clinically relevant.
Data of Treggiari (2009) resulted in a mean duration of 2.9 days (SD 5) in the intervention group receiving light sedation (Ramsay 1-2), compared to 5.5 days (SD 10.8) in the control group receiving deep sedation (Ramsay 3-4). This difference was clinically relevant in favour of the intervention group.
After pooling, data resulted in a MD of -1.39 days (95% CI -3.73 to 0.96) in favour of light sedation. This difference was clinically relevant. Results are shown in figure 2.
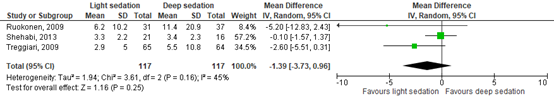
Figure 2. Forest plot comparing the effect of light sedation versus deep sedation on duration of mechanical ventilation.
The level of evidence in the literature
The level of evidence regarding the outcome duration of mechanical ventilation started at high because it was based on RCTs, but was downgraded by two levels due to study limitations (-1, risk of bias) and crossing the border of clinical relevance (-1, imprecision). The final level is low.
- Length of sedation duration (important)
Length of sedation duration was not described as an outcome in the included studies.
- Complications (important)
None of the pre-described complications were described as an outcome in the included studies.
- PICS (important)
Treggiari (2009) assessed the PICS by the mean scores of the Impact of Event Scale-Revised (IES-R) and the PTSD Symptom Checklist instruments (range 0-100, lower score means better outcome) four weeks after ICU discharge (mental domain of PICS). Data resulted in a mean score of 46 (SD 29) in the intervention group (Ramsay score 1-2) compared to 56 (SD 29) in the control group (Ramsay score 3.4). This difference was clinically relevant in favour of the intervention group. No data were reported regarding the physical and cognitive domains.
The level of evidence in the literature
The level of evidence regarding the outcome PICS started at high because it was based on RCTs, but was downgraded by three levels due to study limitations (-2, risk of bias) and low number of patients/events (-1, imprecision). The final level is very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)beneficial effects of light sedation compared to deep sedation or no sedation in adult ICU patients?
P: Adult ICU patients (awake and sedated);
I: Light sedation (RASS range +1 to -2);
C: No light sedation or deep sedation (RASS < -3);
O: Mortality, delirium, duration of mechanical ventilation, length of sedation duration, complications, post-intensive care syndrome (PICS).
Relevant outcome measures
The guideline development group considered mortality, delirium, and duration of mechanical ventilation as critical outcome measures for decision making; and length of sedation duration, complications, post-intensive care syndrome (PICS) important outcome measures for decision making.
The working group defined the outcome measures as follows:
- Mortality: The number of patients who died during IC/hospital stay;
- Delirium: The number of participants who were diagnosed with delirium during IC/hospital stay;
- Duration of mechanical ventilation: The number of days with mechanical ventilation;
- Length of sedation duration: Number of days/hours of required sedation during ICU stay;
- Complications: Ventilator associated pneumonia (VAP), deep venous thrombosis (DVT), critical illness polyneuropathy (CICPN), diaphragm atrophies;
- PICS: Long-term physical, mental and cognitive outcomes;
The working group defined the following differences as minimal clinically (patient) important differences:
- Mortality: A difference of 3%, based on the SDD-trial (Smet, 2009) (RR < 0.97, RR > 1.03)
- Delirium: A difference of 5% in delirium incidence (RR < 0.95, RR > 1.05).
- Duration of mechanical ventilation: A difference of one day.
- Length of sedation duration: A difference of one day.
- Complications: A difference of 10% in complications (RR <0.91, RR >1.1) for dichotomous outcome measures, or 10% of the scale for continuous outcome measures).
- PICS: A difference of 10% in long-term outcomes in the physical, mental and/or cognitive domain (RR <0.91, RR>1.1) for dichotomous outcome measures, or 10% of the scale for continuous outcome measures).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 1st of July 2021. The detailed search strategy is presented under the tab Methods. The systematic literature search resulted in 127 hits. Studies were selected based on the following criteria:
- Describing adult patients at the ICU (except from short sedated postoperative patients <24 hours).
- Patients in the intervention group were lightly sedated (RASS range +1 to -2).
- Study design: RCTs, systematic reviews and observational studies.
- Articles published in Dutch or English.
- Articles published between January 2001 and July 2021.
- Describing at least one of the outcome measures.
A total of seven studies were initially eligible based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included, one SR and one RCT.
Results
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Girard TD, Kress JP, Fuchs BD, Thomason JW, Schweickert WD, Pun BT, Taichman DB, Dunn JG, Pohlman AS, Kinniry PA, Jackson JC, Canonico AE, Light RW, Shintani AK, Thompson JL, Gordon SM, Hall JB, Dittus RS, Bernard GR, Ely EW. Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomised controlled trial. Lancet. 2008 Jan 12;371(9607):126-34. doi: 10.1016/S0140-6736(08)60105-1. PMID: 18191684.
- Levine S, Nguyen T, Taylor N, Friscia ME, Budak MT, Rothenberg P, Zhu J, Sachdeva R, Sonnad S, Kaiser LR, Rubinstein NA, Powers SK, Shrager JB. Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans. N Engl J Med. 2008 Mar 27;358(13):1327-35. doi: 10.1056/NEJMoa070447. PMID: 18367735.
- Luo D, Wan X, Liu J, Tong T. Optimally estimating the sample mean from the sample size, median, mid-range, and/or mid-quartile range. Stat Methods Med Res. 2018 Jun;27(6):1785-1805. doi: 10.1177/0962280216669183. Epub 2016 Sep 27. PMID: 27683581.
- Porhomayon J, Joude P, Adlparvar G, El-Solh AA, Nader ND. The Impact of High Versus Low
Sedation Dosing Strategy on Cognitive Dysfunction in Survivors of Intensive Care Units: A Systematic Review and Meta-Analysis. J Cardiovasc Thorac Res. 2015;7(2):43-8. doi: 10.15171/jcvtr.2015.10. PMID: 26191390; PMCID: PMC4492176. - Ruokonen E, Parviainen I, Jakob SM, Nunes S, Kaukonen M, Shepherd ST, Sarapohja T, Bratty JR, Takala J; "Dexmedetomidine for Continuous Sedation" Investigators. Dexmedetomidine versus propofol/midazolam for long-term sedation during mechanical ventilation. Intensive Care Med. 2009 Feb;35(2):282-90. doi: 10.1007/s00134-008-1296-0. Epub 2008 Sep 16. PMID: 18795253.
- Shehabi Y, Bellomo R, Reade MC, Bailey M, Bass F, Howe B, McArthur C, Murray L, Seppelt IM, Webb S, Weisbrodt L; Sedation Practice in Intensive Care Evaluation Study Investigators; Australian and New Zealand Intensive Care Society Clinical Trials Group. Early goal-directed sedation versus standard sedation in mechanically ventilated critically ill patients: a pilot study*. Crit Care Med. 2013 Aug;41(8):1983-91. doi: 10.1097/CCM.0b013e31828a437d. PMID: 23863230.
- Shi D, Luo D, Wan X, Liu Y, Liu J, Bian Z, Tong T; "Detecting the skewness of data from the sample size and the five-number summary". 2020. https://doi.org/10.48550/arXiv.2010.05749.
- Treggiari MM, Romand JA, Yanez ND, Deem SA, Goldberg J, Hudson L, Heidegger CP, Weiss NS. Randomized trial of light versus deep sedation on mental health after critical illness. Crit Care Med. 2009 Sep;37(9):2527-34. doi: 10.1097/CCM.0b013e3181a5689f. PMID: 19602975.
Evidence tabellen
Evidence table for systematic reviews of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Porhomayon, 2015 |
SR and meta-analysis of RCTs
Literature search up to March 2013
C: Girard, 2008 E: Ruokonen, 2009 G: Treggiari, 2009
Study design: RCT C: prospective E: prospective G: prospective
Setting and Country: C: MICU E: MICU/SICU G: Mix ICU
Source of funding and conflicts of interest: The authors declare that they have no conflict of interests. |
Inclusion criteria SR: (a) original article with a sample size of five or more participants, (b) adult population, (c) evaluation of sedation by accepted standard scoring system, and (d) evaluation of PTSD or anxiety/stress/depression and delirium by a validated standard method.
Exclusion criteria SR: Evaluation after discharge from ICU, sedation scores not reported, studies involving central nervous system injury/stroke/neuro-ICU/neuro-trauma ICUs, patients having preexisting psychological disorders, alcohol abuse, PTSD, depression and anxiety disorders.
11 studies included
Important patient characteristics at baseline:
Number of patients (n) C: 168 E: 12 G: 102
Groups comparable at baseline? Heterogeneity was 64%, Chi² = 28.3, df = 10, (P = 0.002). |
Describe intervention:
C: Light sedation (RASS) ) E: Light sedation (RASS) G: Light sedation (RASS) |
Describe control:
C: Deep sedation (RASS) E: Deep sedation (RASS) G: Deep sedation (RASS)
|
End-point of follow-up:
C: 28 days E: 45 days G: 4 weeks
For how many participants were no complete outcome data available? (intervention/control) C: 1/2 E: Treatment: 10/7 45 day follow=up: 31/34 G: 12/13
|
Mortality Defined as the number of patients who died during IC/hospital stay.
Effect measure: RR [95% CI]: C: 0.77 [0.62 – 0.95] favoring light sedation E: 1.71 [0.74 – 3.95] favoring deep sedation G: 1.07 [0.51 – 2.26] favoring deep sedation.
Pooled effect (random effects model): 0.98 [95% CI 0.62 to 1.54] favoring light sedation. Heterogeneity (I2): 49%
Delirium Not reported.
Duration of mechanical ventilation Defined as the number of days requiring mechanical ventilation.
Effect measure: MD [95% CI] or median (IQR): C: not reported.
Length of sedation duration Not reported.
Complications Not reported.
PICS Defined as long-term physical, mental and cognitive outcomes.
Effect measure: RR [95% CI] C: 0.77 [0.39 – 1.53] favoring light sedation.
Effect measure: mean (SD) score on the Impact of Event Scale-Revised and the PTSD Symptom Checklist instruments (range 0-100, lower score means better outcome) four weeks after ICU discharge.
|
Author’s conclusion In summary, higher sedation dosing strategy will impact cognitive function in critically ill patients both medically and psychologically. Larger randomized prospective trials are needed to better address the long-term effect of sedative agents as well as sedation practices in the ICU and its impact on cognitive function. Newer and emerging therapies with newer antipsychotic or sedative agents are promising but still insufficient data exist to make any solid recommendations to change current practice.
|
Evidence table for RCTs
|
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
|
Shehabi, 2013 |
Type of study: Pilot prospective, multicenter, randomized, controlled trial.
Setting and country: Six ICUs.
Funding and conflicts of interest: The remaining authors have not disclosed any potential conflicts of interest. |
Inclusion criteria: Patients were included if they had been intubated within the previous 12 hours, were expected to need mechanical ventilation for longer than 24 hours, and required immediate and ongoing sedation.
Exclusion criteria: Exclusion criteria were age less than 18 Clinical Investigations Critical Care Medicine www.ccmjournal.org 1985 years; pregnancy proven or suspected primary neurologicalinjury; a diagnosis likely to result in prolonged weakness, drug overdose, burn injury, acute liver failure, dementia, or psychiatric illness; need for ongoing neuromuscular blockade, palliative care, or treatment limitations; inability to communicate in English; a mean blood pressure less than 55 mm Hg; a heart rate less than 55/min; or a high-grade AV block in the absence of a functioning pacemaker.
N total at baseline: Intervention: 21 Control: 16
Important prognostic factors2: age (SD): I: 65 (15) C: 61.6 (17)
Sex: I: 11% M C: 9% M
Groups comparable at baseline? Yes |
EGDS (Fig. 1) had to start within 12 hours of endotracheal intubation or within 12 hours of ICU admission for patients intubated outside the ICU (early intervention). The primary sedative agent in this arm was dexmedetomidine infusion at a starting dose of 1 μg/kg/hr without a loading dose. Bolus administration of dexmedetomidine was strictly prohibited owing to the risk of severe bradycardia and sinus arrest. If required, sedation could be supplemented with propofol. Sedatives were administered to achieve the desired level of light sedation whenever possible. |
The primary sedative agent in this group was at the discretion of the treating clinician. This could be midazolam and/or propofol or other agents deemed necessary but not dexmedetomidine. Clonidine and remifentanil could not be administered. Selected agents could be given by infusion or boluses and titrated by bedside nurses, including cessation when necessary, to achieve the default light sedation or the level of sedation deemed clinically appropriate and specified by the treating clinician. |
Length of follow-up: 90 days.
Loss-to-follow-up: n.r.
Incomplete outcome data: n.r.
|
Mortality Defined as the number of patients who died during IC/hospital stay.
Effect measure: RR [95% CI]: 1.90 [0.42 – 8.58] favoring deep sedation.
Delirium Defined as the number of patients with delirium during IC/hospital stay.
Effect measure: RR [95% CI]: 1.02 [0.44 – 2.34] favoring deep sedation.
Duration of mechanical ventilation Defined as the number of days requiring mechanical ventilation.
Effect measure: MD [95% CI]: -0.10 [-1.57 – 1.37] favoring light sedation.
Length of sedation duration Not reported.
Complications Not reported.
PICS Not reported.
|
Author’s conclusion A sedation algorithm (EGDS) comprising early intervention, targeting light sedation, and using dexmedetomidine as a primary sedative administered soon after intubation was feasible and effective. EGDS reduced the use of other sedatives and the need for restraints when compared with standard sedation. This pilot study confirmed the feasibility of early randomization and suggests that EGDS can be effective and safe. These findings justify further investigation of EGDS. |
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Porhomayon, 2015 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
Risk-of-bias tables
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of quality assessment for RCTs
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Shehabi, 2013 |
Definitely yes;
Reason: Block randomization was undertaken. |
Definitely yes;
Reason: The randomization sequence was undertaken with concealed evelopes. |
Definitely no;
Reason: Blinding was not possible in this pilot and would not be feasible in our planned future process of care sedation RCT. |
No information;
Reason: No information was provided about loss to follow-up. |
Definitely yes;
Reason: All relevant outcomes were reported. |
Probably yes;
Reason: Although the sample was small, due to its multicenter nature and short time to randomization, real life was mimicked. |
Some concerns (lack of blinding). |
- Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
- If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
- Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the methods section of an article can be compared with those whose results are reported.
- Problems may include: a potential source of bias related to the specific study design used (e.g. lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behavior; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body. Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
- Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favors experimental, or favors comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Balzer, 2015 |
Observationele studie |
|
Olsen, 2020 |
Verkeerde controlegroep gebruikt (geen sedatie) |
|
Samuelson, 2008 |
Verkeerde populatie (postoperatieve patiënten, <24 uur gesedeerd) |
|
Tunrunen, 2015 |
Vergelijkt dexmed met standaard zorg |
|
Treggiari, 2009 |
Studie was al geïncludeerd in de review (Porhomayon, 2015) |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 16-12-2022
Laatst geautoriseerd : 16-12-2022
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Het doel is herziening van bestaande trias van Sedatie en Analgesie richtlijnen, waar sedatie en analgesie op de IC een onderdeel van is. De Sedatie en Analgesie richtlijnen hebben betrekking op alle patiënten die sedatie krijgen buiten de OK. De richtlijn zal blijven bestaan uit drie delen – volwassenen; kinderen; en IC. Deze patiëntencategorieën kennen specifieke risico’s waardoor specifieke aanbevelingen nodig zijn.
Sedatie en analgesie van de patiënten die een IC-behandeling krijgen verschilt steeds meer van procedurele sedatie en analgesie. Daarom staat deze IC-richtlijn in de nieuwe sedatie en alagesie-richtlijn meer los van de twee sedatie en analgesie richtlijnen (volwassenen en kinderen). Voorliggende richtlijn beschrijft het comfortabel krijgen en houden van patiënten die een IC-behandeling ondergaan, het tegengaan van pijn, agitatie en stress. Het beschrijft de medicamenteuze en niet medicamenteuze opties om de patiënt met zo min mogelijk complicaties in zo kort mogelijke tijd naar zo hoog mogelijk functioneel herstelniveau te krijgen, zowel fysiek als mentaal.
De richtlijn heeft betrekking op intensivisten en IC-verpleegkundigen. Daarnaast kan de richtlijn gebruikt worden door zorgverleners die betrokken zijn bij de behandeling op of na de Intensive Care zoals de mee behandelende medisch specialisten, paramedici, verpleegkundig specialisten en apothekers.
Er is afstemming met de twee andere onderdelen van de richtlijn Sedatie en Analgesie, namelijk die voor volwassenen en voor kinderen en mag samen met deze onderdelen als geheel worden gezien.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en analgesie van patiënten op de IC. Inbreng patiënten- en naastenperspectief via Stichting FCIC en patiëntenorganisatie IC Connect.
Werkgroep
Drs. N.C. (Niels) Gritters van de Oever, anesthesioloog-intensivist, Treant zorggroep, NVIC
Dr. K.S. (Koen) Simons, internist-intensivist, Jeroen Bosch Ziekenhuis, NVIC
Dr. M. (Marissa) Vrolijk, anesthesioloog-intensivist-, LangeLand Ziekenhuis Zoetermeer, NVIC
Dr. L. (Lena) Koers, anesthesioloog-kinderintensivist, Leiden UMC, NVA
Dr. H. (Rik) Endeman, internist-intensivist, Erasmus MC, NIV
Dr. M. (Mark) van den Boogaard, IC verpleegkundige, senior onderzoeker, Radboud UMC, V&VN
Drs. R. (Roel) van Oorsouw, fysiotherapeut, Radboud UMC, KNGF
Dr. N.G.M. (Nicole) Hunfeld, ziekenhuisapotheker, Erasmus MC, NVZA
Drs. W.P. (Wai-Ping) Manubulu-Choo, ziekenhuisapotheker, Martini Ziekenhuis, NVZA
Drs. M. (Marianne) Brackel, patiëntvertegenwoordiger, Stichting FCIC en patiëntenorganisatie IC Connect, Jeugdarts knmg niet praktiserend
Met methodologische ondersteuning van
• Drs. Florien Ham, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• Drs. Toon Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• Dr. Mirre den Ouden - Vierwind, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• Drs. Ingeborg van Dusseldorp, senior informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. N.C. (Niels) Gritters van de Oever |
Anesthesioloog-intensivist Treant zorggroep. |
Onbezoldigd en t/m juni 2021: NVIC bestuur ( NVIC accreditatie commissie NVIC luchtwegcommissie, congrescommissie) Chief Medical Officer van de LCPS (dagvergoeding) t/m maart 2022 voorzitter farmacotherapiecommissie NVIC per juli 2022 lid stafbestuur Treant ziekenhuisgroep per aug 2022 (vacatievergoeding) lid scientific board covidpredict per 2020 (onbezoldigd), commissie Acute Tekorten Geneesmiddelen per 2020 (vergadervergoeding) |
Geen. |
Geen actie. |
|
Dr. K.S. (Koen) Simons |
Internist-intensivist Jeroen Bosch Ziekenhuis. |
FCCS-instructeur bij NVIC (ca. 2 dagen/jaar, betaald). |
Geen. |
Geen actie. |
|
Dr. M. (Marissa) Vrolijk |
Anesthesioloog- intensivist LangeLand Ziekenhuis. |
Medisch beoordelaar adoptie bij Adoptie Stichting Meiling. |
Geen. |
Geen actie. |
|
Dr. L. (Lena) Koers |
Anesthesioloog-kinderintensivist LUMC |
Geen. |
Geen. |
Geen actie. |
|
Dr. H. (Rik) Endeman |
Internist-intensivist, Erasmus MC. |
Voorzitter van de gemeenschappelijke intensivisten commissie (GIC) (onbetaald). |
TravelGrant van Getinge om te spreken op een lunchsymposium in Kenya voor het jaarcongres (2018) van de Kenyan Society of Anaesthesiology and Intensive Care Medicine. Dit congres wordt ook veelbezocht door anaesthesisten en intensivisten uit omliggende landen. Het onderwerp was 'Hemodynamic monitoring in low resource and high resource environments', duurde een uur, en ging over wat voor meetinstrumenten je kan gebruiken om de hemodynamiek te bewaken indien je geen middelen hebt (low resource) en wel (high resource); duurde uiteindelijk 90 minuten. GETINGE verkoopt high-end HD-monitoring, deze kwamen in de presentatie voor, maar ook die van concurrenten. GETINGE had mij niets opgelegd m.b.t. de inhoud van de presentatie. PI van: Open Lung Concept 2.0 studie: Flow controlled ventilation (gesponsord door Ventinova). |
Geen actie. Het gesponsorde onderzoek is niet gerelateerd aan het onderwerp van de richtlijn. |
|
Dr. M. (Mark) van den Boogaard |
Senior onderzoeker, afdeling lntensive Care, Radboudumcc. |
Onbezoldigde functies: - Bestuurslid European Delirium Association. - Adviseur Network for lnvestigation of Delirium: Unifying Scientists (NIDUS). - Organisator IC-café regio Nijmegen & Omstreken. - Lid werkgroep Longterm Outcome and ICU Delirium van de European Society of lntensive Care Medicine. - Lid richtlijn Nazorg en revalidatie IC-patiënten. |
PI van onderstaande gesubsidieerde projecten: ZonMw subsidies: - programma GGG [2013]: Prevention of ICU delirium and delirium-related outcome with haloperidol; a multicentre randomized controlled trial. - programma DO [2015]: The impact of nUrsing DEliRium Preventive lnterventions in the lntensive Care Unit (UNDERPIN-ICU). Delirium komt terug in beide projecten en in de richtlijn, maar er zullen geen aanbevelingen naar vormen komen die belangenverstrengeling veroorzaken. Geen problemen worden voorzien, vanwege het niet betrokken zijn bij aanbevelingen over medicatie/verpleegkundige interventie obv door ZonMw gesubsidieerde projecten. ZIN subsidie: - programma Gebruiken van uitkomsteninformatie bij Samen beslissen [2018]: Samen beslissen op de IC: het gebruik van (patiëntgerapporteerde) uitkomst informatie bij gezamenIijke besluitvorming over IC-opname en behandelkeuzes op de IC. |
Geen actie. |
|
Drs. R. (Roel) van Oorsouw |
Fysiotherapeut/ PhD-kandidaat Radboudumc. |
Visiterend docent op de Hogeschool. Arnhem Nijmegen (10 uur per jaar) Congrescommissie NVZF (tot oktober 2021) Lid ethiekcommissie KNGF (sinds oktober 2021). |
Geen. |
Geen actie. |
|
Dr. N.G.M. (Nicole) Hunfeld |
Ziekenhuisapotheker ErasmusMC. |
Bestuurslid KNMP (functie: penningmeester, betaald). |
Boegbeeldfunctie, maar sedatie heeft geen relatie met openbare farmacie. |
Geen actie. |
|
Drs. W.P. (Wai-Ping) Manubulu-Choo |
Ziekenhuisapotheker, Martini Ziekenhuis. |
Geen. |
Geen. |
Geen actie. |
|
Drs. M. (Marianne) Brackel |
Patiëntvertegenwoordiger, Stichting FCIC en patiëntenorganisatie IC Connect, Jeugdarts knmg niet praktiserend. |
Geen. |
Geen. |
Geen actie. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Stichting Family and patient Centered Intensive Care (FCIC) en de patiëntenorganisatie IC Connect voor deelname aan de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de FCIC en IC Connect en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module 1 Pijnprotocol op de IC |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 2 Lichte sedatie op de IC |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 3a Analgetica versus hypnotica |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 3b Analgeticum bij analgosedatie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 4 Intraveneuze medicatie op de IC |
Geen substantiële financiële gevolgen. |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 5 Inhalatieanesthetica op de IC |
Geen substantiële financiële gevolgen. |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 6 Nonfarmacologische interventies |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 7 Organisatie van zorg |
Geen substantiële financiële gevolgen. |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sedatie en analgesie op de IC. Er is een knelpuntenanalyse gehouden samen met de andere Sedatie en analgesie richtlijnen. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld. Ook beoordeelde de werkgroep de aanbeveling(en) uit de eerdere richtlijn Procedurele Sedatie en analgesie bij volwassenen op de Intensive Care (NVK/NVA, 2012) op noodzaak tot revisie. Tevens is er gekeken naar samenhang met andere bestaande en te ontwikkelen richtlijnen, o.a. de richtlijn Delirium op de Intensive Care (NVIC, 2010) en de richtlijn Nazorg en revalidatie van intensive care patiënten (VRA/NVIC) en aansluiting op de Europese richtlijn PADIS, 2018, die over hetzelfde onderwerp gaat. Ten tijde van de autorisatiefase van deze richtlijn verscheen de richtlijn sepsis (NIV), waarin onderdelen van de sedatie van de septische IC-patiënt worden besproken. Beide richtlijnen vullen elkaar aan.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
er is hoge zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; het is zeer onwaarschijnlijk dat de literatuurconclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Redelijk |
er is redelijke zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; het is mogelijk dat de conclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Laag |
er is lage zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; er is een reële kans dat de conclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Zeer laag |
er is zeer lage zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; de literatuurconclusie is zeer onzeker. |
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
