Alcoholonthoudingsdelirium
Uitgangsvraag
Wat is de gewenste behandeling van een delier vanwege alcoholonthouding?
Aanbeveling
Onderscheid op klinische gronden.
- Identificeer risicopatiënten op alcoholonthoudingssyndroom, waaronder alcoholonthoudingsdelirium, middels anamnese en het afnemen van de gevalideerde vragenlijst AUDIT-C.
- Observeer en monitor symptomen middels de CIWA-Ar score en rapportage in het EPD.
- Start bij onthoudingsverschijnselen conform de CIWA-score en/of een alcoholonthoudingsdelirium met niet-medicamenteuze behandeling in combinatie met medicamenteuze behandeling
Niet-medicamenteuze behandeling
- Hiervoor gelden dezelfde adviezen als een delier in het algemeen, zie de richtlijnmodule ‘niet-medicamenteuze behandeling van het delier’.
- Richt de behandeling op oriëntatie, zintuiglijke beperking, slaap, mobilisatie, hydratatie, voeding en medicatiegebruik.
Medicamenteuze behandeling
- Wanneer naast alcoholonthouding ook andere somatische factoren een rol spelen bij het delier, hanteer dezelfde adviezen als een delier in het algemeen, zie de richtlijnmodule ‘medicamenteuze behandeling van het delier’.
- Geef een benzodiazepine bij een alcoholonthoudingssyndroom, volgens de ernst van de CIWA-Ar score. Controleer regelmatig het effect van de behandeling. Bouw benzodiazepine af bij voldoende onderdrukking van de verschijnselen.
- Start tevens met thiaminesuppletie in combinatie met vitamine C en vitamine B complex.
Bij onvoldoende effect van de benzodiazepine, start behandeling met haloperidol.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Drie verschillende facetten rondom alcoholonthoudingsdelirium komen aan bod in de overwegingen. Bij de deelvragen over het onderscheiden van alcoholonthoudingsdelirium (deelvraag 1) en de inzet van een niet-medicamenteuze behandeling (deelvraag 2) zijn de overwegingen geformuleerd op basis van bestaande ziekenhuisprotocollen, het Farmacotherapeutisch Kompas en expert opinion. Deelvraag 3 (medicamenteuze behandeling) is tevens gebaseerd op literatuuronderzoek.
1. Valt het alcoholonthoudingsdelirium op klinische gronden te onderscheiden van het delirium door andere oorzaken?
Het cluster is van mening dat het alcoholonthoudingsdelirium bij een somatisch zieke patiënt klinisch niet goed kan worden onderscheiden van het delirium door andere oorzaken en daarom op dezelfde wijze moet worden behandeld.
In de literatuur worden de termen ‘alcoholsyndroom’ en ‘alcoholonthoudingsdelirium’ vaak door elkaar gebruikt. Het cluster hanteert de volgende definities:
- Alcoholonthoudingssyndroom: Het alcoholonthoudingssyndroom wordt veroorzaakt door het staken of minderen van langdurig overmatig alcoholgebruik. Symptomen (variërend van milde hallucinaties tot Wernicke encephalopathie) ontstaan meestal binnen 8-24 uur. De ernst van het alcoholonthoudingssyndroom kan worden vastgesteld aan de hand van de CIWA-Ar score (Internisten Alrijne, 2024; FTK, 2024; Day, 2022).
- Alcoholonthoudingsdelirium (ook delirium tremens genoemd): Kan onderdeel zijn van het alcoholonthoudingssyndroom. Het alcoholonthoudingsdelirium ontstaat gewoonlijk na 2 tot 3 dagen na het stoppen of sterk verminderen van langdurig of overmatig alcoholgebruik. Het wordt gekarakteriseerd door ernstige tremoren, hallucinaties, wanen, agitatie, slapeloosheid en desorientatie (Day, 2022).
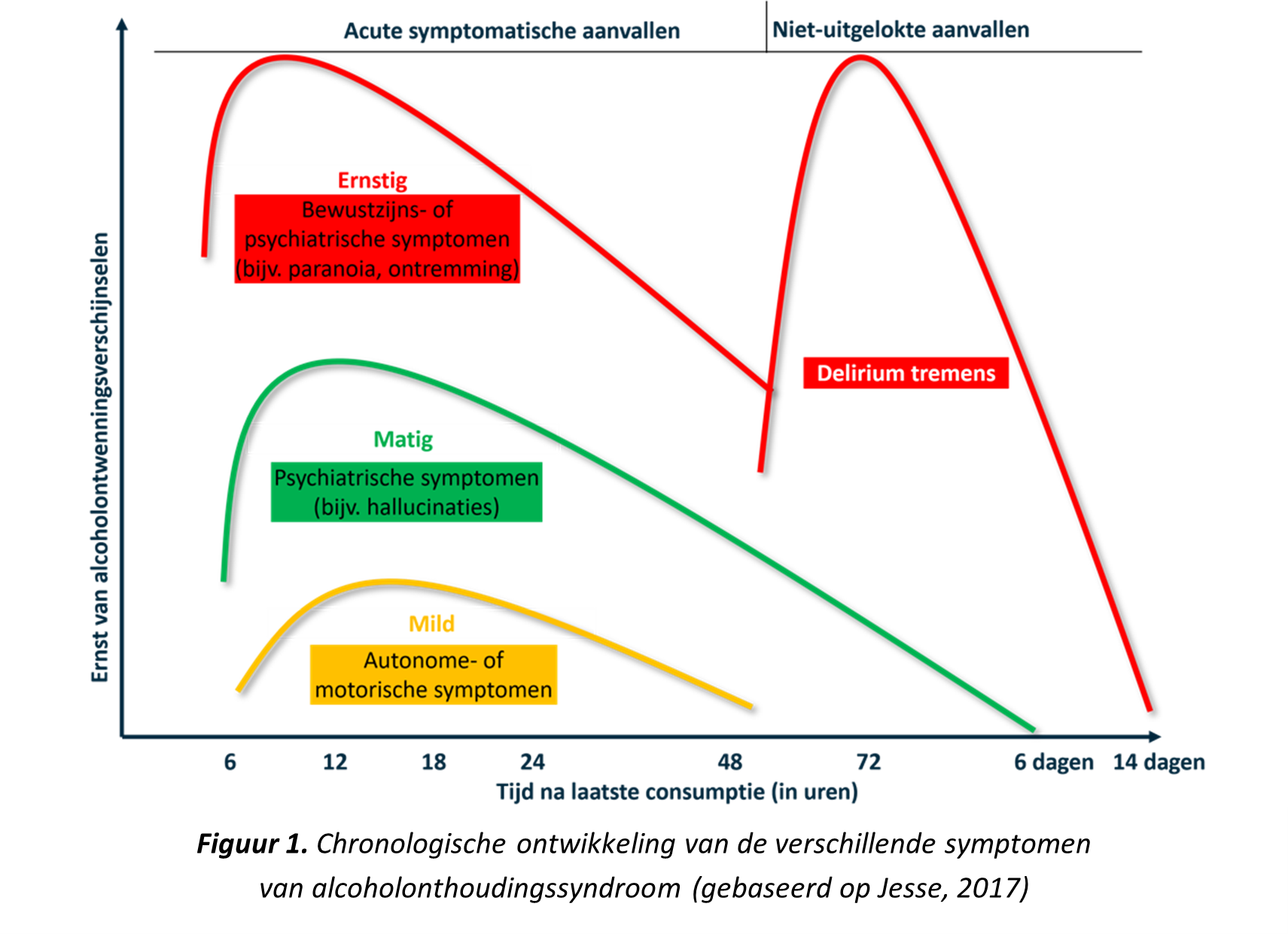
Het ontstaan van een alcoholonthoudingssyndroom is een dynamisch en complex proces. In Figuur 1 wordt de chronologische ontwikkeling van verschillende symptomen classificatie weergeven op basis van de ernst en/of het tijdstip van aanvang van symptomen (Jesse, 2017; Internisten Alrijne, 2024).
- Mild alcoholonthoudingssyndroom (CIWA-score 0-9): In een vroeg stadium bestaan symptomen veelal uit autonome en motorische verschijnselen (e.g. tremor, angst, hyperactiviteit, slapeloosheid, hoofdpijn). Milde symptomen beginnen ongeveer zes uur na de laatste alcoholconsumptie en verminderen veelal binnen 48 uur.
- Matig alcoholonthoudingssyndroom (CIWA-score 10-19): Psychiatrische symptomen zoals hallucinaties of illusies zijn kenmerkend voor een matig alcoholonthoudingssyndroom. Deze symptomen kunnen tot 6 dagen aanhouden.
- Ernstig alcoholonthoudingssyndroom (CIWA-score > 19): Een ernstig alcoholonthoudingssyndroom kan te herkennen zijn aan bewustzijnssymptomen, insulten of ernstige psychiatrische symptomen (e.g. verlaagd bewustzijn, paranoïde gedrag, desoriëntatie, hyperventilatie).
- Ernstig alcoholonthoudingssyndroom met alcoholonthoudingsdelirium (= delirium tremens) (CIWA-score > 19): Een alcoholonthoudingsdelirium begint veelal 48 uur na het stoppen met drinken. Kenmerkende symptomen van ernstige ontwenningsverschijnselen kunnen tot twee weken aanhouden. Het alcoholonthoudingsdelirium valt binnen het alcoholonthoudingssyndroom.
Het onderscheid in de acute fase is soms lastig van elkaar te onderscheiden, maar hierbij is het dan van belang goed te letten op de prodromale verschijnselen. Zorgverleners kunnen symptomen observeren en monitoren middels CIWA-Ar score.
Gezien de slechte afgrensbaarheid van het alcoholonthoudingsdelirium ten opzichte van het delirium door andere oorzaken bij somatisch zieke patiënten, adviseert het cluster om dezelfde richtlijnen te hanteren bij de behandeling van het delirium bij somatisch zieke alcoholisten als bij de behandeling van het delirium bij somatisch zieke patiënten (NVKG, 2021).
Ten aanzien van het voorkómen van een alcoholonthoudingsdelirium, is het cluster van mening dat er wel degelijk verschil is tussen alcoholonthoudingsdelirium en een delirium door andere oorzaken. Bij een ziekenhuisopname is belangrijk om alert te zijn op het alcoholonthoudingssyndroom, zodat alcoholonttrekkingsverschijnselen gericht geobserveerd kunnen worden en indien nodig adequaat en tijdig gestart kan worden met preventieve (medicamenteuze) behandeling. Het is belangrijk om alcoholgebruik goed uit te vragen bij de patiënt of bij naaste(n).
2. Wat is de meest werkzame niet-medicamenteuze behandeling van het alcoholonthoudingsdelirium?
Alcoholonthoudingsdelirium maakt deel uit van het alcoholonthoudingssyndroom. In de eerste plaats zijn de interventies dan ook gericht op het voorkómen van het delier en let men vooral ook op andere onttrekkingsverschijnselen. Hierbij adviseert het cluster de volgende drie stappen in acht te nemen.
1. Identificeer risicopatiënten
Identificeer risicopatiënten middels anamnese of het afnemen van de gevalideerde vragenlijst ‘Alcohol Use Disorder Identification Test-Consumption’ (AUDIT-C; Bush, 1998). De AUDIT-C bestaat uit drie vragen, die kunnen helpen bij het identificeren van personen die alcohol misbruiken. Het cluster adviseert bij anamnese te vragen naar hoeveelheid, frequentie en gevolgen van alcoholgebruik. De grens bij hoeveelheid en frequentie eenheden alcoholgebruik patiënten in de risicogroep vallen is arbitrair. Onder zwaar alcoholgebruik wordt verstaan meer dan 3 glazen per dag of 7 glazen per week voor vrouwen en meer dan 4 glazen per dag of 14 glazen per week voor mannen (Cohen, 2022). Echter geeft alcoholgebruik bij ouderen een verhoogde kans op schadelijke effecten in vergelijking met volwassenen door veranderende fysiologie en comorbiditeiten en is deze grens wellicht lager. Bij gebruik van de AUDIT-C vallen patiënten in de risicogroep indien score ≥ 5 (vrouwen) en ≥ 8 (mannen) (Cohen, 2022).
2. Observeer en monitor symptomen
Observeer en monitor symptomen middels CIWA-Ar (zie Tabel 1). Het cluster adviseert om onthoudingsklachten gedurende 3 dagen te monitoren met de Clinical Institute Withdrawal Assessment for Alcohol (CIWA-Ar) bij risicopatiënten (Day, 2022). De CIWA-Ar geeft een maat voor de ernst van de alcoholonthouding. Het afnemen van de vragenlijst duurt ongeveer 4 minuten en vraagt goede scholing en ervaring van de zorgverleners. Deze observatieschaal is niet geschikt om onderscheid te maken tussen alcoholonthoudingsdelirium of delier van ander origine, maar stelt enkel de ernst van de symptomen vast. Deze schaal richt op de symptomen die bij alcoholdelirium voorkomen alsmede andere onttrekkingsverschijnselen: agitatie, angst, auditieve, visuele en tactiele stoornissen, oriëntatie, hoofdpijn, tremor, zweten, misselijkheid/braken.
Naast de score middels de CIWA-Ar is observatie en rapportage in het EPD op kritische wijze de onthoudings- en delierverschijnselen van belang, aangezien ook delier door andere oorzaken een rol kan spelen bij patiënten opgenomen in een ziekenhuis.
3. Niet-medicamenteuze behandeling
Als op basis van de symptomen een alcoholonthoudingsdelirium wordt vastgesteld, dan gelden in principe dezelfde adviezen op het gebied van niet-medicamenteuze behandeling als voor het delier in het algemeen (zie module ‘niet-medicamenteuze behandeling’). Hierbij wordt geadviseerd speciale aandacht te hebben voor slaap, voedingstoestand en vochtintake, pijn, depressieve klachten, angst en stress. De niet-medicamenteuze behandeling is net als bij een delier op andere gronden een multi-interventieprogramma gericht op veiligheid, voorkomen van complicaties (zoals vallen) en vermindering van de ernst van de deliersymptomen.
Bij een matig tot ernstig alcoholonthoudingsdelirium zijn niet-medicamenteuze behandelingen (met name gespreks- en benaderingstechnieken, goed verlichte kamer) ten aanzien van agitatie en (visuele, auditieve en sensorische) hallucinaties geadviseerd (Verslavingskunde Nederland, 2017). Vraag een consulent psychiatrie of geriatrie in consult bij een matig tot ernstig alcoholonthoudingsdelirium, zodat zorg op maat geleverd kan worden.
3. Wat is de meest werkzame medicamenteuze behandeling van het alcoholonthoudingsdelirium?
Er is literatuuronderzoek uitgevoerd naar de meest effectieve medicamenteuze behandeling met benzodiazepine bij patiënten met alcoholonthoudingsdelirium. Er werden geen artikelen gevonden die voldeden aan de PICO. Daarom konden er geen conclusies worden getrokken over welke benzodiazepine het meest effectief is in de behandeling van patiënten met alcoholonthoudingsdelirium. Er bestaat dus een kennislacune op dit onderwerp. Gezien de beperkte literatuur, baseert het cluster zich op bestaande ziekenhuisprotocollen, het Farmacotherapeutisch Kompas en expert opinion.
Benzodiazepine
Combineer niet-medicamenteuze adviezen met medicamenteuze behandeling in geval van matig tot ernstig delier (FTK, 2023; Internisen Alrijne, 2024) maar ook al bij een alcoholonthoudingssyndroom met autonome verschijnselen (op basis van de CIWA-Ar score, Tabel 1). Indien een medicamenteuze behandeling geïndiceerd is, kan op basis van bestaande ziekenhuisprotocollen, het Farmacotherapeutisch Kompas en expert opinion één van de benzodiazepine gegeven worden (bijvoorbeeld diazepam, lorazepam of oxazepam), waarbij de voorkeur uitgaat naar lorazepam. Volgens het NHG en Ephor hebben kortwerkende benzodiazepine (zonder actieve metabolieten) zoals lorazepam, in het algemeen de voorkeur boven langwerkende, vanwege mogelijk overmatige sedatie. Dit geldt met name bij ouderen en patiënten met een verminderde leverfunctie (NHG, 2020; NHG, 2021; NVvP, 2023; Ephor, 2023). Het is onduidelijk wat het optimale doseringsschema is betreffende benzodiazepine (NVvP, 2009). De behandeling heeft in principe geen vast doseerschema of duur, maar wordt ingesteld op geleide van klachten, de zogenaamde ‘symptom triggered therapie’ (NVvP, 2023). Gebleken is uit de literatuur dat ‘symptom triggered therapy’ even effectief is als vaste doseerschema’s (Sachdeva, 2014). In Tabel 1 is een voorbeeld van een medicamenteuze behandelplan weergeven. Het cluster benadrukt dat regelmatig het effect van de behandeling gecontroleerd moet worden. De NVvP heeft als aanbeveling om gebruik te maken van de CIWA-Ar vragenlijst voor monitoring van de alcoholonthouding (NVvP, 2023: module ‘Behandeling intoxicatie en detoxificatie’).
Bouw benzodiazepine af bij voldoende onderdrukking van de verschijnselen (zie Tabel 1). Afbouwen kan ook plaats vinden in de thuissituatie. Bespreek dit goed met de patient, neem hierbij ook de eventuele kosten en mogelijkheden tot vergoeding in acht. Indien na toediening van een benzodiazepine een alcoholonthoudingsdelirium aanhoudt kan haloperidol worden voorgeschreven (zie Tabel 1).
Thiamine
Naast het risico op alcoholonthoudingssyndroom zijn er bij het plotseling stoppen van alcohol ook andere effecten op het zenuwstelsel, bijvoorbeeld door een tekort aan vitamine B1 bij overmatig alcoholgebruik. Daarom adviseert het cluster om op korte termijn tevens met thiamine te starten (FTK - Thiamine, 2023; NVvP, 2024; Internisen Alrijne, 2024; Ten Wolde, 2024). Volgens protocol in combinatie orale vitamine B complex en vitamine C, vanwege onvoldoende opname, snellere uitscheiding en overmatig verbruik bij alcoholisme. Vitamine C wordt alleen gegeven bij verdenking op en verhoogd risico op Wernicke- encephalopathie.
Haloperidol
Bij onvoldoende effect van benzodiazepine en het delier persisteert, dan kan een behandeling met haloperidol gestart worden (NVKG, 2021). In Tabel 1 is een voorbeeld van het medicamenteuze behandelplan weergegeven.
Tabel 1. Voorbeeld van een medicamenteus behandelplan
|
1. Bespreek niet-medicamenteus beleid |
|
|
2. Start medicamenteus beleid |
Thiaminesuppletie Start met thiaminesuppletie in combinatie met vitamine C en vitamine B complex, zie de tekst voor de doseringen.
Benzodiazepine Licht alcoholonthoudingssyndroom (CIWA-score 0-9)
Matig alcoholonthoudingssyndroom (CIWA-score 10-19)
Ernstig alcoholonthoudingssyndroom (CIWA-score > 19)
Monitoren
|
|
3. Voeg haloperidol toe (Internisten Alrijne, 2024; FTK - Lorazepam, 2023; FTK - Haloperidol, 2023) |
Ernstig alcoholonthoudingssyndroom met delirium tremens (= alcoholonthoudingsdelirium) (CIWA-score > 19)
|
Treedt het alcoholonthoudingsdelirium toch op
Betrek naasten en bespreek met hen de behandelopties en eventuele wijzigingen. Aandacht, geduld, het bieden van herkenningspunten en structuur worden als zeer behulpzaam gezien door naasten. Hierbij wordt expliciet genoemd dat dit voorrang heeft op het starten met medicatie. Breng een patiënt in een veilige omgeving. Probeer de behandeling van de patiënt door zoveel mogelijk dezelfde zorgverleners uit te laten voeren. Bespreek de mogelijkheid van psychosociale zorg met zowel de patiënt als de naaste(n) met hierbij extra aandacht voor bespreken mogelijkheid minderen dan wel stoppen met alcoholgebruik en bespreken van de mogelijkheden ter ondersteuning in de lokale situatie (NHG, 2021).
Wernicke encefalopathie
Er is sprake van een verhoogd risico op een Wernicke encefalopathie bij een alcoholist die al langere tijd één of meerdere onderstaande symptomen heeft: verwaarlozing, cognitieve stoornis, loopstoornis en polyneuropathie. Veelal wordt een Wernicke-encefalopathie gekenmerkt door de trias: bewustzijnsveranderingen, loop- en balansstoornissen en oogbewegingsstoornissen. Bij een verhoogd risico op een Wernicke encefalopathie wordt geadviseerd te starten met thiamine (250mg iv of 3dd im).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het tijdig identificeren van patiënten en preventief behandelen voorkomt de noodzaak tot onvrijwillige zorg en kan het alcoholonthoudingsdelirium voorkomen. Bespreek met de patiënt en zijn naaste(n) daarom het belang van een goede weergave van het alcoholgebruik thuis, zodat gestart kan worden met de preventieve interventies en informeer hen over het alcoholonthoudingssyndroom en delier.
Kosten (middelenbeslag)
Bij het cluster zijn geen kosten-effectiviteitsstudies bekend. Een delier zorgt voor een langere ligduur en daardoor hogere kosten. De oorzaak van opname (somatisch probleem) is mogelijk al verholpen, maar patiënten moeten langer opgenomen blijven vanwege hun delier. Dit leidt tot hogere opname kosten. Het is zeer aannemelijk dat preventief behandelen leidt tot kortere duur van het delier resulterend in een verkorting van de ligduur en een afname in kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Het cluster is van mening dat delen van de richtlijn, waar relevant rekening houdend met lokale omstandigheden waar relevant, omgezet zouden moeten worden in (afdelings-) protocollen.
Het in de anamnese opnemen van vragen naar alcoholgebruik is gebruikelijk. Bij patiënten van 70 jaar of ouder is middels het VMS Veiligheidsprogramma gebruikelijk om te screenen op delier. De uitdaging ligt in het (h)erkennen van het verhoogd risico op alcoholonthoudingssyndroom en het daarna inzetten van de preventieve maatregelen. Hierbij is communicatie en overdracht tussen de verschillende zorgverleners op de verschillende afdelingen een mogelijk struikelblok. Met hulp van het EPD en het instellen van bijvoorbeeld een zorgpad kan dit proces ondersteund worden. Daarnaast is de patiënt en/of zijn naaste niet altijd eerlijk in het aangeven van de werkelijke hoeveelheid alcoholgebruik. Uitleg omtrent het belang van deze vraag kan de grens mogelijk verlagen. Derhalve is naar de mening van dit cluster regelmatige scholing van de professionals van belang om een adequate uitvoer van de richtlijn tot een succes te maken.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Omtrent de medicamenteuze behandeling is er geen onderzoek gevonden naar welke benzodiazepine het meest effectief is in de behandeling van patiënten met alcoholonthoudingsdelirium. Daarom konden er geen conclusies worden getrokken over welke benzodiazepine het meest effectief is in de behandeling van patiënten met alcoholonthoudingsdelirium. Medicamenteuze behandeling bestaat uit het starten van benzodiazepine en kan eventueel worden uitgebreid met haloperidol. Het is onduidelijk wat het optimale doseringsschema is betreffende benzodiazepine, het cluster spreekt op basis van bestaande protocollen en het Farmacotherapeutisch Kompas wel een voorkeur uit. Hierbij wordt de ernst van het alcoholonthoudingssyndroom als leidraad gebruikt, die te meten is met de CIWA-score, en waar ook afkapwaarden voor zijn aangegeven. Van belang om hierbij voor de duur van de behandeling goed te kijken of de symptomen verbeterd zijn, symptom triggered therapie. Het cluster benadrukt dat dat regelmatig het effect van de behandeling gecontroleerd moet worden.
Alcoholonthoudingsdelirium maakt deel uit van het alcoholonthoudingssyndroom, meestal optredend na 48 uur. Dit heeft het vinden van literatuur bemoeilijkt. Aangezien alcoholonthoudingsdelirium deel uitmaakt van het alcoholonthoudingssyndroom kunnen naar de mening van het cluster met ondersteuning van literatuur, andere richtlijnen en protocollen de aanbevelingen onderbouwd worden. Gezien het belang van preventie van het alcoholonthoudingsdelirium en de gevolgen als dit niet herkend wordt (waaronder langere ligduur, psychische gevolgen patiënt, hogere werkdruk zorgpersoneel) worden de interventies dan ook sterk aanbevolen. Daarom zijn de interventies primair gericht op het voorkomen van symptomen van het delier en andere onttrekkingsverschijnselen.
Onderbouwing
Achtergrond
Delirium is one of the most serious symptoms in patients with alcohol withdrawal syndrome (AWS). It is also known as alcohol related withdrawal delirium and is caused by cessation or reduction of long-term excessive alcohol consumption. Three different aspects will be covered in this guideline module:
1. Can alcohol withdrawal delirium be differentiated from delirium due to other causes on clinical grounds?
There is currently a lack of clarity about the clinical differentiation between alcohol withdrawal delirium and delirium from other causes. The fact that a somatically ill patient is alcohol dependent and even exhibits alcohol withdrawal symptoms does not mean that alcohol withdrawal causes delirium by default. The delineation alcohol withdrawal delirium and delirium caused by other cause matters for treatment. If the cause of the delirium is unclear, the patient is usually treated like a 'regular' delirium (preferably with haloperidol). However, there is variation in practice, often related to the overlap with delirium in somatically ill patients. More uniformity and standardization in Dutch practice is desirable.
2. What is the most effective non-drug treatment of alcohol withdrawal delirium?
In some mild cases, a primarily non-medicinal approach (such as limit prodding, offering landmarks, counselling) can be started. In principle, this approach corresponds to the treatment for 'normal' delirium. However, this applies especially in cases where symptoms are not yet evident. In the case of alcohol withdrawal delirium with all characteristics, drug treatment should be moved quickly.
3. What is the most effective drug treatment of alcohol withdrawal delirium?
Benzodiazepines are commonly used as drug treatment in patients with AWS related delirium. In current practice, however, there is a lack of insight in determining the most efficient strategy using benzodiazepines as a treatment of delirium in AWS patients. For instance, it is unclear for caregivers which benzodiazepine is most efficient and there is variation in which benzodiazepine to start treatment with benzodiazepines. This leads to unwarranted clinical variation in the treatment of alcohol withdrawal delirium.
The systematic literature review focuses specifically on the third aspect, the other two are addressed in the considerations.
Conclusies
delirium severity, duration of delirium (time to recovery), days in hospital, complications/ adverse events, and patients experience
|
- GRADE |
No evidence was found regarding the effect of drug treatment with benzodiazepines in patient with alcohol withdrawal delirium on delirium severity, duration of delirium (time to recovery), days in hospital, complications/adverse events. and patients experience. |
Table 1. Brief description of randomized controlled trials that studied benzodiazepines and reported incidences of delirium, in a mixed population (with and/or without alcohol withdrawal delirium)
|
Study name and type |
Patient population and number |
Type of benzodiazepines (intervention) |
Results (incidence of delirium tremens) |
Other remarks |
|
What is the most effective drug treatment using benzodiazepines in patients with alcohol withdrawal delirium? |
||||
|
Bahji (2022); Systematic review |
Alcohol-dependent adult patients diagnosed with acute AW using DMS or ICD were eligible. |
All benzodiazepines were included. Most studies were about:
|
Odd ratios were defined as:
|
Authors conclusion: From all of the pharmacotherapeutic modalities, benzodiazepines appear to be safe and efficacious for reducing some measures of AW. Earlier meta-analysis from 1997 and 1999 demonstrated efficacy for BZDs over placebo and alternative treatments for DT’s . However, methodologically there are several limitations. |
|
Maldonado (2012); Prospective, randomized, controlled trial |
N=47 patients who presented with alcohol withdrawal symptoms. Patients were enrolled regardless of the initial reason for hospitalization. Eligible patients were inpatients with a reported history of alcohol withdrawal or dependence, age 18 or older, who had consumed alcohol within 24 h of admission and had the ability to consent to participate in the study. |
Benzodiazepine (using diazepam and lorazepam) loading protocol was compared with a symptom-triggered treatment protocol |
Two patients, one in each treatment group, developed treatment-refractory delirium tremens and required transfer to the intensive care unit. Further analysis on this outcome were not performed |
Authors conclusion: study did not reveal clear evidence on loading versus symptom triggered schedule.
|
|
Sachdeva (2014); Prospective, randomized, double blind controlled trial
|
N=63 undergoing in-patient detoxification were included. Patients with delirium were excluded. |
Benzodiazepine (lorazepam) symptom-triggered was compared with fixed tapering dose regimens. |
Two patients, one in each treatment group, developed delirium tremens.
|
Authors conclusions: There were no significant differences between both groups in terms of among other delirium tremens.
|
|
Kumar (2009); Randomized, Double Blind comparison |
N=100 Male inpatients in a state of moderately severe, uncomplicated alcohol withdrawal at screening were randomized. |
Lorazepam (8mg/day) was compared with chlordiazepoxide (80mg/day) |
One patient in the chlordiazepoxide group developed withdrawal delirium |
The author did not make any statements or conclusions with respect to delirium.
|
|
Daeppen (2002) |
N=117 |
Benzodiazepine (lorazepam) symptom-triggered was compared with fixed tapering dose regimens. |
There were no delirium tremens reported. |
The author did not make any statements or conclusions with respect to delirium.
|
|
AW = Alcohol Withdrawal; DMS = Diagnostic and Statistical Manual of Mental Disorders; ICD = International Classification of Diseases |
||||
Samenvatting literatuur
Description of studies
No studies with the correct population (patients with alcohol withdrawal delirium) and outcome (e.g. delirium severity) were found in the literature search and could be included in the analysis of the literature. Systematic reviews and randomized controlled trials (RCTs) about incidence of subjects experiencing delirium tremens in a mixed population (with without alcohol withdrawal delirium) are shown in Table 1.
Results
No studies were included in the analysis of the literature. Table 1 shows relevant studies report on benzodiazepine and delirium tremens, but a mixed population (with and/or without alcohol withdrawal delirium). Three studies (Maldonado, 2012; Sachdeva, 2014; Daeppen, 2002) compared loading protocol versus symptom-triggered protocols among benzodiazepines but could not find any significant differences in delirium tremens.
Overall, authors could not draw any conclusions from the studies with respect to delirium tremens specifically e.g., due to methodologically limitations.
Level of evidence of the literature
The level of evidence could not be determined as no studies were included in the analysis of the literature.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the most effective drug treatment with benzodiazepines in patient with alcohol withdrawal delirium?
P: patients with alcohol withdrawal delirium (CIWA ≥ 10; PAWSS)
I: intervention with benzodiazepines (diazepam, lorazepam, oxazepam, midazolam,)
C: placebo or other benzodiazepines (diazepam, lorazepam, oxazepam, midazolam )
Relevant outcome measures
The guideline development group considered delirium severity, duration of delirium (time to recovery) and days in hospital as a critical outcome measure for decision making; and complications/adverse events and patients experience as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
Per outcome the working group defined the following differences as minimal clinically (patient) important differences:
- Delirium severity: RR ≤0.8 or ≥1.25 (dichotomous); 0.5 SD (continuous)
- Duration of delirium (time to recovery): RR ≤0.8 or ≥1.25 (dichotomous); 0.5 SD (continuous)
- Days in hospital: RR ≤0.8 or ≥1.25 (dichotomous); 0.5 SD (continuous)
- Complications/adverse events: RR ≤0.8 or ≥1.25 (dichotomous); 0.5 SD (continuous)
Given the variety in methods to determine and report patients experience, the working group did not a priori define the minimal clinically (patient) important difference for this outcome measure. The differences between the groups were evaluated by the working group after data extraction.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 27 June 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 650 hits. Studies were selected based on the following criteria:
- Systematic review (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available) or randomized controlled trial,
- A full-text English language publication,
- Included RCT with minimally n=20 (>10 patients in each arm),
- Compared benzodiazepine with placebo or other benzodiazepines,
- Included patients with alcohol withdrawal related delirium and aged ≥ 18 years, and
- Included at least one of the following outcomes according to the PICO.
Initially, 18 studies were selected based on title and abstract screening. After reading the full text, all studies were excluded (see the table with reasons for exclusion under the tab Methods).
Results
No studies were included in the analysis of the literature.
Referenties
- Internisten Alrijne, 2024. 'Beoordeling en behandeling alcoholonthouding'. Geraadpleegd op 14-03-2024. Link: https://www.internisten-alrijne.nl/alcoholonthoudingssyndroom.html
- Bush, K., Kivlahan, D. R., McDonell, M. B., Fihn, S. D., & Bradley, K. A. (1998). The AUDIT alcohol consumption questions (AUDIT-C): an effective brief screening test for problem drinking. Archives of internal medicine, 158(16), 1789-1795.
- Cohen SM, Alexander RS, Holt SR. The Spectrum of Alcohol Use: Epidemiology, Diagnosis, and Treatment. Med Clin North Am. 2022 Jan;106(1):43-60. doi: 10.1016/j.mcna.2021.08.003. PMID: 34823734.
- Day E, Daly C. Clinical management of the alcohol withdrawal syndrome. Addiction. 2022 Mar;117(3):804-814. doi: 10.1111/add.15647. Epub 2021 Aug 22. PMID: 34288186.
- Dijkstra, B. A. G., van Oort, M. M. H. J., & de Jong, C. A. J. (2017). Handleiding Detoxificatie van psychoactieve middelen: Verantwoord ambulant of intramuraal detoxificeren.
- Ephor, 2023. Ephor - Benzodiazepinen (angststoornis). geraadpleegd juni 2023, via ephorapp.nl.
- FTK, 2024. Farmacotherapeutisch kompas > indicaties > Stoornissen bij het gebruik van alcohol. Geraadpleegd op 14-03-2024. Link: https://www.farmacotherapeutischkompas.nl/bladeren/indicatieteksten/stoornissen_bij_het_gebruik_van_alcohol
- Jesse S, Bråthen G, Ferrara M, Keindl M, Ben-Menachem E, Tanasescu R, Brodtkorb E, Hillbom M, Leone MA, Ludolph AC. Alcohol withdrawal syndrome: mechanisms, manifestations, and management. Acta Neurol Scand. 2017 Jan;135(1):4-16. doi: 10.1111/ane.12671. Epub 2016 Sep 1. PMID: 27586815; PMCID: PMC6084325.
- MedTzorg - Richtlijn Verslaving 2021. Richtlijn Verslaving: https://medtzorg.nl/wp-content/uploads/2020/09/RICHTLIJN-Verslaving-_-Inhoud-en-Inleiding-definitief-v1_1-dec-2016.pdf. Samenvattingskaart Alcohol: https://medtzorg.nl/wp-content/uploads/2020/06/RICHTLIJN-Verslaving-_-SAMENVATTINGSKAART-ALCOHOL-v1_1-dec16.pdf
- NHG, 2020. NHG-Standaard Delier, 2020. Via Richtlijnen.nhg.org.
- NHG, 2021. NHG-Standaard Problematisch alcoholgebruik, 2021. Via Richtlijnen.nhg.org.
- NVN, 2009. Richtlijn Stoornissen in het gebruik van alcohol. Beoordeeld: 01-01-2009. Link: https://richtlijnendatabase.nl/richtlijn/stoornissen_in_het_gebruik_van_alcohol_2023/alcohol_-_somatische_complicaties/effect_alcoholmisbruik_op_het_zenuwstelsel.html
- NVvP, 2023. Richtlijn Stoornissen in het gebruik van alcohol. Via Richtlijnendatabase.nl: (https://richtlijnendatabase.nl/richtlijn/stoornissen_in_het_gebruik_van_alcohol_2023/behandeling_intoxicatie_en_detoxificatie_2023.html).
- Sachdeva A, Chandra M, Deshpande SN. A comparative study of fixed tapering dose regimen versus symptom-triggered regimen of lorazepam for alcohol detoxification. Alcohol Alcohol. 2014 May-Jun;49(3):287-91. doi: 10.1093/alcalc/agt181. Epub 2014 Jan 8. PMID: 24407777.
- ten Wolde, M., van Beemen, L., & Goossensen, A. 2024. Standaard Thiamine. Korsakov Kenniscentrum. Link: https://korsakovkenniscentrum.nl/voor-professionals/wetenschappelijke-naslagwerken/standaard-thiamine
- Verslavingskunde Nederland, 2017. Richtlijn Detoxificatie psycho actieve middelen -alcohol. Link: https://verslavingskundenederland.nl/database/richtlijn-detoxificatie-van-psychoactieve-middelen-verantwoord-ambulant-of-intramuraal-detoxificeren/
Evidence tabellen
Evidence tables
Niet van toepassing bij deze richtlijn module.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Awissi, D. K. and Lebrun, G. and Coursin, D. B. and Riker, R. R. and Skrobik, Y. Alcohol withdrawal and delirium tremens in the critically ill: A systematic review and commentary. Intensive Care Medicine. 2013; 39 (1) :16-30 |
Wrong intervention/comparison: No comparison benzodiazepine versus benzodiazepine or benzodiazepine versus placebo. |
|
Amato, L. and Minozzi, S. and Davoli, M. Efficacy and safety of pharmacological interventions for the treatment of the Alcohol Withdrawal Syndrome. Cochrane database of systematic reviews (Online). 2011; (6) :CD008537 |
Wrong population: All AWS severities were allowed (also CIWA scores below 10), do not report seperately for CIWA above 10. |
|
Amato, L. and Minozzi, S. and Vecchi, S. and Davoli, M. Benzodiazepines for alcohol withdrawal. Cochrane database of systematic reviews (Online). 2010; 3 :CD005063 |
Wrong outcome: Reports ‘number of patients experiencing DT’. |
|
Anonymous Alcohol withdrawal syndrome: how to predict, prevent, diagnose and treat it. Prescrire international. 2007; 16 (87) :24-31 |
Wrong study design: Narrative paper |
|
Bahji, A. and Bach, P. and Danilewitz, M. and Crockford, D. and El-Guebaly, N. and Devoe, D. J. and Saitz, R. Comparative efficacy and safety of pharmacotherapies for alcohol withdrawal: a systematic review and network meta-analysis. Addiction (Abingdon, England). 2022; 117 (10) :2591-2601 |
Wrong population: All AWS severities were allowed (also CIWA scores below 10), do not report seperately for CIWA above 10. |
|
Daeppen, J. B. and Gache, P. and Landry, U. and Sekera, E. and Schweizer, V. and Gloor, S. and Yersin, B. Symptom-triggered vs fixed-schedule doses of benzodiazepine for alcohol withdrawal: A randomized treatment trial. Archives of Internal Medicine. 2002; 162 (10) :1117-1121 |
Wrong population: All AWS severities were allowed (also CIWA scores below 10), do not report separately for CIWA above 10. |
|
Gopal R, Chennatte SS. Comparing 24-hour symptom triggered therapy and fixed schedule treatment for alcohol withdrawal symptoms - A randomized control study. Asian J Psychiatr. 2020 Feb;48:101888. doi: 10.1016/j.ajp.2019.101888. Epub 2019 Nov 25. PMID: 31835144. |
Wrong outcome: Outcome of this study does not fit the PICO. In this study the primary oucome is the total dose of benzodiazepines administered and the duration of detoxification in both the treatment groups. |
|
Holleck, J. L. and Merchant, N. and Gunderson, C. G. Symptom-Triggered Therapy for Alcohol Withdrawal Syndrome: a Systematic Review and Meta-analysis of Randomized Controlled Trials. Journal of General Internal Medicine. 2019; 34 (6) :1018-1024 |
Wrong outcome: reports number of / incidence of delirium |
|
Kattimani, Shivanand and Bharadwaj, Balaji Clinical management of alcohol withdrawal: A systematic review. Industrial psychiatry journal. 2013; 22 (2) :100-8 |
Wrong study design: Narrative paper |
|
Kumar, C. N. and Andrade, C. and Murthy, P. A randomized, double-blind comparison of lorazepam and chlordiazepoxide in patients with uncomplicated alcohol withdrawal. Journal of Studies on Alcohol and Drugs. 2009; 70 (3) :467-474 |
Wrong population: All AWS severities were allowed (also CIWA scores below 10), do not report separately for CIWA above 10. |
|
Maldonado, J. R. and Nguyen, L. H. and Schader, E. M. and Brooks, J. O. Benzodiazepine loading versus symptom-triggered treatment of alcohol withdrawal: A prospective, randomized clinical trial. General Hospital Psychiatry. 2012; 34 (6) :611-617 |
Wrong population: Mean score from groups were approx. 8. (Hence below 10). Do not report separately for CIWA above 10. |
|
Mayo-Smith, M. F. and Beecher, L. H. and Fischer, T. L. and Gorelick, D. A. and Guillaume, J. L. and Hill, A. and Jara, G. and Kasser, C. and Melbourne, J. Management of alcohol withdrawal delirium: An evidence-based practice guideline. Archives of Internal Medicine. 2004; 164 (13) :1405-1412 |
Wrong intervention: Reviews groups of sedative hypnotive agents and neuroleptic agents. Not separate benzodiazepines. |
|
Muzyk, A. J. and Leung, J. G. and Nelson, S. and Embury, E. R. and Jones, S. R. The role of diazepam loading for the treatment of alcohol withdrawal syndrome in hospitalized patients. American Journal on Addictions. 2013; 22 (2) :113-118 |
Wrong study design: Narrative paper |
|
Ramanujam, R. and Padma, L. and Swaminath, G. and Thimmaiah, R. S. A comparative study of the clinical efficacy and safety of lorazepam and chlordiazepoxide in alcohol dependence syndrome. Journal of Clinical and Diagnostic Research. 2015; 9 (3) :FC10-FC13 |
Wrong population: Study excluded patients with delirium tremens and therefore does not report the right population (alcohol delirium). |
|
Sachdeva, A. and Chandra, M. and Deshpande, S. N. A comparative study of fixed tapering dose regimen versus symptom-triggered regimen of lorazepam for alcohol detoxification. Alcohol and Alcoholism. 2014; 49 (3) :287-291 |
Wrong population: Study excluded patients with delirium tremens and therefore does not report the right population (alcohol delirium). |
|
Sachdeva, A. and Choudhary, M. and Chandra, M. Alcohol withdrawal syndrome: Benzodiazepines and beyond. Journal of Clinical and Diagnostic Research. 2015; 9 (9) :VE01-VE07 |
Wrong study design: Narrative paper |
|
Schmidt, K. J. and Doshi, M. R. and Holzhausen, J. M. and Natavio, A. and Cadiz, M. and Winegardner, J. E. Treatment of Severe Alcohol Withdrawal. Annals of Pharmacotherapy. 2016; 50 (5) :389-401 |
Wrong study design: Narrative papers that include cohort studies. |
|
Ulrichsen, J. and Ntais, C. and Pakos, E. and Kyzas, P. and Ioannidis, J. P. A. Benzodiazepines for alcohol withdrawal. Ugeskrift for Laeger. 2006; 168 (35) :2896-2899 |
Wrong population: Rayyan selection refers to article with other language (Danish). Following the Cochrane reference : https://doi.org/10.1002/14651858.CD005063.pub2 results in article Benzodiazepine for alcohol withdrawal from Ntais (2015). This study allows all AWS severities and do no report seperately for CIWA above 10. |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 15-10-2024
Laatst geautoriseerd : 15-10-2024
Geplande herbeoordeling : 15-10-2029
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2021 een multidisciplinaire cluster ingesteld. Dit cluster bestaat uit vertegenwoordigers van alle relevante organisaties die betrekking hebben op de zorg voor patiënten met dementie en delier.
Het cluster Cognitieve stoornissen en Dementie bestaat uit drie richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. Het cluster Cognitieve stoornissen en Dementie bestaat uit de volgende personen.
Clusterstuurgroep
- Dhr. Prof. Dr. M.G.M. (Marcel) Olde Rikkert (voorzitter), klinisch geriater, Radboudumc, Nijmegen; NVKG
- Dhr. Prof. Dr. A.R. (Tony) Absalom, anesthesioloog, Universitair Medisch Centrum Groningen, Groningen; NVA
- Dhr. Dr. J.H.J.M. (Jeroen) de Bresser, radioloog, Leids Universitair Medisch Centrum, Leiden; NVvR
- Mevr. J.L.M. (Josephine) Lambregts, patiëntvertegenwoordiger; Alzheimer Nederland
- Mevr. Dr. I.K. (Indrag) Lampe, psychiater, OLVG, Amsterdam; NVvP
- Mevr. Prof. Dr. B.C. (Barbara) van Munster, internist, Universitair Medisch Centrum Groningen, Groningen; NIV
- Dhr. Prof. Dr. E. (Edo) Richard, neuroloog, Radboudumc, Nijmegen; NVN
- Mevr. Prof. Dr. Ir. C. (Charlotte) Teunissen, klinisch chemicus, AmsterdamUMC, Amsterdam; NVKC
- Dhr. Dr. R.A.W. (Ronald) Verhagen, orthopedisch chirurg, Tergooi MC, Hilversum; NOV
Clusterexpertisegroep
- Dhr. Dr. A.P.A. (Auke) Appelman, radioloog, Universitair Medisch Centrum Groningen, Groningen; NVvR
- Dhr. Prof. Dr. B.N.M. (Bart) van Berckel, nucleair geneeskundige, AmsterdamUMC, Amsterdam; NVNG
- Mevr. Dr. R.L. (Rozemarijn) van Bruchem- Visser, internist ouderengeneeskunde, Erasmus Medisch Centrum, Rotterdam; NIV
- Dhr. B.P.H. (Bas) ter Brugge, specialist ouderengeneeskunde, Vilente, Doorwerth; Verenso
- Dhr. J.P.C.M. (Jos) van Campen, klinisch geriater, OLVG, Amsterdam; NVKG
- Dhr. Dr. J.A.H.R. (Jurgen) Claassen, klinisch geriater, Radboudumc, Nijmegen; NVKG
- Dhr. Dr. P.L.J. (Paul) Dautzenberg, klinisch geriater, Jeroen Bosch Ziekenhuis, ‘s-Hertogenbosch; NVKG
- Mevr. Dr. A.M. (Agnies) van Eeghen, Arts voor Verstandelijk Gehandicapten, AmsterdamUMC, Amsterdam; NVAVG
- Mevr. Dr. M.E.A. (Marlise) van Eersel, internist, Universitair Medisch Centrum Groningen, Groningen; NIV
- Mevr. Dr. S. (Sanne) Franzen, neuropsycholoog, Erasmus Medisch Centrum, Rotterdam; NIP
- Mevr. C.M. (Christa) de Geus, neurogeneticus, AmsterdamUMC, Amsterdam; NVKG
- Mevr. M. (Marjolein) Groeneveld, MSc, verpleegkundig Consulent Geriatrie, klinisch epidemioloog, Catharina Ziekenhuis, Eindhoven; V&VN
- Dhr. Dr. R.B. (Rients) Huitema, klinisch neuropsycholoog, Universitair Medisch Centrum Groningen, Groningen; NIP
- Dhr. Drs. A. (Ali) Lahdidioui, internist, HagaZiekenhuis, Den Haag; NIV
- Dhr. Dr. J. (Jules) Lavalaye, nucleair geneeskundige, St.Antonius Ziekenhuis, Nieuwegein/Utrecht; NVNG
- Mevr. Drs. L. (Lieke) Mitrov, ziekenhuisapotheker, Maasstad Ziekenhuis, Rotterdam; NVZA – tijdelijk vervangen door Shirley Sparla.
- Mevr. Dr. M. (Marieke) Perry, huisarts/onderzoeker, Radboudumc, Nijmegen; NHG
- Dhr. Dr. G. (Gerwin) Roks, neuroloog, Elisabeth-TweeSteden Ziekenhuis, Tilburg; NVN
- Mevr. Dr. T.R. (Rikje) Ruiter, internist, Maasstad Ziekenhuis, Rotterdam; NIV
- Mevr. A.J.B.P. (Astrid) Schoonbrood, ergotherapeut, Ergotherapiepraktijk Zuid-Limburg; Ergotherapie Nederland
- Mevr. Dr. N. (Niki) Schoonenboom, neuroloog, Spaarne Gasthuis, Haarlem/Hoofdorp, NVN
- Dhr. Dr. H. (Harro) Seelaar, neuroloog, Erasmus Medisch Centrum, Rotterdam; NVN
- Dhr. Dr. K.S. (Koen) Simons, intensivist-internist, Jeroen Bosch Ziekenhuis, ‘s-Hertogenbosch; NVIC
- Mevr. Drs. M.M.E. (Marlies) Sleegers-Kerkenaar, klinisch geriater, Sint Jans Gasthuis, Weert; NVKG
- Mevr. Drs. S.C.A. (Shirley) Sparla, ziekenhuisapotheker, St. Antonius Ziekenhuis; NVZA – tijdelijke vervanging van Lieke Mitrov.
- Mevr. Dr. P.E. (Petra) Spies, klinisch geriater, Gelre ziekenhuizen, Apeldoorn/Zutphen; NVKG
- Mevr. Dr. Ir. J. (Jenny) T. van der Steen, universitair hoofddocent, LUMC, Leiden en senior onderzoeker, Radboudumc, Nijmegen; persoonlijke titel
- Drs. VCJ (Vera) van Stek-Smits, neuropsycholoog-gezondheidszorgpsycholoog, Basalt Revalidatie HMC Westeinde, Den Haag, NIP
- Mevr. Prof. Dr. M. (Meike) Vernooij, radioloog, Erasmus Medisch Centrum, Rotterdam; NVvR
- Dhr. Dr. E.G.B. (Jort) Vijverberg, neuroloog, AmsterdamUMC, Amsterdam, NVN
- Mevr. Dr. M.A. (Marjolein) Wijngaarden, internist, Leids Universitair Medisch Centrum, Leiden, Leiden; NIV
Met ondersteuning van:
- Mevr. Dr. C.T.J. (Charlotte) Michels, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. Dr. L.C. (Lotte) Houtepen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. Drs. L.C. (Laura) van Wijngaarden, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterstuurgroepleden en actief betrokken expertisegroepsleden (fungerend als schrijver en/of meelezer bij tenminste één van de geprioriteerde richtlijnmodules) hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een richtlijnmodule worden wijzigingen in belangen aan de projectleider doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase. Een overzicht van de belangen van de clusterleden en betrokken expertisegroepsleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep: Gemelde (neven)functies en belangen stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Olde Rikkert* |
Hoogleraar Geriatrie, Radboudumc, Nijmegen |
Hoofdredacteur Nederlands Tijdschrift voor Geneeskunde |
Geen; uitsluitend ZonMw gefinancierd onderzoek dat overheidsbelang centraal stelt. Sinds 2017 geen farma-onderzoek meer. |
Geen restrictie |
|
Absalom |
Hoogleraar Anesthesiologie, UMCG, Groningen |
Consultancy werkzaamheden (betaald, alle betalingen aan UMCG) 6. Consultancy werk voor Becton Dickinson (Eysins, Switzerland) en Terumo (Tokyo, Japan) – technische advies over spuitpompen. Niet gerelateerd aan dementie/ MCI/ delier. |
Extern gefinancierd onderzoeken, maar financier heeft geen belangen bij de richtlijn. * Rigel Pharmaceuticals (San Francisco, USA) (PAST) * The Medicines Company (Parsippany, NJ, USA) (PAST) |
Geen restricties, omdat adviseurswerk niet gerelateerd is aan de afbakening van het cluster |
|
De Bresser |
- Neuroradioloog 1.0fte, LUMC, Leiden |
Geen |
Mijn onderzoek wordt mede gesponsord door Alzheimer Nederland. Deze financier heeft geen belang bij bepaalde uitkomsten van de richtlijn. |
Geen restrictie |
|
Lambregts |
Medewerker belangenbehartiging bij Alzheimer Nederland |
Geen |
Geen |
Geen restrictie |
|
Lampe |
Psychiater, OLVG Ziekenhuis, Amsterdam |
Geen |
Geen |
Geen restrictie |
|
Richard |
Neuroloog (1.0fte) Radboudumc, Nijmegen |
- Neuroloog-onderzoeker AmsterdamUMC, locatie AMC, gastvrijheidsaanstelling. |
Geen, uitsluitend onderzoek financiering van non-profit instellingen (e.g. ZonMw, Europese Commissie). |
Geen restrictie |
|
Teunissen |
Hoofd Neurochemisch laboratorium, Afdeling Klinische Chemie, AmsterdamUMC, locatie VUmc, Amsterdam |
*Adviseur voor educatief blad: Mednet Neurologie (betaald). * Alle betalingen zijn aan het AmsterdamUMC. |
Onderzoeksubsidies zijn ontvangen van European Commission (Marie Curie International Training Network, JPND), Health Holland, ZonMW, Alzheimer Drug Discovery Foundation, The Selfridges Group Foundation, Alzheimer Netherlands, Alzheimer Association, Innovative Medicines Initiatives 3TR, EPND, JPND, National MS Society, ABOARD, TAP-dementia. |
Geen restrictie |
|
Van Munster |
* Hoogleraar Interne Geneeskunde, Ouderengeneeskunde/Geriatrie, UMCG, Groningen. *Plaatsvervangend opleider Geriatrie, UMCG, Groningen. |
* 2020 – heden Voorzitter Alzheimer Centrum Groningen (alle functies zijn onbetaald) |
*2022 ZONMw: Young Onset Dementia- INCLUDED: Advance care planning. 2022 ZEGG/ZONMw: "The impact of a comprehensive geriatric assessment including advance care planning in acutely hospitalized frail patients with cognitive disorders: the GOA” study" |
Geen restrictie |
|
Verhagen |
Orthopedisch chirurg/opleider in Tergooi MC |
Geen |
Geen |
Geen restrictie |
Clusterexpertisegroep: Gemelde (neven)functies en belangen expertisegroep
Richtlijn Delier bij volwassenen en ouderen: Module ‘Alcoholonthoudingsdelirium’
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Groeneveld |
Verpleegkundig consulent geriatrie (16 uur) |
EBP scholing en borging ziekenhuisbreed vanuit KIPZ subsidie (2u per week) |
Extern gefinancieerd onderzoek: * Catharina onderzoeksfonds: Prestatie en acceptatie van een predictiemodel voor vallen in het ziekenhuis (rol als projectleider) |
Geen restrictie |
|
Lampe |
Psychiater, OLVG Ziekenhuis, Amsterdam |
Geen |
Geen |
Geen restrictie |
|
Schoonenboom |
Neuroloog, Spaarnegasthuis, Haarlem |
*NVN werkroep cognitieve neurologie *Principal investigator Spaarne Gasthuis (Maria Stichting) *PRECODE advies wetenshap *NGN wetenschapscommissie |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van relevante patiëntenorganisaties aan de need-for-update en/of prioritering. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijnmodule is tevens ter commentaar voorgelegd aan alle relevante patiëntenorganisaties in de stuur- en expertisegroep (zie ‘Samenstelling cluster’ onder ‘Verantwoording’) en aan alle patiëntenorganisaties die niet deelnemen aan de stuur- en expertisegroep, maar wel hebben deelgenomen aan de need-for-update (zie ‘Need-for-update’ onder ‘Verantwoording’). De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wkkgz een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module ‘Alcoholonthoudingsdelirium’ |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase en prioriteringsfase (februari, 2023) inventariseerde het cluster de geldigheid van de richtlijnmodules binnen het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd. Per richtlijnmodule is aangegeven of deze geldig is, herzien moet worden, kan vervallen of moet worden samengevoegd. Ook was er de mogelijkheid om nieuwe onderwerpen aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De richtlijnmodules waarbij door één of meerdere partijen werd aangegeven herzien te worden, werden doorgezet naar de prioriteringsronde. Ook suggesties voor nieuwe richtlijnmodules werden doorgezet naar de prioriteringsronde. Afgevaardigden vanuit de partijen in de stuur- en expertisegroep werden gevraagd om te prioriteren (zie ‘Samenstelling cluster’ onder ‘Verantwoording’). Hiervoor werd de RE-weighted Priority-Setting (REPS) – tool gebruikt. De uitkomsten (ranklijst) werd gebruikt als uitgangspunt voor de discussie. Voor de geprioriteerde richtlijnmodules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd indien mogelijk gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
Tabel 6. Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in een richtlijnmodule volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 7. Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de richtlijnmodule Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd voorgelegd aan alle partijen die benaderd zijn voor de need-for-update fase. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd ter autorisatie of goedkeuring voorgelegd aan de partijen die beschreven staan bij ‘Initiatief en autorisatie’ onder ‘Verantwoording’.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.