Herkenning van patiënten die baat hebben bij een multidisciplinaire beoordeling
Uitgangsvraag
Hoe identificeer je patiënten die mogelijk gebaat zijn bij een multidisciplinaire beoordeling?
Aanbeveling
Aanbeveling-1
Identificeer in de spreekkamer patiënten die gebaat zouden zijn bij een MDB, door alert te zijn op signalen die een uiting kunnen zijn van fragmentatie van zorg én door actief na te gaan of de geleverde zorg voldoet aan de principes van Passende zorg. Vraag hierbij expliciet of er problemen worden ervaren in de coördinatie van zorg door de verschillende behandelaren
Let op een direct of indirect signaal van de patiënt en/of naasten (bijvoorbeeld: directe vraag voor betere afstemming van zorg, patiënt die het overzicht kwijt is, verminderde therapietrouw).
Let vooral op tekenen bij patiënten met medische complexiteit (o.a. bepaald door aantal chronische ziekten en aantal betrokken zorginstellingen) én complexiteit door patiëntgebonden factoren (o.a. lage gezondheidsvaardigheden, cognitieve of verstandelijke beperking, socio-economische karakteristieken)
Wees ook alert op onvoldoende afstemming binnen de volgende categorieën:
- Medisch inhoudelijk (mogelijke signalen: tegenstrijdige adviezen in de behandelingen, negatieve zorguitkomsten);
- Mogelijkheden patiënt (mogelijke signalen: behandelplannen die niet aansluiten bij de prognose van de patiënt of niet verenigbaar zijn in een tijdspad);
- Taak en rolverdeling (mogelijke signalen: meerdere behandelaren voor hetzelfde probleem, afwezigheid van afspraken met betrekking tot regieondersteuning of aanspreekpunt).
Aanbeveling-2
Voor het data gedreven identificeren op ziekenhuisniveau van patiënten die gebaat zouden zijn bij een MDB is nog geen eenduidige strategie. Enkele handvatten om hiermee te beginnen zijn:
- Maak gebruik van eigen, lokale EPD-data die laagdrempelig beschikbaar is bij het gebruik van drempelwaarden of een predictiemodel.
- Kies bij voorkeur voor een voorspelde uitkomst of drempelwaarde over meerdere jaren.
- Combineer in het geval van drempelwaarden waar mogelijk verschillende dimensies om tot de meest complexe populatie te komen waar actie op kan worden ondernomen, bijvoorbeeld:
- Medisch inhoudelijk (e.g. X aantal betrokken medisch specialisten, X aantal aandoeningen, X aantal geneesmiddelen); en/of
- Zorggebruik volume (e.g. X aantal polikliniek bezoeken in 1 jaar, X aantal SEH bezoeken in 1 jaar); en/of
- Zorggebruik kosten (e.g. behoren tot de top-X% van de kostenpiramide gedurende enkele jaren.
- Combineer een data gedreven aanpak altijd met een vragenlijst aan de patiënt, klinische beoordeling of overleg met de huisarts om vast te stellen of de geïdentificeerde patiënt daadwerkelijk baat zou hebben bij een MDB.
Overwegingen
Vanuit het adviesrapport ’Multimorbiditeit en Regie in het ziekenhuis’ is gebleken dat regieondersteuning gewenst is bij patiënten met medische complexiteit (o.a. bepaald door aantal chronische ziekten) én complexiteit door patiëntgebonden factoren (o.a. bepaald door gezondheidsvaardigheden, cognitie, socio-economische karakteristieken). Het opstellen van een overkoepelende en afgestemde behandeling is een belangrijk onderdeel van regieondersteuning. Een MDB is een methode om deze overkoepelende en afgestemde behandeling te bereiken. De werkgroep acht het aannemelijk dat de patiënten die baat hebben bij een MDB aan dezelfde criteria voldoen als de patiënten die baat hebben bij regieondersteuning.
De uitdaging is om aanvullende criteria op te stellen waardoor gedifferentieerd kan worden tussen de verschillende bouwstenen van regieondersteuning, en daarmee de groep die specifiek baat heeft bij een MDB te identificeren. Vanuit de literatuur zijn er geen beschikbare instrumenten of eenduidige methoden om deze patiëntengroep te identificeren. Medisch specialisten die zorg dragen voor patiënten met meerdere chronische aandoeningen onderstrepen de wens voor heldere criteria, maar herkennen ook de complexiteit hiervan (zie Bijlage B).
In de literatuur zien we verschillende methoden terug om een patiëntengroep te identificeren waarbij een MDB van mogelijk toegevoegde waarde kan zijn (zie Bijlage C). Het merendeel van de onderzoeken richt zich op concordante multimorbiditeit, of een index ziekte met comorbide depressie. De onderzoeken die patiënten met discordante multimorbiditeit includeren, houden óf medische complexiteit aan als criterium (aantal chronische ziekten), óf negatieve zorguitkomsten (hoog zorggebruik, falen van behandeling), óf een meetinstrument voor kwetsbaarheid. Eén onderzoek combineert het zorggebruik met een vraag aan patiënten: “Zou u willen dat we u helpen om SEH-presentaties en opnames te voorkomen?”
De werkgroep maakt onderscheid in twee manieren om patiënten te identificeren die baat zouden kunnen hebben bij een MDB: 1) door alert te zijn op signalen in de spreekkamer, en 2) door proactief op zoek te gaan naar patiënten op ziekenhuispopulatieniveau door gebruik te maken van beschikbare data. Beiden zullen verder worden toegelicht in dit hoofdstuk.
Herkennen van patiënten op individueel niveau: signalen in de spreekkamer
Met behulp van focusgroepen hebben we de praktijk van multidisciplinaire afstemming van zorg uitgebreid in kaart gebracht (zie Bijlage B). De aanwezige behandelaren van patiënten met meerdere chronische aandoeningen benadrukten het belang om ruimte te laten voor het ‘onderbuikgevoel’ van behandelaren om de juiste patiënten te identificeren. Dit zien we ook terug bij de initiatiefnemers van de best practices (zie Bijlage D). Het toepassen van intuïtie van behandelaren in de zorg is niet nieuw. Denk bijvoorbeeld aan het ‘niet pluis’-gevoel (gevoel bij de eerste blik op een patiënt: klopt dit of klopt dit niet) of de surprise question (Ben ik verbaasd als de patiënt binnen een jaar komt te overlijden?). Mogelijk is hier ook ruimte voor bij de patiënt met multimorbiditeit: het gevoel en/of ervaring dat de verschillende behandelaren langs elkaar heen werken, onvoldoende afstemmen met elkaar en met de patiënt, en dat dit negatieve gevolgen heeft. Ook voor verpleegkundigen, verpleegkundig specialist (VS) en physician assistants (PA) en ziekenhuisartsen is een belangrijke rol weggelegd in het signaleren. Zij staan vaak dicht bij de patiënt en zijn soms een laagdrempeligere gesprekspartner voor patiënten en naasten.
De werkgroep denkt dat de patiënt en diens naasten ook een belangrijke rol kunnen spelen in het signaleren/aangeven van een behoefte aan een MDB. Het overzicht kwijtraken en het ervaren van een gebrek aan communicatie tussen behandelaren zijn cruciale signalen dat de behandeling onvoldoende afgestemd wordt. De werkgroep stelt voor hier actief naar te vragen in de spreekkamer, en niet gebruik te maken van de nu bestaande screeningsinstrumenten voor, bijvoorbeeld, kwetsbaarheid. Kwetsbaarheid en of ongewenst zorggebruik kunnen een indicatie zijn voor potentieel een onderliggend probleem in coördinatie, maar vindt de werkgroep onvoldoende specifiek.
Tot slot moet ook de eerste lijn de noodzaak voor een MDB kunnen signaleren. Uit een focusgroep met huisartsen (zie Bijlage E) kwam naar voren dat zij een belangrijke rol voor zichzelf weggelegd zien in het herkennen van de juiste groep patiënten.
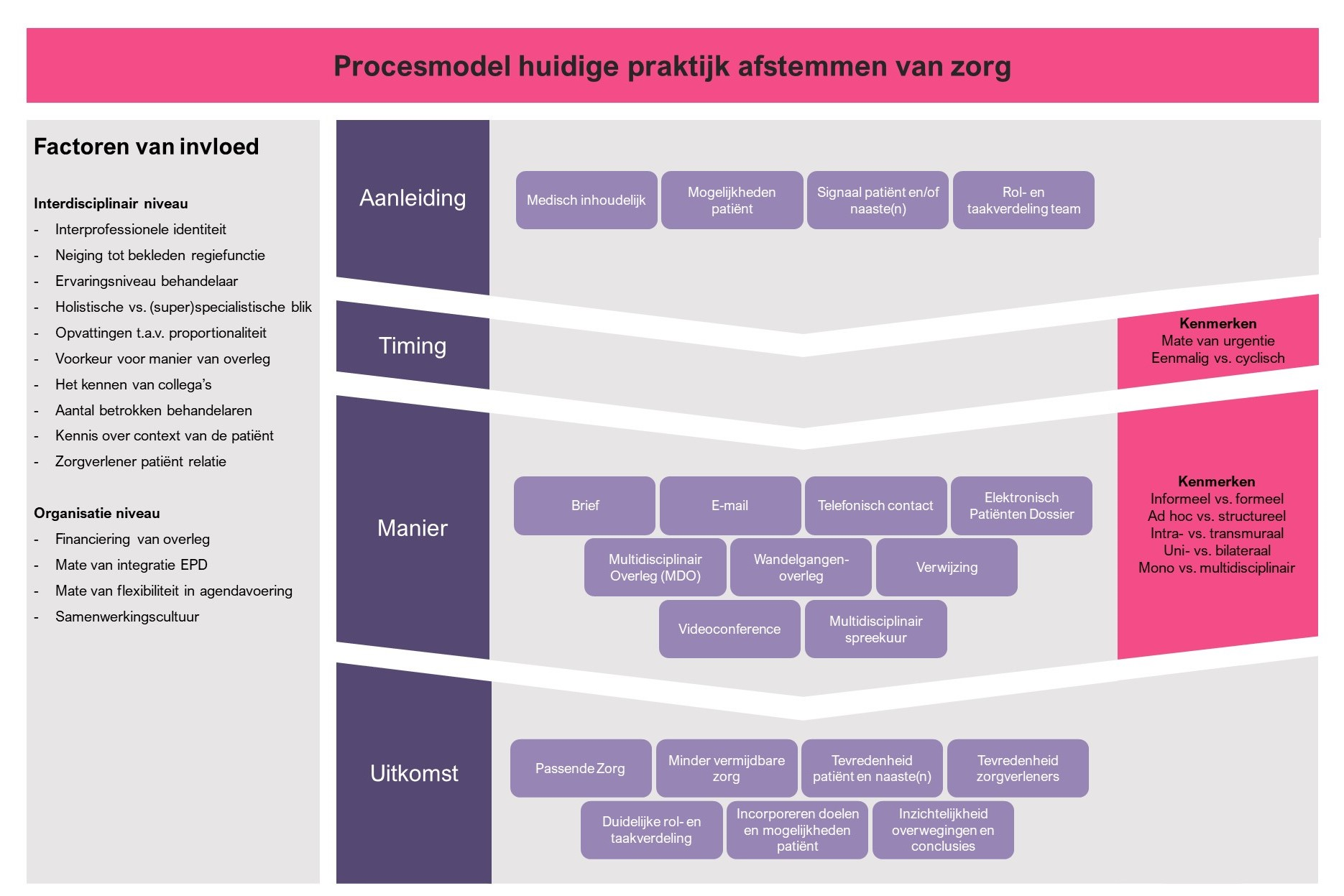
Aan de hand van de focusgroepen heeft de werkgroep een procesmodel opgesteld (Figuur 2) om de verschillende aanleidingen om afstemming te zoeken te illustreren. Deze verschillende aanleidingen zijn allen het gevolg van fragmentatie van zorg. Er zijn regelmatig meerdere aanleidingen tegelijk en aanleidingen kunnen overlappend zijn. Fragmentatie van zorg betekent voor de patiënt met meerdere chronische aandoeningen dat de behandelingen of diagnostiek met elkaar interfereren, of met het biopsychosociaal functioneren.
Figuur 2 geeft ook weer dat er vele factoren van invloed zijn, zowel op interdisciplinair- als organisatieniveau, die bepalen of een zorgverlener multidisciplinaire afstemming zoekt. Denk aan de neiging van een zorgverlener tot het bekleden van een regiefunctie, het kennen van collega’s, eigen opvattingen ten aanzien van proportionaliteit van zorg, alsook de mate van flexibiliteit met betrekking tot agendavoering en cultuur rondom samenwerken. Ook speelt interprofessionele identiteit, ofwel hoe belangrijk iemand interprofessionele samenwerking vindt en in hoeverre iemand geïnteresseerd is in andere disciplines, een belangrijke rol omdat een sterke interprofessionele identiteit leidt tot meer bereidheid om samen te werken (17). Door een MDB structureel vorm te geven, streeft de werkgroep ernaar om de mate van afhankelijkheid van de individuele zorgverlener (de praktijkvariatie) te reduceren en alle betrokken zorgverleners te activeren om alert te zijn op de signalen in de spreekkamer. De signalen in de spreekkamer kunnen onderverdeeld worden in de volgende groepen: “medisch-inhoudelijk”, “mogelijkheden patiënt”, “signaal patiënt en naasten”, en “rol- en taakverdeling zorgverleners”. Tot slot moet er in de spreekkamer aandacht worden besteed aan de vraag of de zorg passend is.
Medisch inhoudelijk
Een van de aanleidingen voor het zoeken van afstemming voor de patiënt met meerdere chronische aandoeningen is het afstemmen op medisch inhoudelijk gebied. Er kunnen vragen bestaan buiten de eigen expertise, of het (toekomstig) handelen van de behandelaar heeft invloed op een andere lopende of geplande behandeling of diagnostisch proces. Het volgen van ziekte-specifieke richtlijnen door individuele behandelaren zonder onderling overleg is vaak ontoereikend, omdat deze richtlijnen elkaar in het geval van multimorbiditeit kunnen tegenspreken en dus leiden tot tegenstrijdige adviezen.
Factoren die bijdragen aan de complexiteit hiervan zijn de hoeveelheid chronische ziekten en de hoeveelheid betrokken behandelaren. Daarnaast kan discordante multimorbiditeit ook een complicerende factor zijn, mochten de verschillende specialismen elkaar weinig treffen in de dagelijkse praktijk en er geen zorgpaden op ingericht zijn.
Een manier om de patiënten te identificeren die baat zouden kunnen hebben bij MDB, is om alert te zijn op de negatieve gevolgen samenhangend met onvoldoende onderlinge medisch inhoudelijke afstemming. Denk hier bijvoorbeeld aan:
- Signalen van mogelijke farmacotherapie gerelateerde problemen zoals een recente val door onbekende oorzaak of verminderde therapietrouw;
- Tegenstrijdige adviezen in de behandelingen;
- Behandelingen die niet verenigbaar zijn in een tijdspad of bij elkaar te veel zijn;
- Negatieve zorguitkomsten zoals veel polikliniekbezoeken, SEH-presentaties, (her)opnames en complicaties;
- Onduidelijkheden over de behandeling, ook wanneer deze bijvoorbeeld in een ander ziekenhuis gegeven wordt;
- Patiënten met verschillende vormen van zorg in de thuissituatie; meerdere betrokken organisaties.
Mogelijkheden patiënt
Een andere aanleiding voor het zoeken van overleg is het afstemmen van zorg op de individuele patiënt. Iedere patiënt heeft eigen doelen, voorkeuren en mogelijkheden. Om deze goed te incorporeren in een behandelplan is het nodig om met elkaar te overleggen. Onder mogelijkheden wordt ook proportionaliteit van zorg verstaan, en wat nog haalbaar is binnen de context van de patiënt. Het kan hierbij goed zijn om te her-evalueren welke zorg passend en is en welke zorg waar moet plaatsvinden.
Het is belangrijk om alert te zijn op patiëntgebonden factoren die goede afstemming vereisen, zoals:
- Kwetsbaarheid;
- Cognitieve stoornissen;
- Psychiatrische comorbiditeit;
- Lage gezondheidsvaardigheden;
- Aanwezigheid verstandelijke beperking;
- Beperkte mobiliteit waardoor een bezoek aan het ziekenhuis een extra belasting is.
Ook hier is het belangrijk om alert te zijn op de negatieve gevolgen die onvoldoende afstemming met zich mee kan brengen, en dit als aanleiding te zien voor het overwegen van een MDB. Denk hierbij aan:
- Behandelplannen die niet aan lijken te sluiten bij de patiënt of de prognose van de patiënt;
- Behandelingen die niet verenigbaar zijn in een tijdspad of bij elkaar te veel zijn;
- Beperkte therapietrouw;
- Polyfarmacie bij een voorkeur van de patiënt voor zo min mogelijk medicatie.
Rol- en taakverdeling zorgverleners
Onduidelijkheid omtrent wie de regieondersteuner is, of de rolverdeling onder de verschillende behandelaren kan ook een aanleiding zijn om overleg te zoeken. Bij onvoldoende afstemming van onderlinge taken kan het zijn dat meerdere behandelaren zich ontfermen over hetzelfde probleem, of dat er een deel van de zorg blijft liggen door aannames dat dit onder de verantwoordelijkheid valt van een ander. Het onderling expliciteren van rollen, taken en verwachtingen is hierbij essentieel.
Uit de focusgroep met huisartsen werd een belangrijk probleem onderstreept waarbij sommige patiënten onderling worden doorverwezen, of terug worden verwezen naar de eerste lijn, met problematiek waarvan niemand zich probleemeigenaar voelt. Een MDB waarbij wordt afgesproken wie welke diagnostiek doet en er een lang termijnplan wordt geschetst zou hierbij helpend zijn voor de eerste lijn.
Wees alert op:
- Meerdere behandelaren en/of betrokken organisaties voor hetzelfde probleem;
- Overlappende problematiek;
- Zorg waar wel behoefte aan is of een noodzaak voor is, waar niemand zich over ontfermt;
- Onderling doorverwijzen of terugverwijzen naar de eerste lijn;
- Onduidelijke rol- en taakverdeling tussen de eerste en tweede lijn;
- Afwezigheid van afspraken rondom regieondersteuner en/of aanspreekpunt.
Signaal patiënt en/of naasten
Bovenstaande aanleidingen spelen veelal onder de betrokken zorgverleners. Een signaal vanuit de patiënt en/of naasten kan ook een aanleiding zijn om afstemming te zoeken. In contact met de zorgverlener kan de patiënt (direct of indirect) aangeven een gebrek aan afstemming van zorg, gebrek aan overzicht, of gebrek aan onderlinge communicatie tussen zorgverleners te ervaren. Onvoldoende afstemming van zorg kan ook leiden tot een moeizame arts-patiënt relatie, vaak als gevolg van tegenstrijdige communicatie door verschillende zorgverleners. Dat kan ook een belangrijk indirect signaal zijn om onderling te overleggen met als doel zowel het behandelplan als de communicatie naar de patiënt toe te stroomlijnen. Tot slot kan het ook zo zijn dat de patiënt of diens naaste(n) ervaart dat er op medisch inhoudelijk vlak, op het gebied van mogelijkheden van de patiënt, of in de rol- en taakverdeling problemen spelen.
Wees alert op:
- De vraag vanuit de patiënt of naasten om betere afstemming van zorg tussen de verschillende behandelaren;
- De patiënt die het overzicht van de verschillende behandelingen kwijt is;
- Verminderde therapietrouw of het niet nakomen van afspraken waaronder herhaalde no shows op de polikliniek;
- Moeizame arts-patiënt relatie waar tegenstrijdige communicatie aan ten grondslag ligt;
- Patiënt die met hulpvragen blijft komen;
- Mantelzorger die geen grip krijgt op de zorg en behandelingen of afwezigheid van ondersteuning uit eigen netwerk bij een patiënt die zelf onvoldoende bekwaam is zorg te coördineren
Passende zorg
Om in de toekomst toegankelijke en betaalbare zorg van hoge kwaliteit te kunnen blijven bieden aan patiënten met meerdere chronische aandoeningen, is het noodzakelijk om bij bovenstaande aanleidingen en signalen in de spreekkamer ook de principes van Passende zorg in het achterhoofd te houden.
De verantwoordelijkheid om te evalueren of de zorg nog passend is, ligt bij alle behandelaren. Passende zorg is gestoeld op de volgende principes:
- Waarde gedreven zorg: doelmatige inzet van effectieve zorg, met als doel relatieve winst in gezondheid en functioneren tegen een redelijke prijs;
- Zorg komt samen met -en gezamenlijk rondom- de patiënt tot stand: de functioneringsvraag staat centraal in het Samen Beslissen, met multidisciplinaire expertise en bezien in de sociale context van de patiënt;
- Juiste zorg op de juiste plek: zorg voorkomen, verplaatsen en rondom mensen organiseren, en waar mogelijk vervangen door slimme zorg en e-health;
- Focus op gezondheid in plaats van ziekte: de eigen ervaren gezondheid en functioneren, en het voorkomen van ziekte en zwaardere zorg.
Dit kan betekenen dat er wellicht geen problematiek in coördinatie ervaren wordt, maar door de bril van Passende zorg er wél kansen liggen voor het optimaliseren van zorg. Denk bijvoorbeeld aan een patiënt op hogere leeftijd die regelmatig in het ziekenhuis komt voor enkel routinematige controles bij verschillende behandelaren. Met een MDB kan je tot een efficiënter en doelmatiger zorgplan komen.
Herkennen van patiënten op populatieniveau: signalen in de data
Het in het ziekenhuis op groepsniveau identificeren van patiënten die baat hebben bij een MDB is een uitdaging omdat er meerdere aanleidingen kunnen zijn voor een MDB. De doelpopulatie is dusdanig complex dat die zich maar moeilijk in enkele beslisregels laat vangen. In het definiëren op populatieniveau kan gekeken worden naar afgeleiden van de vier verschillende aanleidingen voor een MDB: medisch inhoudelijk, volume of frequentie van zorggebruik, kosten van zorggebruik en de ‘zinnigheid’ van zorggebruik. Van deze afgeleiden kan op twee manieren gebruik worden gemaakt: door middel van drempelwaarden of predictiemodellen (Tabel 2). Beide manieren hebben voor- en nadelen en de werkgroep kan op grond van literatuur geen voorkeur aan een van beide werkwijzen toekennen.
Datagedreven identificatie van een dusdanig complexe populatie zal nooit volledig zijn: er is geen drempelwaarde of predictiemodel dat perfect aan kan wijzen welke patiënten het meeste baat hebben bij een MDB. De werkgroep pleit dan ook voor een hybride identificatie strategie.
Drempelwaarden
Onder drempelwaarden verstaan we een getalsmatige grens op het gebied van één van de genoemde aanleidingen waarboven je een gebrek aan coördinatie kan verwachten en patiënten derhalve baat zouden kunnen hebben bij een MDB. Aangezien de aanleiding door meerdere factoren bepaald wordt en de literatuur hier niet eenduidig over is, kunnen we hier geen harde getallen als meest geschikt aanwijzen. Het voordeel van drempelwaarden is dat het eenvoudig inzicht kan geven in de omvang van de populatie en er daarmee op grond van haalbaarheid van de populatie een specifieke afkap waarde kan worden gekozen. Hierbij valt te denken aan het X aantal behandelaren of aantal diagnoses per jaar, een X aantal polikliniek- of SEH-bezoeken per jaar of de top-10% patiënten die verantwoordelijk waren voor de meeste zorgkosten in het afgelopen jaar. Er kan ook een combinatie gemaakt worden van meerdere dimensies. Drempelwaarden zijn, afhankelijk van de datastructuur in het desbetreffende ziekenhuis, relatief makkelijk in gebruik te nemen en vragen geen specifieke validatie vooraf.
Predictiemodellen
Door de grote hoeveelheid data die op verschillende plekken in het zorgsysteem over patiënten verzameld wordt is er een trend om gebruik te maken van predictiemodellering voor de identificatie van een doelpopulatie. Predictiemodellen maken gebruik van meer factoren dan een enkelvoudige drempelwaarde en moeten vooraf gevalideerd worden in de specifieke populatie waarin het model gebruikt gaat worden. Variabelen die regelmatig worden meegenomen zijn: leeftijd, geslacht, sociaaleconomische variabelen (woonsituatie, type verzekering, inkomen), medisch inhoudelijke variabelen (diagnoses, multimorbiditeitsscore, aantal medicamenten) en zelf gerapporteerde variabelen (zelf gerapporteerde gezondheid) (18–20). In Nederland zijn er al een aantal ziekenhuizen die een predictiemodel ontwikkeld hebben. De keuze voor een predictiemodel hangt samen met de beschikbare data in een ziekenhuis, de gewenste uitkomst en de tijdsspanne waarover voorspeld kan worden. Hoewel modellen die ontwikkeld zijn op de data van één ziekenhuis niet zondermeer in een ander ziekenhuis toegepast kunnen worden, kunnen we wel van elkaar leren. Om gebruik te maken van de ervaring die hiermee is opgedaan kunt u informatie vinden op het platform voor multimorbiditeit (Nederlands Platform voor Multimorbiditeit | (multimorbidity.nl)).
Het is mogelijk om te schuiven met de risicodrempel van het predictiemodel en daarmee met de grootte van de voorlopige set van de doelpopulatie (21,22).
Databronnen en tijdsspanne voorspelde uitkomst
Er zijn verschillende databronnen om variabelen uit af te leiden zoals declaratiegegevens van verzekeraars, vragenlijsten of het EPD. Welke databron tot je beschikking staat beïnvloedt in grote mate welke variabelen je in kaart kunt brengen en daarmee welk drempelwaarden of predictiemodel je kunt toepassen. Eigen, lokale EPD-data zijn het meest laagdrempelig beschikbaar voor een ziekenhuisorganisatie voor het gebruik in drempelwaarden of een predictiemodel. Tabel 2 toont enkele voorbeelden van databronnen.
Wanneer een MDB zich richt op patiënten met multimorbiditeit en fragmentatie van zorg, gaat het vaak om patiënten die meerdere jaren veel zorg gebruiken. Veel bestaande prognostische predictiemodellen op het gebied van multimorbiditeit, veelgebruik of zorgkosten hebben echter een korte tijdsspanne waarbinnen de uitkomst wordt voorspeld (bijvoorbeeld hoog zorggebruik in komende 12 maanden). Voor veel van de patiënten die veel zorg nodig hebben is die behoefte echter van relatief korte duur (i.e. episodisch) (23). Inzet van een drempelwaarde of predictiemodel als onderdeel van een identificatie strategie voor een MDB in het ziekenhuis zal daarom vooral gebaat zijn bij een voorspelde uitkomst die over meerdere jaren aanhoudt (e.g. komende drie jaar in de top-10% zorggebruik) of drempelwaarden die meerdere jaren beslaan (e.g. meer dan twee jaar meer dan zeven verschillende betrokken specialismen) (18,19).
Hybride identificatie strategie
In de literatuur wordt bij de inzet van predictiemodellering als instrument voor de identificatie van een doelpopulatie voor zorgcoördinatie, steeds vaker geopteerd voor een hybride strategie (24). Hierin wordt een datagedreven deel gecombineerd met een klinische beoordeling, waarbij beiden als eerste kunnen worden ingezet en daarmee de ‘poortwachter’ zijn. Vaak wordt echter gekozen om te starten met het datagedreven deel als ‘eerste zeef’. Hierbij wordt een prognostisch model of drempelwaarde toegepast op een medisch informatiesysteem (zoals het lokale EPD) en daarmee een voorlopige set van de doelpopulatie geïdentificeerd.
In tweede instantie wordt dan klinisch beoordeeld of een geïdentificeerde patiënt baat zou hebben bij interventie: het toetsen van de signalen uit de spreekkamer. In de literatuur varieert dit klinische deel van de identificatiestrategie van één vraag aan de patiënt (Heeft u interesse in deelname aan de interventie?) tot een zeer uitgebreide beoordeling door meerdere zorgverleners (18,25). Het voordeel van een hybride strategie is dat je gebruik maakt van de sterke punten van predictiemodellering of drempelwaarden én de klinische blik om sneller tot een meer doeltreffende populatie te komen. Het nadeel is dat het complexer kan zijn om te implementeren, zeker bij beperkte ondersteuning op het gebied van datamanagement in het ziekenhuis.
Tabel 2. Drempelwaarden en predictiemodellen binnen de verschillende dimensies van identificatie van MDB-patiënten
|
|
Medisch inhoudelijk |
Volume zorggebruik |
Kosten zorggebruik |
|
Potentiële databron |
EPD, vragenlijsten |
EPD, lokaal datawarehouse, claims data, vragenlijsten |
EPD, lokaal datawarehouse, claims data |
|
Nadelen |
Niet iedereen met deze parameters heeft ook baat bij een MDB. Verdere stratificatie nodig om doelpopulatie af te kaderen en bruikbaar te houden.
Mogelijk worden patiënten gemist die wél fragmentatie ervaren. |
Hoog zorggebruik is altijd een proxy voor fragmentatie. Op zichzelf helpt het je niet verder met achterhalen óf en zo ja welke aanleiding er is tot afstemming van zorg.
In geval van lokale data slechts zicht op deel van het zorggebruik dat binnen eigen centrum plaatsvindt. |
Hoge zorgkosten zijn niet de oorzaak van fragmentatie van zorg en het helpt je niet om te achterhalen óf en zo ja welke aanleiding er is tot afstemming van zorg.
In geval van claims data is realtime identificatie niet mogelijk omdat data vertraagd beschikbaar komt. |
|
Voordelen |
Data grotendeels aanwezig in EPD en in het algemeen stabieler en rijker dan claims data.
Duidelijke klinische aanknopingspunten voor afstemming van zorg. Werkt intuïtiever voor veel zorgverleners. |
In geval van drempelwaarde is frequentie van zorg vaak relatief makkelijk in kaart te brengen.
In geval van claims data omvat het een zo volledig mogelijk beeld van het zorggebruik per patiënt. |
In geval van claims data omvat het een zo volledig mogelijk beeld van de gedeclareerde kosten per patiënt. |
|
Voorbeelden predictiemodellen |
Electronic frailty index (26) |
Predicting Emergency Admissions Over the Next Year (PEONY), QAdmissions, Nederlands model (27–30) |
High Resource User Population Risk Tool (HRUPoRT), Persistent High Utilizer (PHU) model (31–33) |
|
Voorbeelden drempelwaarden |
Aantal diagnoses (bijv. ≥ 3 chronische diagnoses), multimorbiditeitsscore (bijv. Charlson comorbidity score ≥ 3), polyfarmacie (bijv. ≥ 5 medicamenten) (19,34). |
Aantal events per tijdseenheid (bijv. ≥ 12 poliklinische bezoeken in een jaar) (19,34). |
Behoren tot de top-x% van de kostenpiramide voor een bepaalde tijd (bijv. 1 jaar in de top-10% zorgkosten). Totale zorgkosten per tijdseenheid (19,34). |
Onderbouwing
Referenties
- 1. van Oostrom S, Gijsen R, Stirbu I, Korevaar J, Schellevis FG, Picavet S, et al. Toename in chronische ziekten en multimorbiditeit. NTVG [Internet]. 2017 Aug 24 [cited 2023 Mar 21]; Available from: https://www.ntvg.nl/artikelen/toename-chronische-ziekten-en-multimorbiditeit
- 2. Integrated care models: an overview. World Health Organization; 2016.
- 3. Nolte E, Knai C, Hofmarcher M, Conklin A, Erler A, Elissen A, et al. Overcoming fragmentation in health care: chronic care in Austria, Germany and The Netherlands. Health Econ Policy Law. 2012 Jan;7(1):12546.
- 4. Wallace E, Salisbury C, Guthrie B, Lewis C, Fahey T, Smith SM. Managing patients with multimorbidity in primary care. BMJ. 2015 Jan 20;350:h176.
- 5. Rapport Leven met meerdere aandoeningen [Internet]. Patiëntenfederatie Nederland; 2022 Nov p. 55. Available from: https://www.patientenfederatie.nl/downloads/rapporten/1274-rapportage-multimorbiditeit/file
- 6. Basisset MSZ Risicoprofiel 2022-2027. IGJ;
- 7. Multimorbiditeit en regie in het ziekenhuis [Internet]. Richtlijnendatabase; [cited 2023 Mar 21]. Available from: https://richtlijnendatabase.nl/richtlijn/multimorbiditeit_en_regie_in_het_ziekenhuis/startpagina_-_multimorbiditeit_en_regie_in_het_ziekenhuis.html
- 8. Verantwoordelijkheidsverdeling bij samenwerking in de zorg [Internet]. KNMG; 2022. Available from: https://www.knmg.nl/advies-richtlijnen/dossiers/verantwoordelijkheidsverdeling
- 9. Leefstijl bij patiënten met een ernstige psychische aandoening (richtlijn 2015) [Internet]. GGZ Standaarden; 2015. Available from: https://www.ggzstandaarden.nl/richtlijnen/leefstijl-bij-patienten-met-een-ernstige-psychische-aandoening-richtlijn-2015/introductie
- 10. Kwaliteitsstandaard Psychosociale zorg bij somatische aandoeningen [Internet]. WSPZisa; 2019 Nov. Available from: https://richtlijnendatabase.nl/richtlijn/kwaliteitsstandaard_psychosociale_zorg_bij_somatische_aandoeningen/startpagina_-_psychosociale_zorg_bij_somatische_aandoeningen.html
- 11. DE Hert M, Correll CU, Bobes J, Cetkovich-Bakmas M, Cohen D, Asai I, et al. Physical illness in patients with severe mental disorders. I. Prevalence, impact of medications and disparities in health care. World Psychiatry Off J World Psychiatr Assoc WPA. 2011 Feb;10(1):5277.
- 12. Schorr S. Drug safety in patients with psychotic disorders. University of Groningen; 2010.
- 13. van Hasselt FM, Thier CSM, van Rijswijk E, Loonen AJM. Is somatic health screening in patients with severe mental illness of added value? Perspect Psychiatr Care. 2014 Jul;50(3):186-92.
- 14. Osborn DPJ, Nazareth I, King MB. Physical activity, dietary habits and Coronary Heart Disease risk factor knowledge amongst people with severe mental illness: a cross sectional comparative study in primary care. Soc Psychiatry Psychiatr Epidemiol. 2007 Oct;42(10):787-93.
- 15. Oud MJT, Meyboom-de Jong B. Somatic diseases in patients with schizophrenia in general practice: their prevalence and health care. BMC Fam Pract. 2009 May 9;10:32.
- 16. KNMG. Handreiking Verantwoordelijkheidsverdeling bij samenwerking in de zorg [Internet]. 2022. Available from: https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&ved=2ahUKEwiF4pSM-pCCAxVW_7sIHdQ4BpoQFnoECBIQAQ&url=https%3A%2F%2Fwww.knmg.nl%2Fdownload%2Fhandreiking-verantwoordelijkheidsverdeling-bij-samenwerking-in-de-zorg&usg=AOvVaw0lmeGgjWxbXC3GVhsUaVQz&opi=89978449
- 17. Onderzoek Interprofessionale identiteit [Internet]. Federatie Medisch Specialisten; 2021 May. Available from: https://demedischspecialist.nl/sites/default/files/2021-12/fms_factsheet_interprofessionele_identiteit_210x297_def.pdf
- 18. Berkman ND, Chang E, Seibert J, Ali R, Porterfield D, Jiang L, et al. Management of High-Need, High-Cost Patients: A Best Fit Framework Synthesis, Realist Review, and Systematic Review [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2021 [cited 2023 Apr 25]. (AHRQ Comparative Effectiveness Reviews). Available from: http://www.ncbi.nlm.nih.gov/books/NBK575200/
- 19. de Ruijter UW, Kaplan ZLR, Bramer WM, Eijkenaar F, Nieboer D, van der Heide A, et al. Prediction Models for Future High-Need High-Cost Healthcare Use: a Systematic Review. J Gen Intern Med. 2022 May;37(7):176370.
- 20. Wammes JJG, van der Wees PJ, Tanke MAC, Westert GP, Jeurissen PPT. Systematic review of high-cost patients characteristics and healthcare utilisation. BMJ Open. 2018 Sep 8;8(9):e023113.
- 21. Van Calster B, Vickers AJ. Calibration of risk prediction models: impact on decision-analytic performance. Med Decis Mak Int J Soc Med Decis Mak. 2015 Feb;35(2):1629.
- 22. Wynants L, van Smeden M, McLernon DJ, Timmerman D, Steyerberg EW, Van Calster B, et al. Three myths about risk thresholds for prediction models. BMC Med. 2019 Oct 25;17(1):192.
- 23. Johnson TL, Rinehart DJ, Durfee J, Brewer D, Batal H, Blum J, et al. For many patients who use large amounts of health care services, the need is intense yet temporary. Health Aff Proj Hope. 2015 Aug;34(8):1312-9.
- 24. Vogeli C, Spirt J, Brand R, Hsu J, Mohta N, Hong C, et al. Implementing a hybrid approach to select patients for care management: variations across practices. Am J Manag Care. 2016 May;22(5):358-65.
- 25. Davis AC, Osuji TA, Chen J, Lyons LJL, Gould MK. Identifying Populations with Complex Needs: Variation in Approaches Used to Select Complex Patient Populations. Popul Health Manag. 2021 Jun;24(3):393-402.
- 26. Clegg A, Bates C, Young J, Ryan R, Nichols L, Ann Teale E, et al. Development and validation of an electronic frailty index using routine primary care electronic health record data. Age Ageing. 2016 May;45(3):353-60.
- 27. Heins M, Korevaar J, Schellevis F, Rijken M. Identifying multimorbid patients with high care needs - A study based on electronic medical record data. Eur J Gen Pract. 2020 Dec;26(1):189-95.
- 28. Verhoeff M, de Groot J, Burgers JS, van Munster BC. Development and internal validation of prediction models for future hospital care utilization by patients with multimorbidity using electronic health record data. PloS One. 2022;17(3):e0260829.
- 29. Hippisley-Cox J, Coupland C. Predicting risk of emergency admission to hospital using primary care data: derivation and validation of QAdmissions score. BMJ Open. 2013 Aug 19;3(8):e003482.
- 30. Hopman P, Heins MJ, Korevaar JC, Rijken M, Schellevis FG. Health care utilization of patients with multiple chronic diseases in the Netherlands: Differences and underlying factors. Eur J Intern Med. 2016 Nov;35:44-50.
- 31. Rosella LC, Kornas K, Yao Z, Manuel DG, Bornbaum C, Fransoo R, et al. Predicting High Health Care Resource Utilization in a Single-payer Public Health Care System: Development and Validation of the High Resource User Population Risk Tool. Med Care. 2018 Oct;56(10):e61-9.
- 32. Rosella LC, Kornas K, Sarkar J, Fransoo R. External Validation of a Population-Based Prediction Model for High Healthcare Resource Use in Adults. Healthc Basel Switz. 2020 Dec 4;8(4):537.
- 33. Ng SHX, Rahman N, Ang IYH, Sridharan S, Ramachandran S, Wang DD, et al. Characterising and predicting persistent high-cost utilisers in healthcare: a retrospective cohort study in Singapore. BMJ Open. 2020 Jan 6;10(1):e031622.
- 34. Berkman ND, Chang E, Seibert J, Ali R. Characteristics of High-Need, High-Cost Patients?: A "Best-Fit" Framework Synthesis. Ann Intern Med. 2022 Dec;175(12):1728-41.
- 35. Multimorbidity: clinical assessment and management [Internet]. NICE guideline; 2016 Sep [cited 2023 Mar 21]. Available from: https://www.nice.org.uk/guidance/ng56
- 36. Rijken M, Korevaar J. Goede zorg voor mensen met multimorbiditeit. Nivel; 2021.
- 37. Boyd C, Smith CD, Masoudi FA, Blaum CS, Dodson JA, Green AR, et al. Decision Making for Older Adults With Multiple Chronic Conditions: Executive Summary for the American Geriatrics Society Guiding Principles on the Care of Older Adults With Multimorbidity. J Am Geriatr Soc. 2019 Apr;67(4):665-73.
- 38. Engel GL. The need for a new medical model: a challenge for biomedicine. Science. 1977 Apr 8;196(4286):129-36.
- 39. Comprehensive Geriatric Assessment (CGA) [Internet]. Richtlijnendatabase; 2021. Available from: https://richtlijnendatabase.nl/richtlijn/comprehensive_geriatric_assessment_cga/startpagina_-_comprehensive_geriatric_assessment_cga.html
- 40. Elwyn G, Frosch D, Thomson R, Joseph-Williams N, Lloyd A, Kinnersley P, et al. Shared Decision Making: A Model for Clinical Practice. J Gen Intern Med. 2012 Oct;27(10):1361-7.
- 41. Pel-Littel RE, van de Pol M, de Boer M, Delmee L. Infographic Samen beslissen met kwetsbare ouderen [Internet]. Available from: https://www.zorgvoorbeter.nl/zorgvoorbeter/media/documents/thema/persoonsgerichte-zorg/infographic-samen-beslissen-kwetsbare-ouderen.pdf
- 42. Vermunt NP, Harmsen M, Elwyn G, Westert GP, Burgers JS, Olde Rikkert MG, et al. A three?goal model for patients with multimorbidity: A qualitative approach. Health Expect Int J Public Particip Health Care Health Policy. 2018 Apr;21(2):528-38.
- 43. Fried TR, Tinetti ME, Iannone L, O'Leary JR, Towle V, Van Ness PH. Health Outcome Prioritization as a Tool for Decision Making Among Older Persons With Multiple Chronic Conditions. Arch Intern Med. 2011 Nov 14;171(20):1856-8.
- 44. Handreiking Implementatie Passende zorg [Internet]. Federatie Medisch Specialisten; 2023 Jul p. 50. Available from: https://demedischspecialist.nl/sites/default/files/2023-07/handreiking_implementatie_passende_zorg.pdf
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 08-04-2024
Laatst geautoriseerd : 08-04-2024
Geplande herbeoordeling : 08-04-2028
Algemene gegevens
In samenwerking met: verpleegkundigen & verzorgenden, en patientenfederatie nederland.
De ontwikkeling van deze leidraad werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de leidraad.
Samenstelling werkgroep
Voor het ontwikkelen van de leidraad is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met multimorbiditeit.
Werkgroep
Prof. B.C. (Barbara) van Munster, Nederlandse Internisten Vereniging
Dr. S.K. (Sven) Schiemanck, Nederlandse Vereniging van Revalidatieartsen
I. (Ilse) van Ee, Patiëntenfederatie Nederland
Drs. A.J. (Arend) Arends, Nederlandse Vereniging voor Klinische Geriatrie
Drs. E.M. (Eefje) Meulenberg, Nederlandse Vereniging voor Klinische Geriatrie
N. (Niels) Jongejan, Nederlandse Vereniging voor Cardiologie
Dr. J.E.H. (Jeroen) Ponten, Nederlandse Vereniging voor Heelkunde
Prof. dr. P.M.L.A. (Patricia) van den Bemt, Nederlandse Vereniging van ZiekenhuisApothekers
Prof. dr. I. (Indira) Tendolkar, Nederlandse Vereniging voor Psychiatrie
W.M.E. (Mieke) Bil MANP, Verpleegkundigen & Verzorgenden Nederland
Dr. H. (Henk) Kramer, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
Drs. Y.M. (Yolande) Vermeeren, Nederlandse Internisten Vereniging
Drs. U.W. (Ursula) de Ruijter, persoonlijke titel
Agendaleden
Drs. L. (Lucie) van Iersel, Vereniging van Specialisten Ouderengeneeskunde
Drs. E. (Eline) Okel, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie
Meeleeslid
Prof. Dr. J. (Jako) Burgers, strategisch-medisch adviseur bij de NHG, en werkzaam als huisarts reflecteerde op persoonlijke titel op de leidraad
Met ondersteuning van
Drs. E.A. (Emma) Gans, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Dr. J.F. (Janke) de Groot, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Drs. L.A.M. (Liza) van Mun, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Y. (Yvonne) van Kempen, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Ondernomen actie |
|
* Voorzitter werkgroep Munster, Van |
12/2020 - present Head of Alzheimer Center Groningen (5%)
2021: Voorzitter Commissie Kwetsbare Ouderen 11/2022: internist-geriater |
Onbetaalde nevenwerkzaamheden: 2021 - heden Lid Stuurgroep Richtlijn Cluster cognitieve stoornissen 2021 - heden Voorzitter Nederlands Platform voor multimorbiditeit 2021 - heden Member multimorbidity working group European Federation of Internal Medicine 2020 - heden Board member ‘European Academy of Medicine of Ageing’ 2017 - heden Gemandateerd Lid platform kwaliteit NIV namens kerngroep ouderengeneeskunde 2015 - heden Lid werkgroep wetenschap Nederlandse Vereniging Klinische Geriatrie 2015 - heden Member Multimorbidity Working Group, Guideline International Network 2016 - 2023 Voorzitter (2019 lid) werkgroep kwaliteit en richtlijnen, kerngroep ouderengeneeskunde 2020 - 2021 Afgevaardigde NIV DHFA 2019 - 2021 Expertgroep ‘Aging Academy' 2016 - 2021 Redacteur 'Tijdschrift gerontologie en geriatrie'
2022- heden Voorzitter leidraad multimorbiditeit (NIV) 2021 - heden Voorzitter werkgroep multidisciplinaire beoordeling (NIV) 2018 - 2021 Voorzitter werkgroep 'Regievoering bij multimorbiditeit' (NIV) 2016 - 2019 Voorzitter werkgroep 'shared decision making in behandelbeperkingen' (NIV) 2016 - 2019 Lid landelijke werkgroep 'zorgpad kwetsbare ouderen' (NIV) |
Geen |
Iedereen heeft baat bij de uitkomsten dus ook de directe omgeving |
ZONMw: Young Onset Dementia- INCLUDED: Advance care planning (projectleider)
ZEGG/ZONMw: "The impact of a comprehensive geriatric assessment including advance care planning in acutely hospitalized frail patients with cognitive disorders: the GOAL study" (projectleider)
Innovatiesubsidie ONO: ‘Regieondersteuning bij multimorbiditeit’ (projectleider)
ABOARD: A Personalized Medicine Approach for Alzheimer’s Disease (projectleider van deelproject)
Wetenschapsfonds Gelre Ziekenhuizen: ‘Esophagogastric Cancer in the elderly patient’ (geen projectleider)
Wetenschapsfonds Gelre Ziekenhuizen: ‘Perioperatieve mobiliteit’ (projectleider)
Hersenstichting ‘No guts no glory’ (1 miljoen) (geen projectleider)
ZonMw Wetenschap voor de praktijk: ‘Eigen huis als polikliniek: de ervaren kwaliteit van beeldbel zorg bij kwetsbare ouderen met multi-morbiditeit en hun families’
Methodiekontwikkeling geïntegreerd Richtlijn gebruik bij Multimorbiditeit (geen projectleider)
SKMS: ‘Leidraad multimorbiditeit’ (geen projectleider)
Wetenschapsfonds Gelre Ziekenhuizen: ‘Gezondheidsvaardigheden van patiënten met multimorbiditeit en meerdere betrokken behandelaars in het ziekenhuis’ (projectleider)
Wetenschapsfonds Gelre Ziekenhuizen: 'PREsurgery Thoughts’ (projectleider)
KMS: ‘Leidraad multidisciplinaire beoordeling’ (geen projectleider) |
Regievoering bij multimorbiditeit is een van mijn aandachtsgebieden binnen de zorg en mijn onderzoekslijn. |
Geen |
Geen restricties |
|
Ponten |
Gastro-intestinaal en oncologisch chirurg, Groene Hart Ziekenhuis te Gouda. |
Bariatrisch chirurg, Nederlandse Obesitas Kliniek. |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen restricties |
|
Bemt, van den |
Hoofd Sectie Patiëntenzorg - Klinische Farmacie en Farmacologie - UMCG - fulltime |
Voorzitter bestuur Stichting ANNA (Academisch Netwerk Noordelijke Apotheken) -
Voorzitter redactieraad NPFO (Ned Platform Farmaceutisch Onderzoek) – onbetaald Docentbegeleider Masteropleiding Kwaliteit en veiligheid RadboudUMC/NFU – betaald. Commissie Duurzaamheid NVZA – onbetaald NFU werkgroep Green Deal Duurzame Zorg Medicijnen Werkgroep schoon water UMCG - onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen restricties |
|
Arends |
Klinisch geriater Maasstadziekenhuis; medisch manager geriatrie |
Secretaris DHFA (vacatiegelden) Bestuurslid stichting mentorschap Rotterdam en omstreken (onbetaald). |
Geen |
Geen |
Geen |
Voorzitter NVKG |
Geen |
Geen restricties |
|
Kramer |
Longarts, Martini Ziekenhuis Groningen; 1.0 FTE. |
Lid adviesraad Longfibrose Patiëntenvereniging: medisch inhoudelijk advies omtrent patiëntenzorg en vragen van patiënten; onbetaald. |
Ik heb geen belangen (financieel noch anderszins) bij de deelname en/of de uitkomst van deze werkgroep en/of het advies van de werkgroep. |
Geen |
Geen |
Geen |
Geen |
Geen restricties |
|
Schiemanck |
Revalidatiearts, Spaarne Gasthuis Hoofddorp (sinds 1-2-2023)
|
Zelfstandig revalidatiearts, parttime (Revalidatie Advies), sinds 1-10-23
Lid algemeen bestuur, Vereniging van Revalidatieartsen (VRA) tot 11-2021 (onbetaald) |
Geen |
Geen |
Hermes studie: onderzoek naar een ‘negatieve veer’ ter vermindering van spasticiteitsklachten bij lopen. Financier is Health Holland/ ZonMw/NWOttw. Geen rol als projectleider. |
Geen |
De afdeling revalidatiegeneeskunde LUMC heeft een spreekuur voor ‘bewegingsstoornissen bij multimorbiditeit’ (pas sinds kort op zordomein)
|
Geen restricties |
|
Tendolkar |
Afdelingshoofd Psychiatrie, Radboudumc Hoogleraar psychiatrie. |
Geen |
Geen |
Geen |
Onderzoek: Transcrantiaal Electrical Stimulation as treatment for delirium, financier is ZonMw open competitive. Geen projectleider. Onderzoek: TMS for treatment obsessive-compulsive disorder (OCD): bridging the gap between 1st line treatment and invasive brain surgery. Financier is ZonMw, geen projectleider. |
Geen |
Geen |
Geen restricties |
|
Ee, van |
Adviseur patientenbelang - patientenfederatie.nl - fulltime |
Patient-advocate- psoriasispatiënten Nederland - onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen restricties |
|
Meulenberg |
Geriater ETZ |
Kwaliteitszaken NVKG, (onkosten) vergoeding Commissie Behandeling van multimorbiditeit (NIV), vacatiegelden. |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen restricties |
|
Bil |
Verpleegkundig specialist AGZ, afd. Klinische geriatrie OLVG |
Gastdocent (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen restricties |
|
Jongejan |
PA Ouderengeneeskunde en 'stafarts' Stichting QuaRijn, Doorn, fulltime |
NVVC lid: Congrescommissie, parttime |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen restricties |
|
Vermeeren |
Werkgroep multidisciplinaire beoordeling bij multimorbiditeit |
Lyme centrum Apeldoorn, onderdeel van Gelre ziekenhuizen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen restricties |
|
Ruijter |
Arts-onderzoeker Noordwest Ziekenhuisgroep en Erasmus universitair Medisch centrum (betaald) |
Lid Nederlands Platform voor Multimorbiditeit (onbetaald) Onderzoeksstagiair Coöperatie VGZ (onbetaald) |
Geen |
Geen |
Ja, Erasmus MC Efficiencybeurs Advance Care Planning (ACP) bij multimorbide ouderen en Foreest Wetenschapsbeurs Noordwest Ziekenhuisgroep, High Utilizing Patient Prediction (HUPP) mode |
Een deel van mijn onderzoek richt zich op regieondersteuning voor patiënten die fragmentatie van zorg ervaren. |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland voor het rondetafelgesprek en een afgevaardigde van de Patiëntenfederatie Nederland in de werkgroep. Het verslag hiervan (zie bijlage A) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen en bij het opstellen van de overwegingen.
Gedurende de ontwikkeling van deze leidraad is er een survey van Patiëntenfederatie Nederland en haar leden onder dertienduizend mensen gepubliceerd. Van hen hadden er meer dan zevenduizend twee of meer aandoeningen. Het Onderzoek Leven met Meerdere Aandoeningen geeft onder andere inzichten in de gevolgen van het hebben van meerdere chronische aandoeningen op kwaliteit van leven en mentale gezondheid, de behoefte aan multidisciplinaire samenwerking tussen zorgverleners en regievoering, en of de deelnemers zorg krijgen gericht op individuele aandoeningen of het totaalplaatje. De inzichten uit dit onderzoek zijn meegenomen in de ontwikkeling van deze leidraad.
De leidraad is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz.
Bij de leidraad is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn leidraadhoofdstukken op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Hoofdstuk |
Uitkomst raming |
Toelichting |
|
Hoofdstuk 1 |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Hoofdstuk 2 |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Hoofdstuk 3 |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Hoofdstuk 4 |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
De modules zijn tot stand gekomen door middel van verschillende methoden: literatuursearch, focusgroepen, interviews en rondetafelgesprekken.
Literatuur
Er is door middel van een systematische search op 08-07-2021 gezocht naar nationale en internationale literatuur ten aanzien van de multidisciplinaire beoordeling bij multimorbiditeit bij volwassenen. De zoekvraag was gericht op het vinden van verschillende methoden om een multidisciplinaire beoordeling vorm te geven met meerdere medisch specialisten óf organisaties, waarbij de tweede lijn ten minste betrokken was. De methode en bevindingen van deze systematisch search zijn opgenomen in Bijlage C.
Daarnaast is er uitgebreide inventarisatie gedaan van kwaliteitsdocumenten over het multidisciplinair overleg en samenwerking in de zorg. Via de werkgroep werden verschillende documenten aangeleverd, er werd niet-systematisch gezocht (google), en Webinars (o.a. Oncologienetwerken ‘optimaliseren van het MDO’ bijgewoond.
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling.
Focusgroepen
Behandelaren van patiënten met multimorbiditeit in het ziekenhuis
Er werden 7 focusgroepen gehouden met behandelaren van patiënten met multimorbiditeit in het ziekenhuis. Tijdens deze focusgroepen werd o.a. een recente, lokale casus met multimorbiditeit besproken.
De discussiegids bestond uit drie hoofdvragen:
- Wat is de ervaring van behandelaren m.b.t. de onderlinge afstemming van zorg voor patiënten met multimorbiditeit in het ziekenhuis?
- Wat zijn de gedachtes van behandelaren op de werkdefinitie en doelgroep van een MDB, zoals deze is vormgegeven door de werkgroep?
- Hoe zou je een multidisciplinaire beoordeling kunnen vormgeven in de praktijk?
De focusgroepen werden geanalyseerd volgens de grounded theory methode door E. Gans en U. de Ruijter en de bevindingen staan uitgebreid beschreven in Bijlage B.
Huisartsen
Er werd 1 focusgroep gehouden met huisartsen. Zij waren ook uitgenodigd voor de focusgroepen met behandelaren in de tweede lijn, maar dit bleek niet haalbaar.
De discussiegids bestond uit de volgende hoofdvragen:
- Wat is de mogelijke rol voor de huisarts in een MDB?
- Hoe kunnen we de juiste afstemming met de eerste lijn bewaken (in de context van de MDB)?
De bevindingen van deze focusgroep staan beschreven in Bijlage E.
Daarnaast reflecteerde Prof. Dr. Jako Burgers, huisarts, op de leidraad en zijn overwegingen werden meegenomen.
Identificatie en interviews met best practices
Via de werkgroep werd er een uitvraag gedaan over best practices die raken aan de MDB. Er waren twee voorbeelden: het COBRA-MDO (Amsterdam-UMC) en de Intensieve Samenwerkingsafdeling (Jeroen Bosch Ziekenhuis). Beide initiatieven leveren zorg voor de patiënt met multimorbiditeit op een innovatieve wijze, waar wij leerpunten uit hebben getrokken.
De verslaglegging van de interviews die wij gedaan hebben met vertegenwoordigers van deze initiatieven staan beschreven in Bijlage D.
Interviews met auteurs
Op basis van de systematische literatuursearch die wij verricht hebben, waren er nog twee aanvullende vragen die wij aan alle auteurs wilden stellen:
1. Is it possible to give an estimation of the time investment required for the different elements of your care intervention? [deze vraag werd alleen gesteld wanneer het antwoord niet te vinden was in het artikel]
2. Is the care intervention still in practice today? Why/why not?
Met deze vragen wilden wij meer inzicht krijgen in de belemmerende en bevorderende factoren voor het oprichten van een MDB. De samenvatting van de antwoorden die wij verkregen hebben staan beschreven in Bijlage H.
Rondetafelgesprek met belanghebbende partijen
Het rondetafelgesprek vond plaats met belanghebbende partijen rondom de zorg van patiënten met multimorbiditeit. Het doel was om de conceptleidraad te bespreken en verbeteren en aanpassingen op te halen. Dit gesprek vond plaats nadat de conceptteksten waren geschreven en de werkgroep hiermee akkoord was, maar voordat de commentaarfase werd gestart.
Commentaar- en autorisatiefase
De conceptleidraad werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptleidraad aangepast en definitief vastgesteld door de werkgroep. De definitieve leidraad werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.