Intraveneuze sedativa op de IC
Uitgangsvraag
Welke medicatie kan het beste worden gebruikt voor intraveneuze sedatie bij IC-patiënten?
Aanbeveling
Sedeer patiënten op de IC met propofol of dexmedetomidine*.
Gebruik midazolam alleen als adjuvans of bij specifieke patiëntencategorieën.
Gebruik dexmedetomidine* bij patiënten met een hoog risico op, of met symptomen van een delier.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
1. Propofol versus midazolam
Gekeken naar de conclusies met betrekking tot de cruciale uitkomstmaten ligduur op de IC en mortaliteit is sprake van een klinisch relevant effect, ten gunste van propofol met betrekking tot zowel ligduur op de IC als mortaliteit. De bewijskracht voor het effect is laag door beperkingen van de studies (risico op bias). Bovendien is er geen bewijs beschikbaar voor de cruciale uitkomstmaat ventilatieduur en de belangrijke uitkomstmaten delier, autodetubaties en hemodynamische afwijkingen. Dit maakt de overall bewijskracht zeer laag, wat betekent dat het bewijs uit de literatuur geen richting kan geven aan de besluitvorming over welk middel de voorkeur heeft.
Zowel propofol als midazolam zijn snel- en kortwerkende middelen die gemetaboliseerd worden in de lever. Midazolam kent daarbij ook een actieve metaboliet (1-hydroxy midazolam) die renaal geklaard wordt. Verlenging van het sedatieve effect door stapeling (actieve metaboliet) van midazolam kan voorkomen bij patiënten met afgenomen lever- en nierfunctie. Bij langdurig gebruik van propofol is hypertriglyceridemie beschreven. Het zogenaamde propofol infusie syndroom is bij volwassen patiënten beschreven met de volgende kenmerken: ernstige metabole acidose, rhabdomyolyse, myoglobinurie, nierfalen en irreversibel hartfalen.
2. Dexmedetomidine* versus midazolam
Gekeken naar de conclusie met betrekking tot de cruciale uitkomstmaat ligduur op de IC was sprake van een klinisch relevant effect in het voordeel van dexmedetomidine. Voor de cruciale uitkomstmaten mortaliteit en ventilatieduur werd geen klinisch relevant effect gevonden. De bewijskracht van de cruciale uitkomstmaten was laag vanwege de beperkingen van de studies (risico op bias). Dit maakt de overall bewijskracht laag, wat betekent dat de gevonden effecten met veel voorzichtigheid geïnterpreteerd dienen te worden.
Voor de belangrijke uitkomstmaat delier was er sprake van een klinisch relevant effect in het voordeel van dexmedetomidine met een hoge bewijskracht, terwijl dexmedetomidine in het nadeel was wanneer werd gekeken naar de belangrijke uitkomstmaat autodetubaties en hemodynamische afwijkingen (bewijskracht laag/matig respectievelijk). Hiermee kunnen de belangrijke uitkomstmaten ook weinig richting geven aan de besluitvorming over welk middel de voorkeur heeft.
Midazolam heeft een snellere inwerking (2 – 5 min) vergeleken met dexmedetomidine (10 – 15 min). Beide middelen worden gemetaboliseerd door de lever. Stapeling van dexmedetomidine vindt niet of nauwelijks plaats in het lichaam, waar midazolam en de actieve metaboliet (1-hydroxy midazolam) kan stapelen bij afgenomen lever- en nierfunctie. Dexmedetomidine heeft een gunstig effect bij delirante patiënten.
3. Dexmedetomidine* versus propofol
Gekeken naar de conclusies met betrekking tot de cruciale uitkomstmaten ligduur en ventilatieduur op de IC was geen sprake van een klinisch relevant effect tussen de beide medicamenten. De bewijskracht van deze bevindingen is hoog. Wel werd een klinisch relevant effect gevonden in het voordeel van dexmedetomidine wanneer gekeken werd naar mortaliteit. De bewijskracht van deze bevinden was laag vanwege het passeren van de grenzen van klinische relevantie. Dit maakt de overall bewijskracht laag, wat betekent dat de gevonden effecten met veel voorzichtigheid geïnterpreteerd dienen te worden. Voor de belangrijke uitkomstmaat delier werd ook een klinisch relevant verschil gevonden tussen de beide medicamenten met een redelijke bewijskracht. Voor de belangrijke uitkomstmaat autodetubaties was het bewijs erg onzeker vanwege het feit dat er maar één studie resultaten voor deze uitkomst rapporteerde. Voor de belangrijke uitkomstmaat hemodynamische afwijkingen werd geen klinisch relevant effect gevonden met een gemiddelde bewijskracht. Hiermee kunnen de belangrijke uitkomstmaten ook weinig richting geven aan de besluitvorming over welk middel de voorkeur heeft.
In het algemeen wordt gekozen voor propofol als snelwerkend en stuurbaar middel; midazolam vanwege de beperkte effecten op de hemodynamiek en respiratie; en dexemedetomine vanwege het gunstige effect bij delirante patiënten.
* In juni 2022 verscheen een Direct Healthcare Professional Communication (DHPC) vanuit het College ter Beoordeling van Geneesmiddelen (CBG) over het gebruik van dexmedetomidine bij IC-patiënten. De werkgroep heeft de waarschuwing besproken en de resultaten van de studies, waarop de waarschuwing is gebaseerd, gewogen. Zowel de subgroep analyse van de SPICE III-studie (Shehabi, 2021) waarop deze waarschuwing verscheen, als de originele SPICE III studie (Shehabi, 2019) werden niet beschreven in de geïncludeerde reviews die zijn opgenomen in de literatuuranalyse van de richtlijn. Bovendien kreeg de controlegroep in de originele SPICE III studie standaardzorg (midazolam of propofol) toegediend, waarbij geen onderscheid werd gemaakt in de analyse tussen midazolam (PICO2) en propofol (PICO3) in beide publicaties. De werkgroep is van mening dat (conform het standpunt van de NVIC) de in het studieprotocol beschreven behandelwijze in dusdanige mate afwijkt van de dagelijkse Nederlandse praktijk en dat de uitkomsten van de subgroep analyse geen invloed heeft op de door de werkgroep vastgestelde aanbevelingen. Het verschil met de Nederlandse praktijkvoering wordt gezien in hoge dosering, RASS-niveau (in studie gebruikt voor diepe sedatie), moment in behandeling (in studie als primair sedativum binnen 12 uur, in Nederland voornamelijk als add-on en/of later in de behandeling). Daarnaast is er geen verklaring gevonden voor de reden van overlijden en zijn er geen verschillen gevonden in adverse events. Hierdoor betwijfelt de werkgroep of hier sprake is van een causale relatie tussen dexmedetomidine en mortaliteit. De werkgroep adviseert de voorschrijver van dexmedetomidine kennis te laten nemen van de waarschuwing en bovengenoemde nuancering. Derhalve adviseren we voorzichtigheid te betrachten bij het gebruik van hoge dosering dexmedetomidine (1 mcg/kg/u) als primair sedativum in de eerste fase van behandeling bij patiënten onder 65 jaar die op de IC opgenomen zijn voor een reden anders dan postoperatief.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Naast comfort is de mogelijkheid tot communicatie een belangrijke waarde voor patiënten en hun naasten. Waarschijnlijk is dit echter meer afhankelijk van de diepte van sedatie dan van het gekozen middel. De stuurbaarheid, dus mogelijkheid op sedatie diepte snel aan te passen, speelt hierbij mogelijk wel een rol, maar is niet onderzocht in de geïncludeerde studies. Preventie van delier komt de communicatie ten goede en speelt vanuit patiënten voorkeur daarom een rol bij de keuze van het sedativum, met name bij patiënten die een verhoogd risico hebben op een delier, bijvoorbeeld ouderen.
Kosten (middelenbeslag)
Dexmedetomidine als middel is wat duurder dan propofol en midazolam. Het kostenverschil zal vooral voortkomen uit een mogelijk kortere ligduur op de IC. Hierin lijkt midazolam de minst gunstige te zijn en daarom de meeste kosten met zich mee te brengen. Dit was ook de bevinding in de studie van Pradelli (2017), waarin een duidelijke kostenbesparing werd gevonden bij gebruik van propofol versus benzodiazepines. Er is geen verschil in ligduur op IC bij gebruik van propofol in vergelijking met dexmedetomidine.
Aanvaardbaarheid, haalbaarheid en implementatie
Alle drie besproken middelen zijn toepasbaar en worden in de praktijd toegepast voor sedatie van patiënten op de IC. Voor alle middelen geldt dat continue monitoring van de respiratie en hemodynamiek vereist zijn. De afdeling moet beschikken over doseringsprotocollen en er dient voldoende kennis te zijn over eventueel te verwachten neveneffecten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Ondanks de lage bewijskracht lijkt het gebruik van propofol of dexmedetomidine gepaard te gaan met een iets kortere IC-ligduur ten opzichte van midazolam. Dit is ook aannemelijk op basis van het farmacologisch profiel van de verschillende medicamenten, waarbij voor midazolam de meeste werkingsduur verlengde interacties heeft met andere op de IC gebruikte medicatie en de klaring het meest afhankelijk is van de nierfunctie. Het is aannemelijk dat een korte ligduur op IC bij propofol en dexmedetomidine ook een gunstig effect zal hebben op de kostenbesparing. Er is geen verschil gevonden in mortaliteit tussen de drie middelen.
Ten opzichte van zowel propofol als midazolam, werd een gunstig effect gezien van dexmedetomidine ten aanzien van delier. Dit is ook aannemelijk op basis van het werkingsmechanisme van dexmedetomidine als centrale alfa-agonist, ten opzichte van GABA agonisme bij de beide andere middelen. Delier kan aanleiding geven tot een hoge lijdensdruk bij zowel patiënten als naasten, daarom is preventie van delier een belangrijk argument in de medicatie keuze.
Onderbouwing
Achtergrond
Om comfort en de zorgtoegankelijkheid van patiënten op de intensive care (IC) te bevorderen, is vaak sedatie nodig. De gewenste sedatie diepte kan hierbij variëren tussen verschillende patiënten en bij dezelfde patiënt in de loop van de behandeling of rondom specifieke gebeurtenissen (periprocedurele sedatie). Het ideale sedativum is stuurbaar (snel- en kort werkend); heeft weinig stapeling van actieve metabolieten (korte effectieve halfwaardetijd); weinig effect op respiratie en hemodynamiek; weinig effect op ontwikkeling van delier; weinig ander bijwerkingen; is goedkoop, duurzaam, voorradig en makkelijk toepasbaar.
Sedatie methoden kunnen globaal worden onderscheiden in twee hoofdvormen: 1. gebaseerd op pure sedativa; 2. gebaseerd op analgetica met tevens sederende eigenschappen. De tweede vorm wordt vaak omschreven als continue analgosedatie of sedatieanalgesie en gaat uit van het principe dat eerst de pijn, vaak een belangrijke oorzaak van discomfort, wordt bestreden met analgetica die intrinsiek ook een sederende werking hebben. Als bij adequate pijnbestrijding nog steeds onvoldoende comfort of sedatiediepte wordt bereikt, dan wordt een sedativum toegevoegd, waarvan dan veelal lagere doseringen mogelijk zijn.
Beschikbare sedativa in Nederland zijn midazolam, dexmedetomidine en propofol. Clonidine wordt hier niet als sedativum beschouwd in verband met off label toepassing in Nederland.
Vaak wordt één van deze sedativa gekozen en toegepast in combinatie met een opioïd als analgeticum, in het kader van de genoemde analgosedatie. Soms worden meerdere sedativa gecombineerd. Per patiëntencategorie kan een andere prioriteit worden gesteld aan de eisen van het ideale sedatiemiddel. Zo is bij een patiënt met indicatie voor langdurige diepe sedatie de stuurbaarheid van het middel minder van belang, terwijl dit wel een belangrijke vereiste is bij een neurologische patiënt van wie het bewustzijn regelmatig gescoord dient te worden na uitwerken van de sedatie. Bij een hemodynamisch instabiele patiënt is het vooral van belang dat de toch al gecompromitteerde circulatie niet verder verslechtert. De vraag is welk geneesmiddel, of welke combinatie van geneesmiddelen het meest geschikt is voor welke groep patiënten en in welke situatie.
Conclusies
1. Propofol versus midazolam
1.1 Length of ICU stay (critical)
|
Low GRADE |
The evidence suggests that propofol may reduce length of ICU stay when compared to midazolam.
Sources: Ho, 2008 (Degauque, 1991; Sandiumenge Camps, 2000; Costa, 1994; Kress, 1996; Manley, 1997; Sanchez-Izquierdo-Reira, 1998; Weinbroun, 1997) |
1.2 Duration of mechanical ventilation (critical)
|
- GRADE |
The outcome measure duration of mechanical ventilation was not reported in the included studies.
Sources: |
1.3 Mortality (critical)
|
Low GRADE |
The evidence suggests that propofol may reduce mortality risk, compared to midazolam.
Sources: Ho (2008) (Barrientos-Vega, 1997; Chamorro, 1996; Degauque, 1991; Ghori, 2007; Hall, 2001; Kress, 1996; Kress, 2001; Manley, 1997; Sanchez-Izquierdo-Reira, 1998; Weinbroum, 10997) |
1.4 Delirium (important)
|
- GRADE |
The outcome measure delirium was not reported in the included studies.
Sources: |
1.5 Selfextubations (important)
|
-GRADE |
The outcome measure selfextubations was not reported in the included studies.
Sources: - |
1.6 Hemodynamic adverse events (important)
|
- GRADE |
The outcome measure hemodynamic adverse events was not reported in the included studies.
Sources: |
2. Dexmedetomidine versus midazolam
2.1 Length of ICU stay (critical)
|
Moderate GRADE |
The evidence suggests that dexmedetomidine likely reduces length of ICU stay when compared to midazolam.
Sources: Cruickshank (2016) (Esmaoglu, 2009; Riker, 2009; Jakob, 2012) & Zhou (2020) (Riker, 2009; Alexopoulou, 2014; Memis, 2006) |
2.2 Duration of mechanical ventilation (critical)
|
Low GRADE |
The evidence suggests that dexmedetomidine may result in little to no difference in duration of mechanical ventilation when compared to midazolam.
Sources: Cruickshank (2016) and Zhou (2020) (Jakob, 2012) |
2.3 Mortality (critical)
|
Low GRADE |
The evidence suggests that dexmedetomidine may result in little to no difference in mortality risk when compared to midazolam.
Sources: Cruickshank (2016) (Riker, 2009; Jakob, 2012) & Zhou (2020) (Riker, 2009; Alexopoulou, 2014; Memis, 2006) |
2.4 Delirium (important)
|
High GRADE |
Dexmedetomidine reduces delirium when compared with midazolam.
Sources: Sources: Cruickshank (2016) (Riker, 2009; Jakob, 2012) & Zhou (2020) (Riker, 2009; Alexopoulou, 2014; Memis, 2006) |
2.5 Selfextubations (important)
|
Low GRADE |
The evidence suggests that dexmedetomidine may increase selfextubations when compared to midazolam.
Sources: Cruickshank (2016) and (Jakob, 2012) |
2.6 Hemodynamic adverse events (important)
|
Moderate GRADE |
The evidence suggests that dexmedetomidine likely increases hypotension risk when compared with midazolam.
Sources: Sources: Cruickshank (2016) (Riker, 2009; Jakob, 2012) & Zhou (2020) (Riker, 2009; Alexopoulou, 2014; Memis, 2006) |
3. Dexmedetomidine versus propofol
3.1 Length of ICU stay (critical)
|
High GRADE |
Dexmedetomidine results in significant, but clinically unrelevant, decrease in ICU length of stay when compared to propofol.
Sources: Abowali (2021), Cruickshank (2016) & Liu (2017) (Corbett, 2005; Djaiani, 2016; Elegebaly, 2018; Emerenko, 2014; Liu, 2016; Maldonado, 2009; Memis, 2009; Mogahd, 2017; Sheikh, 2018). |
3.2 Duration of mechanical ventilation (critical)
|
High GRADE |
Dexmedetomidine results in significant, but clinically unrelevant, decreasein duration of mechanical ventilation when compared to propofol.
Sources: Abowali (2021), Cruickshank (2016) & Liu (2017) (Corbett, 2005; Djaiani, 2016; Elgebaly, 2018; Emernko, 2014; Herr, 2003; Jakob, 2012; Karaman, 2015; Liu, 2016; Maldonado, 2009; Mogahd, 2017; Sheikh, 2018). |
3.3 Mortality (critical)
|
Low GRADE |
Dexmedetomidine may reduce mortality when compared to propofol.
Sources: Cruickshank (2016) (Jakob, 2012; Memis, 2009; Tasadogan, 2009). |
3.4 Delirium (important)
|
Moderate GRADE |
Dexmedetomidine likely reduced delirium risk when compared to propofol.
Sources: Abowali (2021), Cruickshank (2016) & Liu (2017) (Corbett, 2005; Djaiani, 2016; Jakob, 2012; Liu, 2016; Liu, 2016; Maldonado, 2009; Sheikh, 2018; Shi, 2019). |
3.5 Selfextubations (important)
|
Very low GRADE |
The evidence is uncertain about the effect of dexmedetomidine on selfextubations, compared to propofol.
Sources: Cruickshank (2016) (Jakob, 2012) |
3.6 Hemodynamic adverse events (important)
|
Moderate GRADE |
Dexmedetomidine carries no difference in risk of hypotension compared to propofol.
Sources: Abowali (2021), Cruickshank (2016) & Liu (2017) (Corbett, 2005; Emerenko, 2014; Herr, 2003; Jakob, 2012; Karaman, 2015; Liu, 2016; Liu, 2016). |
Samenvatting literatuur
Description of studies
Abowali (2021) performed a systematic review and meta-analysis comparing postoperative sedation with dexmedetomidine versus propofol in adult patients. Included studies were published between 2003 and 2019, and were included in this review if they were RCTs, compared use of dexmedetomidine with propofol (PICO3) for sedation postoperatively, involved any cardiac surgery and included patients aged >18 years. Non-English literature, literature without available abstract or data were excluded. In total, 11 RCTs were included in the review, comprising 1184 patients who underwent heart valve surgery or CABG. The effects were evaluated on time to detubation, mechanical ventilation time, ICU length of stay, hospital length of stay, delirium, bradycardia, and hypotension.
Cruickshank (2016) performed a systematic review and meta-analysis comparing dexmedetomidine with propofol and/or midazolam (PICO2 and PICO3) for sedation in ICUs. Included studies were published between 1999 and November 2014, and were included in this review if they were RCTs comparing dexmedetomidine/clonidine with propofol, midazolam, lorazepam and diazepam; considered critically ill adults in ICUs who required mechanical ventilation. Narrative reviews, editorials, opinions, case reports, conference abstract, non-English language reports (without possibility to translate) and studies focusing on people with primary brain injuries were excluded. In total, 18 RCTs were included in the review, comprising 2446 patients. To answer our clinical question and based on our selection criteria, we only selected the studies that compared dexmedetomidine with midazolam (n=3) or dexmedetomidine with propofol (n=10), comprising 939 and 1134 patients respectively. The effects were evaluated on mortality, duration of mechanical ventilation, ventilator-free days, length of ICU stay, adverse events (hypotension, hypertension, bradycardia, respiratory depression, delirium, coma, non-planned or accidental removal of lines or catheters), unpleasant side effects, duration of weaning, time spent in target sedation range, proportion of patients in target sedation range, discharge readiness, extubating readiness, length of hospital stay, quality life and costs.
Ho (2008) performed a systematic review and meta-analysis comparing propofol with midazolam (PICO1), for medium and long-term sedation in critically ill adult patients. Included studies were published between 1990 and December 1st 2007, and were included in this review if they were RCTs, compared propofol with an alternative sedative drug for 24h to >7 days of sedation and involved critically ill adult patients. Studies comparing two different formulations of propofol and short-term (<24h) sedation were excluded. In total, 16 RCTs were included in the review, comprising 1386 patients. To answer our clinical question and based on our selection criteria, we selected 12 RCTs for our meta-analysis. The effects were evaluated on ICU length of stay and mortality (in hospital, at the end of study period in ICU, in ICU).
Liu (2017) performed a systematic review and meta-analysis comparing dexmedetomidine versus propofol (PICO3) sedation on outcomes in adult patients after cardiac surgery. Included studies were published up to May 23rd 2016, and were included if they were RCTs and compared dexmedetomidine with propofol for sedation in adult patients after cardiac surgery. In total, 8 RCTs were included in the review, comprising 969 patients. To answer our clinical question and based on our selection criteria, we selected 7 RCTs for our meta-analysis. The effects were evaluated on incidence of delirium, hypotension, atrial fibrillation, bradycardia, length of intubation and duration of ICU stay.
Zhou (2020) performed a systematic review a meta-analysis comparing dexmedetomidine versus midazolam (PICO2) on efficacy and safety in critically ill patients. Included studies were published between January 2005 and October 2018, and were included int his review if they were RCTs or CCTs, evaluated clinical effects and mortality of dexmedetomidine and midazolam, patients hat are critically ill and full text articles were available. In total, 7 studies were included in the review, comprising 1353 patients. To answer our clinical question and based on our selection criteria, we selected 1 RCTs for our meta-analysis. The effects were evaluated on the length of ICU stay, time to extubation, incidence of delirium, incidence of bradycardia, incidence of hypotension and mortality.
Table 4.1 Characteristics of the RCTs
|
RCT |
Review(s) |
Population |
Intervention |
Control |
Outcome(s) |
|
PICO 1 PROPOFOL VERSUS MIDAZOLAM |
|||||
|
Barrientos-Vega, 1997 |
Ho, 2008 |
adult general ICU patients who required mechanical ventilation for >24 h; mean APACHE II score was 21; n=121 |
Propofol (n = 54): maximum infusion rate 6 mg/kg h-1, mean infusion rate = between 3.1 mg/ kg h-1 (on day1) and 5.7 mg/kg h-1 (on day 14). Morphine 0.5 mg/kg day-1. |
Midazolam (n = 54): maximum infusion rate 0.5 mg/kg h-1, mean infusion rate = between 0.19 mg/kg h-1 (on day1) and 0.43 mg/kg h-1 (on day14). Morphine 0.5 mg/kg day-1. |
Mortality |
|
Chamorro, 1996 |
Ho, 2008 |
adult ICU patients who required mechanical ventilation >48 h; n=98 |
Propofol (n = 50): maximum infusion rate 6 mg/kg h-1, mean infusion rate = 2.8 mg/kg h-1. Groups could receive morphine without restriction. |
Midazolam (n = 48): maximum infusion rate 0.2 mg/kg h-1, mean infusion rate = 0.14 mg/ kg h-1. Groups could receive morphine without restriction. |
Mortality |
|
Costa, 1994 |
Ho, 2008 |
adult ICU patients who required mechanical ventilation; n=139 |
Propofol (n = 53): maximum infusion rate and mean infusion rate not described. Morphine 0.2– 0.5 mg/kg day-1. |
Midazolam (n = 51): maximum infusion rate and mean infusion rate not described Morphine 0.2–0.5 mg/kg day. |
ICU length of stay |
|
Degauque, 1991 |
Ho, 2008 |
adult ICU patients who had chronic obstructive airway disease and required mechanical ventilation >24 h; mean APACHE II score was 17.5; n=11 |
Propofol (n = 5): maximum infusion rate not described, mean infusion rate = 1.7 mg/kg h-1. |
Midazolam (n = 6): maximum infusion rate not described, mean infusion rate = 0.14 mg/kg h-1. |
ICU length of stay, mortality |
|
Ghori, 2007 |
Ho, 2008 |
adult patients with severe head injury, with Glasgow Coma Scale <9 and required mechanical ventilation; n=30 |
Propofol (n = 13): maximum infusion rate 5 mg/kg h-1, mean infusion rate not specified. Groups received morphine up to 0.2 mg/kg h-1. |
Midazolam (n = 15): maximum infusion rate 0.3 mg/kg h-1, mean infusion rate not specified. Groups received morphine up to 0.2 mg/kg h-1. |
Mortality |
|
Hall, 2001 |
Ho, 2008 |
adult trauma, general, or surgical ICU patients who required mechanical ventilation; mean APACHE II score was 22; n=156 |
Propofol (n = 79): maximum infusion rate not specified, starting from 0.3 to 0.6 mg/kg h-1 but the mean dose used in the study was not reported. No restrictions on the type and amount of analgesic agent used. |
Midazolam (n = 77): maximum infusion rate not specified, starting from 0.012 to 0.024 mg/kg h-1 but mean dose used in the study was not reported. No restrictions on the type and amount of analgesic agent used. |
Mortality |
|
Kress, 1996 |
Ho, 2008 |
adult medical ICU patients who required intubation and mechanical ventilation; mean APACHE II score was 20; n=73 |
Propofol (n = 37): maximum infusion rate 3 mg/kg h-1, mean infusion rate = 1.3 mg/kg h-1. Morphine up to 15 mg/h. |
Midazolam (n = 36): maximum infusion rate not specified, mean infusion rate = 3.1 mg/h. Morphine up to 15 mg/h. |
Mortality |
|
Kress, 2001 |
Ho, 2008 |
adult medical ICU patients who required mechanical ventilation; median APACHE II score was 21; n=150 |
Propofol (n = 62): maximum infusion rate and mean infusion rate not described. Groups could receive morphine infusion between 1 and 5 mg/kg h-1 as required. |
Midazolam (n = 66): maximum infusion rate not described, mean infusion rate = 0.04 mg/kg. Groups could receive morphine infusion between 1 and 5 mg/kg h-1 as required. |
ICU length of stay, mortality |
|
Manley, 1997 |
Ho, 2008 |
adult ICU patients who required mechanical ventilation >12 h; mean APACHE II score 10; n=37 |
Propofol (n = 22): maximum infusion rate 4 mg/kg h-1, mean infusion rate not described. Also with alfentanil 0.5–2 lg/kg h-1. |
Midazolam (n = 15): maximum infusion rate 0.2 mg/kg h-1, mean infusion rate not described. Also with morphine 0.017– 0.07 mg/kg h-1. |
ICU length of stay, mortality |
|
Sanchez-Izquierdo Reira, 1998 |
Ho, 2008 |
adult trauma ICU patients who required mechanical ventilation >48 h; mean injury severity score was 29.5; n=106 |
Propofol (n = 33): maximum infusion rate 6 mg/kg h-1 mean infusion rate = 2.1 mg/kg h-1. Groups could receive morphine infusion as required for pain control. |
Midazolam = 34): maximum infusion rate 0.35 mg/kg h-1, mean infusion rate = 0.19 mg/ kg h-1. Groups could receive morphine infusion as required for pain control. |
Mortality |
|
Sandiumenge Camps, 2000 |
Ho, 2008 |
adult trauma ICU patients who required mechanical ventilation >48 h; mean injury severity score was 33; n=63 |
Propofol (n = 32): maximum infusion rate 6 mg/kg h-1, mean infusion rate = 3.7 mg/kg h-1. Groups received between 0.02 and 0.04 mg/kg h-1 of morphine. |
Midazolam (n = 31): maximum infusion rate 0.35 mg/kg h-1, mean dose = 12.4 mg/h. Groups received between 0.02 and 0.04 mg/kg h-1 of morphine. |
ICU length of stay |
|
Weinbroum, 1997 |
Ho, 2008 |
adult ICU patients who required mechanical ventilation; mean APACHE II score was 17.5; n=67 |
Propofol (n = 31): maximum infusion rate not described, mean infusion rate = 1.8 mg/kg h-1. Groups could receive morphine 2 mg increments for pain control. |
Midazolam (n = 36): maximum infusion rate not described, mean infusion rate = 0.07 mg/kg h-1. Groups could receive morphine 2 mg increments for pain control. |
ICU length of stay, mortality |
|
PICO2 DEXMEDETOMIDINE VERSUS MIDAZOLAM |
|||||
|
Esmaoglu, 2009 |
Cruickshank, 2017 |
patients whose pregnancies were terminated via caesarean delivery because of eclampsia; n=40 |
Dexmedetomidine (n=20): loading dose administered at 1 μg/kg per 20 minutes, followed by a continuous infusion at 0.7 μg/kg/hour |
Midazolam (n=20): loading dose of 100 mg in 100 ml 0.9% NaCl at 0.05 mg/kg and continued at 0.1 mg/kg/hour |
ICU length of stay |
|
Jakob, 2012 |
Cruickshank, 2017 |
general ICU patients; n=501 |
Dexmedetomidine (n=249): 0.2–1.4 μg/kg per hour. Thereafter, study drugs were titrated by the patient’s nurse stepwise to maintain the target RASS score. |
Midazolam (n=251): 0.03–0.2 mg/kg per hour. Thereafter, study drugs were titrated by the patient’s nurse stepwise to maintain the target RASS score. |
ICU length of stay, duration of MV, mortality, delirium, selfextubations, complications |
|
MacLaren, 2013 |
Cruickshank, 2017 |
medical or surgical ICU patients; n=23 |
Dexmedetomidine (n=11): started at 0.15 μg/kg/hour and adjusted by 0.15 μg/kg/hour to a maximum of 1.5 μg/kg/hour. |
Midazolam (n=12): started at 1 mg/hour and adjusted by 1 mg/hour to a maximum of 10 mg/hour. |
Mortality, delirium, complications |
|
Riker, 2009 |
Cruickshank, 2017; Zhou, 2020 |
general ICU patients; n=275 |
Dexmedetomidine (n=250): starting loading dose from 0.8 μg/kg/hour corresponding to the mid-point of the allowable infusion dose range up to 1 μg/kg. |
Midazolam (n=125): starting loading dose of 0.06 mg/kg/hour corresponding to the mid-point of the allowable infusion dose range up to 0.05 mg/kg. |
ICU length of stay, mortality, delirium, complications |
|
PICO 3 DEXMEDETOMIDINE VERSUS PROPOFOL |
|||||
|
Corbett, 2005 |
Abowali, 2021; Cruickshank, 2017; Liu, 2017 |
Patients after non-emergent CABG surgery; n=89 |
Dexmedetomidine (n=43): 1 μg/kg (actual body weight) loading dose intravenously administered over 15 minutes, followed by a 0.4 μg/kg/hour i.v. infusion. |
Propofol (n=46): 5 μg/kg/minute i.v. infusion titrated within the range of 0.2–0.7 μg/kg/hour or 5–75 μg/kg/minute. |
ICU length of stay, duration of MV, delirium, complications |
|
Djaiani, 2016 |
Liu, 2017 |
Cardiac surgery (patients aged ≥60 y); n=183 |
Dexmedetomidine (n=91): loading dose 0.4 μg/kg for 10-20 min or no bolus; infusion rate 0.2-0.7 μg kg−1 h−1 (target sedation level SAS=4). |
Propofol (n=92): no loading dose; infusion rate 1.5-3 mg kg−1 h−1 (target sedation level SAS=4). |
ICU length of stay, duration of MV, delirium |
|
Elgebaly, 2018 |
Abowali, 2021 |
patients admitted to the ICU after cardiovascular surgery, aged from 18 to 55 years and requiring mechanical ventilation on arrival to the ICU; n=50 |
Dexmedetomidine (n=25): maintenance infusion dose of 0.8 μg/kg/h. |
Propofol (n=25): maintenance infusion dose of 1.5 mg/kg/h. |
ICU length of stay, duration of MV |
|
Emerenko, 2014 |
Liu, 2017 |
Cardiac surgery patients; n=55 |
Dexmedetomidine (n=28): no loading dose; infusion rate 0.2-0.7 μg kg−1 h−1. |
Propofol (n=27): no loading dose; infusion rate 0.3-2 mg kg−1 h−1. |
ICU length of stay, duration of MV, complications |
|
Herr, 2003 |
Abowali, 2021; Cruickshank, 2017; Liu, 2017 |
Patients after CABG surgery; n=295 |
Dexmedetomidine (n=148): 1.0 μg/kg dexmedetomidine over 20 minutes as the loading dose, followed by a maintenance infusion of 0.4 μg/kg/hour. After transfer to the ICU, the infusion rate was titrated in the range of 0.2–0.7 μg/kg/hour as necessary to maintain a RSS score of ≥ 3 before extubation, ≥ 2 after extubation. |
Propofol (n=147): no dose or rate of propofol was specified by the protocol. Investigators were told to follow their usual practice with regard to propofol-based sedation |
Duration of MV, complications |
|
Jakob, 2012 |
Cruickshank, 2017 |
general ICU patients; n=500 |
Dexmedetomidine (n=251): dose range 0.2–1.4 μg/kg/hour. Study treatments were infused without loading dose at a dose matching the prerandomisation dose of propofol for 1 hour. Thereafter, study drugs were titrated by the patient’s nurse stepwise to maintain the target RASS score. |
Propofol (n=249): dose range 0.3–4.0 mg/kg/hour. Study treatments were infused without loading dose at a dose matching the prerandomisation dose of propofol for 1 hour. Thereafter, study drugs were titrated by the patient’s nurse stepwise to maintain the target RASS score. |
Duration of MV, mortality, delirium, selfextubations, complications |
|
Karaman, 2015 |
Abowali, 2021 |
patients who underwent CABG surgery; n=64 |
Dexmedetomidine (n=32): min 0.2 µg/kg/h-max 1.0 µg/kg/h. Infusion doses were titrated to give bispectral index values between 60 and 90 and a Ramsay sedation score (RSS) between 3 and 4. |
Propofol (n=32): min 1.0 mg/kg/h-max 3.0 mg/kg/h. Infusion doses were titrated to give bispectral index values between 60 and 90 and a Ramsay sedation score (RSS) between 3 and 4. |
Duration of MV, complications |
|
Liu, 2016a |
Abowali, 2021 |
Adult patients after elective cardiac surgery with cardiopulmonary bypass (CPB), admitted to intensive care unit (ICU) while intubated and ventilated, and lack of prior AF or flutter before receiving sedation in the ICU; n=90 |
Dexmedetomidine (n=45): The intravenous infusion speed of ≤1.5 μg/kg/h was adjusted to maintain RASS values between 0 and -3. |
Propofol (n=45): The intravenous infusion speed of ≤3 mg/kg/h was adjusted to maintain RASS values between 0 and -3. |
Delirium, complications |
|
Liu, 2016b |
Abowali, 2021 |
Patients who underwent Valve surgery with CPB; n=61 |
Dexmedetomidine (n=29): no loading dose; infusion rate 0.2-1.5 μg kg−1 h−1; target sedation level RASS -3 – 0. |
Propofol (n=32): no loading dose; infusion rate 0.3-3 mg kg−1 h−1. target sedation level RASS -3 – 0. |
ICU length of stay, duration of MV, delirium, complications |
|
Maldonado, 2009 |
Abowali, 2021; Cruickshank, 2017; Liu, 2017 |
Patients following cardiac valve surgery; n=78. |
Dexmedetomidine (n=40): loading dose: 0.4 μg/kg, followed by a maintenance drip of 0.2–0.7 μg/kg/hour. |
Propofol (n=38): drip (25–50 μg/kg/minute. |
ICU length of stay, duration of MV, delirium |
|
Memis, 2009 |
Cruickshank, 2017 |
All patients fulfilled clinical and laboratory criteria of septic shock; n=40 |
Dexmedetomidine (n=20): loading dose at 1 μg/kg over 10 minutes, followed by a maintenance dose of 0.2–2.5 μg/kg per hour into a peripheral or central vein over a 24-hour infusion. |
Propofol (n=20): loading dose of 1 mg/kg over 15 minutes, followed by a maintenance of 1 to 3 mg/kg per hour over a 24-hour infusion. |
ICU length of stay, mortality |
|
Mogahd, 2017 |
Abowali, 2021 |
post-CABG patients; n=70 |
Dexmedetomidine (n=35): ketamine + dexmedetomidine 1.0 μg/kg over 20 min and then 0.2-0.7 μg/kg/h. |
Propofol (n=35): ketamine + propofol 1 mg/kg bolus followed by 25-50 μg/kg/min. |
ICU length of stay, duration of MV |
|
Sheikh, 2018 |
Abowali, 2021 |
Patients planned for elective open heart surgery; n=60 |
Dexmedetomidine (n=30): 1 μg/kg diluted in 100 ml of normal saline over 10 min), followed by infusion 0.2–0.6 μg/kg/h. |
Propofol (n=30): infusion at the rate of 0.25–1 mg/kg/h. |
ICU length of stay, duration of MV, delirium |
|
Shi, 2019 |
Abowali, 2021 |
elderly patients after cardiac surgery; n=164 |
Dexmedetomidine (n=84): Intravenous infusion was switched to a maintenance syringe pump at rate of 50–80 mg/kg/h for propofol, 0.15–0.2 µg/kg/h for remifentanil, with 0.4–0.6 µg/kg/h of dexmedetomidine. |
Propofol (n=80): Intravenous infusion was switched to a maintenance syringe pump at rate of 50–80 mg/kg/h for propofol, 0.15–0.2 µg/kg/h for remifentanil, without dexmedetomidine. |
Delirium |
|
Tasdogan, 2009 |
Cruickshank, 2017 |
Patients with sepsis after ileus surgery; n=40 |
Dexmedetomidine (n=20): loading dose at 1 μg/kg over 10 minutes, followed by a maintenance 0.2–2.5 μg/kg/hour into a peripheral or central vein over a 24-hour infusion. |
Propofol (n=20): loading dose of 1 mg/kg over 15 minutes, followed by a maintenance of 1–3 mg/kg/hour over a 24-hour infusion. |
Mortality |
Results
1. Propofol versus midazolam
1.1 ICU length of stay (critical)
ICU length of stay was described by the review of Ho (2008), including 6 RCTs comprising 362 patients. Data resulted in a mean difference (MD) of -1.49 days (95% confidence interval (CI) -8.54 to 5.56) in favour of propofol in patients who were sedated for more than seven days. In patients who were sedated seven days or less, data resulted in a MD of -1.52 (95% CI -3.83 to 0.80) in favour of propofol. Overall, the MD of ICU length of stay was -1.60 (95% CI -3.69 to 0.48) in favour of propofol. All differences were clinically relevant. Results are shown in figure 4.1.

Figure 4.1. Forest plot showing the effect of using propofol or midazolam for sedation on ICU length of stay in days, stratified by the duration of sedation (>7 days versus 7 days or less)
The level of evidence in the literature
The level of evidence regarding the outcome ICU length of stay started at high, because it was based on randomized controlled trials, but was downgraded by two levels due to lack of blinding (risk-of-bias, -1) and crossing the borders of clinical relevance (imprecision, -1). The final level is low.
1.2 Duration of mechanical ventilation (critical)
Duration of mechanical ventilation was not described by the included studies.
1.3 Mortality (critical)
Mortality was described by the review of Ho (2008), including 10 RCTs comprising 773 patients. Data resulted in a risk ratio (RR) of 1.12 (95% CI 0.86 to 1.46), in favour of midazolam. This difference was clinically relevant. Results are shown in figure 4.2.

Figure 4.2. Forest plot showing the effect of using propofol or midazolam for sedation on mortality.
The level of evidence in the literature
The level of evidence regarding the outcome mortality started at high because it was based on randomized controlled trials, but was downgraded by two levels due to lack of intention to treat analysis in the included studies, lack of blinding (risk-of-bias, -1) and crossing the borders of clinical relevance (imprecision, -1). The final level is low.
1.4 Delirium (important)
Delirium was not described by the included studies.
1.5 Selfextubations (important)
Selfextubations were not described by the included studies.
1.6 Hemodynamic adverse events (important)
Hemodynamic adverse events were not described by the included studies.
2. Dexmedetomidine versus midazolam
2.1 ICU length of stay (critical)
ICU length of stay was described by the review of Cruickshank (2016) and Zhou (2020), including 5 RCTs comprising 940 patients. Data resulted in a MD of -2.02 days (95% CI -2.83 to -1.22), in favour of dexmedetomidine. This difference was clinically relevant. Results are shown in figure 4.3.

Figure 4.3. Forest plot showing the effect of using dexmedetomidine or midazolam for sedation on ICU length of stay.
The level of evidence in the literature
The level of evidence regarding the outcome ICU length of stay started at high because it was based on randomized controlled trials, but was downgraded by one level due to study limitations (risk of bias, -1). The final level is moderate.
2.2 Duration of mechanical ventilation (critical)
Duration of mechanical ventilation was described by the review of Cruickshank (2016), including one RCT comprising 500 patients (Jakob, 2012). Data resulted in a MD of -0.88 days (95% CI -2.65 to 0.88) in favour of dexmedetomidine. This difference was not clinically relevant.
The level of evidence in the literature
The level of evidence regarding the outcome duration of mechanical ventilation started at high because it was based on an RCT, but was downgraded by two levels due to limited number of studies reporting on duration of mechanical ventilation and crossing the border of clinical relevance (imprecision, -2). The final level is low.
2.3 Mortality (critical)
Mortality was described by the review of Cruickshank (2016) and Zhou (2020), including 4 RCTs comprising 913 patients. Data resulted in a RR of 1.11 (95% CI 0.87 to 1.41) in favour of midazolam. This difference was not clinically relevant. Results are shown in figure 4.4.

Figure 4.4. Forest plot showing the effect of using dexmedetomidine or midazolam for sedation on mortality.
The level of evidence in the literature
The level of evidence regarding the outcome mortality started at high because it was based on randomized controlled trials, but was downgraded by two levels due to crossing both borders of clinical relevance (imprecision, -2). The final level is low.
2.4 Delirium (important)
Delirium was described by the review of Cruickshank (2016) and Zhou (2020), including 4 RCTs comprising 910 patients. Data resulted in a RR of 0.71 (95% CI 0.61 to 0.81) in favour of dexmedetomidine. This difference was clinically relevant. Results are shown in figure 4.5.

Figure 4.5. Forest plot showing the effect of using dexmedetomidine or midazolam for sedation on delirium.
The level of evidence in the literature
The level of evidence regarding the outcome delirium started at high because it was based on randomized controlled trials and was not downgraded. The final level is high.
2.5 Selfextubations (important)
Selfextubations were described by the review of Cruickshank (2016), including one RCT comprising 493 patients (Jakob, 2012). The dexmedetomidine group showed 5/247 (2.0%) episodes of selfextubations, compared to 1/250 (0.4%) in the midazolam group (RR of 5.06 (95% CI 0.60 to 43.01). This difference was clinically relevant in favour of midazolam.
The level of evidence in the literature
The level of evidence regarding the outcome selfextubations started at high because it was based on an RCT, but was downgraded by two levels due to crossing the borders of clinical relevance on both sides (imprecision, -2). The final level is low.
2.6 Hemodynamic adverse events (important)
Hemodynamic adverse events were described by the review of Cruickshank (2016) and Zhou (2020), including 4 RCTs comprising 910 patients. Data resulted in a RR of 1.28 (95% CI 0.84 to 1.95) in favour of midazolam. This difference was clinically relevant. Results are shown in figure 4.6.

Figure 4.6. Forest plot showing the effect of using dexmedetomidine or midazolam for sedation on hemodynamic adverse events.
The level of evidence in the literature
The level of evidence regarding the outcome hemodynamic adverse events started at high because it was based on randomized controlled trials, but was downgraded by one level due to crossing the border of clinical relevance. The final level is moderate.
3. Dexmedetomidine versus propofol
3.1 ICU length of stay (critical)
ICU length of stay was described by the review of Cruickshank (2016), Liu (2017) and Abowali (2021), including nine RCTs comprising 661 patients. Data resulted in a MD of -0.64 hours (95% CI –3.06 – 1.77) in favour of dexmedetomidine. This difference was not clinically relevant. Results are shown in figure 4.7.

Figure 4.7. Forest plot showing the effect of using dexmedetomidine or propofol for sedation on ICU length of stay.
The level of evidence in the literature
The level of evidence regarding the outcome ICU length of stay started at high because it was based on randomised controlled trials and was not downgraded. The final level is high.
3.2 Duration of mechanical ventilation (critical)
Duration of mechanical ventilation was described by the review of Cruickshank (2016), Liu (2017) and Abowali (2021), including 11 RCT comprising 1485 patients. Data resulted in a MD of -0.31 hours (95% CI -1.36 to 0.75) favouring dexmedetomidine. This difference was not clinically relevant. Results are shown in figure 4.8.
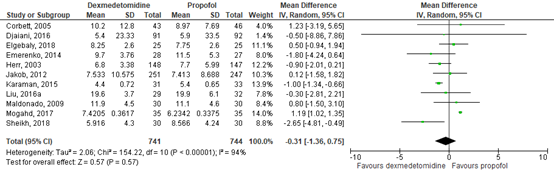
Figure 4.8. Forest plot showing the effect of using dexmedetomidine or propofol for sedation on duration of mechanical ventilation.
The level of evidence in the literature
The level of evidence regarding the outcome duration of mechanical ventilation started at high because it was based on randomised controlled trials and was not downgraded. The final level is high.
3.3 Mortality (critical)
Mortality was described by the review of Cruickshank (2016), including three RCTs comprising 578 patients. Data resulted in a RR of 0.86 (95% CI 0.60 to 1.23) in favour of dexmedetomidine. This difference was clinically relevant. Results are shown in figure 4.9.
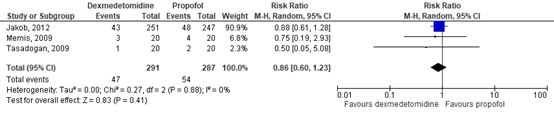
Figure 4.9. Forest plot showing the effect of using dexmedetomidine or propofol for sedation on mortality.
The level of evidence in the literature
The level of evidence regarding the outcome mortality started at high because it was based on randomized controlled trials, but was downgraded by two levels due to crossing the borders of clinical relevance on both sides (-2, imprecision). The final level is low.
3.4 Delirium (important)
Delirium was described by the review of Cruickshank (2016), Liu (2017) and Abowali (2021), including 8 RCTs comprising 1198 patients. Data resulted in a RR of 0.45 (95% CI 0.21 to 0.95) favouring dexmedetomidine. This difference was clinically relevant. Results are shown in figure 4.10.

Figure 4.10. Forest plot showing the effect of using dexmedetomidine or propofol for sedation on delirium.
The level of evidence in the literature
The level of evidence regarding the outcome delirium started at high because it was based on randomized controlled trials, but was downgraded by one level due to crossing the border of clinical relevance (-1, imprecision). The final level is moderate.
3.5 Selfextubations (important)
Selfextubations were described by the review of Cruickshank (2016), including one RCT comprising 493 patients (Jakob, 2012). The dexmedetomidine group showed 1/246 (0.4%) episode of selfextubations, compared to 0/247 (0%) in the propofol group (RR of 3.01 (95% CI 0.12 to 73.58). This difference was clinically relevant in favour of propofol.
The level of evidence in the literature
The level of evidence regarding the outcome selfextubations started at high because it was based on randomized controlled trials, but was downgraded by three levels due to study limitations (-1, risk of bias) and limited number of studies reporting on selfextubations (-2, imprecision). The final level is very low.
3.6 Hemodynamic adverse events (important)
Hemodynamic adverse events were described by the review of Cruickshank (2016), Liu (2017) and Abowali (2021), including seven RCTs comprising 1145 patients. Data resulted in a RR of 1.14 (95% CI 0.88 to 1.48) in favour of propofol. This difference was not clinically relevant. Results are shown in figure 4.11.

Figure 4.11. Forest plot showing the effect of using dexmedetomidine or propofol for sedation on hemodynamic adverse events.
The level of evidence in the literature
The level of evidence regarding the outcome hemodynamic adverse events started at high because it was based on randomized controlled trials, but was downgraded by one level due to crossing the border of clinical relevance (-1, imprecision). The final level is moderate.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)beneficial effects medication for intravenous sedation in IC-patients?
PICO1: Propofol versus midazolam
P: Adult ICU patients (awake and sedated);
I: Continuous administration of intravenous propofol;
C: Continuous administration of intravenous midazolam;
O: ICU length of stay, duration of mechanical ventilation, mortality, delirium, selfextubations, hemodynamic adverse events.
PICO2: Dexmedetomidine versus midazolam
P: Adult ICU patients (awake and sedated);
I: Continuous administration of intravenous dexmedetomidine;
C: Continuous administration of intravenous midazolam;
O: ICU length of stay, duration of mechanical ventilation, mortality, delirium, selfextubations, hemodynamic adverse events.
PICO3: Dexmedetomidine versus propofol
P: Adult ICU patients (awake and sedated);
I: Continuous administration of intravenous dexmedetomidine;
C: Continuous administration of intravenous propofol;
O: ICU length of stay, duration of mechanical ventilation, mortality, delirium, selfextubations, hemodynamic adverse events.
Relevant outcome measures
The guideline development group considered ICU length of stay, duration of mechanical ventilation and mortality as critical outcome measures for decision making; and delirium, selfextubations and hemodynamic adverse events as important outcome measures for decision making.
The working group defined the outcome measures as follows:
- ICU length of stay: The number of days spent on the ICU.
- Duration of mechanical ventilation: The number of days with mechanical ventilation.
- Mortality: The number of patients who died during IC/hospital stay.
- Delirium: The number of participants who were diagnosed with delirium during IC/hospital stay.
- Selfextubations: Incidence of selfextubations.
- hemodynamic adverse events: Incidence of hypotension, fluid requirement, vasopressor use or vasoactive medication.
The working group defined the following differences as minimal clinically (patient) important differences:
- ICU length of stay: A difference of 24 hours.
- Duration of mechanical ventilation: A difference of one day.
- Mortality: A difference of 3%, in mortality incidence, based on the SDD-trial (Smet, 2009)
- Delirium: A difference of 5% in delirium incidence or delirium duration.
- Selfextubations: A difference of 50% in relative risk (RR <0.67, RR>1.50).
- Hemodynamic adverse events: A difference of 25% in relative risk (RR <0.8, RR >1.25).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2000 until 17th of February 2021. The detailed search strategy is presented under the tab Methods. The systematic literature search resulted in 312 hits. Studies were selected based on the following criteria:
- Describing adult patients at the ICU.
- The following intravenous medication were compared in the intervention- and control groups:
- PICO1: Propofol versus midazolam
- PICO2: Dexmedetomidine versus midazolam
- PICO3: Dexmedetomidine versus propofol
- Study design: RCTs, systematic reviews
- Articles published in Dutch or English.
- Full text available
- Articles published between January 2000 and February 2021.
- Describing at least one of the outcome measures.
A total of 22 studies were initially selected based on title and abstract screening. After reading the full text, 17 studies were excluded (see the table with reasons for exclusion under the tab Methods), and five studies were included.
Results
Five studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Abowali HA, Paganini M, Enten G, Elbadawi A, Camporesi EM. Critical Review and Meta
Analysis of Postoperative Sedation after Adult Cardiac Surgery: Dexmedetomidine Versus Propofol. J Cardiothorac Vasc Anesth. 2021 Apr;35(4):1134-1142. doi: 10.1053/j.jvca.2020.10.022. Epub 2020 Oct 17. PMID: 33168430. - Cruickshank M, Henderson L, MacLennan G, Fraser C, Campbell M, Blackwood B, Gordon A,
Brazzelli M. Alpha-2 agonists for sedation of mechanically ventilated adults in intensive care units: a systematic review. Health Technol Assess. 2016 Mar;20(25):v-xx, 1-117. doi: 10.3310/hta20250. PMID: 27035758; PMCID: PMC4828957. - Ho KM, Ng JY. The use of propofol for medium and long-term sedation in critically ill adult
patients: a meta-analysis. Intensive Care Med. 2008 Nov;34(11):1969-79. doi: 10.1007/s00134-008-1186-5. Epub 2008 Jun 25. PMID: 18575838. - Liu X, Xie G, Zhang K, Song S, Song F, Jin Y, Fang X. Dexmedetomidine vs propofol sedation
reduces delirium in patients after cardiac surgery: A meta-analysis with trial sequential analysis of randomized controlled trials. J Crit Care. 2017 Apr;38:190-196. doi: 10.1016/j.jcrc.2016.10.026. Epub 2016 Nov 11. PMID: 27936404. - Pradelli L, Povero M, Bürkle H, Kampmeier TG, Della-Rocca G, Feuersenger A, Baron JF,
Westphal M. Propofol or benzodiazepines for short- and long-term sedation in intensive care units? An economic evaluation based on meta-analytic results. Clinicoecon Outcomes Res. 2017 Nov 9;9:685-698. doi: 10.2147/CEOR.S136720. PMID: 29184423; PMCID: PMC5687490. - Shehabi Y, Howe BD, Bellomo R, Arabi YM, Bailey M, Bass FE, Bin Kadiman S, McArthur CJ, Murray L, Reade MC, Seppelt IM, Takala J, Wise MP, Webb SA; ANZICS Clinical Trials Group and the SPICE III Investigators. Early Sedation with Dexmedetomidine in Critically Ill Patients. N Engl J Med. 2019 Jun 27;380(26):2506-2517. doi: 10.1056/NEJMoa1904710. Epub 2019 May 19. PMID: 31112380.
- Shehabi Y, Serpa Neto A, Howe BD, Bellomo R, Arabi YM, Bailey M, Bass FE, Kadiman SB, McArthur CJ, Reade MC, Seppelt IM, Takala J, Wise MP, Webb SA; SPICE III Study Investigators. Early sedation with dexmedetomidine in ventilated critically ill patients and heterogeneity of treatment effect in the SPICE III randomised controlled trial. Intensive Care Med. 2021 Apr;47(4):455-466. doi: 10.1007/s00134-021-06356-8. Epub 2021 Mar 8. PMID: 33686482; PMCID: PMC7939103.
- Zhou WJ, Liu M, Fan XP. Differences in efficacy and safety of midazolam vs. dexmedetomidine in critically ill patients: A meta-analysis of randomized controlled trial. Exp Ther Med. 2021 Feb;21(2):156. doi: 10.3892/etm.2020.9297. Epub 2020 Dec 17. PMID: 33456523; PMCID: PMC7791964.
Evidence tabellen
Evidence table for systmatic reviews of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Abowali, 2021 |
SR and meta-analysis of RCTs
Literature search up to June 2020
A: Herr, 2003 B: Corbett, 2005 D: Karaman, 2015 E: Djaiani, 2016 F. Liu, 2016 G: Liu, 2016 H: Mogahd, 2017 I: Elgebaly, 2018 J: Sheikh, 2018 K: Shi, 2019
Study design: RCTs
Setting and Country: A: United States
Source of funding and conflicts of interest: Not reported. |
Inclusion criteria SR: Inclusion criteria included RCTs, use of dexmedetomidine in comparison to propofol for sedation postoperatively, any cardiac surgery, and age >18 years.
Exclusion criteria SR: Exclusion criteria included non-English literature, literature without an available abstract, and literature without available data.
11 studies included
Important patient characteristics at baseline:
Number of patients (n: dex/prop) A: 148/147
Mean age (Dex/prop) A: 61.9/62.4
%Male (dex/prop) A: 93/87
Groups comparable at baseline? Yes |
Use of dexmedetomidine postoperatively, any cardiac surgery. |
Use of propofol postoperatively, any cardiac surgery. |
End-point of follow-up: n.r.
For how many participants were no complete outcome data available? (intervention/control) n.r.
|
Dexmed versus propofol
ICU length of stay The number of days at the ICU. Effect measure: mean difference [95% CI]:
B: 0.00 [-1.70 – 1.70]
Pooled effect (random effects model): -0.44 [95% CI -2.74 to 1.86] favoring dexmedetomidine Heterogeneity (I2): 77%
Duration of mechanical ventilation The number of days of mechanical ventilation. Effect measure: mean difference [95% CI]:
A: -0.90 [-2.01 – 0.21]
Pooled effect (random effects model model): -0.21 [95% CI -1.39 to 0.97] favoring dexmedetomidine Heterogeneity (I2): 95%
Mortality n.r.
Delirium Effect measure: risk ratio [95% CI]:
B: 1.07 [0.07 – 16.7] . Pooled effect (random effects model model): 0.45 [95% CI 0.21 to 0.95] favoring dexmedetomidine Heterogeneity (I2): 72%
Selfextubations:
Sedation-related complications Incidence of hypotension. Effect measure: risk ratio [95% CI]:
A: 1.49 [0.94 – 2.37] Pooled effect (random effects model model): 1.30 [95% CI 1.05 to 1.62] favoring propofol Heterogeneity (I2): 9% |
Author’s conclusion In summary, higher sedation dosing strategy will impact cognitive function in critically ill patients both medically and psychologically. Larger randomized prospective trials are needed to better address the long-term effect of sedative agents as well as sedation practices in the ICU and its impact on cognitive function. Newer and emerging therapies with newer antipsychotic or sedative agents are promising but still insufficient data exist to make any solid recommendations to change current practice.
Risk of bias A: Low
|
|
Cruickshank, 2016 |
SR and meta-analysis of RCTs
Literature search up to November, 2014
Dexmed versus midazolam A: Esmaoglu, 2009 B: MacLaren, 2013 D: Jakob, 2012
Dexmed versus propofol: D: Jakob, 2012 E: Memis, 2009 Study design: RCTs
Setting and Country: A: Turkey E: Turkey F: Turkey
Source of funding and conflicts of interest: A: not reported. E: not reported. |
Inclusion criteria SR: -published RCTs comparing dexmedetomidine with clonidine or dexmedetomidine or clonidine with propofol or benzodiazepines (i.e. midazolam or lorazepam). -critically ill adults admitted to ICUs who required MV.
Exclusion criteria SR: -People with primary brain injuries such as trauma or intracerebral bleed/infarct
4 studies were omc;ided
Important patient characteristics at baseline:
N, mean age in yrs (sd or range) A: I: n=20; C: n=20 B: I: n=11, 58.3 (15.3) C: n=12, 57.8 (9.3) C: I: n=250, 61.5 (14.8) C: n=125, 62.9 (62.8) D: : I: n=251, median 65 (51–75) n=249, median 65 (51–74)
Groups comparable at baseline? For what is reported in the SR: yes |
A: Dexmedetomidine: Loading dose 1 μg/kg per 20 minutes, followed by a continuous infusion at 0.7 μg/kg/hour
B: Dexmedetomidine: was started at 0.15 μg/kg/hour and adjusted by 0.15 μg/kg/hour to a maximum of 1.5 μg/kg/hour
C: Dexmedetomidine: Optional blinded loading doses (up to 1 μg/kg dexmedetomidine) could be administered at the investigator’s discretion. The starting maintenance infusion dose of the blinded study drug was 0.8 μg/kg/hour per hour for dexmedetomidine or responding to the mid-point of the allowable infusion dose range of 4mg in 8 hours
D: Dexmedetomidine: Six dose levels of each study drug covered the full dose range (dexmedetomidine, 0.2–1.4 μg/kg/hour; midazolam, 0.03–0.2 mg/kg/hour). Study treatments were infused without loading dose at a dose matching the pre-randomisation dose of midazolam for 1 hour. Thereafter, study drugs were titrated by the patient’s nurse stepwise to maintain the target RASS score
E: Dexmedetomidine: Loading dose at 1 μg/kg over 10 minutes, followed by a maintenance dose of 0.2–2.5 μg/kg per hour into a peripheral or central vein over a 24-hour infusion
F: Dexmedetomidine: Loading dose at 1 μg/kg over 10 minutes, followed by a maintenance 0.2 to 2.5 μg/kg per hour into a peripheral or central vein over a 24-hour infusion
|
B: Midazolam: loading dose of 100 mg in 100 ml of 0.9% NaCl at 0.05 mg/kg and continued at 0.1 mg/kg/hour
B: Midazolam: started at 1 mg/hour and adjusted by 1 mg/hour to a maximum of 10 mg/hour. All infusions were adjusted by increments of 2 ml/hour to maintain blinding
C: Midazolam: optional blinded loading doses (0.05 mg/kg midazolam) could be administered at the investigator’s discretion. The starting maintenance infusion dose of blinded study drug was 0.06 mg/kg/hour for midazolam, corresponding to the mid-point of the allowable infusion dose range of 4 mg in 8 hours
Propofol: six dose levels of each study drug covered the full dose range (dexmedetomidine 0.2–1.4 μg/kg per hour; propofol 0.3–4.0mg/kg per hour). Study treatments were infused without loading dose at a dose matching the pre-randomisation dose of propofol for 1 hour. Thereafter, study drugs were titrated by the patient’s nurse stepwise to maintain the target RASS score
D: Midazolam: six dose levels of each study drug covered the full dose range (dexmedetomidine, 0.2–1.4 μg/kg per hour; midazolam, 0.03–0.2 mg/kg/hour). Study treatments were infused without loading dose at a dose matching the pre-randomisation dose of midazolam for 1 hour. Thereafter, study drugs were titrated by the patient’s nurse stepwise to maintain the target RASS score
E: Propofol: loading dose of 1 mg/kg over 15 minutes, followed by a maintenance dose of 1–3 mg/kg per hour over a 24-hour infusion
Propofol: loading dose of 1 mg/kg over 15 minutes, followed by a maintenance of 1 mg/kg to 3 mg/kg per hour over a 24-hour infusion
|
End-point of follow-up:
A: n.r. extubation or tracheostomy but before hospital discharge E: n.r.
For how many participants were no complete outcome data available? (intervention/control) A: 0/0
|
Dexmed vs. Midazolam ICU length of stay The number of days at the ICU. Effect measure: mean difference [95% CI]:
A: -2.8 [-4.21 - -1.39]
Pooled effect (random effects model model): -1.87 [95% CI -2.72 to -1.02] favoring dexmedetomidine Heterogeneity (I2): 23%
Duration of mechanical ventilation: The number of days of mechanical ventilation. Effect measure: mean difference [95% CI]:
D: -0.88 [-2.65 - 0.88] in favour of dexmedetomidine
Mortality Effect measure: risk ratio [95% CI]:
B: 2.18 [0.23 – 20.84]
Pooled effect (random effects model model): 1.11 [95% CI 0.82 to 1.50] favoring midazolam. Heterogeneity (I2): 22%
Delirium Effect measure: risk ratio [95% CI]:
B: 0.55 [0.23 – 1.31]
Pooled effect (random effects model model): 0.71 [95% CI 0.61 to 0.82] favoring dexmedetomidine. Heterogeneity (I2): 0%
Sedation related complications Incidence of hypotension. Effect measure: risk ratio [95% CI]:
B: 1.82 [1.00 – 3.30]
Pooled effect (random effects model model): 1.41 [95% CI 0.89 to 2.25] favoring dexmedetomidine. Heterogeneity (I2): 77%
Dexmed vs. Propofol: ICU length of stay The number of days at the ICU. Effect measure: mean difference [95% CI]: E: 2.00 [-3.12 – 7.12] favoring propofol.
Duration of mechanical ventilation The number of days of mechanical ventilation. Effect measure: mean difference [95% CI]:
D: 0.12 [-1.58 – 1.82] favoring propofol.
Mortality
D: 0.88 [0.61 – 1.28]
Pooled effect (random effects model model): 0.86 [95% CI 0.60 to 1.23] favoring dexmedetomidine. Heterogeneity (I2): 0%
Delirium Effect measure: risk ratio [95% CI]:
D: 0.50 [0.26 – 0.98] favoring dexmedetomidine.
Selfextubations Effect measure: risk ratio [95% CI]:
D: 3.01 [0.12 – 73.58] favoring porpofol.
Sedation- related complications Effect measure: risk ratio [95% CI]:
D: 0.97 [0.62 – 1.53] favoring dexmedetomidine.
|
Author’s conclusion There is an indication that dexmedetomidine may have a better cardiovascular safety profile than clonidine, but evidence is limited. Length of stay in ICUs and time to extubation were significantly shorter among patients who received dexmedetomidine than among those who received other sedative agents other than clonidine. No difference was observed in time in target sedation range between dexmedetomidine and alternative sedative interventions. Incidence of bradycardia was significantly higher for dexmedetomidine, but did not impact on mortality. There was no clear evidence that dexmedetomidine was superior to other sedative agents in reducing the risk of delirium. Considerable clinical heterogeneity between trials was observed, and the overall risk of bias was high or unclear.
Risk of bias A: Blinding unclear, other (LOW) E: Lack of blinding (LOW)
Overall publication bias: LOW
|
|
Ho, 2008 |
SR and meta-analysis of RCTs
Literature search up to December, 2007
A: Ghori, 2007 B: Kress, 1996 D: Barrientos-Vega, 1997 E: Chamorro, 1996 F. Hall, 2001 G: Weinbroum, 1997 H: Degauque, 1991 I: Costa, 1994 J: Manley, 1997 K: Sanchez-Izquierdo-Reira, 1998 L: Kress, 2001
Study design: RCTs
Setting and Country: A: Ireland H: Belgium L: USA
Source of funding and conflicts of interest: A: University hospital H: not descirbed L: not described
|
Inclusion criteria SR: Only randomised controlled clinical trials comparing propofol with an alternative sedative drug for medium term (24 h to B7 days) or long-term ([7 days) sedation in critically ill adult patients were included.
Exclusion criteria SR: Studies comparing the effects of two different formulations of propofol (e.g. 1% vs. 2% propofol or propofol with antibacterial additive vs. propofol without antibacterial additive) and also short-term (\24 h) sedation studies were excluded.
10 studies included
Important patient characteristics at baseline:
Number of patients (n: prop/mida) A: 13/15 L: 62/66 Groups comparable at baseline? Yes |
A: Propofol: maximum infusion rate 5 mg/kg h-1, mean infusion rate not specified kg h-1 (on day1) and 5.7 mg/kg h-1 (on day 14) to 0.6 mg/kg h-1 but the mean dose used in the study was not reported described, mean infusion rate = 1.8 mg/kg h-1 H: Propofol: maximum infusion rate not described, mean infusion rate = 1.7 mg/kg h-1 mean infusion rate not described. Morphine 0.2– 0.5 mg/kg day-1 alfentanil 0.5–2 lg/kg h-1 K: Propofol: maximum infusion rate 6 mg/kg h-1, mean infusion rate = 2.1 mg/kg h-1 mean infusion rate not described
|
A: Midazolam: maximum infusion rate 0.3 mg/kg h-1, mean infusion rate not specified specified, starting from 0.012 to 0.024 mg/kg h-1 but mean dose used in the study was not reported described, mean infusion rate = 0.07 mg/kg h-1 described, mean infusion rate = 0.14 mg/kg h-1 mean infusion rate not described Morphine 0.2– 0.5 mg/kg day- infusion rate not described. infusion rate = 0.19 mg/ kg h- described, mean infusion rate = 0.04 mg/kg |
End-point of follow-up: Not reported.
For how many participants were no complete outcome data available? Not reported.
|
Propofol versus midazolam ICU length of stay The number of days at the ICU.
Effect measure: mean difference [95% CI]: C: -4.25 [-9.28 – 0.78] G: -10 [-25.80 – 5.80]
Pooled effect (random effects model model): -1.60 [95% CI -3.69 to 0.48] favoring propofol Heterogeneity (I2): 77%
Mortality
Effect measure: risk ratio [95% CI]: A: 1.92 [0.57 – 6.54] F: 1.40 [0.69 – 2.85] L: 1.29 [0.85 – 1.95]
Pooled effect (random effects model model): 1.12 [95% CI 0.86 to 1.46] favoring midazolam. Heterogeneity (I2): 0%
|
Author’s conclusion In summary, with the limited data available, using propofol for medium and long-term sedation in critically ill adult patients appears to be safe and may reduce the duration of mechanical ventilation. It reduces the length of ICU stay when compared to long acting benzodiazepines, but not when compared to midazolam.
Risk of bias A: Lack of blinding 7% of the patients excluded. L: Lack of blinding, 15% of the patients excluded, no ITT.
|
|
Liu, 2017 |
SR and meta-analysis of RCTs
Literature search up to May 23rd , 2016
A: Herr, 2003
Study design: RCTs
Setting and Country: A: America & Canada H: China Source of funding and conflicts of interest: The authors have stated that there is no conflict of interest to declare. ☆☆ Sources of funding: This work was supported by the National Science Foundation of China (No. 81501638, No. 81301652) and the Specialized Research Fund for the Doctoral Program of Higher Education (No. 20130101120028). |
Inclusion criteria SR: Eligible studies were of randomized controlled trials (RCTs), comparing dexmedetomidine with propofol for sedation in adult patients after cardiac surgery.
Exclusion criteria SR: n.r.
8 studies included
Important patient characteristics at baseline:
Number of patients (n: dex/prop) A: 148/147 Target sedation level: A: RSS ≥ 3 during assisted ventilation and ≥2 after extubation surgery, followed by a score of 3-4 after extubation BIS: 60-90 Groups comparable at baseline? Yes |
Dexmedetomidine A: 1 μg/kg for 20 min loading dose; 0.2-0.7 μg kg−1 h−1 infusion rate kg−1 h−1 infusion rate. kg−1 h−1 infusion rate. kg−1 h−1 infusion rate. kg−1 h−1 infusion rate. kg−1 h−1 infusion rate. 10-20 min or no Bolus loading dose; 0.2-0.7 μg kg−1 h−1 infusion rate. kg−1 h−1 infusion rate. |
Propofol: A: varying loading dose; infusion rate Varied, 97.56 ± 15.83 mg/h kg−1 h−1 h−1 h−1 in ICU h−1 h−1 h−1 h−1 |
End-point of follow-up: Not reported.
For how many participants were no complete outcome data available? Not reported.
|
ICU length of stay The number of days at the ICU. Effect measure: mean difference [95% CI]:
B: 0.00 [-1.70 – 1.70]
Pooled effect (random effects model model): -14.09 [95% CI -37.07 to –17.94] favoring dexmedetomidine Heterogeneity (I2): 83%
Duration of mechanical ventilation The number of days of mechanical ventilation. Effect measure: mean difference [95% CI]:
A: -0.90 [-2.01 – 0.21] H: -0.30 [-2.81 – 2.21]
Pooled effect (random effects model model): -0.95 [95% CI -1.26 to –-0.64] favoring dexmedetomidine Heterogeneity (I2): 0%
Mortality
Delirium Effect measure: risk ratio [95% CI]:
B: 1.07 [0.07 – 16.57]
Pooled effect (random effects model model): 0.28 [95% CI 0.07 to 1.10] favoring dexmedetomidine Heterogeneity (I2): 55%
Selfextubations
Sedation-related complications Incidence of hypotension. Effect measure: risk ratio [95% CI]:
A: 1.49 [0.94 – 2.37]
Pooled effect (random effects model model): 1.20 [95% CI 0.85 to 1.72] favoring propofol Heterogeneity (I2): 57%
|
Author’s conclusion Dexmedetomidine sedation could reduce postoperative delirium and was associated with shorter length of intubation, but might increase bradycardia in patients after cardiac surgery compared with propofol.
Risk of bias A: Lack of blinding, unclear sequence generation.
|
|
Zhou, 2020 |
SR and meta-analysis of RCTs
Literature search up to October, 2018
Study design: RCTs
Setting and Country: H: China Source of funding and conflicts of interest: The present study was supported by Nature Science Foundation of Hubei Province (grant no. 2018CFB353) and the Wuhan Health and Family Planning Commission Young and Middle‑aged Medical Backbone Talent Fund (grant no. (2018)116).
The authors declare that they have no competing interests. |
Inclusion criteria SR: i) A randomized controlled trial or a controlled clinical trial; ii) comparison of the clinical effects and mortality of dexmedetomidine and midazolam; iii) patients that are critically ill (patients whose condition is acute, critical and rapidly changing) were included; and iv) full text articles were available.
Exclusion criteria SR: i) Non‑randomized study; ii) studies on treatments other than dexmedetomidine or midazolam; iii) patients that are critically ill were not included; iv) studies lacking outcome measures or comparable results; and v) duplicated publications and incomplete data or articles.
8 studies included
Important patient characteristics at baseline:
N (dexmed /midazolam)
Age (range)
Groups comparable at baseline? Yes |
Dexmedetomidine
|
Midazolam |
End-point of follow-up: Not reported
For how many participants were no complete outcome data available? Not reported
|
Dexmed vs. Midazolam ICU length of stay The number of days at the ICU. Effect measure: mean difference [95% CI]:
Pooled effect (random effects model model): -1.86 [95% CI -2.24 to -1.48] favoring dexmedetomidine Heterogeneity (I2): 2%
Mortality Effect measure: risk ratio [95% CI]:
Pooled effect (random effects model model): 0.97 [95% CI 0.78 to 1.19] favoring dexmedetomidine. Heterogeneity (I2): 0%
Delirium Effect measure: risk ratio [95% CI]:
Pooled effect (random effects model model): 0.72 [95% CI 0.65 to 0.79] favoring dexmedetomidine. Heterogeneity (I2): 0%
Sedation related complications Incidence of hypotension. Effect measure: risk ratio [95% CI]:
Pooled effect (random effects model model): 0.94 [95% CI 0.82 to 1.07] favoring dexmedetomidine. Heterogeneity (I2): 0%
|
Author’s conclusion Taking clinical effects and safety into account, the present study suggested dexmedetomidine to be the preferred option of anesthesia for patients that are critically ill.
Risk of bias
Overall publication bias: LOW
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk-of-bias tables
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Abowali, 2021 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
No |
|
Cruickshank, 2016 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
Yes |
|
Ho, 2008 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Liu, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Zhou, 2020 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Adams, 2013 |
De geïncludeerde studies komen terug in recentere reviews. |
|
Chen, 2015 |
Minder volledige meta-analyse dan andere reviews die dexmed met propofol/midazolam vergelijken. |
|
Fan, 2017 |
De geïncludeerde studies komen uit de search én er zijn een aantal studies toegevoegd n.a.v. de referentielijst van de gevonden studies. |
|
Flükiger, 2018 |
Alleen gekeken naar delier, zoekactie heeft beperkingen t.o.v. andere SRs. |
|
Lewis, 2021 |
Verkeerde populatie (adults supported with NIV at the ICU) |
|
Li, 2015 |
De uitkomstmaat in de review komt niet overeen met de vooraf vastgestelde uitkomstmaten. |
|
Lin, 2012 |
Maar 1 studie uit de review is geschikt die ook in nieuwere review is geïncludeerd. |
|
Liu, 2021 |
De uitkomstmaten in de review komt niet overeen met de vooraf vastgestelde uitkomstmaten. |
|
Pasin, 2013 |
De uitkomstmaten in de review komt niet overeen met de vooraf vastgestelde uitkomstmaten. |
|
Peng, 2017 |
Alleen gekeken naar delier, zoekactie heeft beperkingen t.o.v. andere SRs. |
|
Pradelli, 2017 |
Verkeerde controlegroep (benzodiazepines). |
|
Tran, 2018 |
Maar 2 studies komen in aanmerking voor deze UV en er is geen meta-analyses uitgevoerd. |
|
Turunen, 2015 |
De uitkomstmaten in de review komt niet overeen met de vooraf vastgestelde uitkomstmaten. |
|
Walder, 2001 |
Geen ROB onderzocht |
|
Wang, 2019 |
Verkeerd studiedesign (netwerk meta-analyse met meerdere middelen vergeleken). |
|
Wang, 2021 |
Onvolledige meta-analyse qua uitkomstmaten. |
|
Xing, 2018 |
Minder volledige meta-analyse dan andere reviews die dexmed met propofol/midazolam vergelijken. |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 16-12-2022
Laatst geautoriseerd : 16-12-2022
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Het doel is herziening van bestaande trias van Sedatie en Analgesie richtlijnen, waar sedatie en analgesie op de IC een onderdeel van is. De Sedatie en Analgesie richtlijnen hebben betrekking op alle patiënten die sedatie krijgen buiten de OK. De richtlijn zal blijven bestaan uit drie delen – volwassenen; kinderen; en IC. Deze patiëntencategorieën kennen specifieke risico’s waardoor specifieke aanbevelingen nodig zijn.
Sedatie en analgesie van de patiënten die een IC-behandeling krijgen verschilt steeds meer van procedurele sedatie en analgesie. Daarom staat deze IC-richtlijn in de nieuwe sedatie en alagesie-richtlijn meer los van de twee sedatie en analgesie richtlijnen (volwassenen en kinderen). Voorliggende richtlijn beschrijft het comfortabel krijgen en houden van patiënten die een IC-behandeling ondergaan, het tegengaan van pijn, agitatie en stress. Het beschrijft de medicamenteuze en niet medicamenteuze opties om de patiënt met zo min mogelijk complicaties in zo kort mogelijke tijd naar zo hoog mogelijk functioneel herstelniveau te krijgen, zowel fysiek als mentaal.
De richtlijn heeft betrekking op intensivisten en IC-verpleegkundigen. Daarnaast kan de richtlijn gebruikt worden door zorgverleners die betrokken zijn bij de behandeling op of na de Intensive Care zoals de mee behandelende medisch specialisten, paramedici, verpleegkundig specialisten en apothekers.
Er is afstemming met de twee andere onderdelen van de richtlijn Sedatie en Analgesie, namelijk die voor volwassenen en voor kinderen en mag samen met deze onderdelen als geheel worden gezien.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij sedatie en analgesie van patiënten op de IC. Inbreng patiënten- en naastenperspectief via Stichting FCIC en patiëntenorganisatie IC Connect.
Werkgroep
Drs. N.C. (Niels) Gritters van de Oever, anesthesioloog-intensivist, Treant zorggroep, NVIC
Dr. K.S. (Koen) Simons, internist-intensivist, Jeroen Bosch Ziekenhuis, NVIC
Dr. M. (Marissa) Vrolijk, anesthesioloog-intensivist-, LangeLand Ziekenhuis Zoetermeer, NVIC
Dr. L. (Lena) Koers, anesthesioloog-kinderintensivist, Leiden UMC, NVA
Dr. H. (Rik) Endeman, internist-intensivist, Erasmus MC, NIV
Dr. M. (Mark) van den Boogaard, IC verpleegkundige, senior onderzoeker, Radboud UMC, V&VN
Drs. R. (Roel) van Oorsouw, fysiotherapeut, Radboud UMC, KNGF
Dr. N.G.M. (Nicole) Hunfeld, ziekenhuisapotheker, Erasmus MC, NVZA
Drs. W.P. (Wai-Ping) Manubulu-Choo, ziekenhuisapotheker, Martini Ziekenhuis, NVZA
Drs. M. (Marianne) Brackel, patiëntvertegenwoordiger, Stichting FCIC en patiëntenorganisatie IC Connect, Jeugdarts knmg niet praktiserend
Met methodologische ondersteuning van
• Drs. Florien Ham, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• Drs. Toon Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• Dr. Mirre den Ouden - Vierwind, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• Drs. Ingeborg van Dusseldorp, senior informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. N.C. (Niels) Gritters van de Oever |
Anesthesioloog-intensivist Treant zorggroep. |
Onbezoldigd en t/m juni 2021: NVIC bestuur ( NVIC accreditatie commissie NVIC luchtwegcommissie, congrescommissie) Chief Medical Officer van de LCPS (dagvergoeding) t/m maart 2022 voorzitter farmacotherapiecommissie NVIC per juli 2022 lid stafbestuur Treant ziekenhuisgroep per aug 2022 (vacatievergoeding) lid scientific board covidpredict per 2020 (onbezoldigd), commissie Acute Tekorten Geneesmiddelen per 2020 (vergadervergoeding) |
Geen. |
Geen actie. |
|
Dr. K.S. (Koen) Simons |
Internist-intensivist Jeroen Bosch Ziekenhuis. |
FCCS-instructeur bij NVIC (ca. 2 dagen/jaar, betaald). |
Geen. |
Geen actie. |
|
Dr. M. (Marissa) Vrolijk |
Anesthesioloog- intensivist LangeLand Ziekenhuis. |
Medisch beoordelaar adoptie bij Adoptie Stichting Meiling. |
Geen. |
Geen actie. |
|
Dr. L. (Lena) Koers |
Anesthesioloog-kinderintensivist LUMC |
Geen. |
Geen. |
Geen actie. |
|
Dr. H. (Rik) Endeman |
Internist-intensivist, Erasmus MC. |
Voorzitter van de gemeenschappelijke intensivisten commissie (GIC) (onbetaald). |
TravelGrant van Getinge om te spreken op een lunchsymposium in Kenya voor het jaarcongres (2018) van de Kenyan Society of Anaesthesiology and Intensive Care Medicine. Dit congres wordt ook veelbezocht door anaesthesisten en intensivisten uit omliggende landen. Het onderwerp was 'Hemodynamic monitoring in low resource and high resource environments', duurde een uur, en ging over wat voor meetinstrumenten je kan gebruiken om de hemodynamiek te bewaken indien je geen middelen hebt (low resource) en wel (high resource); duurde uiteindelijk 90 minuten. GETINGE verkoopt high-end HD-monitoring, deze kwamen in de presentatie voor, maar ook die van concurrenten. GETINGE had mij niets opgelegd m.b.t. de inhoud van de presentatie. PI van: Open Lung Concept 2.0 studie: Flow controlled ventilation (gesponsord door Ventinova). |
Geen actie. Het gesponsorde onderzoek is niet gerelateerd aan het onderwerp van de richtlijn. |
|
Dr. M. (Mark) van den Boogaard |
Senior onderzoeker, afdeling lntensive Care, Radboudumcc. |
Onbezoldigde functies: - Bestuurslid European Delirium Association. - Adviseur Network for lnvestigation of Delirium: Unifying Scientists (NIDUS). - Organisator IC-café regio Nijmegen & Omstreken. - Lid werkgroep Longterm Outcome and ICU Delirium van de European Society of lntensive Care Medicine. - Lid richtlijn Nazorg en revalidatie IC-patiënten. |
PI van onderstaande gesubsidieerde projecten: ZonMw subsidies: - programma GGG [2013]: Prevention of ICU delirium and delirium-related outcome with haloperidol; a multicentre randomized controlled trial. - programma DO [2015]: The impact of nUrsing DEliRium Preventive lnterventions in the lntensive Care Unit (UNDERPIN-ICU). Delirium komt terug in beide projecten en in de richtlijn, maar er zullen geen aanbevelingen naar vormen komen die belangenverstrengeling veroorzaken. Geen problemen worden voorzien, vanwege het niet betrokken zijn bij aanbevelingen over medicatie/verpleegkundige interventie obv door ZonMw gesubsidieerde projecten. ZIN subsidie: - programma Gebruiken van uitkomsteninformatie bij Samen beslissen [2018]: Samen beslissen op de IC: het gebruik van (patiëntgerapporteerde) uitkomst informatie bij gezamenIijke besluitvorming over IC-opname en behandelkeuzes op de IC. |
Geen actie. |
|
Drs. R. (Roel) van Oorsouw |
Fysiotherapeut/ PhD-kandidaat Radboudumc. |
Visiterend docent op de Hogeschool. Arnhem Nijmegen (10 uur per jaar) Congrescommissie NVZF (tot oktober 2021) Lid ethiekcommissie KNGF (sinds oktober 2021). |
Geen. |
Geen actie. |
|
Dr. N.G.M. (Nicole) Hunfeld |
Ziekenhuisapotheker ErasmusMC. |
Bestuurslid KNMP (functie: penningmeester, betaald). |
Boegbeeldfunctie, maar sedatie heeft geen relatie met openbare farmacie. |
Geen actie. |
|
Drs. W.P. (Wai-Ping) Manubulu-Choo |
Ziekenhuisapotheker, Martini Ziekenhuis. |
Geen. |
Geen. |
Geen actie. |
|
Drs. M. (Marianne) Brackel |
Patiëntvertegenwoordiger, Stichting FCIC en patiëntenorganisatie IC Connect, Jeugdarts knmg niet praktiserend. |
Geen. |
Geen. |
Geen actie. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Stichting Family and patient Centered Intensive Care (FCIC) en de patiëntenorganisatie IC Connect voor deelname aan de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de FCIC en IC Connect en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module 1 Pijnprotocol op de IC |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 2 Lichte sedatie op de IC |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 3a Analgetica versus hypnotica |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 3b Analgeticum bij analgosedatie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 4 Intraveneuze medicatie op de IC |
Geen substantiële financiële gevolgen. |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 5 Inhalatieanesthetica op de IC |
Geen substantiële financiële gevolgen. |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 6 Nonfarmacologische interventies |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 7 Organisatie van zorg |
Geen substantiële financiële gevolgen. |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sedatie en analgesie op de IC. Er is een knelpuntenanalyse gehouden samen met de andere Sedatie en analgesie richtlijnen. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld. Ook beoordeelde de werkgroep de aanbeveling(en) uit de eerdere richtlijn Procedurele Sedatie en analgesie bij volwassenen op de Intensive Care (NVK/NVA, 2012) op noodzaak tot revisie. Tevens is er gekeken naar samenhang met andere bestaande en te ontwikkelen richtlijnen, o.a. de richtlijn Delirium op de Intensive Care (NVIC, 2010) en de richtlijn Nazorg en revalidatie van intensive care patiënten (VRA/NVIC) en aansluiting op de Europese richtlijn PADIS, 2018, die over hetzelfde onderwerp gaat. Ten tijde van de autorisatiefase van deze richtlijn verscheen de richtlijn sepsis (NIV), waarin onderdelen van de sedatie van de septische IC-patiënt worden besproken. Beide richtlijnen vullen elkaar aan.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
er is hoge zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; het is zeer onwaarschijnlijk dat de literatuurconclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Redelijk |
er is redelijke zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; het is mogelijk dat de conclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Laag |
er is lage zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; er is een reële kans dat de conclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Zeer laag |
er is zeer lage zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; de literatuurconclusie is zeer onzeker. |
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
