Dieetmaatregelen: eiwitbeperking bij eindstadium nierfalen
Uitgangsvraag
Geeft strikte eiwitbeperking uitstel van start met nierfunctievervangende therapie en welke mate van eiwitbeperking is aan te bevelen bij patiënten met eindstadium nierfalen?
P: Patiënten met eindstadium nierfalen
I: Strikt eiwitbeperkt dieet <0,8 g/kg/dag
C: (Geen strikt eiwitbeperkt dieet)
O: Uitstellen moment start nierfunctievervangende therapie vs katabolie (incl. protein-energy wasting)
Aanbeveling
Een zeer strikte eiwitbeperking (0,3-0,4 g/kg/dag met suppletie van keto-analoge aminozuren) wordt niet aanbevolen bij patiënten met eindstadium nierfalen die kiezen voor nierfunctievervangende therapie, met als doel om de start van de dialyse uit te stellen.
Een strikte eiwitbeperking (0,6 g/kg/dag) wordt niet aanbevolen bij patiënten met eindstadium nierfalen, die kiezen voor dialyse met als doel om de start van nierfunctievervangende therapie uit te stellen aangezien hier onvoldoende bewijs voor is.
Een eiwitinname overeenkomend met een strikte eiwitbeperking kan echter wel spontaan ontstaan als gevolg van uremie. Intensieve dieetbegeleiding, inclusief nutritional assessment is vereist om ervoor te zorgen dat voedingstekorten worden voorkomen.
Een normaal aanbevolen eiwitinname (0,8 g/kg/dag) wordt voor deze groep wel aanbevolen.
Overwegingen
Zeer strikte eiwitbeperking (0,3-0,4 g/kg/dag met suppletie van keto-analoge aminozuren) leidt mogelijk tot uitstel van het moment tot start met nierfunctievervangende therapie. Echter, hier zijn drie problemen bij:
- Een zeer strikte eiwitbeperking zoals in de studies is in de praktijk moeilijk haalbaar. Een eiwitbeperking van 0,3-0,4 g/kg/dag komt neer op onvolwaardige vegetarische voeding. Bijvoorbeeld: Voor een man, 182 cm en 77 kg betekent dit 23-31 g eiwit per dag. Dit wordt geleverd door 4-5 snee brood met halvarine/margarine en zoetbeleg, 1 portie groente, 1 portie aardappelen/rijst/pasta en 1-2 porties fruit. De energiebehoefte wordt hiermee niet gedekt. Suppletie van keto-analoge aminozuren (in Nederland komen deze preparaten niet in aanmerking voor vergoeding), vitamines en mineralen is noodzakelijk.
- In de beschikbare studies zijn patiënten ingedeeld in groepen met het advies om al dan niet een bepaalde mate van eiwitbeperking te realiseren. Het is volgens de werkgroep waarschijnlijk dat deze adviezen in de interventiegroep in de praktijk niet gehaald zijn. Dit maakt de conclusies van de studies onbetrouwbaar.
- De nadelen van strikte of zeer strikte eiwitbeperking (met suppletie van keto-analoge aminozuren) zijn met betrekking tot protein-energy wasting niet goed en wat betreft kwaliteit van leven in het geheel niet onderzocht.
Het is onduidelijk of een strikte eiwitbeperking (0,6 g/kg/dag) leidt tot uitstel van start met nierfunctievervangende therapie.
- Ook in deze studies is het volgens de werkgroep waarschijnlijk dat de geadviseerde hoeveelheid eiwit niet is behaald, waardoor deze resultaten eveneens onbetrouwbaar zijn.
- Het samenstellen van een volwaardige voeding op basis van 0,6 g/kg/dag eiwit is vrijwel onmogelijk. Verslechtering van de voedingstoestand is bij het hanteren van een strikte eiwitbeperking niet uit te sluiten.
In de multidisciplinaire richtlijn Chronische nierschade is de aanbeveling bij een eGFR <30 ml/min/1,73 m2 een eiwitinname van 0,8 g/kg/dag. Dit komt overeen met de voedingsnorm voor volwassenen van de Gezondheidsraad en internationaal geaccepteerde referentiewaarden.(7, 10, 12, 13)
Een lagere eiwitinname, overeenkomend met de strikte eiwitbeperking in de meta-analyse, kan bij eindstadium nierfalen spontaan ontstaan als gevolg van uremie.
Bij advisering omtrent eiwitbeperking danwel voldoende eiwitinname is intensieve dieetbegeleiding vereist, waaronder een nutritional assessment. Dit is het systematisch beoordelen van de voedingstoestand en voedingsbehoefte. Er worden metingen gedaan in drie domeinen:
- voedselinname, verbruik en verliezen
- lichaamssamenstelling en nutriëntenreserves
- functionele parameters aangevuld met biochemische parameters (laboratoriumonderzoek).
Onderbouwing
Achtergrond
‘Protein-energy wasting’ (PEW) is een verlies van eiwit- en energievoorraad in het lichaam, niet alleen veroorzaakt door verminderde eiwit- en calorische intake maar ook als gevolg van andere processen waaronder chronische inflammatie.(1) [ref] De prevalentie van PEW neemt toe naarmate de glomerulaire filtratiesnelheid daalt en komt voor bij 11-54% van patiënten met chronische nierschade stadium 3-5. Dit is derhalve een zeer veelvoorkomend verschijnsel bij patiënten met eindstadium nierfalen.(2) PEW is in belangrijke mate geassocieerd met een aanzienlijk verhoogde morbiditeit en mortaliteit en verminderde kwaliteit van leven.(2, 3)
Bij achteruitgang van de nierfunctie neemt de hoeveelheid stikstofhoudende afvalproducten uit voeding en lichaamseigen eiwitkatabolisme in het lichaam toe. Dit heeft een negatieve invloed op smaak, geur en eetlust. Uremie verandert tevens het microbioom in de darm en het epitheel van het maagdarmkanaal, waardoor de opname van voedingsstoffen verslechtert. Daardoor treedt er verlies op van spier- en vetmassa.(4)
De minimale eiwitbehoefte, bepaald door stikstofbalansstudies bij een gezonde volwassene, is 0,8 g/kg (gecorrigeerd voor ideaal lichaamsgewicht).(5-7) Ouderen (>70 jaar) hebben een hogere eiwitbehoefte omdat de eiwitsynthese afneemt. Dit geldt naar alle waarschijnlijkheid ook voor oudere patiënten met chronische nierschade. Diëtisten zien meestal dat de eiwit-inname afneemt naarmate de nierfunctie slechter wordt en minder wordt dan de aanbevolen minimale hoeveelheid. Tevens is de eiwitopname verminderd als gevolg van uremie. Mogelijk vertraagt deze ‘eiwitondervoeding’ de verdere achteruitgang van nierfunctie, maar dit kan anderzijds leiden tot een katabole toestand van het lichaam.(8-10)
De vraag is of (tijdelijk) uitstel van de start van dialyse door verminderde inname van eiwit opweegt tegen de achteruitgang van de voedingstoestand met bijbehorende negatieve gevolgen. Het is de ervaring dat patiënten na start van dialyse regelmatig aangeven dat de eetlust verbetert.
Deze module vormt een aanvulling op de richtlijn chronische nierschade.
Conclusies / Summary of Findings
|
LAAG |
Er is geen voordeel aangetoond van strikte eiwitbeperking (0,6 g/kg/dag) versus normale eiwitintake (≥1 g/kg/dag) voor patiënten met eindstadium nierfalen voor wat betreft de progressie tot nierfunctievervangende therapie, maar dit resultaat is onzeker.
Hahn, 2018(11) |
|
REDELIJK |
Er is redelijke zekerheid dat een zeer strikt eiwitbeperkt dieet (0,3-0,4 g/kg/dag met suppletie van keto-analoge aminozuren) effectief is bij patiënten met eindstadium nierfalen om het moment tot start van nierfunctievervangende therapie uit te stellen (RR: 0,62; 95% BI: 0,44-0,87).
Hahn, 2018(11) |
|
ZEER LAAG |
Er is geen voordeel aangetoond van strikte of zeer strikte eiwitbeperking (0,6 g/kg/dag of 0,3-0,4 g/kg/dag met suppletie van keto-analoge aminozuren) versus strikte eiwitbeperking of normale eiwitintake (0,6 g/kg/dag of ≥1 g/kg/dag) voor patiënten met eindstadium nierfalen voor wat betreft de protein-energy wasting, maar dit resultaat is zeer onzeker.
Hahn, 2018(11) |
|
Algehele kwaliteit van bewijs: zeer laag |
Samenvatting literatuur
Beschrijving studies
In totaal werd één systematische review geïncludeerd in deze literatuuranalyse.(11) Een tabel met studiekarakteristieken is opgenomen in de evidence-tabellen. De Cochrane review van Hahn betrof een zeer recent gepubliceerde review van 17 RCT’s met in totaal 2996 patiënten. In deze review waren patiënten opgenomen met verschillende stadia van chronische nierschade. Voor deze richtlijn zijn nieuwe meta-analyses gedaan, waarbij alleen de RCT’s zijn meegenomen van patiënten met stadium 4 of 5 chronische nierschade en/of eGFR <30 ml/min/1,73 m2. In de review werd strikte eiwitbeperking (0,6 g/kg/dag) vergeleken met normale eiwitintake (≥1 g/kg/dag), en ook was er een vergelijking van zeer strikte eiwitbeperking (0,3-0,4 g/kg/dag met suppletie van keto-analoge aminozuren) met normale of strikt beperkte eiwitintake.
Kwaliteit van bewijs
De kwaliteit van bewijs varieert per uitkomstmaat per analyse. Voor wat betreft de progressie tot start van nierfunctievervangende therapie was de kwaliteit van bewijs redelijk voor de vergelijking waarin zeer strikte eiwitbeperking werd vergeleken met normale of strikt beperkte eiwitbeperking en laag voor de vergelijking tussen strikt beperkte en normale eiwitintake. Voor de uitkomstmaat protein-energy wasting was de kwaliteit van bewijs zeer laag. Factoren die bijdroegen aan het verlagen van de kwaliteit van bewijs waren met name een ernstige risk of bias (vanwege problemen met randomisatie en beperkte follow-up data) en onnauwkeurigheid (met name door zeer weinig events in de analyses). Een gedetailleerde uitwerking hiervan is opgenomen in de evidence-tabellen.
Effectiviteit
De resultaten van de ‘custom-made’ meta-analyses staan in onderstaande figuren vermeld.
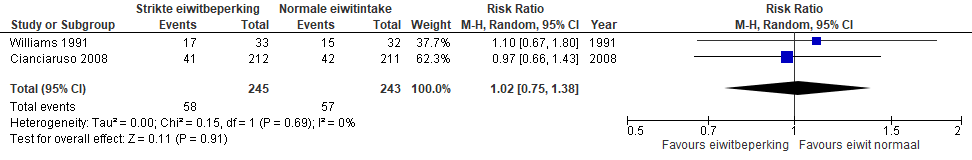
Figuur 1. Progressie tot start nierfunctievervangende therapie – strikte eiwitbeperking (0,6 g/kg/dag) versus normale eiwitintake (≥1 g/kg/dag) bij patiënten met stadium 4 of 5 chronische nierschade en/of eGFR <30 ml/min/1,73 m2
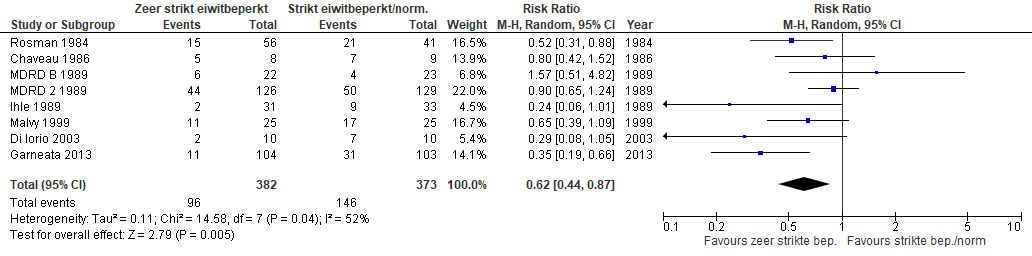
Figuur 2. Progressie tot start nierfunctievervangende therapie – zeer strikte eiwitbeperking (0,3-0,4 g/kg/dag met suppletie van keto-analoge aminozuren) versus strikte eiwitbeperking (0,6 g/kg/dag) of normale eiwitintake (≥1 g/kg/dag) bij patiënten met stadium 4 of 5 chronische nierschade en/of eGFR <30 ml/min/1,73 m2

Figuur 3. ‘Protein-energy wasting’ – (zeer) strikte eiwitbeperking (0,3-0,4 g/kg/dag met suppletie van keto-analoge aminozuren of 0,6 g/kg/dag) versus strikte eiwitbeperking (0,6 g/kg/dag) of normale eiwitintake (≥1 g/kg/dag) bij patiënten met stadium 4 of 5 chronische nierschade en/of eGFR <30 ml/min/1,73 m2
Bijwerkingen
Hiernaar is geen systematisch literatuuronderzoek gedaan.
Zoeken en selecteren
Voor een antwoord op deze vraag is op 22 augustus 2018 gezocht naar evidence (zie de zoekverantwoording). Daarbij is gezocht naar systematische reviews en randomised controlled trials. Uit de literatuursearch kwamen 18 potentieel geschikte systematische reviews en 235 potentieel geschikte randomised controlled trials. De opbrengst van de literatuursearches is vervolgens geselecteerd op basis van onderwerp (sluit het artikel aan bij de uitgangsvraag?), waarbij eerst is gekeken naar de systematische reviews. De literatuurselectie is weergegeven in de zoekverantwoording. De eerste ronde literatuurselectie gebeurde op basis van abstracts van de systematische reviews, waarna 5 artikelen fulltekst werden bestudeerd. Daarbij bleken er opnieuw 4 niet aan de inclusiecriteria te voldoen. Eén Cochrane systematische review bleef ten slotte over.(9) Op het moment van verdere literatuuranalyse werd gecontroleerd in de Cochrane database of intussen een update van de Cochrane systematische review was gepubliceerd. Dat bleek het geval; deze is derhalve meegenomen, in plaats van de review van Fouque et al. uit 2009.(11) Ten slotte is in het literatuurbestand met randomised controlled trials nog nagegaan of er nog aanvullende RCT’s waren verschenen ná de inclusiedatum van de Cochrane systematische review van Hahn et al. Dit bleek niet zo te zijn, derhalve bestaat de body of evidence voor deze vraag uit het artikel van Hahn et al. Nieuwe meta-analyses zijn gemaakt met behulp van RevMan 5.3.
Referenties
- 1 - Fouque D, Kalantar-Zadeh K, Kopple J, Cano N, Chauveau P, Cuppari L, et al. A proposed nomenclature and diagnostic criteria for protein-energy wasting in acute and chronic kidney disease. Kidney Int. 2008;73(4):391-8.
- 2 - Carrero JJ, Thomas F, Nagy K, Arogundade F, Avesani CM, Chan M, et al. Global Prevalence of Protein-Energy Wasting in Kidney Disease: A Meta-analysis of Contemporary Observational Studies From the International Society of Renal Nutrition and Metabolism. J Ren Nutr. 2018;28(6):380-92.
- 3 - Lodebo BT, Shah A, Kopple JD. Is it Important to Prevent and Treat Protein-Energy Wasting in Chronic Kidney Disease and Chronic Dialysis Patients? J Ren Nutr. 2018;28(6):369-79.
- 4 - Kalantar-Zadeh K, Fouque D. Nutritional Management of Chronic Kidney Disease. N Engl J Med. 2017;377(18):1765-76.
- 5 - Weijs PJ. Eiwitbalans bij ziekte, gezondheid en veroudering. Nederlands Tijdschrift voor Voeding en DIëtetiek. 2015;70(6):12-4.
- 6 - Bauer J, Biolo G, Cederholm T, Cesari M, Cruz-Jentoft AJ, Morley JE, et al. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the PROT-AGE Study Group. J Am Med Dir Assoc. 2013;14(8):542-59.
- 7 - Gezondheidsraad. Voedingsnormen energie, eiwitten, vetten en verteerbare koolhydraten. . 2001. Contract No.: 2001/19R (gecorrigeerde editie; juni 2002).
- 8 - Fouque D, Pelletier S, Mafra D, Chauveau P. Nutrition and chronic kidney disease. Kidney Int. 2011;80(4):348-57.
- 9 - Fouque D, Laville M. Low protein diets for chronic kidney disease in non diabetic adults. Cochrane Database Syst Rev. 2009(3):CD001892.
- 10 - Kidney disease igo. Clinical Practice Guideline for the evaluation and management of chronic kidney disease. 2012.
- 11 - Hahn D, Hodson EM, Fouque D. Low protein diets for non-diabetic adults with chronic kidney disease. Cochrane Database Syst Rev. 2018;10:CD001892.
- 12 - (EFSA) EFSA. Dietary Reference Values for nutrients. Summary report.; 2017.
- 13 - (NIH). NIoH. Nutrient Recommendations: Dietary Reference Intakes. 2002/2005.; 2005.
Evidence tabellen
|
1e Auteur |
Jaartal |
Setting |
Design |
Doel |
Follow-up |
Patiënten |
Interventie |
Controle |
Uitkomsten |
Resultaten |
Conclusie auteurs |
Risk of bias |
Opmerkingen |
|
Hahn |
2018 |
- |
Cochrane systematische review |
Onderzoeken effectiviteit eiwitbeperkt dieet in het vertragen van de progressie van chronische nierschade naar eindstadium nierfalen en het vertragen van de start van dialysebehandeling bij volwassenen zonder diabetes |
Minimaal 12 maanden duur interventie |
10 studies met in totaal 1792 patiënten waarin strikt eiwitbeperkt dieet 0,6g/kg/dag werd vergeleken met normale eitwitintake ≥1,0 g/kg/dag 10 studies met in totaal 1004 patiënten waarin zeer strikt eiwitbeperkt dieet 0,3-0,4 g/kg/dag met suppletie van keto-analoge aminozuren werd vergeleken met strikte eiwitbeperking 0,6 g/kg/dag of met normale eiwitintake ≥1,0 g/kg/dag |
|
Normale eiwitintake: ≥1,0 g/kg/dag |
Voor deze review relevant: Progressie tot start nierfunctievervangende therapie, ‘protein-energy wasting’ |
Progressie tot start nierfunctievervangende therapie: Strikt eiwitbeperkt dieet vs normale eiwitintake: RR: 1,05 (95%BI: 0,73-1,53) Zeer strikte eiwitbeperking vs normale of strikte eiwitbeperking: RR: 0,64 (95%BI: 0,49-0,85) Protein-energy wasting: (Zeer) strikte eiwitbeperking vs strikte eiwit beperking of normale eiwitintake: RR: 1,31 (95%BI: 0,42-4,13) |
|
Goed uitgevoerde systematische review. In geïncludeerde studies enige risk of bias vanwege problemen met randomisatie, blindering van de onderzoekers en lost-to-follow-up |
Eigen meta-analyses gemaakt voor subpopulaties uit deze Cochrane review voor patiënten met ernstig/eindstadium nierfalen |
GRADE Evidence Profile
|
(zeer) strikt eiwitbeperkt dieet vergeleken met (strikt beperkte of) normale eiwitintake in patiënten met eindstadium nierfalen Literatuur: Hahn, 2018 |
|||||||||||
|
Certainty assessment |
Samenvatting resultaten |
||||||||||
|
Aantal deelnemers |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Publicatie bias |
Overall certainty of evidence |
Aantal events (%) |
Relatief effect |
Absolute effecten |
||
|
With (strikt beperkte of) normale eiwtintake |
With (zeer) strikt eiwitbeperkt dieet |
Risico met (strikt beperkte of) normale eiwtintake |
Risico verschil met (zeer) strikt eiwitbeperkt dieet |
||||||||
|
Progressie tot start nierfunctievervangende therapie (strikt vs normaal) (follow up: gemiddeld 12 maanden) |
|||||||||||
|
488 |
ernstig a |
niet ernstig |
niet ernstig |
ernstig b |
niet gevonden |
⨁⨁◯◯ |
57/243 (23.5%) |
58/245 (23.7%) |
RR 1.02 |
235 per 1.000 |
5 meer per 1.000 |
|
Progressie tot start nierfunctievervangende therapie (zeer strikt vs strikt of normaal) (follow up: gemiddeld 12 maanden) |
|||||||||||
|
755 |
ernstig c |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
⨁⨁⨁◯ |
146/373 (39.1%) |
96/382 (25.1%) |
RR 0.62 |
391 per 1.000 |
149 minder per 1.000 |
|
Protein-energy wasting (follow up: gemiddeld 12 maanden) |
|||||||||||
|
1191 |
ernstig d |
ernstig |
niet ernstig |
zeer ernstig |
niet gevonden |
⨁◯◯◯ |
5/589 (0.8%) |
7/602 (1.2%) |
RR 1.31 |
8 per 1.000 |
3 meer per 1.000 |
CI: Confidence interval; RR: Risk ratio
Explanations
a. Mogelijke selectiebias vanwege problemen met randomisatietoewijzing en incomplete follow-up data
b. De grenzen van het 95% BI overschrijden zowel het punt van kritisch verschil van voordeel als dat van kritisch verschil van nadeel van de interventie (en het punt geen effect)
c. Risk of bias vanwege problemen met randomisatie
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 27-08-2020
Beoordeeld op geldigheid : 19-05-2020
De Nederlandse Federatie voor Nefrologie beziet jaarlijks of herziening van (delen van) deze richtlijn noodzakelijk is. Indien dat het geval is, dan spant de Nederlandse Federatie voor Nefrologie zich ervoor in om de voorwaarden hiervoor te realiseren.
Algemene gegevens
Deze richtlijn is ontwikkeld met ondersteuning van PROVA.
Samenstelling werkgroep
Voor de ontwikkeling van deze richtlijn is een werkgroep geformeerd onder voorzitterschap van mw. dr. Neelke van der Weerd, internist-nefroloog. In de werkgroep hadden gemandateerde vertegenwoordigers van de belangrijkste beroepsverenigingen die te maken hebben met de zorg rondom patiënten met (eindstadium) nierfalen. Om het patiëntenperspectief te waarborgen, hadden een ervaringsdeskundige en een medewerker van de Nierpatiënten Vereniging Nederland zitting in de werkgroep. De werkgroep is procedureel en methodologisch ondersteund door PROVA en logistiek door het bureau van de Nederlandse Internisten Vereniging. De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget door de Stichting Kwaliteitsgelden Medisch Specialisten.
- Mw. dr. Neelke van der Weerd, internist-nefroloog, Amsterdam UMC, Amsterdam, namens NIV/NfN, voorzitter
- Mw. drs. Mariska Tuut, epidemioloog/richtlijnmethodoloog, PROVA, Varsseveld, secretaris
- Dhr. dr. Harmen Krepel, internist-nefroloog, Bravis Ziekenhuis, Bergen op Zoom/Roosendaal, namens NIV/NfN
- Mw. Inez Jans, diëtist nierziekten, Ziekenhuis Gelderse Vallei, Ede, namens DNN
- Mw. Geertje Pronk, maatschappelijk werker, Alrijne Ziekenhuis, Leiderdorp, namens VMWN
- Dhr. dr. Maarten Snoeijs, vaatchirurg, MUMC+, Maastricht, namens NVVH
- Mw. Judith Wierdsma M.Sc., verpleegkundig specialist nierfalen, UMCU, Utrecht, namens V&VN
- Mw. drs. Adry Diepenbroek, verpleegkundig specialist nierfalen, UMCG, Groningen, namens V&VN
- Mw. Elisabeth van Schaik, ervaringsdeskundige, namens NVN
- Mw. drs. Karen Prantl, beleidsmedewerker, NVN
- Mw. dr. Marije Baas, internist-nefroloog, RadboudUMC, Nijmegen, namens LONT
Met medewerking van dhr. dr. Azam Nurmohamed, internist-nefroloog, Amsterdam UMC, namens LONT
Belangenverklaringen
Alle leden van de werkgroep hebben een belangenverklaring ingevuld. Hieruit bleken geen beperkingen voor deelname aan de werkgroep.
|
Naam |
Hoofdfunctie(s) |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Neelke van der Weerd (voorzitter) |
Internist-nefroloog AMC Amsterdam |
Lid richtlijncommissie NfN
|
Geen |
Geen |
Geen |
Geen |
N.v.t. |
|
Mariska Tuut (secretaris) |
Eigenaar PROVA (adviesbureau evidence-based richtlijnontwikkeling, richtlijnmethodoloog) |
PhD-candidate CAPRHI Research School, Maastricht University |
- |
- |
- |
- |
- |
|
Marije Baas |
Internist-nefroloog, Radboudumc, Nijmegen |
|
Geen belangen |
nee |
geen |
geen |
nee |
|
Adry Diepenbroek |
Verpleegkundig specialist nefrologie UMC Groningen |
Geen |
N.v.t. |
Nee |
Deelname aan het ‘Polder’ initiatief (Pathway for OLDer patients reaching End stage Renal disease). Dit initiatief ontvangt subsidie van de Nierstichting. |
n.v.t. |
nee |
|
Inez Jans |
Diëtist, Ziekenhuis Gelderse Vallei Ede Vanuit functie betrokken bij de Alliantie Voeding in de Zorg Fulltime dienstverband Belangrijkste aandachtsgebieden: nierziekten, voedingsteam |
DNN – voorzitter werkgroep kwaliteit – onbetaald DNN – lid werkgroep richtlijnen – onbetaald Lid adviesgroep Zorgstandaard AL-amyloïdose )vanuit VSOP) – onbetaald Referent teksten over voeding voor www.nieren.nl – onbetaald Tot voor kort: lid werkgroep chronische nierschade; werkgroep is opgeheven, maar nog wel betrokken bij implementatie – was vacatiegeld |
n.v.t. |
nee |
n.v.t. |
n.v.t. |
n.v.t. |
|
Harmen Krepel |
Internist-nefroloog Bravis ziekenhuis Roosendaal / Bergen op Zoom |
- Lid richtlijnencommissie Nederlandse Federatie voor Nefrologie - Lid Taskforce Thuisdialyse |
Geen |
Geen |
Geen |
N.v.t. |
Geen |
|
Karen Prantl |
Beleidsmedewerker Kwaliteit & Onderzoek bij Nierpatiënten Vereniging Nederland (NVN) |
Geen |
Geen |
Geen. NVN zet zich in voor algemene belangenbehartiging van nierpatiënten, hun naasten en donoren. |
Geen |
Geen |
Neen |
|
Geertje Pronk |
Maatschappelijk werk dialyseafdeling, Alrijne ziekenhuis |
Geen |
n.v.t. |
nee |
n.v.t. |
geen |
nee |
|
Elisabeth van Schaik |
Vrijwilliger richtlijnontwikkeling vanuit Nierpatiëntenvereniging Nederland |
n.v.t. |
Geen persoonlijke financiële belangen |
Nier patiënten uit mijn naaste omgeving kunnen wel baat hebben bij het advies. Uiteraard wordt hier vanuit de NVN gekeken naar een algemeen belang voor nierpatiënten voor wie de richtlijn uiteindelijk ook bedoeld zal zijn. |
n.v.t. |
n.v.t. |
Niet dat ik weet |
|
Maarten Snoeijs |
Vaatchirurg MUMC+ |
Werkgroep zorgevaluatie NVVH |
Nee |
Nee |
Nee |
Mijn aandachtsgebied binnen de vaatchirurgie is de vaattoegangschirurgie en MUMC+ is een expertisecentrum/verwijscentrum voor complexe shuntchirurgie |
Nee |
|
Judith Wierdsma |
Verpleegkundig specialist UMC Utrecht: nefrologie (80%) vasculaire geneeskunde (20%) |
- Polikliniek chronische nierschade (alle stadia van nierfalen + getransplanteerde patiënt) - Polikliniek gecompliceerde hypertensie (samenwerking nefrologie en vasculaire geneeskunde) - Lid kernteam zorgpad(ontwikkeling) nierfalen binnen afdeling nefrologie UMC Utrecht |
Nee |
Nee |
Nee |
Nee |
Nee |
Methode ontwikkeling
Evidence based
Implementatie
Gedurende het hele proces van richtlijnontwikkeling is rekening gehouden met implementatie van de richtlijn in de praktijk, bijvoorbeeld bij de samenstelling van de werkgroep, de brede knelpunteninventarisatie, het formuleren van implementeerbare aanbevelingen en de uitgebreide commentaarronde. Daarnaast wordt getracht samenvattingen van de richtlijn in Nederlandse tijdschriften te publiceren en aandacht aan de richtlijn te besteden op congressen. Informatie voor patiënten is beschikbaar via www.nieren.nl en www.thuisarts.nl waar nodig wordt deze informatie op basis van deze richtlijn bijgesteld.
Bij deze richtlijn hoort een implementatieplan (zie aanverwante producten).
Werkwijze
Knelpunteninventarisatie
In een invitational conference, gehouden op 15 mei 2018 zijn knelpunten in de zorg voor patiënten met (eindstadium) nierfalen geïnventariseerd. Voor deze invitational conference waren de volgende partijen uitgenodigd:
- Werkgroepleden + achterban
- Nederlandse Internisten Vereniging
- Ouderengeneeskunde
- Nefrologie
- Nederlandse Vereniging voor Urologie
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde
- Nederlands Huisartsen Genootschap
- Nierstichting
- Zorgverzekeraars Nederland
- Zorginstituut Nederland
- Inspectie voor de Gezondheidszorg
- Vereniging Innovatieve Geneesmiddelen
- Nederlandse Vereniging van Universitair Medische Centra
- Stichting Topklinische Ziekenhuizen
- Nederlandse Vereniging van Ziekenhuizen
- Nederlandse Zorgautoriteit
- Patiëntenfederatie Nederland
- Verenso
- Koninklijke Nederlandse Maatschappij ter Bevordering der Pharmacie
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
- College van Medisch Immunologen
De richtlijnwerkgroep heeft in de eerste werkgroepvergadering eveneens knelpunten geïdentificeerd. Deze zijn in de invitational conference ter commentaar voorgelegd aan de deelnemers.
In de tweede vergadering van de richtlijnwerkgroep zijn de in de richtlijn te behandelen knelpunten en uitgangsvragen vastgesteld.
Uitwerking knelpunten en uitgangsvragen in conceptrichtlijn
Per uitgangsvraag is tevoren door de werkgroep vastgesteld op welke wijze deze werd uitgewerkt. Dit is in de inhoudelijke modules van de richtlijn vermeld.
Bij de uitgangsvragen die met behulp van systematisch literatuuronderzoek zijn beantwoord, is gebruik gemaakt van de GRADE-methodiek. Voor achtergrondinformatie hierover wordt verwezen naar de Nederlandse handleiding voor het gebruik van GRADE.(2) De evidence is samengevat door de epidemioloog in de werkgroep, met inhoudelijke input en feedback van de inhoudelijk experts in de werkgroep. Per uitgangsvraag was hiervoor een aantal ‘ambassadeurs’ aangewezen. De praktische overwegingen en conceptaanbevelingen zijn voorbereid door deze ‘ambassadeurs’ per uitgangsvraag.
De aanbevelingen, en de gehele conceptrichtlijn, zijn plenair door de werkgroep vastgesteld.
Uit het systematische literatuuronderzoek kwam naar voren dat op een aantal vragen met behulp van evidence nog geen antwoord gegeven kan worden. Een overzicht van deze kennislacunes is opgenomen in de aanverwante producten. Deze kennislacunes kunnen dienen als input voor nieuwe wetenschappelijk onderzoek.
Procedure voor commentaar en autorisatie
Na vaststelling van de teksten van de modules door de werkgroep, zijn deze ter commentaar aangeboden aan alle partijen die bij de knelpunteninventarisatie om input gevraagd zijn, aangevuld met de Nederlandse Vereniging voor Cardiologie, de onderzoekers van het DOMESTICO-project, de Nederlandse Vereniging voor Klinische Geriatrie en de Taskforce Thuisdialyse (opgericht door NfN, NVN en Nierstichting). Het binnengekomen commentaar is door de werkgroep beoordeeld en verwerkt in de richtlijn. Daarbij is beargumenteerd welke commentaren wel en welke niet zijn overgenomen.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'. Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Zoekverantwoording
Database: Medline
Datum: 22 augustus 2018
Search Strategy:
1 "eindstadium nierfalen".ti. (0)
2 Renal Insufficiency/ (14647)
3 exp Renal Insufficiency, Chronic/ (104028)
4 (Kidney adj3 Fail*).tw. (8483)
5 (Kidney adj3 Fail*).kf. (1340)
6 (chronic adj kidney).tw. (39732)
7 (chronic adj kidney).kf. (7147)
8 (chronic adj renal).tw. (32261)
9 (chronic adj renal).kf. (776)
10 (CKD or CRD or CKF or CRF).tw. (38895)
11 (CKD or CRD or CKF or CRF).kf. (1901)
12 (end?stage adj2 renal adj2 disease?).tw. (360)
13 (end?stage adj2 renal adj2 disease?).kf. (7)
14 ((renal or kidney) adj2 (fail* or insufficien*)).tw. (109237)
15 ((renal or kidney) adj2 (fail* or insufficien*)).kf. (5454)
16 (end?stage adj2 kidney).tw. (33)
17 (end?stage adj2 kidney).kf. (1)
18 ((chronic or end?stage) adj2 ne??ropath*).tw. (5797)
19 ((chronic or end?stage) adj2 ne??ropath*).kf. (102)
20 esrd.tw. (14096)
21 esrd.kf. (823)
22 or/2-21 (232833)
23 (english or dutch or german).la. (25061510)
24 22 and 23 (205120)
25 24 (205120)
26 limit 25 to yr="2008 -Current" (100892)
27 "predialysis".fc_titl. and "2014".fc_pubyr. and "370".fc_pg. (1)
28 "arteriovenous".fc_titl. and "2015".fc_pubyr. and "448".fc_pg. (1)
29 "right patient".fc_titl. and "2014".fc_pubyr. and "360".fc_pg. (1)
30 "incident".fc_titl. and "2017".fc_pubyr. and "151".fc_pg. (2)
31 from 30 keep 1 (1)
32 27 or 28 or 29 or 31 (4)
33 time/ or time factors/ (1141330)
34 (time or timing).tw. (2810664)
35 (time or timing).kf. (34183)
36 "referral and consultation"/ or tertiary healthcare/ (61945)
37 Tertiary Care Centers/ (9022)
38 tertiary.tw. (126812)
39 tertiary.kf. (936)
40 patient care management/ or disease management/ or patient care team/ or patient selection/ (152632)
41 ((patient adj3 care) or (disease adj3 manag*) or (patient adj3 (team or select*))).tw. (142465)
42 ((patient adj3 care) or (disease adj3 manag*) or (patient adj3 (team or select*))).kf. (4832)
43 Nephrologists/ (101)
44 Renal Insufficiency/dh, dt, nu, su, th [Diet Therapy, Drug Therapy, Nursing, Surgery, Therapy] (3847)
45 exp Renal Insufficiency, Chronic/dh, dt, nu, su, th [Diet Therapy, Drug Therapy, Nursing, Surgery, Therapy] (58385)
46 predialys*.kf. (51)
47 predialys*.ti. (578)
48 limit 47 to medline (516)
49 from 48 keep 4 (1)
50 refer*.tw. (721902)
51 refer*.kf. (6684)
52 tertiar*.tw. (126953)
53 tertiar*.kf. (939)
54 33 or 34 or 35 or 36 or 37 or 38 or 39 or 40 or 41 or 42 or 43 or 46 or 47 or 50 or 51 or 52 or 53 (4557509)
55 44 or 45 (62141)
56 54 or 55 (4602409)
57 26 and 56 (44611)
58 *Renal Insufficiency/dh, dt, nu, su, th (1816)
59 exp *Renal Insufficiency, Chronic/dh, dt, nu, su, th (29636)
60 58 or 59 (31429)
61 54 or 60 (4579318)
62 57 and 61 (37662)
63 (multidiscipl* or interdiscipl* or speciali*).ti. (44073)
64 (multidiscipl* or interdiscipl* or speciali*).kf. (6101)
65 *patient care management/ or *disease management/ or *patient care team/ or *patient selection/ (59472)
66 63 or 64 or 65 (102312)
67 62 and 66 (617)
68 *Renal Insufficiency/ (9400)
69 exp *Renal Insufficiency, Chronic/ (75337)
70 (Kidney adj3 Fail*).ti. (2836)
71 (chronic adj kidney).ti. (17392)
72 (chronic adj renal).ti. (12884)
73 (CKD or CRD or CKF or CRF).ti. (5186)
74 (end?stage adj2 renal adj2 disease?).ti. (54)
75 ((renal or kidney) adj2 (fail* or insufficien*)).ti. (38006)
76 (end?stage adj2 kidney).ti. (3)
77 ((chronic or end?stage) adj2 ne??ropath*).ti. (1649)
78 esrd.ti. (1724)
79 5 or 7 or 9 or 11 or 13 or 15 or 17 or 19 or 21 or 68 or 69 or 70 or 71 or 72 or 73 or 74 or 75 or 76 or 77 or 78 (118164)
80 26 and 79 (52121)
81 67 and 80 (412)
82 61 and 80 (23906)
83 sn.fs. (703601)
84 "referral and consultation"/sn or tertiary healthcare/sn (7787)
85 ((late or early) adj5 refer*).tw. (6377)
86 ((late or early) adj5 refer*).kf. (21)
87 84 or 85 or 86 (13968)
88 82 and 87 (247)= vr 1a verwijzing nierfalenpoli
89 Kidney Transplantation/ (89665)
90 Pancreas Transplantation/ (7212)
91 ((kidney or ren*) adj3 (transplant* or graft*)).tw. (80415)
92 ((kidney or ren*) adj3 (transplant* or graft*)).kf. (6281)
93 89 or 90 or 91 or 92 (112325)
94 80 and 93 (6921)
95 work?up.ti. (1007)
96 94 and 95 (1)
97 prepara*.ti. (111826)
98 94 and 97 (7)
99 (diagnostic adj2 work?up).ti. (268)
100 limit 99 to medline (209)
101 *patient care management/ or *disease management/ or *patient care team/ or *patient selection/ (59472)
102 80 and 93 and 101 (83)= vr 2c start screening transplantatie
103 from 88 keep 1-247 (247)
104 from 102 keep 1-83 (83)
105 preempti*.ti. (1478)
106 Waiting Lists/ (10705)
107 105 and 106 (15)
108 (time adj3 listing).tw. (241)
109 (time adj3 listing).kf. (0)
110 (preemptive adj5 transplan*).tw. (505)
111 (pre?emptive adj5 list*).tw. (14)
112 pre?emptive.tw. (4037)
113 pre?emptive.kf. (188)
114 112 or 113 (4073)
115 106 and 114 (39)
116 110 or 111 or 115 (516)
117 116 and 80 (102)= vraag 2d preemptive listing
118 Home Care Services/ (31461)
119 (predial* adj2 educat* adj3 program*).tw. (17)
120 sohal-*.au. (803)
121 120 and 80 (0)
122 "kidney team".fc_titl. (0)
123 "luchtenburg$".fc_auts. and "trial".fc_titl. (2)
124 "family communication".kw. (66)
125 "Patient Education as Topic"/ (80199)
126 80 and 125 (487)
127 118 and 126 (8)
128 (home adj2 based adj3 (famil* or car*)).tw. (2163)
129 126 and 128 (3)
130 "massey$".fc_auts. and "justification".fc_titl. (2)
131 exp Renal Replacement Therapy/ (191911)
132 ((renal or kidney) adj3 (transplant* or dialy* or graft*)).tw. (85731)
133 social support/ (64426)
134 (social adj3 support*).tw. (37465)
135 (social adj3 support*).kf. (3443)
136 131 or 132 (211405)
137 133 or 134 or 135 (83912)
138 ed.fs. (257724)
139 125 or 138 (331075)
140 80 and 136 and 137 and 139 (14)
141 from 130 keep 2 (1)
142 from 123 keep 1 (1)
143 141 or 142 (2)
144 80 and 143 (2)
145 139 and 144 (2)
146 137 and 145 (1)
147 80 and 136 and 139 (368)
148 home*.tw. (429392)
149 home*.kf. (18051)
150 128 or 148 or 149 (433385)
151 147 and 150 (77)= vr 3c voorlichting huisbezoek
152 "zelf management filter NICE".ti. (0)
153 exp Self Care/ (50277)
154 Patient Education as Topic/ (80199)
155 exp Telemedicine/ (23330)
156 exp Internet/ (69974)
157 exp Access to Information/ (6777)
158 exp Consumer Health Information/ (7148)
159 Information Dissemination/ (14556)
160 Patient Preference/ (6518)
161 disease management/ (30770)
162 (self adj3 (manag* or care)).ti,ab. (33226)
163 (self adj3 (manag* or care)).kf. (3714)
164 ((train* or teach* or educat*) adj3 (model* or program* or structured or intervention* or support)).ti,ab. (138303)
165 ((train* or teach* or educat*) adj3 (model* or program* or structured or intervention* or support)).kf. (2458)
166 (patient* adj3 (information* or educat* or knowledge or literacy or learn* or train* or program* or prefer* or expectation*)).ti,ab. (134912)
167 (patient* adj3 (information* or educat* or knowledge or literacy or learn* or train* or program* or prefer* or expectation*)).kf. (3046)
168 (information* adj3 (need* or requirement* or support* or seek* or access* or disseminat*)).ti,ab. (46969)
169 (information* adj3 (need* or requirement* or support* or seek* or access* or disseminat*)).kf. (849)
170 (decision adj5 (aid* or tool*)).ti,ab. (11587)
171 (decision adj5 (aid* or tool*)).kf. (566)
172 (patient* adj3 (literature or leaflet* or booklet* or pamphlet* or handout* or internet or website* or interview* or survey*)).ti,ab. (48257)
173 (patient* adj3 (literature or leaflet* or booklet* or pamphlet* or handout* or internet or website* or interview* or survey*)).kf. (178)
174 Focus Groups/ (25108)
175 "filter zelfmanagement NICE 2016".ti. (0)
176 Patient-Centered Care/ (16453)
177 Adaptation, Psychological/ (87911)
178 coping.tw. (46794)
179 coping.kf. (3479)
180 Decision Making/ (84778)
181 ((shared adj2 decision adj2 mak*) or empower* or (patient adj2 (perspecti* or view* or opinion*))).tw. (31281)
182 ((shared adj2 decision adj2 mak*) or empower* or (patient adj2 (perspecti* or view* or opinion*))).kf. (2955)
183 or/153-182 (796763)
184 exp Life Style/ (82657)
185 (life adj3 style).tw. (10257)
186 (life adj3 style).kf. (466)
187 183 or 184 or 185 or 186 (870500)
188 80 and 187 (3162)
189 "Quality of Life"/ (165601)
190 Patient Satisfaction/ (74090)
191 ((quality adj2 life) or (patient adj2 satisfact*) or (disase adj2 cours*)).tw. (263353)
192 ((quality adj2 life) or (patient adj2 satisfact*) or (disase adj2 cours*)).kf. (24074)
193 189 or 190 or 191 or 192 (368712)
194 80 and 187 and 193 (621)
195 *"Quality of Life"/ (75448)
196 *Patient Satisfaction/ (26525)
197 ((quality adj2 life) or (patient adj2 satisfact*) or (disase adj2 cours*)).ti. (65509)
198 192 or 195 or 196 or 197 (124676)
199 194 and 198 (282)
200 "filter systematic reviews".ti. (0)
201 meta analysis.pt. (91738)
202 (meta-anal$ or metaanal$).af. (161659)
203 (quantitativ$ adj10 (review$ or overview$)).tw. (7692)
204 (systematic$ adj10 (review$ or overview$)).tw. (141802)
205 (methodologic$ adj10 (review$ or overview$)).tw. (10001)
206 (quantitativ$ adj10 (review$ or overview$)).kf. (45)
207 (systematic$ adj10 (review$ or overview$)).kf. (11879)
208 (methodologic$ adj10 (review$ or overview$)).kf. (55)
209 medline.tw. and review.pt. (72207)
210 (pooled adj3 analy*).tw. (15569)
211 (pooled adj3 analy*).kf. (172)
212 "cochrane$".fc_jour. (13767)
213 or/201-212 (289174)
214 "filter observational studies Medline".ti. (0)
215 epidemiologic studies/ (7756)
216 exp case-control studies/ (936899)
217 exp cohort studies/ (1773441)
218 cross-sectional studies/ (273056)
219 (case adj3 control).af. (295983)
220 (cohort adj5 (study or studies or analy$)).af. (361580)
221 (follow-up adj5 (study or studies)).af. (640062)
222 (longitudinal or retrospective or prospective or (cross adj5 sectional)).af. (2016881)
223 (observational adj5 (study or studies)).af. (141290)
224 or/215-223 (2796873)
225 "filter obs Medline".ti. (0)
226 199 and (224 or 213) (125)= vr 4a zelfmanagement met filter NICE met aanvullingen
227 from 226 keep 1-125 (125)
228 exp proteins/ and exp diet therapy/ (13873)
229 diet, protein-restricted/ (2605)
230 exp dietary proteins/ (90257)
231 ((protein or proteins) adj5 (low or intake* or restrict* or consum* or reduc* or diet*)).ti,ab. (139334)
232 ((protein or proteins) adj5 (low or intake* or restrict* or consum* or reduc* or diet*)).kf. (2968)
233 hypoproteic.ti,ab. (74)
234 hypoproteic.kf. (3)
235 or/228-234 (221271)
236 80 and 235 (882)
237 236 and 213 (41)
238 "6".fc_issue. and "84".fc_vol. and "prevention".fc_titl. and "2013".fc_pubyr. and "1096".fc_pg. (1)
239 "fouque$".fc_auts. and "eleven".fc_titl. and "2007".fc_pubyr. and "383".fc_pg. (1)
240 "1".fc_issue. and "30".fc_vol. and "fouque$".fc_auts. and "diets".fc_titl. and "2014".fc_pubyr. (0)
241 "fouque$".fc_auts. and "low-protein diets ".fc_titl. (9)
242 from 241 keep 2 (1)
243 238 or 239 or 242 (3)
244 236 and 243 (1)
245 243 not 244 (2)
246 disease progression/ (141445)
247 dh.fs. (47068)
248 Kidney Failure, Chronic/dh [Diet Therapy] (1205)
249 Renal Insufficiency/dh (55)
250 exp Renal Insufficiency, Chronic/dh (1417)
251 Protein-Energy Malnutrition/ (7157)
252 235 or 248 or 249 or 250 or 251 (227324)
253 *Renal Insufficiency, Chronic/ (14197)
254 80 or 253 (53459)
255 252 and 254 (1227)
256 243 and 255 (2)
257 243 and 254 (2)
258 (26 or 253) and 243 (2)
259 243 and 26 (2)
260 (253 or 26) and 243 (2)
261 renal insufficiency/ or renal insufficiency, chronic/ or kidney failure, chronic/ (118267)
262 243 and 261 (3)
263 *renal insufficiency/ or *renal insufficiency, chronic/ or *kidney failure, chronic/ (84585)
264 (80 or 263) and 243 (3)
265 (80 or 263) and 252 (3496)
266 264 and 265 (3)
267 nutritional requirements/ or nutritional status/ (56110)
268 disease progression/ (141445)
269 mo.fs. (520829)
270 267 or 268 or 269 (703177)= outcome vr 6a
271 265 and 270 (944)
272 23 and 271 (854)
273 272 (854)
274 limit 273 to yr="2008 -Current" (408)
275 274 and 213 (18) vr 6a eiwitbeperkt dieet SR
276 "sensitief filter voor RCT's van Cochrane".ti. (0)
277 randomized controlled trial.pt. (467280)
278 controlled clinical trial.pt. (92604)
279 (randomized or randomised).ab. (502180)
280 placebo.ab. (191185)
281 drug therapy.fs. (2042250)
282 randomly.ab. (295857)
283 trial.ab. (437165)
284 groups.ab. (1825935)
285 or/277-284 (4279594)
286 285 not (exp animals/ not humans/) (3700709)
287 (274 and (286 or 224)) not 213 (235) vr 6a eiwitbeperkt dieet observat rct
288 from 275 keep 1-18 (18)
289 from 287 keep 1-235 (235)
290 Geriatric Assessment/ (24302)
291 (geriatri* adj2 assess*).tw. (3587)
292 (geriatri* adj2 assess*).kf. (666)
293 290 or 291 or 292 (25974)
294 80 and 293 (136) vr 11a

