Behandeling van wanen en hallucinaties bij de ziekte van Parkinson
Uitgangsvraag
Hoe kunnen wanen en hallucinaties het beste worden behandeld bij patiënten met de ziekte van Parkinson?
Aanbeveling
Vraag bij controle bezoek van patiënten met de ziekte van Parkinson, zowel aan patiënt als familie, naar de aanwezigheid van hallucinaties en wanen.
Verricht bij patiënten met de ziekte van Parkinson en een psychotische stoornis een algemeen medisch onderzoek, om onderliggende medische oorzaken op te sporen dan wel uit te sluiten (bijvoorbeeld urineweginfectie), en behandel deze, indien aanwezig.
Controleer de medicatielijst op medicatie met anticholinerge effecten.
Pas bij hallucinaties bij patiënten met de ziekte van Parkinson eerst de niet noodzakelijke anti-parkinson - en overige medicatie aan, en start vervolgens clozapine, of als hiervoor een contraindicatie bestaat, quetiapine;
Overweeg bij niet beangstigende hallucinaties en tevens aanwezige cognitieve stoornissen het voorschrijven van rivastigmine.
Geef bij hallucinaties bij patiënten met de ziekte van Parkinson geen klassieke neuroleptica (bijvoorbeeld haloperidol) of de atypische antipsychotica risperidon en olanzapine, vanwege de kans op verergering van de motorische verschijnselen.
Verricht bij de aanwezigheid van hallucinaties nader onderzoek naar de cognitie, wanneer het onderzoek naar intercurrente medische aandoeningen niets oplevert, of wanneer na behandeling hiervan de cognitie niet lijkt te verbeteren.
Overwegingen
Psychotische verschijnselen, met name hallucinaties en wanen, zijn veelvoorkomende bijwerkingen van geneesmiddelen voor de ziekte van Parkinson, maar kunnen ook ontstaan zonder medicatie (DLB-variant, of ten gevolgen van een delier). Alvorens deze middelen voor te schrijven is het van belang dat patiënten en hun verzorgers hiervan bewust worden gemaakt en dat deze symptomen bij elke volgende (polikliniek)afspraak worden beoordeeld. Daarbij is het belangrijk om ook naasten te vragen of de patiënt tekenen vertoont van het ervaren van hallucinaties of wanen, omdat sommige patiënten met de ziekte van Parkinson zich misschien niet bewust zijn dat ze hallucineren (met name visuele hallucinaties).
Alle patiënten met de ziekte van Parkinson en een psychotische stoornis dienen een algemeen medisch onderzoek te ondergaan, gericht op het opsporen dan wel uitsluiten van onderliggende medische oorzaken, zoals electrolytstoornissen, uitdroging, urineweginfectie en hypoglycemie. Hierbij is het ook van belang om de medicatielijst te screenen op het gebruik van middelen met een anticholinerge werking. Tevens dient te worden beoordeeld of de sensorische functies optimaal zijn gecorrigeerd (met name visus en gehoor). Bovenaan in de differentiaal-diagnose staat een delier, dat zeker bij oudere patiënten meestal multifactorieel bepaald is. Wanneer mogelijke onderliggende medische oorzaken voor het delier danwel de psychotische symptomen worden gevonden, dient de behandeling allereerst daarop gericht te zijn. Het opsporen en de behandeling van de onderliggende oorzaken van psychotische stoornissen kan door de huisarts, neuroloog, specialist ouderengeneeskunde, klinisch geriater of psychiater verricht worden. Indien sprake is van lichte psychotische verschijnselen die niet heel hinderlijk zijn voor de patiënt en de omgeving, kan de behandelend arts overwegen deze niet actief te behandelen.
Indien er wel een behandelindicatie is, kan het volgende stappenplan worden gebruikt:
- Pas indien mogelijk (niet‐noodzakelijke) medicatie aan voor zover patiënt medicatie gebruikt, in deze volgorde: staak of verlaag anticholinergica, amantadine, MAO‐B remmer, dopamine-agonist, COMT-remmers, levodopa.
- Indien er geen cognitieve stoornissen zijn: start een atypisch neurolepticum. Eerste keuze: clozapine (onder strikte bloedbeeldcontroles van leucocytenaantal en leucocytendifferentiatie, in verband met zeldzame bijwerking agranulocytose/leucocytopenie, 1ste 18 weken wekelijks, daarna blijvend maandelijks, zie ook FK) ; tweede keuze: quetiapine. Zodra de symptomen onder controle zijn kan het neurolepticum weer worden afgebouwd (zie Tabel 1 voor type medicatie met mogelijke bijwerkingen).
- NB. Het gebruik van klassieke antipsychotica (bijvoorbeeld haloperidol) en de atypische antipsychotica risperidon en olanzapine is in alle gevallen gecontraïndiceerd vanwege de kans op verergering van de motorische verschijnselen.
- Een voor de klinische praktijk relevante bijwerking van atypische antipsychotica is het optreden van orthostatische hypotensie, hetgeen kan bijdragen aan ernstige valpartijen. Adviezen voor de symptomatische behandeling van orthostatische hypotensie staan in de richtlijn Valpreventie.
- Indien tevens cognitieve stoornissen bestaan, start rivastigmine. Dit wel afhankelijk van de ernst van de hallucinaties. Als deze erg beangstigend zijn, dan clozapine. Als ze niet erg beangstigend zijn en er zijn cognitieve stoornissen dan eerder keuze voor rivastigmine. Rivastigmine kan ook worden voorgeschreven zonder cognitieve stoornissen. Bedenk wel dat rivastigmine minder effectief is en het langer duurt voor dat er effect is (weken/ maanden i.t.t. dagen bij clozapine) (expert opinie).
Een delier beïnvloedt de cognitie in negatieve zin. Snelle en adequate behandeling van de onderliggende oorzaak is daarom van groot belang. Wanneer het onderzoek naar intercurrente medische aandoeningen niets oplevert, of wanneer na behandeling hiervan de cognitie niet lijkt te verbeteren, is nader onderzoek van de cognitie zinvol. Een overweging hierbij is dat op basis van de beschikbare literatuur en klinische ervaring de indruk bestaat dat psychotische verschijnselen bij de ziekte van Parkinson vaak een eerste aanwijzing kunnen zijn voor het bestaan van cognitieve functiestoornissen.
Tabel 1 Psychotische verschijnselen en medicamenteuze behandeling.
|
Psychotische verschijndelen bij patiënt zonder cognitieve stoornissen |
||||
|
Geneesmiddel |
Dosering |
Contra indicatie |
Bijwerkingen |
Advies |
|
Clozapine* |
1dd 6.25 mg a.n. Z.n. geleidelijk ophogen met stappen van 6.25‐12.5 mg tot maximaal 50 mg/dag en in uitzonderingen tot 100 mg/dag. |
Gestoorde beenmergfunctie, psychose tgv intoxicatie ernstige nier‐, lever‐ of hartziekte. |
Agranulocytose sedatie orthostatische hypotensie convulsies anticholinerge verschijnselen myocarditis, cardiomyopathie |
Controleer het leukocytenaantal (WBC) en het absolute neutrofielenaantal (ANC) vóór de start van de behandeling, vervolgens de eerste 18 weken wekelijks en daarna ten minste iedere 4 weken. Controle voortzetten gedurende de gehele behandeling en tot 4 weken na definitief staken van de behandeling. Overweeg af te bouwen zodra de symptomen onder controle zijn. |
|
Quetiapine |
1dd 12.5 mg a.n. Z.n. geleidelijk ophogen tot max. 200 mg |
Alleen voorschrijven indien clozapine gecontra‐indiceerd is! |
Sedatie Orthostatische hypotensie droge mond hoofdpijn gewichtstoename toename Parkinson |
Effectiviteit niet overtuigend aangetoond. Geen lab. controles nodig. Overweeg af te bouwen zodra de symptomen onder controle zijn. |
|
Psychotische verschijndelen bij patiënt met of zonder cognitieve stoornissen/ Parkinsonisme dementie (met of zonder hallucinaties) |
||||
|
Rivastigmine |
Pleister: 4.6 mg/dag (als snel effect gewenst is of bij slikstoornissen) Z.n. verder op te hogen tot 13,3 mg/dag
Oraal:start dosis 1dd 1.5 mg, op geleide van bijwerkingen geleidelijk verder ophogen tot max. 2dd 6 mg. |
|
Misselijkheid, braken, anorexie, dehydratie, duizeligheid, hypotensie, hartritmestoornissen, slapeloosheid, toename tremor, vallen. |
De pleister geeft minder vaak maagdarmklachten dan de orale vorm.
Langzaam afbouwen i.v.m. kans op plotse cognitieve achteruitgang. |
Onderbouwing
Achtergrond
Hallucinaties kunnen ontstaan door de ziekte zelf, of gerelateerd zijn aan cholinerge degeneratie, en tgv dopaminerge medicatie en tgv andere ontregelingen zoals bij delier. Hierbij kan onderscheid worden gemaakt tussen hallucinaties met behoud van realiteitszin en hallucinaties waarbij de realiteitszin verloren is geraakt. Voor deze symptomen is een adequate behandeling gewenst. Een belangrijke oorzakelijke factor van de psychotische verschijnselen vormt de medicatie voor de behandeling van de ziekte van Parkinson. Verlaging of staken van deze medicatie is soms mogelijk maar kan ook tot een verslechtering van het parkinsonisme leiden, en geeft lang niet altijd tot het gewenste resultaat. De klassieke antipsychotica staan bekend om hun extrapiramidale bijwerkingen en zijn daarom vaak niet geschikt. Tenslotte kunnen intercurrente ziekten, zoals een infectie of een metabole stoornis, een belangrijke oorzaak zijn voor het optreden van psychotische symptomen (formeel dan delier) bij patiënten met de ziekte van Parkinson.
Daar waar nog weinig kennis is over een optimale behandelstrategie van psychoses, wanen en hallucinaties bij patiënten met de ziekte van Parkinson, is het van belang om de literatuur systematisch uit te werken en waar mogelijk te komen tot een breed gedragen behandelstrategie.
Herkenning wanen en hallucinaties
|
Psychotische symptomen, zoals wanen en hallucinaties, kunnen een bepalende rol spelen in het dagelijks leven. Het is daarom van belang dat deze in een vroeg stadium worden herkend. Visuele en auditieve hallucinaties zijn vaak eenvoudig te herkennen, maar ook sense of presence, het gevoel dat men achtervolgd wordt, illusionaire vervalsingen, ontrouw- en vergiftigingswaan komen voor. Het is belangrijk dat er bij ieder bezoek gevraagd wordt naar levendige dromen en hallucinaties en wanen door Parkinsonverpleegkundige en/of behandelend arts. |
Conclusies / Summary of Findings
|
Laag GRADE |
Clozapine leidt mogelijk tot een vermindering van psychotische symptomen ten opzichte van placebo bij patiënten met de ziekte van Parkinson.
Bronnen: (Pollak, 2004; The Parkinson Study Group, 1999) |
|
Laag GRADE |
Quetiapine leidt mogelijk niet tot vermindering in psychotische symptomen ten opzichte van placebo bij patiënten met de ziekte van Parkinson.
Bronnen: (Fernandez, 2009; Kurlan, 2007; Ondo, 2005; Rabey, 2007; Shotbolt, 2009) |
|
Laag GRADE |
Olanzapine leidt mogelijk niet tot vermindering in psychotische symptomen, inclusief hallucinaties en wanen ten opzichte van placebo bij patiënten met de ziekte van Parkinson.
Bronnen: (Breier, 2002; Nichols, 2013) |
|
Laag GRADE |
Clozapine is mogelijk effectiever dan olanzapine ten aanzien van de verbetering van psychotische symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Goetz, 2000) |
|
Laag GRADE |
Er is mogelijk geen verschil in effectiviteit tussen risperidon en clozapine in de verbetering van psychische symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Ellis, 2000) |
|
Laag GRADE |
Er is mogelijk geen verschil in effectiviteit tussen quetiapine en clozapine in de verbetering van psychotische symptomen bij patiënten met de ziekte van Parkinson.
Bronnen: (Merims, 2006; Morgante, 2004) |
Samenvatting literatuur
Beschrijving studies
Twee systematische reviews werden geselecteerd voor inclusie in de analyse (Wilby, 2017; Yasue, 2016). De review van Wilby (2017) is de meest recente en omvatte een systematisch literatuuronderzoek, maar geen meta-analyse. Deze review beschrijft 16 studies waarin farmaceutische behandeling van psychose bij patiënten met de ziekte van Parkinson worden geëvalueerd. Deze review is in de huidige analyse uitsluitend gebruikt vanwege de volledige rapportage van risk of bias assessment. De review van Yasue (2016) richtte zich op 4 studies (waarvan 2 ongepubliceerde studies) die pimavanserine met placebo vergeleken voor de behandeling van psychoses bij mensen met de ziekte van Parkinson. 251 proefpersonen in de pimvanserinegroep werden vergeleken met 251 proefpersonen in de placebogroep op de hallucinaties-en-wanensubschaal van de scale for assessment of positive symptoms (SAPS). De 15 RCT’s vergeleken allen medicamenteuze behandeling van hallucinaties met placebo of alternatieve medicatie bij patiënten met de ziekte van Parkinson die zich presenteerden met aanhoudende wanen en/of hallucinaties secundair aan de ziekte van Parkinson. Eén studie includeerde daarnaast ook patiënten met parkinsonisme in combinatie met alzheimer of Lewy bodies dementie (Kurlan, 2007). In totaal werden vier medicijnen vergeleken met placebo: clozapine, quetiapine en olanzapine. Daarnaast werden olanzapine, risperidon en quetiapine elk vergeleken met clozapine. Hieronder worden de studies beschreven per vergelijking. Tabel 2 geeft een overzicht van de uitkomsten en belangrijkste karakteristieken van de 15 RCTs met in de voetnoot een beschrijving van de uitkomstmaten.
Clozapine versus Placebo
Twee studies vergeleenk clozapine met placebo (Pollak, 2004; PDS, 1999). In de studie van Polak (2004) werden na randomisatie 32 deelnemers toegewezen aan de clozapinegroep en 28 deelnemers aan de placebogroep. Beide groepen werden 4 weken gevolgd. Psychosesymptomen werden gemeten met de positieve subschaal van de Positive and Negative Syndrome Scale (PANSS). Daarnaast werd ook de CGI afgenomen. The Parkinson Study Group (1999) onderzocht ook het effect van clozapine met placebo. In de studie werden 60 patiënten gerandomiseerd verdeeld over de clozapinegroep (6,25 tot 50 mg/dag) of een placebogroep. Beide groepen werden voor een periode van 14 maanden gevolgd. De volgende voor de werkgroep relevante uitkomsten werden meegenomen: Brief Psychiatric Rating Scale (BPRS) en de Clinical Global Impression Scale (CGIS).
Resultaten
Vergeleken met de placebogroep liet de clozapinegroep een grotere afname zien in positieve symptomen gemeten met de PANSS (Mean diffrence (MD)= -5,6; 95%BI -6,9 tot -4,3 versus MD= -0,8; 95%BI -1,8 tot 0,2; p<0,0001) en in ernst van psychische problemen gemeten met de CGI-S (MD= -1,8; 95%BI -2,3 tot -1,3 versus MD= -0,6, 95%BI -1,0 tot -0,2, p=0,001) (Pollak, 2004).
De clozapinegroep liet een grotere afname zien in BPRS-score (-9,3; SD= 1,5) dan de placebogroep (-2,6; SD= 1,3) (p= 0,002), statisch significant in het voordeel van de clozapinegroep. Daarnaast liet de clozapinegroep ook een grotere afname zien in CGIS-score (-1,6; SD= 0,3) dan de placebo groep (-0,5; SD= 0,2) (p< 0,001), statisch significant in het voordeel van de clozapinegroep.
Quetiapine versus Placebo
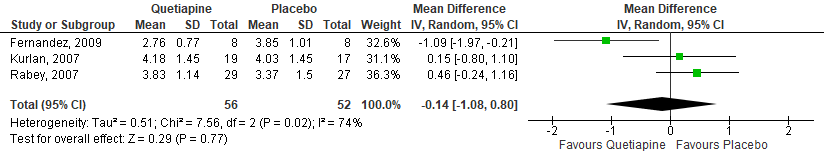
Vijf studies vergeleken quetiapine met placebo (Fernandez, 2009; Kurlan, 2007; Ondo, 2005; Rabey, 2007; Shotbolt, 2009). Na randomisatie werden er 90 deelnemers toegewezen aan de quetiapinegroep en 79 aan de placebogroep. De interventieduur varieerde tussen de 10 en 12 weken en was onbekend voor één studie (Ondo, 2005). Alle vijf studies maten veranderingen in scores op de Brief Psychiatric Rating Scale (BPRS). Daarnaast werden de groepen ook vergeleken in scores op het hallucinatie-item van de BPRS in twee studies (Fernandez, 2009; Ondo, 2005), de Baylor PD Hallucination Scale in twee studies (Fernandez, 2009; Ondo, 2005), de Neuropsychiatric Inventory (NPI) in twee studies (Kurlan, 2007; Shotbolt, 2009) en de CGI in drie studies (Fernandez, 2009; Kurlan, 2007; Rabey, 2007).
Resultaten
Data konden gepoold worden van vier van de vijf studies, omdat voor één studie onvoldoende gegevens bekend waren om effecten te kunnen schatten (Ondo, 2005). Gepoold over de vier studies werd geen verschil gevonden tussen quetiapinegebruikers en placebogebruikers in BPRS score (Figuur 1). In de studies van Fernandez (2009) en Ondo (2005) werd ook apart naar het hallucinatie item van de BPRS gekeken. In beide studies werd geen significant verschil gevonden tussen de groepen (quetipine versus placebo, Fernandez: MD=3,5; SD=1,06 versus MD=3,3; SD=0,92), p=0,33; Ondo: 4 versus 3,5; p>0,05). In de studies van Ondo (2005) en Shotbolt (2009) werden tevens geen significante verschillen gevonden in scores op de BPDH (Ondo: 8 versus 11,5; p=0,19; Schotbolt: 8,3; SD=2,9 versus 9,4; SD=4,9, p>0,05). Gepoold over de twee studies die de NPI afnamen, werd geen significant verschil gevonden tussen de quetiapine- en placebogroepen (Figuur 2). Gepoold over drie studies werd ook geen significant verschil gevonden tussen de groepen in CGI-I (Figuur 3).
Figuur 1 Quetiapine versus Placebo – Brief Psychiatric Rating Scale (BPRS), Totaal score

Figuur 2 Quetiapine versus Placebo – Neuropsychiatric inventory (NPI)

Figuur 3 Quetiapine versus Placebo – Clinical Global Impression Scale, Severity subschaal (CGI-S)
Olanzapine versus Placebo
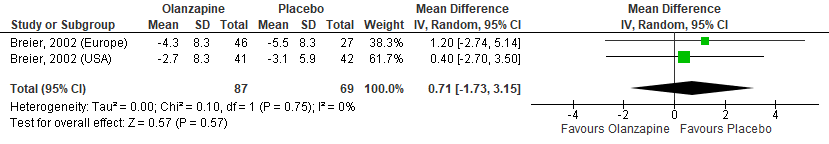
Twee studies vergeleken olanzapine met placebo. De studie van Breier (2002) beschrijft twee steekproeven, een gerekruteerd in de Verenigde Staten en een gerekruteerd in Europa. De resultaten van deze steekproeven werden apart beschreven en daarom in de huidige analyse als twee steekproeven meegenomen. Na randomisatie werden er 104 deelnemers toegewezen aan de olanzapinegroep en 79 aan de placebogroep (Breier, 2002; Nichols, 2013). De interventieduur was in beide studies 4 weken. In beide studies werden de BPRS afgenomen. In de studie van Breier (2002) werden daarnaast ook de NPI en CGI afgenomen.
Resultaten
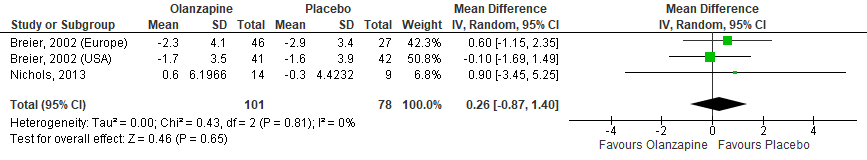
Gepoold over de twee studies (met drie steekproeven) werden geen significante verschillen gevonden in positieve symptomen zoals gemeten met de BPRS tussen olanzapinegebruikers en placebogebruikers (Figuur 4). In de studie van Breier (2002) werden daarnaast geen verschillen gevonden in de totaal score (Figuur 5) en de score op het hallucinatie-item van de BPRS (Figuur 6). Ook in totaalscores en subschaalscores van de NPI en CGI-S (Figuren 7 tot en met 10) werden geen significante verschillen gevonden.
Figuur 4 Olanzapine versus Placebo – Brief Psychiatric Rating Scale, Totaal score (BPRS)
Figuur 5 Olanzapine versus Placebo – Brief Psychiatric Rating Scale, Positive symptoms (BPRS-P)
Figuur 6 Olanzapine versus Placebo – Brief Psychiatric Rating Scale, Hallucinaties (BPRS-H)

Figuur 7 Olanzapine versus Placebo - Neurpsychiatric Inventory (NPI)
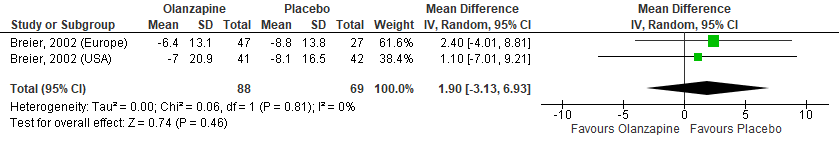
Figuur 8 Olanzapine versus Placebo – Neurpsychiatric Inventory, hallucinations (NPI-H)
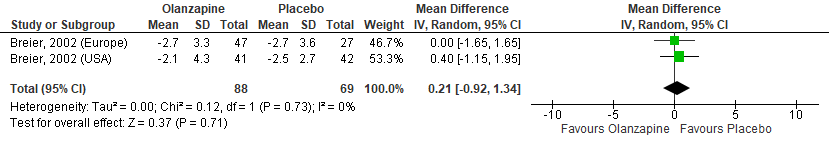
Figuur 9 Olanzapine versus Placebo – Neurpsychiatric Inventory, wanen (NPI-D)
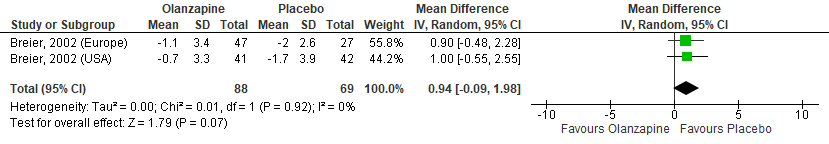
Figuur 10 Olanzapine versus Placebo – Clinical Global Impression Scale, severity subschaal (CGI-S)
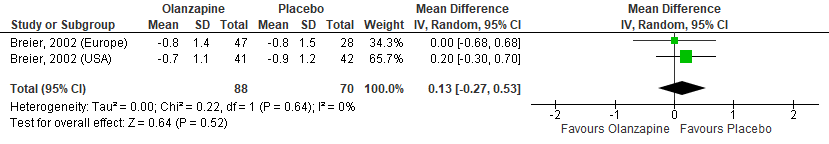
Olanzapine versus Clozapine
Eén studie vergeleek olanzapine met clozapine (Goetz, 2000). Na randomisatie werden 7 deelnemers toegewezen aan de olanzapinegroep en 8 aan de clozapinegroep. De interventieduur was 8 weken. Psychische symptomen werden gemeten met de BPRS en SAPS.
Resultaten
Van baseline tot follow-up werden in de clozapinegroep significante verbeteringen gevonden in BPRS (MD= -8,0; 95%BI -1,0 tot -1,0, p=0,031) en SAPS (MD= -7,0; 95%BI -11,0 tot -2,0; p=0,016). In de olanzapinegroep werden geen significante verbeteringen gevonden op de BPRS (MD= -0,50; 95%BI -6,0 tot 8,0; p=1,0) en SAPS (MD= -5,50; 95%BI -11,0 tot 3,0; p=0,109). De veranderingen van baseline tot follow-up waren niet significant verschillend tussen de twee groepen: BPRS (MD=7,0; 95%BI 1 tot 19, p=0,09) en SAPS (MD=2,0; 95%BI -5 tot 10, p=0,56) (Goetz, 2000).
Risperidon versus Clozapine
Eén studie vergeleek risperidon met clozapine (Ellis, 2000). Na randomisatie werden 5 deelnemers toegewezen aan de risperidongroep en 5 aan de clozapinegroep. De interventieduur bedroeg 12 weken. Psychische symptomen werden gemeten met de BPRS.
Resultaten
De score op de psychose-subschaal van de BPRS verbeterde significant in de risperidongroep (MD=3,8; SD=1,3; p=0,004), maar niet in de clozapinegroep (MD=1,5; SD=3,7; p=0,32). Er was echter geen significant verschil tussen de groepen (p=0,23). Ook waren er geen verschillen in en tussen de groepen in de totaal score van de BPRS (risperidon: MD=6,0; SD=4,6; clozapine: MD=3,0; SD=10,0; p=0,57) (Ellis, 2000).
Quetiapine versus Clozapine
Twee studies vergeleken quetiapine met clozapine (Merims, 2006; Morgante, 2004). Na randomisatie werden in totaal werden 24 deelnemers toegewezen aan de quetiapinegroep en 26 aan de clozapinegroep. De interventieduur bedroeg respectievelijk 12 en 14 weken. De ene studie mat psychotische symptomen met de BPRS en de CGI-S (Morgante, 2004); de andere studie mat psychotische symptomen met de hallucinatie en wanen subschalen van de NPI (Merims, 2006). De laatste studie mat ook verbetering in symptomen ten opzichte van baseline met de CGI-I (Merims, 2006).
Tabel 2 Overzicht van karakteristieken van geïncludeerde studies
|
|
|
|
|
Geselecteerde uitkomstmaten |
Andere uitkomstmaten |
||||||
|
|
N (I) |
N (C) |
Follow-up (weeks) |
BPDH
|
PANSS |
BPRS |
NPI |
SAPS |
UPDRS |
CGI |
|
|
Quetiapine versus placebo |
|||||||||||
|
Shotbolt, 2009 |
11 |
13 |
12 |
T |
|
T |
T |
|
T, III |
|
|
|
Fernandez, 2009 |
8 |
8 |
? |
|
|
T, H |
|
|
III |
I |
|
|
Ondo, 2005 |
21 |
10 |
12 |
T |
|
T, H |
|
|
II, III |
|
|
|
Rabey, 2007 |
30 |
28 |
12 |
|
|
T |
|
|
III |
I |
|
|
Kurlan, 2007 |
20 |
20 |
10 |
|
|
T |
T |
|
T |
I |
|
|
Olanzepine versus placebo |
|||||||||||
|
Breier, 2002 |
90 |
70 |
4 |
|
|
T, H, P |
T, H, D |
|
T, III |
S |
|
|
Nichols, 2013 |
14 |
9 |
4 |
|
|
P |
|
|
III |
|
|
|
Clozapine versus placebo |
|||||||||||
|
Pollak, 2004 |
32 |
28 |
4 |
|
P |
|
|
|
T, III |
S |
|
|
Olanzapine versus clozapine |
|||||||||||
|
Goetz, 2000 |
7 |
8 |
8 |
|
|
T |
|
T, H |
III |
|
|
|
Risperidon versus clozapine |
|||||||||||
|
Ellis, 2000 |
5 |
5 |
12 |
|
|
T, P |
|
|
III |
|
|
|
Quetiapine versus clozapine |
|||||||||||
|
Morgante, 2004 |
11 |
12 |
12 |
|
|
T |
|
|
II+III |
S |
|
|
Merims, 2006 |
13 |
14 |
14 |
|
|
|
H, D |
|
|
I |
|
De letters in de tabel geven de subschalen aan die gerapporteerd worden in de studies: D delusions (wanen); H hallucinaties; I improvement (verbetering ten opzicht van baseline); II ADL subschaal, III motoriek subschaal; P positieve symptomen; S severity (ziekte ernst); T totaal score
BPDH: Baylor PD hallucination scale – Vraagt naar de frequentie van visuele, auditieve en presentie hallucinaties, het inzicht van de patiënt in de werkelijkheid van deze hallucinaties en de impact op de familie (Ondo, 2015).
BPRS: Brief Psychiatric Rating Scale – Meet de domeinen affect, positieve symptomen (P), negatieve symptomen, weerstand en activatie (Overall, 1962). Voor elk domein kunnen subschaal scores berekend worden die optellen tot een totaalscore. De positieve symptoom schaal omvat een item over hallucinaties, welke in sommige studies als aparte uitkomstmaat wordt gerapporteerd (H).
CGI: Clinical Global Impressions Scale – Dit instrument meet het globale functioneren van de patiënt vanuit het perspectief van de behandelaar voor en na start van de interventie (Busner, 2007). In de score wordt de ziektegeschiedenis, psychosociale omstandigheden, symptomen, gedrag en impact van de symptomen op het functioneren meegewogen. De CGI-S (severity item) vraagt hoe psychisch ziek de patiënt is; de CGI-I (improvement item) vraagt hoe de conditie van de patiënt nu is ten opzicht van baseline.
NPI: Neuropsychiatric Inventory – Meet dementie-gerelateerde gedragssymptomen in de domeinen: wanen (D), hallucinaties (H), agitatie/agressie, dysforie, angst, euforie, apathie, disinhibitie, prikkelbaarheid, afwijkende motorische activiteit, nachtelijke gedragsstoornissen en abnormale eetlust en eetgewoonten (Cummings, 1997).
PANSS: Positive and Negative Syndrome Scale – Meet positieve en negatieve positieve psychotische symptomen (Kay, 1989). Positieve symptomen (P) refereren naar overtollige of vervorming van normale functies (bijvoorbeeld hallucinaties en wanen). Negatieve symptomen refereren naar vermindering of verlies van normale functies (bijvoorbeeld apathie).
SAPS: Scale for Assessment of Positive Symptoms – Instrument dat positieve symptomen meet bij schizofrenie, ook geschikt gevonden voor het meten van psychosen bij Parkinson patiënten (Voss, 2013; Fernandez, 2008). Het instrument meet 5 domeinen: hallucinaties (H), wanen (D), vreemd gedrag, positieve formele gedachtenstoornissen, en ongepast affect.
UPDRS: Unified Parkinson’s Disease Rating Scale – Meet de ernst van symptomen en impact of het functioneren bij Parkinson patiënten (Goetz, 2007). Het onderscheid de volgende subschalen: (1) mentale activiteit, gedrag en stemming; (2) ADL (II) (3) motoriek (III), (4) complicaties van therapie.
Resultaten
In de studie van Morgante (2004) werden binnen zowel de quetiapine- en clozapinegroepen significante verbeteringen gevonden met de BPRS (baseline – follow-up: quetiapine: 37,7 (SD=6.9) - 28,4 (SD=5,2); p<0,001; clozapine: 38,2 (SD=6,2) – 27,5 (SD=4,7); p<0,001) en de CGI-S (quetiapine: 3,6 (SD=0.7) – 2,1 (SD=0,6); p<0,001; clozapine: 3,8 (SD=0,8) tot 1,9 (SD=0,6); p<0,001), maar er werden geen significante verschillen gevonden tussen de groepen. In de studie van Merims (2006) werd in de clozapinegroep (3 tot 2; p=0,0011), maar niet in de quetiapinegroep (3 tot 3,2; p>0,05), een afname in hallucinaties waargenomen zoals gemeten met de NPI. De verschillen tussen de groepen waren niet significant (p=0,0974). De twee groepen verschilden wel in frequentie van wanen (p=0,0110). In de clozapinegroep werd een afname in wanen gemeten (3,0 tot 1,0; p=0,0149), terwijl in de quetiapinegroep een toename in wanen werd gemeten (1,5 tot 3,0). Beide groepen lieten een vergelijkbare afname in symptomen zien ten op zichten van baselineline zoals gemeten met de CGI-I (quetiapine: 3,0 tot 1,8; clozapine: 2,2 tot 1,0; p<0,001).
Bewijskracht van de literatuur
De bewijskracht voor alle beschreven vergelijkingen is afkomstig uit gerandomiseerd gecontroleerd onderzoek en start zodoende op ‘hoog’. In 12/15 studies werd het randomisatieproces niet of beperkt beschreven, waardoor het onduidelijk was of aan de voorwaarden van geblindeerde randomisatie voldaan werd. In 8/15 studies bestaat de kans dat de resultaten vertekend zijn door selectieve uitval van deelnemers gedurende de studie. In 6/15 studies was het onduidelijk of er sprake was van bias door schending van de intention to treat analyse. Vanwege deze hoge mate van bias, werd de bewijskracht met 1 niveau verlaagd. Vergelijkingen waarvoor meerdere studies beschikbaar waren, lieten over het algemeen consistente resultaten zien, maar door het kleine aantal studies per vergelijking kan hier geen harde uitspraak over worden gedaan. De bewijskracht werd daarom niet bijgesteld voor (in)consistentie. De bewijskracht werd niet verlaagd voor extrapoleerbaarheid (indirectheid). Alle 15 studies vergeleken relevante medicijnen met adequate uitkomstmaten. Alle studies includeerden patiënten met de ziekte van Parkinson met hallucinaties en/of wanen secundair aan de parkinson. Eén studie includeerde daarnaast ook patiënten met Parkinsonisme in combinatie met alzheimer of Lewy bodies dementie en hallucinaties en/of wanen (Kurlan, 2007). Het kleine aantal studies per vergelijking met veelal kleine studiepopulaties (n=10-259) en relatief kleine verschillen in de uitkomstmaten resulteerde in brede betrouwbaarheidsintervallen. De bewijskracht werd daarom met 1 niveau verlaagd voor imprecisie. De bewijskracht werd niet verlaagd voor publicatiebias; in verband met het kleine aantal studies per vergelijking kan hier weinig over gezegd worden. De bewijskracht werd gegradeerd als laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn effectieve interventies om wanen en hallucinaties te verminderen bij patiënten met de ziekte van Parkinson?
P: patiënten met de ziekte van Parkinson met wanen en hallucinaties;
I: medicamenteuze behandeling, antipsychotica, educatie, mantelzorgeducatie, cognitieve training;
C: reguliere zorg, placebo-interventie;
O: hallucinaties, angst, psychoses, wanen, complicaties, gevalideerde instrumenten: Visuele hallucinatie vragenlijst, PANNS, BPRS, SCOPA, NPI.
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 01 augustus 2018 met relevante zoektermen gezocht naar studies die interventies beschrijven voor het reduceren wanen en hallucinaties bij patiënten met de ziekte van Parkinson. Zowel medicamenteuze als niet-medicamenteuze interventies werden meegenomen in de literatuurzoekactie. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 599 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: Studiedesign RCT’s of ander primair vergelijkend onderzoek, gepubliceerd na 2009, beschrijving van minimaal één van bovengenoemde uitkomstmaten, beschreven in het Engels of in het Nederlands. Op basis van titel en abstract werden onafhankelijk, door twee beoordelaars in eerste instantie 24 studies geselecteerd voor full-tekst selectie. Na raadpleging van de volledige tekst, werden vervolgens 18 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 7 studies definitief geselecteerd. Daarnaast zijn er nog 10 studies geselecteerd na het controleren van referentielijsten. 17 onderzoeken zijn opgenomen in de systematische literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Uit de zoekactie kwamen 9 systematische reviews naar voren die de effectiviteit bespraken van medicamenteuze behandeling van hallucinaties gerelateerd aan de ziekte van Parkinson (Bozymski, 2017; Eng, 2010; Kitten, 2018; Shotbolt, 2010; Touma, 2017; Wilby, 2017; Wood, 2010; Yasue, 2016). Van deze 9 reviews beschreven er twee de risk of bias assessment (Wilby, 2017; Yasue, 2016) en één voerde een meta-analyse uit (Yasue, 2016). Deze twee systematische reviews werden geïncludeerd. De overige reviews bespraken de bevindingen uitsluitend op narratief niveau en werden daarom uitgesloten. Wel werden deze reviews gebruikt om ontbrekende, relevante studies te identificeren.
Uit de zoekactie kwamen 5 RCT’s naar voren die na de geïncludeerde reviews gepubliceerd werden en voldeden aan de inclusie criteria (Cummings, 2014; Fernandez, 2009; Meltzer, 2010; Pintor, 2012; Shotbolt, 2009). Daarnaast werden nog 10 studies geïdentificeerd uit de referentielijsten van bovenstaande systematische reviews, allen gepubliceerd voor 2009 (Breier, 2002; Ellis, 2000; Goetz, 2000; Kurlan, 2007; Merims, 2006; Morgante, 2004; Nichols, 2013; Ondo, 2005; Pollak, 2004; Rabey, 2007). In totaal werden daarmee 15 onderzoeken opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Tevens is na ‘cross-referencing’ een extra referentie toegevoegd (The Parkinson Study Group, 1999).
Referenties
- Bozymski, KM, DK Lowe, KM Pasternak, et al. Pimavanserin: A Novel Antipsychotic for Parkinson's Disease Psychosis, Ann Pharmacother. 2017;51(6):479-87.
- Breier, A, VK Sutton, PD Feldman, et al. Olanzapine in the treatment of dopamimetic-induced psychosis in patients with Parkinson's disease, Biol Psychiatry. 2002;52(5):438-45.
- Busner, J, and SD Targum. The clinical global impressions scale: applying a research tool in clinical practice, Psychiatry (Edgmont (Pa. : Township)). 2007;4(7):28-37.
- Cummings, J, S Isaacson, R Mills, et al. Pimavanserin for patients with Parkinson's disease psychosis: a randomised, placebo-controlled phase 3 trial, Lancet. 2014;383(9916):533-40.
- Cummings, JL. The Neuropsychiatric Inventory: assessing psychopathology in dementia patients, Neurology. 1997;48(5 Suppl 6):S10-6.
- Ellis, T, ME Cudkowicz, PM Sexton, et al. Clozapine and risperidone treatment of psychosis in Parkinson's disease, J Neuropsychiatry Clin Neurosci. 2000;12(3):364-9.
- Eng, ML, and TE Welty. Management of hallucinations and psychosis in Parkinson's disease, Am J Geriatr Pharmacother. 2010;8(4):316-30.
- Fernandez, HH, D Aarsland, G Fenelon, et al. Scales to assess psychosis in Parkinson's disease: Critique and recommendations, Mov Disord. 2008;23(4):484-500.
- Fernandez, HH, MS Okun, RL Rodriguez, et al. Quetiapine improves visual hallucinations in Parkinson disease but not through normalization of sleep architecture: results from a double-blind clinical-polysomnography study, Int J Neurosci. 2009;119(12):2196-205.
- Goetz, CG, LM Blasucci, S Leurgans, et al. Olanzapine and clozapine: comparative effects on motor function in hallucinating PD patients, Neurology. 2000;55(6):789-94.
- Goetz, CG, S Fahn, P Martinez-Martin, et al. Movement Disorder Society-sponsored revision of the Unified Parkinson's Disease Rating Scale (MDS-UPDRS): Process, format, and clinimetric testing plan, Movement Disorders. 2007;22(1):41-47.
- Kay, SR, LA Opler, and JP Lindenmayer. The Positive and Negative Syndrome Scale (PANSS): rationale and standardisation, Br J Psychiatry Suppl. 1989;7):59-67.
- Kitten, AK, SA Hallowell, SR Saklad, et al. Pimavanserin: A Novel Drug Approved to Treat Parkinson's Disease Psychosis, Innov Clin Neurosci. 2018;15(1-2):16-22.
- Kurlan, R, J Cummings, R Raman, et al. Quetiapine for agitation or psychosis in patients with dementia and parkinsonism, Neurology. 2007;68(17):1356-63.
- Meltzer, HY, R Mills, S Revell, et al. Pimavanserin, a serotonin(2A) receptor inverse agonist, for the treatment of Parkinson's disease psychosis, Neuropsychopharmacology. 2010;35(4):881-92.
- Merims, D, M Balas, C Peretz, et al. Rater-blinded, prospective comparison: quetiapine versus clozapine for Parkinson's disease psychosis, Clin Neuropharmacol. 2006;29(6):331-7.
- Morgante, L, A Epifanio, E Spina, et al. Quetiapine and clozapine in parkinsonian patients with dopaminergic psychosis, Clin Neuropharmacol. 2004;27(4):153-6.
- Nichols, MJ, JM Hartlein, MG Eicken, et al. A fixed-dose randomized controlled trial of olanzapine for psychosis in Parkinson disease, F1000Res. 2013;2(150.
- Ondo, WG, S Sarfaraz, and M Lee. A novel scale to assess psychosis in patients with Parkinson's disease, Journal of Clinical Movement Disorders. 2015;2(1):17.
- Ondo, WG, R Tintner, KD Voung, et al. Double-blind, placebo-controlled, unforced titration parallel trial of quetiapine for dopaminergic-induced hallucinations in Parkinson's disease, Mov Disord. 2005;20(8):958-63.
- Overall, J, and D Gorham. Brief Psychiatric Rating Scale, Psychol Rep. 1962;10(799-812.
- Parkinson Study Group. Low-dose clozapine for the treatment of drug-induced psychosis in Parkinson's disease. N Engl J Med. 1999 Mar 11;340(10):757-63. PubMed PMID: 10072410.
- Pollak, P, F Tison, O Rascol, et al. Clozapine in drug induced psychosis in Parkinson's disease: a randomised, placebo controlled study with open follow up, J Neurol Neurosurg Psychiatry. 2004;75(5):689-95.
- Rabey, JM, T Prokhorov, A Miniovitz, et al. Effect of quetiapine in psychotic Parkinson's disease patients: a double-blind labeled study of 3 months' duration, Mov Disord. 2007;22(3):313-8.
- Shotbolt, P, M Samuel, and A David. Quetiapine in the treatment of psychosis in Parkinson's disease, Ther Adv Neurol Disord. 2010;3(6):339-50.
- Shotbolt, P, M Samuel, C Fox, et al. A randomized controlled trial of quetiapine for psychosis in Parkinson's disease, Neuropsychiatr Dis Treat. 2009;5(327-32.
- Touma, KTB, and DC Touma. Pimavanserin (Nuplazid) for the treatment of Parkinson disease psychosis: A review of the literature, Ment Health Clin. 2017;7(5):230-34.
- Voss, T, D Bahr, J Cummings, et al. Performance of a shortened Scale for Assessment of Positive Symptoms for Parkinson's disease psychosis, Parkinsonism & Related Disorders. 2013;19(3):295-99.
- Wilby, KJ, EG Johnson, HE Johnson, et al. Evidence-Based Review of Pharmacotherapy Used for Parkinson's Disease Psychosis, Ann Pharmacother. 2017;51(8):682-95.
- Wood, LD, JJ Neumiller, SM Setter, et al. Clinical review of treatment options for select nonmotor symptoms of Parkinson's disease, Am J Geriatr Pharmacother. 2010;8(4):294-315.
- Yasue, I, S Matsunaga, T Kishi, et al. Serotonin 2A Receptor Inverse Agonist as a Treatment for Parkinson's Disease Psychosis: A Systematic Review and Meta-analysis of Serotonin 2A Receptor Negative Modulators, J Alzheimers Dis. 2016;50(3):733-40.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 14-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk vijf jaar na de autorisatiedatum besluit het bestuur van de NVN om de richtlijn te updaten. In principe zullen de modules jaarlijks beoordeeld worden of deze nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Naast de ontwikkelde modules, is een aantal onderwerpen niet uitgewerkt in de huidige richtlijn. De werkgroep adviseert om deze op korte termijn alsnog te ontwikkelen omdat hier in de praktijk vraag naar is, te weten:
- urogenitale stoornissen;
- seksuele gezondheid;
- interacties tussen medicijnen ;
- visusstoornissen;
- orthostatische hypotensie;
- mond- en keelklachten;
- obstipatie.
Tabel 1 Geldigheid en onderhoud richtlijnmodules
|
Module |
Regiehou-der(s) |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Diagnostiek |
NVN |
NVN |
Nieuwe inzichten, veranderingen in zorg |
|
Medicamenteuze behandeling de Novo patiënt |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Medicamenteuze behandeling van motorische klachten en responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Geavanceerde therapieën voor responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN, NVvN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling houdingsproblematiek bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling valrisico bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Impulscontrolestoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Dopamine dysregulatie-stoornis bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Angststoornissen bij de ziekte van Parkinson |
NVN |
NVvP, NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Apathie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Depressie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Wanen en hallucinaties bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVKG |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Cognitieve stoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vermoeidheid bij de ziekte van Parkinson |
NVN |
NVN, NIP, NVKG |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Slaapstoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Pijnklachten bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Coping met de ziekte van Parkinson |
NVN |
NVN, V&VN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Werk en arbeidsongeschiktheid |
NVN |
NVAB |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Rijgeschiktheid |
NVN, VRA |
NVN, VRA |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Mantelzorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medicinale cannabis bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Mucuna Pruriens bij de ziekte van Parkinson |
NVN |
NVN, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vitamine B12 of D-suppletie bij de ziekte van Parkinson |
NVN |
NVN, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Multidisciplinaire revalidatieprogramma’s bij de ziekte van Parkinson |
VRA |
VRA, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Palliatieve zorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Advance care planning |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medische symptoombehandeling in de stervensfase |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
eHealth bij de ziekte van Parkinson |
NVN |
NVN |
Veranderingen in zorg |
|
Netwerkzorg, casemanagement en verwijscriteria |
NVN, VRA |
NVN, ParkinsonNet |
Veranderingen in zorg |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap (NHG)
- Parkinson Vereniging (PV)
- Vereniging van Specialisten Ouderengeneeskunde (Verenso)
- Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- Ergotherapie Nederland (EN)
- Nederlands Instituut van Psychologen (NIP)
- Nederlandse Vereniging van Diëtisten (NVD)
- ParkinsonNet, beroepsvereniging van professionals in sociaal werk (BPSW)
- Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVvS)
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Nederlandse Associatie Physician Assistants (NAPA)
- ParkinsonNet
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente (para)medische kennis omtrent de zorg voor patiënten met ziekte van Parkinson wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson te maken hebben.
Werkgroep
- Prof. dr. T. (Teus) van Laar (voorzitter), neuroloog, NVN
- Dr. A.J.W. (Agnita) Boon, neuroloog, NVN
- Dr. J.I. (Jorrit) Hoff, neuroloog, NVN
- Dr. M.L. (Mark) Kuijf, neuroloog, NVN
- Dr. A.G. (Alexander) Munts, neuroloog, NVN
- Dr. B. (Bart) Post, neuroloog, NVN
- Dr. G. (Gerrit) Tissingh, neuroloog, NVN (tot ..)
- Dr. F.J. (Erik) Slim, vicevoorzitter, revalidatiearts, VRA
- Drs. W.J. (Willem) Oudegeest, , revalidatiearts, VRA
- Drs. S.P. (Susan) Meuleman, revalidatiearts, VRA
- Prof. dr. O.A. (Odile) van den Heuvel, psychiater, NVvP
- Prof. dr. A.F.G. (Albert) Leentjens, psychiater, NVvP
- Dr. G. (Bert) Ziere, klinisch geriater, NVKG
- Drs. H.J. (Hannie) Scheper, specialist Ouderengeneeskunde, Verenso
- Dr. A.L. (Abram) Rutgers, huisarts, NHG
- Dr. A.A. (Annelien) Duits, klinisch neuropsycholoog, NIP
- H.H. (Herma) Lennaerts – Kats MSc, Parkinsonverpleegkundige, V&VN, ParkinsonNet
- T. (Tiny) van Wieren-Beerda MSc, verpleegkundig specialist parkinson, V&VN
- Drs. M.M. (Masja) van het Hoofd, beleidsmedewerker, Parkinson Vereniging
- Drs. K.C. (Kaie) Klaassen, patiënt-onderzoeker, Parkinson Vereniging
- Drs. M. (Marianne) Luinstra, ziekenhuisapotheker, NVZA
- Dr. M. (Marlies) van Nimwegen, fysiotherapeut (niet praktiserend), KNGF, ParkinsonNet
- Dr. I.H.W.M. (Ingrid) Sturkenboom, ergotherapeut, EN, ParkinsonNet
- K. (Karin) Overbeek-Dekker, diëtist, NVD, ParkinsonNet
- Dr. M. (Marten) Munneke, ParkinsonNet
Klankbordgroep
- Dr. J.G. (Hanneke) Kalf, logopedist, NVLF, ParkinsonNet
- K. (Klaas) Kooistra MSc, apotheker, KNMP
- P.R.I. (Paul) Rabsztyn, verpleegkundig seksuoloog SH (seksuologische hulpverlening) &VPO (voorlichting preventie en onderwijs), NVvS
- Dr. F.J.A. (Anton) Meijer, Neuro- en hoofd-hals radioloog, NVvR
- Prof. Dr. Y. (Yasin) Temel, neurochirurg, NVvN
- Drs. J.P. (Jacqueline) Janssen, Bedrijfsarts, klinisch arbeidsgeneeskundige, NVAB
- M. (Marlinda) Bakker, Geriatrisch maatschappelijk werker, BPSW
- Drs. A.L.A.J. (Danny) Hommel, specialist ouderengeneeskunde, Verenso
- Drs. H. (Hajo) Jongepier, huisarts, NHG
Met ondersteuning van
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. ir. N.L. (Nikita) van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Linda) Niesink-Boerboom, literatuurspecialist, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Guiterrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S. (Sonja) Wouters, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Parkinson Vereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door stakeholderpartijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn ziekte van Parkinson (NVN, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens de invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). De zekerheid van het bewijs wordt beïnvloed door beperkingen in studieopzet- of uitvoering (risk of bias), imprecisie, inconsistentie, indirectheid en publicatiebias.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De formulering van de conclusies hangt af van de bewijskracht. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Netwerkzorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten in de bijlagen).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
