Maagretentie routinematig meten
Uitgangsvraag
Wat is de plaats van routinematig maagretentie meten bij patiënten op de intensive care?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de plaats van het routinematig meten van maagretentie ten opzichte van het niet meten van maagretentie bij patiënten op de intensive care?
- Wat is de plaats van het routinematig meten van maagretentie ten opzichte van het meten van maagretentie op indicatie bij patiënten op de intensive care?
Aanbeveling
Overweeg het monitoren van maagretentie op indicatie: bij het optreden van een teken van intolerantie (braken en oprisping, misselijkheid, opgezette buik, buikpijn of kramp) ter vervanging van routinematig monitoren van maagretentie.
Overwegingen
Er is een systematische literatuuranalyse uitgevoerd, waarbij twee vergelijkingen werden gemaakt: 1) het wel meten van maagretentie ten op zichte van niet meten van maagretentie, en 2) het meten op indicatie ten opzichte van routinematig maagretentie meten. Vier vergelijkende studies zijn hierbij meegenomen: drie RCTs voor de vergelijking niet versus wel maagretentie meten (Chen 2015, Ozen 2016, Reignier 2013) en één observationele studie voor de vergelijking maagretentie routinematig meten versus meten op indicatie (Prest 2021).
Het waren over het algemeen relatief kleine studies met beperkingen in het studiedesign, waardoor de bewijskracht voor zowel de cruciale als belangrijke uitkomstmaten uitkomt op GRADE zeer laag. Vanwege de zeer lage bewijskracht voor alle uitkomstmaten die gerapporteerd werden, is er een zeer grote onzekerheid over het ware effect en die onzekerheid maakt dat er geen eenduidige conclusies getrokken konden worden. Voor een deel van de uitkomstmaten werd geen data gevonden en kon de bewijskracht niet beoordeeld worden.
De bewijskracht ten aanzien van de voordelen van het meten van maagretentie is laag, wat de vraag doet rijzen of het terecht is dat het routinematig meten hiervan breed geïmplementeerd is.
Studies laten zien dat braken en oprispen frequenter voorkomt wanneer maagretentie niet routinematig gemeten wordt. Braken en oprispen kunnen leiden tot aspiratie, wat vervolgens een risico geeft op een aspiratiepneumonie. Chen laat een klinisch relevant voordeel zien voor het meten van maagretentie ten aanzien van het optreden van aspiratie in een groep neurologische patiënten. Ondanks dat braken frequenter op lijkt te treden, en mogelijk aspiratie ook, laten Ozen en Reignier geen verschillen zien in beide groepen ten aanzien van het optreden van een aspiratiepneumonie. Prest laat in zijn studie zien dat er een voordeel is bij het optreden van een pneumonie wanneer er op indicatie maagretentie gemeten wordt versus routinematig.
Een effect van het routinematig of op indicatie meten van maagretentie versus het niet meten van maagretentie is te verwachten ten aanzien van het sneller behalen van voedingsdoelen of mogelijk een grotere kans op complicaties. Reignier en Ozen beschrijven, met een zeer lage bewijskracht, een lager calorietekort bij het niet monitoren van maagretentie. Logischerwijs lijkt dit toe te schrijven aan het interrumperen van voeding of het verlagen van voedingsstanden als er een hoge maagretentie wordt gemeten. De grotere kans op complicaties wordt voor braken beschreven. De grotere kans op braken maakt het mogelijk in de praktijk niet aanvaardbaar om volledig te stoppen met het meten van maagretentie en zou het meten op indicatie een alternatief zijn. Indien maagretentie gemeten wordt is het mogelijk aan te raden om terughoudend te zijn met het interruperen van voeding of verlagen van de toediensnelheid als er naast hoge maagretentie geen andere problemen optreden.
Een positief effect op opnameduur en mortaliteit zijn niet te verwachten. Een kortere opnameduur zou een maat kunnen zijn voor een sneller herstel door hogere voedingsinname. Een langere opname duur zou een maat kunnen zijn voor vertraagd herstel door het optreden braken en aspiratie. De opnameduur wordt door vele factoren beïnvloed, de spreiding is groot en is afhankelijk van definities. De verwachting is niet dat het meten van maagretentie resulteert in een lagere mortaliteit
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het belangrijkste doel van de interventie voor de patiënt is lage mortaliteitcijfers en een korte opnameduur. Door het nastreven van voedingsdoelen wordt geprobeerd dit te bewerkstelligen. Daarom is het te verwachten dat patiënten evenals professionals cumulatieve calorietekort een cruciale uitkomstmaat vinden. Daarnaast zal het zowel voor de patiënt als de professional cruciaal zijn om braken, oprisping, aspiratie en pneumonie te voorkomen. De verwachting is dat zowel patiënten als zorgprofessionals opnameduur en mortaliteit belangrijke uitkomstmaten vinden.
Kosten (middelenbeslag)
Het toepassen van de aanbevelingen zal naar verwachting geen negatief effect op de kosten hebben.
Aanvaardbaarheid, haalbaarheid en implementatie
In de huidige klinische praktijk wordt maagretentie routinematig gemeten. Mogelijk dat zorgprofessionals het niet aanvaardbaar vinden om hiermee te staken als zij gevolgen zoals braken en oprisping waarnemen bij de patiënt. Het de-implementeren van routinematig maagretentie meten in individuele situaties zal meer vereisen dan het continueren van de huidige klinische praktijk. Het meten op indicatie zal daarom makkelijker zijn dan het geheel afschaffen van de het meten van de maagretenties. Indien op indicatie maagretentie gemeten wordt en hierbij blijkt dat het volume hoger is dan gewenst, kan overwogen worden om prokinetica in te zetten. Ook is het een optie om postpylorisch te gaan voeden, bijvoorbeeld bij patiënten met verhoogd risico op pneumonie zoals beschreven in de module postpylorische voeding. Bij het meten van maagretentie komt in de praktijk de vraag frequent voor of maagretentie teruggeven moet worden of niet. Theoretisch zou het teruggeven een toename kunnen geven van verstoppingen van de neusmaagsonde en toename van maagretentie, braken en oprispingen. Het weggooien van retentie zou een risico kunnen geven op ondervoeding en electrolytendisbalans. Hoewel dit buiten de scope van deze module ligt, wordt beschreven in het systematisch review en meta-analyse van Wen (2019) dat het teruggeven of weggooien van maagretentie geen significante verschillen geeft in de hoeveelheid maagretentie, kaliumniveau, incidentie van vertraagde maaglediging, incidentie van aspiratiepneumonie, braken en diarree. De studies rapporteerden niet over het behalen van voedingsdoelen of calorie-inname. Het is dus onduidelijk of het de voorkeur heeft om maagretentie terug te geven of weg te gooien.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Hoewel gedacht werd dat het niet meten van maagretentie kan leiden tot het sneller behalen van voedingsdoelen, maar daarnaast ook een grotere kans geeft op complicaties, wijst de literatuur dit niet uit. Het is onduidelijk of er een verschil zit in het cumulatieve calorietekort, opnameduur op de IC, mortaliteit, pneumonie en aspiratie vanwege een zeer lage bewijskracht. Alleen voor braken is er mogelijk een verschil in het voordeel van het monitoren van maagretentie. Het is niet duidelijk of dit iedere 4 of 8 uur gedaan moet worden, echter in de Nederlandse praktijk is iedere 6-8 uur gebruikelijk. Internationale richtlijnen beschrijven dat het meten van maagretentie gebruikelijk is en behulpzaam kan zijn om voedingsintolerantie te identificeren (ESPEN, 2019), maar ook dat het meten van maagretentie geen deel moet zijn van het routinematig monitoren van IC patiënten die enterale voeding ontvangen (ASPEN, 2016).
Er kan overwogen worden om maagretentie te meten op indicatie. De indicaties in het voedingsprotocol in Prest (2021) waren misselijkheid, abdominale distensie, buikpijn of buikkramp. Ook braken en oprispen kunnen belangrijke indicaties zijn om maagretentie te meten.
Onderbouwing
Achtergrond
Op de meeste intensive cares (IC’s) wordt routinematig de maagretentie gemeten, meestal iedere 6 of 8 uur. De hoeveelheid die geaccepteerd wordt, varieert per ziekenhuis en ligt meestal tussen de 250 en 500 ml. Bij retenties boven de 250-500 ml wordt er gestart met prokinetica en/of wordt voeding gestaakt, verminderd of niet verder opgehoogd. Het niet meer meten van de retenties kan als gevolg hebben dat patiënten sneller hun voedingsdoelen halen. Het kan ook tot gevolg hebben dat voeding gecontinueerd wordt terwijl de maag al vol is (hoog volume maagretentie) met reflux vanuit de maag naar de oesophagus, braken en eventueel aspiratie als gevolg. In de European Society for Clinical Nutrition and Metabolism (ESPEN) richtlijn wordt geadviseerd om tot 500 ml maagretentie in 6 uur te accepteren, terwijl in de American Society for Parenteral and Enteral Nutrition (ASPEN) richtlijn wordt geadviseerd maagretentie niet routinematig te meten (ESPEN, 2019; ASPEN, 2016). Hierdoor is het onduidelijk of maagretentie al dan niet gemeten dient te worden.
Conclusies / Summary of Findings
PICO 1. No gastric residual volume monitoring versus gastric residual volume monitoring
|
Very low GRADE |
The evidence is very uncertain about the effect of not monitoring gastric residual volume on cumulative calorie deficit, length of ICU stay, mortality, aspiration pneumonia, and aspiration when compared with monitoring gastric residual volume in patients admitted to the ICU.
Sources: Chen 2015, Ozen 2016, Reignier 2013. |
|
Low GRADE |
Monitoring gastric residual volume may reduce vomiting when compared with monitoring gastric residual volume in patients admitted to the ICU.
Sources: Chen 2015, Ozen 2016, Reignier 2013. |
PICO 2. Triggered versus routine gastric residual volume monitoring
|
Very low GRADE |
The evidence is very uncertain about the effect of triggered gastric residual volume monitoring on length of ICU stay, mortality and pneumonia when compared with routine gastric residual volume monitoring in patients admitted to the ICU.
Source: Prest 2021 |
|
No GRADE |
No studies were found that could answer the question what the effect is of triggered gastric residual volume monitoring when compared to routine gastric residual volume monitoring on vomiting, aspiration and cumulative calorie deficit in patients admitted to the ICU.
Sources: - |
Samenvatting literatuur
Description of studies
As shown in table 1, three RCTs compared routine gastric residual volume (GRV) monitoring versus no GRV monitoring (PICO 1) and one observational study compared triggered GRV monitoring with routine GRV monitoring (PICO 2).
Table 1. Characteristics of included studies
|
Author, year |
Study design |
Intervention |
Comparator |
Patients |
N |
|
PICO 1 |
|||||
|
Chen, 2015 |
RCT |
No GRV monitoring |
GRV monitoring |
Stroke patients admitted to the ICU for > 96 hours, receiving MV and starting EN via NG tube |
I: 84 C: 126 |
|
Ozen, 2016 |
RCT |
No GRV monitoring |
GRV monitoring |
Critical patients planned to receive > 5 days invasive MV and starting EN via NG tube |
I: 27 C: 34 |
|
Reignier, 2013 |
RCT |
No GRV monitoring |
GRV monitoring |
Critical patients > 48 hours of invasive MV, and started EN via a NG tube within 36 hours |
I: 230 C: 222 |
|
PICO 2 |
|||||
|
Prest, 2021 |
Prospective cohort study |
Triggered GRV monitoring (GRV check when secondary sign of intolerance is present (nausea, abdominal distention, abdominal pain or cramping)) |
Routine GRV monitoring (every 4 hours) |
Surgical trauma ICU patients who received EN for > 48 hours and a minimum ICU length of stay of 72 hours |
I: 145 C: 156 |
RCT: randomized controlled trial, GRV: gastric residual volume, ICU: intensive care unit, MV: mechanical ventilation, EN: enteral nutrition, NG: nasogastric, I: intervention, C: comparator.
Results
PICO 1. No GRV monitoring versus GRV monitoring
- Cumulative calorie deficit
Two studies reported cumulative calorie deficit, which is calculated by subtracting the calorie amount provided daily to the patient from the calorie amount that the patient should have received daily (Ozen 2016; Reignier 2013). One study did not report cumulative calorie deficit (Chen 2015).
Ozen (2016) reported cumulative calorie deficit from day 1 up to day 5 in mean kcal (SD). The results are presented in table 2. The difference is clinically relevant on all days in favor of no GRV monitoring.
Table 2. Cumulative calorie deficit day 1 to 5 on ICU, kcal mean (SD) and mean difference [95% CI] (Ozen 2016).
|
|
No GRV monitoring, kcal (SD) |
GRV monitoring, kcal (SD) |
Mean difference [95% CI] |
|
Day 1 |
162.3 (260.5) |
301.6 (267.7) |
-139.30 [-284.34, 5.74] |
|
Day 2 |
33.8 (146.3) |
52.8 (139.0) |
-19.00 [-97.30, 59.30] |
|
Day 3 |
12.3 (45.2) |
86.0 (163.1) |
-73.70 [-139.95, -7.45] |
|
Day 4 |
8.2 (14.7) |
162.6 (210.6) |
-154.40 [-237.15, -71.65] |
|
Day 5 |
5.7 (32.5) |
71.2 (150.9) |
-65.50 [-125.96, -5.04] |
Reignier (2013) reported the median cumulative calorie deficit from day 0 to day 7. From day 0 to 7 together, the cumulative calorie deficit was 319 kcal (IQR 93-1012) in the no monitoring group, versus 509 kcal (IQR 185-1252) in the GRV monitoring group. This difference is clinically relevant in favor of no GRV monitoring.
- Length of ICU stay
Two studies reported mortality rates (Ozen 2016; Reignier 2013) and one did not (Chen 2015).
Ozen (2016) reported the mean length of ICU stay. This was 27.35 (SD 24.01) days in the no monitoring group and 32.96 (SD 21.81) days in the GRV monitoring group. The mean difference (MD) was -5.61 (95% CI -17.26 to 6.04). This difference is clinically relevant in favor of no GRV monitoring.
Reignier (2013) reported the median length of ICU stay. They found a median ICU stay of 10 days (IQR 6-17) in the no GRV monitoring group and 10 days (IQR 7-17) in the monitoring group. This difference was not clinically relevant.
- Mortality
Two studies reported mortality rates (Ozen 2016; Reignier 2013) and one did not (Chen 2015).
Ozen (2016) reported mortality at the end of the 5-day follow-up. The no monitoring group had 15/27 deaths (55.5%), versus 20/34 (58.8%) in the monitoring group. The risk ratio (RR) was 0.94 (95% CI 0.61 to 1.47). This difference is clinically relevant in favor of no GRV monitoring.
Reignier (2013) reported mortality at 28 days and 90 days. Mortality at 28 days was similar in the no monitoring and monitoring group; 63/230 (27.4%) vs. 61/222 (27.5%), respectively (RR 1.00, 95% CI 0.74 to 1.35). At day 90, the no monitoring group reported 82/230 deaths (35.7%) and the monitoring group 76/222 (34.2%) (RR 1.04, 95% CI 0.81 to 1.34). These differences were not clinically relevant.
- Aspiration pneumonia
Reignier (2013) reported the cumulative incidence of ventilator-associated pneumonia (VAP). The hazard ratio of the cumulative VAP incidence in the no monitoring group versus the monitoring group was 1.06 (90% CI 0.72 to 1.55). Reignier (2013) also presented the cumulative incidence of VAP in a figure. The figure showed little to no difference in VAP incidence between monitoring or not monitoring GRV throughout the study period of 40 days.
- Vomiting
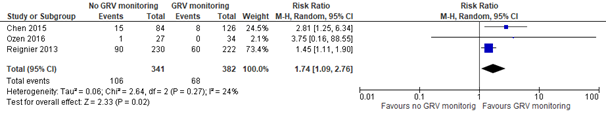
Three studies reported vomiting or regurgitation (Chen 2015; Ozen 2016; Reignier 2013).
As shown in figure 1, a pooled RR of 1.74 (95% CI 1.09 to 2.76) was found in favor of GRV monitoring. This difference is clinically relevant in favor of GRV monitoring.
Figure 1. Vomiting or regurgitation; no GRV monitoring versus GRV monitoring
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
- Aspiration
One study reported aspiration (Chen, 2015) and two did not (Reignier 2013; Ozen 2016). Chen (2015) reported 14/84 patients with aspiration (16.7%) in the intervention group without monitoring and 10/126 (7.9%) patients with aspiration in the control group (RR 2.10, (95% CI 0.98 to 4.50). This difference is considered to be clinically relevant in favor of GRV monitoring.
Level of evidence of the literature
The level of evidence regarding the outcome measure cumulative calorie deficit started as high, since the studies were RCTs. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias; -1); and imprecision (-2). The level of evidence for cumulative calorie deficit is very low.
The level of evidence regarding the outcome measure length of ICU stay started as high, since the studies were RCTs. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias; -1); conflicting results (inconsistency; -1); wide 95% confidence interval (imprecision; -2). The level of evidence for length of ICU stay is very low.
The level of evidence regarding the outcome measure mortality started as high, since the studies were RCTs. The level of evidence was downgraded by 3 levels because of conflicting results (inconsistency; -1); wide 95% confidence interval (imprecision; -2). The level of evidence for mortality is very low.
The level of evidence regarding the outcome measure aspiration pneumonia started as high, since the studies were RCTs. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias; -1), and wide 95% confidence interval (imprecision; -2). The level of evidence for mortality is very low.
The level of evidence regarding the outcome measure vomiting started as high, since the studies were RCTs. The level of evidence was downgraded by 2 levels because of study limitations (risk of bias; -1); the wide 95% confidence interval of the pooled estimate (imprecision; -1). The level of evidence for vomiting is low.
The level of evidence regarding the outcome measure aspiration started as high, since the studies were RCTs. The level of evidence was downgraded by 3 levels because of study limitations (risk of bias; -1); wide 95% confidence interval (imprecision; -2). The level of evidence for aspiration is very low.
Conclusions
PICO 1. No gastric residual volume monitoring versus gastric residual volume monitoring
|
Very low GRADE |
The evidence is very uncertain about the effect of not monitoring gastric residual volume on cumulative calorie deficit, length of ICU stay, mortality, aspiration pneumonia, and aspiration when compared with monitoring gastric residual volume in patients admitted to the ICU.
Sources: Chen 2015, Ozen 2016, Reignier 2013. |
|
Low GRADE |
Monitoring gastric residual volume may reduce vomiting when compared with monitoring gastric residual volume in patients admitted to the ICU.
Sources: Chen 2015, Ozen 2016, Reignier 2013. |
PICO 2. Triggered GRV monitoring versus routine GRV monitoring
- Cumulative calorie deficit
Prest (2021) did not report the cumulative calorie deficit, but did report average caloric and protein intake.
The daily average caloric (1380 vs 1226 kcal/d, P = .035) and protein intake levels (90.3 vs 77.5 g/d, P = .007) were higher among the tGRV patients. The difference in caloric intake is not considered clinically relevant. The difference in protein intake is considered clinically relevant.
- Length of ICU stay
Prest (2021) reported median length of ICU stay. The intervention group had a median length of 12 days (IQR 9-16), versus 13 days (IQR 9-20) in the control group. This difference is clinically relevant in favor of triggered GRV monitoring.
- Mortality
Prest (2021) reported mortality rates after at least 72 hours. In the intervention group, 20/145 deaths (13.8%) occurred and in the control group 11/156 (7.1%) (RR 1.96, 95% CI 0.97 to 3.94). This difference was considered clinically relevant in favor of routine GRV monitoring.
- Aspiration pneumonia
Prest (2021) reported the number of pneumonia cases. In the intervention group 31/145 patients developed pneumonia (21.4%) compared to 61/156 (39.1%) in the control group (RR 0.55, 95% CI 0.38 to 0.79). This difference was considered clinically relevant in favor of triggered GRV monitoring.
- Vomiting
This outcome measure was not reported in Prest (2021).
- Aspiration
This outcome measure was not reported in Prest (2021).
Level of evidence of the literature
No studies were included that reported cumulative calorie deficit.
The level of evidence regarding the outcome measure length of ICU stay started as low, since this was an observational study. The level of evidence was downgraded by 1 level because of a wide 95% confidence interval and number of included patients (imprecision; -2). The level of evidence for length of ICU stay is very low.
The level of evidence regarding the outcome measure mortality started as low, since the study was observational. The level of evidence was downgraded by 1 level because of a wide 95% confidence interval (imprecision; -2). The level of evidence for mortality is very low.
The level of evidence regarding the outcome measure pneumonia started as low, since the study was observational. The level of evidence was downgraded by 1 level because of number of included patients (imprecision; -1. The level of evidence for pneumonia is very low.
No studies were included regarding vomiting or aspiration.
Conclusions
PICO 2. Triggered versus routine gastric residual volume monitoring
|
Very low GRADE |
The evidence is very uncertain about the effect of triggered gastric residual volume monitoring on length of ICU stay, mortality and pneumonia when compared with routine gastric residual volume monitoring in patients admitted to the ICU.
Source: Prest 2021 |
|
No GRADE |
No studies were found that could answer the question what the effect is of triggered gastric residual volume monitoring when compared to routine gastric residual volume monitoring on vomiting, aspiration and cumulative calorie deficit in patients admitted to the ICU.
Sources: - |
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
PICO 1
1. What are the (un)favorable effects of monitoring gastric residual volume compared to not monitoring gastric residual volume in patients admitted to the intensive care unit (ICU)?
| P (patients): | Patients admitted to the ICU |
| I (intervention): | No monitoring gastric residual volume |
| C (comparison): | Monitoring gastric residual volume |
| O (outcome): | Cumulative calorie deficit, length of ICU stay, mortality, pneumonia, aspiration, vomiting |
PICO 2
2. What are the (un)favorable effects of monitoring gastric residual volume triggered by signs of intolerance compared to monitoring gastric residual volume routinely in patients admitted to the ICU?
| P (patients): | Patients admitted to the ICU |
| I (intervention): | Monitoring gastric residual volume routinely |
| C (comparison): | Monitoring gastric residual volume triggered by signs of feeding intolerance |
| O (outcome): | Cumulative calorie deficit, length of ICU stay, mortality, aspiration pneumonia, aspiration, vomiting |
Relevant outcome measures
The guideline development group considered aspiration pneumonia, cumulative calorie deficit and vomiting as critical outcome measures for decision making; and length of ICU stay, aspiration, and mortality as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The guideline development group defined the following as a minimal clinically (patient) important difference:
Cumulative calorie deficit: a difference of 10% in kcal
Length of ICU stay: MD>1 day
Mortality: a 5% difference relative risk: 0.95≤RR≥1.05
Adverse events (vomiting and regurgitation, aspiration, aspiration pneumonia): a 10% difference in relative risk: 0.91≤RR≥1.10
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until October 26th, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 551 hits. Studies comparing not monitoring versus monitoring gastric residual volume (PICO 1) were selected based on the following criteria:
- Systematic review or randomized controlled trial (RCT)
- Publication year 2000 or later
- Patients ≥ 18 years
- Conform PICO
The following criteria were used for the comparison of triggered versus routine monitoring gastric residual volume (PICO 2):
- Systematic review, RCT or comparative observational study
- Publication year 2000 or later
- Patients ≥ 18 years
- Conform PICO
Twenty-two studies were initially selected based on title and abstract screening. After reading the full text, 19 studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included: one Cochrane review (Yasuda 2021) and one RCT (Chen 2015) for the comparison not monitoring versus monitoring gastric residual volume and one observational study (Prest 2021) for the comparison triggered versus routine monitoring of gastric residual volume.
Concerning the Cochrane review, the decision was made to include the original publications of the RCTs for this literature analysis, because in this literature analysis we included outcome measures beyond those reported in the Cochrane review. This resulted in the inclusion of two additional RCTs (Ozen 2016; Reignier 2013).
Results
Four studies were included in the analysis of the literature: two RCTs originating from the Cochrane review; Ozen (2016), Reignier (2013); one single RCT; Chen (2015); and one observational study; Prest (2021). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Chen S, Xian W, Cheng S, Zhou C, Zhou H, Feng J, Liu L, Chen L. Risk of regurgitation and aspiration in patients infused with different volumes of enteral nutrition. Asia Pac J Clin Nutr. 2015;24(2):212-8. doi: 10.6133/apjcn.2015.24.2.12. PMID: 26078237.
- McClave SA, Taylor BE, Martindale RG, Warren MM, Johnson DR, Braunschweig C, McCarthy MS, Davanos E, Rice TW, Cresci GA, Gervasio JM, Sacks GS, Roberts PR, Compher C; Society of Critical Care Medicine; American Society for Parenteral and Enteral Nutrition. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr. 2016 Feb;40(2):159-211. doi: 10.1177/0148607115621863. Erratum in: JPEN J Parenter Enteral Nutr. 2016 Nov;40(8):1200. PMID: 26773077.
- Ozen N, Tosun N, Yamanel L, Altintas ND, Kilciler G, Ozen V. Evaluation of the effect on patient parameters of not monitoring gastric residual volume in intensive care patients on a mechanical ventilator receiving enteral feeding: A randomized clinical trial. J Crit Care. 2016 Jun;33:137-44. doi: 10.1016/j.jcrc.2016.01.028. Epub 2016 Feb 10. PMID: 26948254.
- Prest PJ, Reath JJ, Bell N, Rabieh M, Moore A, Jones M, Watson C, Bynoe R. Evaluating a symptom-triggered gastric residual volume policy in a surgical trauma intensive care unit: Simple and safe. Nutr Clin Pract. 2021 Aug;36(4):899-906. doi: 10.1002/ncp.10654. Epub 2021 Mar 24. PMID: 33760260.
- Reignier J, Mercier E, Le Gouge A, Boulain T, Desachy A, Bellec F, Clavel M, Frat JP, Plantefeve G, Quenot JP, Lascarrou JB; Clinical Research in Intensive Care and Sepsis (CRICS) Group. Effect of not monitoring residual gastric volume on risk of ventilator-associated pneumonia in adults receiving mechanical ventilation and early enteral feeding: a randomized controlled trial. JAMA. 2013 Jan 16;309(3):249-56. doi: 10.1001/jama.2012.196377. PMID: 23321763.
- Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, Hiesmayr M, Mayer K, Montejo JC, Pichard C, Preiser JC, van Zanten ARH, Oczkowski S, Szczeklik W, Bischoff SC. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr. 2019 Feb;38(1):48-79. doi: 10.1016/j.clnu.2018.08.037. Epub 2018 Sep 29. PMID: 30348463.
- Wen Z, Xie A, Peng M, Bian L, Wei L, Li M. Is discard better than return gastric residual aspirates: a systematic review and meta-analysis. BMC Gastroenterol. 2019 Jun 28;19(1):113. doi: 10.1186/s12876-019-1028-7. PMID: 31253100; PMCID: PMC6599274.
- Yasuda H, Kondo N, Yamamoto R, Asami S, Abe T, Tsujimoto H, Tsujimoto Y, Kataoka Y. Monitoring of gastric residual volume during enteral nutrition. Cochrane Database Syst Rev. 2021 Sep 27;9(9):CD013335. doi: 10.1002/14651858.CD013335.pub2. PMID: 34596901; PMCID: PMC8498989.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series)
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Chen 2015ᵃ |
Type of study: RCT
Setting and country: 210 stroke patients, who were hospitalized for more than 96 hours in the Department of Neurology of the First Affiliated Hospital of Sun Yat-sen University from January 2010 to December 2012
Funding and conflicts of interest: None |
Inclusion criteria: 1) definite indication for EN; 2) age ≥18 years old; and 3) planned ICU length of stay >5 days
Exclusion criteria: 1) immuno-compromised; 2) hepatic failure; or 3) gastrointestinal issues postoperatively
N total at baseline: Intervention: 84 Control: 126
Important prognostic factors2:
Sex N (%): I: 44 (55.0) M C: 71 (56.3) M
APACHE II score mean±SD: I: 18.7±4.1 C: 19.1±3.4
Mechanical ventilation N (%) I: 51 (63.8) C: 92 (73.0)
Groups comparable at baseline? Yes |
No GRV measurement.
The infusion was performed by a feeding pump at a constant rate from 7:00 am to 3:00 am next morning. The infusion rate was determined based on the total volume of EN. The volume of EN was increased gradually every day according to energy requirements as follows: Day 1: 33% of the target volume, Day 2: 66% of the target volume, and Day 3: 100% of the target volume.
|
GRV was measured on all nasogastric tubes and recorded every 4 hours. The GRV was assessed at 7 am, 11 am, 3 pm, 7 pm, 11 pm, and 3 am next day. The EN infusion rate was adjusted based on the gastric residual volume. The original rate of infusion was maintained if the residue was ≤200 mL. Rate was increased if the residue was ≤100 mL. The rate was lowered and motility agents were added if the residue was ≥200 mL. |
Length of follow-up: 72 hours
Loss-to-follow-up: Intervention: 0
Control: 4 Reasons: complications (gastrointestinal bleeding (n=2)), extubation before 72h (n=2)
Incomplete outcome data: Excluded four participants allocated to the control group and who failed to continue EN for more than 72 hours |
Regurgitation, N (%) I: 15 (18.8) C: 8 (6.3) P=0.006
Aspiration, N (%) I: 14 (17.5) C: 10 (7.9) P=0.037 |
Author’s conclusions The risk of reflux and aspiration was not increased in stroke patients when EN infusion volume was increased from 500 to 1500 mL with carefully monitoring of the GRV.
During EN therapy for patients with stroke, using feeding pump with a continuous infusion for 20 hours and adjusting infusion rate based on GRV could reduce the incidence of respiratory complications |
|
Ozen 2016 |
Type of study RCT
Setting and country: Adult medical ICU of 2 university hospitals in Ankara, Turkey, between March 2014 and April 2015.
Funding and conflicts of interest: none |
Inclusion criteria: Patients who were planned to receive >5 days of invasive MV treatment, >18 years, patients where EF treatment would be started with a NG tube, and patients whose relative provided written consent were included in the study
Exclusion criteria: Paralytic ileus, acute pancreatitis, pregnancy, inflammatory bowel disease, short bowel syndrome, Crohn disease, gastrointestinal bleeding, esophageal and fundic varices, morbid obesity, or gastrostomy/jejunostomy; those receiving thoracic or abdominal radiotherapy.
N total at baseline: Intervention: 27 Control: 34
Important prognostic factors2: Age mean±SD I: 68.08 ± 18.04 C: 64.92 ± 14.95 Sex N (%): I: 17 (65.4) M C: 15 (40.0) M
APACHE II score: I: 25.29 ± 7.43 C: 23.58 ± 6.97
|
Gastric residual volume was not measured in this group. EF was stopped and the physician informed if the patient developed vomiting, regurgitation, diarrhea, or abdominal distention, and another appropriate feeding method was started. (TPN) |
The GRV was measured by the nurses with the syringe method every 8 hours at 8:00 AM, 4:00 PM, and midnight. EF was stopped for 1 hour before the measurement, and the amount aspirated was returned to the patient at the end of the measurement. |
Length of follow-up: 5 days
Loss-to-follow-up: Intervention: 1 Reasons: Exitus (n = 1)
Control: 9 Reasons: GRV amount > 250 mL twice (n = 1); Going to TPN due to continuous vomiting during the four hours in the first day of the study (n = 1); Exitus (n = 3); Going to TPN due to cholestasis development (n = 1); Going to TPN due to ileus development (n = 1); Extubation (n = 1); Postoperative hemodynamic instability (n = 1)
Incomplete outcome data: In GRV monitoring group, 9 participants were lost to follow-up and excluded after randomization and thus not included in the overall analysis. |
Vomiting N (%) I: 1 (3.8) C: 0 P=0.322
Feeding intolerance N (%) I: 1 (3.8) C: 2 (8) P=0.529
Mortality at the end of follow-up N (%) I: 15 (57.7) C: 20 (80.0) P=0.157
Time in ICU, days mean±SD I: 27.35 ± 24.01 C: 32.96 ± 21.81 P=0.154
Cumulative calorie deficit (kcal) Day 1: I: 162.3 ± 260.5 C: 301.6 ± 267.7
Day 2: I: 33.8 ± 146.3 C: 52.8 ± 139.0
Day 3: I: 12.3 ± 45.2 C: 86.0 ± 163.1 Day 4: I: 8.2 ± 14.7 C: 162.6 ± 210.6
Day 5: I: 5.7 ± 32.5 C: 71.2 ± 150.9 P<0.001 |
Author’s conclusions: The discrepancies in GRV measurement make it unreliable for monitoring feeding intolerance and gastroesophageal reflux. The use of GRV measurements may therefore be discontinued as part of the standard care protocol in medical ICUs. |
|
Reiginier 2013 |
Type of study RCT
Setting and country: Multicenter ICU in France. Of the 9 ICUs, 3 were medical and 6 were medical- surgical; 3 were in university hospitals and 6 in general university affiliated hospitals. The trial lasted from May 2010 to March 2011.
Funding and conflicts of interest: none |
Inclusion criteria: adults (aged ≥18 years) admitted to the study ICUs between May 2010 and March 2011, expected to require more than 48 hours of invasive mechanical ventilation, and started on enteral nutrition via a nasogastric tube within 36h after intubation
Exclusion criteria: abdominal surgery within the past month; history of esophageal, duodenal, pancreatic, or gastric surgery; bleeding from the esophagus, stomach, or bowel; contraindications to prokinetic agents; enteral nutrition via a jejunostomy or gastrostomy; pregnancy; treatment-limitation decisions; and current inclusion in a trial of VAP prevention, enteral nutrition tolerance, or both.
N total at baseline: Intervention: 230 Control: 222
Important prognostic factors2: Age mean±SD I: 61±15 C: 62±14
Sex N I: 159 C: 156 SAPS II score: I: 49 ±17 C: 51±16 |
The intervention consisted in not monitoring residual gastric volume. In the intervention group, intolerance to enteral nutrition was diagnosed when vomiting occurred.
Enteral nutrition was initiated within 36 hours after intubation and delivered according to the same protocol in both groups
|
In the control group, the diagnosis of intolerance to enteral nutrition relied on the presence of vomiting, of residual gastric volume greater than 250 mL, or both. Residual gastric volume was measured every 6 hours by aspiration through the nasogastric tube using a 50-mL syringe. Aspirates smaller than 250 mL were returned to the patient. |
Length of follow-up: 90 days
Loss-to-follow-up: Intervention: 41 Reasons: Excluded per-protocol (n=19), did not meet inclusion criteria (n=7), mechanical ventilation for <48h (n=9), medical reasons (n=3), withdrew consent (n=3)
Control: 14 Reasons: Excluded per-protocol (n=7), did not meet inclusion criteria (n=5), mechanical ventilation for <48h (n=2)
Incomplete outcome data: All analyses were conducted in both a modified ITT population and a per-protocol population. The modified ITT population comprised all randomized participants except those who withdrew consent |
Vomiting, N (%) I: 90 (39.6) C: 60 (27.0)
Intolerance to EN, N (%) I: 90 (39.6) C: 141 (63.5)
ICU length of stay, median (IQR) I: 10 (6-17) C: 10 (7-17) MD (90% CI): -1 (-2 to 0)
Hospital length of stay, median (IQR) I: 17 (9-31) C: 19 (10-32) MD (90% CI): -1 (-3 to 1)
Mortality up to 28 days, N (%) I: 63 (27.8) C: 61 (27.5)
Cumulative calorie deficit from day 0 to 7, median (IQR) I: 319 (93-1012) C: 509 (185-1252) MD (90% CI): -111 (-198 to -36) |
Author’s conclusions: Not monitoring gastric volume was not inferior to routine residual gastric volume monitoring in terms of development of VAP among adults requiring mechanical ventilation and receiving early enteral nutrition.
Note: Similar results were obtained in the per-protocol analysis |
|
Prest 2021 |
Type of study: Prospective cohort
Setting and country: One surgical trauma ICU in the USA
Funding and conflicts of interest: Grant provided by Nestlé Health Science. First and second author received speaking honoraria from Nestlé. |
Inclusion criteria: adults over 18 years of age who received enteral nutrition for>48 hours and who had an ICU LOS of at least 72 hours.
Exclusion criteria: Death within 72 hours
N total at baseline: I: 145 C: 156
Important prognostic factors2 Age mean±SD I: 48.3±18.5 C: 46.3±17.3
Sex N (%) I: 105 (72.4) M C: 116 (74.4) M
|
Triggered GRV: Not checking gastric residuals until a secondary sign of intolerance is present. These include nausea, abdominal distention, abdominal pain, or cramping. Feeds are not reduced or held until residuals are >500 ml. If emesis is present, feeds are automatically held for 4 hours before checking residual amounts, and feeds restart for residuals of <500 ml |
Routine GRV: check residuals every 4 hours; if the residual amount was twice the rate of enteral nutrition, then the nurse was to hold the feeds and contact the rounding team. At this point, the rounding team was at liberty to either continue to hold or resume enteral nutrition. |
Length of follow-up: Until ICU discharge
Loss-to-follow-up: “25 were excluded because they were missing injury severity information”
Incomplete outcome data: 6 patients under the routine GRV protocol and 19 patients under the triggered GRV protocol were excluded due to missing ISS scores. |
ICU length of stay, median (IQR) I: 12 (9-16) C: 13 (9—20) P=0.057
Pneumonia, N (%) I: 31 (21.4) C: 61 (39.1) P=0.001
Mortality (>72h), N (%) I: 20 (13.8)
|
Author’s conclusions: The elimination of GRV assessments results in the delivery of an equivalent amount of protein and calories when compared with routine monitoring of GRVs. The data suggest that this is a safe practice. |
ᵃin the original publication by Chen et al., the intervention and control group were reversed
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Chen 2015 |
Probably yes;
Reason: method of randomization is not reported, however authors of a Cochrane review requested additional information affirming that randomization was performed using a random number table |
Probably no;
Reason: method of allocation and concealment are not reported |
Definitely no;
Reason: Blinding of patients, health care providers and data collectors could not be performed. Blinding of data analysts is not reported. |
Probably yes;
Reason: Loss to follow-up was infrequent in the intervention group. In the control group, 4 patients were excluded later on. |
Probably yes;
Reason: no study protocol available, but the published study included all planned/expected outcomes |
Definitely yes;
Reason: No other problems noted |
Some concerns (all outcomes except mortality)
Lack of details on concealment of allocation, lack of blinding, frequent loss to follow-up.
|
|
Ozen 2016 |
Definitely yes;
Reason: Computer-generated randomization |
Probably no;
Reason: method of concealment is not reported |
Definitely no;
Reason: Blinding of patients, health care providers and data collectors could not be performed. Data analysts were unblinded as well. |
Probably no;
Reason: Nine patients were lost to follow-up in the GRV monitoring group. |
Probably yes;
Reason: no study protocol available, but the published study included all planned/expected outcomes |
Definitely yes;
Reason: No other problems noted |
Some concerns (all outcomes except mortality)
Lack of details on concealment of allocation, lack of blinding, frequent loss to follow-up. |
|
Reignier 2013 |
Definitely yes;
Reason: Randomization by an external computer-generated, interactive, web-response system |
Definitely yes;
Reason: Allocation using an external computer-generated, interactive, web-response system |
Probably no;
Blinding of patients and health care providers could not be performed. Outcome assessors were blinded. |
Probably yes;
Reason: Data were analysed according to the intention-to-treat principle |
Definitely yes;
Reason: This study was registered in ClinicalTrials.gov (identifier: NCT01137487). Published reports included all expected outcomes. |
Definitely yes;
Reason: No other problems noted |
Some concerns (all outcomes except mortality)
Lack of blinding |
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Prest, 2021 |
Unlikely Note: patients whose residuals were checked according to the new protocol were matched to patients who were treated according to the preceding protocol |
Unclear Note: The length of follow-up is not reported and may differ between groups |
Unlikely Note: Outcomes are well-defined and measured adequately |
Unlikely Note: results were adjusted for prognostic factors |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Koekkoek 2017 |
Geen origineel artikel: narrative review |
|
Reintam Blaser 2015 |
Niet conform PICO; verkeerde vergelijking |
|
Elke 2015 |
Geen origineel artikel: narrative review |
|
Pham 2019 |
Niet conform PICO; verkeerde populatie |
|
Bruen 2020 |
Niet conform PICO; a priori gedefinieerde uitkomstmaten ontbreken |
|
Wang 2019 |
Voldoet niet aan selectiecriteria; SR van zowel RCTs als observationele studies |
|
Gungabissoon 2015 |
Niet conform PICO; verkeerde vergelijking |
|
Ikram 2016 |
Geen origineel artikel: narrative review |
|
Jordan 2020 |
Geen origineel artikel: narrative review |
|
Bartlett Ellis 2015 |
Niet conform PICO; verkeerde vergelijking |
|
Heyland 2020 |
Niet conform PICO, a priori gedefinieerde uitkomstmaten ontbreken |
|
Gately 2015 |
Niet conform PICO; verkeerde populatie |
|
Padar 2019 |
Niet conform PICO; verkeerde vergelijking |
|
Ritter 2019 |
Niet conform PICO; verkeerde vergelijking |
|
Arabi 2017 |
Geen origineel artikel: narrative review |
|
Guo 2015 |
Niet conform PICO; verkeerde vergelijking |
|
Metheny 2021 |
Geen origineel artikel: narrative review |
|
Allen 2013 |
Geen origineel artikel: narrative review |
|
Lew 2021 |
Niet conform PICO; verkeerde vergelijking |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-03-2024
Beoordeeld op geldigheid : 05-03-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de
samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die gevoed worden op de intensive care.
Werkgroep
dr. R. (Robert) Tepaske, intensivist, (voorzitter) NVIC
Prof. dr. A.R.H. (Arthur) van Zanten, intensivist, NVIC
dr. M.C.G. (Marcel) van de Poll, intensivist, NVIC
drs. B. (Ben) van der Hoven, internist, NIV
drs. E.J. (Lisa) Mijzen, anesthesioloog-intensivist, NVA
dr. F.J. (Jeannette) Schoonderbeek, chirurg-intensivist, NVvH
L. (Lea) van Duijvenbode - den Dekker, MSc, intensive care verpleegkundige, V&VN Intensive Care
M. (Manon) Mensink, diëtist, NVD
Ir. S. (Suzanne) ten Dam, diëtist, NVD
I. (Idske) Dotinga, ervaringsdeskundige, FCIC/IC Connect
Klankbordgroep
Mevr. E.R. (Elske) van Liere, logopedist, NVLF
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Actie |
|
* Voorzitter werkgroep Tepaske |
Anesthesioloog-Intensivist Begeleider Nurse practitioners profielen circulation & ventilation apotheek |
Allen onbezoldigd:
|
geen |
geen |
geen |
geen |
Eenmalig vergoeding voor deelname aan masterclass 'meten van metabolisme' van Hamilton, Zwitserland |
Geen actie vereist. |
|
Van Zanten |
lnternist-intensivist |
Onbetaald: |
Geen aandelen, opties, patenten of producten |
Echtgenote leidt Congres- en Organisatiebureau Interactie dat voor vele wetenschappelijke |
Precise trial (MUMC+), MC RCT, ZonMW/KCE NL/Belgie. studie naar hoog-eiwit vs. normaal eiwit voor |
richtlijnmaker van ESPEN richtlijn |
geen |
Besproken tijdens werkgroepvergadering. We verwachten geen adviezen te geven over individuele producten (en mogelijk dus bepaalde fabrikanten). Zodra er wel modules worden uitgewerkt waarin specifieke aanbevelingen en / of adviezen worden gegeven t.a.v. bepaalde producten zal dit worden gedaan door andere werkgroepleden. Dhr. van Zanten zal dan niet participeren als trekker en bij het opstellen van aanbevelingen. |
|
Mensink |
Diëtist Rijnstate Arnhem |
geen |
geen |
geen |
geen |
geen |
geen |
Geen actie vereist. |
|
Schoonderbeek |
Chirurg-intensivist staflid Intensive Care |
medisch adviseur, freelance |
nvt |
nvt |
nvt |
nvt |
nvt |
Mevr. Schoonderbeek werkt als freelance medisch adviseur voor Veduma in Zaltbommel. Ze adviseert voornamelijk in letselschade zaken (na aanrijdingen e.d.). Dit heeft nooit iets met voeding te maken. Waardoor geen restricties hoeven worden opgelegd. |
|
Van Duijvenbode-Den Dekker |
Intensive care verpleegkundige - Amphia ziekenhuis Breda |
Visitatie commissie NVIC via V&VN IC |
nvt |
nvt |
nvt |
nvt |
nvt |
Geen actie vereist. |
|
Mijzen |
Anesthesioloog- Intensivist Beatrix ziekenhuis Gorinchem |
FCCS- instructeur, betaald Bestuurslid sectie IC-NVA, onbetaald. |
nvt |
nvt |
nvt |
nvt |
nvt |
Geen actie vereist. |
|
Dotinga |
Functienaam: Trainee beleid en management in zorg en welzijn |
nvt |
nvt |
nvt |
nvt |
nvt |
|
Geen actie vereist. |
|
van de Poll |
Chirurg-intensivist, Staflid Maastricht UMC |
geen |
geen |
geen |
Contractant:ZONMW (Doelmatigheid): INCEPTION trial (multicenter RCT naar ECPR bij OHCA), ZONMW/KCE (BeNeFIT) PRECISe trial (multicenter RCT naar hoog vs normaal eiwit in enterale voeding bij IC patienten), Fresenius-kabi: traceronderzoek naar glutaminemetabolisme in sepsis, Cytosorb CYTATION trial (single center RCT naar gebruik van cytosorb bij vasoplegie), Getinge: co-financiering INCEPTION trial, Nutricia:co-financiering (in-kind) PRECISe trial, NUTRICIA research foundation/Nestle ESICM research grant: single center RCT naar elementaire voeding bij diarree. Consultancy Bayer R&D (data based algorithm development in ARDS) |
geen |
geen |
Besproken tijdens werkgroepvergadering. We verwachten geen adviezen te geven over individuele producten (en mogelijk dus bepaalde fabrikanten). Zodra er wel modules worden uitgewerkt waarin specifieke aanbevelingen en / of adviezen worden gegeven t.a.v. bepaalde producten zal dit worden gedaan door andere werkgroepleden. Dhr. van der Poll zal dan niet participeren als trekker en bij het opstellen van aanbevelingen. |
|
van der Hoven |
Internist-intensivist, staflid IC Volwassenen, Erasmus MC te Rotterdam |
geen |
geen |
geen |
geen |
geen |
geen |
Geen actie vereist. |
|
ten Dam |
Diëtist-onderzoeker OPRAH studie, Amsterdam UMC |
Bestuurslid NVO (Nederlandse Voedingsteam Overleg), onbetaald. Docent Focus op Voeding, VBNU, betaald, Docent Master Health Sciences, VU, onbetaald.
|
geen |
geen |
OPRAH_CT studie; RCT effect sarcopenie op fysiek functioneren. Subsidie AMS. OPRAH_PRO studie; haalbaarheidsstudie OPRAH RCT. Subsidie CCA. |
geen |
geen |
Geen actie vereist. |
|
van Liere |
Logopedist, Adrz |
nvt |
Logopedist in dienst van ziekenhuis, o.a. ICU |
nvt |
nvt |
Nvt |
nvt |
Geen actie vereist. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van FCIC/IC Connect voor de schriftelijke knelpunteninventarisatie, en afvaardiging van FCIC/IC Connect in de werkgroep. Het verslag van de schriftelijke knelpunteninventarisatie [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan FCIC/IC Connect en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Maagretentie routinematig meten |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en/of het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die voeding op de intensive care krijgen. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden daarom meegewogen. Voorbeelden zijn: Aanvullende argumenten uit de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’. Deze overwegingen kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag. Zij zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd onder alle mogelijke omstandigheden en voor elke individuele patiënt van toepassing zijn.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: Alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur) zijn in de overwegingen meegenomen. Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Embase
|
No. |
Query |
Results |
|
#22 |
#19 OR #20 OR #21 |
407 |
|
#21 |
#13 AND #18 NOT (#17 OR #19 OR #20) = Observationeel voor mei 2021 |
230 |
|
#20 |
#12 AND #18 NOT (#17 OR #19) = RCT voor mei 2021 |
113 |
|
#19 |
#11 AND #18 NOT #17 = SR voor mei 2021 |
64 |
|
#18 |
(#7 AND #9 OR (#8 AND #9)) AND ([english]/lim OR [dutch]/lim) AND [2015-2021]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
662 |
|
#17 |
#14 OR #15 OR #16 = studies vanaf mei 2021 |
84 |
|
#16 |
#10 AND #13 NOT (#14 OR #15) |
48 |
|
#15 |
#10 AND #12 NOT #14 |
22 |
|
#14 |
#10 AND #11 |
14 |
|
#13 |
'controlled study'/de OR 'pretest posttest design'/exp OR 'pretest posttest control group design'/exp OR 'controlled clinical trial'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 study):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR 'single blind procedure'/exp OR 'triple blind procedure'/exp OR 'double blind procedure'/exp OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi experimental study'/de OR 'quasi-experiment*':ti,ab,kw OR 'crossover procedure'/de OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'control group'/de OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/exp OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/exp OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) OR versus:ti OR vs:ti OR compar*:ti OR 'comparative study'/exp OR ((compar* NEAR/1 study):ti,ab,kw) OR 'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
14274573 |
|
#12 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1836063 |
|
#11 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
771139 |
|
#10 |
(#7 AND #9 OR (#8 AND #9)) AND ([english]/lim OR [dutch]/lim) AND [1-5-2021]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
106 |
|
#9 |
'residual volume'/exp/mj OR (((gastric OR gastro* OR stomach) NEAR/3 (residual OR residue OR volume OR capacit*)):ti,ab,kw) OR grv:ti,ab,kw OR 'stomach emptying'/exp/mj OR (((gastric OR gastro* OR stomach) NEAR/3 (emptying OR evacuation)):ti,ab,kw) |
27246 |
|
#8 |
'enteric feeding'/exp/mj OR 'stomach tube'/exp/mj OR 'nasogastric tube'/exp/mj OR 'nose feeding'/exp/mj OR 'tube feeding'/exp/mj OR (((stomach OR gastric OR gastro* OR intragastric OR nasogastr* OR 'naso‐gasstric' OR nasal OR nose OR duoden* OR nasoduoden* OR jejun* OR nasojejun* OR esophag* OR oesophag* OR 'fine bore' OR ryles OR 'pej' OR 'peg' OR bowel* OR intestine* OR intestinal OR gastrointestinal OR postpylor* OR 'post‐pylor*' OR transpylor* OR 'trans‐pylor*' OR nasoenter* OR gavage OR enteral OR enteric) NEAR/3 (feed* OR fed OR feeding OR tube* OR intubat* OR tubal OR nutrition* OR immunonutrition* OR nutrient* OR micronutrient*)):ti,ab,kw) OR (((feeding OR fed OR feed) NEAR/3 (tube* OR intubat* OR tubal)):ti,ab,kw) OR 'g‐tube*':ti,ab,kw OR 'ng‐tube*':ti,ab,kw OR 'j‐tube*':ti,ab,kw OR 'gj‐tube*':ti,ab,kw OR 'nj‐tube*':ti,ab,kw |
86175 |
|
#7 |
'critically ill patient'/exp OR 'intensive care'/exp OR 'intensive care unit'/exp OR 'critical illness'/exp OR (((intensive OR critical*) NEAR/3 (care OR patient* OR ill*)):ti,ab,kw) OR icu:ti,ab,kw |
1086386 |
Ovid/Medline
|
# |
Searches |
Results |
|
17 |
14 or 15 or 16 |
320 |
|
16 |
11 not 13 = Observationeel voor mei 2021 |
175 |
|
15 |
10 not 13 = RCT voor mei 2021 |
94 |
|
14 |
9 not 13 = SR voor mei 2021 |
51 |
|
13 |
limit 4 to dt=20210501-20220101 = studies vanaf mei 2021 |
51 |
|
12 |
9 or 10 or 11 |
354 |
|
11 |
(5 and 8) not (9 or 10) |
191 |
|
10 |
(5 and 7) not 9 |
106 |
|
9 |
5 and 6 |
57 |
|
8 |
controlled clinical trial/ or Control groups/ or Cross-Over Studies/ or Double-Blind Method/ or Single-Blind Method/ or Controlled Before-After Studies/ or (((control or controlled) adj6 trial) or ((control or controlled) adj6 study) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or crossover or "cross over" or "parallel group*" or "factorial trial").ti,ab,kf. or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or (phase adj5 (study or trial)).ti,ab,kf. or (Case-Control Studies/ or Matched-Pair Analysis/ or ((case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*))).ti,ab,kf. or (propensity adj6 (scor* or match*)).ti,ab,kf.) or ((exp cohort studies/ or observational study/ or cross-sectional studies/ or multicenter study/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or cross sectional* or cross?ectional* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) or (versus or vs or compar*).ti. or Comparative study/ or (compar* adj study).ti,ab,kf. or historically controlled study/ or Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort*.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
6599605 |
|
7 |
exp randomized controlled trial/ or random*.ti,ab,kf. or ((pragmatic or practical) adj clinical trial*).ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. or rct.ti,ab,kf. |
1398298 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
550521 |
|
5 |
limit 4 to (english language and yr="2015 -Current") |
544 |
|
4 |
(1 and 3) or (2 and 3) |
2257 |
|
3 |
(((gastric or gastro* or stomach) adj3 (residual or residue or volume or capacit*)) or grv).ti,ab,kf. or exp Gastric Emptying/ or ((gastric or gastro* or stomach) adj3 (emptying or evacuation)).ti,ab,kf. |
20051 |
|
2 |
exp enteral nutrition/ or exp Intubation, Gastrointestinal/ or ((stomach or gastric or gastro* or intragastric or nasogastr* or naso gasstric or nasal or nose or duoden* or nasoduoden* or jejun* or nasojejun* or esophag* or oesophag* or fine bore or Ryles or "PEJ" or "PEG" or bowel* or intestine* or intestinal or gastrointestinal or postpylor* or post pylor* or transpylor* or trans pylor* or nasoenter* or gavage or enteral or enteric) adj3 (feed* or fed or feeding or tube* or intubat* or tubal or nutrition* or immunonutrition* or nutrient* or micronutrient*)).ti,ab,kf. or ((feeding or fed or feed) adj3 (tube* or intubat* or tubal)).ti,ab,kf. or (g tube* or ng tube* or j tube* or gj tube* or nj tube*).ti,ab,kf. |
67198 |
|
1 |
exp Critical Care/ or exp Critical Illness/ or exp Intensive Care Units/ or ((intensive or critical*) adj3 (care or patient* or ill*)).ti,ab,kf. or ICU.ti,ab,kf. |
313352 |