Primaire preventie van waterpokken
Uitgangsvraag
Bij welke risicogroepen geeft het in Nederland geregistreerde vaccin tegen waterpokken een goede bescherming tegen waterpokken?
Aanbeveling
Bied vaccinatie tegen waterpokken aan (met monovalent levend verzwakt waterpokken vaccin, momenteel in Nederland Provarivax):
- VZV seronegatieve volwassenen met een beroep binnen de pediatrische sector of verloskundige sector, of die beroepshalve intensief contact hebben met ernstig immuungecompromitteerde patiënten.
- Seronegatieve vrouwen met een kinderwens.
- Varicella IgG-negatieve gezinsleden van varicella IgG-negatieve kinderen met verhoogd risico op ernstig ziektebeloop wegens chemotherapie behandeling.
Voor dosering: zie Farmacotherapeutisch Kompas (https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/v/varicella_zostervaccin__provarivax_) of het Kinderformularium (https://www.kinderformularium.nl)
Overweeg waterpokkenvaccinatie bij de volgende patiëntengroepen:
- Seronegatieve personen (meestal kinderen) die een immuunsuppressieve behandeling zullen ondergaan waarbij voldoende tijd is om nog tot volledige vaccinatie te komen. Bijvoorbeeld personen op een wachtlijst voor hart-, lever- en niertransplantatie.
- Seronegatieve kinderen met leukemie, minimaal één jaar in volledige remissie.
- Kinderen minimaal 2 jaar na allogene stamceltransplantatie bij ongecompliceerd beloop.
- HIV-positieve kinderen die nog seronegatief zijn en een CD4+ T-cel- getal > 0,40 x 109/l (CD4+ T-cel- getal > 0,20 x 109/l individueel afwegen) en een onderdrukte virale lading.
- HIV positieve volwassenen die seronegatief zijn en een CD4+ T-cel- getal > 0,20 x 109/l en een onderdrukte virale lading.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
1. Effectiviteit van waterpokkenvaccinatie in het algemeen
Het waterpokkenvaccin dat momenteel gebruikt wordt is sinds 2004 in Nederland geregistreerd. In het kader van de registratie zijn de veiligheid en effectiviteit beoordeeld door het College ter Beoordeling van Geneesmiddelen op basis van het registratiedossier aangeleverd door de producent. Hier zijn ook niet openbare trials in opgenomen. Daarnaast wordt het vaccin sinds 1996 in de Verenigde Staten op grote schaal toegepast, aanvankelijk in een 1-dosis-schema, vanaf 2006 in een 2-doses-schema.
Het waterpokkenvaccin is een veilig en effectief vaccin dat op indicatie kan worden toegepast bij gezonde kinderen.
De Gezondheidsraad zal naar verwachting in 2020 advies uitbrengen over opname van waterpokkenvaccinatie in het Rijksvaccinatieprogramma. Uit volksgezondheidsperspectief moet bij grootschalige vaccinatie ook rekening worden gehouden met het effect op de epidemiologie in de niet gevaccineerde groep. Door grootschalige vaccinatie zal waterpokken onder niet gevaccineerden gemiddeld op latere leeftijd optreden met een grotere kans op complicaties.
Hoewel er nauwelijks systematisch onderzoek is verricht naar de effectiviteit van waterpokkenvaccinatie bij gezonde seronegatieve volwassenen zijn er theoretisch geen redenen om aan te nemen dat de veiligheid en effectiviteit van waterpokkenvaccinatie bij hen anders is dan bij kinderen. Ook bij gezonde niet immuuungecompromitteerde seronegatieve volwassenen kan waterpokkenvaccinatie worden toegepast. Bij zwangere vrouwen is waterpokkenvaccinatie echter gecontra-indiceerd omdat het een levend vaccin betreft dat bij de foetus tot een infectie met het vaccinvirus zou kunnen leiden.
2. Effectiviteit vaccin tegen waterpokken bij immuungecompromitteerde kinderen
Het waterpokkenvaccin is een levend verzwakt vaccin dat in principe gecontra-indiceerd is bij immuungecompromitteerde patiënten. Hierdoor is onderzoek naar de effectiviteit van het vaccin alleen mogelijk als de veiligheid van de patiënten in de onderzoekspopulatie gewaarborgd is. Dit betekent dat er specifieke eisen worden gesteld aan de immuunstatus van de patiënten die in het onderzoek geïncludeerd worden. Deze eisen gelden ook voor de toepassing van het vaccin in de klinische praktijk.
In de studie van Croce (2017) werd de veiligheid van verschillende levend verzwakte vaccins onderzocht bij kinderen met immuungemedieerde ontstekingsziektes, orgaantransplantatie op immuunsuppressieve therapie en bij patiënten na een beenmergtransplantatie. Van de 202 geïncludeerde patiënten in de groep met immuungemedieerde ontstekingsziektes die varicella vaccinatie ontvingen, ontwikkelden er 12 (6%) waterpokken of herpes zoster. In de orgaantransplantatie groep ontwikkelden 7 van de 192 (3,6%) waterpokken en bij patiënten na een beenmergtransplantatie 2 van de 38 (5,3%). De primaire data van de geïncludeerde studies zijn echter niet herleidbaar.
Er zijn geen systematische reviews of RCT’s onder kinderen die beenmergtransplantatie ondergaan. De case-seriestudie van Aoki (2016) laat zien dat de seropositiviteit van kinderen die hematopoëtische stamceltransplantatie hebben ondergaan die binnen 24 maanden na transplantatie worden gevaccineerd niet verschilt van kinderen die na 24 maanden na transplantatie worden gevaccineerd (Aoki, 2016).
Purswani (2016) deed een observationele studie bij kinderen met perinatale (blootgestelde) HIV (PHIV) naar waterpokkenantilichamen. Een humorale immuunrespons op het waterpokkenvaccin werd het best bereikt wanneer kinderen met PHIV hun eerste dosis kregen ≥ 3 maanden na de start van de cART en het best behouden indien de serie met 2 doses werd voltooid gedurende langdurig gebruik van cART.
Het waterpokkenvaccin is een levend verzwakt vaccin dat in principe gecontra-indiceerd is bij immuungecompromitteerde patiënten. Indien immuungecompromitteerde patiënten toch gevaccineerd worden dient de veiligheid van de patiënt voorop te staan en wordt de indicatie individueel bepaald (zie ook de overzichtstabel bij de aanverwante producten).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het waterpokkenvaccin wordt onder meer gebruikt voor vaccinatie van gezonde huisgenoten en verzorgenden van immuungecompromitteerde kinderen. Deze kinderen kunnen niet zelf gevaccineerd worden en hebben een sterk verhoogd risico op ernstig verloop en/of complicaties van waterpokken. Hier geldt dat zelfs als de effectiviteit van het vaccin matig zou zijn (de kans op) het voorkomen van ernstige ziekte bij het immuungecompromitteerde kind opweegt tegen de mogelijke bijwerkingen bij de gevaccineerde. Bovendien heeft de gevaccineerde persoon er zelf ook baat bij om geen waterpokken te krijgen. Indien voldoende tijd, kunnen personen die in de toekomst immuunsuppressieve behandeling ondergaan gevaccineerd worden tegen waterpokken. Het waterpokkenvaccin kan ook gebruikt worden bij VZV seronegatieve vrouwen met een kinderwens. Zwangere vrouwen hebben een verhoogd risico op een ernstig beloop van waterpokken en waterpokken tijdens de zwangerschap kan een ernstig ziektebeeld veroorzaken bij het ongeboren kind (CVS) of pasgeborene (perinatale waterpokken). VZV seronegatieve volwassenen die beroepshalve een verhoogd risico hebben op het oplopen van waterpokken (pediatrische sector) en werken met patiënten die een verhoogd risico hebben op een ernstig beloop van waterpokken (pediatrische sector, verloskundige sector, immuungecompromitteerde patiënten) kunnen gevaccineerd worden met het waterpokkenvaccin om zo zichzelf en de patiënt te beschermen tegen waterpokken.
Onderbouwing
Achtergrond
Het waterpokkenvaccin zoals wij dat nu kennen werd in de vroege jaren zeventig van de vorige eeuw ontwikkeld in Japan (Takahashi, 1974). Het vaccin was ontwikkeld vanuit blaasjesvocht van een waterpokkenpatiënt dat enige malen was gepasseerd op humane diploïde cellen. In principe is het huidige waterpokkenvaccin nog hetzelfde: wel heeft het minimaal 30 passages ondergaan in MRC-5 cellen (humane longfibroblasten) en is het vrij van conserveermiddelen. De minimale sterkte bedraagt 2700 PFU/dosis van 0,5 ml. De FDA registreerde dit VZV-vaccin in 1995, maar het wordt in Nederland (registratie maart 2004) nog weinig toegepast (in 2018 werden door de apotheken ruim 1400 vaccins afgeleverd (bron: Stichting Farmaceutische Kengetallen (SFK)).
In Nederland is waterpokkenvaccinatie niet opgenomen in het Rijksvaccinatieprogramma. Naar verwachting zal de Gezondheidsraad in 2020 advies uitbrengen over eventuele opname van waterpokkenvaccinatie in het Rijksvaccinatieprogramma. De werkgroep vindt dat de Gezondheidsraad moet oordelen over de wenselijkheid van algemene vaccinatie en acht deze richtlijn niet de plaats voor een uitspraak hierover. Wel zal zij een advies geven voor personen of groepen met een verhoogd risico op een ernstig verlopende waterpokkeninfectie of gezinscontacten/verzorgenden van personen met een verhoogd risico op ernstig verlopende waterpokkeninfectie.
Conclusies / Summary of Findings
1. Effectiviteit vaccin tegen waterpokken in het algemeen
|
Hoog GRADE |
Een enkele dosis waterpokkenvaccin resulteert in een grote vermindering van alle waterpokken (VE 81%) en matige/ernstige waterpokken (VE 98%). Een tweede dosis leidt tot grotere bescherming tegen alle waterpokken (VE 92%).
Bronnen: (Yin, 2018; Marin, 2016) |
2. Effectiviteit vaccin tegen waterpokken bij immuungecompromitteerde kinderen
|
Zeer laag GRADE |
We zijn onzeker over het effect van waterpokkenvaccinatie bij kinderen die een orgaantransplantatie hebben ondergaan.
Bronnen: (Eckerle, 2013; Posfay-Barbe, 2012) |
|
Zeer laag GRADE |
We zijn onzeker over het effect van waterpokkenvaccinatie bij kinderen met auto-immuunziekten die immuunsuppressieve therapie ondergaan.
Bronnen: (Groot, 2015; Speth, 2018) |
|
Laag GRADE |
Waterpokkenvaccinatie lijkt effectief bij HIV-geïnfecteerde kinderen om waterpokken te voorkomen.
Bronnen: (Son, 2010) |
Samenvatting literatuur
1. Effectiviteit vaccin tegen waterpokken in het algemeen
Beschrijving studies
Marin (2016) onderzocht in een systematische review de effectiviteit van het waterpokkenvaccin bij kinderen. Er werd systematisch gezocht in Medline, Embase, Cochrane libraries en CINAHL tot december 2014. Alleen origineel onderzoek dat dosis-specifiek de effectiviteit van waterpokkenvaccinatie rapporteerde en immuuncompetente kinderen onderzocht, werd geïncludeerd. Studies die vaccineffectiviteit (VE) voor postexpositieprofylaxe rapporteerden werden geëxcludeerd. In totaal werden 42 studies geïncludeerd. De gepoolde VE werd berekend voor één- en twee-dosis waterpokkenvaccinatie. VE is het percentage reductie van de ziekte, in dit geval waterpokken, in een groep gevaccineerde personen vergeleken met een ongevaccineerde groep. VE werd berekend als 1 – relatief risico (RR) of odds ratio (OR), afhankelijk van het studiedesign.
Yin (2018) onderzocht in een systematische review de effectiviteit, immunogeniciteit en veiligheid van één- versus twee-dosis waterpokkenvaccinatie. Er werd systematisch gezocht in PubMed, Embase, Cochrane library, China National Knowledge Infrastructure (CNKI) en WANFANG Data databases tot juni 2017. Alleen RCT’s, cohortstudies, case–controlstudies, en zelfgecontroleerde studies die 2-dosis vaccinatie met 1-dosis vaccinatie vergeleken bij gezonde kinderen werden geïncludeerd. Yin analyseerde de verschillende onderzoeksdesigns apart. De uitkomstmaat werd gedefinieerd als incrementele VE.
Resultaten
Waterpokkeninfectie
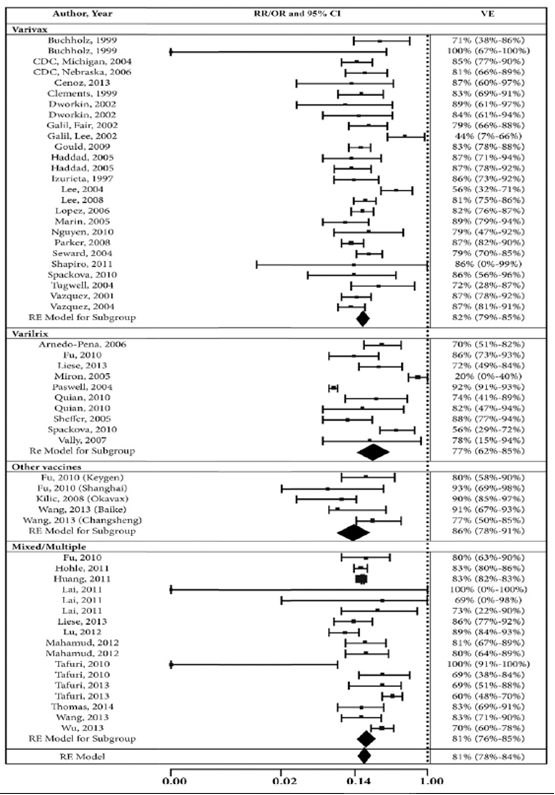
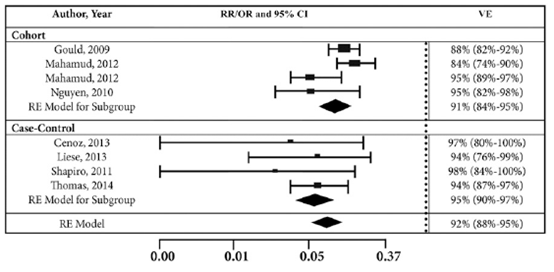
Marin (2016) maakte voor de uitkomstmaat waterpokken onderscheid in 2 categorieën voor de ernst van de ziekte: ‘waterpokken van welke ernst dan ook’ (alle waterpokken) en ‘matige/ernstige waterpokken’. De gepoolde 1-dosis VE voor preventie van alle waterpokken was 81% (95% BI 78-84%) (figuur 1). De gepoolde 1-dosis VE voor preventie van matig/ernstige waterpokken was 98% (95% BI 97 tot 99%). De gepoolde 2-dosis VE voor preventie alle waterpokken was 92% (95% BI 88 tot 95%) (voor matig/ernstige waterpokken niet berekend vanwege gebrek aan studies). Dat wil zeggen dat een eenmalige dosis waterpokkenvaccin 81% van alle waterpokken voorkomt en 98% van de matige/ernstige waterpokken. Bij toevoeging van een tweede dosis verbetert de bescherming tegen alle waterpokken tot 92%.
Figuur 1 Vaccineffectiviteit van 1-dosis waterpokkenvaccinatie voor preventie van alle waterpokken (Marin, 2016)
Figuur 2 Vaccineffectiviteit van 2-dosis waterpokkenvaccinatie voor preventie van alle waterpokken (Marin, 2016)
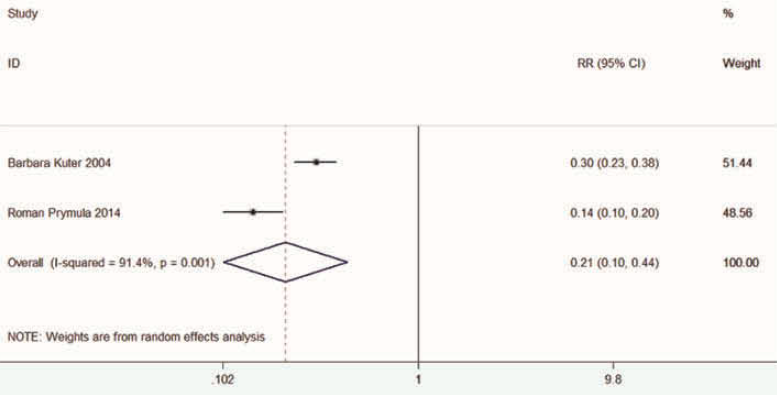
Yin (2018) includeerde 2 RCT’s met in totaal 6758 personen die de VE van één- en twee-dosis vaccinatie direct vergeleken (Kuter, 2004; Prymula, 2014). Het gepoolde RR (random effect model) voor waterpokkeninfectie van één- versus twee-dosisvaccinatie was 0,21 (95% BI 0,10 tot 0,44) (figuur 3). Dat komt neer op een incrementele vaccineffectiviteit voor 2-dosis waterpokkenvaccinatie van 79% (95% BI 56 tot 90%). Dit is echter gebaseerd op 2 enkele RCT’s, en er was sprake van grote heterogeniteit tussen deze studies (I2 91%).
Figuur 3 Vaccin effectiviteit 2-dosis versus 1-dosis waterpokkenvaccinatie in RCT’s (Yin, 2018)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat waterpokken voor de algemene effectiviteit van waterpokken vaccin is niet verlaagd.
2. Effectiviteit vaccin tegen waterpokken bij immuungecompromitteerde kinderen
Beschrijving studies
Kinderen die een orgaantransplantatie hebben ondergaan
Eckerle (2013) voerde een systematische review uit naar de serologische respons van ontvangers van orgaantransplantatie voor verschillende posttransplantatievaccinaties waaronder waterpokkenvaccinatie. In totaal werden 72 studies geïncludeerd, waarvan 6 studies gegevens over de serologische respons van waterpokken vaccinatie bij pediatrische patiënten bevatten. Vijf studies waren prospectief (Zamora, 1994; Kano, 2002; Chaves, 2005; Weinberg, 2006; Shinjoh, 2008) en één studie retrospectief (Khan, 2006). In deze studies werden in totaal 87 patiënten geïncludeerd. De uitkomst was kortetermijnrespons, die werd gedefinieerd als de humorale (serologische) vaccinrespons gemeten als seroconversiegraad wanneer deze informatie beschikbaar was, of als serologische respons gedefinieerd als “beschermend” door de auteurs twee weken tot drie maanden na vaccinatie.
Posfay-Barbe (2012) voerde een observationele prospectieve studie uit naar de VZV-immuniteit bij pediatrische orthotope levertransplantatie ontvangers, en onderzocht de vaccin veiligheid en B- en T-celimmunogeniciteit bij seronegatieve patiënten. In totaal werden 77 levertransplantatiepatiënten geïncludeerd (mediane leeftijd 7,8 jaar; 49% jongen), van wie 39 seronegatief. Van hen waren er 36 geschikt voor immunisatie en zij werden gevaccineerd tegen VZV.
Kinderen met auto-immuunziekten met immuunsuppressieve therapie
Groot (2015) verrichtte een systematische review naar de veiligheid en immunogeniciteit van vaccinatie bij pediatrische patiënten met reumatische ziekten. Dit was een update van een eerdere review uit 2011 van Heijstee in het kader van de European League Against Rheumatism (EULAR) aanbevelingen. Er werd 1 nieuwe studie (Barbosa, 2012) geïncludeerd in de nieuwe search, bovenop 2 niet-gerandomiseerde studies die al uit de oude search kwamen (Lu, 2010; Pileggi, 2010). Deze RCT werd uitgevoerd onder 82 kinderen, waarbij 28 van de 54 kinderen met systemische lupus erythematodes gevaccineerd werden en 28 gezonde kinderen als controle werden meegenomen.
Een recente prospectieve studie van Speth (2018) onderzocht de veiligheid van VZV-vaccinatie bij kinderen met reumatische ziekten waarbij een pre-vaccinatielijst werd gebruikt die bestond uit items over medische geschiedenis, lichamelijk onderzoek, contra-indicaties die het niveau van immunosuppressie classificeren en basis laboratoriumonderzoeken. Alle kinderen overschreden de afkappunten en hadden voldoende immunologische reactiviteit voor het doel van de studie, dus werd VZV-vaccinatie aangeboden. Er werd een vergelijking gemaakt tussen een groep lage-intensiteit immunosuppressie en een groep hoge-intensiteit immunosuppressie. Uitkomstmaten waren immunogeniciteit, effectiviteit en veiligheid.
Kinderen met HIV
Son (2010) onderzocht de effectiviteit van waterpokkenvaccin bij HIV-geïnfecteerde kinderen. Er werden 164 kinderen geïncludeerd die perinataal HIV-geïnfecteerd waren. De incidentie van waterpokken werd berekend van de kinderen uit de periode voordat HIV-geïnfecteerde kinderen werden gevaccineerd (1989-1998) en de periode dat deze kinderen wel werden gevaccineerd (1999-2007).
Resultaten
Kinderen die een orgaantransplantatie ondergaan
In de zes geïncludeerde studies in Eckerle (2013) met in totaal 87 kinderen varieerde de kortetermijnrespons bij kinderen die een orgaantransplantatie ondergaan na post-transplantatievaccinatie tussen 64% en 83%, met een overall gemiddelde van 73% (95% BI 64 tot 83%). Hierbij werd gerapporteerd dat er sprake was van lage heterogeniteit (I2 0%). Dit waren echter studies met kleine aantallen kinderen (n varieerde tussen 6 en 31).
In de observationele studie van Posfay-Barbe (2012) bereikten alle gevaccineerde kinderen seroprotectieve titers en 31 van de 32 kinderen (97%) bleven seroprotectief na een mediane follow-up van 1,7 jaar. Er werden geen doorbraak VZV-gerelateerde ziekten gerapporteerd na een mediane follow-up periode van 4,2 jaar.
Kinderen met auto-immuunziekten met immuunsuppressieve therapie
In de systematische review van Groot (2015) werd het optreden van waterpokken niet als uitkomstmaat gerapporteerd. Van de 54 geïncludeerde kinderen met systemische lupus erythematodes was 100% seroprotectief voorafgaand aan vaccinatie. De frequentie van opvlammingen (flares) was vergelijkbaar in de gevaccineerde en ongevaccineerde groep.
In de prospectieve studie van Speth (2018) werden alle deelnemende kinderen met reumatische ziekten gevaccineerd omdat ze voldeden aan de eisen voor vaccinatie uit de pre-vaccinatielijst. Er waren geen verschillen in VZV-IgG-niveaus tussen de laag-intensiteit en hoog-intensiteit groepen. In de totale groep hadden 21 van de 23 patiënten (91%) een positieve vaccinatie respons. Er waren geen doorbraak waterpokkengevallen na een mediane follow-up van 3 jaar.
Kinderen met HIV
In de studie van Son (2010) werd de vaccineffectiviteit tegen waterpokken berekend door de incidentie in de groep ongevaccineerde kinderen (36.8/1000 personen-jaren) met de groep gevaccineerde kinderen (6,8/1000 personen-jaren) van de periode 1989 tot 1998 met elkaar te vergelijken. Twee van de 72 kinderen (3%) ontwikkelden doorbraakwaterpokken 3,9 en 4,7 jaar na de laatste immunisatie. De vaccineffectiviteit tegen waterpokken was 82% (95% BI 24 tot 99%; P = 0,01).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat waterpokken voor de effectiviteit van waterpokkenvaccin bij kinderen die een orgaantransplantatie ondergaan begint laag vanwege observationele studies, en is met 1 niveau verlaagd vanwege het lage aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat waterpokken voor de effectiviteit van waterpokkenvaccin bij kinderen met auto-immuunziekten met immuunsuppressieve therapie is met 3 niveaus verlaagd vanwege het risico op bias (beperkingen in de onderzoeksopzet (onduidelijke/beperkte blindering, en onduidelijke matching in case-controlstudies), extrapoleerbaarheid (bias ten gevolge van indirectheid) en het geringe aantal patiënten (imprecisie).
De bewijskracht voor de uitkomstmaat waterpokken voor de effectiviteit van waterpokkenvaccin bij kinderen met HIV komt op laag uit omdat het bewijs komt uit een observationele studie.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
1. Wat is de effectiviteit van het in Nederland geregistreerde vaccin tegen waterpokken bij gezonde seronegatieve volwassenen en kinderen??
P: gezonde volwassenen en kinderen zonder antistoffen tegen waterpokken;
I: VZV-vaccinatie met geregistreerd vaccin;
C: geen vaccinatie;
O: waterpokken;
2. Wat is de effectiviteit van het in Nederland geregistreerde vaccin tegen waterpokken bij immuungecompromitteerde kinderen?
P: immuungecompromitteerde kinderen;
I: VZV-vaccinatie met geregistreerd vaccin;
C: geen vaccinatie;
O: waterpokken, beschermende antistoffen.
Relevante uitkomstmaten
De werkgroep achtte waterpokken een voor de besluitvorming cruciale uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. De werkgroep definieerde vooraf geen klinisch (patiënt) relevant verschil voor waterpokken.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is in eerste instantie op 11 oktober 2018 met relevante zoektermen gezocht naar systematische reviews, gerandomiseerde trials, en overige design studies. De literatuurzoekactie leverde 528 treffers op. Besloten werd om voor de eerste zoekvraag twee recente systematische reviews te selecteren en de search opnieuw te doen alleen gericht op immuungecompromitteerde kinderen. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Deze aangepaste literatuurzoekactie leverde 179 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review (gezocht in tenminste twee databases met een objectieve en transparante zoekstrategie, data-extractie en methodologische beoordeling), gerandomiseerde trials of observationele studies die de effectiviteit van vaccinatie tegen waterpokken in een gezonde populatie of bij immuungecompromitteerde kinderen beschrijven. Op basis van titel en abstract werden 13 systematische reviews en RCT’s voor zoekvraag 2 voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 8 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 5 studies definitief geselecteerd voor zoekvraag 2.
Resultaten
In totaal zijn zeven onderzoeken opgenomen in de literatuuranalyse: Twee systematische reviews voor het beantwoorden van deelvraag 1 over de effectiviteit van het vaccin tegen waterpokken in het algemeen en twee systematische reviews en drie observationele studies bij deelvraag 2 voor de effectiviteit bij immuungecompromitteerde kinderen. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Aoki, T., Koh, K., Kawano, Y., Mori, M., Arakawa, Y., Kato, M., & Hanada, R. (2016). Safety of live attenuated high-titer varicella-zoster virus vaccine in pediatric allogeneic hematopoietic stem cell transplantation recipients. Biology of Blood and Marrow Transplantation, 22(4), 771-775.
- Asano, Y., Itakura, N., Hiroishi, Y., Hirose, S., Nagai, T., Ozaki, T., ... & Takahashi, M. (1985). Viremia is present in incubation period in nonimmunocompromised children with varicella. The Journal of pediatrics, 106(1), 69-71.
- Croce, E., Hatz, C., Jonker, E. F., Visser, L. G., Jaeger, V. K., & Bühler, S. (2017). Safety of live vaccinations on immunosuppressive therapy in patients with immune-mediated inflammatory diseases, solid organ transplantation or after bone-marrow transplantation–A systematic review of randomized trials, observational studies and case reports. Vaccine, 35(9), 1216-1226.
- Eckerle, I., Rosenberger, K. D., Zwahlen, M., & Junghanss, T. (2013). Serologic vaccination response after solid organ transplantation: a systematic review. PLoS One, 8(2), e56974.
- Gezondheidsraad (2007). De toekomst van het Rijksvaccinatieprogramma: naar een programma voor alle leeftijden. Den Haag: Gezondheidsraad, publicatienr. 2007/02.
- Groot, N., Heijstek, M. W., & Wulffraat, N. M. (2015). Vaccinations in paediatric rheumatology: an update on current developments. Current rheumatology reports, 17(7), 46.
- Johnson, C. E., Stancin, T., Fattlar, D., Rome, L. P., & Kumar, M. L. (1997). A long-term prospective study of varicella vaccine in healthy children. Pediatrics, 100(5), 761-766.
- Posfay‐Barbe, K. M., Pittet, L. F., Sottas, C., Grillet, S., Wildhaber, B. E., Rodriguez, M., ... & Siegrist, C. A. (2012). Varicella‐zoster immunization in pediatric liver transplant recipients: safe and immunogenic. American journal of transplantation, 12(11), 2974-2985.
- Purswani, M. U., Karalius, B., Yao, T. J., Schmid, D. S., Burchett, S. K., Siberry, G. K., ... & Lurie, R. H. (2015). Prevalence and persistence of varicella antibodies in previously immunized children and youth with perinatal HIV-1 infection. Clinical Infectious Diseases, 62(1), 106-114.
- Son, M., Shapiro, E. D., LaRussa, P., Neu, N., Michalik, D. E., Meglin, M., ... & Gershon, A. A. (2010). Effectiveness of varicella vaccine in children infected with HIV. The Journal of infectious diseases, 201(12), 1806-1810.
- Speth, F., Hinze, C. H., Andel, S., Mertens, T., & Haas, J. P. (2018). Varicella-zoster-virus vaccination in immunosuppressed children with rheumatic diseases using a pre-vaccination check list. Pediatric Rheumatology, 16(1), 15.
- Takahashi, M., Otsuka, T., Okuno, Y., Asano, Y., Yazaki, T., & Isomura, S. (1974). Live vaccine used to prevent the spread of varicella in children in hospital. The Lancet, 304(7892), 1288-1290.
- White, C. J., Kuter, B. J., Hildebrand, C. S., Isganitis, K. L., Matthews, H., Calandra, G. B., ... & Gerety, R. J. (1991). Varicella vaccine (VARIVAX) in healthy children and adolescents: results from clinical trials, 1987 to 1989. Pediatrics, 87(5), 604-610.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Marin, 2016 |
SR and meta-analysis of retrospective (n=29) and prospective (n=1) cohort studies, matched case-control studies (n=10) and other design studies (n=2)
Literature search from 1995 up to December 2014.
Study characteristics of included studies can be found in the Supplementary material of the publication: http://pediatrics.aappublications.org/content/pediatrics/suppl/2016/02/14/peds.2015-3741.DCSupplemental/PEDS_20153741SupplementaryData.pdf |
Inclusion criteria SR: - original report on dose-specific varicella VE - population studied was immunocompetent children.
Exclusion criteria SR: - clinical trials - studies that reported VE for postexposure prophylaxis
42 studies included
Patient characteristics of included studies can be found in the Supplementary material of the publication. |
Varicella vaccine: Varivax (26 studies), Varilrix (10 studies), other vaccines (5 studies) and mixed/ multiple (17 studies)
|
No vaccination
|
Follow-up not reported
|
Defined as varicella of any severity (all)
Pooled effect 1-dose VE (random effects model): 81% [95% CI 78 to 84] (N=58) Heterogeneity (I2): 88%
Pooled effect 2-dose VE (random effects model): 92% [95% CI 88 to 95] (N=9)
Defined as moderate/ severe varicella.
Pooled effect 1-dose VE (random effects model): 98% [95% CI 97 to 99] (N=34) Heterogeneity (I2): 85%
|
VE = vaccine effectiveness
Brief description of author’s conclusion: One dose of varicella vaccine was moderately effective in preventing all varicella and highly effective in preventing moderate/severe varicella, with no differences by vaccine. The second dose adds improved protection against all varicella.
Level of evidence: 1. Varicella: VERY LOW Due to risk of bias (unclear matching in case-control studies, Failure to adequately control confounding and unclear follow-up) and inconsistency (large heterogeneity) |
|
Yin, 2018 |
SR and meta-analysis of RCTs (n=3), retrospective cohort studies (n=7), case-control studies (n=5) and self-control studies (n=7).
Literature search from 1995 up to June 2017.
Study design: RCT’s A: Ngai, 1996 B: Kuter, 2004 C: Prymula, 2014
Setting and Country: A: USA B: USA C: 10 EU countries
Source of funding: Not reported
Study characteristics of other included studies can be found in the publication. |
Inclusion criteria SR of studies reporting VE: - study outcome was defined as incidence of breakthrough varicella after 1-dose and 2-dose varicella vaccination and reported as relative risk (RR) or odds ratio (OR) - the population studied was immunocompetent children.
Exclusion criteria SR: Studies that were not clear or did not contain complete data.
22 studies included (3 RCT’s)
N, mean age A: 1606 patients, 11-55 months B: 2216 patients, 12 months-12yrs C: 4542 patients, 14.2±2.5 months
Sex not reported
Patient characteristics of other included studies can be found in the publication |
Varicella vaccine: Varivax (1 study, RCT)
MMRV: ProQuad (2 cohort studies), GlaxoSmithKline (2 cohort studies), Priorix-Tetra (3 cohort studies)
MMR+V: Varilrix (1 cohort study) |
NA |
End-point of follow-up:
A: not reported B: 10 year C: 3 year |
Varicella Defined as varicella infection
Effect measure: RR [95% CI]: B: 0.30 [0.23-0.38] C: 0.14 [0.10-0.20]
Pooled effect (random effects model): RR 0.21 [95% CI 0.10 to 0.44] favoring 2-doses vaccine Heterogeneity (I2): 91.4%
|
MMRV = combined measles–mumps–rubella–varicella MMR+V = combined measles–mumps–rubella plus varicella
Brief description of author’s conclusion: Two-dose varicella vaccination resulted in higher levels of immunogenicity and provided superior protection than 1-dose vaccination.
Level of evidence: 1. Varicella: LOW Due to risk of bias (lack of blinding) and inconsistency (no overlap of CI).
|
|
Groot, 2015 |
SR of RCTs, cohort and case-report studies
Literature search up to July 2014
A: Barbosa, 2012 B: Lu, 2010 C: Pileggi, 2010
Study design: A: RCT B: case series C: nonrandomized CT
Setting and Country: A: Barbosa, 2012 B: Lu, 2010 C: Pileggi
Source of funding: non-commercial
|
Inclusion criteria SR: not reported
Exclusion criteria SR: adults (≥18 years), non-rheumatic autoimmune diseases, malignancies, immunodeficiencies, transplantations, atopic diseases, animal studies, infections, vaccine development, phase I–III trials, in vitro studies, non-original papers, non-English papers
3 studies included for varicella
N A: 82 patients (54 JSLE patient, 26 HC) B: 6 IBD patients C: 43 patients (JLA, JDM, ARD, IBD and HC)
Age and sex not reported |
A: vaccinated B: 2anti-TNFα (infliximab) + 6-MP C: 13 GC 0.1–0.7 mg/kg/day All combined with MTX 12–25 mg/m2/week; 3 combined with CY 3–3.5 mg/kg/day 1 combined with leflunomide 10 mg/day; 1 combined with penicillamine 13 mg/kg/day
|
A: unvaccinated B: 4 IBD with 6-MP monotherapy (1.5–2 mg/kg/day) C: 12 ARD without GC
|
End-point of follow-up: A: 35.6 months after vaccination B: not reported C: not reported
For how many participants were no complete outcome data available? Not reported
|
Varicella Defined as herpes zoster infection A: I: 0/28 versus 4/54 herpes zoster; RR 0.23 [95% CI 0.01-4.06]
Defined as developed chickenpox C: 2/8
Immunogenicity Defined as increase in GMT
A: similar increase in GMT in patients compared to HC
NB seroprotection 100% in patients and controls before vaccination.
Safety Defined as adverse events A: Frequency of flares similar in vaccinated and unvaccinated patients B: No serious adverse events after primary/booster VZV vaccination, despite anti-TNFα usage. C: 3 patients with mild self-limiting VZV-like rash. No increase in disease activity
|
ARD = auto-immune rheumatic GMT = geometric mean titres HC = healthy controls IBD = inflammatory bowel disease JLA = juvenile idiopathic arthritis JSLE = juvenile systemic lupus erythematosus patient
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Evidence table for systematic reviews of diagnostic test accuracy studies
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Eckerle, 2013
|
SR and meta-analysis
Literature search up to December 2011
A: Kano, 2002 B: Khan, 2006 C: Zamora, 1984 D: Shinjoh, 2008 E: Chaves, 2005 F: Weinberg, 2006
Study design: 5 prospective (A, C, D, E, F) and 1 retrospective (B) cohort studies
Setting and Country: not reported
Source of funding and conflicts of interest: non-commercial
|
Inclusion criteria SR: original research papers published in peerreviewed scientific journals reporting results on adult or paediatric SOT recipients that were vaccinated with currently licensed vaccines. Serologic immune response to vaccination had to be assessed ≥1 after vaccination.
Exclusion criteria SR: studies on vaccination of transplant candidates or organ donors, experimental vaccines or adjuvants, comparative trials on routes of application, trials on vaccines that are out of use and trials on pandemic vaccines. Humoral (serologic) response) not assessed, key data missing or not extractable, no primary data given, case and conference reports
6 studies included for varicella
N A: 7 LTX paediatric patients B: 31 paediatric LTX patients C: 17 RTX paediatric patients D: 11 paediatric RTX patients E: 6 paediatric RTX patients F: 15 LTX and ITX paediatric patients ….
Age and sex not reported: |
A: Primary vaccination before SOT, post-transplant single dose (booster) B: Single or multiple VZVV C: single dose D: Single or multiple vaccination E: Single or double (0, 1–2 months) F: single dose
|
Reference test NA
|
Endpoint of follow-up: not reported
|
1. Varicella Defined as short-term response, proportion [95% CI] A: 0.71 [0.29-0.96] B: 0.65 [0.45-0.81] C: 0.65 [0.38-0.86] D: 0.82 [0.48-0.98] E: 0.67 [0.22-0.96] F: 0.87 [0.60-0.98]
No pooled analysis performed for varicella
|
ITX = intestinal transplantation LTX = liver transplantation RTX = Renal transplantation patients
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Yin, 2018 |
Yes |
Yes |
No |
Yes |
No |
Yes |
Yes |
Yes |
No, missing for included studies |
|
Marin, 2016 |
Yes |
Yes |
No |
No, sex and follow-up not reported |
No |
No |
No |
Yes |
No, missing for included studies |
|
Groot, 2015 |
Yes |
Yes |
No |
No |
No |
No |
Unclear |
No |
No, missing for included studies |
|
Eckerle, 2015 |
Yes |
YEs |
No |
No |
No |
No |
Unclear |
No |
No, missing for included studies |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Posfay-Barbe, 2012 |
Unlikely |
Unlikely |
Unlikely |
NA |
|
Son, 2010 |
Unlikely |
Unlikely |
Unlikely |
NA |
|
Speth, 2018 |
Unlikely |
Likely, only 12 weeks follow-up |
Unlikely |
NA |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Mogelijke systematische reviews |
|
|
Ong 2018 |
End stage renal disease adults. |
|
Nguyen 2017 |
Alleen in PubMed gezocht. 1 studie naar effectiviteit bij kinderen na beenmergtransplantatie (Sauerbrei 1997). |
|
Croce 2017 |
Outcome safety and immunogenicity in 3 subpopulations (IMID, SOT, BMT) for several vaccins. Primary studies not reproducable from article. Only numbers of infections reported. |
|
Heijstek 2011 |
Updated by Groot, 2015. |
|
Breuer 2011 |
Old SR, new studies available. |
|
Mogelijke RCT’s |
|
|
Kamei 2018 |
64% was vaccinated before start of the study. |
|
van de Wetering 2016 |
VZV-seronegative pediatric oncology patients. |
|
Pileggi 2010 |
Included in de Groot 2015. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-06-2020
Beoordeeld op geldigheid : 25-06-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarbij herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap
- Koninklijke Nederlandse Organisatie van Verloskundigen
- Stichting Kind en Ziekenhuis
- Rijksinstituut voor Volksgezondheid en Milieu, Centrum Infectieziektebestrijding
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel was algemene herziening van de richtlijn Varicella met name de adviezen over toediening van PEP en het opnemen van een nieuwe module over behandeling van VZV-infecties.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met waterpokken, zoals, maar niet beperkt tot: alle medisch specialisten, huisartsen, verpleegkundigen, verloskundigen, verpleegkundig specialisten, physician assistant of andere zorgverleners en patiënten die te maken hebben met patiënten die een VZV-infectie hebben of blootgesteld zijn aan waterpokken.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met waterpokken.
Werkgroep
- Dr. J.J.A. (Jeroen) van Kampen, arts-microbioloog, werkzaam in het Erasmus MC te Rotterdam, NVMM (voorzitter)
- Dr. A.C.T.M. (Ann) Vossen, arts-microbioloog, werkzaam in het LUMC te Leiden, NVMM
- Dr. E. (Esther) Heikens, arts-microbioloog, werkzaam in het Haaglanden MC te Den Haag, NVMM
- D.J.C. (Daniëlle) Komen, dermatoloog, werkzaam in het Westfriesgasthuis te Hoorn, NVDV
- Dr. W. (Wim) Opstelten, huisarts, werkzaam te Amersfoort, NHG
- Dr. C.L (Clementien) Vermont, kinderarts-infectioloog/immunoloog, werkzaam in het Erasmus MC – Sophia te Rotterdam, NVK
- F. (Freke) van Voorthuijsen, Stichting Kind & Ziekenhuis
- Dr. A.H.W. (Anke) Bruns, internist-infectioloog/hematoloog, werkzaam in het UMCU te Utrecht, NIV
- Dr. E. (Liesbeth) van Leeuwen, gynaecoloog, werkzaam in het Amsterdam UMC locatie AMC te Amsterdam, NVOG
- Dr. J.M. (Joke) Koelewijn, docent en onderzoeker, werkzaam bij Verloskunde Academie Amsterdam en Sanquin Research/Diagnostiek Amsterdam, KNOV
- Ir. E.A. (Alies) van Lier, epidemioloog, werkzaam bij het RIVM-EPI
- Dr. W.L.M. (Helma) Ruijs, arts maatschappij en gezondheid, werkzaam bij het RIVM-LCI
- Drs. P.K. (Kiki) Chung, AIOS medische microbiologie, werkzaam in het LUMC te Leiden
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bruns |
Internist-infectieoloog/hematoloog UMC Utrecht |
- |
Geen |
Geen actie |
|
Chung |
Arts-assistent in opleiding tot arts-microbioloog, Afdeling Medische Microbiologie, Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen actie |
|
Heikens |
Arts-microbioloog, Haaglanden Medisch Centrum |
Vakdeskundige RVA (betaald) |
Geen |
Geen actie |
|
Koelewijn |
Docent Verloskunde Academie Amsterdam, 44% fte |
Medewerker Tijdschrift voor Verloskundigen (schrijven referaten);betaald |
Geen |
Geen actie |
|
Komen |
Dermatoloog, Westfriesgasthuis |
Lid domeingroep Huidinfecties NVDV, onbetaald |
Geen |
Geen actie |
|
Opstelten |
Huisarts te Amersfoort eigen praktijk, 0,5 dag per week |
Adjunct-hoofdredacteur, NTVG Amsterdam 0,5 dag per week |
Geen |
Geen actie |
|
Ruijs |
Arts voor Maatschappij en Gezondheid / Infectieziektebestrijding |
geen |
Geen |
Geen actie |
|
Van Kampen (voorzitter) |
Arts-microbioloog, afdeling Viroscience, Erasmus MC |
Geen |
Geen
|
Geen actie. |
|
van Leeuwen |
Gynaecoloog, perinatoloog, Academisch Medisch Centrum Amsterdam |
Bestuurder stichting prenatale screening Amsterdam en omstreken (1 dag per week) |
Partner is gynaecoloog, ook geen financiële belangen |
Geen actie |
|
van Lier |
Functie: epidemioloog Rijksvaccinatieprogramma |
Geen nevenwerkzaamheden |
Geen |
Geen actie |
|
Vermont |
Kinderarts-infectioloog/immunoloog Erasmus MC |
Geen |
Geen |
Geen actie |
|
Voorthuijsen |
Kwaliteitsmedewerker Kind en ziekenhuis |
- |
Geen |
Geen actie |
|
Vossen |
Arts-microbioloog, afd. Medische Microbiologie, LUMC |
Voorzitter NVMM bestuur, portefeuille kwaliteit, onbetaald |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een werkgroeplid af te vaardigen namens Stichting Kind en Ziekenhuis in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. In het licht van de bevindingen van de Kwaliteits- & Doelmatigheidsagenda over aantallen beschikbare indicatoren en de moeilijkheid van het ontwikkelen van toepasselijke indicatoren, is er besloten (vooralsnog) geen indicatoren te ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVMM, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door NVK, KNOV, ZiNL, RIVM, NIV, NVMDL, NVDV, NVR, Kind en Ziekenhuis en Lareb via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming omtrent aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk-of-Bias(RoB)- tabellen. De gebruikte RoB-instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa – voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en ook deze worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
- Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
- Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
- Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2010 – december 2018
|
1 exp varicella zoster virus infection/ or exp chickenpox/ or chickenpox.ab,ti. or 'chicken pox'.ab,ti. or varicella.ab,ti. or zoster.ab,ti. or vzv.ab,ti. or shingles.ab,ti. or zona.ab,ti. (38493) 2 exp Herpes Zoster Vaccine/ or exp Chickenpox Vaccine/ or ((varicella or zoster or shingles or chickenpox) adj3 vaccin*).ti. or vaccin*.ti. (152253) 3 (exp Immunocompromised Host/ or exp HIV/ or (immunocompromised or immunocompromized or compromised or compromized or 'immune compromise*' or vulnerable or infected or 'human immunodeficiency virus' or hiv or transplant* or immunosupress*).ti,ab,kw.) and (child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. (135054) 4 1 and 2 and 3 (304) 5 limit 4 to (yr="2010 -Current" and english) (100) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (375966) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1807990) 8 5 and 6 (6) 9 5 and 7 (9) 10 8 or 9 (12) 11 5 not (8 or 9) (88)
= 100 (99 uniek) |
179 |
|
Embase (Elsevier) |
('chickenpox'/exp OR 'varicella zoster virus'/exp OR varicella*:ab,ti OR vzv:ab,ti OR chickenpox:ab,ti OR 'chicken pox':ab,ti OR shingles:ab,ti OR zona:ab,ti OR zoster:ab,ti)
AND ('varicella zoster vaccine'/exp/mj OR 'chickenpox vaccine'/exp/mj OR ((varicella OR zoster OR shingles OR chickenpox) NEAR/3 vaccin*):ab,ti OR shingrix:ab,ti OR varilrix:ab,ti OR zostavax:ab,ti OR vaccin*:ti)
AND ('immunocompromised patient'/exp OR immunocompromised:ab,ti OR immunocompromized:ab,ti OR compromised:ab,ti OR compromized:ab,ti OR 'immune compromise*':ab,ti OR vulnerable:ab,ti OR infected:ab,ti OR 'human immunodeficiency virus infected patient'/exp OR 'human immunodeficiency virus':ab,ti OR hiv:ab,ti OR transplant*:ab,ti OR immunosuppress*:ab,ti)
AND (infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR 'baby'/exp OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR 'minors'/exp/mj OR minors*:ti,ab OR 'boy'/exp OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR 'child'/exp OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR 'schoolchild'/exp OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab OR 'pediatrics'/exp)
AND (english)/lim AND (2010-2018)/py NOT 'conference abstract':it
= 157 (156 uniek) |
