Achtergrond en epidemiologie bij varicella
Uitgangsvraag
Hoe vaak komt waterpokken in Nederland voor, wat zijn de symptomen en complicaties van waterpokken en welke groepen hebben een grotere kans op een ernstig beloop?
Aanbeveling
Wees alert bij de volgende risicogroepen vanwege kans op een ernstig beloop van waterpokken: niet-immune zwangere vrouwen en hun ongeboren kind, pasgeborenen van moeders die zichtbare waterpokken ontwikkelen 7 dagen voor tot en met 7 dagen na de bevalling, prematuren, niet-immune personen vanaf 12 jaar en immuungecompromitteerde personen.
Wees bedacht op mogelijk (ernstige) complicaties van waterpokken, zoals pneumonie, bacteriële superinfecties, cerebellitis, encefalitis en congenitaal varicellasyndroom.
Overwegingen
1. Achtergrond: het varicellazostervirus (VZV) en de pathogenese
Waterpokken (varicella) wordt veroorzaakt door het varicellazostervirus (VZV). Dit virus is erg besmettelijk: voor Nederland wordt geschat dat een primair geval 16,9 (95%BI: 11,5 tot 24,2) nieuwe gevallen van waterpokken kan veroorzaken (Nardone, 2007). Hoewel het ziektebeeld waterpokken al zeer lang bekend is, is het pas in de 19e eeuw duidelijk gedifferentieerd van de veel meer pathogene maar minder besmettelijke pokken (variola). De besmettelijkheid van het blaarvocht werd in 1875 aangetoond, terwijl al in 1888 een relatie werd gelegd met herpes zoster (gordelroos). In 1953 werd het virus voor het eerst geïsoleerd en in 1958 werd vastgesteld dat de verwekkers van waterpokken en gordelroos identiek zijn (Weller, 1958).
VZV is een dubbelstrengs DNA-virus met een lipidenenvelop. Het behoort tot de familie der Herpesviridae, subfamilie Alphaherpesvirinae. Deze groep van virussen verlaat na een infectie het lichaam niet meer en blijft latent aanwezig in de zenuwcellen van sensibele ganglia. De besmetting met VZV verloopt aerogeen of door direct (slijmvlies)contact. Daarnaast is er bij zwangeren de mogelijkheid van placentaire overdracht van VZV naar de foetus. De criteria voor een contact met een redelijke kans op infectie zijn door de American Academy of Pediatrics (AAP) als volgt gedefinieerd:
- gezinscontacten, dat wil zeggen contacten die deel uit maken van hetzelfde huishouden als de indexpatiënt met waterpokken of gordelroos;
- gezichtscontact (< 2 meter) met een waterpokkenpatiënt gedurende ten minste 5 minuten;
- gedurende meer dan 1 uur in dezelfde ruimte verblijven als een patiënt met waterpokken.
De incubatieperiode varieert van 13 tot 18 dagen (uitersten 10 tot 21 dagen) (Ross, 1962). De patiënt is besmettelijk vanaf 48 uur voor het ontstaan van de huidafwijkingen tot het moment dat alle blaasjes zijn ingedroogd. Porte d’ entree is het respiratoire epitheel van de nasofarynx. Hier vindt de eerste replicatie plaats. Na 48 tot 72 uur volgt een viremie en wordt het virus getransporteerd naar de andere lymfeklierstations, de lever en de milt. In deze organen volgt een tweede replicatiefase, die 9 tot 12 dagen na besmetting aanleiding geeft tot een tweede viremie. In de tweede viremische fase bereikt het virus het eindorgaan. In de meeste gevallen is dit de huid waar het virus respectievelijk maculae, papulae en vesiculae veroorzaakt. Opvallend is dat deze laesies niet synchroon ontstaan: na enkele dagen kunnen alle stadia tegelijk worden gezien. Bovendien worden de laesies meer centraal dan perifeer waargenomen en doet het behaarde hoofd ook mee. Na enkele dagen drogen de laesies in onder korstvorming. Deze korstjes zijn niet besmettelijk (Committee on Infectious Diseases, 2000). Na de infectie trekt het virus zich via de sensibele zenuwbanen terug in sensibele ganglia en resulteert dit vrijwel altijd in levenslange immuniteit tegen waterpokken. Bij een verminderde cellulaire immuniteit kan het virus echter gereactiveerd worden en zich verspreiden via de sensibele zenuw naar het bijbehorende dermatoom. Dit resulteert in gordelroos (herpes zoster). Gordelroos komt meestal voor bij ouderen en patiënten met immuunsuppressie. Ook kinderen kunnen gordelroos krijgen, vooral wanneer zij op zeer jonge leeftijd waterpokken hebben gehad. Dit is dan niet gerelateerd aan een immuundeficiëntie, maar is waarschijnlijk terug te voeren op de aanwezigheid van maternale VZV-antilichamen of onrijpheid van het immuunsysteem dat nog geen langdurige specifieke immuniteit kan behouden om reactivatie van het virus te voorkomen (Nikkels, 2004).
2. Epidemiologie
Infecties met VZV komen overal ter wereld voor. Waterpokken wordt het meest in de winter en de vroege lente gezien. In gebieden met een gematigd klimaat heeft meer dan 95% van de twaalfjarigen waterpokken doorgemaakt (Weller, 1997). Dit in tegenstelling tot de (sub)tropen, waar op die leeftijd de seroprevalentie lager ligt (Longfield, 1990; Sinha, 1976; Hussey, 2017; Daulagala, 2018; Al-Turab, 2018). Oorzaken voor deze verschillen kunnen liggen in virale, gastheer- en geo-socio-klimatologische verschillen. Zo is bijvoorbeeld het dominante VZV-genotype niet voor elke regio hetzelfde, zijn er verschillen tussen landelijk en stedelijk gebied, en zijn klimaatfactoren waarschijnlijk van invloed op de VZV-transmissie (Daulagala, 2018). Seroprevalentiegegevens laten zien dat in Europa bijna iedereen waterpokken doormaakt voor de volwassen leeftijd (Nardone, 2007; Bollaerts, 2017). De leeftijd waarop dit gebeurt, verschilt echter wel. Op basis van de hoogte van de seroprevalentie worden drie clusters onderscheiden: 1) ≥70% op 5-jarige leeftijd (Nederland, België, Luxemburg), 2) <70% op 5-jarige leeftijd, maar ≥90% op 10-jarige leeftijd (Finland, Frankrijk, Duitsland, IJsland, Ierland, Slovenië, Spanje en Zwitserland) en 3) <90% op 10-jarige leeftijd (Griekenland, Italië, Polen, Slowakije en het Verenigd Koninkrijk) (Bollaerts, 2017).
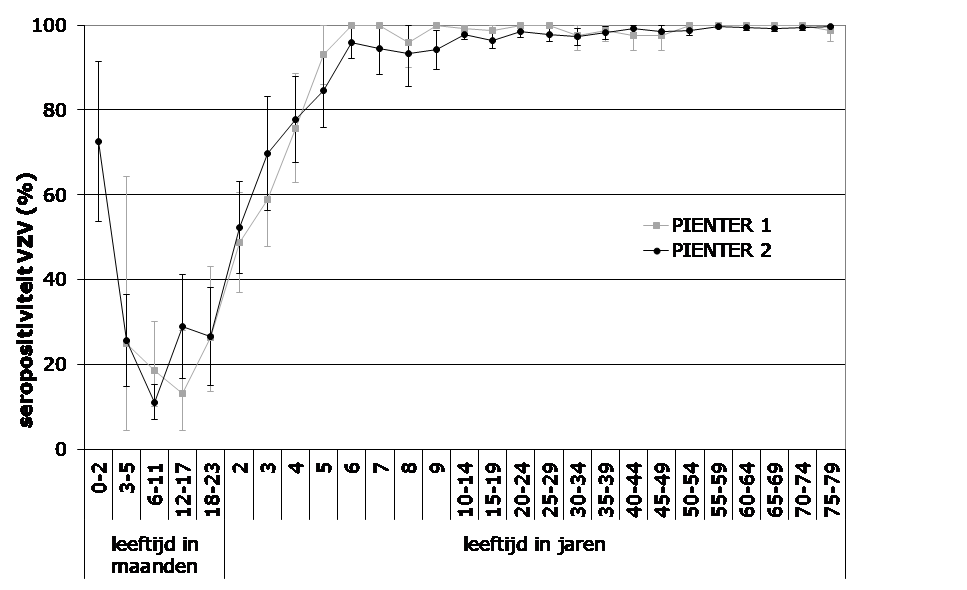
Onder de Nederlandse bevolking (0 tot 80 jaar) is de gemiddelde seroprevalentie dus hoog: 94,6% (95% BI 93,2 tot 96,0%) (van Lier, 2013). Al vanaf 6-jarige leeftijd is meer dan 95% seropositief (Figuur 1) (van Lier, 2013; de Melker, 2006). Waterpokken treedt daarmee op jongere leeftijd op dan in andere Europese landen (Nardone, 2007; Bollaerts, 2017). Determinanten die samenhangen met een lagere seropositiviteit onder kinderen jonger dan 6 jaar waren: jonge leeftijd, eerste generatie niet-Nederlandse etniciteit en lage bezoekfrequentie van kinderdagverblijf of peuterspeelzaal (van Lier, 2013). Recent is in Nederland ook onderzoek gedaan onder asielzoekers waaruit bleek dat de bescherming tegen waterpokken onder de onderzochte groepen (Syrië, Iran, Irak, Afghanistan en Eritrea) ook hoog was: 96% (range 92 tot 98%) (Freidl, 2018). Onderzoek onder asielzoekers in Duitsland, Canada en Italië liet echter zien dat de seroprevalentie aanzienlijk tussen landen van herkomst verschilt en afhankelijk is van de leeftijd van de betreffende persoon (Toikkanen, 2016; Cadieux, 2017; Vairo, 2017).
Figuur 1 Seroprevalentie voor VZV specifieke antistoffen, met 95% betrouwbaarheidsintervallen – PIENTER 2 (2006/2007) versus PIENTER 1 (1995/1996) onderzoek (van Lier, 2013; de Melker, 2006)
In de periode 2012 tot 2016 bedroeg het aantal huisartsconsulten voor waterpokkenepisodes gemiddeld 260 per 100.000 inwoners, dit is ongeveer 43.500 huisartsconsulten per jaar (Bron: NIVEL; Schurink-van 't Klooster, 2017). In de periode 2000 tot 2014 werden jaarlijks gemiddeld ongeveer 265 personen in het ziekenhuis opgenomen met hoofddiagnose waterpokken (Bron: DHD; Schurink-van 't Klooster, 2017). In de periode 2000–2016 werden jaarlijks gemiddeld 2 tot 3 sterfgevallen met primaire doodsoorzaak waterpokken geregistreerd (Bron: CBS; Schurink-van 't Klooster, 2017). Vergeleken met andere landen lijkt de ziektelast (incidentie huisartsconsulten, ziekenhuisopnames en sterfgevallen) laag te zijn (van Lier, 2011). Dit komt hoogstwaarschijnlijk niet door onderrapportage (van Lier, 2014). De ernst van waterpokken onder in het ziekenhuis opgenomen patiënten lijkt ook niet anders dan in andere landen (van Lier, 2011). Deze bevindingen ondersteunen de hypothese dat de ziektelast van waterpokken in Nederland relatief laag is vanwege de lage leeftijd van infectie, resulterend in minder ernstige gevallen. Hoewel het nog steeds mogelijk is dat een deel van de ziektelast van waterpokken onbekend blijft, doordat de huisarts in Nederland minder vaak wordt geraadpleegd, wordt niet verwacht dat dit ernstige gevallen of een grote ziektelast betreft.
3. Symptomen en complicaties van waterpokken
Bij de meeste kinderen verloopt waterpokken mild: geringe temperatuursverhoging (tot 38,5 °C) en klachten van hangerigheid. De huiduitslag kan soms zo heftig jeuken dat medicatie nodig is. Complicaties zijn superinfecties, meestal met residente huidflora als Streptococcus pyogenes (Groep-A betahemolytische streptokok) of Staphylococcus aureus. Hierbij kunnen patiënten flink ziek zijn met hoge koorts.
Bacteriële superinfecties van de huid, otitis media, faryngitis/tonsillitis, conjunctivitis en gastro-enteritis zijn de meest voorkomende complicaties van waterpokken die in de huisartspraktijk worden gezien (van Lier, 2014). De meest voorkomende complicaties van waterpokken bij ziekenhuispatiënten zijn bacteriële superinfecties van de huid, (dreigende) uitdroging, febriele convulsies, pneumonie en gastro-enteritis (van Lier, 2011).
Een andere minder frequente complicatie is cerebellitis (Connolly, 1994; van der Maas, 2009). Deze complicatie begint meestal na het hoogtepunt van de ziekte. Deze uit zich in koorts, evenwichtsstoornissen, dronkemansgang en dysartrie. De oorzaak hiervan is waarschijnlijk een immuungemedieerde ontsteking van de kleine hersenen. De prognose is goed. Veel zeldzamer is een encefalitis die gepaard gaat met convulsies, uitvalsverschijnselen en verminderd bewustzijn tot zelfs coma. De prognose hiervan is veel minder goed, omdat restverschijnselen blijven bestaan (Griffith, 1970). Daarnaast is als zeer zeldzame complicatie de varicella-geassocieerdere vasculopathie beschreven, die kan leiden tot een stroke. De termijn tussen waterpokken en de stroke is gemiddeld 3 tot 6 maanden (Amlie-Lefond, 2016).
4. Risicogroepen ernstig beloop
Een ernstig beloop van waterpokken kan worden gezien bij de volgende groepen:
- Foetus indien moeder tijdens zwangerschap waterpokken doormaakt;
- Prematuren < 28 weken of ≤ 1000 gram ongeacht VZV status van moeder, of prematuren ≥ 28 weken die opgenomen zijn in verband met prematuriteit gerelateerde problematiek en wiens moeder VZV negatief is.
- Pasgeborenen van moeders die zichtbare waterpokken ontwikkelen binnen een periode van 7 dagen voor tot en met 7 dagen na de bevalling;
- Seronegatieve personen vanaf 12 jaar, met name zwangere vrouwen
- Immuungecompromitteerde personen.
Personen vanaf 12 jaar hebben een grotere kans op complicaties van waterpokken dan personen < 12 jaar (Guess, 1986; Choo, 1995; Mohsen, 2003, CDC, 1997). De belangrijkste complicatie bij volwassenen met waterpokken is de VZV-pneumonie welke moeilijk te behandelen is. Een Amerikaanse studie laat zien dat ongeveer 1 op de 400 volwassenen met waterpokken een VZV-pneumonie ontwikkelt (Guess, 1986). Een observationele studie naar VZV-pneumonie bij volwassenen toont dat 68% van de patiënten die beademing nodig hadden, immuungecompromitteerd was met een bijhorend mortaliteitsrisico ten tijde van de ziekenhuisopname van 43% (Mirouse, 2017).
Bij volwassenen met waterpokken in de Verenigde Staten is de mortaliteit 25 maal verhoogd ten opzichte van kinderen tussen de 1 en 4 jaar oud met waterpokken (Meyer, 2000).
Zwangeren hebben bij waterpokken meer kans op ernstige complicaties dan niet-zwangere seronegatieve volwassenen. Hoe verder de zwangerschap is gevorderd, hoe groter de kans op complicaties. Een VZV-pneumonie is een bekende complicatie die bij 5 tot 10% van de zwangeren met waterpokken optreedt en een sterftekans heeft tot 14%. De andere complicaties bij zwangeren zoals hepatitis, encefalitis, cerebellitis, pericarditis, nefritis, artritis en myocarditis zijn zeldzaam. Bij een waterpokken infectie tijdens de zwangerschap kan vroeggeboorte optreden en het congenitaal varicellasyndroom optreden (2% indien infectie optreedt tussen de 13e en 20e zwangerschapsweek en 0,4% indien de infectie optreedt voor de 13e week). Het congenitaal varicellasyndroom bestaat uit huiddefecten, oogafwijkingen en hypoplastische ledematen, al of niet in combinatie met afwijkingen van het centraal zenuwstelsel. Indien een zwangere zichtbare waterpokken ontwikkelt in de periode van 7 dagen voor tot en met 7 dagen na de bevalling, is er een risico op het ontwikkelen van een gegeneraliseerde VZV infectie bij de pasgeborene. Dit uit zich binnen de eerste twee levensweken met gegeneraliseerde blaasjes, en kan gepaard gaan met een sepsis-achtig beeld. Hepatitis, pneumonie en meningoencefalitis kunnen het beeld verder compliceren. Er is een verhoogde mortaliteit tot 30 % beschreven.
Bij T-celdeficiënties gaat waterpokken gepaard met continu hoge koorts, waarbij voortdurend nieuwe laesies ontstaan die geen neiging tot genezing vertonen (Feldman, 1975; Feldman, 1987). Ook de vorm van de laesies is anders dan die van gewone waterpokken: uitgebreider met soms bloedingen (hemorragische waterpokken). De mortaliteit hiervan is zonder behandeling aanzienlijk: ongeveer 20%. Infectie wordt vaak gecompliceerd door pneumonie, meningo-encefalitis, gastro-enteritis en hepatitis. Bij neonaten wordt een dergelijk ernstig ziektebeeld gezien als de moeder binnen 7 dagen voor tot en met 7 dagen na de bevalling zichtbare waterpokken krijgt, dus als in die periode blaasjes ontwikkelen. In een studie naar waterpokkeninfecties bij kinderen met een hematologische aandoening heeft 21,1% van de kinderen een ernstig beloop van de infectie, zoals een gedissemineerde infectie, pneumonie, encefalitis, hepatitis en/of noodzaak tot IC-opname (Henderson, 2000; Kim, 2016).
In tabel 1 worden enkele groepen immuungecompromitteerden met een mogelijk ernstig beloop van waterpokken benoemd. De tabel beoogt geen compleet overzicht te geven. Mogelijk zijn er nog andere risicogroepen met een ernstig beloop van waterpokken of medicatie die niet genoemd worden gezien de snelle ontwikkelingen op gebied van immuuntherapie.
Tabel 1 Enkele risicogroepen en immuunsuppressieve medicatie met een mogelijk ernstig beloop van waterpokken
|
Risicogroep |
Minimale duur immuunsuppressie |
Bepaling immuniteit |
Eerste keuze voor PEP (vaccinatie <3dagen of VZIG) |
Referenties |
|
Ernstige cellulaire immuunstoornis |
|
|
|
Opstelten 2016 |
|
Stamcel-/Beenmergtransplantatie en/of GVHD |
2 jaar na SCT en zolang immuunsuppressie |
IgG VZV bepaling |
VZIG indien geen IgG suppletie met therapeutische spiegel |
Leung, 2000 |
|
Primaire immuundeficientie (ernstig antistof deficientie CVID, XLA of T-cel-dysfunctie) |
Levenslang |
IgG VZV bepaling |
VZIG indien geen IgG suppletie met therapeutische spiegel |
Nanishi, 2016 |
|
Solide orgaantransplantatie |
Levenslang |
IgG VZV bepaling |
VZIG |
Pergam, 2013 |
|
HIV infectie met een CD4+T-cel getal < 200/mm3 |
Levenslang indien geen immuunherstel |
IgG VZV bepaling |
VZIG |
Perronne, 1990; Gnann, 2002 |
|
Actieve hematologische maligniteit (leukemie, lymfoom, aplastische anemie) |
1 jaar na behandeling en complete remissie |
Anamnese. Bij negatieve of twijfelachtige anamnese VZV IgG |
VZIG |
Kim, 2016 |
|
Maligniteit met chemotherapie of immunotherapie |
3 maanden na laatste kuur |
Anamnese. Bij negatieve of twijfelachtige anamnese VZV IgG |
VZIG |
Feldman, 1987 |
|
Immuunsupressiva gebruik bij autoimmuunziekten zoals reumatoïde artritis, vasculitis, SLE, IBD, Multiple Sclerosis of andere aandoeningen
|
|
Anamnese. Bij negatieve of twijfelachtige anamnese VZV IgG |
VZIG |
Manouchehrinia 2017; Osiro 2017; Kohlmann, 2015; Cullen, 2012 |
|
Corticosteroïden (Prednison) ≥ 0.5mg/kg of ≥20 mg per dag voor ≥2 weken of intraveneuze pulse-therapie of cumulatieve dosis > 700 mg |
1 maand |
. |
|
RIVM 2019 |
|
Anti-CD20 monoklonale anstoffen (Rituximab®) |
6-12 maanden |
|
|
|
|
TNF-a-remmers (b.v. infliximab®, adalimumab®, golimumab®, abatacept®) |
3 maanden |
|
|
|
|
Etanercept |
1 maand |
|
|
|
|
Natalizumab |
3 maanden |
|
|
|
|
Calcineurineremmers (ciclosporine > 2,5mg/kg per dag; Tacrolimus®) |
1-3 maanden |
|
|
|
|
M-TOR-remmers (b.v. Sirolimus®,everolimus) |
3 maanden |
|
|
|
|
JAK-remmers (b.v. ruxolitinib®, tofacitinib) |
3 maanden |
|
|
|
|
Mycofenolaatmofetil (cellcept®) |
1 maand |
|
|
|
|
Cyclofosfamide > 2.0 mg/kg per dag of i.v. pulse-therapie |
3 maanden |
|
|
|
|
Thiopurines (Azathioprine > 3.0 mg/kg per dag; 6-Mercaptopurine > 1.5 mg/kg per dag) |
3 maanden |
|
|
|
|
Methotrexaat > 0,4 mg/kg per week |
1-3 maanden |
|
|
|
|
Leflunomide > 0.5 mg/kg per dag 1 jaar |
tot 24 maanden |
|
|
|
|
Beperkt klinische relevante cellulaire immuunstoornis |
nvt |
Overweeg anamnese. Bij negatieve of twijfelachtige anamnese VZV IgG |
|
|
|
HIV infectie met CD4+T-cel getal > 200/mm3 maar detecteerbare virale lading |
|
|
VZIG* |
|
|
Gemetastaseerde maligniteit |
|
|
VZIG* |
|
|
Chronische leverziekten |
|
|
VZIG* |
|
|
Preterminale nierinsuffitientie |
|
|
Vaccinatie in overleg expert |
|
|
Milde antistofdeficientie (IgG subklassedeficientie, SADNI) |
|
|
Vaccinatie in overleg expert |
|
|
Geen klinisch relevante cellulaire immuunstoornis |
Nvt |
Overweeg anamnese. Bij negatieve of twijfelachtige anamnese VZV IgG |
Vaccinatie |
Opstelten 2016, RIVM 2019 |
|
Asplenie |
|
|
|
|
|
Hematologische maligniteit (leukemie > 1 jaar in remissie) |
|
|
|
|
|
Maligniteit in remissie en chemotherapie > 3 maanden geleden |
|
|
|
|
|
HIV infectie met CD4 getal > 200/mm3 en onderdrukte virale lading |
|
|
|
|
|
autoimmuunziekten zoals reumatoïde artritis, vasculitis, SLE, IBD, Multiple Sclerosis zonder immuunsuppressie gebruik en in remissie |
|
|
|
|
|
Chronische nierziekten GFR > 20ml/min |
|
|
|
|
|
Diabetes mellitus |
|
|
|
|
|
Complementdeficientie |
|
|
|
|
|
Immuunsupressiva Corticosteroïden (Prednison) <0.5 mg/kg tot maximum van 10 mg/dag of < 10 mg per dag of cumulatief < 700 mg Intra-articulaire injectie met corticosteroïden Hydrocortisonsuppletie in fysiologische doseringen Topicale, inhalatie immuunsuppressiva Budesonide oraal tot 9mg/dag of klysma Hydrochloroquine Sulfasalazine |
|
|
|
|
*Afhankelijk van klinische situatie kan geen PEP maar vroegbehandeling overwogen worden
Onderbouwing
Achtergrond
Doel van deze module is het beschrijven van de achtergrond van de ziekte en de epidemiologie in Nederland. Hierbij wordt aandacht besteed aan de mate waarin waterpokken in Nederland voorkomt, symptomen en complicaties van waterpokken en groepen die een grotere kans hebben op een ernstig beloop.
Samenvatting literatuur
De informatie betreffende de achtergrond en epidemiologie van waterpokken is terug te vinden onder het tabblad Aanbeveling en overweging.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er geen systematische literatuuranalyse verricht, maar gebruikgemaakt van het verzamelde bewijs uit de oude richtlijn (2010) en aanvullende literatuur specifiek voor de Nederlandse situatie.
Referenties
- Al-Turab, M., Chehadeh, W. (2018). Varicella infection in the Middle East: Prevalence, complications, and vaccination. J Res Med Sci. 23:19.
- Amlie-Lefond, C., & Gilden, D. (2016). Varicella zoster virus: a common cause of stroke in children and adults. Journal of Stroke and Cerebrovascular Diseases, 25(7), 1561-1569.
- Arvin, A. M., Koropchak, C. M., & Wittek, A. E. (1983). Immunologic evidence of reinfection with varicella-zoster virus. J.Infect.Dis., 148, 200-205.
- Bollaerts, K., Riera-Montes, M., Heininger, U., Hens, N., Souverain, A., Verstraeten, T., et al. (2017). A systematic review of varicella seroprevalence in European countries before universal childhood immunization: deriving incidence from seroprevalence data. Epidemiol Infect, 145(13):2666-77.
- BSSI (1995). Guidelines for the management of shingles. report of a working group of the British Society for the Study of Infection (BSSI). J.Infect., 30, 193-200.
- Committee on Infectious Diseases. (2000). Varicella vaccine update. Pediatrics, 105(1), 136-141.
- Cadieux, G., Redditt, V., Graziano, D., & Rashid, M. (2017). Risk factors for varicella susceptibility among refugees to Toronto, Canada. Journal of immigrant and minority health, 19(1), 6-14.
- CDC (1993). Recommendations of the Advisory Committee on Immunisation Practices (ACIP): use of vaccine and immune globulins in persons with altered immunocompetence (Rep. No. 42). Morbidity and Mortality Weekly Report.
- CDC (1997). Varicella-related deaths among adults (Rep. No. 46). Centres for Disease Control and Prevention.
- CDC (2000). Surveillance for Vaccination Coverage Among Children and Adults (Rep. No. 49). Centers for Disease Control and Prevention.
- Choo, P.W., Donahue, J.G., Manson, J.E., Platt, R. (1995). The epidemiology of varicella and its complications. J Infect Dis, 172(3):706-12.
- Cohen, J. I., Brunell, P. A., Straus, S. E., & Krause, P. R. (1999). Recent advances in varicella-zoster virus infection. Ann.Intern.Med., 130, 922-932.
- Connolly, A. M., Dodson, W. E., Prensky, A. L., & Rust, R. S. (1994). Course and outcome of acute cerebellar ataxia. Ann.Neurol., 35, 673-679.
- Daulagala, S., Noordeen, F. (2018). Epidemiology and factors influencing varicella infections in tropical countries including Sri Lanka. Virusdisease, 29(3):277-84.
- De Melker, H., Berbers, G., Hahné, S., Rümke, H., van den Hof, S., de Wit, A., & Boot, H. (2006). The epidemiology of varicella and herpes zoster in The Netherlands: implications for varicella zoster virus vaccination. Vaccine, 24(18), 3946-3952.
- Dunkle, L. M., Arvin, A. M., Whitley, R. J., Rotbart, H. A., Feder, H. M., Jr., Feldman, S. et al. (1991). A controlled trial of acyclovir for chickenpox in normal children. N Engl.J.Med., 325, 1539-1544.
- Eckstein, R., Jehn, U., & Loy, A. (1984). Endemic chickenpox infection on a cancer ward. J.Infect.Dis., 149, 829-830.
- Feldman, S., Hughes, W. T., & Daniel, C. B. (1975). Varicella in children with cancer: Seventy-seven cases. Pediatrics, 56, 388-397.
- Feldman, S. & Lott, L. (1987). Varicella in children with cancer: impact of antiviral therapy and prophylaxis. Pediatrics, 80, 465-472.
- Freidl, G. S., Tostmann, A., Curvers, M., Ruijs, W. L., Smits, G., Schepp, R., ... & Hautvast, J. L. (2018). Immunity against measles, mumps, rubella, varicella, diphtheria, tetanus, polio, hepatitis A and hepatitis B among adult asylum seekers in the Netherlands, 2016. Vaccine, 36(12), 1664-1672.
- Geerlings, S. E. & Hoepelman, I. M. (1997). Farmacotherapie van herpes zoster en postherpetische neuralgie. Geneesmiddelenbulletin, 31, 53-58.
- Griffith, J. F., Salam, M. V., & Adams, R. D. (1970). The nervous system diseases associated with varicella. A critical commentary with additional notes on the syndrome of acute encephalopathy with fatty hepatosis. Acta Neurol.Scand., 46, 279-300.
- Guess, H.A., Broughton, D.D., Melton III, L.J., Kurland, L.T. (1986). Population-based studies of varicella complications. Pediatrics, 78(4 Pt 2):723-7.
- Gustafson, T. L., Lavely, G. B., Brawner, E. R., Hutcheson, R. H., Wright, P. F., & Schaffner, W. (1982). An outbreak of airborne nosocomial varicella. Pediatrics, 70(4), 550-556.
- Henderson, D.K. (2000). Nosocomial herpesvirus infections. In Mandell, G.L., Benett, J. E. & Dolin R. (Eds.). Principles and practice of infectious diseases, 3066-3078.
- Hussey, H., Abdullahi, L., Collins, J., Muloiwa, R., Hussey, G., Kagina, B. (2017) Varicella zoster virus-associated morbidity and mortality in Africa - a systematic review. BMC Infect Dis, 17(1):717.
- Kelley, P. W., Petruccelli, B. P., Stehr-Green, P., Erickson, R. L., & Mason, C. J. (1991). The susceptibility of young adult Americans to vaccine-preventable infections. A national serosurvey of US Army recruits. JAMA, 266, 2724-2729.
- Kim, S. K., Kim, M. C., Han, S. B., Kim, S. K., Lee, J. W., Chung, N. G., ... & Kim, H. K. (2016). Clinical characteristics and outcomes of varicella zoster virus infection in children with hematologic malignancies in the acyclovir era. Blood research, 51(4), 249-255.
- Leclair, J. M., Zaia, J. A., Levin, M. J., Congdon, R. G., & Goldmann, D. A. (1980). Airborne transmission of chickenpox in a hospital. N Engl.J.Med., 302, 450-453.
- Longfield, J. N., Winn, R. E., Gibson, R. L., Juchau, S. V., & Hoffman, P. V. (1990). Varicella outbreaks in Army recruits from Puerto Rico. Varicella susceptibility in a population from the tropics. Arch.Intern.Med., 150, 970-973.
- Meyer, P. A., Seward, J. F., Jumaan, A. O., & Wharton, M. (2000). Varicella mortality: trends before vaccine licensure in the United States, 1970-1994. J.Infect.Dis., 182, 383-390.
- Mirouse, A., Vignon, P., Piron, P., Robert, R., Papazian, L., Geri, G., ... & Rabbat, A. (2017). Severe varicella-zoster virus pneumonia: a multicenter cohort study. Critical Care, 21(1), 137.
- Mohsen, A.H., McKendrick, M. (2003). Varicella pneumonia in adults. Eur Respir J, 21(5):886-91.
- Nardone, A., De Ory, F., Carton, M., Cohen, D., Van Damme, P., Davidkin, I., ... & Tischer, A. (2007). The comparative sero-epidemiology of varicella zoster virus in 11 countries in the European region. Vaccine, 25(45), 7866-7872.
- Nikkels, A. F., Nikkels‐Tassoudji, N., & Piérard, G. E. (2004). Revisiting childhood herpes zoster. Pediatric dermatology, 21(1), 18-23.
- Peyramond, D., Chidiac, C., Lucht, F., Perronne, C., Saimot, A. G., Soussy, J. C. et al. (1998). Management of infections due to the varicella-zoster virus. 11th consensus conference on anti-infectious therapy of the French-speaking Society of Infectious Diseases (SPILF). Eur.J.Dermatol., 8, 397-402.
- RIVM. Vaccinatie bij chronisch inflammatoire aandoeningen Handleiding. https://lci.rivm.nl/richtlijnen/vaccinatie-bij-chronisch-inflammatoire-aandoeningen. 29 april 2019
- Ross, A. H. (1962). Modification of chickenpox in family contacts by administration of gamma globulin. N Engl.J.Med., 276, 369-376.
- Selby, P. J., Powles, R. L., Janeson, B., Kay, H. E., Watson, J. G., Thornton, R. et al. (1979). Parenteral acyclovir therapy for herpesvirus infections in man. Lancet, 2, 1267-1270.
- Schurink-van't Klooster, T. D., & de Melker, H. E. (2017). The National Immunisation Programme in the Netherlands: Surveillance and developments in 2016-2017.
- Sinha, D. P. (1976). Chickenpox--a disease predominantly affecting adults in rural West Bengal, India. Int.J.Epidemiol., 5, 367-374.
- Toikkanen, S. E., Baillot, A., Dreesman, J., & Mertens, E. (2016). Seroprevalence of Antibodies against Measles, Rubella and Varicella among Asylum Seekers Arriving in Lower Saxony, Germany, November 2014–October 2015. International journal of environmental research and public health, 13(7), 650.
- Vairo, F., Di Bari, V., Panella, V., Quintavalle, G., Torchia, S., Serra, M. C., ... & Valle, S. (2017). An outbreak of chickenpox in an asylum seeker centre in Italy: outbreak investigation and validity of reported chickenpox history, December 2015–May 2016. Eurosurveillance, 22(46).
- van der Maas, N. A. T., Vermeer-de Bondt, P. E., De Melker, H., & Kemmeren, J. M. (2009). Acute cerebellar ataxia in the Netherlands: a study on the association with vaccinations and varicella zoster infection. Vaccine, 27(13), 1970-1973.
- van Lier, A., van der Maas, N. A., Rodenburg, G. D., Sanders, E. A., & de Melker, H. E. (2011). Hospitalization due to varicella in the Netherlands. BMC infectious diseases, 11(1), 85.
- van Lier, A., Smits, G., Mollema, L., Waaijenborg, S., Berbers, G., van der Klis, F., ... & de Melker, H. (2013). Varicella zoster virus infection occurs at a relatively young age in The Netherlands. Vaccine, 31(44), 5127-5133.
- van Lier, A., van Erp, J., Donker, G. A., van der Maas, N. A., Sturkenboom, M. C., & de Melker, H. E. (2014). Low varicella-related consultation rate in the Netherlands in primary care data. Vaccine, 32(28), 3517-3524.
- Weller, T. H. (1997). Varicella-herpes zoster virus. In A.S.Evans & R. A. Kaslow (Eds.), Viral Infections of Humans. Epidemiology and control (4th ed., pp. 865-892). New York: Plenum.
- Weller, T. H. & Witton, H. (1958). The etiologic agents of varicella and herpes zoster; serologic studies with the viruses as propagated in vitro. J.Exp.Med., 108, 869-890.
- WIP (2001). Isolatierichtlijnen Richtlijn 4b Werkgroep Infectiepreventie.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-06-2020
Beoordeeld op geldigheid : 25-06-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarbij herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap
- Koninklijke Nederlandse Organisatie van Verloskundigen
- Stichting Kind en Ziekenhuis
- Rijksinstituut voor Volksgezondheid en Milieu, Centrum Infectieziektebestrijding
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel was algemene herziening van de richtlijn Varicella met name de adviezen over toediening van PEP en het opnemen van een nieuwe module over behandeling van VZV-infecties.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met waterpokken, zoals, maar niet beperkt tot: alle medisch specialisten, huisartsen, verpleegkundigen, verloskundigen, verpleegkundig specialisten, physician assistant of andere zorgverleners en patiënten die te maken hebben met patiënten die een VZV-infectie hebben of blootgesteld zijn aan waterpokken.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met waterpokken.
Werkgroep
- Dr. J.J.A. (Jeroen) van Kampen, arts-microbioloog, werkzaam in het Erasmus MC te Rotterdam, NVMM (voorzitter)
- Dr. A.C.T.M. (Ann) Vossen, arts-microbioloog, werkzaam in het LUMC te Leiden, NVMM
- Dr. E. (Esther) Heikens, arts-microbioloog, werkzaam in het Haaglanden MC te Den Haag, NVMM
- D.J.C. (Daniëlle) Komen, dermatoloog, werkzaam in het Westfriesgasthuis te Hoorn, NVDV
- Dr. W. (Wim) Opstelten, huisarts, werkzaam te Amersfoort, NHG
- Dr. C.L (Clementien) Vermont, kinderarts-infectioloog/immunoloog, werkzaam in het Erasmus MC – Sophia te Rotterdam, NVK
- F. (Freke) van Voorthuijsen, Stichting Kind & Ziekenhuis
- Dr. A.H.W. (Anke) Bruns, internist-infectioloog/hematoloog, werkzaam in het UMCU te Utrecht, NIV
- Dr. E. (Liesbeth) van Leeuwen, gynaecoloog, werkzaam in het Amsterdam UMC locatie AMC te Amsterdam, NVOG
- Dr. J.M. (Joke) Koelewijn, docent en onderzoeker, werkzaam bij Verloskunde Academie Amsterdam en Sanquin Research/Diagnostiek Amsterdam, KNOV
- Ir. E.A. (Alies) van Lier, epidemioloog, werkzaam bij het RIVM-EPI
- Dr. W.L.M. (Helma) Ruijs, arts maatschappij en gezondheid, werkzaam bij het RIVM-LCI
- Drs. P.K. (Kiki) Chung, AIOS medische microbiologie, werkzaam in het LUMC te Leiden
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bruns |
Internist-infectieoloog/hematoloog UMC Utrecht |
- |
Geen |
Geen actie |
|
Chung |
Arts-assistent in opleiding tot arts-microbioloog, Afdeling Medische Microbiologie, Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen actie |
|
Heikens |
Arts-microbioloog, Haaglanden Medisch Centrum |
Vakdeskundige RVA (betaald) |
Geen |
Geen actie |
|
Koelewijn |
Docent Verloskunde Academie Amsterdam, 44% fte |
Medewerker Tijdschrift voor Verloskundigen (schrijven referaten);betaald |
Geen |
Geen actie |
|
Komen |
Dermatoloog, Westfriesgasthuis |
Lid domeingroep Huidinfecties NVDV, onbetaald |
Geen |
Geen actie |
|
Opstelten |
Huisarts te Amersfoort eigen praktijk, 0,5 dag per week |
Adjunct-hoofdredacteur, NTVG Amsterdam 0,5 dag per week |
Geen |
Geen actie |
|
Ruijs |
Arts voor Maatschappij en Gezondheid / Infectieziektebestrijding |
geen |
Geen |
Geen actie |
|
Van Kampen (voorzitter) |
Arts-microbioloog, afdeling Viroscience, Erasmus MC |
Geen |
Geen
|
Geen actie. |
|
van Leeuwen |
Gynaecoloog, perinatoloog, Academisch Medisch Centrum Amsterdam |
Bestuurder stichting prenatale screening Amsterdam en omstreken (1 dag per week) |
Partner is gynaecoloog, ook geen financiële belangen |
Geen actie |
|
van Lier |
Functie: epidemioloog Rijksvaccinatieprogramma |
Geen nevenwerkzaamheden |
Geen |
Geen actie |
|
Vermont |
Kinderarts-infectioloog/immunoloog Erasmus MC |
Geen |
Geen |
Geen actie |
|
Voorthuijsen |
Kwaliteitsmedewerker Kind en ziekenhuis |
- |
Geen |
Geen actie |
|
Vossen |
Arts-microbioloog, afd. Medische Microbiologie, LUMC |
Voorzitter NVMM bestuur, portefeuille kwaliteit, onbetaald |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een werkgroeplid af te vaardigen namens Stichting Kind en Ziekenhuis in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. In het licht van de bevindingen van de Kwaliteits- & Doelmatigheidsagenda over aantallen beschikbare indicatoren en de moeilijkheid van het ontwikkelen van toepasselijke indicatoren, is er besloten (vooralsnog) geen indicatoren te ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVMM, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door NVK, KNOV, ZiNL, RIVM, NIV, NVMDL, NVDV, NVR, Kind en Ziekenhuis en Lareb via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming omtrent aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk-of-Bias(RoB)- tabellen. De gebruikte RoB-instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa – voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en ook deze worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
- Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
- Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
- Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
