Monitoring en surveillance bij vaattoegang voor hemodialyse
Uitgangsvraag
Wat is de beste nazorg voor een vaattoegang voor hemodialyse?
Aanbeveling
Voer voorafgaand aan elke cannulatie een lichamelijk onderzoek van de vaattoegang uit om disfunctie van een arterioveneuze fistel of graft op te sporen. Registreer daarnaast problemen die zich tijdens de dialysebehandeling voordoen. Deze vorm van nazorg wordt monitoring genoemd.
Overweeg flowmetingen te verrichten om asymptomatische stenoses in arterioveneuze fistels en grafts op te sporen met behulp van een dilutietechniek of duplexonderzoek. Verricht deze flowmetingen dan eens per 1 tot 3 maanden. Deze vorm van nazorg wordt surveillance genoemd.
Behandel een symptomatische stenose van een arterioveneuze fistel of graft die gepaard gaat met klinische indicatoren van flow disfunctie.
Overweeg de behandeling van een asymptomatische stenose van een arterioveneuze fistel of graft die niet gepaard gaat met klinische indicatoren van flow disfunctie bij een flow < 500 mL/min.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de waarde van surveillance als toevoeging op monitoring. Hiervoor werden klinische uitkomsten vergeleken tussen nazorg met monitoring in combinatie met surveillance met preventieve correctie van asymptomatische stenoses en nazorg met alleen monitoring met behandeling van symptomatische stenoses die leiden tot afwijkingen bij de dialysebehandeling.
Monitoring
Om disfunctie van een arterioveneuze fistel of graft te detecteren verrichten dialyseverpleegkundigen regelmatig een lichamelijk onderzoek van de vaattoegang en registreren zij problemen die zich tijdens de dialysebehandeling voordoen. Deze vorm van nazorg voor de vaattoegang wordt monitoring genoemd.
De vaattoegang voor hemodialyse dient voorafgaand aan de cannulatie te worden onderzocht door de dialyseverpleegkundige. Het lichamelijk onderzoek bestaat uit inspectie, palpatie en auscultatie. Met dit onderzoek kunnen diverse complicaties van de vaattoegang worden gedetecteerd: flow disfunctie, infectie, ischemie, thoracale centraal veneuze obstructie en aneurysmata van de afvoerende vene. Deze module richt zich op de detectie van flow disfunctie. Flow disfunctie kan zich ook uiten door problemen die zich voordoen tijdens de dialysebehandeling of door een verlaagde dialyse effectiviteit (zie tabel 1). Gezamenlijk vormen deze afwijkingen bij monitoring van de vaattoegang klinische indicatoren van flow disfunctie.
Tabel 1 Klinische indicatoren van flow disfunctie
|
1. Lichamelijk onderzoek |
Zwakke en/of discontinue thrill met alleen een systolische component |
|
Hoogklinkende en/of discontinue souffle met alleen een systolische component |
|
|
Hyperpulsatiele vaattoegang zonder veneuze collaps bij het opheffen van de arm |
|
|
Slappe vaattoegang met weinig augmentatie bij afdrukken van de veneuze afvloed |
|
|
2. Terugkerende problemen tijdens dialyse (tijdens minimaal 2 dialysesessies binnen 2 weken)
|
Nieuwe problemen bij cannulatie, wanneer dit eerder geen probleem was |
|
Onmogelijkheid om de beoogde dialyse flow te behalen bij een minimale arteriële druk van -250 mmHg en/of een maximale veneuze druk van +250 mmHg wanneer 16G of grotere naalden worden gebruikt |
|
|
Langdurige afdruktijd van de cannulatie plaatsen, die langer dan gebruikelijk is voor de patiënt |
|
|
3. Onverklaarde daling van de dialyse effectiviteit |
eKt/V < 1.2 of een daling > 0.2 (iedere 3 maanden gemeten, met bevestiging in de week nadat een daling van de dialyse effectiviteit is gemeten; of, bij online clearance monitoring, gemeten tijdens minimaal 2 dialysesessies in 2 weken) |
|
Ureum reductie ratio < 65% of een daling >15% (iedere maand gemeten, met bevestiging in de week nadat een daling van de dialyse effectiviteit is gemeten) |
Surveillance
Het is in de huidige Nederlandse praktijk gebruikelijk om regelmatig de flow in de arterioveneuze vaattoegang te meten met behulp van dilutietechnieken tijdens de dialyse behandeling. Hiermee kunnen stenoses in de vaattoegang worden gedetecteerd die geen problemen veroorzaken tijdens de dialysebehandeling. Deze vorm van nazorg voor de vaattoegang, waarbij met speciale apparatuur aanvullende metingen worden gedaan, wordt surveillance genoemd. Surveillance is bedoeld als aanvulling op monitoring van de vaattoegang door dialyseverpleegkundigen. Het is gebruikelijk om een afwijkende flowmeting tijdens de volgende dialysebehandeling te bevestigen. Naast flowmetingen met dilutietechnieken zijn er andere vormen van surveillance mogelijk. De flow in een arterioveneuze vaattoegang kan ook met duplex worden gemeten, waarbij de meting bij voorkeur in a. brachialis of in de afvoerende zijde van een arterioveneuze graft wordt uitgevoerd. Met duplex onderzoek kunnen ook de locatie en de ernst van de stenose in beeld worden gebracht. Daarnaast kunnen stenoses in de afvoerende vene worden gedetecteerd met behulp van dynamische of statische drukmetingen in het dialysecircuit. Omdat deze drukmetingen geen stenoses in het aanvoerende deel van vaattoegang kunnen detecteren, geeft de commissie de voorkeur aan surveillance met flowmetingen.
De meta-analyse op basis van de ERBP richtlijn laat zien dat surveillance trombose en verlies van arterioveneuze fistels lijkt te voorkomen. Deze conclusie is echter gebaseerd op een beperkt aantal gerandomiseerde studies met in totaal slechts 61 getromboseerde vaattoegangen. In de twee grootste onderzoeken werd surveillance uitgevoerd door 3-maandelijkse duplex onderzoeken van de vaattoegang en werden invasieve drukmetingen van de vaattoegang ten onrechte beschouwd als onderdeel van monitoring. Het wetenschappelijk bewijs voor surveillance is daarom van lage kwaliteit en slecht toepasbaar op de Nederlandse situatie. Surveillance van arterioveneuze grafts lijkt geen effect te hebben op trombose of het verlies van de vaattoegang. Ook hier geldt dat de invulling van de surveillance en monitoring strategie in de studies vaak slecht aansluit bij de Nederlandse praktijk. Surveillance van arterioveneuze fistels en grafts lijkt echter wel tot een toename van het aantal interventies te leiden. Er is geen informatie over het effect van surveillance van de vaattoegang op de kwaliteit van leven van dialysepatiënten. Hier ligt dus een kennislacune.
Na publicatie van de bovenstaande richtlijnen zijn de resultaten van de HASE-studie verschenen, waarin de effectiviteit van surveillance werd onderzocht (Salman, 2020). Dit was een cluster gerandomiseerde studie waarin het effect werd bestudeerd van toevoeging van maandelijkse surveillance door flowmeting met een dilutietechniek (Transonic) aan maandelijkse monitoring met alleen lichamelijk onderzoek om flow disfunctie van de vaattoegang op te sporen. In deze studie werden 436 patiënten geïncludeerd, van wie 85% een arterioveneuze fistel had en 15% een arterioveneuze graft. De follow-up duur was 2 jaar. In de surveillance groep werden patiënten verwezen voor behandeling van de onderliggende stenose bij een flow < 500 mL/min of bij een flow afname > 25% binnen 4 maanden tijd tot een flow < 1000 mL/min. Daarnaast werden patiënten in beide onderzoeksgroepen verwezen voor correctie van de onderliggende stenose bij klinische indicatoren van flow disfunctie. De primaire uitkomstmaat was trombose van de vaattoegang. In de surveillance groep traden minder tromboses op in vergelijking met de groep bij wie alleen monitoring werd uitgevoerd (0,10 versus 0,17 tromboses per patiënt-jaar; P=0,04). Bij de statistische analyse werd echter geen rekening gehouden met de cluster randomisatie. De hiervoor benodigde correctie leidt waarschijnlijk tot verlies van statistische significantie. Daarnaast beschouwt de werkgroep het verschil van 0,07 tromboses per patiënt-jaar als niet klinisch relevant. Het totaal aantal interventies aan de vaattoegang was 227 versus 203, waarbij diagnostische angiografieën niet werden meegerekend. Verlies van de vaattoegang en kwaliteit van leven werden niet gerapporteerd. Hierdoor leidt de HASE-studie niet tot nieuwe inzichten in het effect van surveillance van de vaattoegang.
In de komende jaren zal in Nederland de FLOW zorgevaluatie worden uitgevoerd. Dit is een gerandomiseerde multicenter studie waarin de effectiviteit van de huidige strategie van surveillance in combinatie met monitoring wordt vergeleken met nazorg door monitoring alleen. Vernauwingen in de vaattoegang worden dan alleen behandeld wanneer ze problemen tijdens de dialyse veroorzaken. De verwachting is dat de kennislacune door deze zorgevaluatie zal worden opgelost.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het behouden van een functionele vaattoegang is van groot belang voor dialysepatiënten. Aanvullende metingen om de functie van de vaattoegang te controleren worden daarom snel door patiënten geaccepteerd, zeker in het geval van flowmetingen met een dilutietechniek, die zonder extra belasting voor patiënten tijdens een dialysebehandeling kunnen worden uitgevoerd. De behandeling van een stenose van de vaattoegang wordt meestal verricht met een minimaal invasieve ballondilatatie die poliklinisch kan worden uitgevoerd. Deze ballondilatatie is vaak pijnlijk voor patiënten (gemiddelde VAS score 6 tot 7; Muromiya, 2015) en er is een risico op ruptuur van het behandelde bloedvat (bij 6% van de arterioveneuze fistels; Kornfield, 2009). De interventies om de bij surveillance gedetecteerde stenoses te corrigeren vormen dus wel een extra belasting voor patiënten. Bovendien zou ballondilatatie van stenoses van de vaattoegang kunnen leiden tot progressie van intima hyperplasie en daardoor op termijn verergering van de stenoses kunnen veroorzaken. De acceptatie van deze preventieve interventies hangt daarom af van de effectiviteit van de surveillance bij het voorkomen van trombose en verlies van de vaattoegang voor hemodialyse.
Kosten (middelenbeslag)
Geschat wordt dat in Nederland momenteel zo’n 8000 interventies per jaar worden verricht voor flow disfunctie van de vaattoegang voor hemodialyse, waarvan de kosten ruim 9 miljoen euro bedragen. Surveillance van arterioveneuze fistels lijkt tot ongeveer 30% meer interventies te leiden. De acceptatie van deze kosten hangt af van de effectiviteit van de surveillance bij het voorkomen van trombose en verlies van de vaattoegang voor hemodialyse.
Aanvaardbaarheid, haalbaarheid en implementatie
In vrijwel alle Nederlandse dialysecentra bestaat de nazorg voor de vaattoegang van dialysepatiënten uit monitoring in combinatie met surveillance door flowmetingen met een dilutietechniek. Er bestaat wel een aanzienlijke praktijkvariatie ten aanzien van de frequentie van surveillance en de drempelwaarde voor preventieve interventies. In een enquête onder Nederlandse dialysecentra was de gemiddelde drempelwaarde 448 mL/min (spreiding: 350 tot 600 mL/min) voor arterioveneuze fistels en 535 mL/min (spreiding: 300 tot 600 mL/min) voor arterioveneuze grafts. Deze gemiddelden komen overeen met de drempelwaarde van 500 mL/min die in de ESVS richtlijn wordt geadviseerd (Schmidli, 2018). De frequentie van de flowmetingen bij arterioveneuze fistels verschilde ook per ziekenhuis tussen de 1 en 3 maanden. Patiënten met arterioveneuze grafts werden vaker gemeten: 89% van de centra deed bij hen iedere maand een flowmeting.
In afwachting van de resultaten van de Nederlandse FLOW zorgevaluatie adviseert de commissie om de huidige praktijk te handhaven. Daarbij acht de commissie het wenselijk om de praktijkvariatie in de drempelwaarde voor behandeling van asymptomatische stenoses van de vaattoegang te beperken. De commissie sluit daarom aan bij de aanbeveling van de ESVS richtlijn om als drempelwaarde een flow van 500 mL/min te hanteren.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het wetenschappelijk bewijs voor surveillance van de vaattoegang voor hemodialyse is van lage kwaliteit en slecht toepasbaar op de Nederlandse situatie. Internationale richtlijnen komen op basis van dit bewijs tot verschillende aanbevelingen. De ESVS richtlijn adviseert om surveillance met flowmetingen en duplex uit te voeren en om bij arterioveneuze fistels met een flow < 500 mL/min over te gaan tot behandeling van de onderliggende stenose. De KDOQI richtlijn adviseert daarentegen om geen behandeling uit te voeren van stenoses op basis van surveillance zonder klinische indicatoren van flow disfunctie. De ERBP richtlijn neemt geen standpunt in over surveillance van arterioveneuze fistels en adviseert om geen surveillance te doen van arterioveneuze grafts. Deze verschillende interpretaties onderstrepen het belang van aanvullend onderzoek naar de beste nazorg voor arterioveneuze fistels en grafts.
In vrijwel alle Nederlandse dialysecentra bestaat de nazorg voor de vaattoegang van dialysepatiënten momenteel uit monitoring in combinatie met surveillance door flowmetingen met een dilutietechniek. In afwachting van de resultaten van de Nederlandse FLOW zorgevaluatie adviseert de commissie om de huidige praktijk te handhaven. Daarbij acht de commissie het wenselijk om de praktijkvariatie in de drempelwaarde voor behandeling van asymptomatische stenoses van de vaattoegang te beperken. De commissie sluit daarom aan bij de aanbeveling van de ESVS richtlijn om als drempelwaarde een flow van 500 mL/min te hanteren.
Inbedding in de zorg
Behalve deze geprioriteerde uitgangsvraag zijn er in de dagelijkse praktijk diverse andere aandachtspunten van belang, die kort zijn samengevat in de onderstaande tekst. De werkgroep sluit zich hiervoor aan bij de aanbevelingen van nationale en internationale richtlijnen. Voor verdere toelichting en onderbouwing wordt verwezen naar de betreffende richtlijnen.
Aanvullend onderzoek bij disfunctie van de vaattoegang
Wanneer op basis van monitoring of surveillance verdenking ontstaat op disfunctie van een arterioveneuze fistel of graft, kan deze afwijking met beeldvormend onderzoek worden geanalyseerd. Voor de analyse van flow disfunctie van de vaattoegang is duplexonderzoek het beeldvormend onderzoek van keuze (ESVS Clinical Practice Guidelines, recommendation 9). Het wordt afgeraden om een diagnostische angiografie te maken om disfunctie van de vaattoegang te analyseren wanneer het niet de bedoeling is om aansluitend een interventie uit te voeren (ESVS Clinical Practice Guidelines, recommendation 12). In Nederland wordt in het overgrote deel van de klinieken (82%) standaard een duplexonderzoek van de vaattoegang verricht voorafgaand aan een behandeling voor flow disfunctie. De criteria voor een hemodynamisch significante stenose bij duplexonderzoek zijn (Robbin, 2016):
- De diameter van het bloedvat is 50% kleiner dan de diameter van het bloedvat stroomopwaarts. Binnen 2 cm van de anastomose wordt de diameter vergeleken met de diameter van het bloedvat stroomafwaarts; en
- De ratio van de peak systolic velocity (PSV) op deze plaats ten opzichte van de PSV 2 cm stroomopwaarts is > 2,0. Binnen 2 cm van de anastomose moet de ratio van de PSV op de plaats van de stenose ten opzichte van de PSV 2 cm stroomafwaarts > 3,0 zijn.
Monitoring door patiënten
Op dagen dat patiënten niet dialyseren is het wenselijk dat patiënten hun vaattoegang zelf controleren. Patiënten kunnen een keer per dag met een stethoscoop luisteren of er een souffle is over de vaattoegang. Zo kan een trombose tijdig gedetecteerd en behandeld worden. Daarnaast kunnen patiënten kijken of er wondjes op de vaattoegang zijn die een voorbode kunnen zijn van levensbedreigende bloedingen. Patiënten die zelfstandig dialyseren zullen een grotere rol spelen bij de monitoring van de vaattoegang.
Onderbouwing
Achtergrond
Om disfunctie van een arterioveneuze fistel of graft te detecteren verrichten dialyseverpleegkundigen voor iedere dialysebehandeling een lichamelijk onderzoek van de vaattoegang en registreren zij problemen die zich tijdens de dialysebehandeling voordoen. Deze vorm van nazorg voor de vaattoegang wordt monitoring genoemd. Daarnaast is het in de huidige Nederlandse praktijk gebruikelijk om regelmatig de flow in de arterioveneuze fistel of graft te meten. Hiermee kunnen stenoses in de vaattoegang worden gedetecteerd die geen problemen veroorzaken tijdens de dialysebehandeling. Deze vorm van nazorg voor de vaattoegang, waarbij met speciale apparatuur aanvullende metingen worden gedaan, wordt surveillance genoemd. Asymptomatische stenoses die gedetecteerd zijn door middel van surveillance kunnen vervolgens preventief worden behandeld om trombose en verlies van de vaattoegang te voorkomen.
In deze module wordt beschreven hoe de nazorg voor de vaattoegang voor hemodialyse het beste vorm kan krijgen. Voor de behandeling van flow disfunctie wordt verwezen naar Module ‘Flow disfunctie’.
Conclusies / Summary of Findings
|
Low GRADE |
In patients with an arteriovenous fistula for hemodialysis, surveillance and pre-emptive stenosis correction may reduce access loss compared to treatment of stenosis based on clinical indicators.
Sources: (Ravani, 2016; Aragoncillo, 2017) |
|
Low GRADE |
In patients with an arteriovenous graft for hemodialysis, surveillance and pre-emptive stenosis correction may not reduce access loss to a clinically relevant extent compared to treatment of stenosis based on clinical indicators.
Sources: (Ravani, 2016; Aragoncillo, 2017) |
|
Low GRADE |
In patients with an arteriovenous fistula for hemodialysis, surveillance and pre-emptive stenosis correction may increase the access-related intervention rate compared to treatment of stenosis based on clinical indicators.
Sources: (Ravani, 2016; Aragoncillo, 2017) |
|
Low GRADE |
In patients with an arteriovenous graft for hemodialysis, surveillance and pre-emptive stenosis correction may not increase the access-related intervention rate compared to treatment of stenosis based on clinical indicators.
Sources: (Ravani, 2016) |
|
- GRADE |
It was not possible to draw conclusions or grade the level of evidence for the outcome (health-related) quality of life due to the absence data. |
|
Low GRADE |
In patients with an arteriovenous fistula for hemodialysis, surveillance and pre-emptive stenosis correction may reduce thrombosis compared to treatment of stenosis based on clinical indicators.
Sources: (Ravani, 2016; Aragoncillo, 2017) |
|
Low GRADE |
In patients with an arteriovenous graft for hemodialysis, surveillance and pre-emptive stenosis correction may not reduce thrombosis compared to treatment of stenosis based on clinical indicators.
Sources: (Ravani, 2016; Aragoncillo, 2017) |
Samenvatting literatuur
Description of studies
The Cochrane review by Ravani (2016) analyzed pre-emptive correction of hemodialysis arteriovenous access stenosis. The meta-analysis included RCTs and quasi-RCTs of pre-emptive stenosis correction in a mature vascular access (fistula and graft) evaluating the effects of strategies planned to identify (through periodic access surveillance) and correct pre-emptively a previously unidentified access stenosis (primary prevention) or the effects of pre-emptive correction of a known stenosis in a non-dysfunctional access (secondary prevention). Hemodialysis for acute kidney injury, central venous catheters, and studies comparing different approaches to salvage a dysfunctional, failing, or clotted access were excluded. The review included 14 studies with 1393 patients with an average age of 59 years.
In addition to the Cochrane review, the ERBP guideline included a RCT published after the Cochrane review. Aragoncillo (2017) investigated whether surveillance based on vascular access flow enhances arteriovenous fistula function and longevity in a Spanish open-label multicenter RCT and included 212 patients.
Results
Vascular access loss (critical)
The current analysis includes RCTs that investigated primary prevention. Analysis of vascular access loss is presented in figure 1, based on the studies selected by the systematic review by Gallieni (2019). The effect of surveillance on vascular access loss was different for arteriovenous fistulas and grafts. Based on 2 studies with 318 patients in total, for fistulas the relative risk (RR) for access loss was 0.50 in favor of surveillance, with a 95% confidence interval (CI) from 0.28 to 0.89. This is a clinically relevant difference. For 598 patients with grafts, the RR for access loss was 0.85 (95% CI 0.65 to 1.11) in favor of surveillance, but this was not clinically relevant.
Figure 1 Vascular access loss with surveillance and pre-emptive correction versus treatment of stenosis based on clinical indicators
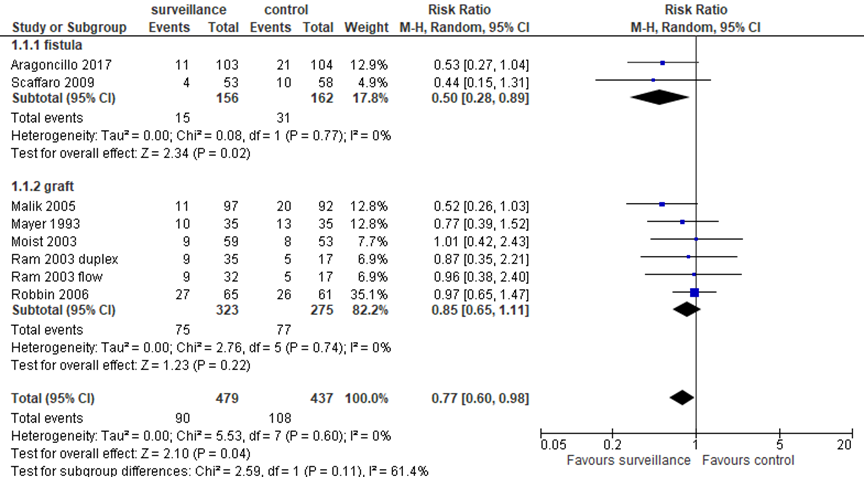
Mantel-Haenszel statistics, random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Access-related intervention rate (critical)
Based on the Cochrane review by Ravani (2016), access-related intervention rate was compared for pre-emptive versus deferred correction (angioplasty or surgical). The study by Aragoncillo (2017) was added. Results for grafts and fistulas were analysed separately in the current analysis (see figure 2). For fistulas, the pooled RR was 1.31 (95% CI: 0.81 to 2.11; N=454) in favor of the control group. This difference was considered clinically relevant, but was not statistically significant. For grafts, the pooled RR was 1.18 (95% CI: 0.89 to 1.56; N=723) in favor of controls. These differences were not considered clinically relevant or statistically significant.
Figure 2. Intervention rate with surveillance and pre-emptive correction versus treatment of stenosis based on clinical indicators.
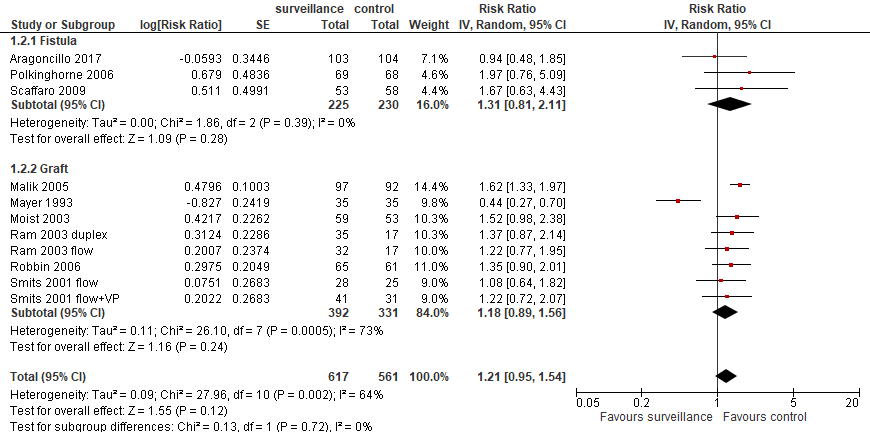
Inverse Variance statistics, random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; SE: standard error
Thrombosis
Thrombosis was reported in 5 (sub)studies for fistulas, as presented in figure 3. In 523 patients, RR was 0.57 (95% CI: 0.31 to 1.05) in favor of surveillance, which is clinically relevant but not statistically significant. In 9 (sub)studies with 569 patients with a graft, RR was 0.96 (95% CI 0.79 to 1.15) in favor of surveillance, which is not clinically relevant.
Figure 3. Thrombosis with surveillance and pre-emptive correction versus treatment of stenosis based on clinical indicators
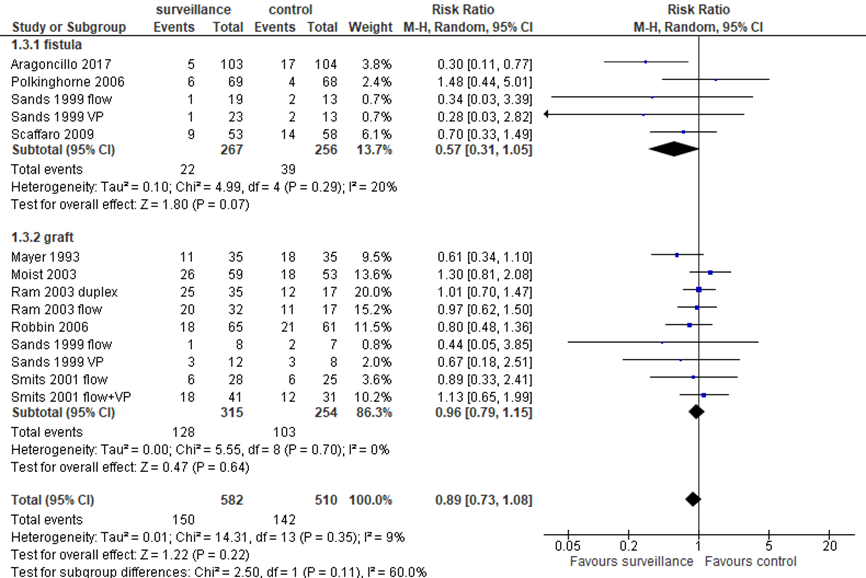
Mantel-Haenszel statistics, random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Health-related quality of life
The ERBP guideline did not report the outcome health-related quality of life.
Level of evidence of the literature
For all reported outcomes, the ERBP guideline considered the level of evidence to be low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
P: patients with an arteriovenous fistula or graft;
I: surveillance and pre-emptive intervention for vascular access stenosis not associated with clinical indicators;
C: treatment of vascular access stenosis when hemodialysis is affected;
O: health-related quality of life, vascular access function, vascular access thrombosis, patient satisfaction, complications.
Relevant outcomes
The guideline development group considered health-related quality of life and vascular access function (i.e. access-related intervention rates and the proportion of functional arteriovenous fistulas or grafts) as critical outcomes for decision making; and vascular access thrombosis, patient satisfaction, complications, and mortality as important outcomes for decision making.
The working group did not define the outcomes listed above a priori, but used the definitions used in the studies.
As minimal clinically (patient) important differences, the working group used 25% for dichotomous outcomes (risk ratio, RR), 0.8 interventions per year for the outcome AV access function, 10% of the maximum score for continuous outcomes (quality of life) and 0.5 for standardized mean differences. If available, hazard ratios (HR) were preferred over unadjusted RR and odds ratios (OR).
Search and select (Methods)
For other chapters in the current guideline, literature analysis of the Kidney disease outcomes quality initiative (KDOQI) clinical practice guideline for vascular access: 2019 update by the American National Kidney Foundation was used, if possible and applicable. However, for the current research question, the working group felt that the approach of the ERBP guideline, developed according to the GRADE toolbox, was more appropriate and comprehensive. Therefore, the scientific evidence analysis of the Clinical practice guideline on peri- and postoperative care of arteriovenous fistulas and grafts for haemodialysis in adults (Gallieni, 2019) was followed, which included a search of Cochrane systematic reviews and other literature published until April 2018. The level of evidence in the ERBP guideline was followed. We refer to the guideline for the search strategy. The working group interpreted the scientific evidence for the Dutch clinical situation. One Cochrane systematic review and one additional RCT was included in the analysis.
Referenties
- Aragoncillo I, Abad S, Caldés S, Amézquita Y, Vega A, Cirugeda A, Moratilla C, Ibeas J, Roca-Tey R, Fernández C, Macías N, Quiroga B, Blanco A, Villaverde M, Ruiz C, Martín B, Ruiz AM, Ampuero J, de Alvaro F, López-Gómez JM. Adding access blood flow surveillance reduces thrombosis and improves arteriovenous fistula patency: a randomized controlled trial. J Vasc Access. 2017 Jul 14;18(4):352-358. doi: 10.5301/jva.5000700. Epub 2017 Apr 20. PMID: 28430315.
- Gallieni M, Hollenbeck M, Inston N, Kumwenda M, Powell S, Tordoir J, Al Shakarchi J, Berger P, Bolignano D, Cassidy D, Chan TY, Dhondt A, Drechsler C, Ecder T, Finocchiaro P, Haller M, Hanko J, Heye S, Ibeas J, Jemcov T, Kershaw S, Khawaja A, Labriola L, Lomonte C, Malovrh M, Marti I Monros A, Matthew S, McGrogan D, Meyer T, Mikros S, Nistor I, Planken N, Roca-Tey R, Ross R, Troxler M, van der Veer S, Vanholder R, Vermassen F, Welander G, Wilmink T, Koobasi M, Fox J, Van Biesen W, Nagler E. Clinical practice guideline on peri- and postoperative care of arteriovenous fistulas and grafts for haemodialysis in adults. Nephrol Dial Transplant. 2019 Jun 1;34(Suppl 2):ii1-ii42. doi: 10.1093/ndt/gfz072. PMID: 31192372.
- Kornfield ZN, Kwak A, Soulen MC, Patel AA, Kobrin SM, Cohen RM, Mantell MD, Chittams JL, Trerotola SO. Incidence and management of percutaneous transluminal angioplasty-induced venous rupture in the “fistula first” era. J Vasc Interv Radiol. 2009;20(6):744-51. doi: 10.1016/j.jvir.2009.03.013.
- Lok CE, Huber TS, Lee T, et al; KDOQI Vascular Access Guideline Work Group. KDOQI clinical practice guideline for vascular access: 2019 update. Am J Kidney Dis. 2020;75(4)(suppl 2):S1-S164.
- Muromiya Y, Nagai K, Yokota N, Okada D, Suenaga T, Ueda Y, Kawahara K, Kanayama H, Minakuchi J, Tsuchida K. Factors associated with pain during vascular access intervention therapy. J Vasc Access 2015; 16 (Suppl 10): S43-S45 DOI: 10.5301/jva.5000425.
- Ravani P, Quinn RR, Oliver MJ, Karsanji DJ, James MT, MacRae JM, Palmer SC, Strippoli GF. Pre-emptive correction for haemodialysis arteriovenous access stenosis. Cochrane Database Syst Rev. 2016 Jan 7;2016(1):CD010709. doi: 10.1002/14651858.CD010709.pub2. PMID: 26741512; PMCID: PMC6486172.
- Robbin ML, Greene T, Cheung AK, Allon M, Berceli SA, Kaufman JS, et al. Arteriovenous fistula development in the first 6 weeks after creation. Radiology 2016;279:620-629.
- Salman L, Rizvi A, Contreras G, Manning C, Feustel PJ, Machado I, Briones PL, Jamal A, Bateman N, Martinez L, Tabbara M, Vazquez-Padron RI, Asif A. A Multicenter Randomized Clinical Trial of Hemodialysis Access Blood Flow Surveillance Compared to Standard of Care: The Hemodialysis Access Surveillance Evaluation (HASE) Study. Kidney Int Rep. 2020 Aug 4;5(11):1937-1944. doi: 10.1016/j.ekir.2020.07.034.
- Scaffaro LA, Bettio JA, Cavazzola SA, Campos BT, Burmeister JE, Pereira RM, Barcellos CS, Caramori P. Maintenance of hemodialysis arteriovenous fistulas by an interventional strategy: clinical and duplex ultrasonographic surveillance followed by transluminal angioplasty. J Ultrasound Med. 2009 Sep;28(9):1159-65. doi: 10.7863/jum.2009.28.9.1159. PMID: 19710213.
- Schmidli J, Widmer MK, Basile C, de Donato G, Gallieni M, Gibbons CP, Haage P, Hamilton G, Hedin U, Kamper L, Lazarides MK, Lindsey B, Mestres G, Pegoraro M, Roy J, Setacci C, Shemesh D, Tordoir JHM, van Loon M, Esvs Guidelines Committee, Kolh P, de Borst GJ, Chakfe N, Debus S, Hinchliffe R, Kakkos S, Koncar I, Lindholt J, Naylor R, Vega de Ceniga M, Vermassen F, Verzini F, Esvs Guidelines Reviewers, Mohaupt M, Ricco JB, Roca-Tey R. Editor's Choice - Vascular Access: 2018 Clinical Practice Guidelines of the European Society for Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg. 2018 Jun;55(6):757-818. doi: 10.1016/j.ejvs.2018.02.001. Epub 2018 May 2. PMID: 29730128
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-03-2022
Beoordeeld op geldigheid : 24-02-2022
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die een vaattoegang voor hemodialyse hebben of krijgen.
Werkgroep
- Dr. M.G.J. Snoeijs, vaatchirurg in Maastricht UMC+, NVvH (voorzitter)
- Dr. R.D. Toorop, vaatchirurg in UMC Utrecht, NVvH
- Dr. F. van Hoek, vaatchirurg in Radboudumc, NVvH
- Dr. M.J. Molegraaf, vaatchirurg in Isala ziekenhuis, NVvH
- Dr. M. Schouten, internist-nefroloog in Tergooi, NIV
- Dr. J.I. Rotmans, internist-nefroloog in LUMC, NIV
- Drs. R.J.B. Brans, radioloog in Maastricht UMC+, NVvR
- M. ter Meer, praktijkbegeleider dialyse en dialyseverpleegkundige OLVG, V&VN
- Drs. K. Prantl, Beleidsmedewerker kwaliteit & onderzoek, NVN
- H.Th. Hubbers, ervaringsdeskundige, NVN
Met ondersteuning van
- Dr. K.N.J. Burger, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot mei 2021)
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Snoeijs |
Vaatchirurg Maastricht UMC+ |
Geen |
Leading the Change, OASIS Zorgevaluatie (Wat is de beste vaattoegang voor oudere dialysepatienten?), rol als projectleider.
ZonMW, FLOW Zorgevaluatie (Is het detecteren en preventief behandelen van stenoses in de vaattoegang zinvol?), rol als projectleider.
Nierstichting, Shunt Simulatie Studie (Helpen computer simulaties van de flow bij het aanleggen van arterioveneuze fistels?), geen rol als projectleider.
Australasian Kidney Trials Network, VALID (Validatie van interventies aan de vaattoegang als care outcome measure), geen rol als projectleider.
Ik ben verantwoordelijk voor het expertisecentrum met topreferente zorgfunctie voor vaattoegangschirurgie in Maastricht UMC+. |
Geen actie |
|
Toorop |
Vaat-en transplantatiechirurg UMC Utrecht |
geen |
geen |
Geen actie |
|
Van Hoek |
Vaat- en transplantatiechirurg, Radboudumc |
geen |
geen |
Geen actie |
|
Molegraaf |
vaatchirurg MSB Isala Ziekenhuis |
geen |
geen |
Geen actie |
|
Rotmans |
Internist-nefroloog LUMC |
geen |
Uitvinder op meerdere patenten op het gebied van vaattoegang voor dialyse maar geen eigenaar (patenten zijn van LUMC). VIDI-grant ZonMW onderzoekssubsidie. Unrestricted research grant van Enceladus Pharmaceuticals (inmiddels afgerond) betrof een grant voor een investigator-initiated placebo-gecontroleerde klinische studie naar de effectiviteit van liposomaal prednisolon voor het verbeteren van shuntrijping (maturatie). Deze studie is afgerond maar nog niet gepubliceerd (is under review). De shunt maturatie bleek in beide groepen vergelijkbaar (dus geen gunstig effect van liposomaal prednison). |
Geen moduleschrijver voor uitgangsvragen met betrekking tot maturatie |
|
Schouten |
internist-nefroloog Tergooi |
Richtlijncommissie Nederlandse Federatie voor Nefrologie (betaald) |
geen |
Geen actie |
|
Brans |
Interventieradioloog Maastricht UMC+ |
Secretaris commissie accreditatie NVvR (onbetaald) |
geen |
Geen actie |
|
Ter Meer |
Praktijk begeleider dialyse OLVG te Amsterdam en |
Gast docent Amstel Academie voor opleiding dialyseverpleegundige en dialyse assistent betaald (verzorgen van lessen over vaattoegang) Gast docent albeda college opleiding vaattoegang tot 2021 betaald (verzorgen van de les VSA) Presentatie voor firma Baxter 4 x betaald, presentatie over nieuwe ontwikkelingen op gebied van vaattoegangszorg voor verpleegkundigen. |
geen |
Geen actie |
|
Prantl |
beleidsmedewerker kwaliteit & onderzoek NVN |
geen |
Namens de NVN heb ik meegedacht met de ontwikkeling van de Vascoscope, een nieuw echoapparaat dat het aanprikken waarschijnlijk kan vereenvoudigen. Inmiddels geen betrokkenheid meer bij dit onderzoek. |
Geen actie |
|
Hubbers |
Ervaringsdeskundige |
Geen |
Namens de NVN heb ik als vrijwilliger twee keer deelgenomen in de werkgroep Vascoscoop in het UMC Utrecht. Doel hiervan was te komen tot een handzaam echoapparaatje dat zowel een verpleegkundige als patiënt makkelijk zelf kan bedienen/gebruiken om misprikken bij vaattoegang voor hemodialyse te voorkomen. Nadien heb ik het doorontwikkelde apparaat twee keer gezien waarvan 1x getest in de praktijk. |
Geen actie |
|
Burger |
Senior adviseur bij Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
|
Ruiter |
Adviseur bij Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door Patiëntenfederatie Nederland en andere relevante patiëntenorganisaties uit te nodigen voor een schriftelijke knelpuntenanalyse. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen. Bovendien werd het patiëntperspectief vertegenwoordigd door afvaardiging van patiëntenorganisatie Nierpatiënten Vereniging Nederland in de werkgroep. Tot slot werden de modules voor commentaar voorgelegd aan Patiëntenfederatie Nederland en andere relevante patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module 1 Operatieve besluitvorming |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2 Perioperatieve zorg |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 3 Gebruik en verzorging |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 4 Monitoring en surveillance |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 5 Flow disfunctie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 6 Infectie van de vaattoegang |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 7 Ischemie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 8 High-flow vaattoegang |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 9 Ongebruikte vaattoegang |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 10 Randvoorwaarden (Organisatie van zorg) |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor de vaattoegang voor hemodialyse. Tevens zijn er knelpunten aangedragen door stakeholders door middel van een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek. Daarnaast vond de werkgroep het wenselijk om aan de overwegingen een sectie toe te voegen die de uitgangsvraag in een bredere context plaatst. In dit onderdeel “inbedding in de zorg” zijn op basis van bestaande internationale richtlijnen aandachtpunten behandeld die van belang zijn in de dagelijkse praktijk. Voor verdere toelichting en onderbouwing wordt verwezen naar de betreffende richtlijnen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.


