Beeldvorming VUR en andere structurele afwijkingen bij UWI
Uitgangsvraag
Wat is de meest effectieve teststrategie (beeldvorming) voor het opsporen van VUR en andere structurele afwijkingen met behandelconsequenties na een UWI?
Aanbeveling
Kinderen onder de 6 maanden
Verricht een echografie na een eerste UWI1.
Verricht bij kinderen die niet opknappen 48 h na start van adequate antibiotische behandeling direct een echografie.
Herhaal de echografie met een goed gevulde blaas indien de blaas ten tijde van de echografie niet gevuld was.
1 UWI met en zonder koorts, aangezien kinderen onder de 6 maanden een pyelonefritis zonder koorts kunnen hebben
Verricht een MCUG bij kinderen met de volgende risicofactoren voor VUR graad III-V:
- Kinderen met een afwijkende echo. Afwijkend: verwijde ureters met of zonder hydronefrose, parenchymafwijkingen en/of dikke blaaswandafwijkingen
Van belang is dat de blaas voldoende gevuld is.
Overweeg een MCUG bij de volgende risicofactoren:
- een non E. coli verwekker
- urosepsis
- abnormale mictie
- verhoogd kreatinine
Verricht geen MCUG na een 1e UWI bij kinderen met een echografie van goede kwaliteit bij gevulde blaas zonder afwijkingen en zonder bijkomende risicofactoren.
Herhaal een echografie bij een recidief van een UWI met koorts binnen 6 maanden na de eerste UWI.
Verricht een MCUG bij een recidiverende UWI als de echo afwijkend is.
Overweeg een MCUG bij een recidief UWI of bij aanwezigheid van een andere risicofactor, gezien de hoge kans op VUR graad III-V.
Bij alle kinderen na doorgemaakte UWI geldt dat er een verhoogde kans op recidieven is, en verhoogde alertheid (ook door ouders) gevraagd is om een recidief zo vroeg mogelijk te herkennen en adequaat te behandelen.
Kinderen 6-36 maanden met eerste UWI met koorts
Verricht echografie in de groep kinderen met een verhoogde kans op structurele afwijkingen (CAKUT) of VUR graad III-V. Dit zijn de kinderen met de volgende kenmerken (conform boven):
- een non E. coli verwekker
- urosepsis
- abdominale massa
- abnormale mictie (hierbij ook denken aan onderliggende blaas- en darmfunctie stoornis)
- geen klinische respons binnen 48 h na start van adequate antibiotische therapie
- verhoogd kreatinine
Verricht een echografie bij recidiverende UWIs. Met name bij kinderen onder 1 jaar is een vroeg recidief een risicofactor voor structurele afwijkingen.
Verricht bij kinderen die niet opknappen 48 h na start van adequate antibiotische behandeling direct een echografie.
Overweeg een MCUG bij kinderen met
- afwijkende echografie (afwijkend: verwijde ureters met of zonder hydronefrose, parenchymafwijkingen en/of dikke blaaswandafwijkingen); van belang is dat de blaas voldoende gevuld is,
- risicofactoren voor VUR graad III-V of
- een recidiverende UWI.
Kinderen > 36 maanden met eerste UWI met koorts
Verricht echografie in de groep kinderen met een verhoogde kans op onderliggende problematiek, zoals dysfunctioneel plassen.
Bepaal ook het blaasresidu na uitplassen.
Dit zijn de kinderen met de volgende kenmerken (conform boven):
- non E. coli verwekker
- abnormale mictie (hierbij ook denken aan onderliggende blaas- en darmfunctie stoornis)
- recidiverende UWIs
- geen klinische respons binnen 48 h na start van adequate antibiotische therapie, urosepsis, abdominale massa of verhoogd kreatinine. Verricht bij deze laatste groep de echografie in de acute fase.
Overleg over verrichten van MCUG bij sterke verdenking op hooggradige VUR op echo.
Zie 'Stroomschema beeldvorming UWI' voor visuele weergave beeldvorming voor verschillende leeftijdsgroepen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De kwaliteit van het bewijs is matig, en er is veel onzekerheid omtrent de number needed to detect gezien wisselende a priori kansen (afhankelijk van de geincludeerde patientengroep) en wisselende definities van afwijkende echografie of risicofactoren.
Het verrichten van een echografie is weinig belastend en biedt de mogelijkheid om structurele afwijkingen en VUR graad III-V op te sporen die antenataal gemist zijn. Een voldoende kwaliteit van de echografie is hiervoor vereist.
Bij de afweging omtrent het verrichten van een MCUG (of DSMA als screening, en aansluitend MCUG in kinderen met afwijkingen op DMSA) worden de voor- en nadelen van opsporen van VUR graad III-V, en de nadelen van het missen van VUR graad III-V betrokken. De testeigenschappen en de number needed to detect, die afhankelijk is van de vooraf kans, worden meegenomen in de besluitvorming.
Het belang van het opsporen van VUR graad III-V bestaat erin, dat deze kinderen in aanmerking komen voor antibiotische profylaxe wat leidt tot een vermindering van het aantal infectierecidieven (maar geen zeker aangetoond effect heeft op het ontstaan van parenchymschade, module 'Kans op VUR en andere anatomische afwijkingen bij een normale prenatale echo bij UWI'). Daarnaast zijn deze kinderen onder poliklinische controle zodat bij obstipatie en dysfunctional voiding kan worden behandeld (deze zijn geassocieerd met een verhoogde infectiekans- link naar richtlijn Urine-incontinentie bij kinderen).
Bovendien wordt op tekenen van nierschade gelet en op termijn een DMSA verricht (module 'Lange termijn gevolgen en follow up UWI').
Belangrijke nadeel van antibiotische profylaxe is resistentieontwikkeling en doorbraakinfecties met resistente bacteriën en dagelijkse toediening van medicijnen door ouders.
De grootste nadelen van het verrichten van een MCUG en DMSA zijn belasting van de patiënt door het discomfort door katheter of infuus. Ook stralenbelasting speelt een rol.
Bij kinderen bij wie geen MCUG is verricht, zal in ongeveer 12% van de kinderen in het eerste jaar opnieuw een UWI optreden en 17% in de eerste 2 jaar (Soccorso, 2010; Alberici, 2019; Keren 2015). Door bij deze groep opnieuw een echografie van goede kwaliteit en met gevulde blaas te doen om gemiste CAKUT en VUR op te sporen en bij afwijkingen alsnog een MCUG te verrichten kunnen deze worden opgespoord. Een voorwaarde is wel dat ouders en behandelaars alert zijn op het verhoogde recidiefrisico van UWIs en het belang van vroegtijdige behandeling en diagnose hiervan kennen.
Onderbouwing
Achtergrond
Kinderen die een urineweginfectie (UWI) hebben doorgemaakt hebben een hogere kans op een onderliggende structurele afwijking, zoals VUR. In verband met dit verhoogde risico is de vraag wie van hen profiteren van beeldvorming om VUR of eventuele andere structurele veranderingen op te sporen voor de klinische besluitvorming ten aanzien van complicaties op lange termijn.
De werkgroep heeft zich gericht op reflux graad III-V, aangezien hooggradige reflux minder vaak spontaan verdwijnt (link naar 3.3), samengaat met hogere kans op recidiverende UWIs en een hogere kans op (ernstige) parenchymschade (Keren, 2015), en gepaard gaat met een hoger risico op lange termijn gevolgen als hypertensie en verminderde nierfunctie (zie de module 'Lange termijn gevolgen en follow up UWI'). Deze effecten worden versterkt in aanwezigheid van blaas- en darmfunctie stoornis (onder andere Keren, 2015).
Interventies bij kinderen met VUR graad III-V verminderen het aantal UWI recidieven, maar mogelijk niet de kans op parenchymschade. Antibiotische profylaxe heeft ook nadelige consequenties, met name op het gebied van resistentieontwikkeling. De gouden standaard voor het opsporen van VUR is MCUG. DMSA kan worden gebruikt om parenchymschade op te sporen, en in de kinderen die schade hebben een MCUG te doen om VUR op te sporen.
Conclusies
1. Betrouwbaarheid opsporen afwijkingen (VUR)
|
Laag GRADE |
Echografie heeft, afhankelijk van de VUR graad, een gepoolde sensitiviteit van 59-70% voor VUR graad III-V, en een gepoolde sensitiviteit van 37 tot 44% voor VUR graad I-V.
Bronnen: (Shaikh, 2016; Saltchychev, 2016; Hsu 2016; Pauchard, 2017) |
2. Betrouwbaarheid opsporen afwijkingen (VUR en littekens)
|
Redelijk GRADE |
De top down approach (TDA) geeft waarschijnlijk de hoogste sensitiviteit (85%) met de hoogste number needed to detect van 14 voor DMSA voor VUR graad III-V en 7,3 voor aansluitende MCUG in patienten met parenchymschade. De American Academy of Pediatrics (AAP) strategie geeft de laagste sensitiviteit (38%) met een number needed to detect van 4,2 voor MCUG voor het opsporen van VUR graad III-V. De National Institute of Clinical Excellence (NICE) strategie heeft een sensitiviteit van 50% met een Number needed to detect van 2,4 voor kinderen< 6maanden, en 7 voor kinderen 6 tot 36 maanden.
Welke strategie wordt gekozen hangt af van de voordelen van het opsporen van VUR graad III-V, het gevolg van het in eerste instantie missen van VUR graad III-V, de belasting en kosten van diagnostiek en de number needed to detect die afhankelijk is van de a priori kans.
Bronnen: (La Scola, 2013) |
|
Redelijk GRADE |
De kosten zijn het hoogst bij toepassing van de top down approach (TDA) strategie en het laagst bij toepassing van strategieën, waarbij het verrichten van MCUG (of DMSA met daarna in subgroep MCUG) afhangt van de uitkomst van de echografie. De stralingsbelasting is afhankelijk van de gekozen strategie en kan variëren van 0 wanneer alleen een echografie wordt gemaakt tot maximaal 4,2 mSv wanneer zowel een MCUG als een DMSA scan aan de test strategie worden toegevoegd.
Bronnen: (La Scola, 2013) |
TDA (top down approach) strategie: geen echografie, MCUG en late DMSA bij positieve acute DMSA
AAP (American Academy of Pediatrics) strategie: echografie, MCUG bij positieve echografie
NICE strategie: echografie bij alle kinderen <6 maanden; bij atypische UWI bij kinderen ≥6 maanden, MCUG bij positieve echografie en/of atypische UWI bij kinderen <-6 maanden; bij risicofactoren bij kinderen ≥6 maanden, late DMSA bij atypische UWI.
|
Laag GRADE |
Het is onduidelijk hoe groot de kans is op VUR graad III-V bij verschillende risicogroepen. Studies rapporteren verschillende definities van afwijkende echografie en risicofactoren, en depatiëntengroepen verschillen.
Bij een vooraf kans van 10% op VUR III-V, is bij kinderen zonder risicofactoren (dus E. Coli verwekker) en een normale echografie na uwi de kans op VUR III-V zeer laag (<2 %; Pauchard, 2017). Ureterdilatatie en non E. Coli zijn belangrijke risicofactoren, en de kans op VUR graad III-V wordt afhankelijk van de a priori kans en echografie definities op 20-30% geschat als1 van deze risicofactoren aanwezig is. Als een kind meerdere risicofactoren heeft, stijgt de kans op VUR graad III-V tot 40-50%. Dat geldt ook bij het optreden van een recidief in het eerste levensjaar.
Bronnen: (Pauchard, 2017, Alberici, 2019, module 'Kans op VUR en andere anatomische afwijkingen bij een normale prenatale echo'). |
Samenvatting literatuur
Beschrijving studies
Echografie ter opsporing van VUR
Shaikh (2016) verrichtte een Cochrane meta-analyse naar echografie als screening voor VUR en VUR graad IIIV op MCUG bij kinderen met een UWI. De literatuursearch (1985-2016) leverde 20 studies naar echografie op. Echografie werd in alle studies binnen 10 dagen na opname verricht, MCUG doorgaans 1 tot 6 weken na een UWI. Elke echografische afwijking werd als positief beschouwd, gevonden afwijkingen werden tevens specifiek beschreven. Voor accuratesse werd uitgegaan van een pre-test waarschijnlijkheid van 40% voor VUR en 13% voor VUR graad III-V. In zeven studies was sprake van incomplete test data (2 tot 19%). De analyses voor DMSA zijn geëxcludeerd voor deze uitgangsvraag, omdat enkel studies naar DMSA < 1 maand na een UWI werden beschreven.
Saltychev (2016) verrichtte een meta-analyse naar echografie als screening voor alle graden VUR bij kinderen na een eerste UWI includeerde 14 studies, waarvan 8 overlappend met de review van Shaikh (2016). Studies waarbij conventionele echografie en MCUG werden vergeleken voor het aantonen van VUR bij kinderen onder de 16 jaar werden geïncludeerd. In de meeste studies varieerde de leeftijd tussen de 1 en 24 maanden oud. Positieve echo was gedefinieerd als enkel of primair dilatatie van de urinewegen van elke graad. De timing van beeldvorming werd niet beschreven. Prenatale anomalieën en niet-conventionele echografie werden geëxcludeerd.
Pauchard (2017) onderzocht in een observationeel onderzoek 122 kinderen jonger dan 3 maanden (gemiddelde leeftijd was 43±25 dagen; 80% jongen), met een eerste, UWI met koorts. Patiënten die bekend waren met afwijkingen aan nieren en/of urinewegen werden geëxcludeerd. Alle kinderen ondergingen een MCUG en een renale echografie.
Hsu (2016) onderzocht in een prospectief cohortonderzoek 388 kinderen jonger dan 2 maanden (N=61) en tussen 2 en 24 maanden (N=327) die in het ziekenhuis werden opgenomen met een eerste UWI. Alle kinderen ondergingen renale echografie, DMSA en MCUG.
Beeldvorming strategieën
La Scola (2013) bekeek retrospectief de accuratesse, stralingsbelasting en kosten van vijf verschillende diagnostische strategieën voor kinderen tussen 2 maanden en 3 jaar oud met een eerste febriele UWI. Kinderen met ernstige sepsis, dehydratie, braken en verminderde kreatinineklaring warden geëxcludeerd.
In tabel 1 zijn deze strategieën samengevat. Primaire uitkomstmaten waren VUR (alle graden en graad 3 tot 5) en UWI-gerelateerde littekens. Secundaire uitkomstmaten waren economische kosten en de stralingsbelasting per strategie. Van de 304 geïncludeerde kinderen was de mediane leeftijd 7 maanden en 64% meisje. Abnormale echobevindingen werden gezien in 42 kinderen (14%).
Tabel 1 Samenvatting van de strategieën geëvalueerd in La Scola (Bron: La Scola, 2013)
|
Guidelines |
Year |
Ultrasound
|
Voiding Cystogram |
Late DMSA Scan |
|
RCH |
2006 |
Yes |
If boys <6 mo and/or positive ultrasonography |
No |
|
NICE |
2007 |
|
|
|
|
<6 mo
|
|
Yes
|
If positive ultrasonography and/or atypical UTIa
|
If atypical UTIa
|
|
≥6 mo |
|
If atypical UTIa |
If children with risk factorsb |
If atypical UTIa |
|
TDA |
2007 |
No |
If positive acute DMSA |
If positive acute DMSA |
|
AAP |
2011 |
Yes |
If positive ultrasonography |
No |
|
ISPN |
2011 |
Yes |
If positive ultrasonography and/or children with risk factorsc |
If positive ultrasonography and/or VUR |
AAP, American Academy of Pediatrics; ISPN, Italian Society of Pediatric Nephrology; NICE, National Institute of Clinical Excellence; RCH, Royal Children’s Hospital of Melbourne; TDA, top down approach.
a Seriously ill, poor urine flow, abdominal or bladder mass, raised creatinine, septicemia, failure to respond to correct antibiotic treatment within 48 hours, or infection with non–Escherichia coli organisms.
b Dilatation on ultrasonography, poor urine flow, non–E. coli infection, or family history of VUR.
c Abnormal prenatal ultrasonography of the urinary tract, family history of VUR, septicemia, renal failure, age<6 months in a male infant, likely noncompliance of the family, abnormal bladder emptying, no clinical response to correct antibiotic treatment within 72 h, or non–E. coli infection. Abnormal ultrasonography: hydronephrosis, ureteric dilatation, hypoplasia, duplicated system, bladder abnormalities.
Narchi (2015) bekeek in een retrospectief cohort van kinderen tussen de 2 maanden en 2 jaar oud met een eerste febriele UWI hoeveel afwijkingen aan de nieren werden gemist bij het toepassen van de NICE (2007) en AAP (2011) richtlijnen. Echografie werd 3 tot 14 dagen na de diagnose UWI verricht om hydronefrose of anatomische afwijkingen op te sporen. Contrast MCUG werd na ongeveer 1 maand na de diagnose uitgevoerd, en een DMSA scan werd 6 maanden na de diagnose gedaan om littekens in de nieren op te sporen. Er werden 43 kinderen geïncludeerd met een mediane leeftijd van 7,6 maanden, 65% was meisje.
Soccorso (2010) bekeek retrospectief de rol van MCUG bij kinderen onder 1 jaar oud met een eerste febriele UWI. Echografie werd tijdens de opname verricht, DMSA minimaal 3 maanden na de UWI en MCUG op een ongedefinieerd moment. Er werden 427 kinderen geïncludeerd (40% meisje, mediane leeftijd 5 maanden) en opgesplitst in 2 groepen: groep A met normale echografie (n=354) en groep B met abnormale echografie (n=73). De meest voorkomende echografische afwijkingen waren matige tot ernstige hydroureteronefrose en duplex systeem. In beide groepen werd gekeken naar het aantal patiënten met littekens op DMSA en vervolgens naar het verschil in aantal patiënten met VUR alle graden in af- en aanwezigheid van littekens.
Wong (2010) bekeek retrospectief de voorspellende waarde van verschillende beeldvorming strategieën die aanbevolen worden in de NICE richtlijn voor het identificeren van urologische afwijkingen (afwijkingen die chirurgische of medische ingreep vereisen) voor kinderen tot 2 jaar oud met een eerste febriele UWI. In totaal werden 820 kinderen, verspreid over 9 pediatrische afdelingen van regionale ziekenhuizen in China, geïncludeerd. Echografie en MCUG werd zo snel mogelijk uitgevoerd na succesvolle behandeling (niet nader gespecificeerd). DMSA werd na 4 tot 6 maanden gedaan als VUR (alle graden) was geïdentificeerd op de MCUG. Voor de overige groep was DMSA optioneel. De mediane leeftijd bij de diagnose van eerste febriele UWI was 3,8 maanden en 30% meisje.
Recent werd een retrospectieve studie van Alberici (2019) gepubliceerd naar de effectiviteit van de Italiaanse richtlijn om kinderen met VUR graad III-V of parenchymafwijkingen op te sporen en de rol van risicofactoren. Er werden 414 kinderen tussen 2 en 36 maanden met een eerste UWI retrospectief geanalyseerd. Allen kregen een echografie en patiënten met 1 of meer risicofactoren voor VUR of een afwijkende echografie kregen een MCUG. Ook kinderen met een recidief kregen een MCUG. 35% had geen verdere risicofactoren en een normale echografie, 65% had een afwijkende echografie of andere risicofactoren zoals gedefinieerd in de ISPN guideline (zie La Scola, 2013). Bij 84% was E-coli de verwekker van UWI. Bij 23% van hen kwam VUR graad III-V voor.
Resultaten
Echografie
1. Betrouwbaarheid opsporen afwijkingen (VUR)
Shaikh (2016) verrichtte een bivariabele analyse met 20 studies voor het detecteren van VUR. De summary sensitiviteit was 0,44 (95% BI 0,34 tot 0,54) en de specificiteit 0,78 (95% BI 0,68 tot 0,86). De post-test waarschijnlijkheid van VUR bij positieve echografie was 57%, bij negatieve echografie 32%. Er was sprake van heterogeniteit, echter rapporteerde geen enkele studie een hoge accuratesse. Sensitiviteitsanalyses lieten een nog lagere specificiteit (0,72) zien voor studies met een laag biasrisico. Voor VUR graad III-V (n=11) liet de bivariabele analyse een summary sensitiviteit van 0,59 (95% CI 0,45 tot 0,72) en een specificiteit van 0,79 (95% BI 0,65 tot 0,87) zien. Hierbij werd een post-test waarschijnlijkheid van hoge graad VUR van 30% berekend bij positieve echografie en 8% bij negatieve echografie. NB. De percentages pretest zijn hoger bij Shaikh dan bij LaScola. Een verklaring hiervoor kan zijn dat het een geselecteerde groep kinderen betreft met een hoger a priori risico: het is niet bekend is of een prenatale echografie is verricht, alleen dat kinderen geen bekende afwijkingen hebben.
Saltchychev (2016) vond een sensitiviteit van echo om VUR I-V aan te tonen tussen 0,11 en 0,94 met een gepoolde sensitiviteit van 0,37 (95% BI 0,34 tot 0,40) met substantiële heterogeniteit (I2 96%). De specificiteit varieerde tussen 0,40 en 0,94 met een gepoolde specificiteit van 0,81 (95% BI 0,80 tot 0,83) en een I2 van 97% (figuur 1). De negatief voorspellende waarde was 0,75 (95% BI 0,65 tot 0,86).
In beide studies werden geen resultaten gerapporteerd met betrekking tot belasting van het kind of kosten.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat betrouwbaarheid voor opsporen VUR is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias door patiënten selectie) en tegenstrijdige resultaten (inconsistentie, betrouwbaarheidsintervallen overlappen niet en statistische heterogeniteit).
Strategieën
2. Betrouwbaarheid opsporen afwijkingen (VUR en littekens)
In de retrospectieve analyse van La Scola (2013) had 22% van de kinderen (66/304) VUR, waarvan 8,5% (26/304) VUR graad III-V. Voor alle 5 strategieën werd berekend hoeveel VUR gemist werden. Het percentage gemiste VUR graad III-V was voor RCH, NICE, TDA, AAP en ISPN respectievelijk: 46%, 50%, 15%, 61% en 27%. De diagnostische accuratesse per strategie voor het opsporen van VUR graad III-V is weergegeven in figuur 1. TDA beveelt aan om de resultaten van een acute DMSA scan te gebruiken voor de vervolgstappen. Daarmee werden de meeste kinderen met VUR graad III-Vopgespoord (sensitiviteit 0,85), maar kregen de meeste kinderen zonder VUR 3 tot 5 een DMSA (number needed to detect van 14 voor DSMA en 7 voor MCUG). De andere strategieën bevelen vervolgtesten aan na een positieve echografie of aanwezigheid van risicofactoren. De ISPN richtlijn had een sensitiviteit van 73%, met een number needed to detect (MCUG voor VUR graad III-V) van 6. Met AAP werden de minste kinderen met VUR graad III-Vopgespoord (sensitiviteit 0,38), met NICE werd het grootte percentage kinderen zonder VUR ook als zodanig getest (specificiteit 0,90).
Als de getallen gerapporteerd in La Scola omgerekend worden naar het aantal kinderen dat een MCUG zou moeten krijgen om bij 1 kind VUR graad III-V op te sporen (number needed to detect), is dat voor de strategieën AAP 4,2 (42/10), ISPN 6,1 (116/19), NICE 2,4 (26/11) bij kinderen <6 maanden en 7 (14/2) bij kinderen >6 maanden, RCH 6,6 (92/14) en TDA 7,3 (160/22).
Tabel 2 Vergelijking van de verschillende test strategieën ten aanzien van sensitiviteit en number needed to detect (NntD), bij kinderen <3 jaar met 1e UWI en normale antenatale echo (La Scola, 2012)
|
Test strategie |
|
Parenchymafwijkingen |
|
|
|
|
NNtD |
Sensitiviteit |
NNtD |
Sensitiviteit |
|
NICE |
<6 maanden: MCUG 26/11 |
13/26 (50%) |
DMSA 11/7 |
17/45 (38%) |
|
|
6-36 maanden: MCUG 14/2 |
|
DMSA 47/10 |
|
|
|
|
|
|
|
|
AAP |
MCUG 42/10 |
10/26 (39%) |
nvt |
0% |
|
TDA |
DMSA 304/22 MCUG 160/22 |
22/26 (85%) |
DMSA 160/45 |
45/45 (100%) |
|
RCH |
MCUG 92/14 |
14/26 (54%) |
nvt |
0% |
|
ISPN |
MCUG 116/19 |
19/26 (73%) |
DMSA 56/20 |
20/45 (47%) |
In de retrospectieve analyse van Narchi (2015) werd bij 32% van de kinderen (14/43) hydronefrose op de echo gezien, allemaal graad 2. Bij 37% van de kinderen (16/43) werd VUR graad II-V gezien op de MCUG. Bij 58% van de kinderen (25/43) werd parenchymschade op DMSA gevonden. Van de kinderen met parenchymschade op DMSA zou 44% gemist worden (11/25) met NICE en 100% met AAP (geen van de kinderen zou DMSA scan ondergaan). Van de kinderen met VUR-graad 2 tot 5 zou 63% (10/16) gemist worden met NICE en 56% (9/16) met AAP. De number needed to detect werden niet gegeven, en graad II werd ook als relevante uitkomstmaat gerekend.
In een retrospectieve review (Soccorso, 2010) werden littekens op DMSA gezien in 38/354 (11%) in groep A (normale echografie, 83%), waarvan 21/38 (55%) VUR-graad I-V op MCUG liet zien. Van de patiënten met een normale DMSA in deze groep werd VUR gezien in 48/316 (15%). In totaal werd bij 69/354 (19%) VUR, doorgaans laaggradig, gezien in groep A waarbij allen werden behandeld met antibiotische profylaxe en geen doorbraak UWI werden gezien.
In groep B (abnormale echografie,17%) werd parenchymschade gezien in 43/73 (59%) van de patiënten, waarvan 23 (53%) met VUR. Echter van de patiënten zonder parenchymschade in groep B werd VUR gezien in 22/30 (73%) patiënten. In totaal had 45/73 (62%) VUR in groep B, waarvan bij follow-up sprake van doorbraak UWIs was in 12% en noodzaak tot operatieve behandeling in 5%.
In de studie van Wong (2010) werden bij 73 van de 820 kinderen (9%) abnormale echobevindingen gezien. Van de 65 kinderen met een verwijd renale bekken werd bij 27 kinderen (42%) VUR-graad I-V gevonden, waarvan 21 kinderen met VUR-graad 3 tot 5. Echter, van de 747 kinderen met normale echobevindingen hadden 168 kinderen (22%) ook VUR, waarvan 65 kinderen VUR graad III-V (8,7%). De MCUG was abnormaal bij 203 kinderen (25%), 195 kinderen (24%) hadden VUR, waarvan 86 kinderen graad 3 tot 5. De DMSA werd gedaan bij 612 kinderen, na een mediaan van 6 maanden, om parenchymschade vast te stellen. 66 kinderen (11%) hadden littekens op DMSA in verschillende graden. Het risico op abnormale DMSA was hoger bij patiënten met een hogere VUR-graad. De mate van littekens was ook erger bij patiënten met een hogere VUR-graad. Als het protocol van de NICE-richtlijn werd toegepast op het cohort, was de negatieve voorspellende waarde (NPV) voor urologische afwijkingen 92,6% voor jongens en 100% bij meisjes jonger dan 6 maanden. Bij kinderen in de leeftijd tussen 6 en 24 maanden was de NPV 91% voor jongens en 97,3% voor meisjes
In de studie van Alberici (2019) werd overall bij 23% van de kinderen met normale prenatale echografie VUR graad III-V gevonden. Bij afwijkende echografie werd bij 39% VUR graad III-V gediagnosticeerd (vaak ook in aanwezigheid van andere RF), bij afwijkende echo zonder risicofactoren werd 29% VUR gediagnosticeerd, en bij kinderen met normale echografie zonder risicofactoren na FU van 24 maanden 9% VUR graad III-V. In de kinderen met E. coli verwekker (meestal in aanwezigheid van andere RF) werd bij 31% VUR graad III-V gediagnosticeerd. Bij niet E. coli was dit 54%.
Bij de kinderen zonder risicofactoren werd geen MCUG verricht. Bij 18% van hen trad bij een mediane FU van 24 maanden een recidief van UWI met koorts op en werd alsnog een MCUG verricht. In 44% van hen werd VUR-graad III-V aangetoond.
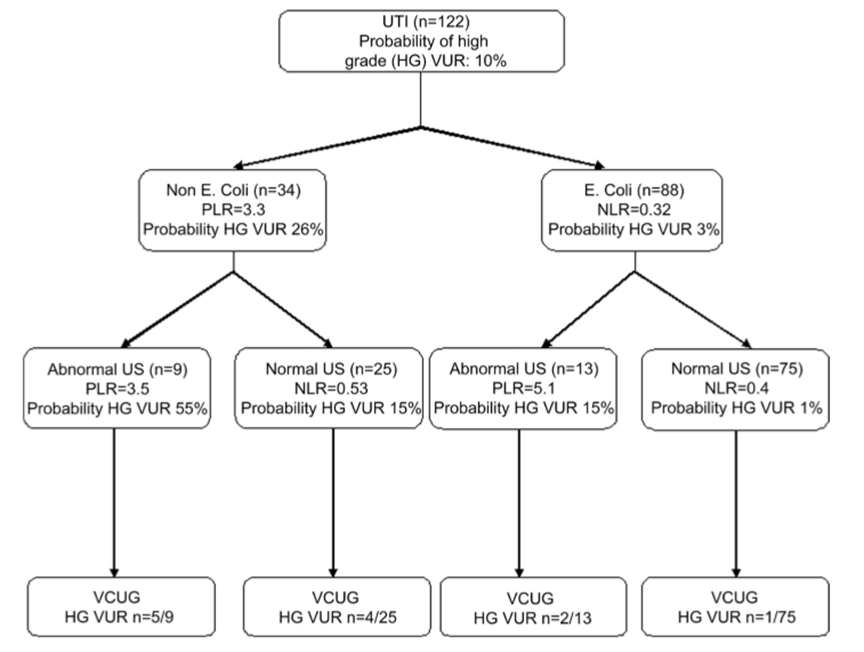
In de studie van Pauchard (2017) had 20% van de kinderen (25/122) VUR, waarvan 9,8% (12/122) VUR-graad 3 tot 5. In de groep waarbij E-coli de verwekker was van UWI (88/122) was de kans op VUR-graad 3 tot 5 veel kleiner (3%) dan in de groep waarbij E-coli niet de verwekker was (26%). De kans op VUR-graad 3 tot 5 was het grootst in de groep waarbij E-coli niet de verwekker was en een abnormale echo (55%) (figuur 1). In de groep waarbij E-coli de verwekker was met een abnormale echo was de kans op VUR-graad 3 tot 5 15%.
Figuur 1 Kans op VUR bij non E. coli versus E. coli en normale versus abnormale echo (bron: Pauchard, 2017)
Kosten en belasting van de patiënt
La Scola (2013) berekende de kosten die benodigd zouden zijn voor het uitvoeren van de verschillende protocollen en vergeleek dit met de kosten van een totaal-protocol waarbij alle kinderen alle testen zouden ondergaan. De kosten per patiënt zouden voor een totaal protocol €249 zijn. Voor het toepassen van RCH, NICE, TDA, AAP en ISPN op deze patiëntengroep zouden de gemiddelde kosten per kind respectievelijk €108, €88, €172, € en €145 zijn.
Bovendien werd de stralingsbelasting berekend van elke strategie. De stralingsbelasting voor een bedraagt 1 mSv voor een DMSA scan en 0,5 tot 3,2 mSv voor een MCUG. Voor het toepassen van RCH, NICE, TDA, AAP en ISPN op deze patiëntengroep zou de stralingsbelasting per kind respectievelijk 0,3; 0,5; 2,05; 0,14 en 0,75 mSv zijn.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat betrouwbaarheid voor opsporen van afwijkingen is met 1 niveau verlaagd vanwege imprecisie (brede betrouwbaarheidsintervallen).
De bewijskracht voor de uitkomstmaten kosten en belasting van de patiënt voor opsporen van afwijkingen zijn met 1 niveau verlaagd vanwege imprecisie (berekening gebaseerd op kleine aantallen patiënten).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de meest effectieve beeldvorming teststrategie voor het opsporen van VUR en andere structurele afwijkingen na een doorgemaakte UWI met betrekking tot betrouwbaarheid, kosten en patiëntbelasting?
P: kinderen met een UWI;
I1: renale echografie;
I2: late dimercaptosuccinic acid (DMSA) scan (DMSA >6 maanden na infectie);
I3: beeldvorming strategie;
C: mictiecystourethrografie (MCUG) (voor opsporen VUR); andere beeldvorming strategie
O: betrouwbaarheid opsporen afwijkingen (VUR, verwijde ureteren, structurele afwijkingen), belasting, kosten.
Relevante uitkomstmaten
De werkgroep achtte het onderkennen van VUR graad III-V van belang in verband met een verhoogde kans op UWIs, parenchymschade en lange termijngevolgen als hypertensie, verminderde nierfunctie en zwangerschapscomplicaties.
De betrouwbaarheid van de test, de belasting en kosten ervan per patiënt en number needed to detect en de gevolgen van het initieel missen van de diagnose VUR graad III-V werden afgewogen t.o.v. de positieve consequenties van het opsporen van VUR graad III-V.
De gevolgen van testen zijn weergegeven in onderstaande tabel.
Tabel 3 Positieve en negatieve gevolgen van het wel en niet opsporen van VUR graad III-V met MCUG als gouden standaard
|
Opsporen VUR graad III-V na eerste UWI |
|
|
Positief gevolg |
Negatief gevolg |
|
|
Belasting van MCUG (Number needed to detect) of DMSA en MCUG (afhankelijk van strategie). Belasting MCUG: catheterplaatsing en 20 minuten stilliggen, stralenblootstelling (maximaal 0,44 mSv) DMSA: infuus en stralenblootstelling (maximaal 0,44 mSv) Echografie: weinig belastend |
|
Antibiotische profylaxe/endoscopische interventie met verminderde kans op recidief UWI, met geen duidelijk effect op parenchymschade (UV 4.14) |
Toegenomen frequentie UWIs met resistente bacteriën (Selekman, 2018) |
|
Mogelijk alerter op recidieven |
|
|
Mogelijk meer aandacht voor dysfunctional voiding |
|
|
Controle ivm lange termijngevolgen VUR graad III-V (hypertensie, verminderde nierfunctie, zwangerschapscomplicaties) en intermediate uitkomst parenchymschade (module 4) |
|
|
Missen VUR graad III-V door niet uitvoeren MCUG |
|
|
Positief gevolg |
Negatief gevolg |
|
|
Verhoogde kans op recidief UWI door niet geven van antibiotische profylaxe en delay in diagnose door pas na 2-3e UWI of op andere gronden doorvoeren MCUG module 3.3 |
Opsporen andere afwijkingen binnen CAKUT (Congenital anomalies kidney urinary tract) spectrum
Het opsporen van prenataal niet opgespoorde CAKUT afwijkingen is van belang omdat een subgroep van deze met een verhoogde kans op UWIs samen kunnen gaan en tot een verminderde nierfunctie kunnen leiden. Chirurgische en conservatieve interventies kunnen dit risico verminderen.
Afwijkingen, die kunnen leiden tot UWIs zijn pelviene-ureterale overgang stenosen, primaire niet refluerende mega-ureter en de vaak antenataal al gediagnosticeerde urethrakleppen. Geschat wordt dat ongeveer 40% van de afwijkingen al antenataal wordt opgespoord (Beetz, 2018; Choi, 2016).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 04 september 2018 met relevante zoektermen gezocht naar systematische reviews, RCT’s en observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 168 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: SRs en RCT’s die renale echografie, late DMSA scan, of een combinatie van testen vergeleken met mictiecystogram en ten minste één van de volgende uitkomstmaten rapporteerden: betrouwbaarheid opsporen van afwijkingen (VUR, verwijde ureteren, structurele afwijkingen), belasting, kosten. Op basis van titel en abstract werden in eerste instantie 73 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 67 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 6 studies definitief geselecteerd.
Daar zijn 3 studies aan toegevoegd: een zeer recente uit 2019 die op basis hiervan buiten de search viel, en 2 die niet werd geselecteerd omdat gezocht werd op meta-analyse of RCT.
Zes onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Alberici, I., La Manna, A., Pennesi, M., Starc, M., Scozzola, F., Nicolini, G., ... & Maringhini, S. (2019). First urinary tract infections in children: the role of the risk factors proposed by the Italian recommendations. Acta Paediatrica, 108(3), 544-550.
- Beetz, R. (2018). Konnatale Dilatationen der oberen Harnwege. Der Urologe, 57(8), 969-986.
- Choi, H. A., Lee, D. J., Shin, S. M., Lee, Y. K., Ko, S. Y., & Park, S. W. (2016). The prenatal and postnatal incidence of congenital anomalies of the kidneys and urinary tract (CAKUT) detected by ultrasound. Childhood Kidney Diseases, 20(1), 29-32.
- Hsu, C. C., Tsai, J. D., Ku, M. S., Chen, S. M., Liao, P. F., Hung, T. W., ... & Sheu, J. N. (2016). Antimicrobial Resistance and Diagnostic Imaging in Infants Younger Than 2 Months Old Hospitalized With a First Febrile Urinary Tract Infection. The Pediatric infectious disease journal, 35(8), 840-845.
- La Scola, C., De Mutiis, C., Hewitt, I. K., Puccio, G., Toffolo, A., Zucchetta, P., ... & Montini, G. (2013). Different guidelines for imaging after first UTI in febrile infants: yield, cost, and radiation. Pediatrics, peds-2012.
- Narchi, H., Marah, M., Khan, A. A., Al-Amri, A., & Al-Shibli, A. (2015). Renal tract abnormalities missed in a historical cohort of young children with UTI if the NICE and AAP imaging guidelines were applied. Journal of pediatric urology, 11(5), 252-e1.
- Saltychev, M., Ristola, M. T., Laimi, K., & Hurme, T. (2016). Accuracy of ultrasonography in predicting vesicoureteral reflux in children: A meta-analysis. Scandinavian journal of urology, 50(4), 239-245.
- Selekman, R. E., Shapiro, D. J., Boscardin, J., Williams, G., Craig, J. C., Brandström, P., ... & Copp, H. L. (2018). Uropathogen Resistance and Antibiotic Prophylaxis: A Meta-analysis. Pediatrics, 142(1), e20180119.
- Shaikh, N., Spingarn, R. B., & Hum, S. W. (2016). Dimercaptosuccinic acid scan or ultrasound in screening for vesicoureteral reflux among children with urinary tract infections. The Cochrane Library.
- Soccorso, G., Wagstaff, J., Blakey, K., Moss, G. D., Broadley, P., Roberts, J. P., & Godbole, P. (2010). Investigating febrile UTI in infants: Is a cystogram necessary?. Journal of pediatric urology, 6(2), 148-152.
- Wong, S. N., Tse, N. K. C., Lee, K. P., Yuen, S. F., Leung, L. C. K., Pau, B. C. K., ... & Yip, C. M. S. (2010). Evaluating different imaging strategies in children after first febrile urinary tract infection. Pediatric Nephrology, 25(10), 2083-2091.
Evidence tabellen
Evidence table for systematic reviews of diagnostic test accuracy studies
|
Study reference |
Study characteristics |
Patient characteristics |
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Shaikh, 2016
|
SR and meta-analysis for US
Literature search up to March 2016
A: Alon 1986 B: Alon 1999 C: Calisti 2005 D: Cleper 2004 E: El Shenoufy 2009 F: Goldman 2000 G: Hoberman 2003 H: Ismaili 2011 I: Kim 2006 J: Lee 2009a K: Lee 2012a L: Lopez Sastre 2007 M: Mahant 2002 N: Montini 2009 O: Morin 1999 P: Muller 2009 Q: Sheu 2013 R: Soylu 2007 S: Supavekin 2013a T: Tsai 2012
Study design: Cross-sectional and cohort,
Setting and Country: Hospital, outpatient clinic
Source of funding and conflicts of interest: Not described
|
Inclusion criteria SR: children from 0-19 with culture confirmed UTI, US compared to VCUG
Exclusion criteria SR: case-control studies
20 studies included
Important patient characteristics:
N, mean age, A: n81, 0.2-12yr, symp UTI B: n100, 0.1-18yr, fUTI C: n147, 1-24mo, first UTI D: n64, 0-1mo, neonatal UTI E: n45, 1-5yr, symp UTI G: n309, 1-24mo, first fUTI H: n209, 0.2-204 mo, first fUTI I: n52, first fUTI J: n220, 0-2yr, first fUTI, M>F K: n618, 0-12yr, first fUTI L: n301, 4-40d, neonatal UTI M: n170, <5 yr, first UTI N: n300, 0.1-2yr, first fUTI O: n70, 0.1-17yr, first fUTI P: n325, <1yr, first UTI Q: n473, <2yr, first fUTI R: n88, 0-204mo, fUTI S: n67, 0.02-7 yr, m 1yr, first UTI T: n231, 0-3mo, first fUTI
|
Describe index test and cut-off point(s):
Renal US
US with any abnormality was considered positive.
A: <4 days admission B: during admission, only “major” US abnormalities C: Unclear timing D: during admission E: 1 wk after UTI G: <48 hours, dilatation H: <48 hours I: <72 hours J: immediately after diagnosis K: <4 days admission L: after infectious episode M: during admission N: < 10 days O: on admission P: 1 wk after diagnosis Q: <3 days admission R: Unclear timing S: Unclear timing T: <3 days admission, increased bladder wall thickness were counted as abnormal
|
Describe reference test and cut-off point(s):
VCUG
A: in 4-6 wks after completing antibiotics B: in 4-6 wks after fUTI C: Unclear timing D: in 3-4 wks after UTI E: in 4-6 wks after UTI G: in 1 mo after UTI H: in 1 mo after UTI I: in 1-4 wks after UTI J: after resolution of fever K: in 2 wks after resolution of fever L: after infectious episode M: Unclear timing N: in 2 mo O: in 4 wks P: in 2 mo Q: in 4 wks after UTI R: Unclear timing S: Unclear timing T: 7-10 days after end of antibiotic therapy
Prevalence (%) (based on refence test at specified cut-off point)
For accuracy calculation a pretest probability of 40% was assumed for VUR and of 13% for VUR 3-5. |
Endpoint of follow-up:
Not applicable
For how many participants were no complete outcome data available? N (%) B: 24 (19%) F: 1 (2%) G: 7 (2%) L: 39 (13%) M: 8 (5%) N: 17 (4%)
Reasons for incomplete outcome data described? G: 5/7 abnormality without dilatation L: 10/301 no US 39/301 no VCUG M: 8/70 no VCUG N: 17/438 no US/VCUG O: 35/325 no US 12/325 no VCUG |
VUR grade 1-5 Sensitivity / specificity (95% CI) A: 0.39 (0.17, 0.64) / 0.18 (0.02, 0.52) B: 0.21 (0.10, 0.37) / 0.97 (0.89, 1.00) C: 0.58 (0.42, 0.72) / 0.70 (0.60, 0.78) D: 0.46 (0.19, 0.75) / 0.86 (0.74, 0.94) E: 0.38 (0.14, 0.68) / 0.94 (0.79, 0.99) G: 0.12 (0.07, 0.20) / 0.89 (0.83, 0.93) H: 0.34 (0.22, 0.48) / 0.87 (0.80, 0.91) I: 0.60 (0.32, 0.84) / 1.00 (0.91, 1.00) J: 0.70 (0.58, 0.81) / 0.71 (0.63, 0.78) K: 0.60 (0.50, 0.68) /0.72 (0.67, 0.76) L: 0.46 (0.33, 0.60) / 0.68 (0.61, 0.75) M: 0.40 (0.24, 0.58) 0.76 (0.68, 0.83) N: 0.27 (0.17, 0.40) / 0.91 (0.87, 0.95) O: 0.91 (0.71, 0.99) / 0.15 (0.06, 0.28) P: 0.56 (0.41, 0.70) / 0.62 (0.55, 0.68) Q: 0.39 (0.31, 0.47) / 0.78 (0.73, 0.83) R: 0.13 (0.04, 0.28) / 0.92 (0.81, 0.98) S: 0.53 (0.28, 0.77) / 0.72 (0.58, 0.84) T: 0.67 (0.53, 0.78) / 0.40 (0.32, 0.48)
Bivariate analysis: 0.44 (34 to 0.54) / 0.78 (0.68 to 0.86)
Accuracy in detecting VUR Post-test probability of VUR given a negative test: 32%
VUR grade 3-5 (n=11 studies) Sensitivity / specificity (95% CI) A: 0.56 (0.21, 0.86) / 0.45 (0.23, 0.68) E: 0.57 (0.18, 0.90) / 0.92 (0.79, 0.98) G: 0.24 (0.13, 0.38) / 0.91 (0.87, 0.94) I: 0.82 (0.48, 0.98) / 1.00 (0.91, 1.00) J: 0.86 (0.72, 0.95) / 0.69 (0.62, 0.76) K: 0.79 (0.66, 0.88) / 0.70 (0.66, 0.74) M: 0.46 (0.19, 0.75) / 0.74 (0.67, 0.81) P: 0.63 (0.42, 0.81) / 0.61 (0.55, 0.67) Q: 0.52 (0.41, 0.62) / 0.79 (0.74, 0.83) R: 0.19 (0.05, 0.42) / 0.93 (0.83, 0.98) T: 0.77 (0.61, 0.89) / 0.41 (0.34, 0.49)
Bivariate analysis: 0.59 (0.45 to 0.72) / 0.79 (0.65 to 0.87) Heterogeneity: Substantial between studies, yet only Kim 2006 reported sensitivity and specificity values close to 90%. Collection with urine bags; sensitivity with and without bags was 0.78 (0.55 to 0.91) and 0.49 (0.33 to 0.66), P = 0.045. Sensitivity analyses: NS difference Accuracy in detecting VUR 3-5 Post-test probability given a negative test: 8% |
Study quality (ROB): A: low B: high, pt selection + flow C: low D: high, pt selection E: low, applicability concerns G: low H: low, but did not exclude pt with known urinary tract abnormalities I: high, pt selection J: high, index test + selection K: high, pt selection L: low, applicability concerns M: low N: low, applicability concerns O: low, applicability concerns P: low Q: low R: high, pt selection S: low T: low, applicability concerns
Place of the index test in the clinical pathway: replacement/ triage Heterogeneity Although there was substantial heterogeneity between studies, none of the studies reported high sensitivity and specificity values. None of the covariates investigated in the meta-regression had a significant effect on either the sensitivity or specificity values. Limiting the analysis to low risk of bias studies resulted in an even lower summary specificity value (0.72, 95% CI 0.59 to 0.82).
Author’s conclusion Since the US lacks accuracy, this test cannot replace the VCUG in detecting VUR. Nor can it serve to rule in or rule out VUR or high-grade VUR.
DMSA analyses were only performed on acute DMSA scans (< 1 mo after UTI) and thus excluded for this research question.
|
|
Saltychev, 2016
|
SR and meta-analysis for US
Literature search up to June 2015
A: Oostenbrink 2000 B: Mahant 2002 C: Hoberman 2003 D: Zamir 2004 E: Alshamsan 2009 F: Lee 2009 G: Montini 2009 H: Müller 2009 I: Tse 2009 J: Preda 2010 K: Wong 2010 L: Ismaili 2011 M: Tsai 2012 N: Kido 2015
Study design: observational studies (prospective and retrospective)
Setting and Country: Netherlands, United States, Canada, Israel, Saudi Arabia, China, South Korea, Italy, Hong Kong, Belgium, Taiwan, Japan, Sweden
Source of funding and conflicts of interest: No conflicts, funds not reported
|
Inclusion criteria SR: children < 16yrs with first UTI, abnormal finding US, compared with MCUG
Exclusion criteria SR: focused exclusively on a particular grade of VUR; results per kidney and not per person; investigated prenatal anomalies of the urinary tract; used other than conventional RBUS
14 studies included
Important patient characteristics:
N, mean age A: n140, m 1.4yr B: n162, m 85d C: n309, 1-24mo D: n255, m 16mo E: n130, m 22mo F: n220,m 4.5mo G: n300, m 7 mo H: n191, m 2.7mo M/7.2mo F I: n98, > 6mo J: n290, m 2.7mo M/ 7.4mo F K: n820, m 3.8mo L: n209, m 10mo M: n220, m 60d N: n200, m 4.5mo
|
Describe index test and cut-off point(s):
Renal US
Abnormal finding on US, defined exclusively or primarily as urinary tract dilatation of any grade
An Area Under the Curve (AUC) of 0.91–1 was considered excellent, 0.81–0.9 good, 0.71–0.8 fair, 0.61–0.7 poor and 0.51–0.6 a failure.
A likelihood ratio greater than 10 was considered large, 5–10 moderate, 2–5 small and 1–2 minimal increase in the likelihood of disease, 1 no change, and 1–0.5 minimal, 0.5–0.1 small, 0.2–0.1 moderate and less than 0.1 a large decrease in the likelihood of disease
|
Describe reference test and cut-off point(s):
VCUG
Timing not reported |
Endpoint of follow-up: Not applicable
For how many participants were no complete outcome data available? unknown
|
VUR grade 1-5 Sensitivity / specificity A: 0.57 / 0.81 B: 0.32 / 0.82 C: 0.10 / 0.90 D: 0.16 / 0.88 E: 0.50 / 0.80 F: 0.70 / 0.71 G: 0.27 / 0.91 H: 0.44 / 0.89 I: 0.11 / 0.94 J: 0.56 / 0.62 K: 0.14 / 0.94 L: 0.34 / 0.87 M: 0.67 / 0.40 N: 0.94 / 0.56
Range sensitivity: 0.11 to 0.94 Range specificity: 0.40 to 0.94
Pooled characteristic Random effects model
Sensitivity 0.37 (95% CI 0.34 to 0.40) Specificity 0.81 (95% CI 0.80 to 0.83) Heterogeneity I2: 97%
Positive likelihood ratio Negative likelihood ratio 0.75 (95% CI 0.65 to 0.86), I2: 88% AUC
|
Study quality (ROB): A: low risk B: high, applicability concern C: low D: low E: low F: low G: low H: low I: high, applicability concern J: low K: low L: high, applicability concern M: low N: high, applicability concern
Place of the index test in the clinical pathway: replacement/ triage
Heterogeneity: can probably be explained by the differences in the age and gender distribution of the samples, diverse guidelines used in different settings, the subjective nature of sonography, the differences in sonography machines and transducers, the dissimilar definitions of ‘‘normal’’ or ‘‘abnormal’’ RBUS findings, and the dissimilarities in definitions of the grade of dilatation of the urinary tract and the grade of VUR. Diverse timing of RBUS and VCUG may also cause inconsistencies in the reported figures.
Author’s conclusion: they found RBUS to be specific (0.8) but insensitive (0.4) and AUC was only fair. There is no evidence that RBUS should be recommended as a test to predict a VUR in children with their first UTI. |
DMSA, dimercaptosuccinic acid; fUTI, febrile urinary tract infection; pt, patient; US, ultrasound
Evidence table for diagnostic test accuracy studies
DMSA ,dimercaptosuccinic acid; fUTI, febrile urinary tract infection; UTI, urinary tract infection; VCUG, voiding cystourethrography.
Table of quality assessment for systematic reviews of diagnostic studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Shaikh, 2016 |
Unclear, any US abnormality considered positive |
Yes |
Yes |
Yes |
Yes |
Yes |
No, not reported |
Yes |
|
Saltychev, 2016 |
Yes |
Yes |
No |
Yes, however definition of index and reference not described per study |
Yes |
Yes |
No, due to software limitations |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate (in relation to the research question to be answered in the clinical guideline) and predefined.
- Search period and strategy should be described; at least Medline searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to the research question (PICO) should be reported.
- Quality of individual studies should be assessed using a quality scoring tool or checklist (preferably QUADAS-2; COSMIN checklist for measuring instruments) and taken into account in the evidence synthesis.
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, diagnostic tests (strategy) to allow pooling? For pooled data: at least 5 studies available for pooling; assessment of statistical heterogeneity and, more importantly (see Note), assessment of the reasons for heterogeneity (if present)? Note: sensitivity and specificity depend on the situation in which the test is being used and the thresholds that have been set, and sensitivity and specificity are correlated; therefore, the use of heterogeneity statistics (p-values; I2) is problematic, and rather than testing whether heterogeneity is present, heterogeneity should be assessed by eye-balling (degree of overlap of confidence intervals in Forest plot), and the reasons for heterogeneity should be examined.
- There is no clear evidence for publication bias in diagnostic studies, and an ongoing discussion on which statistical method should be used. Tests to identify publication bias are likely to give false-positive results, among available tests, Deeks’ test is most valid. Irrespective of the use of statistical methods, you may score “Yes” if the authors discuss the potential risk of publication bias.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias assessment diagnostic accuracy studies (QUADAS II, 2011)
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
La Scola, 2013 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Soccorso, 2010 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear, no exclusion criteria
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes, blinded researcher
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes, blinded researcher
|
Was there an appropriate interval between index test(s) and reference standard? Unclear, timing VCUG unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Unclear
|
Are there concerns that the included patients do not match the review question? Patient selection not clearly described
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
Wong, 2010 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Unclear, full imaging studies used as gold standard
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? No, those were excluded
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
Judgments on risk of bias are dependent on the research question: some items are more likely to introduce bias than others, and may be given more weight in the final conclusion on the overall risk of bias per domain:
Patient selection:
- Consecutive or random sample has a low risk to introduce bias.
- A case control design is very likely to overestimate accuracy and thus introduce bias.
- Inappropriate exclusion is likely to introduce bias.
Index test:
- This item is similar to “blinding” in intervention studies. The potential for bias is related to the subjectivity of index test interpretation and the order of testing.
- Selecting the test threshold to optimise sensitivity and/or specificity may lead to overoptimistic estimates of test performance and introduce bias.
Reference standard:
- When the reference standard is not 100% sensitive and 100% specific, disagreements between the index test and reference standard may be incorrect, which increases the risk of bias.
- This item is similar to “blinding” in intervention studies. The potential for bias is related to the subjectivity of index test interpretation and the order of testing.
Flow and timing:
- If there is a delay or if treatment is started between index test and reference standard, misclassification may occur due to recovery or deterioration of the condition, which increases the risk of bias.
- If the results of the index test influence the decision on whether to perform the reference standard or which reference standard is used, estimated diagnostic accuracy may be biased.
- All patients who were recruited into the study should be included in the analysis, if not, the risk of bias is increased.
Judgement on applicability:
Patient selection: there may be concerns regarding applicability if patients included in the study differ from those targeted by the review question, in terms of severity of the target condition, demographic features, presence of differential diagnosis or co-morbidity, setting of the study and previous testing protocols.
Index test: if index tests methods differ from those specified in the review question there may be concerns regarding applicability.
Reference standard: the reference standard may be free of bias but the target condition that it defines may differ from the target condition specified in the review question.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Weitz 2017 |
populatie met UPJO als risicogroep voor VUR, echter volgens Joop nauwelijks relatie tussen UWI en UPJO |
|
Springarn 2013 |
protocol Shaikh 2014 |
|
Paintsil 2013 |
narrative review guidelines, mogelijk interessant voor overwegingen |
|
Nagler 2011 |
interventie VUR |
|
Mantadakis 2011 |
meta-analyse van acccuratesse DMSA (<3 maanden na UWI) voor hoge VUR vs MCUG |
|
Leroy 2011 |
geen beeldvorming, procalcitonine als predictor voor VUR |
|
Shaikh 2010 |
andere outcome: DMSA defecten ipv VUR |
|
Yilmaz 2018 |
andere outcome: geen accuratesse |
|
Shabbeer 2018 |
kopie artikel Hung 2016 |
|
Freeman 2018 |
vergelijking MRI als vervanging voor DMSA voor renal scarring ipv MCUG |
|
Alizadeh 2018 |
andere populatie (UPJO) en andere interventie (biomarker) |
|
Schaeffer 2017 |
accuratesse en grading variability van MCUG, niet relevant voor deze vraag want MCUG = reference test toch? Wellicht wel interresant voor de overwegingen |
|
Prasad 2017 |
narrative review |
|
Pastore 2017 |
andere interventie: geen beeldvormingstrategie vergeleken |
|
Kawai 2017 |
andere outcome: geen accuratesse VUR |
|
Babu 2017 |
narrative review |
|
Rubenwolf 2016 |
andere populatie |
|
Miklaszewska 2016 |
andere populatie |
|
Mattoo 2016 |
andere interventie: behandeling ipv diagnosticeren |
|
Lee 2016 |
narrative review, mogelijk interessant voor overwegingen |
|
Karakurt 2016 |
andere populatie |
|
Hung 2016 |
alleen accuratesse echo voor DMSA afwijkingen |
|
Hsu 2016 |
alleen accuratesse echo voor DMSA afwijkingen |
|
Chang 2016 |
andere outcome: geen accuratesse |
|
Arlen 2016 |
andere interventie: geen beeldvormingstrategie vergeleken |
|
Saleh Farghaly 2015 |
andere interventie: spect versus dmsa voor scarring opsporen |
|
Keren 2015 |
andere interventie: geen beeldvormingstrategie vergeleken |
|
Corbetta 2015 |
andere interventie: geen beeldvormingstrategie vergeleken |
|
Carovac 2015 |
andere interventie: geen beeldvormingstrategie vergeleken |
|
Babu 2015 |
andere interventie: geen beeldvormingstrategie vergeleken |
|
Awais 2015 |
narrative review, mogelijk interessant voor overwegingen |
|
Wong 2014 |
vergelijking contrastenhanced voiding urosonography met MCUG, niet relevante nieuwe techniek? |
|
Vegar-Zubović 2014 |
vergelijking voiding urosonography vs ultrasound, geen MCUG check |
|
Papadopoulou 2014 |
andere interventie/outcome: veiligheid voiding urosonography contrastvloeistof |
|
Mahyar 2014 |
MCUG en DMSA alleen in acute fase, wel klinische predictoren |
|
Kirsch 2014 |
andere interventie |
|
Halimi-Asl 2014 |
andere interventie |
|
Cara-Fuentes 2014 |
andere interventie |
|
Supavekin 2013 |
inclusie in SR Shaikh |
|
St Aubin 2013 |
andere populatie: prenatale afwijking |
|
Hubertus 2013 |
populatie met UPJO als risicogroep voor VUR, echter nauwelijks relatie tussen UWI en UPJO |
|
Hekmatnia 2013 |
andere interventie: vergelijking magnetic resonance voiding cystourethrograph en MCUG |
|
Drnasin 2013 |
andere populatie: gezonde kinderen zonder UTI |
|
Badeli 2013 |
andere interventie |
|
Tsai 2012 |
inclusie in SR Saltychev + shaikh |
|
Sorkhi 2012 |
inclusie in SR Shaikh |
|
Sasaki 2012 |
accuratesse echo voor VUR in kinderen met normale prenatale echo |
|
Mohkam 2012 |
accuratesse echo en DMSA (alleen acute fase dmsa) |
|
Leroy 2012 |
geen beeldvorming, wel clinical decision rule |
|
Lee 2012 |
inclusie in SR Shaikh |
|
Hannula 2012 |
andere outcome: geen accuratesse |
|
Gokce 2012 |
andere populatie: prenatale afwijking |
|
Gökaslan 2012 |
andere populatie: prenatale afwijking |
|
Bogaert 2012 |
narrative review |
|
Beiraghdar 2012 |
andere interventie |
|
Beetz 2012 |
narrative review |
|
Roberts 2011 |
UTI guideline |
|
Otukesh 2011 |
vergelijking voiding urosonography en n=25 |
|
Long 2011 |
narrative review |
|
Leroy 2011 |
Dubbel |
|
Ismaili 2011 |
associatie VUR per echobevinding |
|
Soccorso 2010b |
timing MCUG <4 weken versus >8 weken, geen vergelijking echo of DMSA (B130) |
|
Mohkam 2010 |
andere interventie: alleen acute DMSA |
|
Mohammad 2010 |
andere interventie |
|
Merguerian 2010 |
oude guideline |
|
Anderson 2010 |
andere populatie: prenatale afwijking |
|
Alsaywid 2010 |
andere outcome: scarring, geen accuratesse voor VUR etc |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 11-12-2019
Laatst geautoriseerd : 11-12-2019
Geplande herbeoordeling : 01-01-2025
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Kindergeneeskunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Kindergeneeskunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze evidence-based richtlijn geeft richting aan risico’s op UWIs bij kinderen en eventuele late gevolgen, diagnostiek, methodes voor het afnemen van een kweek bij UWI en de behandeling ervan specifiek bij kinderen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor kinderen met UWIs, zoals.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen met UWIs te maken hebben.
- Dr. D. (Dasja) Pajkrt, kinderarts-infectioloog/immunoloog, werkzaam in het AMC te Amsterdam, NVK (voorzitter)
- Dr. Med. F.G. (Fabienne) Ropers, kinderarts, werkzaam in het LUMC te Leiden, NVK
- Dr. A.T. (Sandra) Bernards, arts-microbioloog, werkzaam in het LUMC te Leiden, NVMM
- Dr. A (Anne) Brandts, kinderradiologie fellow, werkzaam in het in het Erasmus MC te Rotterdam, NVvR
- Drs. H.J.R. (Eric) van der Horst, kinderuroloog, werkzaam in het VUmc te Amsterdam, NVU
- Drs. J. (Joop) van den Hoek, kinderuroloog, werkzaam in het Erasmus MC te Rotterdam, NVU
- Dr. Ir. M.A.C. (Maarten) Broeren, laboratoriumspecialist klinische chemie, werkzaam in het Máxima Medisch Centrum te Eindhoven, NVKC
- Drs. S. (Sanne) Klinkhamer, huisarts, NHG
- Dr. V. (Vivian) Bongers, nucleair geneeskundige, werkzaam in het Diakonessenhuis te Utrecht, NVNG
Meelezer
- E. (Eva) Schmidt-Cnossen MSc, projectmanager & Relatiemanager Smiley, Stichting Kind en Ziekenhuis
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M.W. (Maya) Keuning, arts-onderzoeker, werkzaam in het AMC te Amsterdam
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bernards |
Arts-microbioloog bij het Leids Universitair Medisch Centrum |
Geen |
Geen |
Geen actie |
|
Bongers |
Nucleair geneeskundig Diakonessenhuis Utrecht |
Geen |
Geen |
Geen actie |
|
Brandts |
Fellow Kinderradiologie, Erasmus Medisch Centrum, |
Geen |
Geen |
Geen actie |
|
Broeren |
Laboratoriumspecialist klinische chemie (klinisch chemicus) |
Geen |
Geen |
Geen actie |
|
Hoek |
Uroloog Erasmus MS - Sophia Rotterdam |
Geen |
Geen |
Geen actie |
|
Keuning |
Projectondersteuning revisie Richtlijn Urineweginfecties bij kinderen - selectie en analyse |
Arts-onderzoeker Pediatrische infectieziekten AMC - dataverzameling en schrijven |
Deelname ter ontwikkeling eigen competenties en netwerk in het kader van medische |
Geen actie |
|
Klinkhamer |
Deelnemend huisarts (juliusgezondheidscentrum Vleuterweide Utrecht) |
Geen |
Geen |
Geen actie |
|
Pajkrt |
Kinderarts-infectioloog-immunoloog Emma Kinderziekenhuis AMC |
Geen |
Geen |
Geen actie. |
|
Ropers |
Algemeen kinderarts Leids universitair medisch centrum |
Geen |
Geen |
Geen actie |
|
Van der Horst |
Kinderuroloog Vu medisch centrum Amsterdam |
Lid cie. ontwikkeling skillslab Vumc (onbetaald, tot dec 2018) |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door Stichting Kind en Ziekenhuis af te vaardigen in de klankbordgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. In het licht van de bevindingen van de Kwaliteits & Doelmatigheidsagenda over aantallen beschikbare indicatoren en de moeilijkheid van het ontwikkelen van toepasselijke indicatoren, is er besloten (vooralsnog) geen indicatoren te ontwikkelen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVK, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door NVK, NVNG, NVU, V&VN, NHG, en Stichting Kind en Ziekenhuis via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Gedurende het ontwikkeltraject is afstemming met de NHG gezocht, omdat de herziening van de NHG standaard nagenoeg gelijk liep met deze richtlijn. Van belang was dat er geen discrepanties waren tussen de richtlijnen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Vanwege een beperkt aantal searches dat kon worden ingezet, is voor een aantal uitgangsvragen besloten geen (nieuwe) search uit te voeren, maar de tekst van de oude richtlijn te behouden. Bij deze uitgangsvragen werd geen nieuwe literatuur verwacht. Er kon voor deze uitgangsvragen geen GRADE beoordeling plaatsvinden, omdat de literatuur niet (her)beoordeeld is.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
