Rol van FeNO in behandeling van astma
Uitgangsvraag
Wat is het klinisch nut van FeNO bij de behandeling van volwassen astmapatiënten?
Aanbeveling
Wees terughoudend met het routinematig inzetten van FeNO voor het sturen van de behandeling van astmapatiënten.
Neem bij patiënten die hun ziekte niet onder controle krijgen in overweging een FeNO uit te voeren.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Wat betreft het nut van FeNO bij de behandeling van astma zijn de conclusies van het Cochrane rapport vergelijkbaar met die in de systematische reviews van Petsky (2016) en Korevaar (2023). In de onderzoeken bij volwassenen werd afhankelijk van hoe exacerbaties gedefinieerd werden een effect gezien van een FeNO-gestuurde behandeling ten opzichte van gebruikelijke zorg. De meeste onderzoeken combineerden milde en ernstige exacerbaties in hun uitkomstmaat ‘exacerbatiefrequentie’. Gecombineerd lieten deze onderzoeken een effect zien van een FeNO-gestuurde behandeling op het aantal exacerbaties (≥1 exacerbatie tijdens de studieperiode of het aantal exacerbaties per jaar). Er waren slechts een paar onderzoeken die specifiek keken naar ernstigere exacerbaties die tot een ziekenhuisopname of behandeling met orale corticosteroïden leidden. In deze onderzoeken trad de uitkomst bovendien weinig op, waardoor aantonen of uitsluiten van een effect lastig is. Ook voor de overige uitkomsten kon een gunstig effect van een FeNO-gestuurde behandeling niet worden aangetoond of worden uitgesloten. In een algemene astmapopulatie lijkt de meerwaarde van een FeNO-gestuurde behandeling dan ook beperkt, maar mogelijk is de meerwaarde er wel voor de subgroep van patiënten met frequentere exacerbaties. Het aantal onderzoeken specifiek bij patiënten met frequente exacerbaties (of ernstig astma) is nog relatief beperkt, dus dit zou een onderwerp kunnen zijn voor toekomstig onderzoek, waarin het voorkomen van ernstige astma-exacerbaties die leiden tot een prednisonkuur en/of ziekenhuisopname, als meest klinisch relevante uitkomst wordt meegenomen.
Waarden en voorkeuren voor de patiënt.
Het belangrijkste doel van de patiënt is dat de astma stabiel is en blijft. Bij voorkeur met een zo laag mogelijke dosering van inhalatiecorticosteroïden. Daarnaast is het voor de patiënt van belang om zo min mogelijk prednison kuren te krijgen (dit met name i.v.m. de bijwerkingen).
De huidige bewijslast laat nog onvoldoende aanwijzingen zien voor een gunstig effect op de behandeling indien FeNO metingen worden meegenomen in de overweging om medicatie op te hogen danwel te verlagen.
Er zitten geen risico’s aan de interventie voor de patiënt. De interventie kent een lage tijdsinvestering, inclusief uitleg kan een meting binnen 5-10 min verricht worden.
De zwangere astma patiënte
In de GINA guideline van 2023 wordt een studie genoemd van Powel (2011) wat laat zien dat er een voordeel lijkt te zijn van het monitoren van zwangeren met zowel de ACQ als FeNO t.o.v. het gebruiken van de ACQ alleen. Als uitkomstmaat werd in deze studie het aantal exacerbaties en foetale uitkomst genoemd.
Kosten (middelenbeslag)
De aanschaf van apparatuur bedraagt tussen de 2500-3500 euro. Per meting zijn er ook nog kosten, deze zijn sterk afhankelijk van het aantal metingen dat wordt verricht (de prijs per meting daalt bij het doen van meer metingen, dit heeft ermee te maken dat er bij iedere meting een nieuw filter moet worden geplaatst), maar ligt tussen de 6 en 25 euro per meting.
Aanvaardbaarheid, haalbaarheid en implementatie
De FeNO-meting is een snel en makkelijk onderzoek om te verrichten, die wordt uitgevoerd door de longfunctie analist. Het heeft geen invloed op de gezondheid en is ook makkelijk uitvoerbaar bij patiënten met geringere gezondheidsvaardigheden. Echter heeft niet ieder ziekenhuis in Nederland de beschikking over de apparatuur om een FeNO uit te voeren, hoewel er steeds meer ziekenhuizen bijkomen met de juiste apparatuur. Momenteel wordt FeNO ingezet om te bepalen of er sprake is van inflammatie bij patiënten die zijn gediagnosticeerd met ernstig astma. Ook speelt het een rol bij de keuze van biologicals bij ernstig astma. Hierdoor wordt er steeds meer ervaring opgedaan met FeNO, door steeds meer longartsen in Nederland.
De ervaring van de werkgroep is dat de implementatie (afgezien van de kosten) eenvoudig is en met een korte scholing uitvoerbaar is door longfunctie laboranten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de literatuur kan het volgende worden geconcludeerd. In de tweedelijns astmapopulatie lijkt de meerwaarde van een FeNO-gestuurde behandeling op de frequentie van exacerbaties er niet te zijn. Ook op de overige uitkomstmaten (astma QoL, FEV1, inhalatiemedicatie gebruik) werd geen meerwaarde gezien van FeNO-gestuurde behandeling. Er zijn geen nadelen voor de patiënt aan het uitvoeren van een FeNO test. Behoudens kosten is de implementatie van FeNO goed haalbaar voor ieder ziekenhuis in Nederland.
De werkgroep wil duidelijk maken dat bij patiënten met ernstig astma een FeNO meting een rol kan spelen in de keuze voor een biological. Hiervoor verwijzen we naar de richtlijn ernstig astma. In het beloop van een astmapatiënt op de polikliniek in de tweede lijn is het niet altijd direct duidelijk of een patiënt snel stabiliseert of toch ernstig dan wel moeilijk behandelbaar astma heeft. Het kan daarom zinvol zijn om laagdrempelig in het poliklinisch traject een FeNO meting te verrichten. Zeker bij aanhoudende klachten en een ongecontroleerde astmapatiënt.
De werkgroep verwacht dat in de toekomst meer duidelijkheid komt over welke rol FeNO heeft in het behandeltraject van de tweedelijns astmapatiënt.
Voor de zwangere patiënte is er mogelijk wel een rol weggelegd voor het monitoren middels FeNO. Hiervoor verwijzen we naar de richtlijn astma en zwangerschap.
Onderbouwing
Achtergrond
In internationale en nationale richtlijnen worden verschillende adviezen gegeven met betrekking tot het gebruik van FeNO (stikstofoxide in de uitgeademde lucht) meting. In de meeste richtlijnen wordt beschreven dat het gebruik van FeNO in de ‘algemene astmapopulatie’ wordt afgeraden, maar dat meer inzicht nodig is m.b.t. het gebruik van FeNO bij specifieke subgroepen. In 2016 zijn twee Cochrane reviews verschenen over kinderen en volwassenen (Petsky, 2016a; Petsky, 2016b), over de rol van FeNO-levels bij de behandeling van astma. Hierin werd gesteld dat algemeen gebruik van FeNO om de behandeling af te stemmen niet kan worden aangeraden bij kinderen en volwassenen. Mogelijk dat het voor bepaalde subgroepen wel klinisch nuttig is om FeNO in te zetten bij de diagnosestelling of om de behandeling op af te stemmen. Er zijn sinds de publicatie van eerdergenoemde Cochrane reviews nieuwe wetenschappelijke artikelen gepubliceerd over het onderwerp. De vraagstelling in deze module is wat de rol is van FeNO in behandeling van volwassenen met niet-ernstig astma.
Conclusies / Summary of Findings
De conclusies zijn, met toestemming van de auteurs, overgenomen uit het Cochrane rapport (Damen, 2021).
Astma exacerbaties
|
Moderate GRADE |
Het gebruik van FeNO leidde tot een 39% lagere odds op ≥1 exacerbatie.
Bronnen: Garg, 2020; Honkoop, 2014; Powell, 2011; Shaw, 2007; Smith, 2005; Syk, 2013; Zeiger, 2019 |
Exacerbatie rate
|
Moderate GRADE |
Het gebruik van FeNO leidde tot een 33% lagere exacerbatie rate.
Bronnen: Calhoun, 2012; Garg, 2020; Heaney, 2020; Hojo, 2013; Powell, 2011; Shaw, 2007; Smith, 2005; Syk, 2013; Zeiger, 2019 |
Ernstige exacerbaties met noodzaak tot opname
|
Very low GRADE |
Een verschil in effect met betrekking tot het aantal exacerbaties met noodzaak tot ziekenhuisopname kon worden aangetoond noch worden verworpen.
Bronnen: Heaney, 2020; Powell, 2011; Shaw, 2007; Syk, 2013; Zeiger, 2019 |
Exacerbaties met noodzaak tot behandeling met orale corticosteroïden
|
Low GRADE |
Een verschil in effect met betrekking tot het aantal exacerbaties met noodzaak tot behandeling met orale corticosteroïden kon worden aangetoond noch worden verworpen.
Bronnen: Heaney, 2020; Powell, 2011; Smith, 2005; Syk, 2013; Zeiger, 2019 |
Kwaliteit van leven
|
Low GRADE |
Een verschil in effect met betrekking tot kwaliteit van leven kon worden aangetoond noch worden verworpen.
Bronnen: Bernholm, 2018; Calhoun, 2012; Hashimoto, 2011; Heaney, 2020; Honkoop, 2014 |
Medicatiegebruik
|
Low GRADE |
Een verschil in effect met betrekking tot de dosering inhalatiecorticosteroïden kon worden aangetoond noch worden verworpen.
Bronnen: Bernholm, 2018; Garg, 2020; Heaney, 2020; Powell, 2011; Shaw, 2007; Smith, 2005; Syk, 2013; Truong-Thanh, 2020 |
Astmacontrole gemeten met de Asthma Control Questionnaire
|
Low GRADE |
Er zijn aanwijzingen dat het gebruik van FeNO leidt tot een 0.1 punt lagere score op de Asthma Control Questionnaire.
Bronnen: Bernholm, 2018; Calhoun, 2012; Heaney, 2020; Powell, 2011; Shaw, 2007; Syk, 2013; Wang, 2019 |
Astmacontrole gemeten aan de hand van FEV1 percentage
|
Very low GRADE |
Een verschil in effect met betrekking tot de FEV1 percentage van voorspeld kon worden aangetoond noch worden verworpen.
Bronnen: Bernholm, 2018; Heaney, 2020; Honkoop, 2014; Powell, 2011; Smith, 2005; Syk, 2013; Truong-Thanh, 2020; Wang, 2019 |
FeNO-waarde
|
Low GRADE |
Een verschil in effect met betrekking tot de FeNO waarde kon worden aangetoond noch worden verworpen.
Bronnen: Bernholm, 2018; Hashimoto, 2011; Heaney, 2020; Hirano, 2013; Hojo, 2013; Powell, 2011; Shaw, 2007; Smith, 2005; Syk, 2013; Truong-Thanh, 2020; Wang, 2019 |
Samenvatting literatuur
Beschrijving van de studies
Van de vijftien geïncludeerde studies zijn er 12 RCT’s (Bernholm, 2018; Calhoun, 2012; Garg, 2020; Hashimoto, 2011; Heaney, 2020; Honkoop, 2015; Powell, 2011; Shaw, 2007; Smith, 2005; Syk, 2013; Truong-Thanh, 2020; Wang, 2019), één niet-gerandomiseerd vergelijkend onderzoek (Zeiger, 2019), en twee niet-gerandomiseerde niet-vergelijkende onderzoeken (Hirano, 2013; Hojo, 2013). Twee onderzoeken werden in Nederland uitgevoerd (Hashimoto, 2011; Honkoop, 2015), twee in Groot-Brittannië (Heaney, 2020; Shaw, 2007), twee in de Verenigde Staten (Calhoun, 2012; Zeiger, 2019) en twee in Japan (Hirano, 2013; Hojo, 2013). Daarnaast werd steeds één onderzoek uitgevoerd in Australië (Powell, 2011), in China (Wang, 2019), in Denemarken (Bernholm, 2018), in India (Garg, 2020), in Nieuw-Zeeland (Smith, 2005), in Zweden (Syk, 2013) en in Vietnam (Truong-Thanh, 2020). De grootte van de onderzoekspopulaties varieerde tussen 13 (Hirano, 2013) en 1351 (Zeiger, 2019) deelnemers. De gemiddelde leeftijd lag tussen 28 en 57,5 jaar. Zes onderzoeken includeerden deelnemers met astma, ongeacht astmacontrole of -ernst (Bernholm, 2018; Garg, 2020; Shaw, 2007; Smith, 2005; Syk, 2013; Truong-Thanh, 2020) en de andere onderzoeken includeerden subgroepen astmapatiënten (Calhoun, 2012; Hashimoto, 2011; Heaney, 2020; Hirano, 2013; Hojo, 2013; Honkoop, 2015; Powell, 2011; Wang, 2019; Zeiger, 2019). In zes onderzoeken werd de behandelbeslissing alleen genomen op basis van de FeNO-waarde (Calhoun, 2012; Garg, 2016; Hirano, 2013; Shaw, 2007; Smith, 2005; Syk, 2013), terwijl in de overige onderzoeken FeNO gecombineerd werd met andere kenmerken, zoals symptomen, de Global Initiative for Asthma (GINA)-richtlijn, een astmacontrole vragenlijst of spirometrie. Ook de afkapwaarden van FeNO om de behandeling aan te passen verschilden tussen de onderzoeken. Vier onderzoeken gebruikten één afkapwaarde, variërend tussen 15 en 40 ppb (Hirano, 2013; Hojo, 2013; Smith, 2005; Wang, 2019). Indien de FeNO-waarde boven deze afkapwaarde lag, werd intensievere behandeling overwogen, terwijl bij een FeNO onder de afkapwaarde de behandeling naar beneden werd bijgesteld. Acht onderzoeken maakten gebruik van twee (Bernholm, 2018; Calhoun, 2012; Heaney, 2020; Honkoop, 2015; Powell, 2011; Shaw, 2007; Truong-Thanh, 2020; Zeiger, 2019) of zelfs drie afkapwaarden (Syk, 2013). Indien de FeNO-waarde tussen de afkapwaarden in lag, werd de behandeling niet aangepast. In twee onderzoeken werd gekeken naar de verandering in FeNO ten op zichte van de vorige meting (Garg, 2020; Hashimoto, 2011). In vijf onderzoeken werd een NIOX analyser (Aerocrine, Solna, Sweden) gebruikt om FeNO te meten (Bernholm, 2018; Hashimoto, 2011; Hojo, 2013; Syk, 2013; Zeiger, 2019), in vijf onderzoeken werd niet beschreven hoe FeNO gemeten werd (Calhoun, 2012; Heaney, 2020; Honkoop, 2015; Shaw, 2007; Smith, 2005), en in de overige vijf onderzoeken werden verschillende manieren gebruikt om FeNO te meten (Electrochemical analyser (NO breath FeNO monitor; Bedfont Scientific Limited, Maidstone, United Kingdom) (Garg, 2020), Chemiluminescence-based analyzer (NA-623 N, Chest Co. and Kimoto Electric Co., Tokyo, Japan) (Hirano, 2013), HypAir FeNO+ (Medisoft; Sorinnes, Belgium) (Truong-Thanh, 2020), Sunvou-P100, (Share Ltd. Wuxi, China) (Wang, 2019), chemiluminescence analyser (ECOMEDICS, Duernten, Switzerland)(Powell, 2011)). Een overzicht van de evidence tabellen van de individuele studies is weergegeven in bijlage 4D van het Cochrane rapport (Damen, 2021). Een overzicht van de risk of bias beoordelingen staat in de risk of bias tabellen en de details van deze beoordelingen zijn terug te vinden in de bijlage ‘Evidencetabellen’.
Resultaten
Astma-exacerbaties
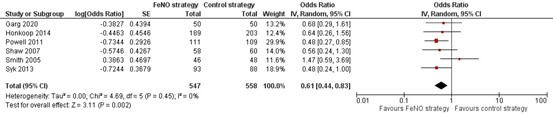
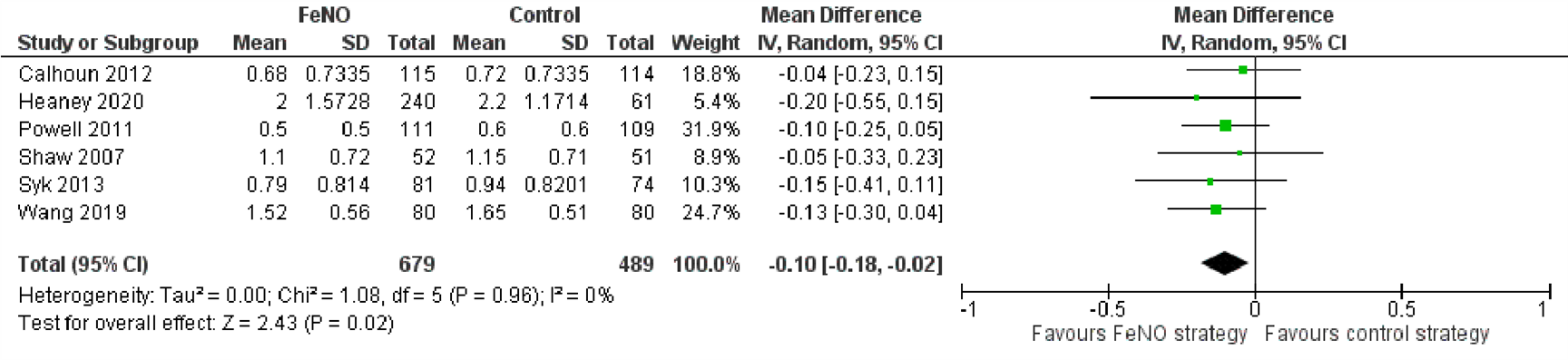
Zeven van de ingesloten onderzoeken presenteerden gegevens over het aantal patiënten met ≥1 exacerbatie gedurende de studieperiode, waarvan zes RCTs die hun resultaten op vergelijkbare wijze gepresenteerd hadden in de forest plot opgenomen konden worden (Figuur 1). De meerderheid van deze zes onderzoeken vond geen significant effect van FeNO op deze uitkomst. Wanneer de resultaten van de individuele onderzoeken samengenomen werden, resulteerde dit in een statistisch significant lagere odds op het optreden van ≥1 exacerbatie bij patiënten die volgens de FeNO-geleide strategie behandeld werden in vergelijking met patiënten behandeld met de controle-strategie (OR=0,61; 95% BI 0,44 tot 0,83). In het zevende observationele onderzoek, en daarom niet opgenomen in de forest plot, werd geen significant verschil gevonden tussen de groepen (HR=0,86; 95% BI 0,66 tot 1,14) (Zeiger, 2019).
Figuur 1. Forest plot van de odds ratio voor het aantal patiënten met ≥1 exacerbatie gedurende de studieperiode behandeld volgens de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolde odds ratio 0,61 (95% BI 0,44 tot 0,83)
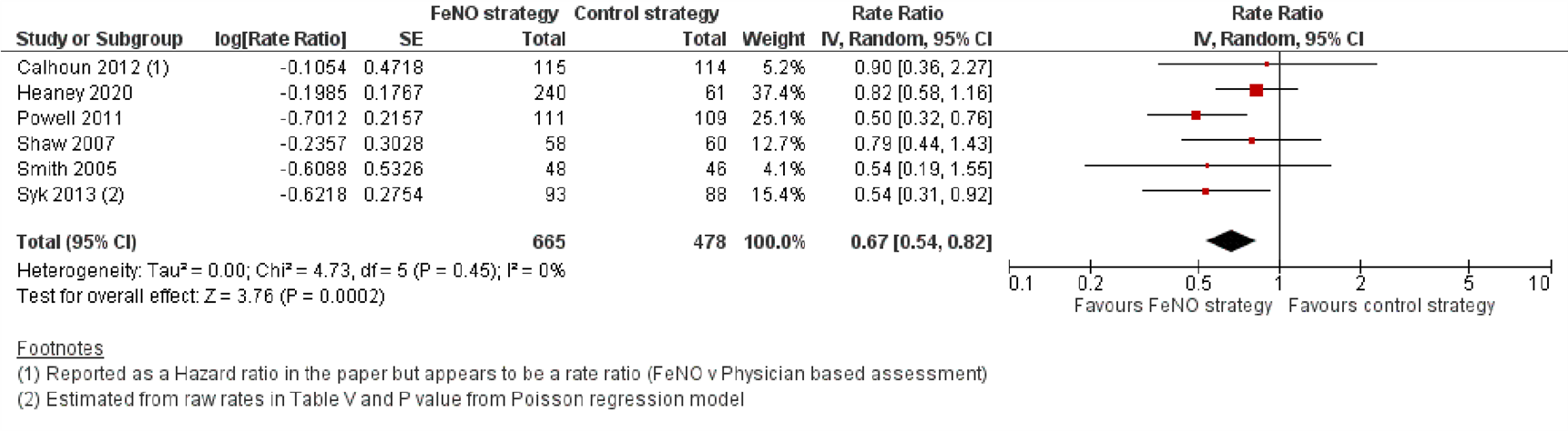
Voor het aantal exacerbaties per jaar (exacerbatie rate) werden negenonderzoeken ingesloten, waarvan zes RCTs konden worden opgenomen in de forest plot (Figuur 2). Er werd een lagere exacerbatie rate gevonden in het voordeel van de FeNO-groep (rate ratio=0,67; 95% BI 0,54 tot 0,82). In de overige drie onderzoeken kon een verschil in de gemiddelde exacerbatie rate per patiënt per jaar tussen de groepen worden aangetoond noch worden uitgesloten (MD=-0,10; 95% BI -0,33 tot 0,13) (Garg, 2020), de exacerbatie rate per 10.000 persoonsdagen (Rate Ratio=0,85; 95% BI 0,57 tot 1,27) (Zeiger, 2019), en de exacerbatiefrequentie voor en na aanpassing van de medicatie (Hojo, 2013) (single arm studie, details in de bijlage ‘Evidencetabellen’.
Figuur 2. Forest plot van de rate ratio voor het aantal exacerbaties per 52 weken in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolde rate ratio 0,67 (95% BI 0,54 tot 0,82)
In vijf onderzoeken werd informatie gepresenteerd over het aantal patiënten met ernstige exacerbaties met noodzaak tot opname. Drie hiervan zijn opgenomen in de forest plot (Figuur 3), echter in twee van deze onderzoeken werd deze uitkomst geen enkele keer geobserveerd (Shaw, 2007; Syk, 2013). Ook in het derde onderzoek kwam de uitkomst niet vaak voor en werd geen verschil gevonden tussen de FeNO-strategie en de controlestrategie (OR=0,14; 95% BI 0,01 tot 2,67). In het onderzoek van Heaney en collega’s (2020) werd geen verschil gevonden in het aantal ziekenhuisopnames per jaar (Rate Ratio=0,77; 95% BI 0,32 tot 1,84). In het vijfde onderzoek werd een lager aantal ziekenhuisopnames gevonden in de FeNO-groep (10,0/401,5, in vergelijking tot 9,2/877,7 in de controlegroep) (Zeiger, 2019). Vanwege de manier waarop deze resultaten zijn geanalyseerd (met behulp van Inverse Probability Weighting) is het echter niet mogelijk om op basis van deze gegevens een effectmaat te berekenen of een conclusie te trekken over statistische significantie.
Figuur 3. Forest plot van de odds ratio voor het aantal patiënten met ≥1 ernstige exacerbatie met noodzaak tot ziekenhuisopname in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolede odds ratio 0,14 (95% BI 0,01 tot 2,67)
In drie onderzoeken werd het aantal exacerbaties met noodzaak tot behandeling met orale corticosteroïden beschreven (Figuur 4). Een verschil in dit aantal tussen de groepen kon worden aangetoond noch worden uitgesloten (OR=0,86; 95% BI 0,50 tot 1,48). Daarnaast vond het onderzoek van Heaney en collega’s (2020) geen verschil in het aantal patiënten dat orale corticosteroïden gebruikte (OR=0,79; 95% BI 0,36 tot 1,74 en ook niet in de dosering orale corticosteroïden in mg (MD=-1; 95% BI -2 tot 1). Een ander onderzoek beschreef het aantal mensen met een dosis die valt in de volgende categorieën: geen, 0 - < 1,8g, 1,8 - <3,6g of ≥ 3,6g (Zeiger, 2019). De gerapporteerde aantallen lijken vergelijkbaar tussen de groepen en zijn te vinden in de bijlage ‘Evidencetabellen’.
Figuur 4. Forest plot van de odds ratio voor het aantal patiënten met ≥1 exacerbatie met noodzaak tot behandeling met orale corticosteroïden in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolde odds ratio 0,86 (95% BI 0,50 tot 1,48)
Kwaliteit van leven
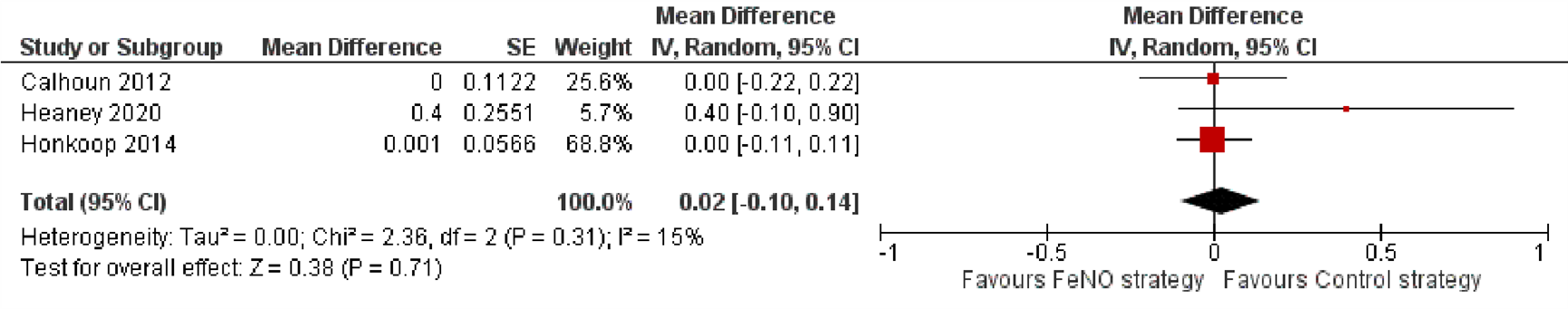
In vijf onderzoeken werd informatie gepresenteerd over kwaliteit van leven gemeten met de Asthma Quality of Life Questionnaire (AQLQ) (Juniper, 1993). Op basis van de drie onderzoeken die konden worden opgenomen in de meta-analyse, kon een verschil tussen de groepen worden aangetoond noch worden uitgesloten (MD=0,02; 95% BI -0,10 tot 0,14, Figuur 5). Een vierde onderzoek vond geen verschil in AQLQ maar kwantificeerde dit niet (Hashimoto, 2011). Ook het onderzoek van Bernholm en collega’s (2018) vond geen verschil in mediane score op de Mini AQLQ (FeNO vs. controlegroep: 6,2 (IQR 5,3 tot 6,6) vs. 6,2 (IQR 5,3 tot 6,6), p-waarde=0,5).
Figuur 5. Forest plot van de mean difference in de score op de Asthma Quality of Life Questionnaire in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolde mean difference 0,02 (95% BI -0,10 tot 0,14)
Medicatiegebruik
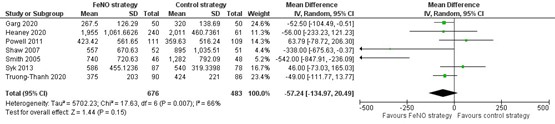
Acht onderzoeken beschreven de dosering inhalatiecorticosteroïden (budesonide variant) bij het laatste bezoek en zeven daarvan zijn gepresenteerd in Figuur 6. De verschillen in dosering tussen de onderzoeken zijn groot. De gemiddelde dosering in de controlegroep varieert van 320 µg/dag 56 tot 2011 µg/dag (Heaney, 2020). Een verschil in de dosering tussen de FeNO-groep en de controlegroep kon worden aangetoond noch worden uitgesloten (MD=-57 µg/dag; 95% BI -135 tot 20). In het achtste onderzoek werd geen verschil gevonden in de mediane dosis inhalatiecorticosteroïden in µg/dag (FeNO: 100 (IQR 0–600), Controle: 0 (IQR 0–800), P=0,8) (Bernholm, 2018). In één onderzoek werd geen verschil gevonden tussen de groepen in het aantal deelnemers dat gebruik maakte van inhalatiecorticosteroïden (RR=1,18; 95% BI 0,80 tot 1,74) (Bernholm, 2018).
Figuur 6. Forest plot van de mean difference in de dosering inhalatiecorticosteroïden bij het laatste bezoek (µg/dag) in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolde mean difference -57 µg/dag (95% BI -135 tot 20)
In verschillende onderzoeken werden nog andere resultaten vermeld met betrekking tot medicatiegebruik. Dit betrof het gebruik van Long-Acting β-Agonists (LABA) of de dosering daarvan (Bernholm, 2018), het gebruik van Short-Acting β-Agonists (SABA) (Hojo, 2013; Zeiger, 2019), het gebruik van fluticasone als inhalatiecorticosteroïde (Garg, 2020), het aantal patiënten met een reductie in dosering inhalatiecorticosteroïden of orale corticosteroïden (Heaney, 2020), het gebruik van ciclesonide (Hirano, 2013) en het gebruik van prednisolone (Hirano, 2013). Voor geen van deze medicaties werd een statistisch significant verschil gevonden tussen de groepen. De resultaten zijn te vinden in de bijlage ‘Evidencetabellen’.
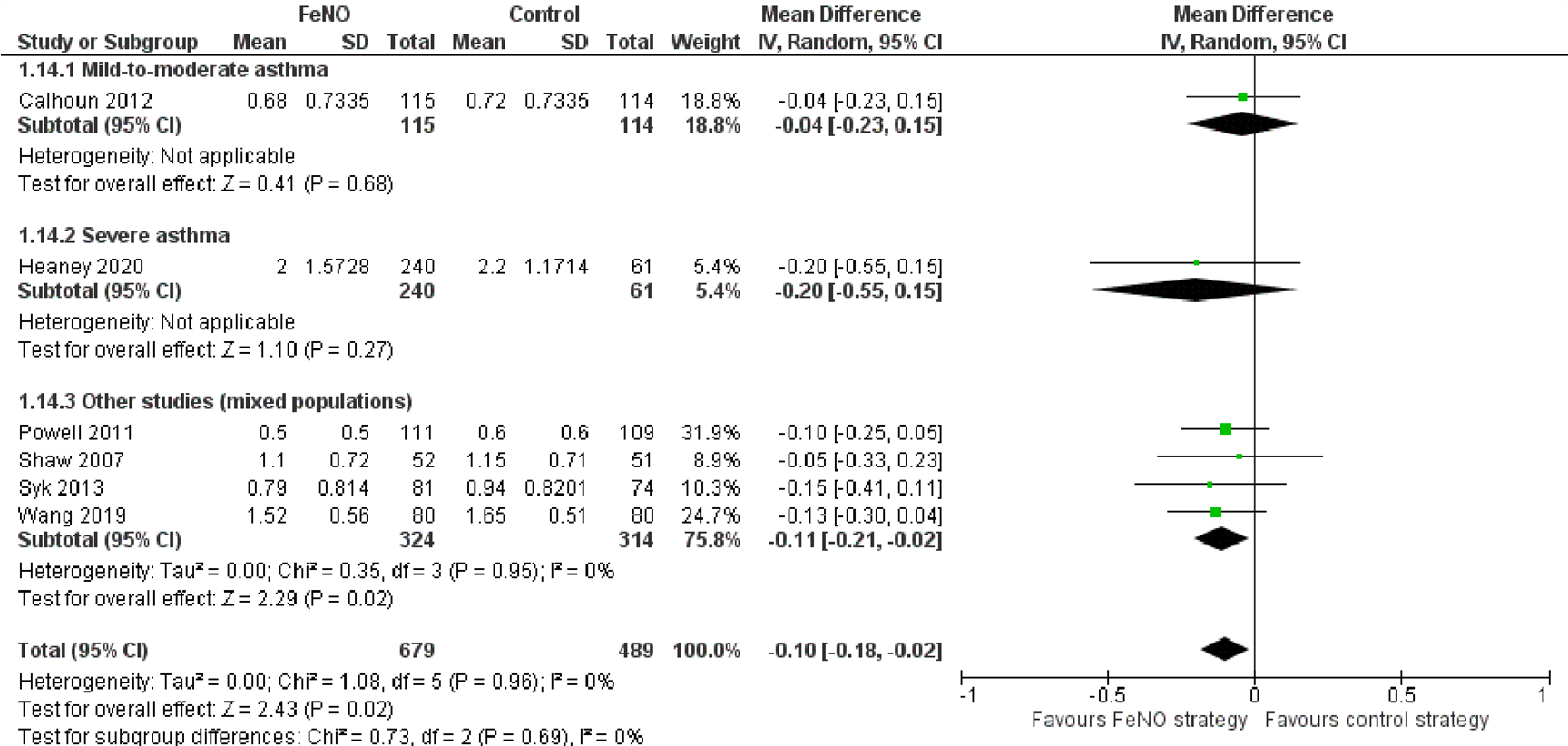
Astmacontrole
In zeven onderzoeken werden gegevens beschreven over de score op de Asthma Control Questionnaire (ACQ). De scores op de ACQ kunnen variëren tussen 0 (totaal gecontroleerd) en 6 (ernstig niet gecontroleerd) (Juniper; 1999). Zes hiervan zijn opgenomen in de forest plot (Figuur 7). In geen van de onderzoeken werd een statistisch significant verschil aangetoond, maar de resultaten van de meta-analyse tonen een klein significant verschil aan in het voordeel van de FeNO-strategie (MD=-0,10; 95% BI -0,18 tot -0,02). In het zevende onderzoek werd geen verschil gevonden in mediane score op de ACQ (FeNO-groep: 0,8 (IQR 0,4 tot 1,8), controlegroep 0,8 (IQR 0,4 tot 2), p-waarde=0,7) (Bernholm, 2018).
In twee onderzoeken werd astmacontrole gemeten met de Asthma Control Test (ACT). De score op de ACT kan variëren van 5 (slechtste controle) tot 25 (totale controle) (Nathan, 2004). Truong-Thanh en collega’s (2020) vonden geen verschil tussen de FeNO-groep en de controlegroep (MD=-1; 95% BI -2,63 tot 0,63). In een single arm studie werd geen verschil gevonden in ACT-score voor en na aanpassing van de medicatie (Hojo, 2013). Eén onderzoek vond geen verschil in het percentage mensen met compleet gecontroleerde astma (FeNO: 88,46%, controle: 87,38%, p-waarde > 0,05) (Wang, 2019).
Figuur 7. Forest plot van de mean difference in score op de Asthma Control Questionnaire in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolde mean difference -0,10 (95% BI -0,18 tot -0,02)
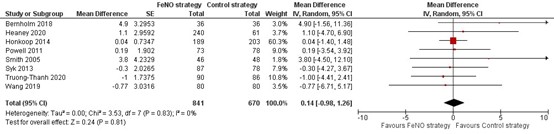
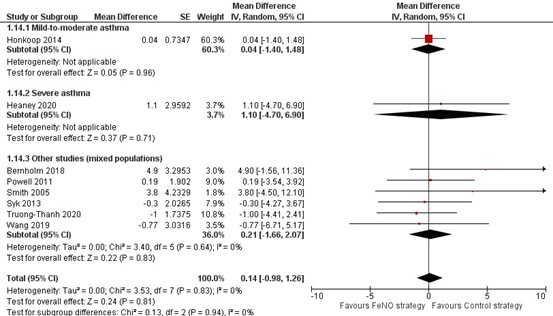
In negen gerandomiseerde onderzoeken werd de FEV1 percentage van voorspeld gerapporteerd (Figuur 8). Geen van deze negen onderzoeken zag een verschil tussen de FeNO- en controlestrategie. Ook wanneer acht van deze negen onderzoeken samengenomen werden, kon een verschil worden aangetoond noch worden verworpen (MD=0,14; 95% BI -0,98 tot 1,26). Het negende onderzoek beschreef dat er geen verschil werd gevonden, maar presenteerde geen getallen (Shaw, 2007). Ook in een observationeel onderzoek werd geen verschil gevonden voor- en nadat de medicatie was aangepast (Hojo, 2013), zie details in de bijlage ‘Evidencetabellen’.
Figuur 8. Forest plot van de mean difference in het FEV1 percentage van voorspeld in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolde mean difference 0,14 (95% BI -0,98 tot 1,26)
FEV1
Voor de FEV1 in liter werd geen verschil gevonden tussen de FeNO-groep en de controlegroep (MD=0,18; 95% BI -0,24 tot 0,60) (Bernholm, 2018). Eén onderzoek (Hirano, 2013) beschreef een lagere FEV1 nadat de medicatie was aangepast op basis van de FeNO-waarde (voor: 2,80 l, na: 2,72 l, P<0,05). Een ander onderzoek vond echter geen verschil voor en na aanpassing van de medicatie (Hojo, 2013).
Dezelfde drie onderzoeken rapporteerden ook de gemiddelde forced vital capacity (FVC) in liter met vergelijkbare conclusies: er werd geen verschil in FVC gevonden tussen de FeNO-groep en de controlegroep (MD=0,24; 95% BI -0,27 tot 0,75) (Bernholm, 2018), één studie vond een verbeterde FVC nadat de medicatie was aangepast (voor: 3,85 l, na: 3,70 l; P<0.0001) (Hirano, 2013) en een andere studie vond geen verschil (Hojo, 2013).
Voor de peak expiratory flow (PEF) werd geen verschil gevonden tussen patiënten behandeld volgens de FeNO-strategie en de controlestrategie (MD=-1; 95% BI –5,14 tot 3,14 (Truong-Thanh, 2020) en MD=-2,13; 95% BI -7,72 tot 3,46 (Wang, 2019)). Ook werd er geen verschil gevonden in gemiddelde FEV1/FVC % (MD=-0,50;95% BI -4,31 tot 3,31) (Bernholm, 2018) en in de delta PEF % voorspeld (MD= -0,67; 95% BI -1,40 tot 0,06) (Wang, 2019).
FeNO-waarde
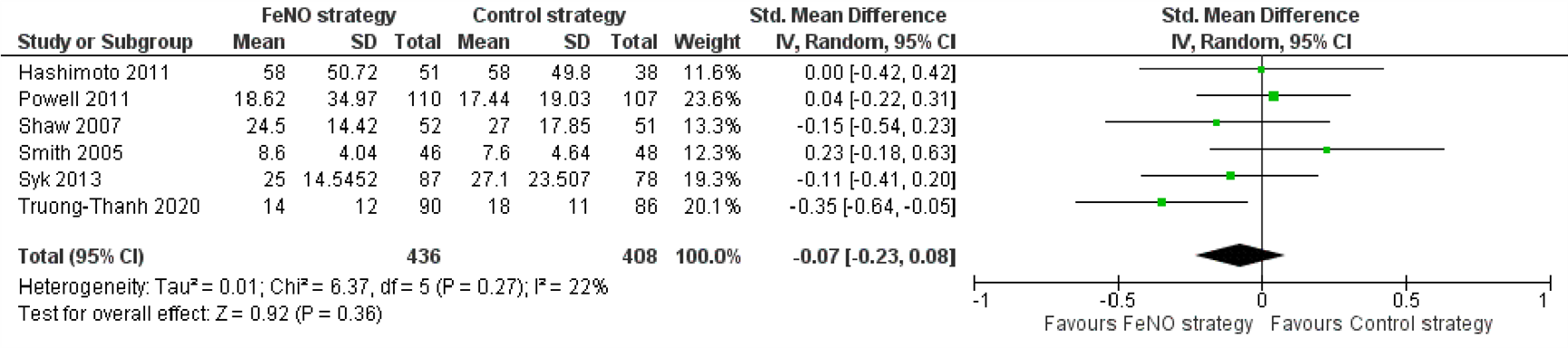
De meerderheid van de onderzoeken rapporteerden informatie over de FeNO-waarden aan het eind van het onderzoek. Zes hiervan konden worden opgenomen in een meta-analyse (Figuur 9). Een verschil in FeNO-waarden tussen de groep behandeld volgens de FeNO-strategie en de controlestrategie kon worden aangetoond noch worden verworpen (SMD=-0,07; 95% BI -0,23 tot 0,08). Twee andere onderzoeken rapporteerden geen verschil in mediane FeNO-waardes tussen de groepen (ratio van geometric means=1,02; 95% BI 0,87 tot 1,19 (Heaney, 2020); en FeNO-groep: 15 (IQR 12 tot 18), controlegroep: 21 (IQR 14 tot 29) (Bernholm, 2018). Hirano en collega’s (2013) beschreven een daling in FeNO-waarde nadat de behandeling werd aangepast (voor: 71.9, na: 52.7 ppb, P<0.01), maar in een ander onderzoek werd geen verschil gevonden (Hojo, 2013). In een laatste onderzoek werd ten slotte een daling van de gemiddelde FeNO-waarden beschreven in de groep behandeld volgens de FeNO-strategie (voor: 47,33 (SD 16,58), na: 25,58 (SD 10,72)), maar het is onduidelijk of dit verschil statistisch significant was en ook de FeNO-waarden in de controlegroep werden niet beschreven (Wang, 2019).
Figuur 9. Forest plot van de standardised mean difference in FeNO-waarden bij het laatste bezoek in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma
Gepoolde standardised mean difference -0,07 (95% BI -0,23 tot 0,08)
Resultaten subgroepen
Astma-ernst
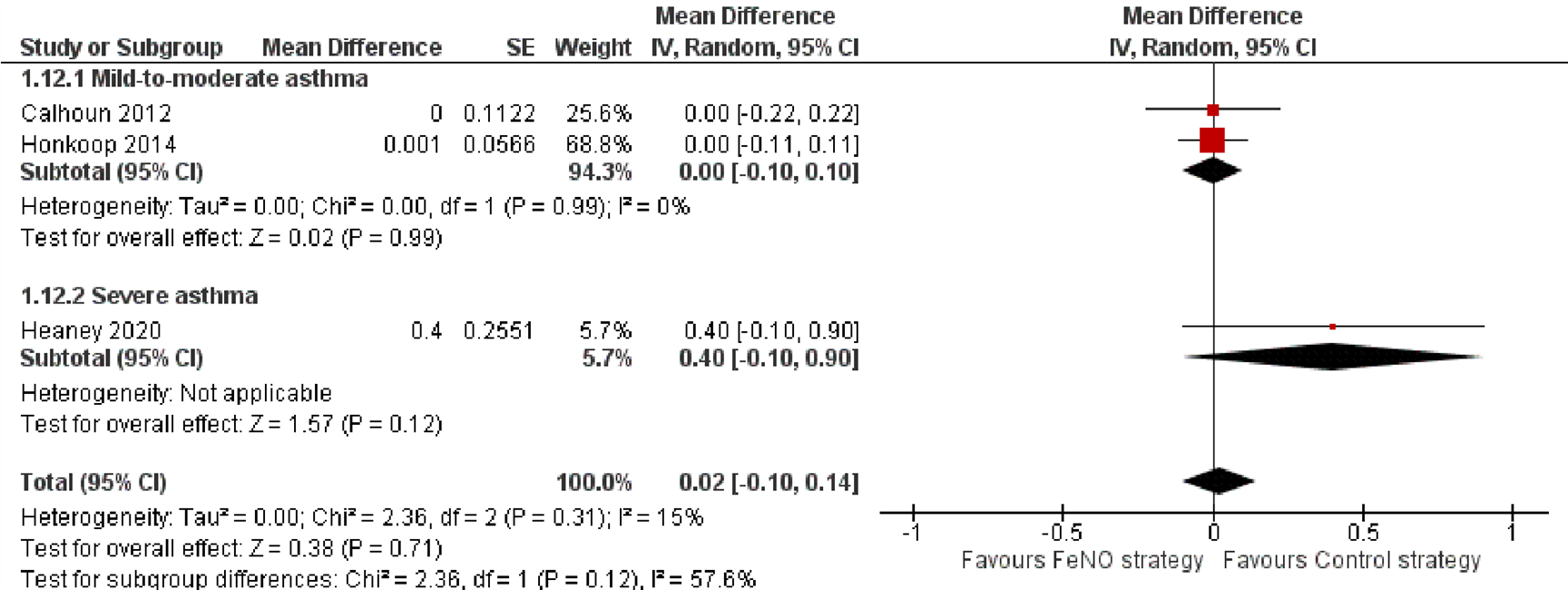
Vier onderzoeken selecteerden hun studiepopulatie op basis van astma-ernst. Eén onderzoek includeerde astmapatiënten met milde tot matige astma (Calhoun, 2012), één onderzoek includeerde patiënten met matige astma (Hojo, 2013) en twee onderzoeken selecteerden patiënten met ernstige astma (Hashimoto, 2011; Heaney, 2020). Daarnaast includeerde één onderzoek astmapatiënten die behandeld werden door de huisarts (Honkoop, 2015). De meerderheid van deze patiënten zullen waarschijnlijk milde tot matige astma hebben gehad. Deze vijf onderzoeken werden ingedeeld in twee groepen: milde tot matige astma (Calhoun, 2012; Hojo, 2013; Honkoop, 2015) en ernstige astma (Hashimoto, 2011; Heaney, 2020).
Astma-exercebaties
Slechts één van deze vijf onderzoeken rapporteerde het aantal patiënten met ≥1 astma-exacerbatie (Honkoop, 2015). In Figuur 1 is te zien dat het resultaat in dit onderzoek niet afwijkt van de andere onderzoeken. Twee onderzoeken, één met patiënten met milde tot matige astma (Calhoun, 2012) en één met ernstige astmapatiënten (Heaney, 2020) beschreven het aantal exacerbaties. Ook hier kan op basis van Figuur 2 geconcludeerd worden dat er geen aanwijzingen zijn dat de resultaten in deze onderzoeken verschillen van de andere onderzoeken of van elkaar. Geen van de onderzoeken presenteerde informatie over het aantal ernstige exacerbaties met noodzaak tot ziekenhuisopname of het aantal ernstige exacerbaties dat behandeld werd met orale corticosteroïden.
Kwaliteit van leven
Drie onderzoeken presenteerden gegevens over de kwaliteit van leven gemeten met de AQLQ (Calhoun, 2012; Heaney, 2020; Honkoop, 2015). Geen van deze onderzoeken vond een statistisch significant effect van de FeNO-strategie en er was ook geen significant verschil tussen de subgroepen (Figuur 10).
Figuur 10. Forest plot van de mean difference in de score op de Asthma Quality of Life Questionnaire in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma, uitgesplitst naar astma-ernst
Medicatiegebruik
Eén onderzoek beschreef de dosis inhalatiecorticosteroïden bij patiënten met ernstige astma (Heaney, 2020). De onderzoeken die patiënten met milde tot matige astma includeerden, beschreven deze uitkomst niet. Hoewel de dosis inhalatiecorticosteroïden in dit onderzoek hoger lag dan in de andere onderzoeken, was het verschil tussen de FeNO-groep en de controlegroep niet anders dan in de andere onderzoeken (Figuur 6).
Astmacontrole
Eén onderzoek beschreef de astmacontrole gemeten met de ACQ bij patiënten met milde tot matige astma (Calhoun, 2012) en één onderzoek beschreef deze uitkomst bij patiënten met ernstige astma (Heaney, 2020). Er werd geen verschil gevonden in effectiviteit van de FeNO-strategie tussen deze twee onderzoeken en ook in vergelijking met de overige onderzoeken die deze uitkomst rapporteerden, was er geen verschil (Figuur 11).
Figuur 11. Forest plot van de mean difference in score op de Asthma Control Questionnaire in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma, uitgesplitst naar astma ernst
In één onderzoek met patiënten met milde tot matige astma (Honkoop, 2015) en één onderzoek met patiënten met ernstige astma (Heaney, 2020) werd informatie gepresenteerd over de FEV1 percentage van voorspeld. Er was geen verschil tussen deze twee onderzoeken onderling en ook niet met de overige onderzoeken (Figuur 12).
Figuur 12. Forest plot van de mean difference in het FEV1 percentage van voorspeld in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma, uitgesplitst naar astma-ernst
FeNO-waarde
Twee onderzoeken presenteerden informatie over de FeNO-waarden aan het eind van de studie voor de groep ernstige astmapatiënten (Hashimoto, 2011; Heaney, 2020). Het effect dat gevonden werd in het onderzoek van Hashimoto en collega’s, week niet af van de resultaten van de andere onderzoeken (Hashimoto, 2011) (Figuur 9). Het onderzoek van Heaney kon niet worden opgenomen in de forest plot, maar de resultaten van dit onderzoek komen overeen met de overige onderzoeken (geen verschil tussen de groepen) (Heaney, 2020).
Astmacontrole
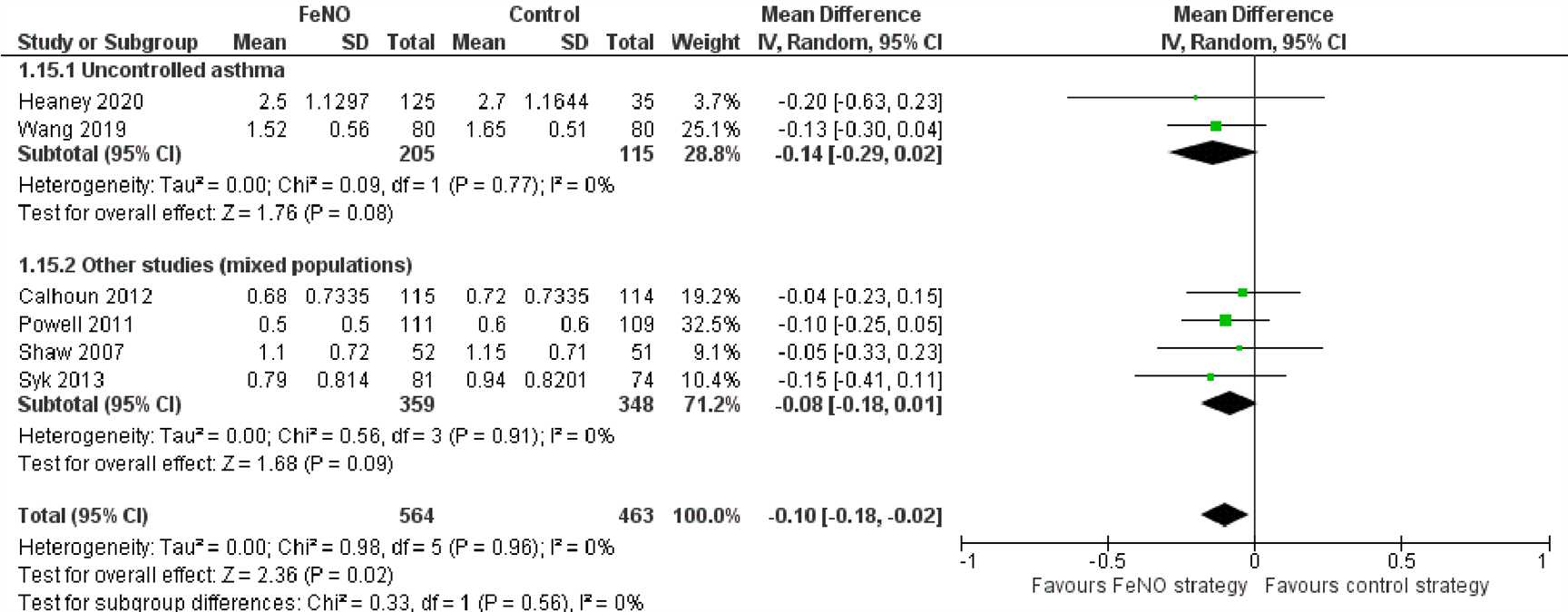
Vijf onderzoeken selecteerden hun populatie op basis van astmacontrole. Eén onderzoek includeerde alleen patiënten met stabiele astma (Hirano, 2013) en vier onderzoeken includeerden alleen patiënten met persisterende of ongecontroleerde astma (Hashimoto, 2011; Hojo, 2013; Wang, 2019; Zeiger, 2019). Twee onderzoeken voerden daarnaast nog een subgroepanalyse uit waarbij ze alleen patiënten met ongecontroleerd astma includeerden (Heaney, 2020; Syk, 2013).
Astma-exacerbaties
Het onderzoek dat patiënten met stabiele astma includeerde, presenteerde geen gegevens voor de uitkomsten met betrekking tot exacerbaties. Van de zes onderzoeken bij patiënten met ongecontroleerde astma presenteerde er slechts één informatie over het aantal exacerbaties per jaar (Heaney, 2020). In deze subgroep werd geen verschil gevonden tussen de groepen, echter ook in de totale onderzoekspopulatie werd geen verschil gevonden tussen de groepen (Ongecontroleerde astma: Rate Ratio=0,93 (95% BI 0,65 tot 1,33); Totale populatie: Rate Ratio=0,84 (95% BI 0,84 tot 1,15)). Daarnaast liet één ander onderzoek bij patiënten met ongecontroleerde astma geen verschil zien tussen de groepen in het aantal patiënten met ≥1 exacerbatie (RR=0,84; 95% BI 0,60 tot 1,17) (Zeiger, 2019).
Kwaliteit van leven
De uitkomst kwaliteit van leven gemeten met de AQLQ werd gepresenteerd in één onderzoek waarin een subgroepanalyse werd gedaan voor patiënten met ongecontroleerde astma (Heaney, 2020). Er werd geen verschil gevonden tussen de groepen in zowel de subgroep als de totale populatie (Ongecontroleerde astma: MD=0, (95% BI −0,3 tot 0,7); Totale populatie: MD=0,2 (95% BI -0,2 tot 0,5)).
Medicatiegebruik
Ook met betrekking tot het gebruik van inhalatiecorticosteroïden was de informatie beperkt. Eén onderzoek deed een subgroepanalyse bij patiënten met ongecontroleerde astma (Heaney, 2020). Dit onderzoek vond bij deze groep patiënten een statistisch significant lagere dosis inhalatiecorticosteroïden in de FeNO-groep (MD=-280 (95% BI -488 tot -72), terwijl in de totale populatie geen verschil werd gevonden tussen de groepen (MD=96 (95% BI -287 tot 94)).
Astmacontrole
In twee onderzoeken die patiënten met ongecontroleerde astma includeerden werd informatie gepresenteerd over astmacontrole gemeten met de ACQ60 (Heaney, 2020). Deze twee onderzoeken weken niet af van de overige onderzoeken (Figuur 13).
Figuur 13. Forest plot van de mean difference in score op de Asthma Control Questionnaire in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma, uitgesplitst naar astmacontrole
Het totale aantal deelnemers in deze figuur verschilt van dat in Figuur 7, omdat het onderzoek van Heaney 2020 een subgroepanalyse uitvoerde enkel voor patiënten met ongecontroleerde astma en niet voor patiënten met gecontroleerde astma
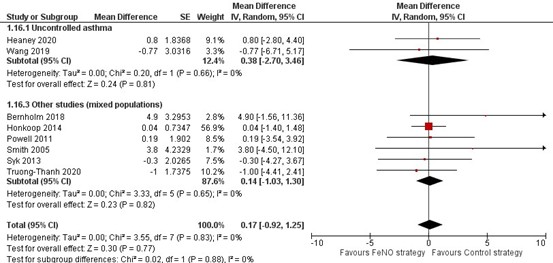
Dezelfde twee onderzoeken presenteerden ook gegevens over de uitkomst FEV1 percentage van voorspeld (Heaney, 2020; Wang, 2019). Ook hier werd geen verschil gevonden tussen deze twee onderzoeken en de overige onderzoeken (Figuur 14). Een onderzoek bij patiënten met stabiele astma vond een statistisch significant lagere FEV1 in liter acht weken nadat de behandeling was bijgesteld op basis van FeNO (Baseline: 2,80; week 8: 2,72; P<0.05). Dit onderzoek had geen controlegroep ter vergelijking (Hirano, 2013).
Figuur 14. Forest plot van de mean difference in het FEV1 percentage van voorspeld in de FeNO-strategie in vergelijking met de controlestrategie bij volwassenen met astma, uitgesplitst naar astmacontrole
Het totale aantal deelnemers in deze figuur verschilt van dat in Figuur 8, omdat het onderzoek van Heaney 2020 een subgroepanalyse uitvoerde enkel voor patiënten met ongecontroleerde astma en niet voor patiënten met gecontroleerde astma
FeNo-waarde
Informatie over FeNO-waardes aan het eind van het onderzoek werd gepresenteerd op verschillende manieren. Eén onderzoek vond een lagere gemiddelde FeNO waarde tien weken nadat de behandeling was aangepast bij patiënten met stabiele astma (Week 0: 73,1 ppb; week 10: 45,3 ppb) (Hirano, 2013). Twee andere onderzoeken vonden geen verschil in FeNO na 40 en 48 weken (Hojo, 2013) en na één jaar (Maand 0: 47,33 ppb; Maand 12: 25,58; P>0,05) (Wang, 2019) bij patiënten met ongecontroleerde astma. Een vierde onderzoek vond geen verschil in FeNO-waarden tussen de FeNO-groep en de controlegroep bij patiënten met ongecontroleerde astma (Hashimoto, 2011) (zie Figuur 9). Een vijfde onderzoek vond tenslotte een hogere FeNO in de FeNO-groep ten op zichte van de controlegroep (ratio van geometrische gemiddelden=1,24; 95% BI 1,02 tot 1,51) in de subgroep van patiënten met ongecontroleerde astma, terwijl in de totale onderzoekspopulatie geen verschil werd gevonden tussen de groepen (ratio van geometrische gemiddelden=1,02; 95% BI 0,87 tot 1,19) (Heaney, 2020).
Atopisch astma bij volwassenen
Eén onderzoek includeerde patiënten met ongecontroleerde astma en deed hierbinnen een subgroep analyse bij patiënten met atopisch astma (Zeiger, 2019). In deze subgroep werd geen verschil gevonden tussen de FeNO-groep en de controlegroep in het aantal patiënten met ≥1 exacerbatie (RR=0,76; 95% BI 0,53 tot 1,09). Ook in de volledige onderzoekspopulatie werd geen verschil gevonden voor deze uitkomst (RR=0,84; 95% BI 0,60 tot 1,17).
Obesitas bij volwassenen
In één onderzoek werd gekeken of de effectiviteit van de FeNO strategie verschillend was tussen drie groepen gevormd op basis van BMI (Murphy, 2019). Dit onderzoek includeerde alleen zwangere vrouwen en op basis van BMI werden de vrouwen ingedeeld in de categorieën geen overgewicht, overgewicht, en obesitas. Er werd geen verschil in effectiviteit van de FeNO strategie voor de volgende uitkomsten gerelateerd aan exacerbaties: aantal vrouwen met ≥1 exacerbatie tijdens de zwangerschap (p=0,067), aantal ziekenhuisopnames (p=0,098), aantal bezoeken aan de eerste hulp (p=0,433). Ook voor kwaliteit van leven werd geen verschil gevonden tussen de groepen voor de uitkomsten Short-Form (SF) 12-Physical (p=0,802), SF 12-Mental (p=0,076) en AQLQ (p=0,569). Met betrekking tot het gebruik van inhalatiecorticosteroïden werd een verschil in effectiviteit gevonden (p=0,017). In de groep zonder overwicht en de groep met obesitas maakten vrouwen behandeld volgens de FeNO-strategie vaker gebruik van dit medicijn (Geen overgewicht: RR=1,86; 95% BI 1,13 tot 3,07; Obesitas: RR=1,57; 95% BI 1,06 tot 2,32) terwijl in de groep vrouwen met overgewicht geen verschil werd gevonden (RR=1,27; 95% BI 0,82 tot 1,97). Er werd geen verschil gevonden in effectiviteit voor de dosis inhalatiecorticosteroïden (p=0,068) en het aantal vrouwen dat orale corticosteroïden gebruikte (p=0,072). Met betrekking tot astmacontrole werden geen verschillen in effectiviteit aangetoond voor FEV1 percentage van voorspeld (p=0,861), FEV1 in L (p=0,706), FVC in L (p=0,493) en FEV1:FVC (p=0,171). Ten slotte werd ook voor de FeNO-waarden geen verschil in effectiviteit gevonden tussen de groepen (p=0,279).
Zwangerschap
Eén onderzoek includeerde alleen zwangere vrouwen (Powell, 2011). De resultaten voor dit onderzoek lijken niet af te wijken van de andere onderzoeken (Damen, 2021). Het gevonden effect in het voordeel van de FeNO-strategie lijkt echter wel iets sterker te zijn in dit onderzoek. Dit geldt voor de uitkomsten aantal patiënten met ≥1 exacerbatie gedurende de studieperiode en aantal exacerbaties per 52 weken (zie Figuur 2 en Figuur 4).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat astma-exacerbaties is met 1 niveau verlaagd naar GRADE redelijk gezien beperkingen in de onderzoeksopzet (risk of bias).
De bewijskracht voor de uitkomstmaat exacerbatie rate is met 1 niveau verlaagd naar GRADE redelijk gezien beperkingen in de onderzoeksopzet (risk of bias).
De bewijskracht voor de uitkomstmaat ernstige exacerbaties met noodzaak tot opname is met 3 niveaus verlaagd naar GRADE zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat exacerbaties met noodzaak tot behandeling met orale corticosteroïden is met twee niveaus verlaagd naar GRADE laag gezien beperkingen in de onderzoeksopzet (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd naar GRADE laag gezien beperkingen in de onderzoeksopzet (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat medicatiegebruik is met twee niveaus verlaagd naar GRADE laag gezien beperkingen in de onderzoeksopzet (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat astmacontrole gemeten met de Asthma Control Questionnaire is met twee niveaus verlaagd naar GRADE laag gezien beperkingen in de onderzoeksopzet (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat astmacontrole gemeten aan de hand van FEV1 percentage is met twee niveaus verlaagd naar GRADE laag gezien beperkingen in de onderzoeksopzet (risk of bias) en onnauwkeurigheid.
De bewijskracht voor de uitkomstmaat FeNO-waarde is met twee niveaus verlaagd naar GRADE laag gezien beperkingen in de onderzoeksopzet (risk of bias) en onnauwkeurigheid.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the benefits and risks of FeNO-guided asthma treatment (in combination with usual care) compared to usual clinical care in adults with (non-severe) asthma?
| P: | Adults (≥18 y.o.) with (non-severe) asthma |
| I: |
FeNO-guided asthma treatment (starting or changing asthma treatment based on the FeNO test), also in combination with usual clinical care |
| C: | Usual clinical care |
| O: |
Asthma exacerbations, quality of life, medication use, asthma indicators, FeNO level |
Relevant outcome measures
The guideline development group considered asthma exacerbations, quality of life, medication use, asthma indicators as critical outcome measures for decision making; and FeNO level as an important outcome measure for decision making.
The working group did not define the above outcome measures a priori, but used the definitions provided in the studies.
The outcomes were defined as follows:
- Asthma exacerbations: amount of patients with ≥1 exacerbation during the study period; amount of exacerbations per 52 weeks; number of emergency department visits; amount of severe exacerbations with need of hospitalization per year; amount of exacerbations with need of treatment with oral corticosteroids.
- Medication use: dose of inhaled corticosteroids (at the last visit); amount of high-dose therapies of prednisolone per year.
- Asthma indicators: forced expiratory volume in one second (FEV1), peak flow, airway hyperresponsiveness, Asthma Control Questionnaire (ACQ) score.
- ‘Quality of life’ was based on the asthma QoL score.
- ‘FeNO level’ was reported in parts per billion (ppb).
The working group defined 25% as a minimal clinically (patient) important difference for risk ratios (0.80 ≤ RR ≤ 1.25), 10% of the maximum score for quality-of-life scales and 0.5 for standardized mean differences.
Search and select (Methods)
A Cochrane report addressing the PICO-question (Damen, 2021) was known to the working group through systematic searches for other modules of this guideline. In the Cochrane report, RCTs were searched from January 1, 2016 to August 17, 2020 in the Cochrane Airways Group Trials Register (based on MEDLINE, Embase, Cochrane CENTRAL, PsycINFO, and CINAHL). Observational studies were searched in MEDLINE and Embase from January 1, 2013 to September 9, 2020. To update the original search of the Cochrane report we performed an additional systematic literature search from January 1, 2020 up to June 6, 2023 in Medline (via OVID) and Embase (via Embase.com). The detailed search strategies are depicted under the tab Methods. The systematic literature search resulted in 1125 hits. Studies were selected based on the following criteria: systematic review and meta-analysis of RCT’s and RCT’s investigating FeNO-guided asthma treatment compared to usual care in adult patients with asthma. Fourteen studies were initially selected based on title and abstract screening. After reading the full text, 11 studies were excluded (see exclusion reasons under the tab Methods) and 3 studies (Heaney, 2021; Truong-Thanh, 2020; Garg, 2020) were included. These 3 studies were already incorporated in the Cochrane report. After discussing with the authors of the Cochrane report, literature analysis of the Cochrane report was copied to this module. The Cochrane literature analysis was published in Dutch and is reported in Dutch in this module.
Resultaten
In het Cochrane rapport (Damen, 2021) werden in totaal vijftien studies geïncludeerd, waarvan zeven op basis van de systematische review van Petsky (2016) en Petsky (2018), voor de literatuuranalyse over het nut van FeNO bij de behandeling van astma bij volwassenen. De belangrijkste studiekarakteristieken en resultaten van de systematische reviews zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Bernholm KF, Homøe AS, Meteran H, et al. FeNo-based asthma management results in faster improvement of airway hyperresponsiveness. ERJ Open Research 2018;4(4) doi: https://doi.org/10.1183/23120541.00147-2017.
- Calhoun WJ, Ameredes BT, King TS, et al. Comparison of physician-, biomarker-, and symptom-based strategies for adjustment of inhaled corticosteroid therapy in adults with asthma: the BASALT randomized controlled trial. Jama 2012;308(10):987-97. doi: 10.1001/2012.jama.10893 [published Online First: 2012/09/13].
- Damen J, Heus P, Spijker R, Jenniskens K, Kamm I, Nijman S, Vernooij R, Ghannad M, Korevaar D, Hooft L. Nut van FeNO bij de diagnostiek en behandeling van specifieke groepen astmapatiënten. Cochrane Netherlands 2021.
- Garg Y, Kakria N, Katoch CDS, et al. Exhaled nitric oxide as a guiding tool for bronchial asthma: A randomised controlled trial. Medical Journal Armed Forces India 2020;76(1):17-22. doi: https://doi.org/10.1016/j.mjafi.2018.02.001.
- GINA Report, Global Strategy for Asthma Management and Prevention (2023): https://ginasthma.org/wp-content/uploads/2023/07/GINA-2023-Full-report-23_07_06-WMS.pdf [geraadpleegd op 13-02-2024].
- Hashimoto S, Brinke AT, Roldaan AC, et al. Internet-based tapering of oral corticosteroids in severe asthma: a pragmatic randomised controlled trial. Thorax 2011;66(6):514-20. doi: 10.1136/thx.2010.153411 [published Online First: 2011/04/09].
- Heaney LG, Busby J, Hanratty CE, et al. Composite type-2 biomarker strategy versus a symptom-risk-based algorithm to adjust corticosteroid dose in patients with severe asthma: a multicentre, single-blind, parallel group, randomised controlled trial. Lancet Respir Med 2020 doi: 10.1016/s2213-2600(20)30397-0 [published Online First: 2020/09/12].
- Hirano T, Matsunaga K, Sugiura H, et al. Persistent elevation of exhaled nitric oxide and modification of corticosteroid therapy in asthma. Respiratory Investigation 2013;51(2):84-91. doi: https://doi.org/10.1016/j.resinv.2013.01.002.
- Hojo M, Mizutani T, Iikura M, et al. Asthma control can be maintained after fixed-dose, budesonide/ formoterol combination inhaler therapy is stepped down from medium to low dose. Allergology International 2013;62(1):91-98. doi: https://doi.org/10.2332/allergolint.12-oa-0444.
- Honkoop PJ, Loijmans RJB, Termeer EH, et al. Symptom- and fraction of exhaled nitric oxide-driven strategies for asthma control: A cluster-randomized trial in primary care. Journal of Allergy and Clinical Immunology 2015;135(3):682-88.e11. doi: https://doi.org/10.1016/j.jaci.2014.07.016.
- Juniper EF, O'Byrne PM, Guyatt GH, et al. Development and validation of a questionnaire to measure asthma control. Eur Respir J 1999;14(4):902-7. doi: 10.1034/j.1399-3003.1999.14d29.x [published Online First: 1999/11/26].
- Korevaar DA, Damen JA, Heus P, Moen MJ, Spijker R, van Veen IH, Weersink EJ, van Kemenade GJ, van Hal PTW, Hooft L. Effectiveness of FeNO-guided treatment in adult asthma patients: A systematic review and meta-analysis. Clin Exp Allergy. 2023 Aug;53(8):798-808. doi: 10.1111/cea.14359. Epub 2023 Jun 9. PMID: 37293870.
- Murphy VE, Jensen ME, Robijn AL, et al. How maternal BMI modifies the impact of personalized asthma management in pregnancy. Journal of allergy and clinical immunology: in practice 2019 doi: 10.1016/j.jaip.2019.06.033.
- Nathan RA, Sorkness CA, Kosinski M, et al. Development of the asthma control test: a survey for assessing asthma control. J Allergy Clin Immunol 2004;113(1):59-65. doi: 10.1016/j.jaci.2003.09.008 [published Online First: 2004/01/10].
- Petsky Helen L, Kew Kayleigh M, Chang Anne B. Exhaled nitric oxide levels to guide treatment for children with asthma. Cochrane Database of Systematic Reviews 2016;11:CD011439. doi: 10.1002/14651858.CD011439.pub2.
- Petsky HL, Kew KM, Turner C, et al. Exhaled nitric oxide levels to guide treatment for adults with asthma. Cochrane Database of Systematic Reviews 2016;9(9):CD011440. doi: 10.1002/14651858.CD011440.pub2.
- Powell H, Murphy VE, Taylor DR, et al. Management of asthma in pregnancy guided by measurement of fraction of exhaled nitric oxide: a double-blind, randomised controlled trial. Lancet 2011;378(9795):983-90. doi: 10.1016/s0140-6736(11)60971-9 [published Online First: 2011/09/13].
- Shaw DE, Berry MA, Thomas M, et al. The use of exhaled nitric oxide to guide asthma management: a randomized controlled trial. Am J Respir Crit Care Med 2007;176(3):231-7. doi: 10.1164/rccm.200610-1427OC [published Online First: 2007/05/15].
- Smith AD, Cowan JO, Brassett KP, et al. Use of exhaled nitric oxide measurements to guide treatment in chronic asthma. N Engl J Med 2005;352(21):2163-73. doi: 10.1056/NEJMoa043596 [published Online First: 2005/05/26].
- Syk J, Malinovschi A, Johansson G, et al. Anti-inflammatory treatment of atopic asthma guided by exhaled nitric oxide: a randomized, controlled trial. J Allergy Clin Immunol Pract 2013;1(6):639-48.e1-8. doi: 10.1016/j.jaip.2013.07.013 [published Online First: 2014/02/26].
- Truong-Thanh T, Vo-Thi-Kim A, Vu-Minh T, et al. The beneficial role of FeNO in association with GINA guidelines for titration of inhaled corticosteroids in adult asthma: A randomized study. Advances in Medical Sciences 2020;65(2):244-51. doi: https://doi.org/10.1016/j.advms.2020.03.001.
- Wang X, Wu L, Zhang Z, et al. The reliability of adjusting stepped care based on FeNO monitoring for patients with chronic persistent asthma. Open Medicine (Poland) 2019;14(1):217-23. doi: https://doi.org/10.1515/med-2019-0015.
- Zeiger RS, Schatz M, Yang SJ, et al. Fractional Exhaled Nitric Oxide-Assisted Management of Uncontrolled Persistent Asthma: A Real-World Prospective Observational Study. Permanente Journal 2019;23 doi: https://doi.org/10.7812/tpp/18-109.
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Khatri, S. B. and Iaccarino, J. M. and Barochia, A. and Soghier, I. and Akuthota, P. and Brady, A. and Covar, R. A. and Debley, J. S. and Diamant, Z. and Fitzpatrick, A. M. and Kaminsky, D. A. and Kenyon, N. J. and Khurana, S. and Lipworth, B. J. and McCarthy, K. and Peters, M. and Que, L. G. and Ross, K. R. and Schneider-Futschik, E. K. and Sorkness, C. A. and Hallstrand, T. S. Use of fractional exhaled nitric oxide to guide the treatment of asthma an official american thoracic society clinical practice guideline. American Journal of Respiratory and Critical Care Medicine. 2021; 204 (10) :E97-E109 |
Wrong type of publication (clinical practice guideline) |
|
Alahmadi, F. and Peel, A. and Keevil, B. and Niven, R. and Fowler, S. J. Assessment of adherence to corticosteroids in asthma by drug monitoring or fractional exhaled nitric oxide: A literature review. Clinical and Experimental Allergy. 2021; 51 (1) :49-62 |
Wrong type of publication (narrative review) |
|
Wang, R. and Usmani, O. S. and Chung, K. F. and Sont, J. and Simpson, A. and Bonini, M. and Honkoop, P. J. and Fowler, S. J. Domiciliary Fractional Exhaled Nitric Oxide and Spirometry in Monitoring Asthma Control and Exacerbations. Journal of Allergy and Clinical Immunology: In Practice. 2023; 11 (6) :1787-1795.e5 |
Wrong comparison; wrong setting (home measurements) |
|
Schneider A, Brunn B, Hapfelmeier A, Schultz K, Kellerer C, Jörres RA. Diagnostic accuracy of FeNO in asthma and predictive value for inhaled corticosteroid responsiveness: A prospective, multicentre study. EClinicalMedicine. 2022 Jul 1;50:101533. doi: 10.1016/j.eclinm.2022.101533. PMID: 35812996; PMCID: PMC9256551. |
Wrong type of publication (diagnostic accuracy study) |
|
Pianigiani T, Alderighi L, Meocci M, Messina M, Perea B, Luzzi S, Bergantini L, D'Alessandro M, Refini RM, Bargagli E, Cameli P. Exploring the Interaction between Fractional Exhaled Nitric Oxide and Biologic Treatment in Severe Asthma: A Systematic Review. Antioxidants (Basel). 2023 Feb 7;12(2):400. doi: 10.3390/antiox12020400. PMID: 36829959; PMCID: PMC9952501. |
Wrong type of publication (narrative review) |
|
Park JA, Cha H, Yang SK, Ryu HT, Kim DW, Hong SN, Yang MS, Kim DW. The Role of Fractional Exhaled Nitric Oxide in Diagnosing Asthmatic Type 2 Chronic Rhinosinusitis With Nasal Polyps. Am J Rhinol Allergy. 2023 Sep;37(5):524-530. doi: 10.1177/19458924231173205. Epub 2023 May 9. PMID: 37160729. |
Wrong type of publication (diagnostic accuracy study) |
|
Uematsu, M. and Saito, J. and Sato, S. and Fukuhara, A. and Suzuki, Y. and Rikimaru, M. and Onuma, T. and Tomita, H. and Watanabe, N. and Saito, M. and Morimoto, J. and Kawamata, T. and Umeda, T. and Togawa, R. and Sato, Y. and Koizumi, T. and Hirai, K. and Minemura, H. and Nikaido, T. and Kanazawa, K. and Tanino, Y. and Munakata, M. and Shibata, Y. Usefulness of diurnal variation of fractional exhaled nitric oxide for predicting early therapeutic response to asthma treatment. Journal of Asthma. 2022; 59 (10) :2039-2050 |
Does not fit the PICO (wrong comparison) |
|
Nakwan N, Thidarat Ruklerd T, Perkleang T, Taptawee P. The levels and correlations of FeNO, blood eosinophils and lung function in well-controlled asthma. Adv Respir Med. 2022 Jan 31. doi: 10.5603/ARM.a2022.0015. Epub ahead of print. PMID: 35099053. |
Wrong type of study |
|
Murphy VE, Jensen ME, Holliday EG, Giles WB, Barrett HL, Callaway LK, Bisits A, Peek MJ, Seeho SK, Abbott A, Robijn AL, Colditz PB, Searles A, Attia J, McCaffery K, Hensley MJ, Mattes J, Gibson PG. Effect of asthma management with exhaled nitric oxide versus usual care on perinatal outcomes. Eur Respir J. 2022 Nov 17;60(5):2200298. doi: 10.1183/13993003.00298-2022. PMID: 35777773; PMCID: PMC9669403. |
Does not fit the PICO (wrong population) |
|
Murphy VE, Porsbjerg CM, Robijn AL, Gibson PG. Biomarker-guided management reduces exacerbations in non-eosinophilic asthma in pregnancy: A secondary analysis of a randomized controlled trial. Respirology. 2020 Jul;25(7):719-725. doi: 10.1111/resp.13713. Epub 2019 Oct 26. PMID: 31656059. |
Does not fit the PICO (wrong population) |
|
Boer S, Honkoop PJ, Loijmans RJB, Snoeck-Stroband JB, Assendelft WJJ, Schermer TRJ, Sont JK. Personalised exhaled nitric oxygen fraction (FENO)-driven asthma management in primary care: a FENO subgroup analysis of the ACCURATE trial. ERJ Open Res. 2020 Sep 14;6(3):00351-2019. doi: 10.1183/23120541.00351-2019. PMID: 32963989; PMCID: PMC7487343. |
Wrong setting (primary care) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-11-2025
Beoordeeld op geldigheid : 12-09-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met niet-acute astma in de tweedelijn.
Werkgroep
- Dr. B. (Bas) Langeveld, longarts, werkzaam in het Deventer ziekenhuis te Deventer, NVALT (voorzitter)
- Dr. A. (Astrid) Aardenburg – van Huisstede, longarts, werkzaam in Noordwest Ziekenhuisgroep
- Dr. M (Marijke) Amelink, longarts, werkzaam in het Spaarne Gasthuis te Haarlem, NVALT
- Drs. L.M. (Leonie) Imming, longarts, werkzaam in Medisch Spectrum Twente te Enschede, NVALT
- Dr. B. (Bart) Hilvering, longarts, werkzaam in het Amsterdam UMC te Amsterdam, NVALT
- Dr. J.N.G. (Hanneke) Oude Elberink, allergoloog, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NIV/NVvAKI
- Dr. M.E. (Marjolein) Cornet, KNO-arts, werkzaam in het Alrijne ziekenhuis te Leiden, NVKNO
- Prof. dr. J.W.M. (Jean) Muris, huisarts en hoogleraar Huisartsgeneeskunde, NHG
- Drs. M.H.A. (Mariëtte) Scholma-Bronsema, verpleegkundige specialist Astma/COPD/OSA, werkzaam in het Wilhelmina Ziekenhuis te Assen, V&VN
- Drs. Y. (Yvonne) Kappe, senior beleidsadviseur, Longfonds & VND
- Drs. E.M. (Esther) van der Roest, ervaringsdeskundige, VND
- S.T. (Saskia) van Dorst M, ervaringsdeskundige, Longfonds
Klankbordgroep
- Wendy Bokxem, Verpleegkundig specialist longgeneeskunde i.o, werkzaam in Ziekenhuisgroep Twente te Hengelo, V&VN
Met ondersteuning van
- M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Janneke) Hoogervorst-Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.N. (Nynke) Kampstra, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Werkgroep
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. B. (Bas) Langeveld, (voorzitter) |
Longarts, Deventer ziekenhuis |
Incidenteel deelname adviesraad industrie (AstraZeneca, Novartis, GSK) over biologicals (betreft ernstig astma, dit valt buiten scope van de richtlijn) |
Deelname Studies: AstraZeneca: ANDHI, tot 2019 GSK: NIMBLE, start 2e kwartaal 2022 (PI) Studies betreffen middelen voor de behandeling van ernstig astma, dit valt buiten de inhoud van deze richtlijn. Opbrengst komt ten goede van de onderzoeksafdeling longziekten van het Deventer ziekenhuis |
Geen restricties (ernstig astma valt buiten deze richtlijn). Deelname adviesraad wordt neergelegd gedurende richltijnontwikkeling. |
|
Dr. A. (Astrid) Aardenburg – van Huisstede |
Longarts, Noordwest Ziekenhuisgroep |
Bijscholing huisartsen CASPIR (betaald) Principal Investigator diverse onderzoeken opgezet door farmacie (betaald) |
Voor alle genoemde studies lokale projectleider: * UMCG - High-flow therapie bij COPD * Astra Zeneca - Oberon studie (COPD) * Franciscus Gasthuis - Tricolon studie (COPD) * Rapsodie database ernstig astma - Geen projectleider |
Geen restricties |
|
Dr. M (Marijke) Amelink |
Longarts, Spaarne ziekenhuis |
Research waarbij unrestricted grant van teva (onbetaald voor mij) mbt ernstig astma. - spreker caspir cursus (betaald via caspir) - verschillende keren een adviesraad gedaan voor pharmacie (eenmalige vergoeding voor astra Z, GSK, Sanofi) - mede voorzitter noord NL symposium met Els Weersink (sponsor chiesi, onbetaald). Staat los van astma. Ik heb geen aandelen, opties of financiële belangen bij een bedrijf. Geen lopend betaald adviseurschap. |
1 unrestricted grand mbt ernstig astma |
Geen restricties |
|
Drs. L.M. (Leonie) Imming |
Longarts, MST |
Geen |
GSK: NIMBLE, start 2e kwartaal 2022. Studie betreft middelen voor de behandeling van ernstig astma, dit valt buiten de inhoud van deze richtlijn. |
Geen restricties |
|
Dr. B. (Bart) Hilvering |
Longarts, Amsterdam UMC |
Incidenteel advisory boards en voordrachten over ernstig astma door GSK, AstraZeneca, Sanofi, dit valt buiten de scope van de richtlijn |
Lokale PI voor de AIRLEAF en CLAIRLEAF studie, geïnitieerd door Boehringer Ingelheim, medicatie voor bronchiectasieen, dit valt buiten de scope van de richtlijn |
Geen restricties |
|
Dr. J.N.G. (Hanneke) Oude Elberink |
Internist-allergoloog, UMCG |
Geen |
Geen |
Geen restricties |
|
Dr. M.E. (Marjolein) Cornet |
KNO-arts, Alrijne ziekenhuis |
Geen |
Geen |
Geen restricties |
|
Prof. dr. J.W.M. (Jean) Muris |
Geen |
Geen |
Geen |
Geen restricties |
|
M.H.A. (Mariëtte) Scholma-Bronsema |
Verpleegkundig specialist longziekten Wilhelmina Ziekenhuis Assen |
Vrijwilliger longfonds voorzitter kwaliteitsteam Assen van de Huisartsen Zorg Drenthe. Lid van transmurale zorg aanpak astma-COPD (landelijke commissie). |
Geen |
Geen restricties |
|
Drs. Y. (Yvonne) Kappe |
Projectleider Longfonds en astmaVereniging Nederland en Davos
|
Geen |
Geen |
Geen restricties |
|
Drs. E.M. (Esther) van der Roest |
ErvaringsdeskundigeastmaVereniging Nederland en Davos |
Geen |
Geen |
Geen restricties |
|
S.T.M. (Saskia) van Dorst |
Ervaringsdeskundige Longfonds |
Geen |
Geen |
Geen restricties |
Klankbordgroep
|
Klankbordgroep lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. W. (Wendy) Bokxem |
Verpleegkundig specialist longgeneeskunde, ZGT Hengelo |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van astmaVereniging Nederland en Davos en Longfonds in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kopje waarden en voorkeuren van patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patientenfederatie Nederland en de aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz. Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
| Module |
Uitkomst raming |
Toelichting |
|
Rol van FeNO in behandeling van astma
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met niet-acute astma. Tevens zijn er (aanvullende) knelpunten aangedragen door de Nederlandse Associatie Physician Assistants, Longfonds en Astma Vereniging Nederland en Davos, NVALT-sectie astma & allergie, COPD & Astma Huisartsen Advies Groep en de Nederlandse Vereniging van Ziekenhuizen via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekstrategie
Embase (06-06-2023 - Period from 01-01-2020)
|
|
Embase |
|
|
No. |
Query |
Results |
|
#12 |
#9 OR #10 OR #11 |
1109 |
|
#11 |
#4 AND (#7 OR #8) NOT #9 NOT #10 OBS |
603 |
|
#10 |
#4 AND #6 NOT #9 Clinical trials,RCTs |
390 |
|
#9 |
#4 AND #5 SR |
116 |
|
#8 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14144639 |
|
#7 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#6 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3302394 |
|
#5 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#4 |
#3 AND [2020-2023]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1442 |
|
#3 |
#1 AND #2 |
9713 |
|
#2 |
'asthma'/exp OR 'bronchus hyperreactivity'/exp OR 'airway obstruction'/exp OR (((airway OR airflow OR repirator*) NEAR/2 (obstruct* OR occlusion* OR closure)):ti,ab,kw) OR ((bronch* NEAR/2 (hyperreactiv* OR 'hyper reactiv*' OR hyperrespons* OR 'hyper respons*')):ti,ab,kw) OR asthma*:ti,ab,kw OR wheez*:ti,ab,kw |
413588 |
|
#1 |
'nitric oxide'/exp AND ('biological marker'/exp OR 'breath analysis'/exp OR 'exhalation'/exp) OR 'fractional exhaled nitric oxide'/exp OR 'fractional exhaled nitric oxide test'/exp OR 'feno':ti,ab,kw OR eno:ti,ab,kw OR (((fe OR exhal* OR fraction*) NEAR/2 (no OR nitric* OR nitrogen*)):ti,ab,kw) |
22689 |
Ovid/Medline
|
|
Ovid/Medline |
|
|
11 |
(4 and (7 or 8)) not 9 not 10 OBS |
377 |
|
10 |
(4 and 6) not 9 Clinical trials, RCTs |
204 |
|
9 |
4 and 5 SR |
59 |
|
8 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5437927 |
|
7 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4453456 |
|
6 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2595280 |
|
5 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
672162 |
|
4 |
limit 3 to yr="2020 -Current" |
1004 |
|
3 |
1 and 2 |
4339 |
|
2 |
Fractional Exhaled Nitric Oxide Testing/ or feno.ti,ab,kf. or (exhaled adj3 ("NO" or nitric oxide*)).ti,ab,kf. |
6129 |
|
1 |
exp Asthma/ or Bronchial Hyperreactivity/ or Airway Obstruction/ or ((airway or airflow or repirator*) adj2 (obstruct* or occlusion* or closure)).ti,ab,kf. or (bronch* adj2 (hyperreactiv* or hyper reactiv* or hyperrespons* or hyper respons*)).ti,ab,kf. or asthma*.ti,ab,kf. or wheez*.ti,ab,kf. |
241186 |