Behandeling EUG: MTX
Uitgangsvraag
Wat is het optimale methotrexaat (MTX) schema bij de behandeling van een extra-uteriene graviditeit (EUG) of een persisterende zwangerschap met onbekende locatie (ZOL)?
Aanbeveling
Kies voor een enkele dosering MTX bij vrouwen met een asymptomatische EUG of persisterende ZOL en een indicatie voor behandeling met MTX conform de huidige richtlijn (hCG waarde onder de 5000 IU/L).
Geef alleen een herhaalde dosering indien het hCG onvoldoende (<15%) daalt 1 week na de eerste enkele dosering conform aan de huidige richtlijn.
Overwegingen
Balans tussen gewenste en ongewenste effecten
De dubbele dosis methotrexaat (MTX) zou moeten leiden tot meer succesvolle behandeling (daling van hCG) en minder complicaties (noodzaak tot chirurgisch ingrijpen). Een nadeel van de dubbele dosis is dat er meer bijwerkingen worden verwacht. Uit de literatuuranalyse blijkt dat het effect van de dubbele dosis nauwelijks klinisch relevant beter is dan van de enkele dosis (RR 1,10; 95% BI 1,03 tot 1,18; NNT 12; 95% BI 7 tot 42). Bij 80% van de patiënten in de geïncludeerde studies die een enkele dosis kregen was de behandeling succesvol. Wat betreft complicaties is er onvoldoende informatie om een duidelijke conclusie te trekken. Complicaties waren tamelijk zeldzaam (9% na een enkele dosering en 6% na dubbele dosis) en niet significant verschillend tussen de groepen. Wel zijn er waarschijnlijk iets meer bijwerkingen bij de dubbele dosis met een RR van 1,35 (95% BI 1,00 tot 1,82). Een enkele dosis is wellicht iets minder effectief, maar leidt waarschijnlijk niet tot veel meer complicaties. In beide regimes wordt er op dag 7 na de eerste toediening weer hCG bepaald en kan bij onvoldoende daling alsnog een herhaalde dosering MTX worden gegeven.
De gemiddelde hCG waarden van patiënten in de geïncludeerde studies waren relatief hoog, met uitschieters ver boven de aanbeveling uit de NVOG richtlijn van hCG 5000 IU/L. Binnen de geïncludeerde studies kon geen analyse worden verricht naar de effectiviteit van een dubbele dosering bij hogere hCG waardes.
Kwaliteit van bewijs
De overall kwaliteit van bewijs is laag. Dit betekent dat we onzeker zijn over het gevonden geschatte effect van de cruciale uitkomstmaten. Met name grotere studies zullen bijdragen aan meer zekerheid over het gevonden effect.
Er is afgewaardeerd vanwege zeer ernstige imprecisie: onnauwkeurigheid, omdat het betrouwbaarheidsinterval beide grenzen van klinische relevantie overschrijdt.
Er is niet afgewaardeerd vanwege Risk of Bias, hoewel de patiënten en behandelaars niet geblindeerd konden worden. We gaan ervan uit dat de uitkomsten niet subjectief te beïnvloeden zijn. Bij de studie van Navali, 2018, was er twijfel over de juistheid van de gerapporteerde resultaten voor complicaties en voor bijwerkingen, omdat er in deze studie sprake was van selectieve loss to follow-up. In de interventiegroep stopten vier van de 60 deelnemers met de studie, onduidelijk is op welk moment, vanwege ‘ontevredenheid’. Daarnaast werden de bijwerkingen niet per patiënt gerapporteerd, maar per bijwerking. Omdat er twijfel was over de rapportage van bijwerkingen in deze studie en de resultaten nogal afweken van die van de andere studies voor deze uitkomst, zijn die niet meegenomen in de meta-analyse over bijwerkingen.
Waarden en voorkeuren van patiënten (en eventueel hun naasten/verzorgers)
De belasting voor patiënten van de behandeling met MTX in het algemeen wordt wisselend ervaren, ook afhankelijk van de setting en toelichting die aan de patiënt wordt gegeven bij voorschrijven van dit medicijn.
In sommige ziekenhuizen wordt MTX in het patiëntendossier direct als chemotherapie gelabeld, en het kan ook voorkomen dat patiënten de medicatie op een oncologische afdeling moeten ontvangen. Voor een beschrijving van de juiste arbeidshygiëne rondom MTX toediening verwijzen we naar een recent artikel hierover (Verwiel, 2021).
Overwegend zullen patiënten een 2de dosering met MTX waarschijnlijk liever achterwege laten als de effectiviteit weinig verschilt en met minder kans op bijwerkingen.
Het advies om tot 3 maanden na behandeling met MX niet zwanger te worden is na een enkele dosering gelijk aan een dubbele dosering; dat weegt derhalve niet mee in deze afweging.
Ongewenste effecten
Ongewenste effecten van een behandeling met MTX kunnen complicaties en bijwerkingen betreffen. Er werd in de meta-analyse geen duidelijk verschil gevonden in het aantal complicaties, zoals een spoed operatie in verband met verdenking tuba ruptuur, na een enkele of dubbele dosis MTX. Wel zijn er na een dubbele dosis iets meer bijwerkingen.
Kostenaspecten
Bij de werkgroep zijn geen kosten-effectiviteitsanalyses bekend over een enkele versus dubbele dosering MTX. MTX is een op zichzelf een goedkoop medicijn, echter het ziekenhuisbezoek bij een toediening, inclusief de voorbereiding van het medicijn, is wel een kostbare aangelegenheid. Dubbele dosering is weinig effectiever dan enkele dosering. Bij een enkele dosering scheelt dit precies de helft in de totale kosten van een dubbele dosering en dit aspect draagt dus bij aan de overweging om tot de aanbeveling voor een enkele dosering te komen.
Gelijkheid ((health) equity/equitable)
Er is geen verschil in gezondheidsgelijheid bij enkele versus dubbele dosering. De behandeling van een EUG betreft basis spoedzorg voor iedereen. Voorwaarde voor behandeling met MTX in zijn algemeenheid is dat er altijd 24/7 toegang tot zorg moet zijn. Wanneer dit niet het geval is, dan is MTX geen goede strategie.
Aanvaardbaarheid:
Ethische aanvaardbaarheid
De interventie lijkt aanvaardbaar voor de betrokkenen. Er zijn geen ethische bezwaren.
Duurzaamheid
Bij een dubbele dosering MTX spelen de ziekenhuisbezoeken, en de reisbewegingen van en naar het ziekenhuis een grotere rol; dit is gehalveerd bij een enkele dosering MTX.
Haalbaarheid
De interventie lijkt haalbaar. De interventie is over het algemeen al standaardzorg in de praktijk.
Rationale van aanbeveling-1: weging van argumenten voor en tegen de interventies
Bij vrouwen met een asymptomatische EUG of persisterende ZOL s een dubbele dosering maar marginaal effectiever dan een enkele dosering. Gezien het gelijke aantal complicaties en minder bijwerkingen in het regime van een enkele dosering, heeft het de voorkeur om een enkele dosering te geven. Te meer omdat bij een enkele dosering de patiënt een ziekenhuisbezoek bespaard blijft, wat vanuit patiëntperspectief, economisch en duurzaamheidsperspectief beter is.
Rationale van aanbeveling-2: weging van argumenten voor en tegen de interventies
Bij een enkele dosering wordt het hCG na 7 dagen toch ook herhaald, bij onvoldoende daling is er voldoende ruimte om een herhaalde dosering MTX te geven.
Onderbouwing
Achtergrond
In patients with an ectopic pregnancy or persistent pregnancy of unknown location (PUL) without clinical symptoms MTX may be the preferred treatment of choice. According to the former Dutch guideline MTX was given in a single dose regimen in case of serum hCG values below 5000 IU/L. The question is whether a double dose regimen, given on day 0 and day 4 may be a more effective treatment, meaning faster and uneventful decline of serum hCG.
Conclusies / Summary of Findings
|
Outcome Timeframe |
Study results and measurements |
Absolute effect estimates |
Certainty of the evidence (Quality of evidence) |
Summary |
|
|
Single dose MTX |
Double dose MTX |
||||
|
Treatment success
|
Relative risk: 1.1 (CI 95% 1.03 - 1.18) Based on data from 601 participants in 5 studies
|
801 per 1000 |
881 per 1000 |
Moderate Due to serious imprecision1 |
Double dose MTX probably leads to little or no difference on treatment success (Hamed, 2012; Navali, 2018; Saadati, 2015; Saleh, 2016; Song, 2015) |
|
Difference: 80 more per 1000 (CI 95% 24 more - 144 more) |
|||||
|
Complications
|
Relative risk: 0.64 (CI 95% 0.36 - 1.14) Based on data from 601 participants in 5 studies
|
93 per 1000 |
60 per 1000 |
Low Due to very serious imprecision2 |
Double dose MTX may decrease complications (Hamed, 2012; Navali, 2018; Saadati, 2015; Saleh, 2016; Song, 2015) |
|
Difference: 33 fewer per 1000 (CI 95% 60 fewer - 13 more) |
|||||
|
Side effects
|
Relative risk: 1.35 (CI 95% 1.0 - 1.82) Based on data from 485 participants in 4 studies
|
227 per 1000 |
306 per 1000 |
Moderate Due to serious imprecision3 |
Double dose MTX probably increases side effects (Hamed, 2012; Saadati, 2015; Saleh, 2016; Song, 2015) |
|
Difference: 79 more per 1000 (CI 95% 0 fewer - 186 more) |
|||||
- Imprecision: serious. Wide confidence intervals; the 95% CI overlaps with one of the limits of clinical relevance
- Imprecision: very serious. Wide confidence intervals. Both the upper and lower limits of clinical relevance are crossed by the 95% CI.
- Imprecision: serious. Wide confidence intervals; the 95% CI overlaps with one of the limits of clinical relevance
Samenvatting literatuur
Description of studies
Five studies, all RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in Table 2. The assessment of the risk of bias is summarized in the risk of bias tables (below ‘Bijlagen’).
All five studies were RCTs including women with a diagnosis of EP based on hCG level and transvaginal ultrasound. The maximum hCG level for inclusion varied from 5000 mIU/ml (Navali, 2018) to 15000 mIU/ml (Hamed, 2012; Saadati, 2015; Song, 2015). In the study by Saleh (2016) the maximum hCG level for inclusion was 6000 mIU/ml.
Table 2. Characteristics of included studies
|
Study |
Participants (number, age, other important characteristics) |
Comparison |
Follow-up |
Outcome measures |
Comments |
Risk of bias* |
|
Hamed, 2012 |
N at baseline Intervention: 79 Control: 78
Age Intervention: 23.1±6.5 (19–35) Control: 25.4±4.7 (18–36)
β-hCG, mIU/mL Intervention: 3565.8±1977.6 (550–9200) Control: 3158.4±1462.4 (450–8800) |
Intervention: double dose 50 mg/m2 MTX intramuscularly on days 0 and 4 Control: single-dose, 50 g/m2 MTX intramuscularly on day 0 |
6 weeks |
1. Success rate, defined as a 15% or higher drop in serum β-hCG level between day 4 and day 7, 2. Adverse effects (abdominal pain, gastro-intestinal symptoms, mucositis, loss of hair, elevated liver enzymes, thrombocytopenia, leucopenia, separately or in combination) 3. Complications (emergency laparotomy) |
“No conflicts of interest” Qassim, Saudi Arabia |
LOW |
|
Navali, 2018 |
N at baseline Intervention: 60 Control: 60
Age Intervention: 31.8±5.7 Control: 31.1±5.2
β-hCG, mIU/ml Intervention: 3478±860 Control: 3174±854
|
Intervention: two doses of intramuscular MTX 50 mg/m2 on day 0 and 4 Control: single-dose of intramuscular MTX 50 mg/m2 |
4 weeks(?) |
1. Success rate (15% reduction hCG) 2. Side effects (most common and reported here: abdominal pain) 3. Complications (surgery required) |
“No conflicts of interest” Tabriz, Iran |
Some concerns |
|
Saadati, 2015 |
N at baseline Intervention: 38 Control: 38
Age Intervention: 27±6 Control: 28±7
β-hCG, mIU/ml Intervention: 3311 ± 1250 Control: 3249 ± 1427 |
Intervention: two doses of intramuscular MTX 50 mg/m2 on day 0 and 4
Control: single-dose of intramuscular MTX 50 mg/m2 |
Not reported |
1. Success rate (15% reduction hCG) 2. Side effects (vomiting and gastro-intestinal symptoms) 3. Complications (operations) |
Funding: Ahvaz Jundishapur University of Medical Sciences, No Declaration of Interests Ahvaz, Iran |
LOW |
|
Saleh, 2016 |
N at baseline Intervention: 80 Control: 80
Age Intervention: 23.3±3.8 ( 17-36 ) Control: 21.3±5.4 (18-34)
β-hCG, mIU/ml Intervention: not reported |
Intervention: two doses of intramuscular MTX 50 mg/m2 on day 1 and 4
Control: single-dose of intramuscular MTX 50 mg/m2 |
6 weeks |
1. Success rate (15% or more drop in serum β-hCG level between day 4 and day 7), 2. Side effects (abdominal pain, gastro-intestinal symptoms, mucositis, elevated liver enzymes, loss of hair, separately or in combination) 4. Complications (emergency laparotomy) |
No declaration of interest Zagazig, Egypt |
LOW |
|
Song, 2015 |
N at baseline Intervention: 46 Control: 46
Age Intervention: 30.8+3.9 Control: 30.5+4.1
β-hCG, mIU/ml Intervention: 4127 (493–14891) Control: 3845 (525–13030) |
Intervention: two doses of intramuscular MTX 50 mg/m2 on day 0 and 4
Control: single-dose of intramuscular MTX 50 mg/m2 |
Not reported |
1. Success rates (15% decrease in the b-hCG level), 2. Side effects (abdominal pain, nausea, vomiting, mucositis, elevated liver enzymes, leucopenia, thrombocytopenia, diarrhea, hair loss, separately or in combination) 3. Complications (surgery because of suspicions of rupture) |
No Conflicts of Interest reported, Seoul, Republic of Korea |
LOW |
*For further details, see risk of bias table in the appendix
Results
Critical outcomes
1. Treatment success
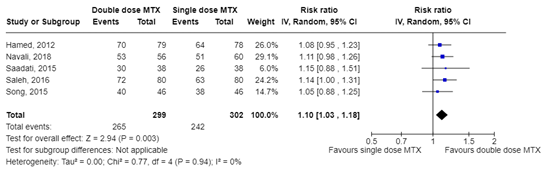
The composite outcome preferred by the working group was not reported in any of the included studies. Successful treatment was defined as at least 15% drop in serum hCG level in all five included studies, comprising 601 patients. The pooled Risk Ratio (RR) of double dose versus single dose MTX was 1.10 (95% CI 1.03 to 1.18), in favor of the double dose, as shown in Figure 1. This point estimate is equal to the minimal clinically relevant difference.
Figure 1. Treatment success comparison double dose versus single dose MTX
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
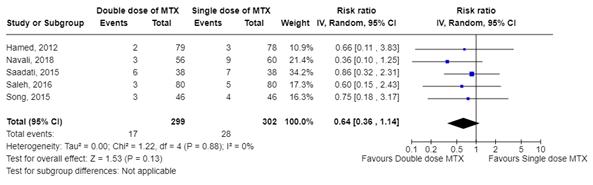
2. Complications
Complications were defined as emergency surgery in most included studies (see Table 2). This outcome was reported in all included studies, comprising 601 patients. The pooled Risk Ratio (RR) of double dose versus single dose MTX was 0.64 (95% CI 0.36 to 1.14) in favor of the double dose, as shown in Figure 2. This is larger than the minimal clinically important difference. In a sensitivity analysis, the data from Navali, 2018 were excluded because of some concerns about potential bias in this study. This sensitivity analysis yielded a RR 0.74 (95% CI 0.39 to 1.43), in favor of the double dose. This does not change the conclusion.
Figure 2. Complications comparison double dose versus single dose MTX
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
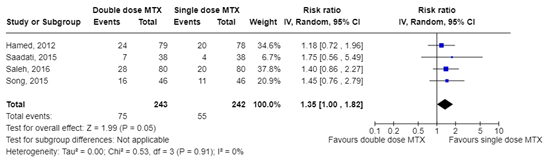
3. Side effects
Side effects were reported differently in the included studies. In four studies all women experiencing one or more side effects were reported (Hamed, 2012; Saadati, 2015; Saleh, 2016; Song, 2016). In one study data were reported at the level of individual side effects (Navali, 2018). The results of this study differed considerably from the other four studies; for this reason and because there was potential bias in this study, it was left out of the meta-analysis. The pooled Risk Ratio (RR) was 1.35 (95% CI 1.00 to 1.82), as shown in Figure 3. This point estimate is clinically relevant in favor of the single dose.
Figure 3. Side effects comparison double dose versus single dose MTX
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Important outcome
Future chance of pregnancy or time to next pregnancy
This outcome was not reported in any of the included RCTs.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of systemic methotrexate ‘double dose’ compared to ‘single dose’ as a treatment for patients with EUG or persistent PUL?
Wat is de effectiviteit van systemisch methotrexaat ‘dubbele dosis‘ in vergelijking tot ‘enkele (single) dosis’ als behandeling van patiënten met een EUG of een persisterende ZOL?
Table 1. PICO
|
Patients |
Patients with EUG or persistent PUL, subgroups high (>5000) and low (<5000) hCG |
|
Intervention |
Systemic methotrexate double doses max 4 days apart |
|
Control |
Systemic methotrexate single dose |
|
Outcomes |
1. Successful treatment, defined as (a combination of) the following 1.1 Uncomplicated decrease of hCG 1.2 Complications 1.3 Side effects of MTX 2. Future chance of pregnancy or time to next pregnancy |
|
Other selection criteria |
Study design: systematic reviews and randomized controlled trials |
Relevant outcome measures
The guideline panel considered successful treatment as a critical outcome measure for decision making; and future chance of pregnancy as important outcome measures for decision making.
A priori, the guideline panel did not define the outcome measures listed above but used the definitions used in the studies.
The guideline panel defined a RR <0.9 or >1.1 as a minimal clinically (patient) important difference for successful treatment and complications and a RR <0.8 or >1.25 as a minimal clinically (patient) important difference for side effects of MTX.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched using relevant search terms from 2014 until 18 April, 2024. The detailed search strategy is listed under the tab ‘Literature search strategy’. The systematic literature search resulted in 778 hits. Studies were selected based on the following criteria: (systematic reviews of) RCTs comparing the effect of double and single dose of methotrexate in women with EUG or persistent PUL and reporting one or more of the above mentioned outcomes. Nine studies, six SRs and three RCTs, were initially selected based on title and abstract screening. After reading the full text, All six SRs were excluded (see the exclusion table below ‘Bijlagen’), and five RCTs (all three initially selected and two that were included in the SRs) were included.
Referenties
- Hamed HO, Ahmed SR, Alghasham AA. Comparison of double-and single-dose methotrexate protocols for treatment of ectopic pregnancy. Int J Gynecol Obstet. 2012;116:67–71.
- Navali N, Asl NJ, Moosavi S. Methotrexate in unruptured ectopic pregnancy: comparing the single-and double-dose treatment. Advances in Bioscience and Clinical Medicine. 2018;6(3):1–6.
- Saadati N, Najafian M, Masihi S, Safiary S, Abedi P. Comparison of two different protocols of methotrexate therapy in medical management of ectopic pregnancy. Iranian Red Crescent Medical Journal, 2015, 17.12.
- Saleh HS, Mowafy HE, abd El Hameid AA, Abdelsalam WA, Sherif HE. Double versus single dose methotrexate regimens in management of undisturbed ectopic pregnancy. Crit Care Obstet Gynecol. 2016;2:1–5.
- Song T, Kim MK, Kim ML, Jung YW, Yun BS, Seong SJ. Single-dose versus two-dose administration of methotrexate for the treatment of ectopic pregnancy: a randomized controlled trial. human reproduction. 2016;31(2):332-338.
- Verwiel LN, Crul M, Lemmers M, van Mello NM (2021). Wat u altijd al wilde weten over MTX-gebruik bij een EUG of ZOL. Nederlands Tijdschrift voor Obstetrie en Gynaecologie. 2021; 134:70-74.
Evidence tabellen
Risk of Bias table
Research question: What is the effectiveness of systemic methotrexate ‘double dose’ compared to ‘single dose’ as a treatment for patients with EUG or persistent PUL?
|
Study reference
|
Was the allocation sequence adequately generated?
|
Was the allocation adequately concealed?
|
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? |
Was loss to follow-up (missing outcome data) infrequent?
|
Are reports of the study free of selective outcome reporting?
|
Was the study apparently free of other problems that could put it at a risk of bias?
|
Overall risk of bias If applicable/necessary, per outcome measure
|
|
Hamed, 2012 |
Probably yes
Reason: computer-generated random numbers |
Probably yes
Reason: serially numbered opaque envelopes |
Definitely no
Reason: blinding not possible |
Definitely yes
Reason: no loss to follow-up |
Probably yes
Reason: Results in line with methods |
Probably yes
Reason: no other problems |
LOW
|
|
Navali, 2018 |
No information
Reason: not reported |
Probably yes
Reason: closed envelopes |
Definitely no
Reason: blinding not possible |
Probably yes
Reason: 4/60 in intervention group dropped out, unclear when |
Probably yes
Reason: Results in line with methods |
Probably no
Reason: “4 patients from group 2 left the study due to dissatisfaction”. Not clear when these patients dropped out |
Some concerns |
|
Saadati, 2015 |
Probably yes
Reason: ‘block randomization’ |
Probably yes
Reason: closed envelopes |
Definitely no
Reason: blinding not possible |
Definitely yes
Reason: no loss to follow-up |
Probably yes
Reason: Results in line with methods |
Probably yes
Reason: no other problems |
LOW |
|
Saleh, 2016 |
Probably yes
Reason: computer programme |
Probably yes
Reason: “sequentially numbered opaque envelopes sealed by a third person” |
Definitely no
Reason: blinding not possible |
Definitely yes
Reason: no loss to follow-up |
Probably yes
Reason: Results in line with methods |
Probably yes
Reason: no other problems |
LOW |
|
Song, 2015 |
Probably yes
Reason: “randomly permuted blocks by using software available online” |
Probably yes
Reason: serially numbered opaque envelopes |
Definitely no
Reason: blinding not possible |
Definitely yes
Reason: no loss to follow-up |
Probably yes
Reason: Results in line with methods |
Probably yes
Reason: no other problems |
LOW |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Al Wattar BH, Solangon SA, de Braud LV, Rogozińska E, Jurkovic D. Effectiveness of treatment options for tubal ectopic pregnancy: A systematic review and network meta-analysis. BJOG. 2024 Jan;131(1):5-14. |
SR, only used to identify RCTs |
|
Alleyassin A, Khademi A, Aghahosseini M, Safdarian L, Badenoosh B, Hamed EA. Comparison of success rates in the medical management of ectopic pregnancy with single-dose and multiple-dose administration of methotrexate: A prospective, randomized clinical trial. Fertil Steril. 2006;85:1661–1666. |
Intervention different from PICO |
|
Alur-Gupta S, Cooney LG, Senapati S, Sammel MD, Barnhart KT. Two-dose versus single-dose methotrexate for treatment of ectopic pregnancy: a meta-analysis. Am J Obstet Gynecol. 2019 Aug;221(2):95-108.e2. |
SR, only used to identify RCTs |
|
Amirian M, Rajaee M, Moayedi U, Mohammadi F, Hosseini S. Comparison of single and multiple-dose methotrexate therapy for ectopic pregnancy: A clinical trail. Life Sci J. 2013;10:564–567. |
Intervention different from PICO |
|
Balcı, S., & Sel, G. (2021). Single Versus Two-Dose Methotrexate in Ectopic Pregnancy Treatment: Meta-analysis. Current Obstetrics and Gynecology Reports, 10(4), 107-114. |
SR, only used to identify RCTs |
|
Golmohammadlou S, Hajishafiha M, Hasankhani Z. Comparison of single and two dose of methotrexate in treatment of ectopic pregnancy. Iran J Reprod Med. 2012;10:74. |
Not in English |
|
Guvendag Guven ES, Dilbaz S, Dilbaz B, Aykan Yildirim B, Akdag D, Haberal A. Comparison of single and multiple dose methotrexate therapy for unruptured tubal ectopic pregnancy: A prospective randomized study. Acta Obstet Gynecol Scand. 2010;89:889–895. |
Intervention different from PICO |
|
Khakwani M, Parveen R, Ali S. Treatment success with two doses of methotrexate vs single dose of methotrexate in Ectopic Tubal Pregnancy. Pakistan Journal of Medical Sciences, 2022;38.6: 1436. |
Intervention different from PICO |
|
Klauser CK, May WL, Johnson VK, Cowan BD, Hines RS. Methotrexate for ectopic pregnancy: A randomized “single dose” compared with “multidose” trial. Obstet Gynecol. 2005;105:64S. |
Not a complete article (poster abstract) |
|
Mergenthal MC, Senapati S, Zee J, Allen-Taylor L, Whittaker PG, Takacs P, Sammel MD, Barnhart KT. Medical management of ectopic pregnancy with single-dose and 2-dose methotrexate protocols: human chorionic gonadotropin trends and patient outcomes. Am J Obstet Gynecol. 2016 Nov;215(5):590.e1-590.e5. |
Not randomized |
|
Tabatabaii Bafghi A, Zaretezerjani F, Sekhavat L, Dehghani Firouzabadi R, Ramazankhani Z. Fertility outcome after treatment of unruptured ectopic pregnancy with two different methotrexate protocols. Int J Fertil Steril. 2012;6:189–194. |
Intervention different from PICO |
|
Xiao, C., Shi, Q., Cheng, Q., & Xu, J. (2021). Non-surgical management of tubal ectopic pregnancy: a systematic review and meta-analysis. Medicine, 100(50), e27851. |
SR, only used to identify RCTs |
|
Yang, C., Cai, J., Geng, Y., & Gao, Y. (2017). Multiple-dose and double-dose versus single-dose administration of methotrexate for the treatment of ectopic pregnancy: a systematic review and meta-analysis. Reproductive biomedicine online, 34(4), 383-391. |
SR, only used to identify RCTs |
|
Yuk JS, Lee JH, Park WI, Ahn HS, Kim HJ. Systematic review and meta-analysis of single-dose and non-single-dose methotrexate protocols in the treatment of ectopic pregnancy. Int J Gynaecol Obstet. 2018 Jun;141(3):295-303. |
SR, only used to identify RCTs |
|
Zargar M, Razi T, Barati M. Comparision of single and multidose of methotrexate in medical treatment of ectopic pregnancy. Pak J Med Sci. 2008;24:586–589. |
Intervention different from PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-06-2025
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Samenstelling van het cluster
Voor het ontwikkelen van Benigne Gynaecologie cyclus 2 is in 2023 een multidisciplinaire cluster ingesteld. Dit cluster bestaat uit vertegenwoordigers van alle relevante organisaties die betrekking hebben op de zorg voor patiënten met hevig menstrueel bloedverlies, patiënten in de menopauze en patiënten met EUG of ZOL.
Het cluster Benigne Gynaecologie bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule.
Het cluster Benigne Gynaecologie cyclus 2 bestaat uit de onderstaande personen. Voor een overzicht per module, zie Samenstelling van de werkgroep. Sommige werkgroepleden zijn schrijver en meelezer bij meerdere modules.
Clusterstuurgroep
- (Voorzitter) Timmermans, Mevr. dr. A. (Anne), gynaecoloog, AmsterdamUMC, Amsterdam, NVOG
- Breijer, Mevr. dr. M.C. (Merel), gynaecoloog, ADRZ, Goes en Vlissingen, NVOG
- Lips, Dhr. dr. D.J. (Daan), gastrointestinaal/oncologisch chirurg met HPB specialisatie, MST, Enschede, NVvH
- Radder, Mevr. Dr. C.M. (Celine), gynaecoloog, OLVG, Amsterdam, NVOG
Schrijvers module Behandeling EUG: MTX
Mello, Mevr. dr. N.M. (Norah) van, gynaecoloog, AmsterdamUMC, NVOG
Lemmers, Mevr. dr. M. (Marike), gynaecoloog, Jonkerbosch MSB, Canisius Wilhelmina Ziekenhuis (CWZ), Nijmegen, NVOG
Meelezers module Behandeling EUG: MTX
Crul, Mevr. M. (Mirjam), ziekenhuisapotheker, AmsterdamUMC, NVZA
Knijnenburg, Mevr. J.M.L. (José), patiëntenvertegenwoordiger, Freya
Met ondersteuning van
- Dederen, MSc. dhr. T.A. (Thibaut), junior adviseur bij het Kennisinstituut van de Federatie Medisch Specialisten, Utrecht, FMS
- Labeur, MSc. Y.J. (Yvonne), adviseur bij het Kennisinstituut van de Federatie Medisch Specialisten, Utrecht, FMS
- Lee, PhD. Mevr. J.H. (Hanneke) van der, senior adviseur bij het Kennisinstituut van de Federatie Medisch Specialisten, Utrecht, FMS
- Tuijtelaars, dr. J. (Jana), adviseur bij het Kennisinstituut van de Federatie Medisch Specialisten, Utrecht, FMS
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterstuurgroepleden en actief betrokken expertisegroepsleden (fungerend als schrijver en/of meelezer bij tenminste één van de geprioriteerde richtlijnmodules) hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een richtlijnmodule worden wijzigingen in belangen aan de projectleider doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase. Een overzicht van de belangen van de clusterleden en betrokken expertisegroepsleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
Tabel 2. Gemelde (neven)functies en belangen stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Timmermans* |
Gynaecoloog; Amsterdam UMC; 0.8 fte |
Lid commissie kwaliteitsdocumenten NVOG (onbetaald); projectgroep Gynae Goes Green NVOG (onbetaald) |
Geen |
Geen restricties |
|
Breijer |
Gynaecoloog Admiraal De Ruyter Ziekenhuis |
Lid commissie kwaliteitsdocumenten NVOG namens pijler gynaecologie, onbetaald |
Geen |
Geen restricties |
|
Lips |
Chirurg, Chirurgencoöperatie Oost-Nederland Enschede, Medisch Spectrum Twente |
Medisch Manager, afdeling chirurgie. Medisch voorzitter, Chirurgencooperatie ChirCON |
Proctor, Intuitive Surgical |
Geen restricties |
|
Radder |
Gynaecoloog te OLVG in Amsterdam, 1.0 fte |
Registratiecommissie Obstetrie en Gynaecologie van NVOG, onbetaald Clusterstuurgroep koploperproject richtlijnen 2.0 FMS, betaald |
Geen |
Geen restricties |
*Voorzitter cluster Benigne Gynaecologie
Clusterexpertisegroep
Tabel 3. Gemelde (neven)functies en belangen expertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Crul |
Ziekenhuisapotheker Amsterdam UMC |
Soncos, Nederlands Platform voor Oncologie, gemandateerd lid namens NVZA (Nederlandse Vereniging van Ziekenhuisapothekers) European Society of Oncology Pharmacy, vice-voorzitter European Cancer Community Foundation, board member University of Tartu, gastdocent palliatieve zorg University of Porto, scientific advisor occupational safety for healthcare workers who handle hazardous medicinal products PAO farmacie docent palliatieve zorg en medicatiebegeleiding European Medicines Agency (EMA) - healthcare professional working party namens ESOP |
Geen |
Geen restricties |
|
Knijnenburg |
Directeur bij Freya, vereniging voor mensen met vruchtbaarheidsproblemen - 32u p/wk - betaald Medewerker communicatie en marketing bij van der Pol-consulting b.v. - 8u p/wk - betaald |
Geen |
Dienstverband bij de (onafhankelijke) landelijke patiëntenvereniging voor mensen met vruchtbaarheidsproblemen. ZonMW betrokken als patientvertegenwoordiger bij alle studies op gebied fertiliteit RadboudUMC/Goodlife Summer studie - voedingssupplement man Amsterdam UMC Andes studie - PCOS angst, depressie, lichaamsbeeld RadboudUMC/MUMC HMove - sporten en afweersysteem bij miskramen MUMC Murim - herhaalde miskramen en RIF Belangenbehartiger bij patiëntenorganisatie |
Geen restricties |
|
Lemmers |
Gynaecoloog Jonkerbosch MSB, canisius Wilhelmina Ziekenhuis, Nijmegen |
Belangenverklarkng tbv module MTX richtlijn EUG Nevenwerkzaamheden: Richtlijn hyperemesis Richtlijn zwangerschapsafbreking 2e trim Richtlijn zwangerschapsafbreking 1e trim Voor de richtlijnen is er een vacatie vergoeding Bestuur Werkgroep Gynaecologische Endoscopie (onbetaald) |
Geen |
Geen restricties |
|
Mello, van |
Gynaecoloog, Amsterdam UMC |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van relevante patiëntenorganisaties aan de need-for-update, de prioritering en de ontwikkeling van modules. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijnmodules zijn tevens ter commentaar voorgelegd aan de relevante patiëntenorganisaties in de expertisegroep (zie ‘Initiatief en autorisatie’ onder ‘Verantwoording’). De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Tabel 4. Kwalitatieve raming
|
Module |
Uitkomst raming |
Toelichting |
|
Module Behandeling EUG: MTX |
Geen financiële gevolgen |
p.50 (kostenaspect, overwegingen Behandeling EUG: MTX) |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase (september-oktober, 2023) inventariseerde het cluster de geldigheid van de richtlijnmodules binnen het cluster. Ook was er de mogelijkheid om nieuwe onderwerpen aan te dragen die aansloten bij één (of meerdere) richtlijn(en) behorend tot het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd.
Deze betrokken partijen betroffen:
Beroepsvereniging Verzorgenden Verpleegkundigen (V&VN)
Endometriose Stichting
Inspectie Gezondheidszorg en Jeugd (IGJ)
KBO-PCOB (samenwerkingsverband inmiddels opgeheven)
Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
Nederlandse Vereniging van Ziekenhuizen (NVZ)
Nederlandse Vereniging voor Anesthesiologie (NVA)
Nederlandse Vereniging voor Bekkenfysiotherapie (NVFB)
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
Nederlandse Vereniging voor Heelkunde (NVvH)
Nederlandse Vereniging voor Hematologie (NVvH) via NIV
Nederlandse Vereniging voor Kindergeneeskunde (NVK)
Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC)
Nederlandse Vereniging voor Klinische Fysica (NVKF)
Nederlandse Vereniging voor Medische Microbiologie (NVMM)
Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
Nederlandse Vereniging voor Psychiatrie (NVvP)
Nederlandse Vereniging voor Radiologie (NVvR)
Nederlandse Vereniging voor Urologie (NVU)
Nederlandse Vereniging voor Vulva Pathologie (NVvVP)
Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVVS)
Stichting Bekkenbodem4All (BB4All)
Vereniging van Klinische Genetica Nederland (VKGN)
Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
Vuurvrouw
Werkgroep Psychosomatische Obstetrie en Gynaecologie (WPOG)
Zelfstandige Klinieken Nederland (ZKN)
Zorginstituut Nederland (ZiNL)
Zorgverzekeraars Nederland (ZN)
In de 1e cyclus is per richtlijnmodule aangegeven of deze geldig is, herzien moet worden, kan vervallen of moet worden samengevoegd. In de 2e cyclus is dit overzicht van cyclus 1 opnieuw beoordeeld door de stuurgroep. De richtlijnmodules die mogelijk herzien moesten worden, werden doorgezet naar de prioriteringsronde. Ook suggesties voor nieuwe richtlijnmodules (afkomstig van de uitvraag bij bovenstaande stakeholders en expertiseleden) werden doorgezet naar de prioriteringsronde.
De prioriteringsronde is uitgevoerd door de stuur- en expertisegroep, en gebundeld per vereniging. Daarna werd de RE-weighted Priority-Setting (REPS) – tool gebruikt, om tussen verenigingen te ranken. De uitkomst (ranklijst) van de schriftelijke prioritering werd gebruikt als uitgangspunt voor de discussie. De definitieve top-5 is afgestemd door de stuurgroep.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd indien mogelijk gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
Tabel 5. Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in een richtlijnmodule volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 6. Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de richtlijnmodule Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodules zijn voorgelegd aan alle partijen die beschreven zijn in Tabel 1. Initiatief en autorisatie (dit voorstel is vooraf met alle betrokken partijen afgestemd). De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werden de conceptrichtlijnmodules aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd ter autorisatie of goedkeuring voorgelegd aan de partijen die beschreven staan bij ‘Initiatief en autorisatie’ onder ‘Verantwoording’.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.