Hematothorax
Uitgangsvraag
Wat is de plaats van observatie (afwachtend beleid) bij een hematothorax?
Aanbeveling
Bespreek bij een instrueerbare patiënt de voor- en nadelen en eventuele risico’s van conservatief beleid en drainplaatsing.
Overweeg een conservatieve behandeling van een traumatische hematothorax als patiënten:
- geen massale hematothorax hebben;
- geen respiratoire of hemodynamische problematiek hebben;
- goed gemonitord kunnen worden;
- op ieder moment een thorax drainage kunnen ondergaan.
Neem in deze overweging mee dat de volgende factoren invloed hebben op succesvol conservatief beleid:
- klein volume van de hematothorax;
- laag risico op toename van het volume van de hematothorax;
- geen toename van het volume van de hematothorax op vervolg beeldvorming;
- afwezigheid van een pneumothorax.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek uitgevoerd naar de meerwaarde van een afwachtend beleid ten opzichte van het plaatsen van een drain bij patiënten met een traumatische hematothorax. Er werd één systematische review geïncludeerd in de literatuuranalyse, waarin zes studies werden opgenomen die aan de PICO van deze richtlijnmodule voldeden. Het aantal geplaatste drains en mortaliteit na initieel afwachtend beleid werden als cruciale uitkomstmaten gedefinieerd. Morbiditeit/complicaties en kwaliteit van leven werden als belangrijke uitkomstmaten gedefinieerd.
Het percentage patiënten dat in eerste instantie een afwachtend beleid onderging, maar uiteindelijk alsnog een drain nodig had, varieerde in de geïncludeerde studies tussen de 11.1% en 29.9%. In deze module werd een initieel afwachtend beleid vergeleken met het direct plaatsen van een drain, waardoor het aantal patiënten dat een drain kreeg geplaatst in de controlegroep automatisch 100% betrof. Hierdoor was het niet mogelijk om de literatuur te graderen en een GRADE-conclusie op te stellen. Het aantal patiënten dat na initieel afwachtend beleid alsnog een drain geplaatst kreeg werd daarom beschrijvend weergegeven.
Op basis van de huidige literatuur is het, ondanks de gevonden klinisch relevante verschillen, onduidelijk of een afwachtend beleid een effect heeft op de mortaliteit en het voorkomen van pneumonie vanwege de zeer lage bewijskracht. De voornaamste reden voor de zeer lage bewijskracht is het feit dat de studies een observationeel studiedesign hebben en een klein aantal patiënten zijn geïncludeerd.
Aangezien het op basis van de huidige gevonden literatuur onduidelijk is wanneer een afwachtend beleid zou moeten worden gevoerd ten opzichte van het plaatsen van een thoraxdrain zal er per patiënt moeten worden afgewogen wat het meest passende beleid is.
Het is van belang de volgende factoren mee te nemen in deze beslissing:
Volume van de hematothorax
Verondersteld mag worden dat bij een (niet massale) hematothorax die relatief groot genoemd kan worden de voordelen van een thoraxdrain meer opwegen tegen de nadelen. De definitie van een relatief grote maar niet massale hematothorax is in de literatuur niet eenduidig. Er wordt hiervoor zowel een minimaal volume van >300 ml als wel van > 400 ml beschreven, waarbij het belangrijk is te realiseren dat een CT-scan, waarop dit volume gemeten kan worden, een momentopname is.
Aangezien het bepalen van het volume van een hematothorax vooralsnog tijdrovend en niet altijd goed mogelijk is, zijn er ook indirecte methoden voor het schatten van een grootte van een hematothorax beschreven, zoals schildikte met een breedte van 1,5 cm op CT beschreven als waarde waarboven gesproken kan worden van een grote hematothorax, en formules (V = d2 * h, waar ‘d’ en ‘h’ de maximale diepte en hoogte van een effusie representeren) op basis van hoogte en dikte. Deze methoden blijken echter een beperkte reproduceerbaarheid en accuratesse te hebben voor het ware volume van de hematothorax op dat moment (Tewkesbury, 2024). Vanwege de afwezigheid van eenduidige en reproduceerbare maten, en het feit dat een CT-scan een momentopname is, adviseert de werkgroep om een grove visuele schatting van de hematothorax te maken om te bepalen of deze groot genoemd kan worden.
Risico op toename
Naast het (geschatte) volume op initiële beeldvorming is het risico op toename van het volume van de hematothorax ook een factor waarmee rekening gehouden dient te worden. Dit risico kan onder andere afhankelijk zijn van de aard van het trauma (stomp of scherp), locatie van het letsel of aanwezigheid van verhoogde bloedingsneiging. Het risico op toename wordt lager als er een CT met contrast is gemaakt die (nog) geen actieve bloeding laat zien.
Toename van volume hematothorax
De daadwerkelijke toename van het volume van de hematothorax zoals geschat op vervolg beeldvorming kan, afhankelijk van de hoeveelheid en snelheid van de toename, een beslissende factor zijn om over te gaan tot het plaatsen van een thoraxdrain.
Aanwezigheid van pneumothorax
Bestaat er naast een hematothorax ook een pneumothorax dan draagt dit bij aan de beslissing om voor een thoraxdrain te kiezen in plaats van een afwachtend beleid
Voordelen van een thoraxdrain
Een thoraxdrain kan resulteren in een verbetering van de respiratoire status van de patiënt en daarnaast de kans op vermindering van empyeemvorming en fibrothorax verminderen. Daarnaast is het monitoren van het bloedverlies ook als voordeel te noemen.
Nadelen van een thoraxdrain
Bijkomend nadeel- buiten het risico op complicaties- van een thoraxdrain is meer pijn door de plaatsingsprocedure en pijn en belemmering in mobiliteit door de drain gedurende de behandeling. Voor de patiënt is het belangrijk om progressie met daarbij behorende klachten van dyspneu en angst te voorkomen. Een ander potentieel nadeel van een thoraxdrain is dat er meer inzet van zorgcapaciteit nodig is en daarmee ook meer kosten met zich meebrengt. Dit is met name het gevolg van het feit dat patiënten met een thoraxdrain (langer) worden opgenomen in het ziekenhuis terwijl dat bij en afwachtend beleid niet altijd nodig is. Als er bij een afwachtend beleid wordt gekozen voor een opname is deze over het algemeen korter, mits er niet in tweede instantie een thoraxdrain geplaatst moet worden.
Complicaties
De kans op een complicatie bij een thoraxdrain is ongeveer 19% (Hernandez, 2018). De complicaties waarmee rekening gehouden moet worden zijn onder andere uitbreiding van de hematothorax, een nieuwe bloeding (bij patiënten met een verhoogde bloedingsneiging is dit risico groter), iatrogene schade aan organen (zoals milt, lever, long, hart) en infecties (rondom drain, pneumonie of juist empyeemvorming).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten is het belangrijk om de voor hen meest passende behandeling te krijgen. Patiënten kunnen verschillend denken over afwachtend beleid ten opzichte van het plaatsen van een drain. Het is belangrijk dat de arts in samenspraak met de patiënt, of indien nodig de vertegenwoordiger, een zorgvuldige afweging maakt van de voor- en nadelen van beide opties.
Kosten (middelenbeslag)
Het plaatsen van een thoraxdrain brengt hogere zorgkosten met zich mee als het gaat om wondzorg, opnameduur, thuiszorg, pijnstilling, materiaal en afval in vergelijking met succesvolle conservatieve therapie (Hernandez, 2017). Conservatieve behandelingen zijn goedkoper dan drainage, zeker als er weinig geassocieerd letsel is. Dit wordt voor een belangrijk deel veroorzaakt door de gemiddeld kortere opnameduur. Daarnaast is de werkgroep van mening dat snellere mobilisatie van trauma patiënten zorg- en maatschappelijke kosten verlaagt, hoewel dit voor deze groep patiënten niet expliciet uitgezocht is.
Duurzaamheid
Drainplaatsing heeft een grotere negatieve impact op het milieu in vergelijking met conservatieve behandeling. Vanuit dit oogpunt is het dus beter om af te zien van drainplaatsing. Indien er voor drainplaatsing gekozen wordt, besteed dan aandacht aan het type drain-, drainage- en afdekmateriaal en aan het reduceren van het gebruik van disposables.
Aanvaardbaarheid, haalbaarheid en implementatie
Aangezien de afweging voor het wel of niet plaatsen van een thoraxdrain ten opzichte van een afwachtend beleid bij een hematothorax reeds wordt toegepast zijn de vragen met betrekking tot aanvaarbaarheid, haalbaarheid en implementatie niet van toepassing. Zowel de thoraxdrain als het afwachtend beleid worden immers al in de praktijk toegepast.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het principe ”primum non nocere” geldt ook bij de beslissing wel of geen thoraxdrain bij hematothorax. Het is mede gezien het complicatierisico van 19%, de kans op meer pijn en hogere kosten bij het plaatsen van een thoraxdrain van belang bij elke patiënt met hematothorax af te wegen of een afwachtend beleid een optie is. Uiteraard moet dit worden afgezet tegenover de potentiële voordelen van het wel plaatsen van een thoraxdrain, het verbeteren de respiratoire status en het voorkomen van empyeemvorming en fibrothorax. Factoren die meegewogen kunnen worden in het besluit tot het plaatsen van een thoraxdrain bij een (niet-massale) hematothorax zijn de grootte, het risico op en de daadwerkelijk toename van de grootte/volume en de aan- of afwezigheid van een pneumothorax.
Onderbouwing
Achtergrond
De behandeling van een vastgestelde hematothorax na trauma (incidentie in Nederland: circa 299 patiënten per jaar geregistreerd; 0,4% van alle patiënten die in het ziekenhuis worden opgenomen na trauma; LTR, 2021-2022) kent praktijkvariatie. Welk initieel beleid gevolgd moet worden bij een hematothorax die niet massaal of minimaal/beperkt te noemen is, is onduidelijk en op dit moment afhankelijk van expert opinion. Bij de massale hematothorax (gedefinieerd in de ATLS 10e editie als onmiddellijk bloedvolume uit de thoraxdrain groter dan 1500 milliliter, drainage van meer dan 200 milliliter per uur gedurende twee tot vier opeenvolgende uren, of de noodzaak tot een bloedtransfusie) is een chirurgische interventie noodzakelijk en bij een minimale of zeer beperkte hematothorax zal geen interventie nodig zijn. Juist bij patiënten met een hematothorax met een grootte daartussen in, is het beleid niet eenduidig. Een deel van deze patiënten zal gebaat zijn bij een thoraxdrain en voor een deel van de patiënten zal het beter zijn om geen thoraxdrain te plaatsen en een afwachtend beleid te voeren. Bij het besluit over het beleid in dit soort gevallen worden de voordelen van een thoraxdrain afgewogen tegen de potentiële risico’s.
De huidige richtlijnen (Thoraxdrainage, EAST en ATLS 10e editie) geven aanbevelingen voor wanneer een thoraxdrain geplaatst dient te worden. Deze aanbevelingen zijn echter niet eenduidig en bevatten niet of nauwelijks onderbouwing vanuit de literatuur.
Conclusies / Summary of Findings
Tube thoracostomy rate (failure of initial clinical observation / expectant management) (critical)
|
No GRADE |
The number of patients who need a tube thoracostomy after initial clinical observation / expectant management ranges between 11.1% and 29.9%.
Source: - |
Mortality (critical)
|
Very low GRADE |
The evidence was very uncertain about the effect of clinical observation / expectant management on mortality when compared with tube thoracostomy in patients with traumatic hemothorax.
Sources: Gilbert, 2020; Demetri, 2018; Mahmood, 2013; Mahmood, 2015; Wells, 2015. |
Complications (important)
|
Very low GRADE |
The evidence was very uncertain about the effect of clinical observation / expectant management on the complication pneumonia when compared with tube thoracostomy in patients with traumatic hemothorax.
Sources: Gilbert, 2020; Stafford, 2006 |
Quality of life
|
No GRADE |
No evidence was found regarding the effect of clinical observation / expectant management on quality of life when compared with tube thoracostomy in patients with traumatic hemothorax.
Source: - |
Samenvatting literatuur
Description of studies
The systematic review of Gilbert (2020) investigated clinical outcomes of expectant management of occult hemothoraces defined as one that is not detected on supine x-ray but detected on a CT scan. Gilbert (2020) also tried to identify predictors of tube thoracostomy in a delayed fashion, but this was beyond the scope of this guideline and was therefore not included. Gilbert (2020) searched MEDLINE, EMBASE, and Cochrane databases from January 1946 to October 2019. Randomized controlled trials, prospective or retrospective cohort studies, and cross-sectional studies evaluating adult patients (fifteen years or older) with penetrating or blunt trauma who had an occult hemothorax were included. Studies describing overt (non-occult) hemothorax or isolated pneumothorax were excluded. The intervention of interest was patients with an occult hemothorax that were managed expectantly, meaning no insertion of tube thoracostomy in the initial clinical assessment. The comparison group was patients with occult hemothorax that were managed with tube thoracostomy in the initial clinical assessment. In total, one prospective cohort study (Mahmood, 2015) and five retrospective cohort studies (Bilello, 2005; Stafford, 2006; Mahmood, 2013; Wells, 2015; Demetri, 2018) were included, which included a total of 1405 patients with an occult hemothorax. The Methodological Index for Non-randomized Trials (MINORS) criteria was used to assess the risk of bias. Gilbert (2020) reported the failure rate of clinical observation / expectant management.
Results
Tube thoracostomy rate (failure of initial clinical observation / expectant management) (critical)
Tube thoracostomy rates were reported in all six trials of Gilbert (2020). However, the outcome ‘number of thoracostomies’ corresponds to the control intervention of this guideline and therefore, the thoracostomy rate in the control group automatically reaches 100%. It is therefore not beneficial to compare the intervention and control group with regards to the tube thoracostomy rate. It is more beneficial to investigate how many patients, who initially underwent clinical observation / expectant management, still needed tube thoracostomy after initial clinical observation/expectant management. These results were presented below (Table 1).
Table 1. The failure rate of initial clinical observation / expectant management among the studies included in Gilbert (2020)
|
Author (year of publication) |
Failure rate of initial clinical observation / expectant management |
|
Bilello (2005) |
16/76 (21.1%) |
|
Stafford (2006 |
5/45 (11.1%) |
|
Mahmood (2013) |
13/73 (17.8%) |
|
Mahmood (2015) |
15/56 (26.8%) |
|
Wells (2015) |
110/368 (29.9%) |
|
Demetri (2018) |
53/184 (28.8%) |
|
|
Total: 212/802 (26.4%) |
Mortality (critical)
Mortality was reported in four studies in the systematic review of Gilbert (2020) (Demetri, 2018; Mahmood, 2013; Mahmood, 2015; Wells, 2015). The results were pooled in a meta-analysis. The pooled mortality rate in the clinical observation / expectant management group was 17/472 (3.6%), compared to 36/656 (5.5%) in the tube thoracostomy group. This resulted in a pooled relative risk ratio (RR) of 0.62 (95% CI 0.26 to 1.48), in favor of clinical observation / expectant management (see figure 1). This was considered as a clinically relevant difference.
Figure 1. Forest plot showing the comparison between clinical observation / expectant management and tube thoracostomy for mortality in adult patients with traumatic hemothorax
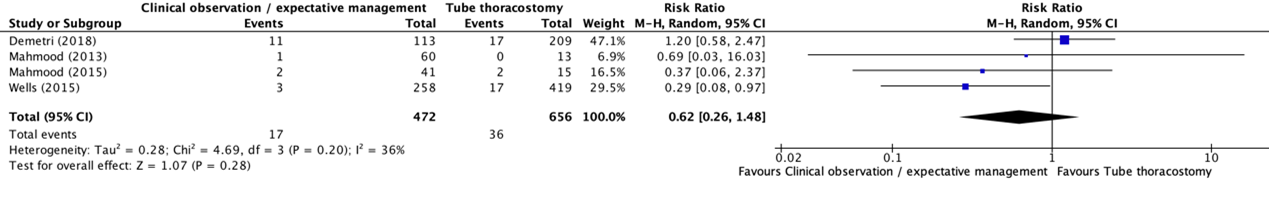
Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity
Complications (important)
Pneumonia was reported in one study in the systematic review of Gilbert (2020) (Stafford, 2006). The number of patients with pneumonia in the clinical observation / expectant management group was 3/47 (6.4%), compared to 6/41 (14.6%) in the tube thoracostomy group. This resulted in a relative risk ratio (RR) of 0.57 (95% CI 0.15 to 2.15), in favor of the clinical observation / expectant management group. This was considered as a clinically relevant difference.
Quality of life (important)
None of the studies included in Gilbert (2020) reported the outcome measure quality of life.
Level of evidence of the literature
Tube thoracostomy rate (failure of initial clinical observation / expectant management) (critical)
Due to the fact that the outcome ‘tube thoracostomy rate (failure of initial clinical observation / expectant management)’ is similar to the control intervention and could only be presented descriptively, it was not possible to grade the literature for the tube thoracostomy rate between clinical observation / expectant management and treatment with tube thoracostomy in patients with traumatic hemothorax.
Mortality (critical)
The level of evidence regarding the outcome mortality was derived from observational studies and therefore started low. The level of evidence was downgraded by one level because of the wide confidence interval crossing the lower and upper thresholds of clinical relevance, and the small number of events (imprecision, -2). The level of evidence was very low.
Complications (important)
The level of evidence regarding the outcome pneumonia was derived from an observational study and therefore started low. The level of evidence was downgraded by one level because of the wide confidence interval crossing the lower and upper thresholds of clinical relevance, and the small number of events (imprecision, -2). The level of evidence was very low.
Quality of life (important)
None of the studies included in Gilbert (2020) reported the outcome measure quality of life. The level of evidence was therefore not determined.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the (un)beneficial effects of clinical observation / expectative management in comparison with a drain / tube thoracostomy in patients with traumatic hemothorax?
| P: |
Patients with traumatic hemothorax |
| I: |
Clinical observation / expectative management |
| C: |
Drain (tube thoracostomy) |
| O: | Tube thoracostomy rate (failure of initial clinical observation / expectant management), mortality, complications, quality of life |
Relevant outcome measures
The guideline development group considered tube thoracostomy rate (failure of initial clinical observation / expectant management) and mortality as critical outcomes for decision making; and morbidity/complications and quality of life as important outcomes for decision making.
The working group defined a threshold of 10% for continuous outcomes and a relative risk (RR) for dichotomous outcomes of <0.80 and >1.25 as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the first of August, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 241 hits. Studies were selected based on the following criteria: systematic reviews, randomized controlled trials, and observational study designs on observation in patients with hemothorax. Six studies were initially selected based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods) and one study was included.
Results
One systematic review was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bilello JF, Davis JW, Lemaster DM. Occult traumatic hemothorax: when can sleeping dogs lie? Am J Surg. 2005 Dec;190(6):841-4. doi: 10.1016/j.amjsurg.2005.05.053. PMID:16307931.
- Demetri L, Martinez Aguilar MM, Bohnen JD, Whitesell R, Yeh DD, King D, de Moya M. Is observation for traumatic hemothorax safe? J Trauma Acute Care Surg. 2018 Mar;84(3):454-458. doi: 10.1097/TA.0000000000001793. PMID: 29298241.
- Gilbert RW, Fontebasso AM, Park L, Tran A, Lampron J. The management of occult hemothorax in adults with thoracic trauma: A systematic review and meta-analysis. J Trauma Acute Care Surg. 2020 Dec;89(6):1225-1232. doi: 10.1097/TA.0000000000002936. PMID: 32925577.
- Hernandez MC, El Khatib M, Prokop L, Zielinski MD, Aho JM. Complications in tube thoracostomy: Systematic review and meta-analysis. J Trauma Acute Care Surg. 2018 Aug;85(2):410-416. doi: 10.1097/TA.0000000000001840. PMID: 29443856; PMCID: PMC6081248.
- Mahmood I, Tawfeek Z, Khoschnau S, Nabir S, Almadani A, Al Thani H, Maull K, Latifi R. Occult hemopneumothorax following chest trauma does not need a chest tube. Eur J Trauma Emerg Surg. 2013 Feb;39(1):43-6. doi: 10.1007/s00068-012-0210-1. Epub 2012 Jul 20. PMID: 26814922.
- Mahmood I, Tawfeek Z, El-Menyar A, Zarour A, Afifi I, Kumar S, Peralta R, Latifi R, Al-Thani H. Outcome of concurrent occult hemothorax and pneumothorax in trauma patients who required assisted ventilation. Emerg Med Int. 2015;2015:859130. doi: 10.1155/2015/859130. Epub 2015 Feb 16. PMID: 25785199; PMCID: PMC4345256.
- Mowery, Nathan T. MD; Gunter, Oliver L. MD; Collier, Bryan R. DO; Diaz, Jose' J. Jr. MD; Haut, Elliott MD; Hildreth, Amy MD; Holevar, Michelle MD; Mayberry, John MD; Streib, Erik MD. Practice Management Guidelines for Management of Hemothorax and Occult Pneumothorax. The Journal of Trauma: Injury, Infection, and Critical Care 70(2):p 510-518, February 2011. | DOI: 10.1097/TA.0b013e31820b5c31
- Stafford RE, Linn J, Washington L. Incidence and management of occult hemothoraces. Am J Surg. 2006 Dec;192(6):722-6. doi: 10.1016/j.amjsurg.2006.08.033. PMID: 17161082.
- Tewkesbury G, Beyer C, Eddinger K, McLauchlan N, Tran A, Cannon JW, Knollmann F. CT-based pleural effusion volume estimation formula demonstrates low accuracy and reproducibility for traumatic hemothorax. Injury. 2024 Jan;55(1):111112. doi: 10.1016/j.injury.2023.111112. Epub 2023 Oct 11. PMID: 37839918.
- Wells BJ, Roberts DJ, Grondin S, Navsaria PH, Kirkpatrick AW, Dunham MB, Ball CG. To drain or not to drain? Predictors of tube thoracostomy insertion and outcomes associated with drainage of traumatic hemothoraces. Injury. 2015 Sep;46(9):1743-8. doi: 10.1016/j.injury.2015.04.032. Epub 2015 May 7. PMID: 25983221.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Gilbert (2020) |
SR and meta-analysis of cohort studies
Literature search from January 1946 up to October 2019.
A: Bilello (2005) B: Demetri (2018) C: Stafford (2006) D: Mahmood (2013) E: Mahmood (2015) F: Wells (2015)
Study design: A: Retrospective cohort study. B: Retrospective cohort study. C: Retrospective cohort study. D: Retrospective cohort study. E: Prospective cohort study F: Retrospective cohort study.
Setting and Country: A: North America B: North America C: North America D: Middle East E: Middle East F: North America
Source of funding and conflicts of interest: The authors declare no conflicts of interest. |
Inclusion criteria SR: - Studies evaluating adult patients (15 years or older) with penetrating or blunt trauma who had an occult hemothorax.
Exclusion criteria SR: - Studies describing overt (non-occult) hemothorax or isolated pneumothorax.
Six studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A: N = 99, age not reported. B: N = 340, age not reported. C: N = 73, age not reported. D: N = 56, age not reported. E: N = 88, age not reported. F: N = 749, age not reported.
Sex: A: No information. B: No information. C: No information. D: No information. E: No information. F: No information.
Groups comparable at baseline? Probably yes.
|
Describe intervention:
A: Expectant management B: Expectant management C: Expectant management D: Expectant management E: Expectant management F: Expectant management
|
Describe control:
A: Tube thoracostomy B: Tube thoracostomy C: Tube thoracostomy D: Tube thoracostomy E: Tube thoracostomy F: Tube thoracostomy
|
End-point of follow-up:
A: No information. B: No information. C: No information. D: No information. E: No information. F: No information.
|
Tube thoracostomy rate (failure rate of initial expectant management) A: 16/76 B: 53/184 C: 13/73 D: 15/56 E: 5/45 F: 110/368
Mortality B (Demetri, 2018) I: 11/113 C: 17/209
D (Mahmood, 2013) I: 1/60 C: 0/13
E (Mahmood, 2015) I: 2/41 C: 2/15
F (Wells, 2015) I: 3/258 C: 17/419
Pneumonia C (Stafford, 2006) I: 3/47 C: 6/41
|
Author’s conclusion Conservative treatment of occult hemothorax fails in 23.1% of patients. The presence of hemothorax greater than 300 mL and the need for mechanical ventilation predicted failure of conservative treatment and the need for TT. There was no difference in mortality between EM and TT cohorts. These data suggest that it may be possible to safely observe patients with occult hemothoraces less than 300 mL (1.5 cm pleural stripe) secondary to blunt trauma without upfront TT insertion.
|
Risk of bias tabel
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables?
|
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
Bilello (2005) |
Definitely yes
Reason: All blunt-trauma patients presenting with hemothorax at a level I trauma center from January 1998 through June 2004, a 6.5-year period, were retrospectively reviewed |
Probably yes
Reason: Patients with occult hemothoraces on CAT of the chest and/or abdomen were included in the study. |
Probably yes
Reason: Patients with premorbid conditions (pleural effusions, congestive heart failure, etc.), hemopneumothorax, and previously placed chest tubes were excluded. |
Probably yes
Reason: questionnaire data with ascertainment rules was used. |
Probably no
Reason: No information reported. |
Probably no
Reason: No information reported. |
Probably no
Reason: No information reported. For the other outcomes, it was enough. |
Probably no
Reason: No information reported. |
Some concerns |
|
Demetri (2018) |
Definitely yes
Reason: All trauma patients in a tertiary care Level I trauma center from January 2000 through December 2014 were retrospectively reviewed in this Institutional Review Board-approved study. To identify patients with traumatic hemothorax, an electronic health record query was placed with our institutional clinical data registry |
Probably yes
Reason: The Research Patient Data Regis- try is a centralized data warehouse that extracts clinical information from the electronic health records of hospital systems within the Partners Healthcare Network |
Probably yes
Reason: Patients who did not receive a chest computed tomography (CT) scan or received TT prior to CT were excluded |
Probably yes
Reason: Given the possibility that bilateral hemothoraces may be correlated and may cause confounding in a per-hemothorax analysis, we have only reported the per- patient analysis |
Probably yes
Reason: Furthermore, a variable denoting year of the injury was included to adjust for the possible confounding effect of changes in trauma care practice over the study period |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
Some concerns |
|
Mahmood (2013) |
Probably yes
Reason: The study group consisted of all trauma patients admitted from July 2008 through July 2010 who had concurrent hemopnemothorax on chest CT that was not evident on initial supine chest X-ray. |
Probably yes
Reason: Hemothorax was quantified on CT by measuring the deepest lamellar fluid stripe at the most dependent portion of the fluid collection |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
High |
|
Mahmood (2015) |
Probably yes
Reason: It is a prospective observational study which included all blunt chest trauma patients who required PPV or venti- latory support for surgical procedure and presented with concurrent HPTX by chest CT (not evident on initial supine chest radiograph) from 2011 through 2013. The presence of |
Probably yes
Reason: HPTX was confirmed by CT evaluation and follow-up chest radiographs were obtained to monitor the progression of HPTX during hospital stay. |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
High |
|
Stafford (2006) |
Probably yes
Reason: Emergency and radiology department databases were re- viewed and cross-referenced with the trauma registry data- base at a level I trauma center to identify all blunt trauma patients admitted to the trauma service who had concurrent chest radiograph and TCT as part of their initial trauma evaluation from 1996 through 2001. |
Probably yes
Reason: The medical records were reviewed to confirm the registry data and the presence or absence of an occult hemothorax. |
Definitely yes
Reason: An occult hemothorax was defined as a hemothorax that was not identified on the initial chest radiograph but was identified on the concurrent TCT as noted on the offi- cial radiology department reading of the studies. Only those patients with occult hemothorax and who were admitted to the hospital were included in the study. Those patients not admitted to the hospital, who died in the emergency room or operating room, or had charts unavailable for review were excluded from the study. |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
No information.
Reason: - |
High |
|
Wells (2015) |
Probably yes
Reason: A retrospective cohort study of all adults (age >15 years) admitted to the Foothills Medical Centre (FMC) with a traumatic HTX was conducted. |
Probably yes
Reason: All available thoracic CT images were reviewed to confirm the presence of blood in the pleural space using Hounsfield unit (HU) measurements (where 35–70 HU indicate a HTX). Measurement of HTX size was completed using a previously validated formula: V = d2 ⋅ X ⋅ L, where V is volume in cubic centimetres (cc), d is the greatest depth of HTX from the chest wall to lung on any CT image in centimetres, X the thickness of CT slice in centimetres, and L the total craniocaudal length occupied by pleural fluid in centimetres. |
No information
Reason: - |
No information
Reason: Model covariates for adjusted mortality analyses included age and ISS; those for adjusted empyema analyses included age, ISS, concomitant thoracic injury, requirement for multiple thoracic interventions, and ventilation days; and those for adjusted hospital and ICU length of stay analyses included age, ISS, concomitant thoracic injury, develop- ment of a hospital-acquired pneumonia, empyema, or bacteremia, and requirement for multiple thoracic interventions. |
Probably no
Reason: Unfortunately, without being able to quantify the size of ipsilateral PTX or severity of the flail segment, and therefore not having adjusted for such disparities in the statistical analyses, it is difficult to determine the degree to which these other predictors may have confounded the need for TT. |
No information
Reason: - |
No information
Reason: - |
No information
Reason: - |
Some concerns |
Exclusie tabel
|
Author and year |
Reason for exclusion |
|
Chung (2018) |
Wrong comparison of interventions. |
|
Demetri (2018) |
Already included in Gilbert (2020). |
|
De Lesquen (2015) |
Wrong study design. |
|
Patel (2021) |
Wrong comparison of interventions. |
|
Wells (2015) |
Already included in Gilbert (2020). |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-05-2025
Beoordeeld op geldigheid : 28-05-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met thoracale letsels na trauma.
Werkgroep
- Dr. M.M.E. (Mathieu) Wijffels, traumachirurg, NVvH (voorzitter)
- Drs. P.J. (Pieter Jan) van Huijstee, longchirurg, NVvH (voorzitter)
- Dr. D. (Doeke) Boersma, chirurg, NVvH
- Dr. W.P. (Wietse) Zuidema, chirurg, NVvH
- Drs. W.W.L. (Wilson) Li, cardiothoracaal chirurg, NVT
- Drs. A.W.M. (Antoinette) Stolwijk, chirurg-intensivist, NVIC
- Drs. V.P.M. (Vincent) Rietveld, SEG, NVSHA
- Dr. M. (Monique) Brink, radioloog, NVvR
- Drs. S.A.S. (Sandra) van den Heuvel, anesthesioloog, NVA
- L. (Lydia) Köster MSc, fysiotherapeut, KNGF
Klankbordgroep
- T. (Thomas) Jonkergouw, adviseur patiëntbelang, Patiëntenfederatie Nederland
- Dr. H. (Hendrik-Jan) Dieker, cardioloog, NVVC
Met ondersteuning van
- Dr. R. (Romy) Zwarts – van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mitchel) Griekspoor MSc., adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E.R.L. (Evie) Verweg, junior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Wijffels |
Traumachirurg, Erasmus MC |
Geen |
Onderzoeksbeurzen van ZonMw (prospectieve ribfixatie studie), Johnson en Johnson DePuy Synthes, OTC/Stryker, Stichting Coolsingel, KLS Martin (onderzoek naar ribplaten) |
Gedeeltelijke restrictie. Het werkgroeplid zal niet meebeslissen over ribfixatie en/of ribplaten. Wanneer deze onderwerpen worden besproken zal Monique Brink de vergadering voorzitten. |
|
Van Huijstee |
Algemeen Thoracaal en Trauma-Chirurg, Medische Specialistische Co-operatie HAGA Ziekenhuis, Den Haag
|
Voorzitter Ned. Ver. Voor Longchirurgie (Onbetaald), Bestuurslid Ned. Ver. Voor Heelkunde (Onbetaald), ATLS-instructeur bij stichting ALSG.
Executive Board Member of Chest Wall International Group (onbezoldigd) |
Ad Hoc, Betaald adviseurschap bij Distrimed voor ontwikkeling van nieuwe implantaten voor congenitale borstkasafwijkingen en onkostenvergoeding bij proctoring van collega-chirurgen in het gebruik van deze implantaten. |
Gedeeltelijk restrictie. Het werkgroeplid zal niet meebeslissen over ribfixatie en/of ribplaten. Wanneer deze onderwerpen worden besproken zal Monique Brink de vergadering voorzitten. |
|
Stolwijk |
Traumachirurg, intensivist, MUMC+ |
Lid klankbordgroep richtlijn abdominale letsels na trauma medisch Manager Acute Zorg Limburg (NAZL) |
Geen.
|
Geen restrictie |
|
Boersma |
Chirurg |
Geen |
Geen |
Geen restrictie |
|
Köster |
Fysiotherapeut projectleider/ adviseur Traumazorg bij het traumacentrum Zuid West Nederland. |
Geen. Penningmeester geworden van Stichting Netwerk Traumarevalidatie Nederland (onbetaald). |
Geen |
Geen restrictie |
|
Brink |
Radioloog, Radboud UMC |
Sprekersbureau Canon Medical Systems |
Research Grant Canon Medical Systems 2016-2020 |
Geen restrictie |
|
Rietveld |
SEH-arts, Rijnstate |
Partner en course director DEUS |
Ontwikkeling point-of-care echografie |
Geen restrictie |
|
Zuidema |
Traumachirurg, Amsterdam UMC |
Secretaris NVT, Lid Geschillencommisie Ziekenhuizen |
Unrestricted grant (Mendela) voor studie over digitale pneumothorax zuigsystemen |
Geen restrictie |
|
Van den Heuvel |
Anesthesioloog 50%, pijnspecialist 50%, Radboud UMC |
Geen |
Regiehouder pijn Radboudumc, Editor pijn.nl Co-secretaris World Institute of Pain Benelux, onbetaald Educational committee web-based learning World Institute of Pain, onbetaald |
Geen restrictie |
|
Li |
Cardiothoracaal chirurg, Radboudumc |
Secretaris NVT |
Geen |
Geen restrictie |
|
Jonkergouw |
Adviseur Patiëntbelang Patiëntenfederatie Nederland |
Vrijwilliger Diabetes Vereniging Nederland |
Geen |
Geen restrictie |
|
Dieker |
Cardioloog, Radboudumc |
Geen |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname aan de schriftelijke knelpunteninventarisatie en een afgevaardigde patiëntenvereniging in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
|
Module |
Uitkomst raming |
Toelichting |
|
Module Hematothorax |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met thoracale letsels. Tevens zijn er knelpunten aangedragen door wetenschappelijke verenigingen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), duurzaamheid, aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVvH Thoracale letsels na trauma |
|
|
Uitgangsvraag: Wat is de plaats van observatie (afwachtend beleid) bij een hematothorax? |
|
|
Database(s): Medline (OVID), Embase |
Datum: 01-08-2023 |
|
Periode: Geen beperking |
Talen: Geen beperking |
|
Literatuurspecialist: Linda Niesink |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
→ Voor deze vraag is gezocht op de elementen hematothorax (in het blauw) en observatie (afwachtend beleid etc.) (in het groen).
→ De genoemde sleutelartikelen van Wells (2015), Demetri (2018) en Chung (2018) zitten in de zoekopbrengst. Het artikel van Hernandez (2018) valt er buiten op zowel hematothorax als observatie/afwachtend beleid, dit artikel lijkt alleen over thoracostomy te gaan.
→ Resultaten staan in Rayyan. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 01-08-2023 met relevante zoektermen gezocht naar systematische reviews, RCT’s en observationele studiedesigns over observatie bij patiënten met een hematothorax. De literatuurzoekactie leverde 241 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
25 |
4 |
26 |
|
RCTs |
54 |
15 |
56 |
|
Observationele studies |
155 |
25 |
159 |
|
Totaal |
234 |
44 |
241 |
Zoekstrategie
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Hemothorax/ or hematothora*.ti,ab,kf. OR haematothora*.ti,ab,kf. OR haemothora*.ti,ab,kf. OR hemathora*.ti,ab,kf. OR haemathora*.ti,ab,kf. OR hemothora*.ti,ab,kf. OR 'blood in the pleural cavity'.ti,ab,kf. OR 'blood-stained pleural effusion'.ti,ab,kf. OR 'blood-stained pleural fluid'.ti,ab,kf. OR 'bloody pleural effusion'.ti,ab,kf. OR 'bloody pleural fluid'.ti,ab,kf. OR 'hemopleura'.ti,ab,kf. OR 'hemorrhage pleural'.ti,ab,kf. OR 'hemorrhagic pleurisy'.ti,ab,kf. OR 'pleural hemorrhage'.ti,ab,kf. (6471) 2 exp Conservative Treatment/ or exp Watchful Waiting/ or ((observative or conservative) adj2 (management OR treatment)).ti,ab,kf. or (manage* adj3 expectant*).ti,ab,kf. or noninvasive.ti,ab,kf. OR 'non invasive'.ti,ab,kf. OR expectative*.ti,ab,kf. OR expectantly.ti,ab,kf. OR 'watchful waiting'.ti,ab,kf. OR 'wait and see'.ti,ab,kf. OR 'no treatment'.ti,ab,kf. OR 'no intervention'.ti,ab,kf. OR 'natural course'.ti,ab,kf. OR observation.ti,ab,kf. (410992) 3 1 and 2 (129) 4 3 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (125) 6 meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. (684473) 7 exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. (2616982) 8 Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) (5479971) 9 4 and 6 (4) – SRs 10 (4 and 7) not 9 (15) - RCTs 11 (4 and 8) not (9 or 10) (25) – observationele studies 12 9 or 10 or 11 (44) |
