Evaluatie van thoraxletsel
Uitgangsvraag
Hoe dient de zorg rondom de behandeling van traumapatiënten met thoracaal letsel te worden georganiseerd?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de waarde en de plaats van lichamelijk onderzoek in vergelijking met aanvullende beeldvorming voor de primaire diagnostiek en besluitvorming rondom patiënten met thoracale letsels na trauma in de tweede en derde lijn?
- Wat is de plaats van evaluerende scores om het klinisch beloop van therapeutische interventies te monitoren?
Aanbeveling
Aanbeveling-1
Gebruik lichamelijk onderzoek bij de initial assessment volgens ATLS zowel voor verbetering van de aanvraag van het aanvullend beeldvormend onderzoek als voor besluitvorming voor nog verder onderzoek om een zo volledig mogelijk beeld van de letsels van de patiënt te krijgen en ter voorkoming van eventueel missen van diagnosen.
Aanbeveling-2
Overweeg het gebruik van een combinatie van statische (Bijv. Battle-score) als dynamische (Bijv. SCARF-score) thoraxtrauma scores om het risico op een gecompliceerd beloop en de ingezette interventies op dit beloop te monitoren bij patiënten die worden behandeld aan thoracale letsels als gevolg van trauma.
Overwegingen
Lichamelijk onderzoek
De patiënt met verdenking op thoracaal trauma wordt opgevangen volgens Advance Trauma Life Support (ATLS)-principes in alle Nederlandse ziekenhuizen, ongeacht het levelcriterium. (ATLS 10e editie). Hierin wordt ook de primaire survey inclusief lichamelijk onderzoek beschreven.
Zowel negatieve als positieve bevindingen bij lichamelijk onderzoek kennen echter een slechte voorspellende waarde ten aanzien van het wel of niet hebben van thoracale letsels, zeker in geval van intoxicaties, verminderd bewustzijn en afleidende letsels elders in het lichaam. Dit neemt niet weg dat op basis van deze bevindingen de behandeling gestart dient te worden voor specifieke, potentieel levensbedreigende diagnoses, zoals beschreven in de ATLS-principes.
In aanvulling hierop zal aanvullend onderzoek uitgevoerd gaan worden. De richtlijn initiële radiodiagnostiek bij traumapatiënten beschrijft daarom wanneer radiologische beeldvorming noodzakelijk is en of CT ingezet moet worden bij de patiënt met kans op meervoudig letsel. Dit zal in deze module niet verder behandeld worden.
Ondanks het relatief laagdrempelig gebruik van radiologische beeldvorming in deze richtlijn, zal iedere initiële evaluatie met lichamelijk onderzoek volgens het ATLS-protocol nauwkeurig en volledig uitgevoerd dienen te worden, zeker als de vitale parameters dit toelaten.
Op de eerste plaats is dit relevant omdat veel criteria voor het wel of niet uitvoeren van beeldvorming in deze richtlijn op lichamelijk onderzoek gebaseerd zijn. Daarnaast is het aannemelijk dat de kwaliteit van de beoordeling van het diagnostische onderzoek zal toenemen als er een gerichtere terugkoppeling is van het lichamelijk onderzoek door de aanvrager aan de beoordelaar van de beeldvorming. Hierdoor zal er bij discrepantie tussen de bevinden bij het lichamelijk onderzoek en de uitslagen van het beeldvormende onderzoek gerichter gekeken kunnen worden en kan dit tot extra informatie leiden (Vassalou, 2024)). Als laatste kan goed lichamelijk onderzoek letsels opsporen die op de eerste beeldvormende modaliteit niet te zien zijn of onopgemerkt blijven, maar bij klinisch hoge verdenking met een aanvullende modaliteit gericht afgebeeld kunnen worden, als dit klinische implicaties heeft. Voorbeelden hiervan zijn ribfracturen die op echografie beter zichtbaar zijn dan op een thoraxfoto (Vassalau, 2024), of kraakbeenletsel, wat beter zichtbaar is op een gerichte echografie of MRI dan op CT (ref: Nummela 2022).
Wat de rol van aanvullende CT is bij patiënten met beperkt mono-letsel (dus één of twee ribfracturen, of alleen een pneumothorax op een thoraxfoto), wordt in de richtlijn “initiële radiodiagnostiek bij trauma patiënten” niet selectief besproken. Veel in deze richtlijn ‘Thoracale letsels na trauma’ besproken studies suggereren dat het vrijwel altijd zinvol is om een CT-scan van de thorax te maken bij een afwijkende thoraxfoto, omdat een thoraxfoto de ernst en uitgebreidheid van letsel onderschat. Deze studies zijn echter gebaseerd op volledig, of grotendeels hoog energetische- of polytrauma populaties (Kim, 2023, richtlijn initiële radiodiagnostiek bij traumapatiënten).
De spaarzame studies die ook laag energetische letsels of monotrauma van de thorax onderzochten, zijn terughoudend met CT. Zo geeft Kim (2023) voorzichtig aan dat patiënten met een beperkt aantal ribfracturen (minder dan drie) en geen risicofactoren bij lichamelijk onderzoek, een zeer lage kans op geassocieerd relevant letsel hebben en dat bij deze patiënten een CT-scan achterwege gelaten kan worden, maar dat dit ook van andere factoren afhangt, zoals comorbiditeit. Ook het NEXUS CT algoritme laat ruimte om een CT achterwege te laten bij een afwijkende X thorax, Indien er sprake is van “injuries adequately visualized and low clinical suspicion of significant injury”, maar dit wordt niet verder gespecificeerd (Rodriguez, 2017).
Evaluerende scores
Vroege triage, diagnostiek en gestandaardiseerde zorgpaden hebben bewezen reductie te geven in complicaties als verlengde opnameduur, pneumonie en mortaliteit naast ook verlaging van zorgkosten (Gonzalez, 2015; Todd, 2006). Hoe eerder de patiënt met een verhoogd risico op een gecompliceerd beloop geïdentificeerd wordt, hoe beter de preventie van deze complicatie en hoe lager de hiermee gepaard gaande potentiële kans op morbiditeit en mortaliteit.
Verschillende prognostische score-systemen zijn voorgesteld met diverse combinaties van anatomische letsel beschrijvingen (zoals Injury Severity Score en aantal ribfracturen) en klinische en patiënt-gerelateerde factoren (zoals leeftijd en pre-existentie comorbiditeit) (Brasel, 2006; Gonzalez, 2015). Long fysiologische variabelen worden vaak niet meegenomen in deze scores. Nadeel van al deze score-systemen is dat ze allemaal een statische moment opname zijn die bij binnenkomst wordt bepaald, die in min of meerdere mate een voorspelling trachten te doen over de kans op eventuele complicaties maar die geen dynamische correlatie hebben met de huidige toestand van de patiënt en per definitie niet met de reeds ingezette behandeling. Alle score-systemen lijken min of meer voorspellende waarde te hebben ten aanzien van gecompliceerd beloop of mortaliteit, echter zijn er helaas geen vergelijkende studies gedaan naar voorspellende waarde van de verschillende score-systemen ten opzichte van elkaar.
Tot nu toe is er één studie gepubliceerd waarin een dynamische evaluerende score is gebruikt; de Sequential Clinical Assesment of Respiratory Function (SCARF)-score) die van meerwaarde zou kunnen zijn in het monitoren van de behandeling van patiënten met bewezen letsel van de thoraxwand (Hardin, 2019). Voordeel van deze dynamische evaluerende score is dat deze gestandaardiseerd de klinische toestand van de patiënt vast legt. Dit heeft als voordeel dat niet alleen gevaren hoeft te worden op de ‘klinisch blik’ van de wisselende zorgverleners maar ook dat verschillende behandelaars op andere momenten vergelijkbaar de ingezette behandelingen (bijv. Pijnstilling, fysiotherapie, ondersteuning van de ademhaling of operaties) objectief kunnen evalueren en daar waar nodig kunnen aanpassen.
Een combinatie van een statische, eenmalige thoraxtrauma-score (zoals de Battle score) bij de initiële diagnostiek en een dynamische score (zoals de SCARF score) voor de evaluatie van de therapie zou een mooie combinatie zijn om zowel de a priori kans op complicaties als het al dan niet daadwerkelijk ontstaan hiervan te monitoren. Er is echter geen vergelijkend onderzoek gedaan naar het effect van deze (gecombineerde) benadering.
De evaluerende scores maken over het algemeen gebruik van het aantal ribfracturen vastgesteld op CT, omdat met name een liggende X thorax het aantal ribfracturen sterk onderschat. Alternatieven zoals een herhaalde staande X thorax of echografie zijn weliswaar bewezen nauwkeuriger dan een liggende X thorax voor het vaststellen van ribfracturen (Vassalou, 2024), maar zijn niet onderzocht op de waarde voor evaluerende scores.
Voorts is nog niet gedefinieerd welk type ribfracturen bijdragen aan de score; elke knik in de cortex of bicorticaal verplaatste fracturen.
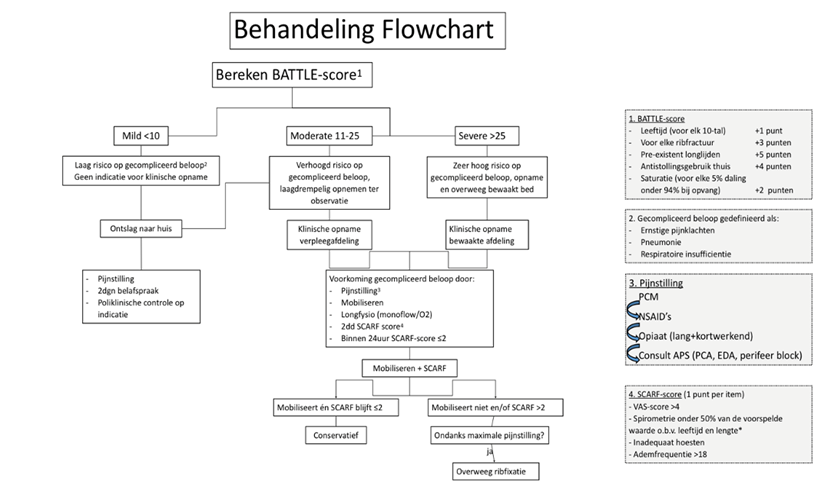
Een voorstel voor het gebruik van zowel statische als dynamische Thoraxtrauma score systemen ondanks dat deze combinatie nog niet klinisch vergelijkend geëvalueerd is, zou er als volgt uit kunnen zien, maar kan aangepast worden aan individuele eigenschappen van de patiënt en/of zorginstelling:
Figuur 1. Schematisch voorstel voor een diagnostische en behandeling flowchart voor patiënten met letsel aan de thorax als gevolg van trauma
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten is het van belang dat er een gedegen klinisch assessment wordt uitgevoerd zodat alle letsels worden ontdekt en een passend behandelplan kan worden opgesteld voor een snelle genezing. Daarnaast is het belangrijk dat het klinische beloop goed gemonitord wordt zodat vroegtijdig duidelijk wordt als er mogelijk sprake is van een complicatie. Hiermee kan eventuele morbiditeit en mortaliteit worden verlaagd. Nauwkeurig lichamelijk onderzoek kan gepaard gaan met meer pijn en ongemak, zoals bij compressie van ribfracturen, of manoeuvreren in een houding die goed lichamelijk onderzoek toestaat. Het verrichten van extra beeldvorming gaat gepaard met een extra (stralings) belasting voor de patiënt.
Kosten (middelenbeslag)
Lichamelijk onderzoek is momenteel onderdeel van de standaard zorg bij patiënten, het zal dan ook geen extra kosten met zich meebrengen, maar dit kost wel tijd.
Extra beeldvormend onderzoek gaat gepaard met hogere kosten, straling en verhoogde kans op niet-relevante nevenbevindingen en kan schaars zijn buiten kantoortijden, waarbij CT duurder uitvalt dan X thorax of echografie.
Een gedegen lichamelijk onderzoek kan beter richting geven aan het radiologische onderzoek waardoor er minder beeldvorming voor niks gemaakt wordt.
Het afnemen van een evaluerende score zal extra tijd vergen van de verpleegkundige en/of medisch specialist. Daar staat tegenover dat complicaties mogelijk eerder worden opgemerkt waardoor de ligduur en medicatie gebruik kan worden verkort.
Duurzaamheid:
Het extra vervaardigen van beeldvorming is minder duurzaam dan het afzien van aanvullende beeldvorming.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep ziet geen bezwaren die de aanvaardbaarheid, haalbaarheid en implementatie van een gedegen lichamelijk onderzoek in de weg staan, aangezien dit standaard zorg betreft. Wel is het belangrijk om bewust te zijn dat het lichamelijk onderzoek het radiologisch onderzoek enorm kan ondersteunen, waardoor letsel eerder of nauwkeuriger zal worden opgemerkt.
Het gebruik van beeldvorming bij patiënten met mogelijk meervoudig letsel is reeds geïmplementeerd in de richtlijn initiële radiodiagnostiek bij traumapatiënten.
Bij mono letsels die niet onder deze richtlijn vallen, is er mogelijk plaats voor terughoudendheid met CT bij een goed beoordeelbare X thorax, lage verdenking op geassocieerd letsel en geen belangrijke co morbiditeit. Hier zal vanwege weinig beschikbare criteria praktijkvariatie in blijven bestaan. Het is niet de bedoeling dat deze richtlijn tot meer gebruik van CT zal leiden dan nu de huidige werkwijze is.
De implementatie van een evaluerende score kan mogelijk weerstand oproepen, aangezien dit extra tijd kost om af te nemen en daarmee de registratielast verhoogd.
Echter is dit standaardisatie van bevindingen die nu ook al gedaan worden. Daarmee is het niet per se een extra registratielast maar een verandering in de registratielast. Het is wel belangrijk om betrokken zorgverleners te scholen om zo’n score te kunnen implementeren.
De evaluerende scores zijn goed te implementeren als patiënten reeds een CT ondergaan hebben. De werkgroep is van mening dat er geen CT van de thorax gemaakt moet worden met als enige doel om een score te bepalen (conform module 1 van deze richtlijn).
Rationale van aanbeveling-1: weging van argumenten voor en tegen de interventies
Op basis van een degelijk lichamelijk onderzoek kan gerichter aanvullend onderzoek worden aangevraagd. Letsels van het bijvoorbeeld kraakbeen van de thoraxwand zijn moeilijk met radiologische diagnostiek te beoordelen; hier is juist een klinische terugkoppeling heel belangrijk (bloeduitstorting en pijn zijn bijvoorbeeld belangrijke bevindingen).
Rationale van aanbeveling-2: weging van argumenten voor en tegen de interventie
Een dynamische Thoraxtrauma-score (bijvoorbeeld de SCARF-score) zou gebruikt kunnen worden als gestandaardiseerde manier van evaluatie van de klinische toestand van de patiënt. Daarmee is het ook een geschikte manier om het effect van een behandeling te monitoren. Ondanks dat het niet bewezen is in vergelijkend onderzoek hebben gestandaardiseerde zorgpaden en verslaglegging in het verleden gunstige effecten laten zien zowel op het klinische beloop van de patiënt als de kosten die hiermee gepaard gaan.
Onderbouwing
Achtergrond
De patiënten met een thoracaal letsel vormen een wijd spectrum aan patiënten met zeer uiteenlopende letsels, variërend van een hoogenergetisch verkeersongeval bij bijvoorbeeld een jonge motorrijder met multipele letsels waaronder een thoraxletsel, tot een kwetsbare oudere na bijvoorbeeld een val tegen een verwarming met enkele ribfracturen. Doel van deze module is handvatten te geven voor de Nederlandse praktijk om zo te komen tot uniformiteit van behandeling van patiënten met thoracaal letsel, waar mogelijk wetenschappelijk onderbouwd. Individuele aanpassingen en/of uitzondering zijn hierop mogelijk, afhankelijk van de conditie van de patient of lokale situatie in een zorginstelling.
Samenvatting literatuur
Er is geen systematische literatuursearch verricht naar deze uitgangsvraag omdat deze niet op basis van (internationale) literatuur beantwoord kan worden. Dus de hieronder genoemde aanbevelingen en overwegingen zijn opgesteld door de werkgroepleden op basis van kennis uit de praktijk (expert opinion) en waar mogelijk onderbouwd door niet-systematisch literatuuronderzoek welke vermeld staat in de literatuurverwijzingen.
Referenties
- Murphy CE 4th, Raja AS, Baumann BM, Medak AJ, Langdorf MI, Nishijima DK, Hendey GW, Mower WR, Rodriguez RM. Rib Fracture Diagnosis in the Panscan Era. Ann Emerg Med. 2017 Dec;70(6):904-909. doi: 10.1016/j.annemergmed.2017.04.011. Epub 2017 May 27. PMID: 28559032.
- Battle CE, Hutchings H, James K, Evans PA. The risk factors for the development of complications during the recovery phase following blunt chest wall trauma: a retrospective study. Injury. 2013 Sep;44(9):1171-6. doi: 10.1016/j.injury.2012.05.019. Epub 2012 Jun 12. PMID: 22695321.
- Battle C, Hutchings H, Lovett S, Bouamra O, Jones S, Sen A, Gagg J, Robinson D, Hartford-Beynon J, Williams J, Evans A. Predicting outcomes after blunt chest wall trauma: development and external validation of a new prognostic model. Crit Care. 2014 May 14;18(3):R98. doi: 10.1186/cc13873. PMID: 24887537; PMCID: PMC4095687.
- Brasel KJ, Moore EE, Albrecht RA, deMoya M, Schreiber M, Karmy-Jones R, Rowell S, Namias N, Cohen M, Shatz DV, Biffl WL. Western Trauma Association Critical Decisions in Trauma: Management of rib fractures. J Trauma Acute Care Surg. 2017 Jan;82(1):200-203. doi: 10.1097/TA.0000000000001301. PMID: 27779590.
- Brasel KJ, Guse CE, Layde P, Weigelt JA. Rib fractures: relationship with pneumonia and mortality. Crit Care Med. 2006 Jun;34(6):1642-6. doi: 10.1097/01.CCM.0000217926.40975.4B. PMID: 16625122.
- Chen J, Jeremitsky E, Philp F, Fry W, Smith RS. A chest trauma scoring system to predict outcomes. Surgery. 2014 Oct;156(4):988-93. doi: 10.1016/j.surg.2014.06.045. PMID: 25239357.
- Flagel BT, Luchette FA, Reed RL, Esposito TJ, Davis KA, Santaniello JM, Gamelli RL. Half-a-dozen ribs: the breakpoint for mortality. Surgery. 2005 Oct;138(4):717-23; discussion 723-5. doi: 10.1016/j.surg.2005.07.022. PMID: 16269301.
- Fokin A, Wycech J, Crawford M, Puente I. Quantification of rib fractures by different scoring systems. J Surg Res. 2018 Sep;229:1-8. doi: 10.1016/j.jss.2018.03.025. Epub 2018 Apr 16. PMID: 29936974.
- Gonzalez KW, Ghneim MH, Kang F, Jupiter DC, Davis ML, Regner JL. A pilot single-institution predictive model to guide rib fracture management in elderly patients. J Trauma Acute Care Surg. 2015 May;78(5):970-5. doi: 10.1097/TA.0000000000000619. PMID: 25909417.
- Hardin KS, Leasia KN, Haenel J, Moore EE, Burlew CC, Pieracci FM. The Sequential Clinical Assessment of Respiratory Function (SCARF) score: A dynamic pulmonary physiologic score that predicts adverse outcomes in critically ill rib fracture patients. J Trauma Acute Care Surg. 2019 Dec;87(6):1260-1268. doi: 10.1097/TA.0000000000002480. PMID: 31425473.
- Kim W, Song J, Moon S, Kim J, Cho H, Park J, Kim S, Ahn S. Characteristics of rib fracture patients who require chest computed tomography in the emergency department. BMC Emerg Med. 2023 Mar 22;23(1):33. doi: 10.1186/s12873-023-00807-9. PMID: 36949390; PMCID: PMC10035164.
- Lin FC, Li RY, Tung YW, Jeng KC, Tsai SC. Morbidity, mortality, associated injuries, and management of traumatic rib fractures. J Chin Med Assoc. 2016 Jun;79(6):329-34. doi: 10.1016/j.jcma.2016.01.006. Epub 2016 Mar 22. PMID: 27025223.
- Manay P, Satoskar RR, Karthik V, Prajapati RP. Studying Morbidity and Predicting Mortality in Patients with Blunt Chest Trauma using a Novel Clinical Score. J Emerg Trauma Shock. 2017 Jul-Sep;10(3):128-133. doi: 10.4103/JETS.JETS_131_16. PMID: 28855775; PMCID: PMC5566020.
- Maxwell CA, Mion LC, Dietrich MS. Hospitalized injured older adults: clinical utility of a rib fracture scoring system. J Trauma Nurs. 2012 Jul-Sep;19(3):168-74; quiz 175-6. doi: 10.1097/JTN.0b013e318261d201. PMID: 22955713.
- Moore EE, Cogbill TH, Jurkovich GJ, McAninch JW, Champion HR, Gennarelli TA, Malangoni MA, Shackford SR, Trafton PG. Organ injury scaling. III: Chest wall, abdominal vascular, ureter, bladder, and urethra. J Trauma. 1992 Sep;33(3):337-9. PMID: 1404499.
- Pape HC, Remmers D, Rice J, Ebisch M, Krettek C, Tscherne H. Appraisal of early evaluation of blunt chest trauma: development of a standardized scoring system for initial clinical decision making. J Trauma. 2000 Sep;49(3):496-504. doi: 10.1097/00005373-200009000-00018. PMID: 11003329.
- Pieracci FM. Scoring Systems of Blunt Thoracic Trauma and Rib Fractures. In: Moya Mde, Mayberry J. eds. Rib Fracture Management A Practical Manual. Cham, Switzerland: Springer International Publishing AG; 2018.
- Pressley CM, Fry WR, Philp AS, Berry SD, Smith RS. Predicting outcome of patients with chest wall injury. Am J Surg. 2012 Dec;204(6):910-3; discussion 913-4. doi: 10.1016/j.amjsurg.2012.05.015. Epub 2012 Oct 1. PMID: 23036605.
- Rodriguez RM, Hendey GW, Mower WR. Selective chest imaging for blunt trauma patients: The national emergency X-ray utilization studies (NEXUS-chest algorithm). Am J Emerg Med. 2017 Jan;35(1):164-170. doi: 10.1016/j.ajem.2016.10.066. Epub 2016 Oct 29. PMID: 27838036; PMCID: PMC5177494.
- Todd SR, McNally MM, Holcomb JB, Kozar RA, Kao LS, Gonzalez EA, Cocanour CS, Vercruysse GA, Lygas MH, Brasseaux BK, Moore FA. A multidisciplinary clinical pathway decreases rib fracture-associated infectious morbidity and mortality in high-risk trauma patients. Am J Surg. 2006 Dec;192(6):806-11. doi: 10.1016/j.amjsurg.2006.08.048. PMID: 17161098.
- Van Vledder MG, Kwakernaak V, Hagenaars T, Van Lieshout EMM, Verhofstad MHJ; South West Netherlands Trauma Region Study Group. Patterns of injury and outcomes in the elderly patient with rib fractures: a multicenter observational study. Eur J Trauma Emerg Surg. 2019 Aug;45(4):575-583. doi: 10.1007/s00068-018-0969-9. Epub 2018 Jun 15. PMID: 29905897; PMCID: PMC6689021.
- Vassalou EE, Perysinakis I, Klontzas ME, de Bree E, Karantanas AH. Performance of thoracic ultrasonography compared with chest radiography for the detection of rib fractures using computed tomography as a reference standard. Skeletal Radiol. 2024 Nov;53(11):2367-2376. doi: 10.1007/s00256-024-04658-8. Epub 2024 Mar 19. PMID: 38499892.
Evidence tabellen
Niet van toepassing.
Risk of bias tabel
Niet van toepassing.
Exclusie tabel
Niet van toepassing.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-05-2025
Beoordeeld op geldigheid : 28-05-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met thoracale letsels na trauma.
Werkgroep
- Dr. M.M.E. (Mathieu) Wijffels, traumachirurg, NVvH (voorzitter)
- Drs. P.J. (Pieter Jan) van Huijstee, longchirurg, NVvH (voorzitter)
- Dr. D. (Doeke) Boersma, chirurg, NVvH
- Dr. W.P. (Wietse) Zuidema, chirurg, NVvH
- Drs. W.W.L. (Wilson) Li, cardiothoracaal chirurg, NVT
- Drs. A.W.M. (Antoinette) Stolwijk, chirurg-intensivist, NVIC
- Drs. V.P.M. (Vincent) Rietveld, SEG, NVSHA
- Dr. M. (Monique) Brink, radioloog, NVvR
- Drs. S.A.S. (Sandra) van den Heuvel, anesthesioloog, NVA
- L. (Lydia) Köster MSc, fysiotherapeut, KNGF
Klankbordgroep
- T. (Thomas) Jonkergouw, adviseur patiëntbelang, Patiëntenfederatie Nederland
- Dr. H. (Hendrik-Jan) Dieker, cardioloog, NVVC
Met ondersteuning van
- Dr. R. (Romy) Zwarts – van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mitchel) Griekspoor MSc., adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. E.R.L. (Evie) Verweg, junior adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Wijffels |
Traumachirurg, Erasmus MC |
Geen |
Onderzoeksbeurzen van ZonMw (prospectieve ribfixatie studie), Johnson en Johnson DePuy Synthes, OTC/Stryker, Stichting Coolsingel, KLS Martin (onderzoek naar ribplaten) |
Gedeeltelijke restrictie. Het werkgroeplid zal niet meebeslissen over ribfixatie en/of ribplaten. Wanneer deze onderwerpen worden besproken zal Monique Brink de vergadering voorzitten. |
|
Van Huijstee |
Algemeen Thoracaal en Trauma-Chirurg, Medische Specialistische Co-operatie HAGA Ziekenhuis, Den Haag
|
Voorzitter Ned. Ver. Voor Longchirurgie (Onbetaald), Bestuurslid Ned. Ver. Voor Heelkunde (Onbetaald), ATLS-instructeur bij stichting ALSG.
Executive Board Member of Chest Wall International Group (onbezoldigd) |
Ad Hoc, Betaald adviseurschap bij Distrimed voor ontwikkeling van nieuwe implantaten voor congenitale borstkasafwijkingen en onkostenvergoeding bij proctoring van collega-chirurgen in het gebruik van deze implantaten. |
Gedeeltelijk restrictie. Het werkgroeplid zal niet meebeslissen over ribfixatie en/of ribplaten. Wanneer deze onderwerpen worden besproken zal Monique Brink de vergadering voorzitten. |
|
Stolwijk |
Traumachirurg, intensivist, MUMC+ |
Lid klankbordgroep richtlijn abdominale letsels na trauma medisch Manager Acute Zorg Limburg (NAZL) |
Geen.
|
Geen restrictie |
|
Boersma |
Chirurg |
Geen |
Geen |
Geen restrictie |
|
Köster |
Fysiotherapeut projectleider/ adviseur Traumazorg bij het traumacentrum Zuid West Nederland. |
Geen. Penningmeester geworden van Stichting Netwerk Traumarevalidatie Nederland (onbetaald). |
Geen |
Geen restrictie |
|
Brink |
Radioloog, Radboud UMC |
Sprekersbureau Canon Medical Systems |
Research Grant Canon Medical Systems 2016-2020 |
Geen restrictie |
|
Rietveld |
SEH-arts, Rijnstate |
Partner en course director DEUS |
Ontwikkeling point-of-care echografie |
Geen restrictie |
|
Zuidema |
Traumachirurg, Amsterdam UMC |
Secretaris NVT, Lid Geschillencommisie Ziekenhuizen |
Unrestricted grant (Mendela) voor studie over digitale pneumothorax zuigsystemen |
Geen restrictie |
|
Van den Heuvel |
Anesthesioloog 50%, pijnspecialist 50%, Radboud UMC |
Geen |
Regiehouder pijn Radboudumc, Editor pijn.nl Co-secretaris World Institute of Pain Benelux, onbetaald Educational committee web-based learning World Institute of Pain, onbetaald |
Geen restrictie |
|
Li |
Cardiothoracaal chirurg, Radboudumc |
Secretaris NVT |
Geen |
Geen restrictie |
|
Jonkergouw |
Adviseur Patiëntbelang Patiëntenfederatie Nederland |
Vrijwilliger Diabetes Vereniging Nederland |
Geen |
Geen restrictie |
|
Dieker |
Cardioloog, Radboudumc |
Geen |
Geen |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname aan de schriftelijke knelpunteninventarisatie en een afgevaardigde patiëntenvereniging in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
|
Module |
Uitkomst raming |
Toelichting |
|
Module Evaluatie van een thoraxletsel |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met thoracale letsels. Tevens zijn er knelpunten aangedragen door wetenschappelijke verenigingen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), duurzaamheid, aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.