Niet-medicamenteuze behandeling van delier
Uitgangsvraag
Wat zijn optimale niet-medicamenteuze preventieve maatregelen en wat is de beste actieve behandeling van delier bij patiënten met sepsis?
De uitgangsvraag omvat de volgende deelvragen:
2a. Zijn er niet-medicamenteuze preventieve maatregelen om een delier te voorkomen bij patiënten met sepsis?
2b. Wat is de beste niet-medicamenteuze behandeling van een delier bij patiënten met sepsis?
Aanbeveling
Overweeg bij patiënten met sepsis op de IC alleen niet-medicamenteuze maatregelen ter preventie of behandeling van een delier, indien deze geen hoge kosten meebrengen en eenvoudig uit te voeren zijn.
Behandel patiënten met sepsis met een delier buiten de IC volgens de richtlijn delier bij volwassenen en ouderen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Een delier is een ernstige complicatie bij patiënten met sepsis, zorgt voor een langere ziekenhuisverblijfsduur en kan leiden tot langetermijncomplicaties. De incidentie van delier bij patiënten met sepsis op een IC is niet goed bekend, maar het optreden van een delier bij IC-patiënten wordt geschat op ongeveer 30% (Salluh, 2015; Wassenaar, 2016). Mogelijk kunnen niet-medicamenteuze interventies de incidentie, duur en ernst van delier verminderen. Vanwege het ontbreken van specifieke informatie voor de sepsispopulatie op de IC in de literatuur is er een literatuuronderzoek verricht naar verschillende niet-medicamenteuze maatregelen en behandelingen bij volwassen patiënten opgenomen op de IC.
Op basis van de geselecteerde literatuur blijft het onduidelijk of niet-medicamenteuze preventieve maatregelen de incidentie van delier en ernstige bijwerkingen kunnen verminderen. Ook blijft het onduidelijk of een niet-medicamenteuze actieve behandeling de duur van delier kan verkorten en de mortaliteit kan verlagen bij volwassen patiënten met sepsis op de IC. In een aantal RCT’s werd een klinisch relevante verlaging van het risico op delier gerapporteerd, terwijl in de overige RCT’s juist geen klinisch relevant verschil werd waargenomen. Er werden geen ernstige bijwerkingen gerapporteerd in de geselecteerde studies met preventieve maatregelen als interventie. Daarnaast rapporteerden de meeste RCT’s geen klinisch relevante verschillen wat betreft de duur van delier en mortaliteit.
De totale bewijskracht voor de cruciale uitkomstmaten is zeer laag voor zowel de preventieve maatregelen als de behandeling van delier. Dit komt voornamelijk doordat de interventies vaak maar in één studie werden beschreven waarin een gering aantal patiënten werden geïncludeerd met een beperkt voorkomen van delier. Bij een aantal studies ontbrak een adequate sample-size berekening. Het is daarom goed mogelijk dat nieuwe studies de conclusies kunnen veranderen. Er is meer onderzoek nodig, bij voorkeur bij patiënten met sepsis, om uitsluitsel te krijgen of preventieve maatregelen en niet-medicamenteuze behandelingen van delier de duur en/of ernst van delier verminderen met inclusie van voldoende aantallen patiënten. Patiënten met sepsis kunnen namelijk op de IC liggen, maar zeker ook op verpleegafdelingen. De patiënten op verpleegafdelingen zijn in deze literatuursamenvatting niet meegenomen. Een ander methodologisch punt is dat een aantal studies de effecten van een multicomponent interventies heeft onderzocht, waardoor de effecten van afzonderlijke interventies niet te beoordelen zijn. Ook op basis van de belangrijke uitkomstmaten kan niet worden bepaald of preventieve maatregelen en niet-medicamenteuze behandeling van delier effectief en veilig zijn.
Bij een delier spelen meerdere risicofactoren een rol, zoals cognitieve stoornissen, slaapdeprivatie, immobiliteit, visuele beperkingen en gehoorstoornissen. Bij niet-IC-patiënten zijn er aanwijzingen dat een interventie gericht op meerdere risicofactoren een reductie van het delier kunnen geven (Inouye, 1999). Van een aantal studies geïncludeerd in deze richtlijn, zijn de effecten van een multicomponent ergotherapie interventie onderzocht. Deze interventies bestonden uit meerdere sensorische stimuli, zoals het voorkomen van oedeem en doorligplekken, cognitieve stimulatie, training van basale dagelijkse activiteiten zoals hygiëne en eten, fysiotherapie gericht op de bovenste extremiteiten en dagelijks bezoek van de familie. De resultaten van pilotstudies zijn gepubliceerd in Bannon (2019). Wij zijn van mening dat grotere studies, met een adequate sample-size, waarin multi-component interventies worden toegepast, een betere onderbouwing zullen geven aan de gestelde PICO vragen.
Er zijn geen subgroepen geïdentificeerd waarvoor de voor- en nadelen van de interventie of de bewijskracht anders uitvallen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers/familie)
De voorkeur van de patiënt voor deze interventies is niet onderzocht en onbekend. Het belangrijkste doel van de niet-medicamenteuze interventies is preventie of verkorten van de duur van een delier. Het optreden van een delier wordt door patiënten zeer wisselend beleefd. Ook het verminderen van de ernst van een delier is voor patiënt en verzorgers van groot belang. Sommige patiënten hebben geen herinnering meer aan een delier wanneer zij zijn hersteld, maar voor de partner en mantelzorgers is het vaak een ontluisterende ervaring. Andere patiënten geven aan dat het optreden van een delier tijdens de periode van een ernstige ziekte waarvoor een IC-opname noodzakelijk was als een zeer belastende periode te hebben ervaren wat zij ook nooit meer willen maken. De genoemde interventies lijken niet belastend voor de patiënt. Naasten van patiënt kunnen de interventies als positief ervaren (flexibelere bezoektijden, betrokkenheid bij behandeling van patiënt). Daarnaast kan de rol van naasten als positief worden ervaren door patiënten omdat hun gezicht en stem vertrouwd is.
Over het algemeen wordt de opnameduur op een IC verlengd bij het ontstaan van een delier. Bovendien kan een delier leiden tot cognitieve stoornissen op lange termijn, een verminderde kwaliteit van leven en het post-IC syndroom. Ook geeft een delier een hogere werkbelasting voor de verpleging. Daarmee zijn de kosten bij een delier duidelijk hoger dan bij patiënten die geen delier hebben doorgemaakt. De preventie van een delier of verkorten van de duur van het delier kan kostenbesparend zijn. Dit moet dan afgewogen worden tegen de kosten van een interventie. De kosten van een interventie zijn natuurlijk erg afhankelijk van deze interventie zelf (flexibele bezoektijden, licht, dag-nachtritme brengen waarschijnlijk minimale kosten met zich mee; maar interventies zoals intensieve fysiotherapie en familie trainen vragen extra tijd van personeel en brengen daardoor meer kosten met zich mee).
Aanvaardbaarheid, haalbaarheid en implementatie
Op basis van de bestudeerde literatuur lijkt een enkele interventie geen effect op vermindering van de ernst en duur van een delier te hebben. Juist de combinatie van meerdere interventies kunnen mogelijk tot een succes leiden, hetgeen momenteel wordt onderzocht in meerdere studies. De Nederlandse UNDERPIN-ICU studie (protocol: Wassenaar, 2017) onderzocht een bundel van niet-medicamenteuze verpleegkundige interventies bestaande uit het optimaliseren van visus, gehoor, oriëntatie, slaap, cognitie en mobilisatie bij 1749 IC-patiënten met een hoog risico op het ontwikkelen van een delier. Het gebruik van deze bundel van niet-medicamenteuze maatregelen had geen effect op deliervrije dagen in de eerste 28 dagen na een IC opname, noch op andere uitkomstmaten (proefschrift Rood, 2020). Totdat de resultaten van andere lopende studies beschikbaar zijn zal er mogelijk terughoudendheid zijn met betrekking tot implementatie van een interventiebundel. Het implementeren van een interventiebundel kan alleen werken, als het hele behandelteam (medisch, verpleegkundig, ondersteunend en consultatief) hieraan mee doet en dus getraind wordt. En inwerk- en implementatieprogramma kost tijd en daarmee geld. De interventies op zichzelf zijn relatief makkelijk in te voeren (verlengen bezoektijden, lichttherapie, oordopjes, bril/gehoorapparaat, filmpjes van familie) en kosten niet veel tijd of geld per interventie. Ook het geven van psycho-educatie, zowel schriftelijk als mondeling aan patiënt en familie nog voor het optreden van een delier lijkt goed uitvoerbaar.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het belangrijkste doel van de niet-medicamenteuze interventies is preventie of verkorten van de duur van een delier. Er zijn geen studies gevonden die de effectiviteit van een of een combinatie van meerdere niet-medicamenteuze interventies ter voorkoming of verkorting van een delier aantonen. Ondanks de kleine aantallen patiënten, deels in pilot studies lijken verschillende interventies toch de incidentie van delier of zelfs de mortaliteit te verminderen. Omdat het voornaamste tegenargument voor interventies de kosten betreft is dit een belangrijk aspect om mee te nemen. De kostenafweging dient per situatie te worden gemaakt.
Onderbouwing
Achtergrond
Mogelijk kan een niet-medicamenteuze behandeling van een delier de duur en ernst van een delier verminderen of delier voorkomen bij patiënten met sepsis. Niet-farmacologische interventies voor een delier, zoals vermindering van prikkels, geluid, heroriëntatie, rooming in van familieleden (inclusief flexibele bezoekuren), naasten of andere mantelzorgers spelen een belangrijke rol in de dagelijkse behandeling van patiënten die zijn opgenomen op ene IC. Zie hiervoor ook de richtlijn Delirium op de intensive care. Het bewaken van een dag-nacht ritme met bijvoorbeeld lichttherapie overdag en minimaliseren van licht gedurende de nacht, het aanbieden van rustgevende achtergrondmuziek, het zo snel mogelijk mobiliseren van patiënt en het optimaliseren van sensore beperkingen (gebruik van gehoorapparaten en bril) zijn veel genoemde maatregelen waarvan de effectiviteit niet duidelijk is voor patiënten met sepsis.
Conclusies / Summary of Findings
Deelvraag 1: Preventieve maatregelen
|
Zeer laag GRADE |
Het is onduidelijk of preventieve maatregelen de incidentie van delier verlagen ten opzichte van standaardzorg bij patiënten met sepsis op de intensive care.
Bronnen: (Bannon, 2019; Eghbali-Babadi, 2017; Rosa, 2019) |
|
- GRADE |
Vanwege het ontbreken van studies waarin ernstige bijwerkingen van preventieve maatregelen werden beschreven bij patiënten met sepsis op de intensive care was het niet mogelijk een conclusie te trekken voor deze uitkomstmaat. Er werden slechts sporadisch ernstige bijwerkingen genoemd.
Bronnen: (Bannon, 2019) |
Deelvraag 2: Behandeling
|
Zeer laag GRADE |
Het is onduidelijk of niet-medicamenteuze behandelingen de duur van delier verkorten bij patiënten met sepsis op de intensive care.
Bronnen: (Bannon, 2019; Nydahl, 2019) |
|
Zeer laag GRADE |
Het is onduidelijk of niet-medicamenteuze behandelingen de mortaliteit verminderen bij patiënten met sepsis op de intensive care.
Bronnen: (Bannon, 2019; Herling, 2018, Rosa, 2019) |
|
Zeer laag GRADE |
Het is onduidelijk of niet-medicamenteuze behandelingen de intensive-careverblijfsduur verkorten bij patiënten met sepsis op de intensive care.
Bronnen: (Nydahl, 2019; Herling, 2018; Rosa, 2019) |
|
Zeer laag GRADE |
Het is onduidelijk of niet-medicamenteuze behandelingen de kwaliteit van leven verbeteren bij patiënten met sepsis op de intensive care.
Bronnen: (Bannon, 2019) |
|
Zeer laag GRADE |
Het is onduidelijk of niet-medicamenteuze behandelingen de cognitieve functie verbeteren bij patiënten met sepsis op de intensive care.
Bronnen: (Bannon, 2019; Herling, 2018) |
|
Zeer laag GRADE |
Het is onduidelijk of niet-medicamenteuze behandelingen de kans op ernstige bijwerkingen verhogen bij patiënten met sepsis op de intensive care.
Bronnen: (Bannon, 2019; Herling, 2018) |
|
Zeer laag GRADE |
Het is onduidelijk of niet-medicamenteuze behandelingen de duur van mechanische ventilatie verkort bij patiënten met sepsis op de intensive care.
Bronnen: (Herling, 2018; Rosa, 2019) |
|
- GRADE |
Vanwege het ontbreken van studies waarin de ziekenhuisverblijfsduur werd beschreven bij patiënten met sepsis op de intensive care was het niet mogelijk een conclusie te trekken voor deze uitkomstmaat. |
Samenvatting literatuur
Systematic reviews
De SR van Bannon (2019) werd als uitgangspunt genomen. De studie vergeleek het effect van niet-medicamenteuze interventies met standaard zorg op de incidentie en duur van delier bij volwassen patiënten opgenomen op de IC. RCT’s over de effectiviteit van verschillende niet-medicamenteuze interventies bij ernstig zieke patiënten opgenomen op de IC werden geïncludeerd. Niet-gerandomiseerd onderzoek werd geëxcludeerd. Er werd gezocht naar relevante literatuur in Medline, Embase, CINAHL, Web of Science, PsycINFO, AMED en de Cochrane database tot en met maart 2018. Vijftien RCT’s rapporteerden de uitkomstmaat incidentie of duur van delier voor de vergelijking tussen niet-medicamenteuze interventies en standaard zorg bij volwassen patiënten opgenomen op de IC. Verschillende niet-medicamenteuze interventies werden beschreven in dit review: fysiotherapie, ergotherapie, therapie met fel licht, oorpluggen, spiegels, heroriëntatie en verschillende multicomponent interventies. Elf van de vijftien RCT’s rapporteerden de incidentie van delier. Een meta-analyse werd uitgevoerd voor vier RCT’s die de niet-medicamenteuze interventie ‘therapie met fel licht’ rapporteerden. Acht RCT’s rapporteerden de uitkomstmaat duur van het delier. Een meta-analyse werd uitgevoerd voor twee RCT’s die de niet-medicamenteuze interventie ‘multicomponent physical therapy’ rapporteerden. Voor de overige interventies kon geen meta-analyse worden uitgevoerd. Alle 15 RCT’s hadden een risico op bias vanwege het ontbreken van blindering. Een aantal studies had een klein aantal patiënten geïncludeerd zonder een adequate sample-size berekening. Voor informatie over de follow-up en het aantal patiënten in de interventie en controlegroep verwijzen we graag naar de bijlage met Evidence tabel.
De SR van Herling (2018) werd als aanvulling op de SR van Bannon (2019) gebruikt. De studie beschreef het effect van preventieve interventies ten opzichte van standaard zorg bij volwassen patiënten opgenomen op de IC. De studie includeerde RCT’s over de effectiviteit van medicamenteuze en niet-medicamenteuze interventies bij ernstig zieke patiënten opgenomen op de IC. Niet-gerandomiseerd onderzoek werd geëxcludeerd in de review. Er werd gezocht naar relevante literatuur in Medline, Embase, BIOSIS, Web of Science, LILACS, CINAHL en de Cochrane database tot en met april 2018. In deze RCT werden in totaal 12 RCT’s geïncludeerd: zeven RCT’s met een medicamenteuze interventie en vijf RCT’s met een niet-medicamenteuze interventie. Van deze vijf RCT’s was alleen de RCT van Brummel (2014) nog niet opgenomen in de SR van Bannon (2019) en werd daarom ook uitgewerkt in deze literatuursamenvatting. Deze RCT had ook een risico op bias vanwege het ontbreken van blindering. Daarnaast beschreef de SR van Herling (2018) uitkomstmaten die niet in de SR van Bannon (2019) werden gerapporteerd.
RCT’s
In de cluster cross-over RCT van Rosa (2019) werd onderzocht of flexibele bezoekuren op de IC van invloed zijn op de incidentie van delier. Alle patiënten waren 18 jaar of ouder en waren opgenomen op de IC. Patiënten met een coma langer dan 96 uur of de aanwezigheid van de volgende symptomen voor het begin van de studie werden geëxcludeerd: delier, hersendood, exclusief palliatieve zorg, niet kunnen communiceren, verwachte IC opname van minder dan 48 uur, verwacht overlijden binnen 24 uur, gevangenen, geen beschikbaar familielid om deel te nemen aan de studie of eerdere deelname aan de studie. De interventie bestond uit flexibele bezoekuren waarbij het familielid tot 12 uur lang aanwezig mocht zijn op de IC en informatie kreeg over (procedures op) de IC (onderwijsmoment). De controlegroep kreeg bezoek tijdens de ‘normale’ bezoekuren en deze bezoekers kregen geen extra informatie (standaardzorg). De studie includeerde 1.685 patiënten, waarvan 837 ernstig zieke patiënten met de interventie flexibele bezoekuren en 848 ernstig zieke patiënten met de gebruikelijke bezoekuren. Patiënten werden gevolgd tot ontslag uit het ziekenhuis, overlijden of tot een maximum van 30 dagen.
In de stepped-wedge cluster pilot RCT van Nydahl (2019) werd onderzocht of vroege mobilisatie van ernstig zieke patiënten op de IC invloed heeft op de incidentie van delier. De studie includeerde ernstig zieke patiënten (18 jaar of ouder) opgenomen op de IC. Patiënten werden geëxcludeerd als zij in palliatieve staat waren, eerder geen toestemming hadden gegeven om hun data voor onderzoek te gebruiken, eerder al geïncludeerd waren in de studie of niet in staat waren tot mobilisatie. De interventie bestond uit een vroeg mobilisatie protocol, waarbij voor elke patiënt individuele mobiliteitsdoelen werden gesteld. In totaal ontvingen 120 patiënten de interventie vroege mobilisatie en 152 patiënten ontvingen deze interventie niet (controle arm). Alle IC- afdelingen startten met een controle periode, waarna elke maand willekeurig een IC-afdeling werd toegewezen aan de interventie. De eerste maand was een implementatiefase, daarna begonnen de daadwerkelijke metingen. Patiënten werden gevolgd tot ontslag van de IC of tot een maximum van 28 dagen.
In de RCT van Eghbali-Babadi (2017) werd onderzocht of communicatie met de familie de incidentie van delier vermindert bij ernstig zieke patiënten opgenomen op de cardiovasculaire chirurgie IC. Alle patiënten waren 18 jaar of ouder, hadden een familielid beschikbaar om mee te doen, geen historie van een drugs, alcohol of sigaretten verslaving, geen delier, niet blind of doof en geen intubatie met een tracheale buis. Patiënten werden geëxcludeerd in het geval van overlijden, in het geval de familie niet wilde meedoen of wanneer er acute complicaties optraden na de operatie. De interventie bestond uit een bezoek van een familielid op de ochtend na de operatie. Dit familielid heeft de dag voor dit bezoek een onderwijsmoment gehad om de familieleden informatie te geven over delier en ze te leren hoe te communiceren met de patiënt. De controlegroep ontving standaard zorg. In totaal ontvingen 68 patiënten de interventie en 34 patiënten ontvingen deze interventie niet (controlegroep). Patiënten werden in totaal drie keer beoordeeld op delier, twee keer in de ochtend en een keer in de avond.
Resultaten
Deelvraag 1: Preventieve maatregelen
Incidentie van delier
De uitkomstmaat incidentie van delier werd in 12 RCT’s beschreven (Alvarez, 2017; Eghbali-Babadi, 2017, Finotto, 2006; Giraud, 2016; Karadas, 2016; Moon, 2015; Ono, 2011; Potharajaroen, 2018; Rosa, 2019; Simons, 2016; Taguchi, 2007; Van Rompaey, 2012) De resultaten van de verschillende interventies die werden beschreven in deze RCT’s worden hieronder toegelicht.
Vier verschillende RCT’s bestudeerden het effect van therapie met fel licht (Bannon 2019). In figuur 9 worden de resultaten van deze vier studies gepresenteerd. Het gepoolde relatief risico (RR) bedroeg 0,45 in het voordeel van fel licht therapie, met een breed 95% betrouwbaarheidsinterval (BI) van 0,10 tot 2,13. Hoewel de grootte van het effect klinisch relevant was, waren de verschillen niet statistisch significant.
Figuur 9 De incidentie van delier bij het wel of niet ondergaan van de interventie fel licht therapie bij ernstig zieke patiënten op de intensive care
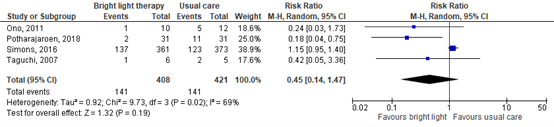
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Bron: Bannon, 2019.
De overige interventies konden niet gepoold worden weergegeven door de verschillende aard van de interventies.
In de pilot RCT van Alvarez (Bannon, 2019) werd een multicomponent ergotherapie interventie bestudeerd bestaande uit meerdere sensore stimuli, het voorkomen van oedeem en doorligplekken, cognitieve stimulatie, training van basale dagelijkse activiteiten zoals hygiëne en eten, fysiotherapie gericht op de bovenste extremiteiten en dagelijks bezoek van de familie. In totaal kregen 2 van de 65 (3,0%) ernstig zieke patiënten met de interventie een delier, ten opzichte van 14 van de 65 (20%) ernstig zieke patiënten met standaard zorg (RR 0,15; 95% BI 0,02 tot 1,03). Dit betekent dat patiënten die de interventie ontvingen een klinisch relevant lager risico lijken te hebben op een delier ten opzichte van patiënten zonder de interventie.
In de RCT van Finotto (Bannon, 2019) werd het effect van een multicomponent interventie bestudeerd bestaande uit oriëntatie en cognitieve stimulatie door aanraking, het corrigeren van sensorische problemen, reduceren van geluid en het faciliteren van participatie van de familie en voorlichting over delier. In totaal kregen 3 van de 17 (17,6%) ernstig zieke patiënten met de interventie een delier, ten opzichte van 6 van de 31 (19,4%) ernstig zieke patiënten met standaard zorg (RR 0,91; 95% BI 0,18 tot 4,73). Dit betekent dat patiënten die de interventie ontvingen geen lager risico hebben op een delier ten opzichte van patiënten zonder de interventie. Bovendien is het gerapporteerde verschil klinisch niet relevant.
In de pilot RCT van Giraud (Bannon, 2019) werd het gebruik van verschillende spiegels bestudeerd als heroriënterend hulpmiddel, ter ondersteuning van het zelfbewustzijn, ondersteuning van hand-oog coördinatie en als communicatie hulpmiddel. In totaal kregen 20 van de 115 (17,4%) ernstig zieke patiënten met de interventie een delier gerapporteerd, ten opzichte van 17 van de 108 (15,7%) ernstig zieke patiënten met standaard zorg (RR 1,10; 95% BI 0,51 tot 2,40). Dit betekent dat patiënten in de interventiegroep een hoger risico hebben op het krijgen van een delier. Echter het gerapporteerde verschil is niet klinisch relevant.
In de RCT van Karadas (Bannon, 2019) werd het effect van dagelijkse fysiotherapie bestudeerd. In totaal kregen 4 van de 47 (8,5%) ernstig zieke patiënten opgenomen op de IC met de interventie een delier, ten opzichte van 10 van de 47 (21,3%) ernstig zieke patiënten met standaard zorg (RR 0,40; 95% BI 0,10 tot 1,67). Dit geeft een aanwijzing dat patiënten in de interventiegroep een klinisch relevant lager risico hebben op het krijgen van een delier.
In de RCT van Moon (Bannon, 2019) werd het effect bestudeerd van een multicomponent interventie op risicofactoren zoals ondervoeding, infectie, pijn, aanwezigheid van een urinekatheter, vocht of elektrolyten disbalans, immobiliteit en slaaptekort. In totaal kregen 12 van de 60 (20,0%) ernstig zieke patiënten met de interventie een delier, ten opzichte van 21 van de 63 (33,3%) ernstig zieke patiënten met standaard zorg (RR 0,60; 95% BI 0,32 tot 1,11). Dit betekent dat patiënten die de interventie ontvingen een klinisch relevant lager risico hebben op een delier ten opzichte van patiënten zonder de interventie.
In de RCT van Rompaey (Bannon, 2019) werd het dragen van oordopjes tijdens de nacht bestudeerd. Van de 69 ernstig zieke patiënten opgenomen op de IC die sliepen met oordopjes tijdens de nacht kregen 14 (20,3%) patiënten een delier, ten opzichte van 13 (19,4%) van de 67 patiënten met standaard zorg (RR 1,05; 95% BI 0,53 tot 2,06). Dit betekent dat er geen verschil in incidentie van delier is gevonden tussen de interventie en controlegroep bij ernstig zieke patiënten opgenomen op de IC.
In de RCT van Eghbali-Babadi (2017) werd het effect van communicatie in combinatie met een onderwijscomponent tussen de patiënt en een familielid bestudeerd. Tijdens de eerste ochtend na de operatie hadden 4/34 (11,8%) patiënten in de interventiegroep een delier, ten opzichte van 8/34 (23,5%) patiënten met standaard zorg (RR 0,50; 95% BI 0,17 tot 1,51). Tijdens de eerste avond na de operatie hadden 4/34 (11,8%) patiënten in de interventiegroep een delier, ten opzichte van 11/34 (32,4%) in de controlegroep (RR 0,36; 95% BI 0,13 tot 1,03). Tijdens de tweede ochtend na de operatie hadden 3/34 (8,8%) patiënten in de interventiegroep een delier, ten opzichte van 7/34 (20,6%) patiënten in de controlegroep (RR 0,43; 95% BI 0,12 tot 1,52). Op alle drie de meetmomenten werd er een klinisch relevant lager risico op delier gevonden in de interventiegroep.
In de RCT van Rosa (2019) werd het effect van flexibele bezoekuren in combinatie met een onderwijscomponent bestudeerd. In totaal kregen 157 van de 831 (18,9%) ernstig zieke patiënten met interventie een delier, ten opzichte van 170 van de 845 (20,1%) ernstig zieke met standaard zorg (RR 0,91; 95% BI 0,73 tot 1,15). Dit betekent dat patiënten die de interventie ontvingen geen lager risico hebben op een delier ten opzichte van patiënten zonder de interventie.
Bewijskracht van de literatuur
Met uitzondering van de interventie fel licht therapie konden de resultaten van de verschillende interventies niet gepoold worden weergegeven. De bewijskracht voor de uitkomstmaat incidentie van delier voor iedere afzonderlijke interventie is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege beperkingen in de extrapoleerbaarheid (indirectheid) omdat niet alleen patiënten met sepsis zijn geïncludeerd, maar de algehele IC-populatie. Daarnaast is er met twee niveaus afgewaardeerd vanwege een gering aantal patiënten/events en vanwege de overschrijding van het BI met de grenzen voor klinische besluitvorming (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Ernstige bijwerkingen (bij preventieve maatregelen)
Geen enkele studie heeft de uitkomstmaat ernstige bijwerkingen gerapporteerd bij preventieve maatregelen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ernstige bijwerkingen (bij preventieve maatregelen) is niet te beoordelen, omdat dit niet in de geïncludeerde literatuur is beschreven.
Deelvraag 2: actieve behandeling
Duur van delier
De uitkomstmaat duur van delier werd in 8 verschillende RCT’s beschreven (Alvarez, 2017; Giraud, 2016; Karadas, 2016; Morris, 2016; Munro, 2017; Nydahl, 2019; Schweickert, 2009; Simons, 2016). De resultaten van de verschillende interventies die werden beschreven in deze RCT’s worden hieronder toegelicht.
Twee RCT’s bestudeerden het effect van een multicomponent fysiotherapie op de duur van delier (Bannon, 2019). In figuur 10 worden de resultaten van deze twee studies gepresenteerd. De duur van delier in de interventie groep was 0,65 dagen korter (95% BI -2,73 tot 1,44), ten opzichte van de duur van het delier in ernstig zieke patiënten met standaard zorg. Echter het gerapporteerde verschil is niet klinisch relevant.
Figuur 10 De duur van delier bij het wel of niet ondergaan van de interventie fysiotherapie bij ernstig zieke patiënten op de intensive care
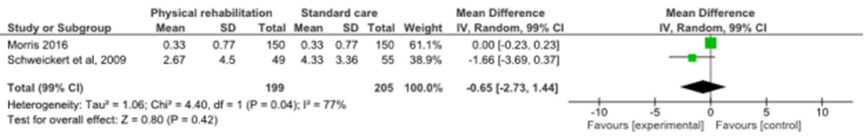
Experimental: fysiotherapie; Control: standaardzorg; Bron: Bannon, 2019; Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
In de pilot RCT van Alvarez (Bannon, 2019) werd het effect van een multicomponent ergotherapie interventie bestaande uit meerdere sensore stimuli, het voorkomen van oedeem en doorligplekken, cognitieve stimulatie, training van basale dagelijkse activiteiten zoals hygiëne en eten, fysiotherapie gericht op de bovenste extremiteiten en dagelijks bezoek van de familie bestudeerd. De gemiddelde duur van delier was 1,83 dagen (standaarddeviatie (SD) 1,87) bij ernstig zieke patiënten met interventie, ten opzichte van 2 dagen (SD 1,34) bij ernstig zieke patiënten met standaard zorg. Gemiddeld was de duur van delier 0,17 dagen korter bij ernstig zieke patiënten met interventie (95% BI -0,91 tot 0,57), ten opzichte van het delier in de groep zonder interventie. Het gerapporteerde verschil is klinisch niet relevant.
In de pilot RCT van Giraud (Bannon, 2019) werd het gebruik van verschillende spiegels bestudeerd als heroriënterend hulpmiddel, ter ondersteuning van het zelfbewustzijn, ondersteuning van hand-oog coördinatie en als communicatie hulpmiddel. En werd de duur van delier beschreven na een maximale follow-up van 12 weken. De gemiddelde duur van delier was 1 dag (IQR 1 tot 3) bij ernstig zieke patiënten met interventie, ten opzichte van 2 dagen (IQR 1 tot 8) bij ernstig zieke patiënten met standaard zorg. Dit betekent dat de duur van delier 1 dag korter was bij ernstig zieke patiënten met interventie, ten opzichte van het delier in de groep zonder interventie (95% BI van -2,02 tot 0,02). Het gerapporteerde verschil is klinisch relevant.
In de RCT van Karadas (Bannon, 2019) werd het effect van dagelijkse fysiotherapie bestudeerd op de duur van delier na een follow-up tot aan ontslag. De mediane duur van delier was 15 uur (range 3 tot 144 uur) bij ernstig zieke patiënten met interventie, ten opzichte van 38 uur (range 9 tot 120 uur) bij ernstig zieke patiënten met standaard zorg (95% BI van -42 tot 34). De duur van delier was 23 uur korter bij ernstig zieke patiënten met interventie, ten opzichte van het delier in de groep zonder interventie. Het gerapporteerde verschil is klinisch niet relevant.
In de pilot RCT van Munro (Bannon, 2019) werd het effect van een ingesproken bericht door een familielid bestudeerd op de duur van delier na een follow-up van drie dagen. De gemiddelde duur van delier was 0,3 dagen (SD 0,48) bij ernstig zieke patiënten met interventie, ten opzichte van 0,9 dagen (SD 1,28) bij ernstig zieke patiënten met standaard zorg. Gemiddeld was de duur van delier 0,6 dagen korter bij ernstig zieke patiënten met interventie, ten opzichte van het delier in de groep zonder interventie (95% BI van -1,44 tot 0,24). Het gerapporteerde verschil is klinisch niet relevant.
In de RCT van Simons (Bannon, 2019) werd het effect van lichttherapie beschreven op de duur van delier na een follow-up van 3 dagen. De gemiddelde duur van delier was 2,66 uur (SD 2,97) bij ernstig zieke patiënten met interventie, ten opzichte van 3,00 uur (SD 2,23) bij ernstig zieke patiënten met standaardzorg. Gemiddeld was de duur van delier 0,34 uur korter bij ernstig zieke patiënten met interventie (95% BI -0,84 tot 0,16), ten opzichte van het delier in de groep zonder interventie. Echter het gerapporteerde verschil is klinisch niet relevant.
In de pilot RCT van Nydahl (2019) bestudeerde het effect van een mobilisatie protocol op de duur van delier. Het aantal delier-vrije dagen werd beschreven bij ernstig zieke patiënten opgenomen op de IC na een follow-up van 28 dagen. In de interventie groep was de mediaan 28 dagen (interkwartiel range (IQL) 24,7 tot 28 dagen), in de controlegroep (standaard zorg) was de mediaan ook 28 dagen (IQL 26 tot 28 dagen). Dit betekent dat er geen verschil in het aantal delier vrije dagen is gevonden in de mediaan van het aantal delier vrije dagen tussen de interventie en controlegroep bij ernstig zieke patiënten opgenomen op de IC.
Bewijskracht van de literatuur
De verschillende interventies konden niet gepoold worden weergegeven. De bewijskracht voor de uitkomstmaat duur van delier voor iedere afzonderlijke interventie is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege beperkingen in de extrapoleerbaarheid (indirectheid) omdat niet alleen patiënten met sepsis zijn geïncludeerd maar de algehele IC-populatie. Daarnaast is er met twee niveaus afgewaardeerd vanwege een gering aantal events en vanwege de overschrijding van het BI met de grenzen voor klinische besluitvorming (beide imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Mortaliteit
De uitkomstmaat mortaliteit werd in 5 RCT’s beschreven (Brummel, 2014; Moon, 2015; Rosa, 2019; Schweickert, 2009, Simons, 2016). De resultaten van de verschillende interventies die werden beschreven in deze RCT’s worden hieronder toegelicht.
In de RCT van Brummel (Herling, 2018) werd het effect van fysiotherapie en cognitieve therapie bestudeerd. Er werd een lager risico op mortaliteit gerapporteerd voor de interventiegroep ten opzichte van de controlegroep (standaard zorg) (RR 0,94; 95% BI 0,40 tot 2,20). Dit verschil is klinisch niet relevant.
In de RCT van Moon (Bannon, 2019) werd het effect bestudeerd van een multicomponent interventie op risicofactoren zoals ondervoeding, infectie, pijn, aanwezigheid van een urinekatheter, vocht of elektrolyten disbalans, immobiliteit en slaaptekort. In de groep ernstig zieke patiënten die de interventie ontvingen overleden 4 van de 60 patiënten (6,7%), ten opzichte van 13 van de 63 ernstig zieke patiënten met standaard zorg (20,6%) (RR 0,38; 95% BI 0,13 tot 1,13). Dit betekent dat patiënten die de interventie ontvingen een klinisch relevant lager risico lijken te hebben op overlijden ten opzichte van patiënten zonder de interventie.
In de RCT van Schweickert (Bannon, 2019) werd het effect van een multicomponent fysiotherapie bestudeerd. In de groep ernstig zieke patiënten die de interventie ontvingen overleden 9 van de 49 patiënten (18,4%), ten opzichte van 14 van de 55 ernstig zieke patiënten met standaard zorg (25,5%) (RR 0,72; 95% BI 0,27 tot 1,92). Dit verschil was klinisch relevant.
In de RCT van Simons (Bannon, 2016) werd het effect van therapie met fel licht bestudeerd. In de groep ernstig zieke patiënten die de interventie ontvingen overleden 66 van de 361 patiënten (18,0%), ten opzichte van 73 van de 373 ernstig zieke patiënten met standaard zorg (20,0%) (RR 0,93; 95% BI 0,69 tot 1,26). Dit betekent dat er geen klinisch relevant verschil is in mortaliteit bij ernstig zieke patiënten met en zonder interventie.
In de RCT van Rosa (2019) werd het effect van flexibele bezoekuren in combinatie met een onderwijscomponent bestudeerd. In totaal zijn 124 van de 837 (14,8%) ernstig zieke patiënten met interventie overleden, ten opzichte van 121 van de 840 (14,4%) ernstig zieke patiënten met standaard zorg (RR 1,01; 95% BI 0,77 tot 1,32). Dit betekent dat er geen verschil in mortaliteit is gevonden tussen de interventie en controlegroep bij ernstig zieke patiënten opgenomen op de IC.
Bewijskracht van de literatuur
De verschillende interventies konden niet gepoold worden weergegeven. De bewijskracht voor de uitkomstmaat mortaliteit voor iedere afzonderlijke interventie is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege beperkingen in de extrapoleerbaarheid (indirectheid) omdat niet alleen patiënten met sepsis zijn geïncludeerd maar de algehele IC-populatie. Daarnaast is er met twee niveaus afgewaardeerd vanwege een gering aantal patiënten/events en vanwege de overschrijding van het BI met de grenzen voor klinische besluitvorming (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Intensive-careverblijfsduur
De uitkomstmaat IC-verblijfsduur werd in 5 RCT’s beschreven (Brummel, 2014; Moon, 2015; Nydahl, 2019; Rosa, 2019; Simons, 2016). De resultaten van de verschillende interventies die werden beschreven in deze RCT’s worden hieronder toegelicht.
In de RCT van Brummel (Herling, 2018) werd het effect van fysiotherapie en cognitieve therapie bestudeerd. Het gemiddelde verschil tussen de interventie en controlegroep (standaard zorg) is 1,23 dagen (95% BI -0,68 tot 3,14). Dit betekent dat patiënten in de interventiegroep iets meer dan 1 dag korter op de IC opgenomen liggen, een klinisch relevant verschil.
In de RCT van Moon (Herling, 2018) werd het effect bestudeerd van een multicomponent interventie op risicofactoren zoals ondervoeding, infectie, pijn, aanwezigheid van een urinekatheter, vocht of elektrolyten disbalans, immobiliteit en slaaptekort. In de groep ernstig zieke patiënten die de interventie ontvingen was de IC-verblijfsduur 10,8 dagen (SD 9,7), ten opzichte van 10,0 dagen (SD 11,8) in de groep met ernstig zieke patiënten met standaard zorg. De interventiegroep lag 0,8 dagen langer opgenomen op de IC ten opzichte van de controlegroep (-3,01 tot 4,61). Het gerapporteerde verschil is ten nadele van de interventie, maar niet klinisch relevant.
In de RCT van Simons (Herling, 2018) werd het effect van therapie met fel licht bestudeerd. In de groep ernstig zieke patiënten die de interventie ontvingen was de IC-verblijfsduur 4 dagen (IQR 2-8), ten opzichte van 4 dagen (IQR 2-9) in de groep met ernstig zieke patiënten zonder interventie. De interventiegroep lag gemiddeld 0,33 dagen korter op de IC ten opzichte van de controlegroep (standaard zorg) (95% BI -1,03 tot 0,37). Dit betekent dat er geen klinisch relevant verschil is in IC-verblijfsduur bij ernstig zieke patiënten met en zonder interventie.
In de pilot RCT van Nydahl (2019) werd het effect bestudeerd van een mobilisatie protocol op de duur van delier. In de interventie groep was de mediaan 19 dagen (interkwartiel range (IQL) 5,5 tot 24 dagen), in de controlegroep (standaard zorg) was de mediaan 21 dagen (IQL 9 tot 25 dagen). Dit betekent dat patiënten in de interventiegroep 2 dagen korter opgenomen liggen op de IC. Het gerapporteerde verschil is klinisch relevant.
In de RCT van Rosa (2019) werd het effect van flexibele bezoekuren in combinatie met een onderwijscomponent bestudeerd. Ernstig zieke patiënten met en zonder interventie (standaard zorg) hadden beiden een gemiddelde verblijfsduur van 5 dagen (95% BI 3 tot 8 dagen). Dit betekent dat er geen verschil in IC-verblijfsduur is gevonden tussen de interventie en controlegroep bij ernstig zieke patiënten opgenomen op de IC.
Bewijskracht van de literatuur
De verschillende interventies konden niet gepoold worden weergegeven. De bewijskracht voor de uitkomstmaat IC-verblijfsduur voor iedere afzonderlijke interventie is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege beperkingen in de onderzoeksopzet (risk of bias door het ontbreken van blindering) en wegens beperkingen in de extrapoleerbaarheid (indirectheid) omdat niet alleen patiënten met sepsis zijn geïncludeerd maar de algehele IC-populatie. Daarnaast is er afgewaardeerd vanwege een gering aantal patiënten/events (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Ziekenhuisverblijfsduur
De uitkomstmaat ziekenhuisverblijfsduur werd niet gerapporteerd in de geselecteerde literatuur.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘ziekenhuisverblijfsduur’ is niet te beoordelen, omdat dit niet is onderzocht.
Kwaliteit van leven
De uitkomstmaat kwaliteit van leven werd in twee RCT’s beschreven (Giraud, 2016; Morris, 2016). De resultaten van de verschillende interventies die werden beschreven in deze RCT’s worden hieronder toegelicht.
In de pilot RCT van Giraud (Bannon, 2019) werd de EQ-5D gebruikt om de kwaliteit van leven te meten. De gemiddelde EQ-5D ‘visual analogue scale’ was 73 (SD 19) in ernstig zieke patiënten met de interventie met spiegels, ten opzichte van 77 (SD 15) in ernstig zieke patiënten zonder de interventie. Dit betekent dat patiënten die de interventie ontvingen 4 punten lager (4%) scoorden ten opzichte van patiënten met standaard zorg. Het gerapporteerde verschil is niet klinisch relevant. De EQ-5D index score was 0,87 (SD 0,13) in ernstig zieke patiënten met de interventie spiegels, ten opzichte van 0,87 (SD 0,13) in ernstig zieke patiënten zonder de interventie (p=0,95). Dit betekent dat er geen verschil in kwaliteit van leven is gevonden tussen de interventie en controlegroep bij ernstig zieke patiënten opgenomen op de IC.
In de RCT van Morris (Bannon, 2019) werd het effect van een multicomponent fysiotherapie bestudeerd. De SF-36 werd gebruikt om de kwaliteit van leven te meten (fysieke en mentale gezondheid). De gemiddelde fysieke gezondheid van de interventiegroep was 3,4 punten hoger (3,4%) ten opzichte van standaard zorg (95% BI -0,02 tot 7,0). De gemiddelde mentale gezondheid van de interventiegroep was 4,4 punten hoger (4,4%) ten opzichte van standaard zorg (95% BI -1,2 tot 6,0). De gerapporteerde verschillen zijn niet klinisch relevant.
Bewijskracht van de literatuur
De verschillende interventies konden niet gepoold worden weergegeven. De bewijskracht voor de uitkomstmaat kwaliteit van leven voor iedere afzonderlijke interventie is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege het ontbreken van blindering (risk of bias) en vanwege beperkingen in de extrapoleerbaarheid (indirectheid) omdat niet alleen patiënten met sepsis zijn geïncludeerd maar de algehele IC-populatie. Daarnaast is er met twee niveaus afgewaardeerd vanwege een gering aantal patiënten/events (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Cognitieve functie
De uitkomstmaat cognitieve functie werd in drie RCT’s beschreven (Alvarez, 2017; Brummel, 2014; Morris, 2016) door middel van de ‘Mini Mental Scale Assessment (MMSE). De verschillende interventies die werden beschreven in deze RCT’s worden hieronder toegelicht. Omdat in de RCT van Alvarez (Bannon, 2019) een nulmeting van de MMSE ontbrak kunnen we het effect van de interventie niet beoordelen voor deze uitkomstmaat.
In de RCT van Brummel (Herling, 2018) werd het effect van een combinatie van fysiotherapie en cognitieve therapie bestudeerd. In de interventie groep steeg de MMSE van 25,4 (95% CI 24,7 tot 26,1) bij ontslag tot 27,6 (27,0 tot 28,2) na 6 maanden. In de controlegroep bedroeg de MMSE 25,1 (24,3 tot 25,8) bij ontslag en 27,0 (26,4 tot 27,6) na 6 maanden. Het gemiddelde verschil in MMSE was 0,97 (95% BI van -0,19 tot 2,13) tussen de interventie en controlegroep (standaard zorg). Dit verschil is klinisch niet relevant.
In de RCT van Morris (Bannon, 2019) werd het effect van een multicomponent fysiotherapiebehandeling op de duur van delier bestudeerd. De studie rapporteerde geen klinisch relevante verschillen.
Bewijskracht van de literatuur
De verschillende interventies konden niet gepoold worden weergegeven. De bewijskracht voor de uitkomstmaat cognitieve functie voor iedere afzonderlijke interventie is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege het ontbreken van blindering (risk of bias) en vanwege beperkingen in de extrapoleerbaarheid (indirectheid) omdat niet alleen patiënten met sepsis zijn geïncludeerd maar de algehele IC-populatie. Daarnaast is er afgewaardeerd vanwege een gering aantal patiënten/events (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Ernstige bijwerkingen (bij behandeling)
De uitkomstmaat ernstige bijwerkingen (bij actieve behandeling) werd in 3 RCT’s beschreven (Brummel, 2014; Morris, 2016; Schweickert, 2009). De resultaten van de verschillende interventies die werden beschreven in deze RCT’s worden hieronder toegelicht.
In de RCT van Brummel (Herling, 2018) werd het effect van fysiotherapie en cognitieve therapie bestudeerd. In deze studie werd één ernstige bijwerking gerapporteerd van een patiënt met acute pijn in de rug gepaard met ‘hypertensive urgency’ tijdens een fysiotherapie sessie.
Twee RCT’s bestudeerden het effect van een multicomponent fysiotherapie (Morris, 2016; Schweickert, 2009). In de RCT van Morris (Bannon, 2019) werd geen verschil gevonden in het aantal ernstige bijwerkingen tussen beide groepen (totaal 300 patiënten). In de RCT van Schweickert (Bannon, 2019) werd tijdens één van de 498 therapiesessies een desaturatie van 80% waargenomen, één event waarbij de arterielijn werd verwijderd en in 4% van alle cases werd de therapie beëindigd (bij 49 patiënten in de interventiegroep).
Bewijskracht van de literatuur
De verschillende interventies konden niet gepoold worden weergegeven. De bewijskracht voor de uitkomstmaat ernstige bijwerkingen voor iedere afzonderlijke interventie is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege het ontbreken van blindering (risk of bias) en vanwege beperkingen in de extrapoleerbaarheid (indirectheid) omdat niet alleen patiënten met sepsis zijn geïncludeerd maar de algehele IC-populatie. Daarnaast is er afgewaardeerd vanwege een gering aantal patiënten/events (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Duur van mechanische ventilatie
De uitkomstmaat duur van mechanische ventilatie werd in twee RCT’s beschreven (Brummel, 2014; Rosa, 2019). De verschillende interventies die werden beschreven in deze RCT’s worden hieronder toegelicht.
In de RCT van Brummel (Herling, 2018) werd het effect van fysiotherapie en cognitieve therapie bestudeerd. De mediaan was 25,3 dagen (IQR 0 tot 28,9) in de interventie groep, ten opzichte van 27,4 dagen (IQR 0 tot 29,2) in de controlegroep (standaard zorg). Dit betekent dat patiënten in de interventiegroep ongeveer 2 dagen korter aan de mechanische ventilatie liggen (95% BI van -14,98 tot 10,78). Het gerapporteerde verschil is klinisch relevant in het voordeel van de interventie.
In de RCT van Rosa (2019) werd het effect van flexibele bezoekuren in combinatie met een onderwijscomponent bestudeerd. Het aantal mechanische ventilatie vrije dagen in de eerste zeven opnamedagen werd beschreven. Indirect geeft dit informatie over de duur van mechanische ventilatie. Het gemiddeld aantal ventilatie vrije dagen in ernstig zieke patiënten met interventie is 5,9 dagen (SD 2,2), ten opzichte van 6,0 dagen (SD 2,1) in de controlegroep (standaard zorg). Het verschil tussen deze twee groepen bedraagt 0,1 dag. Het gerapporteerde verschil is niet klinisch relevant.
Bewijskracht van de literatuur
De verschillende interventies konden niet gepoold worden weergegeven. De bewijskracht voor de uitkomstmaat duur van mechanische ventilatie voor iedere afzonderlijke interventie is gebaseerd op een RCT en start daarom op hoog. Er is afgewaardeerd vanwege het ontbreken van blindering (risk of bias) en vanwege beperkingen in de extrapoleerbaarheid (indirectheid) omdat niet alleen patiënten met sepsis zijn geïncludeerd maar de algehele IC-populatie. Daarnaast is er afgewaardeerd vanwege een gering aantal patiënten/events (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Tabel 9.11 Overzicht van de resultaten van de verschillende interventies
|
Interventie |
Studie |
Uitkomstmaten |
|||||||
|
|
|
Incidentie delier |
Duur delier |
Mortaliteit |
IC-verblijfsduur |
Kwaliteit van leven |
Cognitieve functie |
Ernstige bijwerkingen |
Duur mechanische ventilatie |
|
Lichttherapie |
Bannon, 2019 (Ono, 2011; Potharajaroen, 2018; Simons, 2016; Taguchi, 2007) |
Klinisch relevant (RR 0,45; 95%BI 0,10 tot 2,13) |
Geen verschil |
Geen verschil |
Geen verschil |
- |
- |
- |
- |
|
Heroriëntatie d.m.v. spiegels |
Giraud, 2016 |
Geen verschil |
Klinisch relevant (1 dag korter; 95% BI van -2,02 tot 0,02) |
- |
- |
Geen verschil |
- |
- |
- |
|
Oordopjes |
Van Rompaey, 2012 |
Geen verschil |
- |
- |
- |
- |
- |
- |
- |
|
Mobilisatie |
Nydahl, 2019 |
- |
Geen verschil |
- |
Klinisch relevant (2 dagen korter) |
- |
- |
- |
- |
|
Fysiotherapie |
Karadas, 2016 |
Klinisch relevant (RR 0,40; 95% BI 0,10 tot 1,67) |
Geen verschil |
- |
- |
- |
- |
- |
- |
|
Multicomponent fysiotherapie |
Bannon, 2019 (Morris, 2016; Schweickert, 2009) |
- |
Geen verschil |
Klinisch relevant (RR 0,72; 95% BI 0,27 tot 1,92) |
- |
Geen verschil |
Geen verschil |
Geen verschil |
- |
|
Multicomponent ergotherapie |
Alvarez, 2017 |
Klinisch relevant (OR 0,15; 95% BI 0,02 tot 1,03) |
- |
- |
- |
- |
- |
- |
- |
|
Fysiotherapie en cognitieve therapie |
Brummel, 2014 |
- |
- |
Geen verschil |
Klinisch relevant (1,23 dagen korter; 95% BI -0,68 tot 3,14) |
- |
Geen verschil |
Geen verschil |
Klinisch relevant (2 dagen korter; 95% BI van -14,98 tot 10,78) |
|
Communicatie met familie |
Eghbali-Babadi, 2017 |
Klinisch relevant (RR 0,43; 95% BI 0,12 tot 1,52). |
- |
- |
- |
- |
- |
- |
- |
|
Communicatie met familie |
Munro, 2017 |
- |
Geen verschil |
- |
- |
- |
- |
- |
- |
|
Flexibele bezoekuren |
Rosa, 2019 |
Geen verschil |
- |
Geen verschil |
Geen verschil |
- |
- |
- |
Geen verschil |
|
Multicomponent |
Finotto, 2006 |
Geen verschil |
- |
- |
- |
- |
- |
- |
- |
|
Multicomponent |
Moon, 2015 |
Klinisch relevant (RR 0,60; 95% BI 0,32 tot 1,11) |
- |
Klinisch relevant (RR 0,38; 95% BI 0,13 tot 1,13) |
Geen verschil |
- |
- |
- |
- |
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Deelvraag 1: Preventieve maatregelen
P: volwassenen patiënten met sepsis;
I: niet-medicamenteuze preventieve maatregelen om delier te voorkomen;
C: standaard zorg, placebo;
O: Incidentie van delier, ernstige bijwerkingen.
Deelvraag 2: Behandeling
P: volwassenen patiënten met sepsis;
I: niet-medicamenteuze behandeling van delier;
C: standaard zorg, placebo;
O: duur van delier, mortaliteit, intensive-careverblijfsduur, ziekenhuisverblijfsduur, kwaliteit van leven, cognitieve functie, ernstige bijwerkingen, duur van mechanische ventilatie.
Relevante uitkomstmaten
Voor preventieve maatregelen achtte de werkgroep incidentie van delier en ernstige bijwerkingen voor de besluitvorming cruciale uitkomstmaten. Voor actieve behandeling achtte de werkgroep duur van delier en mortaliteit voor de besluitvorming cruciale uitkomstmaten; en intensive-careverblijfsduur, ziekenhuisverblijfsduur, kwaliteit van leven, cognitieve functie, ernstige bijwerkingen en duur van ventilatie voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde de grens van 3% als een klinisch (patiënt) relevant verschil voor mortaliteit (gebaseerd op de SDD-trial van de Smet, 2009). Voor de overige dichotome uitkomstmaten werd de GRADE standaardgrens van 25% als een klinisch (patiënt) relevant verschil aangehouden. Voor verblijfsduur op de intensive care (IC), duur van delier en duur van mechanische ventilatie werd 1 dag als klinisch relevant verschil gedefinieerd, voor ziekhuisverblijfsduur 2 dagen. Voor de overige continue uitkomstmaten werd een verschil van 10% als klinisch relevant gedefinieerd, voor bijwerkingen een verschil van 5%.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 7 augustus 2019 met relevante zoektermen gezocht naar relevante Engelstalige literatuur over niet-medicamenteuze behandeling ter preventie en behandeling van delier bij patiënten met sepsis en septische shock, gepubliceerd vanaf 1990. Omdat er nauwelijks literatuur beschikbaar is over delier bij sepsis en een groot deel van de patiënten met sepsis wordt opgenomen en behandeld op een IC heeft de werkgroep ervoor gekozen de literatuuranalyse uit te breiden naar ernstig zieke patiënten op de IC. De interventie sedatie interruptie is in deze module achterwege gelaten omdat dit wordt uitgewerkt in de module Optimale sedatiemethode [MR1] in deze richtlijn. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 298 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: vergelijkend (gerandomiseerd) onderzoek of systematic reviews (SR’s) waarin de vergelijking wordt gemaakt tussen het wel of niet toepassen van een niet-medicamenteuze preventieve maatregel of actieve behandeling van delier bij volwassen patiënten opgenomen op de intensive care én waarin de uitkomstmaten incidentie of duur van delier, ernstige bijwerkingen, mortaliteit, IC-/ziekenhuisverblijfsduur, kwaliteit van leven, cognitieve functie of duur van mechanische ventilatie worden beschreven. Op basis van titel en abstract werden in eerste instantie 11 SR’s en 13 RCT’s voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 19 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vijf studies definitief geselecteerd.
Resultaten
In totaal zijn vijf studies opgenomen in de literatuuranalyse, waarvan twee SR’s en drie RCT’s. Voor de cruciale uitkomstmaten zijn de originele studies geraadpleegd ter aanvulling op de informatie uit de SR’s. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
[MR1]Link naar submodule sedatietoediening
Referenties
- Bannon L, McGaughey J, Verghis R, Clarke M, McAuley DF, Blackwood B. The effectiveness of non-pharmacological interventions in reducing the incidence and duration of delirium in critically ill patients: a systematic review and meta-analysis. Intensive Care Med. 2019 Jan;45(1):1-12. doi: 10.1007/s00134-018-5452-x. Epub 2018 Nov 30. PMID: 30506354.
- de Smet AM, Kluytmans JA, Cooper BS, et al. Decontamination of the digestive tract and oropharynx in ICU patients. N Engl J Med. 2009;360(1):20‐31. doi:10.1056/NEJMoa0800394.
- Eghbali-Babadi M, Shokrollahi N, Mehrabi T. Effect of Family-Patient Communication on the Incidence of Delirium in Hospitalized Patients in Cardiovascular Surgery ICU. Iran J Nurs Midwifery Res. 2017 Jul-Aug;22(4):327-331. doi: 10.4103/1735-9066.212985. PMID: 28904548; PMCID: PMC5590365.
- Herling SF, Greve IE, Vasilevskis EE, Egerod I, Bekker Mortensen C, Møller AM, Svenningsen H, Thomsen T. Interventions for preventing intensive care unit delirium in adults. Cochrane Database Syst Rev. 2018 Nov 23;11(11):CD009783. doi: 10.1002/14651858.CD009783.pub2. PMID: 30484283; PMCID: PMC6373634.
- Inouye SK, Bogardus ST Jr, Charpentier PA, et al. A multicomponent intervention to prevent delirium in hospitalized older patients. N Engl J Med. 1999;340(9):669‐676. doi:10.1056/NEJM199903043400901.
- Nydahl P, Günther U, Diers A, Hesse S, Kerschensteiner C, Klarmann S, Borzikowsky C, Köpke S. PROtocol-based MObilizaTION on intensive care units: stepped-wedge, cluster-randomized pilot study (Pro-Motion). Nurs Crit Care. 2020 Nov;25(6):368-375. doi: 10.1111/nicc.12438. Epub 2019 May 24. PMID: 31125163.
- Rood, P. Non-pharmacological prevention and treatment of delirium in the ICU. Proefschrift Radboudumc, 1 december 2020.
- Rosa RG, Falavigna M, da Silva DB, Sganzerla D, Santos MMS, Kochhann R, de Moura RM, Eugênio CS, Haack TDSR, Barbosa MG, Robinson CC, Schneider D, de Oliveira DM, Jeffman RW, Cavalcanti AB, Machado FR, Azevedo LCP, Salluh JIF, Pellegrini JAS, Moraes RB, Foernges RB, Torelly AP, Ayres LO, Duarte PAD, Lovato WJ, Sampaio PHS, de Oliveira Júnior LC, Paranhos JLDR, Dantas ADS, de Brito PIPGG, Paulo EAP, Gallindo MAC, Pilau J, Valentim HM, Meira Teles JM, Nobre V, Birriel DC, Corrêa E Castro L, Specht AM, Medeiros GS, Tonietto TF, Mesquita EC, da Silva NB, Korte JE, Hammes LS, Giannini A, Bozza FA, Teixeira C; ICU Visits Study Group Investigators and the Brazilian Research in Intensive Care Network (BRICNet). Effect of Flexible Family Visitation on Delirium Among Patients in the Intensive Care Unit: The ICU Visits Randomized Clinical Trial. JAMA. 2019 Jul 16;322(3):216-228. doi: 10.1001/jama.2019.8766. PMID: 31310297; PMCID: PMC6635909.
- Salluh JI, Wang H, Schneider EB, et al. Outcome of delirium in critically ill patients: systematic review and meta-analysis. BMJ. 2015;350:h2538. Published 2015 Jun 3. doi:10.1136/bmj.h2538.
- Wassenaar A, Rood P, Schoonhoven L, Teerenstra S, Zegers M, Pickkers P, van den Boogaard M. The impact of nUrsiNg DEliRium Preventive INnterventions in the Intensive Care Unit (UNDERPIN-ICU): A study protocol for a multi-centre, stepped wedge randomized controlled trial. Int J Nurs Stud. 2017 Mar;68:1-8. doi: 10.1016/j.ijnurstu.2016.11.018. Epub 2016 Dec 8. PMID: 28013104.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de optimale niet-medicamenteuze preventieve- en actieve behandeling van delier?
APACHE: Acute Physiological And Chronic Health Evaluation; BELA: Basic everyday life activities; BLT: Bright Light Therapy; CAM-ICU: Confusion Assessment Method for the ICU; ET: Endotracheal tube; GCS: Glasgow Coma Scale; HRQoL: Health related quality of life; ICP: Intracranial pressure; ICU: Intensive Care Unit; ITT, Intention to Treat; MMSE: Mini-Mental State Examination, MV; Mechanical Ventilation; RASS: Richmond Agitation and Sedation Scale; ROM: Range of Movement; SD: Standard deviation; TBI: Traumatic brain injury
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Rosa, 2019 |
Type of study: RCT
Setting and country: Cluster cross-over RCT involving family members, and clinicians from 36 adult ICUs with restricted visiting hours (<4,5 uur) in Brazilië.
Funding and conflicts of interest: This study was funded by the Brazilian Ministry of Health through the Brazilian Unified Health System Institutional Development Program (PROADI-SUS). |
Inclusion criteria: The trial enrolled medical-surgical adult ICUs with 6 or more beds and restricted visiting hours (<4.5 hours per day) at public and private non-profit hospitals in Brazil. ICUs not meeting the minimum structural or organizational requirements for the operation of ICUs in Brazil were excluded. Patients 18 years or older admitted to participating ICUs were consecutively included.
Exclusion criteria: The exclusion criteria were coma (Richmond Agitation-Sedation Scale19 score ≤−4) lasting longer than 96 hours from initial screening assessment or presence of any of the following characteristics at screening assessment: delirium (positive Confusion Assessment Method for the ICU (CAM-ICU) screening),20 brain death, exclusive palliative care, inability to communicate, predicted ICU length of stay less than 48 hours, unlikely to survive longer than 24 hours, prisoner status unavailability of a family member to participate in ICU visits, and previous enrol-ment in the study.
N total at baseline: Intervention: 837 Control:848
Important prognostic factors2: age ± SD: I: 58.4 (18.3) C: 58.6 (18.2)
Sex: I: 53.5% M C: 52.1% M
Groups comparable at baseline? Yes, baseline characteristics of participants were well balanced. |
Describe intervention (treatment/procedure/test):
Flexible visitation
The flexible visitation model included both flexibility of ICU visiting hours and family education. One or 2 close family members were allowed to visit the patient for up to 12 hours per day.
Only 1 relative was enrolled in the study. These family members had to attend at least 1 structured meeting in which they received education about the ICU environment, common procedures, multidisciplinary work, infection control, palliative care, and delirium. These structured meetings were conducted by trained clinicians using a face to- face format at least 3 times per week. Additionally, family members had access to an information brochure and website designed to help them understand the various processes and emotions associated with an ICU stay and improve cooperation without increasing ICU staff workload. Patients were also allowed to receive social visits at specific time intervals according to local rules. Social visits were offered to friends or family members who did not qualify for flexible visitation.
|
Describe control (treatment/procedure/test):
Restricted visitation
In the restricted visitation model, visitors were allowed as before randomization, according to local hours (median, 1.5 hours/d (interquartile range {IQR}, 1.0 to 2.0); up to 4.5 hours/d). Visitors were not required to attend educational meetings. |
Length of follow-up: Until hospital discharge or death, or for a maximum of 30 days.
Loss-to-follow-up: All patients that were randomized completed the trial.
Incomplete outcome data: Intervention: 6/837 (0.72%) Control: 3/848 (0.35%). For delirium
In both groups, the % of incomplete outcome data is low. Reasons for incomplete outcome data are not reported.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Incidence of delirium: Intervention: 157/831 (18.9%) Control: 170/845 (20.1) RR: 0.91 (0.73-1.15).
ICU length of stay Intervention (N=837): Median (IQR): 5.0 (3.0 – 8.0) Control (N=848): Median (IQR): 5.0 (3.0 – 8.0)
Ventilator free days Intervention (N=837): Mean (SD): 5.9 (2.2) Control (N=848): Mean (SD): 6.0 (2.1)
Hospital mortality Intervention: 124/837 (14.8) Control: 121/840 (14.4) RR 1.01; 95% CI 0.77 – 1.32
|
|
|
Nydall, 2019 |
Type of study: Pilot RCT
Setting and country: Stepped-wedge-cluster RCT, Germany
Funding and conflicts of interest: Not reported. |
Inclusion criteria: For ICU: adult patients, no protocol for early mobilization present, and a nurse-patient ratio of at least 1:3 in more than 80% of the shifts.
Patients: 18 years or older, order for mobilization present.
Exclusion criteria: For ICU: non-acute care settings were excluded.
Patients: palliative state, not previously consented to their data being used for research, had already been included in a previous state, immobility order or if mobilization was not documented.
N total at baseline: Intervention: 120 Control: 152
Important prognostic factors2: For example age ± SD: I: 74 (61-81) C:70 (58-79)
Sex: I:54.1 % M C: 52.3 % M
Groups comparable at baseline? Patients’ Characteristics differed between individual ICUs (Table S2) but were generally comparable for intervention and control periods. |
Describe intervention (treatment/procedure/test):
Mobilization protocol.
|
Describe control (treatment/procedure/test):
Usual care. |
Length of follow-up: Follow-up for 28 days after ICU admission or until discharge from ICU.
Loss-to-follow-up: Intervention: 2 N (%) Reasons (describe) – no primary outcome reported.
Control: 0 N (%) Reasons (describe)
Incomplete outcome data: Data was complete for all patients with successful follow-up.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Adverse events 15/152 control 5/120 intervention In table S4, the complete list of adverse events is reported.
Hospital free days during 28 day follow-up period Control: 5 (0-10) Intervention: 0 (0-11)
ICU free days during 28 day follow-up period Control: 21 (9-25) Intervention: 19 (5.5-24)
Mechanically ventilated free days 28 (20-28) control 26 (13-28) intervention
Delirium free days 28 (26-28) control 28 (24.7-28) interventie |
|
|
Eghbali-Babadi, 2017 |
Type of study: RCT
Setting and country: Cardiac surgery of ICU, Iran
Funding and conflicts of interest: The Isfahan University of Medical Sciences funded the study. There are no conflicts of interest reported. |
Inclusion criteria: Patients who underwent open heart surgery in the ICU. Inclusion criteria were 18-70 years, availability of immediate family members, no history of addiction to drugs, alcohol, and cigarette smoking, no delirium, conscious level disorder and mental diseases before surgery, no history of blindness and deafness, elective open heart surgery, no family history for surgery, and no intubation with a tracheal tube.
Exclusion criteria: In cases of patients’ or their familys’ reluctance to continue participation, death or postsurgery complications, the patients were excluded from the study.
N total at baseline: Intervention: 34 Control: 34
Important prognostic factors2: For example age ± SD: I: 55,11 (12.11) C: 54.12 (13.11)
Sex I: 58,82% male C: 70.58% male
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
The day after the surgery, one of the family members in the intervention group who had received education on the day before was allowed to visit the patient in the morning shift.
|
Describe control (treatment/procedure/test):
Routine care |
Length of follow-up: Patients were assessed for delirium twice a day for a total of three times, two times in the morning and one time in the evening, using the CAM-ICU scale.
Loss-to-follow-up: None
Incomplete outcome data: None
|
Outcome measures and effect size (include 95%CI and p-value if available):
Incidence delirium Intervention: 4 (11,76%) Control: 8 (23.53%) First time (next morning after surgery 10 AM)
Incidence delirium Intervention: 4 (11,76%) Control: 11 (32.35%) Second time (next evening after surgery 17 PM).
Intervention: 3 (8.83%) Control: 7 (26.58%) Third time (two days after surgery 10 AM)
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures .
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Herling, 2018 |
No, pharmacological interventions were included as well. |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Bannon, 2019 |
Yes |
Yes |
Yes (Supplemental material) |
Yes |
Not applicable |
Yes, a risk of bias table for the included studies (See below). |
All studies included adult patients, paediatric trials were not identified.
All studies included different IC populations. |
Unclear, not reported. |
Unclear, only reported for the SR itself. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
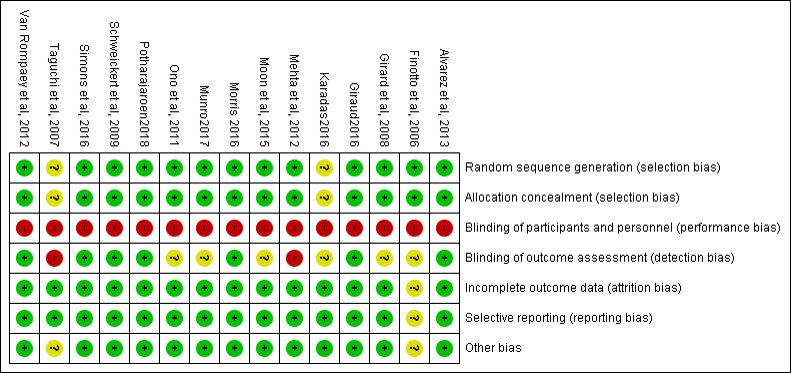
Source: Bannon (2009)
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat is de optimale niet-medicamenteuze preventieve- en actieve behandeling van delier?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Rosa, 2019 |
The ICUs were consecutively randomized in a 1:1 ratio using computer-generated randomization with random block sizes of 2, 4, and 6 and stratified by number of ICU beds (≤10 or >10).
|
Unlikely, performed by a statistician blinded to the cluster. |
Likely, participants were not blinded.
|
Likely, the care provides were not blinded. |
Likely, the outcome assessors were not blinded to study interventions. |
Unlikely, the outcomes reported in the study protocol were all included in the RCT. |
Unclear, the number of participants lost to follow-up are similar, but the reasons are not reported.
Some imbalance in number and causes of participant exclusion and follow-up losses might have resulted in bias due to loss to follow-up because of possible recruitment bias. |
Unlikely, the participants in the analysis are exactly those who were randomized into the trial. |
|
Nydahl, 2019 |
Randomization was performed by an independent researcher using http://www .randomizer.org. |
Unlikely, performed by an independent researcher. |
Likely, participants were not blinded. |
Likely, the care provides were not blinded. |
Likely, the outcome assessors were not blinded to study interventions. |
Unlikely, the outcomes reported in the study protocol were all included in the RCT. |
Unlikely, the percentage loss to follow-up is very low in both groups. |
Unlikely, all patients allocated to the groups were analysed. |
|
Eghbali-Babadi, 2017 |
Patients were allocated to two groups based on random numbers table. |
Unlikely, allocation via random numbers table. |
Likely, participants were not blinded. |
Likely, care providers were not blinded. |
Unlikely, the outcome assessors were blinded. |
Unlikely, the methods section mentions incidence of delirium and this is the only outcome measure reported. |
Unlikely, all patients allocated to the groups had a complete follow-up. |
Unlikely, all patients allocated to the groups were analysed. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Al-Quadheeb, 2014 |
Geen aanvullende studies ten opzichte van Bannon 2019 |
|
Collinsworth, 2016 |
Geen aanvullende studies ten opzichte van Bannon 2019 |
|
Garcia Guerra, 2019 |
Geen aanvullende studies ten opzichte van Bannon 2019 |
|
Garry, 2016 |
Voldoet niet aan de PICO – geen control groep met usual care |
|
Giraud, 2016 |
Geïncludeerd in de SR van Bannon 2019. |
|
Hipp, 2012 |
Geen systematic review |
|
Hu, 2015 |
Voldoet niet aan PICO – primaire uitkomstmaat is slaapverbetering |
|
Hunter, 2014 |
Geen aanvullende studies ten opzichte van Bannon 2019 |
|
Kang, 2018 |
Geen aanvullende studies ten opzichte van Bannon 2019 |
|
Karadas, 2016 |
Geïncludeerd in de SR van Bannon 2019. |
|
Litton, 2016 |
Geen aanvullende studies ten opzichte van Bannon 2019 |
|
Mehta, 2012 |
Geïncludeerd in de SR van Bannon 2019. |
|
Munro, 2017 |
Geïncludeerd in de SR van Bannon 2019. |
|
Oldham, 2016 |
Geen systematic review |
|
Potharajaroen, 2018 |
Geïncludeerd in de SR van Bannon 2019. |
|
Schweickert, 2009 |
Geïncludeerd in de SR van Bannon 2019. |
|
Simons, 2016 |
Geïncludeerd in de SR van Bannon 2019. |
|
Trogrlia, 2015 |
Voldoet niet aan PICO – gaat specifiek over de implementatie |
|
Van Rompaey, 2012 |
Geïncludeerd in de SR van Bannon 2019. |
|
Winkelman, 2018 |
Voldoet niet aan de PICO – verkeerde uitkomstmaat |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-11-2022
Beoordeeld op geldigheid : 01-09-2022
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2017 een multidisciplinaire werkgroep ingesteld voor sepsis fase 1, de samenstelling van de werkgroep is gewijzigd in 2019 voor de ontwikkeling van sepsis fase II en III, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met sepsis in het ziekenhuis.
Werkgroep
- Prof. Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. C.H.S.B. van den Berg, intensivist-infectioloog, UMC Groningen, NVIC
- D. Bolman, patiëntvertegenwoordiger, IC Connect en FCIC
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis, te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-VS
- Dr. C.S.C. Bouman, internist-intensivist, Amsterdam UMC, locatie AMC, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht, NVIC
- Drs. M. Hoogendoorn, manager Vakgroep Anesthesiologie & Intensive Care, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, universitair hoofddocent Sector Verplegingswetenschap afdeling Interne Geneeskunde en universitair hoofddocent Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Dr. H. P. Krepel, nefroloog, Bravis ziekenhuis te Roosendaal en Bergen op Zoom, NIV
- Dr. M.C.G. van de Poll, chirurg-intensivist, Maastricht UMC, NVIC
- Dr. B. P.C. Ramakers, internist-intensivist, RadboudUMC te Nijmegen, NVIC
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. J. Sommers, fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC, KNGF
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede Medisch Directeur, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald: Voorzitter Sectie lC NIV Lid Concilium Interne Geneeskunde Lid GIC Lid platform kwaliteit NIV Lid ESPEN richtlijn commissie Voeding volwassen lC patiënten Lid diverse congrescommissies (Nationale Voedingscongres, internationaal Sepsis Symposium Netherlands, Mythen Missers en Maatwerk infectieuze bedreigingen, MasterclasslC Schiermonnikoog)
Betaald: Spreker voor voedingsfirma's (niet sepsis gerelateerd): Danone-Nutricia, Abbott, BBraun, Baxter, Fresenius-Kabi, Lyric,Mermaid, Nestle-Novartis.
initiator Masterclass Voeding en lC |
Participatie als onderzoeker in lC sepsis trials (b.v. KPA-ART 123 trombomoduline & adrenomedulline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau interactie dat voor vele wetenschappelijke verenigingen congressen organiseert (onder andere sepsis congres).
|
Belangen zijn besproken, voorzitterschap is akkoord |
|
C. van den Berg |
intensivist-infectioloog, UMC Groningen |
Geen |
Geen |
Geen restricties |
|
D. Bolman |
vertegenwoordiger FCIC en IC Connect, ervaringsdeskundige |
vrijwilliger FCIC en IC Connect (onbetaald) vrijwilliger Nederlandse adoptievoorziening (onbetaald) |
Geen |
Geen restricties |
|
V. Bon |
Verpleegkundig Specialist SEH OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Ik heb meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://clinicaltrials.gov/ct2/show/NCT01988428). |
Geen restricties |
|
C. Bouman |
Internist-intensivist Care Volwassenen Amsterdam UMC locatie AMC |
Geen |
Geen |
Geen restricties |
|
L. Derde |
Intensivist UMC Utrecht (0,8 fte) Co-lead WP5 PREPARE (0,2 fte) |
EU coordinating investigator, voorzitter EU Regionale Management Commissie en lid Internationale Trial Stuur Commissie REMAP-CAP, onder andere gefinancierd via PREPARE (FP7) en RECOVER (H2020) grants
Lid NVVM influenza richtlijn
Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia)
Voorzitter van de Clinical Training Committee (CTC) van ESICM.
Lid SSC/ESICM/SCCM COVID-19 guideline committee
Voorzitter NVIC taskforce COVID-19 |
Betrokken bij onderzoek dat door EU wordt gefinancierd:
1. EU coordinating investigator REMAP-CAP: doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Diverse medicamenten (tocilizumab, sarilumab, interferon, lopinavir/ritonavir, anakinra) zijn (deels) door de fabrikanten geleverd voor de studie. In de Verenigde Staten wordt één van de domeinen (eritoran, apremilast) ondersteund door de fabrikanten (Eisai, Amgen). De funders, sponsors en fabrikanten hadden geen rol in de opzet van de studie, de analyses, publicaties, of beslissingen die in de trial zijn genomen. |
Geen restricties |
|
M. Hoogendoorn |
Vakgroep manager Anesthesiologie & Intensive Care, Isala, Zwolle |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen restricties |
|
E. Ista |
Universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
Universitair Hoofddocent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijnen V&VN, Utrecht (onbetaald) tot 2018
Lid CCMO, discipline verplegingswetenschap (betaald) |
Geen |
Geen restricties |
|
R. Jansen |
Klinisch geriater, Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amstelacademie voor verschillende verpleegkundigen opleidingen (betaald).
Onbetaald medeorganisator ouderengeneeskunde congres Maastricht 2.0 in 2018, en 2019.
Onbetaald medeorganisator van nieuw congres Cardiovasculaire aandoeningen bij ouderen (CarVascGer) 2020 te Utrecht. |
Honoraria van Bayer Nederland, Boehringer-Ingelheim, Daiichi-Sankyo en BMS-Pfizer voor houden lezingen, webTV, et cetera over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen restricties |
|
H. Krepel |
Nefroloog, Bravis Ziekenhuis Roosendaal/Bergen op Zoom |
Geen |
Domestico studie (thuisdialyse) |
Geen actie |
|
M. van de Poll |
Intensivist MUMC+ |
Lid van richtlijncommissie NVIC Voeding |
Investigator-initiated grants van Fresenius Kabi en Nutricia, ZON-MW, KCE |
Restricties ten aanzien van het opstellen van aanbevelingen over voeding. |
|
B. Ramakers |
Intensivist in het Radboudumc |
Voorzitter stichting Venticare (kennisplatform voor medewerkers in de acute zorg): onbetaald |
Geen |
Geen restricties |
|
M. de Regt |
Internist Acute Geneeskunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam |
Geen |
Geen |
Geen restricties |
|
S. Sankatsing |
Internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van lnternist-lnfectiologen (NVll), onbetaald
Lid Commissie Richtlijnen Nederlandse lnternisten Vereniging (NlV), waarvoor vacatiegelden
Lid Expertise team behandeling Covid-19 van de Federatie Medisch Specialisten (FMS), onbetaald |
Geen |
Geen restricties |
|
R. Schellaars |
Intensivist, Ziekenhuis Gelderse Vallei, Ede |
Voormalig bestuurslid SIC-NVA |
Geen |
Geen restricties |
|
R. Wilting |
Chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen restricties |
|
J. Sommers |
Fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC |
Cursuscoördinator en docent NPI, scholing IC fysiotherapie (betaald) |
Geen |
Geen restricties |
|
M. Ruiter |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
R. Zwarts - van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
F. Willeboordse |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afvaardiging van een patiëntvertegenwoordiger in de werkgroepen. Het verslag van de focusgroep (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sepsis. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Patient Centered Intensive Care en IC Connect, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen en Dutch Acute Medicine via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij fase II/III van de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Vasopressoren |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Inotropica |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: modaliteit |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: timing |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: dosering |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: antistolling |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatiemiddel |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatie: continu vs. interruptie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Niet-medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Transfusiebeleid |
n.v.t. |
Verwijzing naar bestaande module. |
|
Mobilisatie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Voorlichting langetermijngevolgen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Randvoorwaarden |
geen substantiële financiële gevolgen |
In deze module wordt vooral verwezen naar andere relevante documenten verwezen. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbo.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1989 – augustus 2019
|
1 exp *SEPSIS/ or exp *Intensive Care Units/ or exp *Critical Illness/ or (Sepsis or sepses or septic* or icu* or intensive care or critical care or critically ill* or critical ill*).ti. (185863) 2 (exp Delirium/ or (deliri* or (acute adj2 (confusion$ or 'brain syndrome' or 'brain failure' or 'psycho-organic syndrome' or 'organic psychosyndrome')) or (terminal$ adj restless$) or (toxic adj confus$)).ti,ab,kw.) not (*psychoses, alcoholic/ or *alcohol withdrawal delirium/ or *substance withdrawal syndrome/) (15771) 3 exp Noise/ or exp Exercise Therapy/ or exp Physical Therapy Modalities/ or exp Occupational Therapy/ or exp Lightning/ or exp Orientation/ or exp Cognitive Behavioral Therapy/ or exp Phototherapy/ or exp Music Therapy/ or exp Exercise/ or exp Education/ or exp Mindfulness/ or earplug*.ti,ab,kw. or noise.ti,ab,kw. or eye mask*.ti,ab,kw. or visual.ti,ab,kw. or orient*.ti,ab,kw. or auditory.ti,ab,kw. or spatial.ti,ab,kw. or echolocation.ti,ab,kw. or light*.ti,ab,kw. or phototherap*.ti,ab,kw. or heliotherap*.ti,ab,kw. or music.ti,ab,kw. or physiotherapy.ti,ab,kw. or exercise.ti,ab,kw. or education*.ti,ab,kw. or training.ti,ab,kw. or ergotherapy.ti,ab,kw. or mobilization.ti,ab,kw. or mobilisation.ti,ab,kw. or non-pharmacological.ti,ab,kw. or non-medical.ti,ab,kw. or mindful*.ti,ab,kw. or multi-component.ti,ab,kw. or ((color or physical or cognitive or occupational) adj3 therap*).ti,ab,kw. (3366672) 4 1 and 2 and 3 (459) 5 limit 4 to (english language and yr="1989 -Current") (421) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (407656) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1886441) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3241192) 9 5 and 6 (38) 10 (5 and 7) not 9 (88) 11 (5 and 8) not 9 not 10 (91) 12 9 or 10 or 11 (217)
= 217 |
298 |
|
Embase (Elsevier) |
('sepsis'/exp/mj OR 'intensive care unit'/exp/mj OR 'critically ill patient'/exp/mj OR sepsis:ti OR sepses:ti OR septic*:ti OR icu*:ti OR 'intensive care':ti OR 'critical care':ti OR 'critically ill*':ti OR 'critical ill*':ti) AND (('delirium'/exp OR ((acute NEAR/2 (confusion* OR 'brain syndrome' OR 'brain failure' OR 'psycho-organic syndrome' OR 'organic psychosyndrome')):ab,ti) OR deliri*:ab,ti OR ((toxic NEAR/1 confus*):ab,ti) OR ((terminal* NEAR/1 restless*):ab,ti)) NOT ('alcohol psychosis'/exp/mj OR 'delirium tremens'/exp/mj OR 'withdrawal syndrome'/exp/mj)) AND ('noise'/exp OR 'eye mask'/exp OR 'physiotherapy'/exp OR 'occupational therapy'/exp OR 'lightning'/exp OR 'orientation'/exp OR 'cognitive therapy'/exp OR 'phototherapy'/exp OR 'music therapy'/exp OR 'exercise'/exp OR 'education'/exp OR 'mobilization'/exp OR 'mindfulness'/exp OR earplug*:ti,ab OR noise:ti,ab OR 'eye mask*':ti,ab OR visual:ti,ab OR orient*:ti,ab OR auditory:ti,ab OR spatial:ti,ab OR echolocation:ti,ab OR light*:ti,ab OR phototherap*:ti,ab OR heliotherap*:ti,ab OR music:ti,ab OR physiotherapy:ti,ab OR exercise:ti,ab OR education*:ti,ab OR training:ti,ab OR ergotherapy:ti,ab OR mobilization:ti,ab OR mobilisation:ti,ab OR 'non-pharmacological':ti,ab OR 'non-medical':ti,ab OR mindful*:ti,ab OR 'multi-component':ti,ab OR (((color OR physical OR cognitive OR occupational) NEAR/3 therap*):ti,ab)) AND (english)/lim AND (1989-2019)/py NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 37
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 140
Observationeel onderzoek: ‘major clinical study’/exp OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 54
= 231 |
