Medicamenteuze behandeling van delier
Uitgangsvraag
Wat is de optimale medicamenteuze preventieve en actieve behandeling van delier bij patiënten met sepsis?
De uitgangsvraag omvat de volgende deelvragen:
1a. Wat is de beste medicamenteuze behandeling om een delier te voorkomen bij patiënten met sepsis?
1b. Wat is de beste medicamenteuze behandeling van een delier bij patiënten opgenomen met sepsis?
Aanbeveling
Start niet met een antipsychoticum (zoals haloperidol, risperidone, quetiapine of ziprasidone) of met een cholinesterase remmer (zoals rivastigmine) om de duur van een delier te verkorten bij patiënten met sepsis op een IC.
Overweeg in geval van ernstige onrust het kortdurend gebruik van dexmedetomidine en/of een antipsychoticum, en in geval van psychotische verschijnselen (hallucinaties) een antipsychoticum.
Behandel patiënten met sepsis met een delier buiten de IC volgens de richtlijn delier bij volwassenen en ouderen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er was onvoldoende literatuur beschikbaar over delier bij volwassen patiënten met sepsis. De wetenschappelijke onderbouwing werd daarom gebaseerd op delier bij ernstig zieke IC-patiënten. Ook in deze categorie was het aantal geïncludeerde patiënten beperkt. Voor de hele populatie was geen onderscheid naar leeftijd te maken. Het blijft op basis van de literatuur onduidelijk hoe delier het beste kan worden voorkomen en behandeld bij patiënten met sepsis. Hier ligt een kennislacune.
Voor een delier bij oudere patiënten (> 75 jaar en ouder) of een delier bij patiënten met een dementie opgenomen in het ziekenhuis verwijzen wij naar de herziene richtlijn delier bij volwassenen en ouderen. Ook al worden vooral oudere patiënten getroffen door een delier, er is in het meeste onderzoek geen onderscheid in leeftijd gemaakt, zodat alle volwassen zijn geïncludeerd. Naar de mening van de werkgroep zijn de aanbevelingen en aandachtspunten grotendeels leeftijdsonafhankelijk.
Dat in een richtlijn over sepsis specifiek het delier bij sepsis of in dit hoofdstuk verbreed tot IC-patiënten wordt onderzocht is mede gebaseerd op IC-specifieke middelen zoals dexmedetomidine en clonidine.
Aangezien er veel literatuur is over sedativa zoals dexmedetomidine op de IC, wordt dit in deze richtlijn besproken. Voor het delier bij niet-IC-patiënten wordt daarom verwezen naar de herziene richtlijn delier bij volwassenen. Voor delier bij patiënten op de IC wordt verwezen naar de richtlijn Delier op de intensive care (in ontwikkeling/herziening). Opgemerkt moet worden dat patiënten op een medium-care die niet geïntubeerd of beademend zijn in strikte zin niet voldoen aan IC-criteria waarvoor beide richtlijnen deels van toepassing kunnen zijn.
Voor haloperidol werd geen bewijs gevonden dat het profylactisch gebruik bij IC-patiënten de incidentie van delier kan verminderen ten opzichte van placebo. Dexmedetomidine kan waarschijnlijk wel de incidentie van delier verminderen met bijna 50% ten opzichte van placebo, dit is een klinisch relevant verschil. Dexmedetomidine vermindert mogelijk ook de incidentie ten opzichte van andere sedatiemiddelen met 35 tot 50%, zoals midazolam en propofol, en opioïden bij op de intensive care. Dit verschil is mogelijk niet klinisch relevant voor midazolam en opioïden, maar wel voor propofol. Dit voordeel van dexmedetomidine geldt niet voor de combinatie van midazolam en propofol. Alle studies zijn uitgevoerd in IC-patiënten, er is niet vermeld in de systematische reviews hoeveel patiënten hiervan patiënten met sepsis waren. In de bewijskracht is daarom ook afgewaardeerd voor deze indirecte vergelijking, dit betekent dat de conclusies wat meer onzekerheid bevatten. In een recente gepubliceerde multicenter, dubbelblind gerandomiseerde studie, verschenen na het uitvoeren van de literatuuranalyse, werd geen verschil gevonden tussen dexmedetomidine en propofol in het aantal dagen zonder delier of coma (10.7 versus 10.8 dagen; odds ratio 0,96; 95% betrouwbaarheidsinterval van 0,74 tot 1,26; 422 patiënten) bij patiënten met sepsis op een IC (Hughes, 2021).
Een probleem voor de interpretatie van de beschikbare literatuur is dat dexmedetomidine grotendeels gebruikt werd als anxiolyticum bij patiënten met agitatie en hallucinaties, vergelijkbaar met de dagelijkse praktijk, en niet als sedativum. In de meta-analyse van Flükiger (2018) waren studies geïncludeerd van patiënten met mechanische ventilatie en nachtelijke sedatie. De genoemde sedatiemiddelen werden dus niet altijd gebruikt voor delier preventie. Het is de vraag of deze resultaten impliceren dat alle patiënten op de IC preventief gesedeerd moeten worden om een delier te voorkomen. De werkgroep is van mening dat genoemde sedativa niet standaard gebruikt moeten worden om een delier te voorkomen, maar dat als er een indicatie is voor het gebruik van sedativa op de IC, dexmedetomidine de voorkeur heeft om een delier te voorkomen.
Om de duur van een delier te verkorten of de mortaliteit te verminderen hadden verschillende antipsychotica en rivastigmine geen effect in een meta-analyse op de duur van een delier. Voor het verminderen van onrust, psychotische verschijnselen zoals hallucinaties en/of wanen en angst bij de patiënt kunnen antipsychotica kortdurend gebruikt worden. De richtlijn delier bij volwassenen en ouderen adviseert bij deze verschijnselen om behandeling met antipsychotica te starten wanneer de patiënt een hoge lijdensdruk heeft en/of een gevaar is voor zichzelf of een ander en/of zijn behandeling in de weg staat (door bijvoorbeeld het uittrekken van infusen/lijnen). Dit advies kan ook op een IC worden gevolgd. In een kleine studie met clonidine werd wel een effect gevonden in de duur van een delier ten opzichte van placebo, maar dit was een studie met slechts 15 patiënten per groep. Er zijn dus onvoldoende aanwijzingen dat clonidine effectief is bij sepsis patiënten. Bij de behandeling van een delier is geen bewijs gevonden dat dexmedetomidine of andere sedativa de duur van een delier kon verkorten.
Er is geen direct bewijs gevonden dat behandeling met haloperidol of dexmedetomidine de verblijfsduur op een IC kan verkorten. Voor effecten van haloperidol, andere antipsychotica, dexmedetomidine of andere sedativa op cognitieve stoornissen, de duur van de mechanische ventilatie of kwaliteit van leven is geen informatie gevonden bij sepsis- of IC-patiënten in de bestuurde literatuur.
Ten aanzien van bijwerkingen, geeft dexmedetomidine met name bradycardie als bijwerking en daarnaast ademhalingsdepressie en hypotensie, propofol geeft hemodynamische consequenties en midazolam geeft bijwerkingen die bij benzodiazepines passen (afhankelijkheid, meer kans op delier en ademhalingsdepressie).
In de studies is vaak gestart op het moment dat er sprake was van aanwijzingen voor een delier, onrust of angst, hetgeen in ieder geval een indicatie is tot sedatie voor minimaal 24 uur. Het is niet zo dat standaard bij opname met sepsis gestart wordt met sedatie, dus ook niet met dexmedetomidine.
In de richtlijn delier bij volwassenen wordt onderscheid gemaakt naar drie motore subtypes van delier; hyperactief delier, hypoactief delier en een gemengd type. Deze verdeling naar subtypes van een delier is in dit hoofdstuk over een delier bij sepsis niet gebruikt, omdat deze informatie in de literatuur ontbreekt. Volgens de recente literatuur dient een hypoactief delier niet medicamenteus behandeld te worden, dus ook niet met dexmedetomidine.
Studies voor de IC-patiënten zijn bij te verwachten sedatie behoefte van > 24 uur. Er zijn ook studies bij cardiale patiënten die perioperatief en kortdurend postoperatief behandeld zijn. Wanneer de indicatie voor sedatie vervalt, dient zo snel mogelijk gestaakt te worden met de sedatie.
Sedatie van alle patiënten ter preventie van een delier is niet wenselijk. Sedatie geeft op zich een verhoogde kans op complicaties zoals delier, polyneuropathie, verlengde opname- en beademingsduur, verhoogde kans op morbiditeit en mogelijk mortaliteit, hogere kosten en mogelijk zelfs infectie.
De werkgroep vindt dat dexmedetomidine niet op verpleegafdelingen moet worden gebruikt in de preventie van delier.
Melatonine gaf veelbelovende resultaten, met een afname in delierincidentie van 50%, maar bij een beperkt aantal patiënten en met een zeer breed betrouwbaarheidsinterval. Daarbij is melatonine erg lastig te doseren. Vooralsnog geven deze bevindingen onvoldoende aanleiding om het gebruik te overwegen in de Nederlandse zorg en moeten aanvullende studies worden afgewacht.
Benzodiazepines
Het onderwerp benzodiazepines is buiten de zoekvraag gelaten voor deze richtlijnmodule, omdat het geen direct knelpunt is voor de sepsis richtlijn, maar een generiek delier advies. De werkgroep heeft er daarom voor gekozen om deze adviezen in de overwegingen te plaatsen.
De werkgroep adviseert terughoudend te zijn met het gebruik van benzodiazepines bij patiënten met sepsis vanwege de associatie met delier. De voor- en nadelen van het gebruik dienen zorgvuldig afgewogen te worden.
Bij ernstige angst bij een niet-gesedeerde patiënt op de IC kan kortdurend gebruik van benzodiazepines (bijvoorbeeld lorazepam) overwogen worden. Dit wordt momenteel al frequent in veel klinieken toegepast.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers/familie)
Het optreden van een delier als complicatie bij een sepsis, heeft grote impact voor de patiënt en diens partner, familie of mantelzorgers. Voor de meeste patiënten is een delier een angstige en vreemde ervaring die zij niet meer mee willen maken. Ook kan een delier als erg ontluisterend worden ervaren. Daarnaast zijn er langeretermijngevolgen, zoals een blijvende cognitieve verslechtering (Girard, 2010; Inouye, 2016 Pandharipande, 2013; Wolters, 2014). Het is voor een patiënt erg belangrijk als een delier voorkomen kan worden, door zowel medicamenteuze als niet-medicamenteuze maatregelen.
De voorkeuren van de patiënt voor een behandeling zijn niet onderzocht en zijn onbekend. Het principe van dexmedetomidine is dat de patiënt net voldoende in slaap is dat hij/zij niet geprikkeld wordt en wakker is bij aanspreken/handelingen. Over het algemeen wordt dit door de patiënt als prettig ervaren en beleeft de patiënt het delier beduidend minder. Andere sedativa worden niet ervaren tijdens de behandeling zelf, want die patiënten worden meestal pas weer wakker als de dosering gestaakt is, maar het nog niet uitgewerkt is.
Kosten (middelenbeslag)
Het voorkomen of beperken van een delier is kostenbesparend. Tot 2020 was dexmedetomidine nog onder patent, de prijs per ampul (generiek) is sindsdien fors gedaald waardoor het prijsverschil per behandeldag ten opzichte van de andere middelen nog slechts enkele euro’s bedraagt en derhalve geen rol speelt in de keuze van het medicament. Er zijn aanwijzingen dat met dexmedetomidine, indien gebruikt als sedativa, de incidentie van een delier wordt verminderd. Dit heeft een direct voordeel voor de patiënt en kan mogelijk cognitieve stoornissen op lange termijn voorkomen, en daarmee kostenbesparend zijn.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn momenteel geen nieuwe effectieve behandelingen beschikbaar om een delier bij IC-patiënten te voorkomen. Het gebruik van benzodiazepines moet zoveel mogelijk worden voorkomen omdat deze middelen geassocieerd zijn met een delier.
Indien er een indicatie is voor het gebruik van sedativa wegen de meerkosten van dexmedetomidine op tegen de mogelijke reductie van de incidentie van een delier op een IC.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
In de dagelijkse praktijk zal de keuze vooral gebaseerd worden op de mate van evidence enerzijds en de kosten, beschikbaarheid en bijwerkingen anderzijds. Vanwege onvoldoende literatuur over een delier bij volwassen patiënten met een sepsis is de wetenschappelijke onderbouwing gebaseerd op delier bij volwassen IC-patiënten. Voor preventie en behandeling van een delier bij patiënten opgenomen in het ziekenhuis maar buiten de IC verwijzen wij naar de herziene richtlijn delier bij volwassenen en ouderen. Voor haloperidol werd geen bewijs gevonden dat het profylactisch gebruik de incidentie van delier kan verminderen bij IC-patiënten ten opzichte van placebo. Dexmedetomidine kan waarschijnlijk wel de incidentie van delier verminderen met bijna 50% ten opzichte van placebo, dit is een klinisch relevant verschil. Dexmedetomidine profylaxe vermindert mogelijk ook de incidentie ten opzichte van andere sedatiemiddelen met 35 tot 50%, zoals midazolam en propofol, en opioïden bij op de intensive care. Dit verschil is mogelijk niet klinisch relevant voor midazolam en opioïden, maar wel voor propofol. Benzodiazepines zijn geassocieerd met het ontstaan van een delier en het gebruik van deze middelen moet zoveel mogelijk worden voorkomen.
Vanwege onvoldoende literatuur over een delier bij volwassen patiënten met een sepsis is de wetenschappelijke onderbouwing gebaseerd op delier bij volwassen IC-patiënten. Voor haloperidol en andere antipsychotica, werd geen bewijs gevonden dat het gebruik de ernst en duur van een delier kan verminderen bij IC-patiënten ten opzichte van placebo. Ook heeft haloperidol waarschijnlijk geen invloed op de verblijfsduur op de intensive care. Los van een delier kunnen er situaties zijn waarbij patiënt toch behandeld moet worden met antipsychotica om psychotische verschijnselen te onderdrukken. Ook rivastigmine was niet effectiever dan placebo op de duur van een delier. Dexmedetomidine, clonidine en quetiapine kunnen mogelijk de duur van een delier iets verminderen, maar dit is beschreven in een beperkt aantal studies met zeer kleine patiëntaantallen. Dexmedetomidine heeft waarschijnlijk geen effect op mortaliteit. Mogelijk kan medicamenteuze behandeling met dexmedetomidine de verblijfsduur op de intensive care verkorten. Van haloperidol, andere antipsychotica en rivastigmine is dit effect op de opname duur op een intensive care niet gevonden. Er werden geen effecten gevonden van haloperidol op ernstige bijwerkingen, verlenging QT-interval, en extrapiramidale symptomen bij IC-patiënten. De kwaliteit van leven, cognitie en duur van de mechanische ventilatie bij een delier bij IC-patiënten zijn onvoldoende beschreven in de bestuurde literatuur.
Onderbouwing
Achtergrond
Conclusies / Summary of Findings
Medicamenteuze behandeling om een delier te voorkomen
|
Haloperidol vermindert waarschijnlijk de incidentie van delier niet ten opzichte van placebobehandeling bij patiënten met sepsis op de intensive care.
Bronnen: (Flükiger, 2018; Herling, 2018; Santos, 2017; Zayed, 2019; Rood, 2019) |
|
Redelijk GRADE |
Dexmedetomidine vermindert waarschijnlijk de incidentie van delier ten opzichte van placebobehandeling bij patiënten met sepsis op de intensive care.
Bronnen: (Flükiger, 2018; Pasin, 2014) |
|
Laag GRADE |
Dexmedetomidine vermindert mogelijk de incidentie van delier ten opzichte van andere sedatiemiddelen (midazolam, propofol, opioïden of midazolam in combinatie met propofol) bij patiënten met sepsis op de intensive care.
Bronnen: (Flükiger, 2018; Pasin, 2014) |
|
Laag GRADE |
Melatonine of melatonine receptoragonisten profylaxe vermindert mogelijk incidentie van delier ten opzichte van placebobehandeling bij patiënten met sepsis op de intensive care.
Bron: (Zhang, 2019) |
|
Laag GRADE |
Intraveneuze toediening van n-3 vetzuren vermindert mogelijk incidentie van delier ten opzichte van standaardbehandeling bij patiënten met sepsis op de intensive care.
Bron: (Burkhart, 2014) |
|
Zeer laag GRADE |
Het is onduidelijk of gebruik van dexmedetomidine tot meer bijwerkingen (hypotensie, bradycardie) leidt dan standaardsedativa bij patiënten met sepsis op de intensive care.
Bron: (Flükiger, 2018) |
Medicamenteuze behandeling om een delier te behandelen
|
Laag GRADE |
Medicamenteuze behandeling lijkt de duur van delier niet te verminderen ten opzichte van placebobehandeling bij patiënten met sepsis op de intensive care.
Bronnen: (Al-Qadheeb, 2014; Flükiger, 2018) |
|
Laag GRADE |
Behandeling met dexmedetomidine lijkt de duur van delier niet te verminderen ten opzichte van andere medicamenteuze behandeling bij patiënten met sepsis op de intensive care.
Bronnen: (Al-Qadheeb, 2014) |
|
Redelijk GRADE |
Medicamenteuze behandeling heeft waarschijnlijk geen invloed op mortaliteit ten opzichte van placebo bij patiënten met sepsis op de intensive care.
Bron: (Zayed, 2019) |
|
Laag GRADE |
Behandeling met dexmedetomidine lijkt geen invloed te hebben op mortaliteit ten opzichte van andere behandeling bij patiënten met sepsis op de intensive care.
Bron: (Al-Qadheeb, 2014) |
|
Redelijk GRADE |
Medicamenteuze behandeling met haloperidol heeft waarschijnlijk geen invloed op intensive-careverblijfsduur ten opzichte van placebo bij patiënten met sepsis.
Bronnen: (Zayed, 2019) |
|
- GRADE |
Vanwege het ontbreken van studies die verblijfsduur in het ziekenhuis rapporteren bij actieve behandeling van delier bij patiënten met sepsis of bij intensive-carepatiënten was het niet mogelijk om een conclusie te trekken noch om de bewijskracht te graderen voor deze uitkomstmaat. |
|
Laag GRADE |
Behandeling van delier met haloperidol lijkt geen invloed te hebben op de incidentie van ernstige bijwerkingen ten opzichte van placebo bij patiënten met sepsis op de intensive care.
|
|
- GRADE |
Vanwege het ontbreken van studies die kwaliteit van leven rapporteren bij actieve behandeling van delier bij patiënten met sepsis of bij intensive-carepatiënten was het niet mogelijk om een conclusie te trekken noch om de bewijskracht te graderen voor deze uitkomstmaat. |
|
- GRADE |
Vanwege het ontbreken van studies die cognitieve functie rapporteren bij actieve behandeling van delier bij patiënten met sepsis of bij intensive-carepatiënten was het niet mogelijk om een conclusie te trekken noch om de bewijskracht te graderen voor deze uitkomstmaat. |
Duur van mechanische ventilatie
|
- GRADE |
Vanwege het ontbreken van studies die duur van mechanische ventilatie rapporteren bij actieve behandeling van delier bij patiënten met sepsis of bij intensive-carepatiënten was het niet mogelijk om een conclusie te trekken noch om de bewijskracht te graderen voor deze uitkomstmaat. |
Samenvatting literatuur
De geselecteerde studies beschrijven allemaal patiënten opgenomen op de intensive care (IC) en geclassificeerd als “ICU patients” of “critically ill patients”, omdat er nauwelijks literatuur beschikbaar was over delier tijdens een sepsis, met uitzondering van één RCT (Burkhart, 2014). Er dient te worden opgemerkt dat voor sommige studies beschreven in SR’s niet altijd duidelijk was of het profylaxe of behandeling betrof. In zulke gevallen werden de indelingen gevolgd die gemaakt werden in de SR’s en daarvan werden de vooraf door de werkgroep gedefinieerde uitkomstmaten uitgewerkt.
Preventie
In de Cochrane review van Herling (2018) werden twaalf RCT’s beschreven met in totaal 3885 patiënten, waarbij delier werd bestudeerd aan de hand van een aantal uitkomstmaten bij diverse behandelingen.
De meta-analyse van Pasin (2014) beschreef incidentie van “delirium, agitation, and/or confusion” in de IC-setting bij “critically ill patients”, waarbij dexmedetomidine werd vergeleken met andere middelen in dertien manuscripten met in totaal 3029 patiënten. Alleen de studies waarbij tenminste delier was onderzocht, werden gebruikt in de analyse.
Santos (2017) onderzocht in een SR de effectiviteit van haloperidol profylaxe bij ernstig zieke volwassen patiënten op de IC met een hoog risico op delier, waarin 3 RCT’s met in totaal 666 patiënten incidentie van delier beschreven.
Zhang (2019) analyseerde acht RCT’s met in totaal 409 patiënten waar profylactische toediening van melatonine of melatonine receptor agonisten werd beschreven bij IC-patiënten, met onder andere als uitkomstmaat incidentie van delier.
De studie van Rood (2019) is een geregistreerde secundaire analyse van de multicenter gerandomiseerde REDUCE-trial naar kwaliteit van leven op lange termijn na haloperidol profylaxe (3x daags 1 of 2 mg) vergeleken met placebo. Incidentie van delier werd hierin beschreven bij 887 IC-patiënten.
De gerandomiseerde trial van Burkhart (2014) beschreef de effecten van intraveneus toegediende n-3 vetzuren op markers van hersenschade, evenals op delier incidentie en overleving bij patiënten met sepsis op de IC. De interventiegroep van 25 patiënten (waarvan voor 13 de toediening voortijdig werd beëindigd wegens een te hoge concentratie triglyceriden) werd vergeleken met standaardzorg bij 25 patiënten.
Behandeling
De SR van Al-Qadheeb (2014) beschreef (de relatie tussen) duur van delier en mortaliteit op de ICU. Zeventien interventies met in totaal 2.849 patiënten beschreven deze uitkomstmaten. In de huidige analyse zijn alleen de dertien farmacologische interventies beschreven.
Preventie en behandeling
Flükiger (2018) beschreef preventie (25 RCT’s) en behandeling (drie RCT’s) van delier op de IC en vergeleek dexmedetomidine met placebo of andere middelen voor de uitkomstmaat incidentie van delier. In een studie werd de duur van delier vergeleken tussen dexmedetomidine en placebo.
In de meta-analyse van Zayed (2019) werd haloperidol vergeleken met placebo voor preventie en behandeling van delier op de IC. Zes RCT’s met 2552 patiënten beschreven incidentie van delier, mortaliteit, verblijfsduur op de IC en ernstige bijwerkingen.
Resultaten
1. Medicamenteuze behandeling om een delier te voorkomen
1.1. Incidentie van delier
Incidentie van delier werd door een aantal studies (Flükiger, 2018; Herling, 2018; Santos, 2017; Zayed, 2019; Zhang, 2019; Rood, 2019) beschreven, waarbij verschillende middelen werden vergeleken met placebo (figuur 1) en waarbij dexmedetomidine werd vergeleken met andere middelen (figuur 2). Op basis van vier studies werd geen klinisch relevant verschil gevonden tussen haloperidol (1553 patiënten) en placebo (1298 patiënten), met een relatief risico (RR) op delier van 0,96 (95% BI 0,81 tot 1,14). Daarentegen werd op basis van negen studies wel een klinisch relevante vermindering van delierincidentie gevonden bij dexmedetomidine (1031 patiënten) vergeleken met placebo (1040 patiënten), met een RR van 0,52 (95% BI 0,39 tot 0,70). In een klein aantal patiënten werd een lagere incidentie van delier gevonden bij melatonine en melatonine receptor agonisten (104 patiënten) ten opzichte van placebo (107 patiënten) met een RR van 0,49 (95% BI 0,28 tot 0,88).
Figuur 1 Delier incidentie bij profylactische medicatie versus placebo bij IC-patiënten
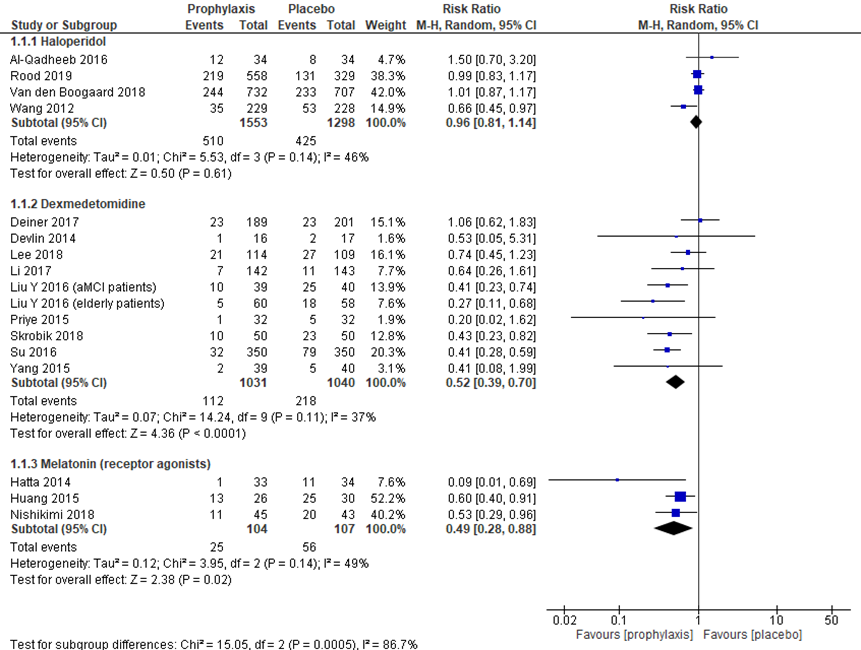
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Flükiger, 2018; Herling, 2018; Santos, 2017; Zayed, 2019; Zhang, 2019; Rood, 2019.
Bij dexmedetomidine werd een lagere incidentie van delier gevonden ten opzichte van andere middelen, met een RR van 0,66 en een 95% BI van 0,53 tot 0,82, bij 1799 versus 1708 patiënten in 20 studies (Flükiger, 2018; Pasin, 2014). Vergeleken met midazolam (RR 0,67; 95% BI 0,46 tot 0,99; 6 studies met 474 patiënten), propofol (RR 0,55; 95% BI 0,42 tot 0,72; 7 studies met 1247 patiënten) en opiaten (RR 0,61; 95% BI 0,44 tot 0,83; 2 studies met 441 patiënten) en midazolam gecombineerd met propofol (RR 0,77; 95% BI 0,45 tot 1,34; vijf studies met 365 patiënten) waren deze verschillen klinisch relevant. In de studie naar het effect van n-3 vetzuren bij patiënten met sepsis vond Burkhart (2014) een RR op delier van 0,95 (95% BI 0,66 tot 1,38) bij 21 versus 20 patiënten. Dit verschil is niet klinisch relevant.
In deze richtlijn is ook een module over sedatie [MR1] opgenomen. In de literatuuranalyse van de betreffende modules werden studies geïncludeerd die dexmedetomidine gebruikten met als doel te sederen, waarbij delier werd gerapporteerd als complicatie. Door het verschil in vraagstelling zijn de geïncludeerde studies tussen de huidige module en de sedatie modules niet gelijk en daarmee zijn ook de conclusies enigszins verschillend.
Figuur 2 Delier incidentie bij dexmedetomidine versus andere profylactische medicatie bij IC-patiënten
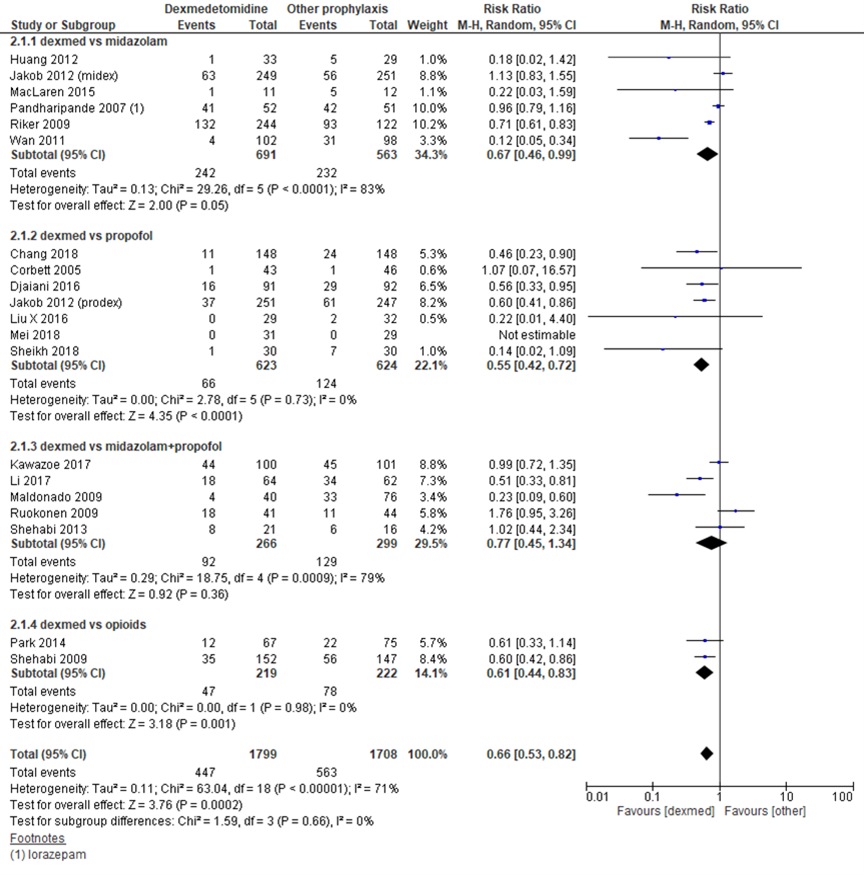
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Flükiger, 2018; Pasin, 2014
Bewijskracht van de literatuur
De bewijskracht voor alle uitkomstmaten is gebaseerd op RCT’s en start derhalve hoog. Voor de uitkomstmaat incidentie van delier is afgewaardeerd met één niveau tot redelijk vanwege de bestudeerde populatie (indirect bewijs) voor de vergelijkingen tussen haloperidol versus placebo en dexmedetomidine versus placebo. Voor de vergelijking tussen dexmedetomidine en andere middelen is met nog een niveau afgewaardeerd tot laag vanwege overschrijding van de grenzen van klinische relevantie.
Voor de vergelijking tussen melatonine (receptor agonisten) versus placebo is afgewaardeerd tot laag vanwege bestudeerde populatie (indirect bewijs) en de beperkte populatieomvang (imprecisie). Voor de vergelijking tussen n-3 vetzuren en controle werd afgewaardeerd met twee niveaus tot laag vanwege de kleine onderzoekspopulatie (imprecisie) en voor beperkingen in de onderzoeksopzet (risk of bias).
1.2. Ernstige bijwerkingen
In de SR van Flükiger (2018) zijn bijwerkingen beschreven, maar met de opmerking dat deze niet systematisch zijn onderzocht en als exploratief moeten worden beschouwd. Er wordt geconcludeerd dat dexmedetomidine vergeleken met standaard sedativa het risico op bradycardie (RR 2,05; 95% BI 1,31 tot 3,22; I2 36%) en hypotensie (RR 1,26; 95% BI 1,04 tot 1,54; I2 9%) verhoogt, maar gedetailleerde informatie over de vergelijking is niet weergegeven.
Bewijskracht van de literatuur
Voor de uitkomstmaat ernstige bijwerkingen is afgewaardeerd met drie niveaus tot zeer laag vanwege de bestudeerde populatie (indirect bewijs), vanwege het beperkte aantal events (imprecisie) en vanwege het risico op bias door de beperkte informatie en het ontbreken van een systematische zoekstrategie.
2. Medicamenteuze behandeling om een delier te behandelen
2.1. Duur van delier
Een aantal SR’s beschreef medicamenteuze behandeling van delier en hanteerde daarbij duur van delier als uitkomstmaat. Diverse vormen van medicatie werden vergeleken met placebo (figuur 3). Daarnaast werd dexmedetomidine vergeleken met andere sedatiemiddelen (figuur 4). Op basis van de SR’s van Al-Qadheeb (2014) en Flükiger (2018) werd geen klinisch relevant verschil gevonden tussen medicamenteuze behandeling en placebo, met een gemiddeld verschil van 0,60 dagen (95% BI -1,32 tot 0,11) in het voordeel van medicatie in 8 studies met in totaal 978 patiënten. Wanneer naar afzonderlijke middelen gekeken werd, dan verminderden quetiapine (gemiddeld verschil -3,40 dagen; 95% BI -5,82 tot -0,98; 18 patiënten per groep), clonidine (gemiddeld verschil -1,70 dagen; 95% BI -2,70 tot -0,70; 15 patiënten per groep) en dexmedetomidine (gemiddeld verschil -0,65 dagen; 95% BI -1,17 tot -0,12; 39 versus 32 patiënten) duur van delier, maar dit waren enkele studies met zeer kleine patiëntaantallen (15 tot 39 per groep). In 6 trials met in totaal 908 patiënten (Al-Qadheeb, 2014) werd dexmedetomidine vergeleken met andere medicatie en was het gemiddeld verschil 0,96 dagen (95% BI -2,12 tot 0,21) in het voordeel van eerstgenoemde, maar dit verschil was niet klinisch relevant.
Figuur 3 Duur van delier bij medicamenteuze behandeling versus placebo bij IC-patiënten
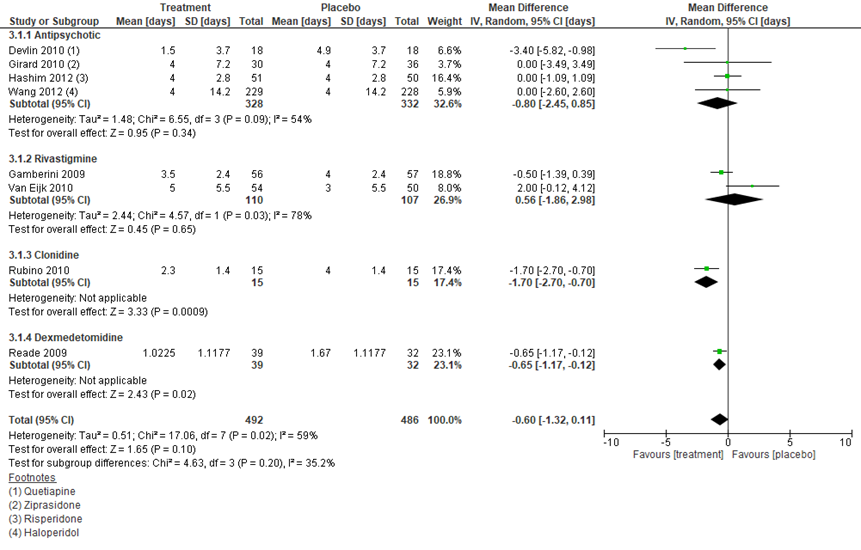
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Al-Qadheeb, 2014; Flükiger, 2018
Figuur 4 Duur van delier bij dexmedetomidine versus andere medicamenteuze behandeling bij IC-patiënten
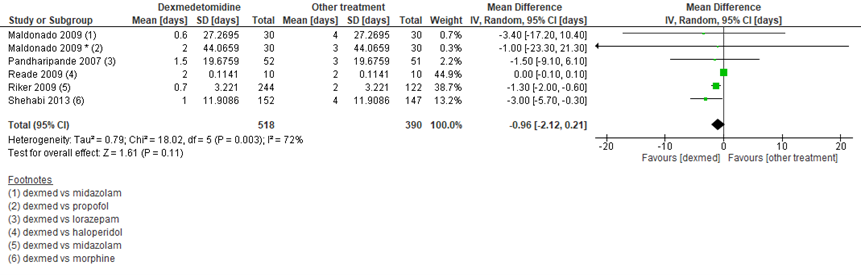
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Al-Qadheeb (2014)
Bewijskracht van de literatuur
Voor de uitkomstmaat duur van delier is afgewaardeerd met twee niveaus tot laag vanwege de bestudeerde populatie (indirect bewijs) en vanwege een beperkte populatieomvang (imprecisie).
2.2. Mortaliteit
Een aantal studies rapporteerde mortaliteit als uitkomstmaat bij medicamenteuze behandeling van delier bij IC-patiënten, waarbij geen significante verschillen werden gevonden. Zayed (2019) beschreef studies die medicamenteuze behandeling vergeleek met placebo. In elf studies met in totaal 1505 behandelde en 1474 controlepatiënten werd geen verschil gevonden, met een RR van 1,00 en een 95% BI van 0,84 tot 1,18 (figuur 5). In zes studies naar haloperidol met 1293 versus 1259 patiënten werd een RR ten opzichte placebo gevonden van 0,96 (95% BI 0,81 tot 1,14). In twee studies naar rivastigmine met in totaal 224 patiënten werd een RR gevonden van 2,44 ten opzichte van placebo (95% BI 0,91 tot 6,59). Drie trials bestudeerden atypische antipsychotica en vonden bij 203 patiënten een RR van 1,22 (95% BI 0,46 tot 3,26). Daarnaast beschreef een trial mortaliteit bij ziprasidone ten opzichte van haloperidol en vond een RR van 1,17 (95% BI 0,32 tot 4,27) bij 30 versus 35 patiënten (Al-Qadheeb, 2014).
Figuur 5 Mortaliteit bij medicamenteuze behandeling versus placebo bij IC-patiënten
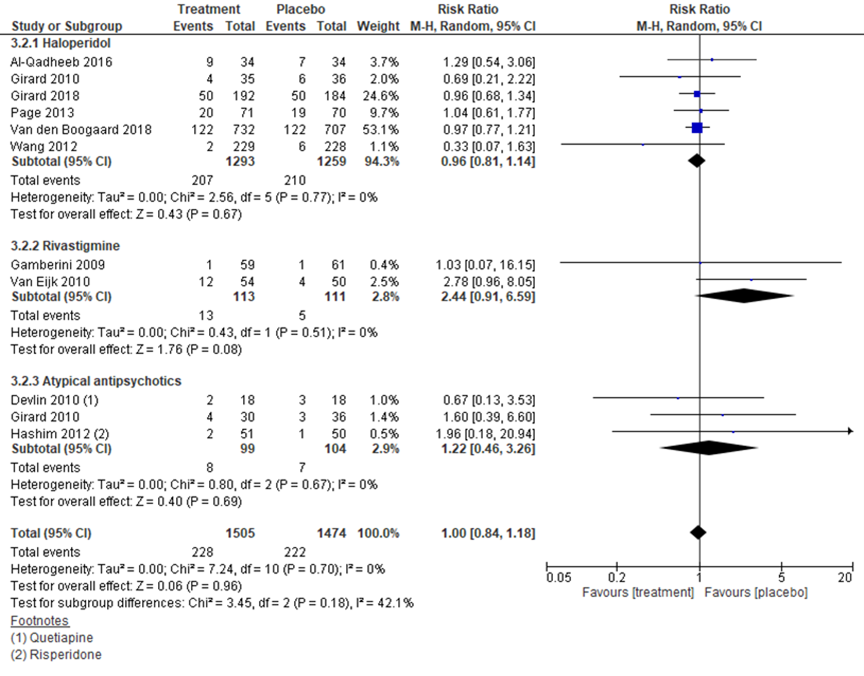
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bronnen: Zayed (2019)
Vijf studies vergeleken dexmedetomidine (499 patiënten) met andere medicatie (374 patiënten) en vonden een RR op mortaliteit van 0,86 met een 95% BI van 0,64 tot 1,16 in het voordeel van dexmedetomidine (figuur 6). Dit verschil was niet significant (Al-Qadheeb, 2014).
Figuur 6 Mortaliteit bij dexmedetomidine versus andere medicamenteuze behandeling bij IC-patiënten
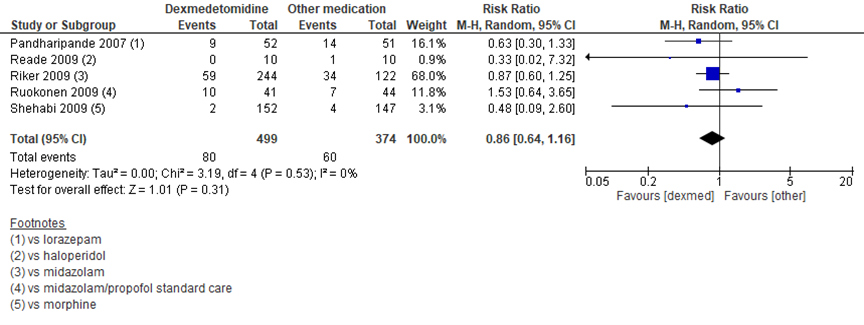
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Al-Qadheeb (2014)
Bewijskracht van de literatuur
Voor de uitkomstmaat mortaliteit bij de vergelijking van medicamenteuze behandeling versus placebo is afgewaardeerd met één niveau tot redelijk vanwege de bestudeerde populatie (indirect bewijs) en voor de vergelijking van dexmedetomidine versus andere medicamenteuze behandeling met twee niveaus tot laag vanwege de bestudeerde populatie (indirect bewijs) en vanwege een beperkte populatieomvang (imprecisie).
2.3. Intensive-careverblijfsduur
Verblijfsduur op IC werd in verschillende studies beschreven (figuur 7). Zayed (2019) vond geen verschillen tussen haloperidol en placebo (figuur 7) in vijf studies met 1045 versus 1012 patiënten (gemiddeld verschil 0.00; 95% BI -0,82 tot 0,83). Flükiger (2018) gaf een overzicht van verblijfsduur op de IC bij dexmedetomidine vergeleken met verschillende andere medicatie, maar zonder de afzonderlijke studiedata weer te geven. Dit bemoeilijkt het bepalen van de verdeling van de data en van de bewijskracht van de conclusies. In vijf datasets van in totaal 1508 patiënten werd geen verschil gevonden tussen dexmedetomidine en placebo (gemiddeld verschil -0,03; 95% BI -0,08 tot 0,01). Ook tussen dexmedetomidine en opiaten werd geen verschil gevonden (gemiddeld verschil 0,03; 95% BI -0,26 tot 0,33), in twee datasets met in totaal 441 patiënten. Daarentegen werd in 11 datasets met in totaal 1983 patiënten een kortere verblijfsduur op IC gevonden bij behandeling met dexmedetomidine vergeleken met standaard sedatie (gemiddeld verschil -1,29 dagen; 95% BI -2,15 tot -0,42). De statistische heterogeniteit in deze vergelijking was met 82% hoog.
Bewijskracht van de literatuur
Voor de uitkomstmaat verblijfsduur op de IC is afgewaardeerd met één niveau tot redelijk vanwege de bestudeerde populatie (indirect bewijs) voor de vergelijking tussen haloperidol en placebo. Voor de vergelijking tussen dexmedetomidine met andere middelen werd met twee niveaus afgewaardeerd tot laag vanwege de bestudeerde populatie (indirect bewijs) en vanwege een beperkte onderzoekspopulatie (imprecisie).
Figuur 7 Verblijfsduur op intensive care bij haloperidol versus placebo
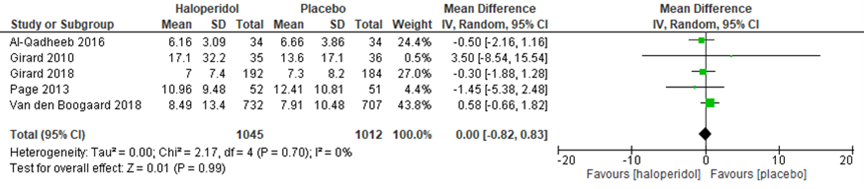
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Zayed (2019)
2.4. Ziekenhuisverblijfsduur
Verblijfsduur in het ziekenhuis werd niet beschreven in de geïncludeerde studies.
Bewijskracht van de literatuur
Vanwege het ontbreken van data kon de bewijskracht niet worden bepaald voor ziekenhuisverblijfsduur.
2.5. Ernstige bijwerkingen
Zayed (2019) analyseerde bijwerkingen bij gebruik van haloperidol vergeleken met placebo in 6 studies (figuur 8). Er werden geen significante verschillen gevonden tussen de groepen op het gebied van “serious adverse events” (RR 0,65; 95% BI 0,23 tot 1,88; 4 studies met 872 versus 847 patiënten), “corrected QT-interval prolongation” (RR 0,87; 95% BI 0,63 tot 1,19; 6 studies met 1293 versus 1259 patiënten), “extrapyramidal symptoms” (RR 0,84; 95% BI 0,57 tot 1,23; 6 studies met 1293 versus 1259 patiënten) of het totaal daarvan (RR 0,84; 95% BI 0,66 tot 1,07).
Figuur 8 Bijwerkingen bij haloperidol versus placebo bij IC-patiënten
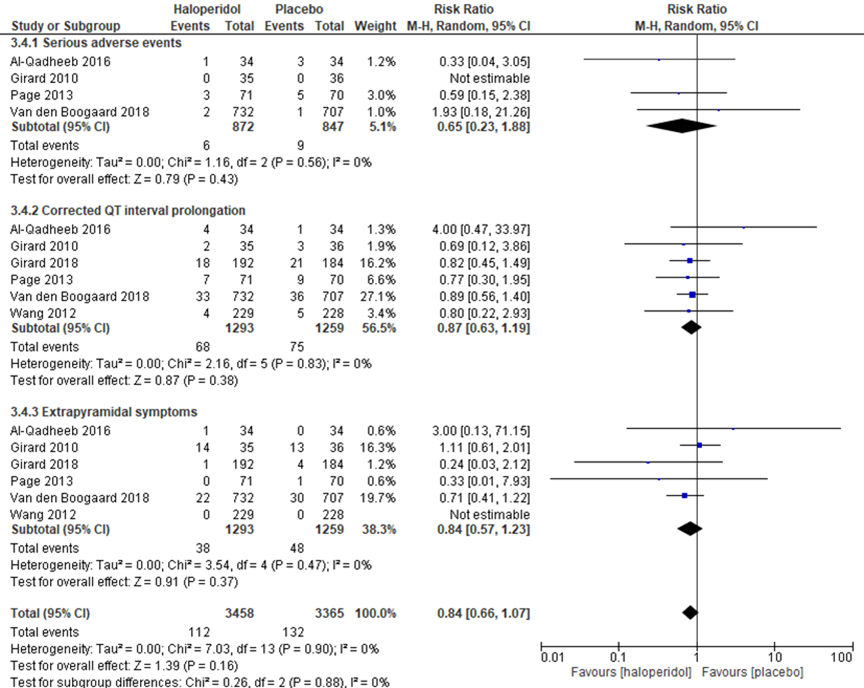
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Zayed, 2019
Bewijskracht van de literatuur
Voor de uitkomstmaat ernstige bijwerkingen is afgewaardeerd met twee niveaus tot laag vanwege de bestudeerde populatie (indirect bewijs) en het beperkte aantal events (imprecisie).
2.6. Kwaliteit van leven
Kwaliteit van leven is niet beschreven in de geïncludeerde studies bij de behandeling van delier.
Cognitieve functie is niet beschreven in de geïncludeerde studies bij de behandeling van delier.
2.8. Duur van mechanische ventilatie
Duur van mechanische ventilatie is niet beschreven in de geïncludeerde studies bij de behandeling van delier.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Deelvraag 1: Wat zijn de (on)gunstige effecten van profylactische medicamenteuze behandeling van delier bij volwassen patiënten met sepsis?
P: volwassen en met name oudere patiënten met sepsis opgenomen op de intensive care;
I: medicamenteuze profylactische behandeling;
C: onderlinge vergelijking van medicatie, placebo, usual care;
O: incidentie van delier, ernstige bijwerkingen.
Deelvraag 2: Wat zijn de (on)gunstige effecten van medicamenteuze behandeling van delier ten opzichte van andere medicatie of placebo bij volwassen patiënten met sepsis?
P: volwassen en met name oudere patiënten met sepsis opgenomen op de intensive care;
I: medicamenteuze behandeling met antipsychotica, sedativa of andere middelen;
C: onderlinge vergelijking van medicatie, placebo, usual care;
O: duur van delier, mortaliteit, intensive-careverblijfsduur, ziekenhuisverblijfsduur, kwaliteit van leven, cognitieve functie, ernstige bijwerkingen, duur van mechanische ventilatie (bij actieve behandeling).
Relevante uitkomstmaten
Voor preventieve behandeling achtte de werkgroep incidentie van delier en ernstige bijwerkingen voor de besluitvorming cruciale uitkomstmaten. Voor actieve behandeling achtte de werkgroep duur van delier en mortaliteit voor de besluitvorming cruciale uitkomstmaten; en IC-verblijfsduur, ziekenhuisverblijfsduur, kwaliteit van leven, cognitieve functie, ernstige bijwerkingen en duur van ventilatie voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De ernst van een delier is moeilijk te meten. Over het voorkomen van een delier lopen de getallen in de literatuur uiteen door het gebruik van verschillende definities en grote verschillen in het tijdstip en de manier waarop een delier wordt vastgesteld. Mede gelet op deze variatie vindt de werkgroep een reductie in het voorkomen van een delier van 25% klinisch relevant. Ook een verkorting van het delier met een dag (24 uur) is een duidelijk meetbaar verschil en van klinisch belang. De werkgroep definieerde de grens van 3% als een klinisch (patiënt) relevant verschil voor mortaliteit (gebaseerd op de SDD-trial van de Smet, 2009). Verder hield de werkgroep voor IC-verblijfsduur en duur van mechanische ventilatie 1 dag aan als klinisch relevant verschil en voor ziekenhuisverblijfsduur 2 dagen. Voor incidentie van ernstige bijwerkingen werd de standaardgrens van 25% aangehouden. Voor continue schalen voor kwaliteit van leven en cognitieve functie werd uitgegaan van een grens van 10%.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 7 augustus 2019 met relevante zoektermen gezocht naar relevante Engelstalige literatuur over medicamenteuze behandeling ter preventie en behandeling van delier bij patiënten met sepsis en septische shock, gepubliceerd vanaf 1990. Omdat er nauwelijks literatuur beschikbaar is specifiek over delier bij sepsis en een groot deel van de patiënten met sepsis wordt opgenomen en behandeld op een IC, hebben wij de literatuuranalyse uitgebreid met volwassen ernstig zieke IC-patiënten met een delier, waarbij geen onderscheid gemaakt is naar de verschillende soorten intensive cares. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 298 treffers op. Op basis van titel en abstract werden in eerste instantie 15 mogelijke systematische reviews (SR’s) en 15 RCT’s voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 21 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en zeven SR’s en twee RCT’s definitief geselecteerd. Deze zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn weergegeven in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Al-Qadheeb NS, Balk EM, Fraser GL, et al. Randomized ICU trials do not demonstrate an association between interventions that reduce delirium duration and short-term mortality: a systematic review and meta-analysis. Crit Care Med. 2014;42(6):1442‐1454. doi:10.1097/CCM.0000000000000224.
- Burkhart CS, Dell-Kuster S, Siegemund M, et al. Effect of n-3 fatty acids on markers of brain injury and incidence of sepsis-associated delirium in septic patients. Acta Anaesthesiol Scand. 2014;58(6):689‐700. doi:10.1111/aas.12313.
- de Smet AM, Kluytmans JA, Cooper BS, et al. Decontamination of the digestive tract and oropharynx in ICU patients. N Engl J Med. 2009;360(1):20‐31. doi:10.1056/NEJMoa0800394.
- Dittrich T, Tschudin-Sutter S, Widmer AF, Rüegg S, Marsch S, Sutter R. Risk factors for new-onset delirium in patients with bloodstream infections: independent and quantitative effect of catheters and drainages-a four-year cohort study. Ann Intensive Care. 2016 Dec;6(1):104. doi: 10.1186/s13613-016-0205-x. Epub 2016 Oct 28. PMID: 27797086; PMCID: PMC5085969.
- Flükiger J, Hollinger A, Speich B, et al. Dexmedetomidine in prevention and treatment of postoperative and intensive care unit delirium: a systematic review and meta-analysis. Ann Intensive Care. 2018;8(1):92. Published 2018 Sep 20. doi:10.1186/s13613-018-0437-z.
- Girard T.D, Jackson, J.C. Pandharipande, P.P.; Pun, B.T.; Thompson, J.L.; Shintani, A.K.; Gordon, S.M.Canonico, A.E.; Dittus, R.S.; Bernard, G.R.; et al. Delirium as a predictor of long-term cognitive impairment in survivors of critical illness. Crit Care Med 2010,38,1513–1520.
- Herling SF, Greve IE, Vasilevskis EE, et al. Interventions for preventing intensive care unit delirium in adults. Cochrane Database Syst Rev. 2018;11(11):CD009783. Published 2018 Nov 23. doi:10.1002/14651858.CD009783.pub2.
- Hughes CG, Mailloux PT, Devlin JW, Swan JT, Sanders RD, Anzueto A, Jackson JC, Hoskins AS, Pun BT, Orun OM, Raman R, Stollings JL, Kiehl AL, Duprey MS, Bui LN, O'Neal HR Jr, Snyder A, Gropper MA, Guntupalli KK, Stashenko GJ, Patel MB, Brummel NE, Girard TD, Dittus RS, Bernard GR, Ely EW, Pandharipande PP; MENDS2 Study Investigators. Dexmedetomidine or Propofol for Sedation in Mechanically Ventilated Adults with Sepsis. N Engl J Med. 2021 Apr 15;384(15):1424-1436. doi: 10.1056/NEJMoa2024922. Epub 2021 Feb 2. PMID: 33528922.
- Inouye SK, Marcantonio ER, Kosar CM, et al. The shortterm and long-term relationship between delirium and cognitive trajectory in older surgical patients. Alzheimers Dement 2016;12(7):766–75.
- Pandharipande PP, Girard TD, Jackson JC, et al. Long-term cognitive impairment after critical illness. N Engl J Med 2013;369(14):1306–16.
- Pasin L, Landoni G, Nardelli P, et al. Dexmedetomidine reduces the risk of delirium, agitation and confusion in critically Ill patients: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth. 2014;28(6):1459‐1466. doi:10.1053/j.jvca.2014.03.010.
- Rood PJT, Zegers M, Slooter AJC, et al. Prophylactic Haloperidol Effects on Long-term Quality of Life in Critically Ill Patients at High Risk for Delirium: Results of the REDUCE Study. Anesthesiology. 2019;131(2):328‐335. doi:10.1097/ALN.0000000000002812.
- Santos E, Cardoso D, Neves H, Cunha M, Rodrigues M, Apóstolo J. Effectiveness of haloperidol prophylaxis in critically ill patients with a high risk of delirium: a systematic review. JBI Database System Rev Implement Rep. 2017;15(5):1440‐1472. doi:10.11124/JBISRIR-2017-003391.
- van den Boogaard M, Slooter AJC, Brüggemann RJM, Schoonhoven L, Beishuizen A, Vermeijden JW, Pretorius D, de Koning J, Simons KS, Dennesen PJW, Van der Voort PHJ, Houterman S, van der Hoeven JG, Pickkers P; REDUCE Study Investigators, van der Woude MCE, Besselink A, Hofstra LS, Spronk PE, van den Bergh W, Donker DW, Fuchs M, Karakus A, Koeman M, van Duijnhoven M, Hannink G. Effect of Haloperidol on Survival Among Critically Ill Adults With a High Risk of Delirium: The REDUCE Randomized Clinical Trial. JAMA. 2018 Feb 20;319(7):680-690. doi: 10.1001/jama.2018.0160. Erratum in: JAMA. 2018 Apr 10;319(14):1510. PMID: 29466591; PMCID: PMC5839284.
- Wolters AE, van Dijk D, Pasma W, et al. Long-term outcome of delirium during intensive care unit stay in survivors of critical illness: a prospective cohort study. Crit Care 2014;18(3):1–7.
- Yamamoto T, Mizobata Y, Kawazoe Y, Miyamoto K, Ohta Y, Morimoto T, Yamamura H. Incidence, risk factors, and outcomes for sepsis-associated delirium in patients with mechanical ventilation: A sub-analysis of a multicenter randomized controlled trial. J Crit Care. 2020 Apr;56:140-144. doi: 10.1016/j.jcrc.2019.12.018. Epub 2019 Dec 24. PMID: 31901649.
- Zayed Y, Barbarawi M, Kheiri B, et al. Haloperidol for the management of delirium in adult intensive care unit patients: A systematic review and meta-analysis of randomized controlled trials. J Crit Care. 2019;50:280‐286. doi:10.1016/j.jcrc.2019.01.009.
- Zhang Q, Gao F, Zhang S, Sun W, Li Z. Prophylactic use of exogenous melatonin and melatonin receptor agonists to improve sleep and delirium in the intensive care units: a systematic review and meta-analysis of randomized controlled trials. Sleep Breath. 2019;23(4):1059‐1070. doi:10.1007/s11325-019-01831-5.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the optimal pharmacological prophylaxis and treatment of delirium?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Herling, 2019
Cochrane SR |
SR and meta-analysis of RCTs
Literature search up to April 2018
A: Abdelgalel, 2016 B: Page 2013; C: Pandharipande 2007 D: Van den Boogaard 2018;
Study design: RCT
Setting and Country: A: ICU, Egypt B: Single-centre, general mixed medical-surgical ICU, UK C: Dual-centre, Medical and surgical ICU at a tertiary centre, USA D: Multicentre, 21 ICUs at university hospitals, teaching and non-teaching hospitals, the Netherlands
Source of funding and conflicts of interest: A: Funding not stated and conflict of interest not declared B: Funding by National Institute for Health Research, UK Intensive Care Foundation. VJP has received honoraria from Orion; EWE from Hospira, Orion and Abbott; and DFM and GDP are co-directors of Research for the UK Intensive Care Foundation. C: PP, DH, MM, TG, BP have received research grants/honoraria from Hospira. EE has received grants and honoraria from Hospira, Pfizer and Eli Lilly and Aspect Medical Systems. D: Funded partly by the ZonMw programme (dossier no 836031004). They had no influence on study design, conduct or publication. Dr Brüggemann reported that he received grant support and consultancy and speaker fees from Pfizer, Merck, Sharp, & Dohme, Astellas, and Gilead. |
Inclusion criteria SR: RCTs with patients 18 years and older treated in ICU.
Exclusion criteria SR: Non-randomized controlled trials, controlled before-and-after trials, historically-controlled trials and cohort studies. Patients from cardiac ICUs
The SR included 12 studies, 4 of which described pharmacological interventions in line with the PICO
Population characteristics: Both intubated and non-intubated participants. ICU participants from medical and surgical ICUs as well as mixed ICUs.
A: 18 years and older; Need for non-invasive ventilation due to acute exacerbation of acute respiratory failure in COPD; Acute hypoxaemic cardiogenic pulmonary oedema; Postoperative respiratory failure B: Critically ill patients (≥ 18 years) demanding mechanical ventilation within 72 hours of admission. C: Adult, medical and surgical ICU patients requiring mechanical ventilation > 24h. D: Adult patients 18 years or older who were delirium free and with an expected ICU stay of more than 2 days.
N, mean age, sex: A: N=90 (30/30/30), 50 years, 74% male B: N=142 (71/70), 68 years, 58% male C: N=106 (52/51), 60 years, 52% male D: N=1789 (353*/734/706), 67 years, 63% male * not included in results SR
Groups were comparable at baseline. |
Any intervention, pharmacological or otherwise, aiming to prevent ICU delirium
A: dexmedetomidine continuous intravenous infusion of 0.2 to 0.7 μg/kg/hour preceded by a loading dose of 1.0 μg/kg intravenously over 10 minutes if needed or haloperidol continuous intravenous infusion of 0.5 to 2 mg/hour preceded by a loading dose of 2.5 mg intravenously over 10 minutes if needed. B: intravenous haloperidol 2.5 mg every eight hours C: sedation with dexmedetomidine as needed or for a maximum of 120 hours D: haloperidol 2 mg three times daily intravenously (1 mg group not included in SR) |
Standard ICU care defined as not providing any therapy specifically aimed at preventing ICU delirium or placebo, or both.
A: Placebo: normal saline continuous intravenous infusion (2 to 8 mL/hour) and loading dose (10 mL) over 10 minutes if needed; B: placebo; C: sedation with lorazepam for up to 120 hours; D: placebo (saline intravenously 3 times daily). |
End-point of follow-up: A: Hospital release B: 28 days C: Hospital release D: 90 days
For how many participants were no complete outcome data available? A: None; B: 1 lost to follow up and 1 discontinued intervention; C: 3 were withdrawn by family and accounted for; D: 3 + 2 + 2 participants did not receive treatment. |
Prevention: Delirium incidence RR, (95% CI)
A: Dexmed versus halo 0.30 (0.09 to 0.98) P = 0.047, n = 60. Dexmed versus placebo 0.23 (0.07 to 0. 73) P = 0.01, n = 60. B: not reported C: Dexmed versus lora 0.96 (0.76 to 1.16) P = 0.65, n = 103 D: halo versus placebo 1.01 (0.87 to 1.17), P=0.88
Prevention: Serious adverse events A: bradycardia occurred significantly more in dexmedetomidine group (8 patients) than in haloperidol group (2 patients) and placebo group (1 patient). 2 patients in haloperidol group developed prolonged QTc-interval ( > 500ms).No patients in both placebo and dexmedetomidine groups developed prolonged QTc interval. Three patients developed arrhythmia in haloperidol group compared to 2 patients in both dexmedetomidine and placebo groups. Hypotension occurred in 4 patients in dexmedetomidine group while hypotension occurred in 3 patients in both haloperidol and placebo groups B: Oversedation was found in 11 patients in the haloperidol group, 6 patients in the placebo group, serious adverse events were 3 reported incidents in the intervention group (fast atrial fibrillation with hypotension (n = 1), readmission to ICU with sepsis (n = 1), failed extubation (n = 1)) and 5 in placebo group (apnoea post treatment for agitation (n = 1), readmission to ICU with sepsis (n = 1), failed extubation (n = 3) C: Seizures were reported for 2 in the dexmedetomidine group and 1 in the lorazepam group and self-extubation was reported for 4 in the dexmedetomidine group compared to 2 in the lorazepam group. One in each group experienced bradycardia HR < 40 /minute at some point during the 120-hour study drug protocol D: Serious adverse events were reported, 3 patients died, 1 in each group. The events were judged to be unrelated to the study medication. 2 patients in the 1 mg haloperidol group and 1 patient in the 2mg haloperidol group developed monomorphic ventricular tachycardia, 1 patient in the 2 mg haloperidol group developed refractory shock, 1 patient in the placebo group developed a suspected malignant neuroleptic syndrome event. |
A: small study, few events, low APACHE II score |
|
Santos, 2017 |
SR and meta-analysis of clinical studies
Literature search up to October 2015
A: Al-Qadheeb, 2016 B: Wang, 2012
Study design: RCT and cohort studies (only RCTs included in table)
Setting and Country: A: ICU (two medical and one surgical) of the Academic Medical Center, Tufts Medical Center, USA; B: ICU of two large tertiary teaching hospitals, China.
|
Inclusion criteria SR: Studies that assessed the effectiveness of haloperidol prophylaxis with any dosage in preventing delirium in adult patients in an ICU. Patients with a predicted high risk of delirium (as identified by validated screening instruments for delirium), aged 18 years or over, and in hospital settings (ICUs only).
Exclusion criteria SR: Patients with a history of concurrent antipsychotic medication use were excluded.
Population characteristics: A: Mechanically ventilated patients with sub-syndromal delirium without complicating neurologic conditions, cardiac surgery, or requiring deep sedation. B: Patients 65 years or older who were admitted to the ICU after non-cardiac surgery.
N, mean age, sex: A: N=68 (34/34), 60 years, sex not reported B: N=457 (229/228), 74 years, sex not reported
In B the control and treatment groups were not comparable at baseline |
Haloperidol prophylaxis
A:Patients received 1 mg of haloperidol IV every 6 hr until delirium occurred (Intensive Care Delirium Screening Checklist ≥ 4 with psychiatric confirmation), 10 days of therapy had elapsed,or ICU discharge. B: Bolus injection of 5 mL (0.5 mg haloperidol), followed by continuous infusion at a rate of 1 mL/hr (0.1 mg/hr haloperidol). Trial medication was started within 1 hr after enrollment and continued for 12 hrs. |
Placebo
A: Patients received 0.2 mL of 5% dextrose in water every 6 hours until delirium occurred (Intensive Care Delirium Screening Checklist ≥ 4 with psychiatric confirmation), 10 days of therapy had elapsed, or ICU discharge. B: Bolus injection of 5 mL (normal saline), followed by continuous infusion at a rate of 1 mL/hr (0.1 mg/hr placebo). Placebo medication was identical in appearance to the active drug. Trial medication was started within 1 hr after enrollment and continued for 12 hrs. |
End-point of follow-up:
A: ICU release B: Hospital release
For how many participants were no complete outcome data available? The outcomes of people who withdrew were not described and included in the analysis. |
Prevention: Delirium incidence RR (95% CI):
A: halo 12/34, 35.3% Placebo 8/34, 23.5% P=0.287. Delirium was assessed by Intensive Care Delirium Screening Checklist with psychiatric confirmation.
B: halo 35/229, 15.3% placebo 53/228, 23.2% p=0.031. Incidence in the first 7 days. Delirium was assessed by level of sedation (Richmond Agitation Sedation Scale) and level of confusion (Confusion Assessment Method for the ICU).
Prevention: Serious adverse events Not reported in SR |
|
|
Pasin, 2014 |
SR and meta-analysis of RCTs
Literature search up to November 2013
A: Riker, 2009 B: Wan, 2011 C: Shehabi, 2013
Study design: RCT
Setting and Country:
Not specified
Source of funding and conflicts of interest: (commercial / non-commercial / industrial co-authorship)
Not specified.
|
Inclusion criteria SR: RCTs in humans with dexmedetomidine in any clinical setting.
Exclusion criteria SR: Non-adult patients and lack of data on incidence of delirium, agitation, and/or confusion.
13 studies were included; 3 studies in ICU patients describing delirium incidence were used in the current analysis.
N (intervention/ control) A: 244/122 B: 102/98 C: 21/16 |
Dexmedetomidine
A: 0.2-1.4 µg/kg/h dexmed infusion, loading dose 1 µg/kg B: dexmed (dose not specified) C: 1 µg/kg/h dexmed infusion, no loading dose
|
Other medication
A: 0.02-0.1 mg/kg/h midazolam infusion with loading dose 0.05 mg/kg B: midazolam (dose not specified) C: propofol and midazolam at the discretion of the treating clinician. |
End-point of follow-up:
Not specified
For how many participants were no complete outcome data available?
Not specified
|
Prevention: Delirium incidence RR (95% CI)
Dexmed versus diazepam A: 0.71 (0.61, 0.83) B: 0.12 (0.05, 0.34)
Dexmed versus propofol+midazol C: 1.02 (0.44, 2.34)
Values pooled with Flükiger, 2018, see below.
Prevention: Serious adverse events Not reported in SR |
|
|
Flükiger, 2018 |
SR and meta-analysis of (RCTs / cohort / case-control studies)
Literature search up to August, 2018
A: Huang, 2012 B: Jakob, 2012 (2 trials) C: MacLaren 2015 D: Pandharipande 2007 E: Chang 2018 F: Corbett 2005 G: Djaiani 2016 H: Jakob, 2012 (prodex) I: Liu X 2016 J: Mei 2018 K: Sheikh 2018 L: Kawazoe 2017 M: Li Y 2017 N: Maldonado 2009 O: Ruokonen, 2009 P: Park, 2014 Q: Shehabi, 2009 R: Devlin, 2014 S: Priye, 2015 T: Yang, 2015 U: Liu Y, 2016 V: Li X, 2017 W: Su. 2016 X: Deiner, 2017 Y: Lee, 2018 Z: Skrobik, 2018
AA: Reade, 2016 BB: Yapici, 2010 CC: Reade, 2009
Study design: RCT
Country: A: China B: Europe, Russia C: USA D: USA E: Taiwan F: USA G: Canada H: Europe, Russia I: China J: China K: India L: Japan M: China N: USA O: Switzerland, Finland P: South Korea Q: Australia R: USA S: India T: China U: China V: China W: China X: USA Y: South Korea Z: USA
AA: Australia, New Zealand BB: Turkey CC: Australlia, randomized open label pilot
Setting not specified.
Source of funding and conflicts of interest: Not reported
|
Inclusion criteria SR: (1) RCT; (2) adult (≥ 18 years) medical or surgical ICU patients; (3) sedation with dexmedetomidine versus any comparator either for prevention or treatment of ICU delirium, regardless of dose, duration, or time of administration; (4) incidence of delirium as a mandatory outcome measurement regarding incidence comparison; and (5) full text available in English.
Exclusion criteria SR: Missing indication of delirium incidence, study design other than RCT, focus on withdrawal delirium, oral administration of dexmed, or dexmed administered in both intervention and control groups.
25 studies were included for delirium prevention; 3 studies were included for delirium treatment.
N, mean age, male sex A: 62, 65 y, 42% B: 500, 56 y, 66% C: 23, 58 y, 57% D: 103, 60 y, 52% E: 60, 71 y, 58% F: 89, 63 y, 82% G: 183, 73 y, 75% H: 498, 56 y, 66% I: 61, 54 y, 41% J: 296, 75 y, 46% K: 60, 35 y, N/A L: 201, 69 y, 63% M: 285, 67 y, 69% N: 118, 58 y, 64% O: 85, 66 y, 82% P: 142, 53 y, 56% Q: 299, 71 y, 75% R: 33, 65 y, 52% S: 700, 74 y, 60% T: 79, 51 y, 53% U: 197, 73 y, 49% V: 126, 44 y, 56% W: 700, 74 y, 60% X: 390, 74 y, 49% Y: 318, 73 y, 44% Z: 100, 62 y, 64%
AA: 74, 57 y, 76% BB: 72, 60 y, 38% CC: 20, 60 y, 85%
|
Dexmed
A: 1 µg/kg/h + 2µg fentanyl B: 0.45 µg/kg/h + fentanyl C: 0.1-0.8 µg/kg/h +midazolam + fentanyl D: 0.4-1.0 µg/kg/h E: 0.2 µg/kg/h F: 0.3 µg/kg/h + midazolam 1.5 mg G: 0.4 µg/kg/h
H: 0.9 µg/kg/h I: 0.3-0.8 µg/kg/h J: 100 µg K: 1 µg/kg
L: not specified M: 0.8 µg/kg/h
+ fentanyl 0.5-1.0 µg/kg N: 0.35 µg/kg/h
O: 0.3-1.4 µg/kg/h + fentanyl 1.5µg
P: 0.5 µg/kg/h Q: 0.5 µg/kg/h + propofol 30 mg/h + midazolam 2.5 mg R: 0.2-0.4 µg/kg/h + midazolam 0.5-0.8 mg + fentanyl 25-42 µg S: 0.4 µg/kg/h T: 0.5 µg/kg/h + midazolam 0.3 mg + fentanyl 120 µg U: 0.3 µg/kg/h V: 0.6 µg/kg/h + propofol 600 mg + midazolam 3 mg + fentanyl 1.5-1.9 mg W: 4 µg + midazolam 153 mg X: 0.5 µg/kg/h Y: 1 µg/kg + propofol 2mg/kg Z: 0.36 µg/kg/h + propofol 22+35 µg/kg/min + midazolam 6 mg/h + fentanyl 100 µg
AA: 0.5 µg/kg/h BB: 0.36 µg/kg/h + propofol 4.0-8.0 mg/kg/h + midazolam 15 µg + fentanyl 20-50 µg/kg/h CC: 0.2 to 0.7 μg/kg/hour with optional loading dose 1.0 μg/kg over 20 minutes |
Placebo or other medication Dose mean/range/IQR A: midazolam 0.1 mg + 2µg fentanyl B: midazolam 0.04-0.08 mg + fentanyl C: midazolam + fentanyl
D: lorazepam 3 mg/h E: propofol 0.4 mg/kg/h F: propofol 19.5 mg/kg/h + midazolam 1 mg G: propofol 25-50 µg/kg/min H: propofol 1.75 mg/kg/h I: propofol 0.9 mg/kg/h J: propofol 260 mg K: propofol 0.25-1.0 mg/kg/h L: propofol+midazolam M: propofol 2mg/kg + midazolam 0.06 mg/kg/h + fentanyl 0.5-1.0 µg/kg N: propofol 7 mg + midazolam 7 mg O: propofol 2.4 mg/kg/h + midazolam (?) + fentanyl 1.5µg P: Remifentanyl 1-2.5 mg/h Q: Morphine 49 µg/kg/h + propofol 35 mg/h + midazolam 1.5 mg R: placebo midazolam 0.6-1.0 mg + fentanyl 39-68 µg S: placebo T: placebo midazolam 0.6 mg + fentanyl 200 µg U: placebo V: placebo propofol 520 mg + midazolam 3 mg + fentanyl 1.5-1.9 mg W: placebo + midazolam 173 mg X: placebo Y: placebo
Z: placebo + propofol 18+32 µg/kg/min + midazolam 6 mg/h + fentanyl 100 µg
AA: placebo, 5 mg midazolam BB: midazolam 75 µg
+ fentanyl 20-50 µg/kg/h CC: Haloperidol 0.5 to 2 mg/hour, with optional loading dose of 2.5 mg
|
End-point of follow-up:
Not specified
For how many participants were no complete outcome data available?
Not specified
|
Prevention: Delirium incidence RR (95% CI)
Dexmed versus midazolam A: 0.18 (0.02, 1.42) B: 1.13 (0.83, 1.55) C: 0.22 (0.03, 1.59) D: 0.96 (0.79, 1.16) (lorazepam) Dexmed versus propofol E: 0.46 (0.23, 0.90) F: 1.07 (0.07, 16.57) G: 0.56 (0.33, 0.95) H: 0.60 (0.41, 0.86) I: 0.22 (0.01, 4.40) J: Not estimable (no events) K: 0.14 (0.02, 1.09) Dexmed versus propofol+midaz L: 0.99 (0.72, 1.35) M: 0.51 (0.33, 0.81) N: 0.23 (0.09, 0.60) O: 1.76 (0.95, 3.26) Dexmed versus opioids P: 0.61 (0.33, 1.14) Q: 0.60 (0.42, 0.86)
Combined with SR Pasin 2014: Pooled effect (random effects model) in 1799 versus 1708 patients: 0.66 (0.53, 0.82) favoring dexmed. Heterogeneity (I2): 71%
Dexmed versus placebo R: 0.53 (0.05, 5.31) S: 0.20 (0.02, 1.62) T: 0.41 (0.08, 1.99) U: 0.41 (0.23, 0.74) in aCMI patients; 0.27 (0.11, 0.68) in other elderly patients V: 0.64 (0.26, 1.61) W: 0.41 (0.28, 0.59) X: 1.06 (0.62, 1.83) Y: 0.74 (0.45, 1.23) Z: 0.43 (0.23, 0.82)
Pooled effect (random effects model) in 1031 versus 1040 patients: 0.52 (0.39, 0.70) favoring dexmed. Heterogeneity (I2): 37%
Prevention: Adverse events Comparison (n data sets, n patients) RR (95% CI)
Mortality Dexmed versus placebo: (5, 1508 patients) 0.92 (0.51, 1.64) Dexmed versus sedative: (10, 1907 patients) 0.97 (0.77, 1.29) Dexmed versus opiods: (1, 299 patients) 0.48 (0.09, 2.60)
Bradycardia Dexmed versus placebo (6, 1587 patients) 1.35 (1.11, 1.64) Dexmed versus sedative (9, 1829 patients) 2.05 (1.31, 3.22) Dexmed versus opiods (2, 441 patients) 2.03 (1.07, 3.83)
Tachycardia Dexmed versus placebo (2, 733 patients) 0.34 (0.30, 0.76) Dexmed versus sedative (4, 1124 patients) 1.06 (0.70, 1.62)
Hypotension Dexmed versus placebo (6, 1587 patients) 1.19 (1.03, 1.38) Dexmed versus sedative (8, 1614 patients) 1.26 (1.04, 1.54)
Hypertension Dexmed versus placebo (2, 1090 patients) 0.62 (0.49, 0.80) Dexmed versus sedative (2, 998 patients) 1.18 (0.88, 1.57)
Circulatory insufficiency Dexmed versus placebo (1, 700 patients) 0.80 (0.32, 2.00)
Treatment: delirium outcome AA: delirium resolution (h) dexmed 23.3 (IQR 13.0-54.0) Placebo 40 (IQR 25.3-76.0 P=0.01 BB: CAM-ICU ≥ 3 36h postop Dexmed 38/38 patients Midazolam 34/34 patients CAM-ICU ≥ 3 60h postop Dexmed 1/38 patients Midazolam 7/34 patients P<0.05 CC: Time (%) with ICDSC<4 Dexmed 95.5 (IQR 51-100) Haloperidol 31.5 (17-97) P=0.122 Time (%) with ICDSC<1 Dexmed: 61 (0-100) Haloperidol 0 (0-0) P=0.134
Other relevant outcomes were not reported. |
|
|
Zhang, 2019 |
SR and meta-analysis of RCTs
Literature search up to August, 2018
A: Nishikimi, 2018 B: Huang, 2015 C: Hatta, 2014
Study design: RCT
Setting and Country: A: Single-center, triple-blinded, randomized placebo-controlled trial, Japan B: Single-center, double-blinded, randomized placebo-controlled trial, China C: Multicenter, rater-blinded, randomized placebo-controlled trial, Japan
Source of funding and conflicts of interest: Not reported |
Inclusion criteria SR: (1) randomized controlled clinical trials; (2) subjects were those admitted to intensive care unit with any diagnosis; (3) melatonin or melatonin receptor agonists were prophylactically used after admission to ICU; and quantitative analysis if (4) sleep, delirium, and other clinical variables were provided as endpoints.
Exclusion criteria SR: 1) patients who had already received melatonin or melatonin receptor agonists prior to the admission to ICU; (2) study protocols, letters, correspondences, and conference addressing; and (3) animal studies.
8 studies were included, 3 of which described relevant outcomes
N, mean age A: 88, 68 y B: 20, 41 y C: 67, 78 y
Sex (intervention/ control: A: 73/56 % Male B: 60/50 % Male C: 32/48 % Male |
Intervention A: Single dose of ramelteon (8 mg) orally B: Single dose of melatonin (1 mg) orally C: Single dose of ramelteon (8 mg) orally |
Placebo
Placebo |
End-point of follow-up:
Not reported
For how many participants were no complete outcome data available? (intervention/control)
Not reported
|
Delirium incidence RR (95% CI) A: 0.53 (0.29, 0.96) B: 0.60 (0.40, 0.91) C: 0.09 (0.01, 0.69)
Pooled effect (random effects model): 0.49 (0.28, 0.88) favoring melatonin. p = 0.017 Heterogeneity (I2): 49.3%
Prevention: adverse events Not reported for the described studies.
|
|
|
Zayed, 2019 |
SR and meta-analysis of (RCTs / cohort / case-control studies)
Literature search up to (month/year)
A: Girard, 2010 B: Wang, 2012 C: Page, 2013 D: Al-Qadheeb, 2016 E: Van den Boogaard, 2018 F: Girard, 2018
Study design: RCT
Setting and Country: A: Multi-center, randomized, double-blind, placebo-controlled trial. B: Prospective, randomized, double-blind, and placebo controlled trial in two centers. C: Single center double-blind, placebo-controlled randomized trial D: Single center randomized, double-blind, placebo-controlled trial. E: Multi-center randomized, double-blind, placebo-controlled trial F: Multi-center randomized, double-blind, placebo-controlled, phase 3 trial
Country not reported.
Source of funding and conflicts of interest:
Not reported |
Inclusion criteria SR: trials that compared haloperidol versus placebo for the management, both treatment and prophylaxis, of delirium in ICU patients.
Exclusion criteria SR: Before-andafter treatment trials, cohort studies, and retrospective studies were excluded.
6 studies were included
N, mean age A: 101 (3 arms) B: 457 C: 141 D: 68 E: 1789 (3 arms) F: 566 (3 arms)
Age, male sex (intervention/ control): A: 51/56 y, 57/61% B: 74/74 y, 63/63% C: 68/69 y, 52/64% D: 69/62 y, 53/59% E: 67/67 y, 63/61% F: 61/59 y, 56/58%
Groups comparable at baseline in characteristics, APACHE 2 score, ventilation. |
Haloperidol
A: Haloperidol 5 mg every 6h. Haloperidol was stopped if patient was delirium free for 48 h, experienced a predefined side effects or at day 14 of study period. B: Bolus injection of 0.5 mg haloperidol followed by continuous infusion at a rate 0.1 mg/h haloperidol for 12h. C: Haloperidol 2.5 mg Every 8 h. Medication was discontinued on ICU discharge, once delirium-free and coma free for 2 consecutive days, or after a maximum of 14 days of treatment, whichever came first. Medication was restarted if patient developed delirium. D: Haloperidol 1 mg every 6 h. Study medication was stopped when one of the following occurred: delirium, ICU discharge, 10 days of therapy had elapsed, or development of adverse effects necessitating study drug discontinuation. E: Haloperidol 1 mg or 2 mg every 6 h. Medication was started within 24 h of admission to the ICU through day 28, until ICU discharge (whichever came first), or until delirium occurred. F: 2.5-10 mg every 12 h for patients <70y. 1.25-5 mg every 12 h for patients >70y. -Patients received up to 10 mg every 12 h and up to 20 mg every 24 h. Trial drug or placebo was discontinued if patient had no delirium for 48 h, development of a pre-defined side effects, after the 14-days intervention period or at ICU discharge, whichever occurred first. |
Placebo
Not specified |
End-point of follow-up:
A: 21 days B: 28 days C: 28 days D: 10 days and until disposition E: 90 days F: 90 days
For how many participants were no complete outcome data available? (intervention/control)
Not reported |
Prevention: delirium incidence RR (95% CI) D: 1.50 (0.70, 3.20) E: 1.01 (0.87, 1.17) B: 0.66 (0.45, 0.97) Pooled effect (random effects model): 0.93 (0.65, 1.34) Heterogeneity (I2): 64%
Treatment: delirium duration Not described
Treatment: mortality RR (95% CI) D: 1.29 (0.54, 3.06) A: 0.69 (0.21, 2.22) F: 0.96 (0.68, 1.34) C: 1.04 (0.61, 1.77) E: 0.97 (0.77, 1.21) B: 0.33 (0.07, 1.63) Pooled effect (random effects model): 0.96 (0.81, 1.14) Heterogeneity (I2): 0%
Treatment: hospital length of stay Not described
Treatment: ICU length of stay RR (95% CI) D: -0.50 (-2.16, 1.16) A: 3.50 (-8.54, 15.54) F: -0.30 (-1.88, 1.28) C: -1.45 (-5.38, 2.48) E: 0.58 (-0.66, 1.82) Pooled effect (random effects model): 0.00 (-0.82, 0.83) Heterogeneity (I2): 0%
Treatment: QoL Not described
Treatment: Adverse events RR (95% CI) Serious adverse events A: Not estimable C: 0.59 (0.15, 2.38) D: 0.33 (0.04, 3.05) E: 1.93 (0.18, 21.26) Pooled effect (random effects model): 0.65 (0.23, 1.88)
Corrected QT interval prolongation A: 0.69 (0.12, 3.86) B: 0.80 (0.22, 2.93) C: 0.77 (0.30, 1.95) D: 4.00 (0.47, 33.97) E: 0.89 (0.56, 1.40) F: 0.82 (0.45, 1.49) Pooled effect (random effects model): 0.87 (0.63, 1.19)
Extrapyrimidal symptoms A: 1.11 (0.61, 2.01) B: Not estimable C: 0.33 (0.01, 7.93) D: 3.00 (0.13, 71.15) E: 0.71 (0.41, 1.22) F: 0.24 (0.03, 2.12) Pooled effect (random effects model): 0.84 (0.57, 1.23)
Total pooled effect (random effects model): 0.84 (0.66, 1.07) favouring haloperidol Heterogeneity (I2): 0%
Other relevant outcomes were not reported. |
|
|
Al-Qadheeb, 2014 |
SR and meta-analysis of RCTs
Literature search up to December 2012
A: Devlin, 2010 B: Maldonaldo, 2009 C: Shehabi, 2009 D: Rubino, 2010 E: Pandharipande, 2007 F: Riker, 2009 G: Gamberini, 2009 H: Reade, 2009 I: Girard, 2010 J: Wang, 2012 K: Hashim, 2012 L: Van Eijk, 2010 M: Ruokonen, 2009
Study design: RCT
Setting and Country: Not reported
Source of funding and conflicts of interest: Not reported |
Inclusion criteria SR: Randomized controlled parallel group or factorial trials of adults (≥19 years or older) admitted to an ICU at the time of study randomization; any pharmacological, non-pharmacological or mixed pharmacological/ non-pharmacological strategy hypothesized to decrease delirium burden (i.e., delirium duration, delirium severity or delirium-associated complications) with any other strategy; trials had to measure delirium at least once daily with a validated technique such as the CAM-ICU or ICDSC or have delirium assessed by a psychiatrist or neurologist using DSM –IV criteria.
Exclusion criteria SR: Not specified.
17 studies were included, 13 of which were relevant to the current analysis
N, mean age, male sex A: 36, 63 y, 56% B: 118, 58 y, 65% C: 299, 72 y, 76% D: 30, 63 y, 60% E: 103, 60 y, 52% F: 366, 63 y, 49% G: 113, 74 y, 68% H: 20, 56 y, 85% I: 62, 54 y, 63% J: 458, 75 y, 63% K: 100, 67 y, 69% L: 104, 69 y, 64% M: 85, 66y, 78% |
Pharmacological treatment A: Quetiapine 50mg PO q12h; ↑ by 50 mg q24h to 200mg q12h + PRN IV haloperidol I: Ziprasidone PO q6h + PRN haloperidol
J: Postoperative haloperidol (0.5 mg IV x 1 then 0.1mg/hr IV x 12 hr) K: Postoperative 0.5 mg PO risperidone q12h until either ICDSC=0 or ICDSC≥4
D: Postoperative clonidine (0.5 mg/kg IV x 1 then 1–2 mg/kg/hr)
G: Rivastigmine 1.5mg PO 3x daily L: Rivastigmine PO 2.5mg daily up to 6mg twice daily
Dexmed B: Postoperative dexmedetomidine IV (load then 0.2–0.7 mcg/kg/hr) C: Postoperative dexmedetomidine IV 0.1–0.7 mcg/kg/hr E: Dexmedetomidine IV 0.15–1.5 mcg/kg/hr +PRN propofol F: Dexmedetomidine IV (load then 0.2–1.4 mcg/kg/hr + PRN IV midazolam H: Dexmedetomidine IV (load then 0.2–0.7 mcg/kg/hr M: Dexmedetomidine IV 0.8–1.4 mcg/kg/hr
|
Placebo A: Placebo 50mg PO q12h; ↑ by 50 mg q24h to 200mg q12h + PRN IV haloperidol I: (1) Haloperidol 5mg PO q6h + PRN haloperidol; (2) Placebo PO q6h + PRN haloperidol J: Postoperative placebo (0.5 mg IV x 1 then 0.1mg/hr IV x 12 hr) K: Postoperative placebo q12h until either ICDSC=0 or ICDSC ≥ 4
D: Postoperative placebo (0.5 mg/kg IV x 1 then 1–2 mg/kg/hr)
G: Placebo 3x daily
L: Placebo PO 2.5mg daily up to 6mg twice daily
Other medication B: (1) Postoperative propofol IV 25– 50 mcg/kg/min (2)Postoperative midazolam IV 0.5–2 mg/hr C: Postoperative morphine IV 10–70 mcg/kg/hr E: Lorazepam IV 1–10 mg/hr + PRN propofol F: Midazolam IV (0.02–0.1mg/kg/hr) + PRN IV midazolam H: Haloperidol IV (2.5mg load then 0.5–2mg/hr M: Standard sedation (midazolam or propofol) protocol
|
End-point of follow-up:
A: 14 days I: 21 days J: 28 days K: hospital discharge D: extubation G: hospital discharge L: 30 days B: hospital discharge C: hospital discharge E: 28 days F: 30 days H: hospital discharge M: 45 days
For how many participants were no complete outcome data available? (intervention/control) Not reported |
Treatment: delirium duration Based on CAM-ICU or ICDSC score, or psychiatric assessment Mean difference (95% CI) in days: Treatment versus placebo A: -3.4 (-5.8, -1.0) D: -1.7 (-2.7, -0.7) G: -0.5 (-1.4, 0.4) I: ziprasidone versus placebo 0 (-3.5, 3.5) J: 0 (-2.6, 2.6) K: 0 (-1.1, 1.1) L: 2.0 (-0.1, 4.1) Pooled effect (random effects model): -0.57 (-1.57, 0.44) favoring medication Heterogeneity (I2): 65%
Dexmed versus other B: dex versus mida -3.4 (-17.2, 10.4) Dex versus propfol -1.0 (-23.3, 21.3) C: -3.0 (-5.7, -0.3) E: -1.5 (-9.1, 6.1) F: -1.3 (-2.0, -0.7) H: 0 (-0.1, 0.1) Pooled effect (random effects model): -0.96 (-2.12, 0.21) favoring dexmed Heterogeneity (I2): 72%
I: ziprasidone versus halo 0 (-3.8, 3.8)
Treatment: mortality Treatment versus placebo A: 0.67 (0.13, 3.53) G: 1.03 (0.07, 16.2) I: 0.80 (0.25, 2.57) J: 0.33 (0.07, 1.63) K: 1.96 (0.18, 20.9) L: 2.78 (0.96, 8.05) Data combined with Zayed, 2019 Pooled effect (random effects model): 1.00 (0.84, 1.18) favoring treatment Heterogeneity (I2): 0%
Dexmed versus other E: 0.48 (0.09, 2.60) H: 0.63 (0.30, 1.33) F: 0.87 (0.60, 1.25) C: 0.33 (0.02, 7.32) M: 1.53 (0.64, 3.65) Pooled effect (random effects model): 0.86 (0.64, 1.16) favoring dexmed Heterogeneity (I2): 0%
Other relevant outcomes were not reported. |
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Burkhart, 2014
NCT 00772096
|
Type of study: Randomized study
Setting and country: Single-centre, Basel, Switzerland
Funding and conflicts of interest: This work was supported by grants from the Swiss Society of Intensive Care Medicine and the departmental fund of the Department for Anesthesia, Surgical Intensive Care, Prehospital Emergency Medicine and Pain Therapy, University Hospital of Basel and an unrestricted research grant from Fresenius Kabi, Switzerland. Omegaven was supplied free of charge by Fresenius Kabi, Switzerland. The funders had no role in study design, data collection and analysis, decision to publish or preparation of the manuscript. |
Inclusion criteria: Patients aged 18 years or older who were admitted to the medical or surgical ICU; diagnosis of sepsis, severe sepsis or septic shock.
Exclusion criteria: Patients with primary infection of the central nervous system, brain trauma, severe coagulation abnormalities or a history of cerebrovascular disease, neoplasia involving the central nervous system, long-term psychiatric medication, or allergy to fish or egg protein.
N total at baseline: 50 Intervention: 25 Control: 25
Age I: 72 ± 9 C: 66 ± 13
Sex I: 52% male C: 56% male
APACHE II score I: 26 ± 11 C: 26 ± 9
Groups were comparable at baseline.
|
Standard treatment for sepsis
plus
2 ml/kg/day of a lipid emulsion containing highly refined fish oil n-3 fatty acid containing parenteral lipid emulsion corresponding to fish oil 0.2 mg/kg/day or n-3 fatty acids 0.12 mg/kg/day upon admission to the ICU and continued for 7 days or until discharge from hospital if earlier.
|
Standard treatment for sepsis (according to the 2008 Surviving Sepsis Campaign international guidelines)
|
Length of follow-up: Not specified
Loss-to-follow-up: Not described
Incomplete outcome data: Intervention: 5/21 (24%) Control: 4/20 (20%) ICDSC could not be assessed during the study period due to intubation, heavy sedation, or Death.
|
Prevention: Delirium incidence SAD (ICDSC ≥ 4) RR (95% CI) 0.95 (0.66, 1.38) favouring treatment. P = 0.796
Delirium duration I: 4 (1-36) C: 5 (2-15) days Not significant (no further data provided)
Mortality The median follow-up time was 109 days (IQR 9–408 days). Overall survival in our trial was similar in both groups: n = 12 (48%) in each group.
ICU length of stay (days) I: 6 (2-33) C: 5 (3-22) days Not significant (no further data provided)
No other relevant outcomes were described. |
|
|
Rood, 2019
REDUCE trial |
Type of study: Randomized, double-blind, placebo-controlled study
Setting and country: Multicentre study in 21 Dutch hospitals.
Funding and conflicts of interest: Supported in part by the ZonMw program (The Hague, The Netherlands) Goed Gebruik Geneesmiddelen.
The authors declare no competing interests. |
Inclusion criteria: patients aged 18 yr or older who were delirium-free at ICU admission and had an anticipated ICU stay of at least 2 days as estimated by the attending intensivist were eligible for study participation.
Exclusion criteria: delirium before study inclusion, an acute neurologic condition, use of antipsychotic agents, history of clinically relevant ventricular arrhythmia, and inability to provide written informed consent
N, age (y), male sex at baseline I: 558, 65±13, 62% C: 329, 66±12, 66%
APACHE II score I: 19±7 C: 19±7
Sepsis I: 28% C: 30% |
Intravenous administration 3 × 1 mg or 3 × 2 mg of haloperidol (groups analysed as 1 group).
The first dose of study medication was administered within 24 h after ICU admission.
Administration of study medication was terminated at day 28 or earlier in case of either ICU discharge or occurrence of delirium. |
0.9% sodium chloride |
Length of follow-up: 6 months
Loss-to-follow-up: The 6-month response rate was 47%, similar in both groups.
Incomplete outcome data: N after 6 months I: 248 C: 165 |
Prevention: Delirium incidence (28 days) I: 219/558 (39%) C: 131/329 (40%) P=0.867
Treatment related outcomes, but intervention is prophylaxis
Mortality (28 days) I: 85/558 (15%) C: 47/329 (14%) P=0.702
Mortality (90 days) I: 109/558 (20%) C: 60/329 (18%) P=0.635
ICU length of stay (days) Median (IQR) I: 5 (2-10) C: 4 (2-10) P=0.297
Hospital length of stay (days) Median (IQR) I: 18 (11-33) C: 16 (10-39) P=0.039
Quality of Life, physical component mean±SD Baseline I: 37±13 (N=558) C: 37±12 (N=329)
1 month I: 31±9 (N=289) C: 32±8 (N=175)
6 months I: 39±11 (N=248) C: 38±11 (N=165)
Quality of Life, mental component mean±SD Baseline I: 47±11 (N=558) C: 47±12 (N=329)
1 month I: 46±11 (N=289) C: 47±11 (N=175)
6 months I: 50±10 (N=248) C: 51±10 (N=165) |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Herling, 2019 |
Yes |
Yes |
Yes |
Yes |
N/A |
Yes |
Yes |
Yes |
Unclear |
|
Santos, 2017 |
Yes |
Yes |
Yes |
Yes |
N/A |
Yes |
Yes |
unclear |
Unclear |
|
Pasin, 2014 |
Yes |
Yes |
Only included studies |
Yes |
N/A |
Yes |
Yes |
Yes |
Unclear |
|
Flükiger, 2018 |
Yes |
Yes |
Only included studies |
Yes |
N/A |
Yes |
Yes |
Yes |
Unclear |
|
Zhang, 2019 |
Yes |
Yes |
Only included studies |
Yes |
N/A |
Yes |
Yes |
Yes |
Unclear |
|
Zayed, 2019 |
Yes |
Yes |
Only included studies |
Yes |
N/A |
Yes |
Yes |
unclear |
Unclear |
|
Al-Qadheeb, 2014 |
Yes |
Yes |
Only included studiess |
Yes |
N/A |
Yes |
Yes |
unclear |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
|
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Burkhart, 2014 |
Eligible patients were randomized by a computer-based system into blocks of 10. The sequentially numbered, opaque sealed envelopes containing the group allocation were handed over to the responsible clinician who opened the envelope and assigned participants to their groups. |
unclear |
likely |
likely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Rood, 2019 |
Patients were randomly assigned to the intervention group or the control group. |
unclear |
unlikely |
unclear |
unclear |
unlikely |
likely |
unclear |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Needham, 2017 |
Geen relevante/kwantificeerbare uitkomstmaten beschreven |
|
Sheldon, 2010 |
Geen origineel onderzoek |
|
Girard, 2010 |
Reeds beschreven in SR |
|
Van den Boogaard, 2018 |
Reeds beschreven in SR |
|
Skrobik, 2018 |
Reeds beschreven in SR |
|
Al-Qadheeb, 2016 |
Reeds beschreven in SR |
|
Bakri, 2015 |
Reeds beschreven in SR |
|
Page, 2013 |
Reeds beschreven in SR |
|
Van Eijk, 2010 |
Reeds beschreven in SR |
|
Spiegler, 2010 |
Geen origineel onderzoek |
|
Devlin, 2010 |
Reeds beschreven in SR |
|
Devlin, 2011 |
Geen relevante/kwantificeerbare uitkomstmaten beschreven |
|
Nguyen, 2016 |
Overlap met andere SR’s |
|
Bathula, 2013 |
Overlap met andere SR’s |
|
Barbateskoiv, 2019 |
Geen relevante/kwantificeerbare uitkomstmaten beschreven |
|
Korenoski, 2018 |
Data van afzonderlijke trials niet te herleiden |
|
Serafim, 2015 |
Overlap met andere SR’s |
|
Mo, 2013 |
Data van afzonderlijke trials niet te herleiden |
|
Ng, 2013 |
SR niet van RCT’s |
|
Devlin, 2011 |
Overlap met andere SR’s |
|
Barr, 2013 |
SR niet van interventie |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-11-2022
Beoordeeld op geldigheid : 01-09-2022
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2017 een multidisciplinaire werkgroep ingesteld voor sepsis fase 1, de samenstelling van de werkgroep is gewijzigd in 2019 voor de ontwikkeling van sepsis fase II en III, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met sepsis in het ziekenhuis.
Werkgroep
- Prof. Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. C.H.S.B. van den Berg, intensivist-infectioloog, UMC Groningen, NVIC
- D. Bolman, patiëntvertegenwoordiger, IC Connect en FCIC
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis, te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-VS
- Dr. C.S.C. Bouman, internist-intensivist, Amsterdam UMC, locatie AMC, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht, NVIC
- Drs. M. Hoogendoorn, manager Vakgroep Anesthesiologie & Intensive Care, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, universitair hoofddocent Sector Verplegingswetenschap afdeling Interne Geneeskunde en universitair hoofddocent Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Dr. H. P. Krepel, nefroloog, Bravis ziekenhuis te Roosendaal en Bergen op Zoom, NIV
- Dr. M.C.G. van de Poll, chirurg-intensivist, Maastricht UMC, NVIC
- Dr. B. P.C. Ramakers, internist-intensivist, RadboudUMC te Nijmegen, NVIC
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. J. Sommers, fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC, KNGF
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede Medisch Directeur, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald: Voorzitter Sectie lC NIV Lid Concilium Interne Geneeskunde Lid GIC Lid platform kwaliteit NIV Lid ESPEN richtlijn commissie Voeding volwassen lC patiënten Lid diverse congrescommissies (Nationale Voedingscongres, internationaal Sepsis Symposium Netherlands, Mythen Missers en Maatwerk infectieuze bedreigingen, MasterclasslC Schiermonnikoog)
Betaald: Spreker voor voedingsfirma's (niet sepsis gerelateerd): Danone-Nutricia, Abbott, BBraun, Baxter, Fresenius-Kabi, Lyric,Mermaid, Nestle-Novartis.
initiator Masterclass Voeding en lC |
Participatie als onderzoeker in lC sepsis trials (b.v. KPA-ART 123 trombomoduline & adrenomedulline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau interactie dat voor vele wetenschappelijke verenigingen congressen organiseert (onder andere sepsis congres).
|
Belangen zijn besproken, voorzitterschap is akkoord |
|
C. van den Berg |
intensivist-infectioloog, UMC Groningen |
Geen |
Geen |
Geen restricties |
|
D. Bolman |
vertegenwoordiger FCIC en IC Connect, ervaringsdeskundige |
vrijwilliger FCIC en IC Connect (onbetaald) vrijwilliger Nederlandse adoptievoorziening (onbetaald) |
Geen |
Geen restricties |
|
V. Bon |
Verpleegkundig Specialist SEH OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Ik heb meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://classic.clinicaltrials.gov/ct2/show/NCT01988428). |
Geen restricties |
|
C. Bouman |
Internist-intensivist Care Volwassenen Amsterdam UMC locatie AMC |
Geen |
Geen |
Geen restricties |
|
L. Derde |
Intensivist UMC Utrecht (0,8 fte) Co-lead WP5 PREPARE (0,2 fte) |
EU coordinating investigator, voorzitter EU Regionale Management Commissie en lid Internationale Trial Stuur Commissie REMAP-CAP, onder andere gefinancierd via PREPARE (FP7) en RECOVER (H2020) grants
Lid NVVM influenza richtlijn
Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia)
Voorzitter van de Clinical Training Committee (CTC) van ESICM.
Lid SSC/ESICM/SCCM COVID-19 guideline committee
Voorzitter NVIC taskforce COVID-19 |
Betrokken bij onderzoek dat door EU wordt gefinancierd:
1. EU coordinating investigator REMAP-CAP: doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Diverse medicamenten (tocilizumab, sarilumab, interferon, lopinavir/ritonavir, anakinra) zijn (deels) door de fabrikanten geleverd voor de studie. In de Verenigde Staten wordt één van de domeinen (eritoran, apremilast) ondersteund door de fabrikanten (Eisai, Amgen). De funders, sponsors en fabrikanten hadden geen rol in de opzet van de studie, de analyses, publicaties, of beslissingen die in de trial zijn genomen. |
Geen restricties |
|
M. Hoogendoorn |
Vakgroep manager Anesthesiologie & Intensive Care, Isala, Zwolle |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen restricties |
|
E. Ista |
Universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
Universitair Hoofddocent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijnen V&VN, Utrecht (onbetaald) tot 2018
Lid CCMO, discipline verplegingswetenschap (betaald) |
Geen |
Geen restricties |
|
R. Jansen |
Klinisch geriater, Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amstelacademie voor verschillende verpleegkundigen opleidingen (betaald).
Onbetaald medeorganisator ouderengeneeskunde congres Maastricht 2.0 in 2018, en 2019.
Onbetaald medeorganisator van nieuw congres Cardiovasculaire aandoeningen bij ouderen (CarVascGer) 2020 te Utrecht. |
Honoraria van Bayer Nederland, Boehringer-Ingelheim, Daiichi-Sankyo en BMS-Pfizer voor houden lezingen, webTV, et cetera over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen restricties |
|
H. Krepel |
Nefroloog, Bravis Ziekenhuis Roosendaal/Bergen op Zoom |
Geen |
Domestico studie (thuisdialyse) |
Geen actie |
|
M. van de Poll |
Intensivist MUMC+ |
Lid van richtlijncommissie NVIC Voeding |
Investigator-initiated grants van Fresenius Kabi en Nutricia, ZON-MW, KCE |
Restricties ten aanzien van het opstellen van aanbevelingen over voeding. |
|
B. Ramakers |
Intensivist in het Radboudumc |
Voorzitter stichting Venticare (kennisplatform voor medewerkers in de acute zorg): onbetaald |
Geen |
Geen restricties |
|
M. de Regt |
Internist Acute Geneeskunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam |
Geen |
Geen |
Geen restricties |
|
S. Sankatsing |
Internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van lnternist-lnfectiologen (NVll), onbetaald
Lid Commissie Richtlijnen Nederlandse lnternisten Vereniging (NlV), waarvoor vacatiegelden
Lid Expertise team behandeling Covid-19 van de Federatie Medisch Specialisten (FMS), onbetaald |
Geen |
Geen restricties |
|
R. Schellaars |
Intensivist, Ziekenhuis Gelderse Vallei, Ede |
Voormalig bestuurslid SIC-NVA |
Geen |
Geen restricties |
|
R. Wilting |
Chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen restricties |
|
J. Sommers |
Fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC |
Cursuscoördinator en docent NPI, scholing IC fysiotherapie (betaald) |
Geen |
Geen restricties |
|
M. Ruiter |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
R. Zwarts - van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
F. Willeboordse |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afvaardiging van een patiëntvertegenwoordiger in de werkgroepen. Het verslag van de focusgroep (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sepsis. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Patient Centered Intensive Care en IC Connect, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen en Dutch Acute Medicine via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij fase II/III van de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Vasopressoren |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Inotropica |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: modaliteit |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: timing |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: dosering |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: antistolling |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatiemiddel |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatie: continu vs. interruptie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Niet-medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Transfusiebeleid |
n.v.t. |
Verwijzing naar bestaande module. |
|
Mobilisatie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Voorlichting langetermijngevolgen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Randvoorwaarden |
geen substantiële financiële gevolgen |
In deze module wordt vooral verwezen naar andere relevante documenten verwezen. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbo.
Zoekverantwoording
|
Uitgangsvraag: UV13 - Wat is de optimale medicamenteuze preventieve- en actieve behandeling van delier? |
|
|
Database(s): Medline, Embase |
Datum: 23-03-2018 |
|
Periode: > 1988 |
Talen: Engels |
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1988 – maart 2018
|
1 exp *DELIRIUM/ or (delirium or confusion*).ti. (12437) 2 exp *SEPSIS/ or exp *Intensive Care Units/ or exp *Critical Illness/ or (Sepsis or sepses or septic* or icu* or intensive care or critically ill).ti. (162881) 3 exp Treatment Outcome/ or exp HALOPERIDOL/ or exp Antipsychotic Agents/ or exp "Hypnotics and Sedatives"/ or exp PROPOFOL/ or exp Cholinesterase Inhibitors/ or exp Analgesics, Opioid/ or exp MELATONIN/ or (haloperidol or antipsychotic* or neuroleptic agent* or sedative* or midazolam or lorazepam or diazepam or dexmedetomidine* or propofol or cholinesterase inhibitor* or opioid* or opiate or melatonine* or treatment or prevent* or outcome).ti,ab. (5739629) 4 1 and 2 and 3 (613) 5 limit 4 to (english language and yr="1988 -Current") (541) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (346909) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1735118) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (2931820) 9 5 and 6 (47) 10 5 and 7 (121) 11 5 and 8 (216) 12 9 or 10 or 11 (295)
= 295 |
394 |
|
Embase (Elsevier) |
((('delirium'/exp/mj OR delirium:ti OR confusion*:ti)
AND ('sepsis'/exp/mj OR 'intensive care unit'/mj OR 'critically ill patient'/mj OR sepsis:ti OR sepses:ti OR septic*:ti OR icu*:ti OR 'intensive care':ti OR 'critically ill':ti)
AND ('prevention and control'/exp OR 'treatment outcome'/exp OR 'haloperidol'/exp OR 'neuroleptic agent'/exp OR 'hypnotic sedative agent'/exp OR 'propofol'/exp OR 'cholinesterase inhibitor'/exp OR 'opiate agonist'/exp OR 'melatonin'/exp OR haloperidol:ti,ab OR antipsychotic*:ti,ab OR 'neuroleptic agent*':ti,ab OR sedative*:ti,ab OR midazolam:ti,ab OR lorazepam:ti,ab OR diazepam:ti,ab OR dexmedetomidine*:ti,ab OR propofol:ti,ab OR 'cholinesterase inhibitor*':ti,ab OR opioid*:ti,ab OR opiate:ti,ab OR melatonine*:ti,ab OR treatment:ti,ab OR prevent*:ti,ab OR outcome:ti,ab))
AND (1988-2018)/py AND (english)/lim NOT 'conference abstract'/it))
Filter Systematic Reviews: ((('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))
Filter RCT: ((('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)
Filter observationele designs: (('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti))
= 308 |
|
Uitgangsvraag: UV13 - Wat is de optimale medicamenteuze preventieve- en actieve behandeling van delier? |
|
|
Database(s): Medline, Embase |
Datum: 10-07-2019 |
|
Periode: > 2018 |
Talen: Engels |
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2018 – juli 2019
|
1 exp *DELIRIUM/ or (delirium or confusion*).ti. (13586) 2 exp *SEPSIS/ or exp *Intensive Care Units/ or exp *Critical Illness/ or (Sepsis or sepses or septic* or icu* or intensive care or critically ill).ti. (175763) 3 exp Treatment Outcome/ or exp HALOPERIDOL/ or exp Antipsychotic Agents/ or exp "Hypnotics and Sedatives"/ or exp PROPOFOL/ or exp Cholinesterase Inhibitors/ or exp Analgesics, Opioid/ or exp MELATONIN/ or (haloperidol or antipsychotic* or neuroleptic agent* or sedative* or midazolam or lorazepam or diazepam or dexmedetomidine* or propofol or cholinesterase inhibitor* or opioid* or opiate or melatonine* or treatment or prevent* or outcome).ti,ab. (6224489) 4 1 and 2 and 3 (727) 5 limit 4 to (english language and yr="2018-Current") (122) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (402811) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1875031) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3217826) 9 5 and 6 (22) 10 5 and 7 (42) 11 5 and 8 (60) 12 9 or 10 or 11 (89)
= 89 |
103 (nieuw tov eerdere search) |
|
Embase (Elsevier) |
((('delirium'/exp/mj OR delirium:ti OR confusion*:ti)
AND ('sepsis'/exp/mj OR 'intensive care unit'/mj OR 'critically ill patient'/mj OR sepsis:ti OR sepses:ti OR septic*:ti OR icu*:ti OR 'intensive care':ti OR 'critically ill':ti)
AND ('prevention and control'/exp OR 'treatment outcome'/exp OR 'haloperidol'/exp OR 'neuroleptic agent'/exp OR 'hypnotic sedative agent'/exp OR 'propofol'/exp OR 'cholinesterase inhibitor'/exp OR 'opiate agonist'/exp OR 'melatonin'/exp OR haloperidol:ti,ab OR antipsychotic*:ti,ab OR 'neuroleptic agent*':ti,ab OR sedative*:ti,ab OR midazolam:ti,ab OR lorazepam:ti,ab OR diazepam:ti,ab OR dexmedetomidine*:ti,ab OR propofol:ti,ab OR 'cholinesterase inhibitor*':ti,ab OR opioid*:ti,ab OR opiate:ti,ab OR melatonine*:ti,ab OR treatment:ti,ab OR prevent*:ti,ab OR outcome:ti,ab))
AND (2018-2019)/py AND (english)/lim NOT 'conference abstract'/it))
Filter Systematic Reviews: ((('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))
Filter RCT: ((('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)
Filter observationele designs: (('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) = 105 |
