Schildklierwaarden bepalingen uit de navelstreng postpartum
Uitgangsvraag
Wanneer dient navelstrengbloed bepaling van schildklier waarden overwogen te worden bij vrouwen postpartum met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap?
Deze uitgangsvraag is ontstaan omdat er praktijkvariatie bestaat in het beleid postpartum bij bovengenoemde groep vrouwen die positieve TSH receptor antistoffen (TRAb) heeft. Er is een inventarisatie onderzoek gedaan waarbij de meest recente ziekenhuis protocollen betreffende schildklier aandoeningen tijdens de zwangerschap en in de neonatale periode opgevraagd zijn (ongepubliceerde data). Hieruit blijkt dat veel ziekenhuis protocollen de vermelding doen om cito bepalingen te laten uitvoeren van schildklier bepalingen (TRAb, schildklier stimulerend hormoon (TSH), vrije thyroxine (fT4), en soms totaal of vrij trijoodthyronine (totaal T3 of FT3)) in navelstrengbloed van neonaten geboren uit een moeder met positieve TRAb. Echter, in de praktijk blijkt dit niet altijd te gebeuren: er zijn situaties vermeldt waarbij bepalingen direct na de geboorte of daags daarna plaatsvinden, of soms uit navelstreng bloed en/of neonataal bloed. Daarnaast blijkt er variatie te zijn in de bepalingen zelf, dat wil zeggen alleen TRAb bepaling en/of compleet schildklier hormoon panel in de neonaat.
Deze praktijkvariatie in het beleid postpartum bij deze groep vrouwen en neonaten heeft invloed op logistieke vraagstukken maar ook op financiële aspecten. Is een consult kinderarts postpartum altijd nodig, en zo ja, wanneer? Dienen bloedmonsters altijd afgenomen te worden, en zo ja, welke en wanneer? Dient een cito bepaling plaats te vinden? En niet onbelangrijk, dient een neonaat altijd postpartum geobserveerd te worden, en zo ja, hoe lang?
Deze module behandelt geen vraagstukken met betrekking tot diagnostiek bij andere vormen van schildklier afwijkingen, noch het beleid gericht op de behandeling van neonaten in geval van neonatale hyperthyreoidie. De module zal wel behulpzaam kunnen zijn om bepaalde vraagstukken te verduidelijken en richting te kunnen geven aan een uniformer beleid postpartum bij vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap.
Aanbeveling
Neem géén navelstrengbloed af bij neonaten van vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap, waarbij in het derde trimester geen maternale TRAb gevonden zijn. De kans op neonatale hyperthyreoïdie is nagenoeg nul.
Neem géén navelstrengbloed af bij neonaten van vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap, waarbij in serum in het derde trimester de concentratie maternale TRAb <3 maal de ULN is. De kans op neonatale hyperthyreoïdie is niet verhoogd.
Neem wél navelstrengbloed af bij neonaten van vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap, waarbij de laatste bekende concentratie maternale TRAB in serum in het tweede of derde trimester ≥3 maal de ULN is geweest. De kans op neonatale hyperthyreoïdie is wel verhoogd.
Bepaal in navelstreng bloed postpartum bij neonaten van vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap, waarbij in serum in het derde trimester de concentratie maternale TRAb ≥3 maal de ULN is, TRAb en de schildklier hormonen TSH en vrije T4 als nulmeting ter follow up voor het neonatale beleid postpartum.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In deze module werd onderzocht wanneer schildklier hormoon bepalingen uit de navelstreng overwogen dienen te worden bij vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap.
Er zijn geen vergelijkende studies gevonden die deze zoekvraag kunnen beantwoorden. De werkgroep heeft wel 5 artikelen geïdentificeerd (waarvan 2 studies en 3 review papers) die niet aan de zoekvraag voldoen maar wel relevante informatie geven voor de richting van de aanbevelingen (Besançon 2014; Van der Kaay 2016; Illouz 2018; Van Trotsenburg 2020; Del Campo Cano 2022).
Deze 5 artikelen geven niet direct een antwoord op de zoekvraag, maar zijn bruikbaar om richting te geven aan een uniformer beleid inzake beleid rond schildklier hormoon bepaling van de neonaat na de bevalling van vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap.
Let op: bovenbeschreven 5 studies, die gebruikt zijn om richting te geven aan een uniformer beleid, gebruiken derde trimester schildklier hormoon bepalingen om postpartum beleid van de neonaat te formuleren. De aanbevelingen in deze module zijn gebaseerd op dit principe: gebruik derde trimester schildklier hormoon bepaling om het neonatale beleid te bepalen. Dit neemt niet weg dat eerste en tweede trimester schildklier hormoon bepalingen bij de moeder altijd doorgang vinden om het foetale beleid te bepalen.
- Bepaling van maternale TRAb in navelstrengbloed van neonaten: associatie tussen maternale TRAb en risico op neonatale hyperthyreoidie.
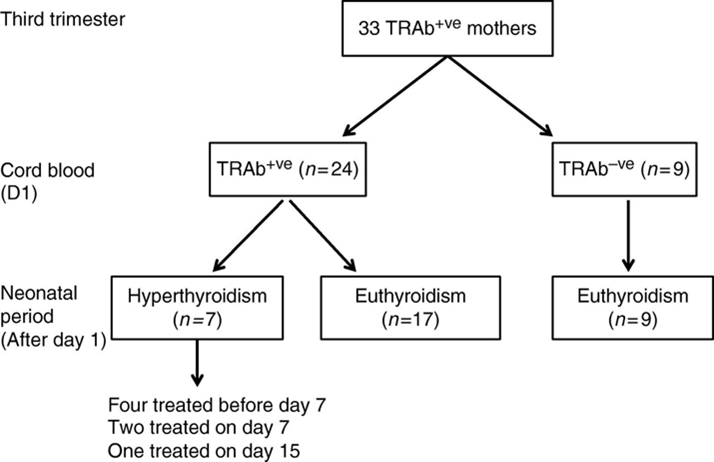
De Franse studie van Besançon (2014) liet zien dat bij moeders met maternale TRAb tijdens de zwangerschap bij wie géén TRAb in navelstrengbloed werd gevonden, de kans erg laag was op het ontwikkelen van neonatale hyperthyreoidie. Indien TRAb wel in navelstrengbloed werd aangetoond, was de kans op neonatale hyperthyroidie verhoogd. Figuur 1 illustreert deze bevindingen: van de 33 moeders met maternale TRAb gemeten in het derde trimester van de zwangerschap, was in het navelstrengbloed van 24 neonaten de aanwezigheid van TRAb gevonden en in 9 niet. Géén van de 9 neonaten zonder TRAb in het navelstrengbloed toonde tekenen van neonatale hyperthyreoidie. In meer dan de helft van de kinderen met in het navelstrengbloed gemeten TRAb werd geen neonatale hyperthyreoidie vastgesteld, terwijl dat wel het geval was in de overige 7 kinderen.
Figure 1. Ontwikkeling van de schildklierfunctie van de 33 neonaten geboren van moeders met positieve TRAb, gemeten uit navelstrengbloed (afgenomen op dag 1) en tijdens de neonatale periode. Bron: Besancon (2014).
Legenda: TRAb+ve: aanwezigheid van TRAb. TRAb-ve: afwezigheid van TRAb.
De auteurs benadrukken het belang om direct postpartum TRAb in navelstrengbloed te bepalen van alle neonaten geboren uit moeders met positieve maternale TRAb teneinde gerichte observatie en tijdige behandeling te bewerkstelligen. De afwezigheid van TRAb in navelstrengbloed, voorspellend voor géén ontwikkeling van neonatale hyperthyreoidie, maakt verdere observatie door kinderarts niet nodig.
Zoals beschreven in Module 'Afkapwaarde TSH-receptor antistof bepaling', recenter bewijs laat zien dat de concentratie maternale TRAb gemeten tijdens het derde trimester van de zwangerschap (hoger of lager dan de ULN) meer voorspellend is voor het ontwikkelen van foetale en neonatale hyperthyreodie dan de aanwezigheid van antistoffen alléén. Banigé (2017) liet in een retrospectieve studie van bijna 2500 vrouwen met positieve TRAb zien dat maternale concentraties van TRAb tijdens het derde trimester >2,5 maal ULN voorspellend waren voor de ontwikkeling van foetale hyperthyreoidie. In een later verschenen meta-analyse door Van Dijk (2018) is gebleken dat de kans op het ontwikkelen van neonatale hyperthyreoidie verhoogd is wanneer maternale TRAb concentraties in het derde trimester van de zwangerschap >3,7 maal ULN. Aanvullende literatuur na het verschijnen van dit paper met een vergelijkbare vraagstelling maar rekening houdend met nieuwere meetmethodes laat een andere grens zien (TRAb >3 maal ULN). De American Thyroid Association beveelt een grenswaarde aan voor maternale TRAb die drie maal ULN, en de Endocrine Society beveelt een TRAb grenswaarde aan die twee tot drie maal ULN is, op basis van de huidige literatuur (Module 'Afkapwaarde TSH-receptor antistof bepaling').
- Noodzaak van neonatale schildklier hormonen TSH en vrije T4 bepaling om neonatale hyperthyreoidie aan te tonen.
Dit vraagstuk is geanalyseerd in twee retrospectieve studies uit 2016 en 2018. TSH en vrije T4 spiegels in navelstrengbloed vormen een afspiegeling van de foetale schildklierhormoon huishouding en kunnen diagnostisch zijn voor neonatale hyperthyreoidie (Van der Kaay, 2016; Illouz, 2018).
Zoals eerder beschreven in module 'Afkapwaarde TSH-receptor antistof bepaling' is de gemeten concentratie maternale TRAb in derde trimester moederlijk serum meer voorspellend voor het optreden van foetale en neonatale hyperthyreoidie (resp. >2,5 maal hoger en ≥3 maal hoger dan de ULN). Daarom is het zinvol om schildklierhormoon spiegels in navelstreng bloed te bepalen in kinderen geboren uit moeders bij wie de maternale TRAb concentraties ≥3 maal ULN gemeten zijn in derde trimester serum.
- Algoritme: beleid bij neonaten direct postpartum geboren uit vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap, afgeleid van Van Trotsenburg (2020). (Zie stroomschema in de bijlagen)
Concluderend heeft het literatuur onderzoek laten zien dat:
- Bij de afwezigheid van maternale TRAb wordt geen neonatale hyperthyreoidie verwacht na de geboorte. Diagnostiek uit navelstrengbloed en onderzoek van de neonaat postpartum zijn niet nodig.
- De aanwezigheid van maternale TRAb in maternaal serum tijdens het derde trimester van de zwangerschap is niet direct geassocieerd met een verhoogd risico op neonatale hyperthyreoidie. Daarentegen is de concentratie wel van belang: indien de concentratie maternaal TRAb ≥3 maal de ULN is, dan is het risico op het ontwikkelen van neonatale hyperthyreoidie verhoogd en dient aanvullend onderzoek plaats te vinden.
- Indien de concentratie maternaal TRAb in het derde trimester <3 maal de ULN is, dan is de kans op neonatale hyperthyreoidie nagenoeg nul, en kan diagnostiek postpartum in navelstrengbloed achterwege worden gelaten. De betrokkenheid van een kinderarts is dan niet nodig.
- Indien de concentratie maternaal TRAb in het derde trimester ≥3 maal de ULN is, dan is de kans op neonatale hyperthyreoidie verhoogd, en dient diagnostiek postpartum in navelstrengbloed gedaan worden. De betrokkenheid van een kinderarts is dan nodig voor diagnostiek, onderzoek en beleid postpartum.
- Bij kinderen die een verhoogd risico op neonatale hyperthyreoidie hebben (module 'TSH receptor antistof bepaling begin zwangerschap') is het raadzaam om de TRAb en de schildklier hormonen TSH en vrije T4 te bepalen als 0-meting van de schildklierhormoon huishouding ter follow up voor het neonatale beleid postpartum.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Vrouwen met een voorgeschiedenis en/of actieve ziekte van Graves tijdens de zwangerschap dienen adequaat voorgelicht te worden over de diagnostische stappen tijdens de zwangerschap om neonatale hyperthyreodie op te sporen direct na de geboorte. De belastbaarheid voor de patiënt wordt niet groot verwacht: eerste-, tweede- en derde trimester serum bepaling van TRAb en schildklierhormonen kunnen worden meegenomen tijdens reguliere bloedafnames die passen bij het standaard prenatale zorg.
Het afnemen van navelstreng bloed van de pasgeboren neonaat kan niet als belastend beschouwd worden.
Kosten (middelenbeslag)
Praktijkvariatie kan leiden tot stijging van kosten in de zorg. Met behulp van de aanbevelingen geformuleerd in deze module, alsmede de beschreven flowchart, kan worden gestreefd naar een meer uniform beleid in het veld om zo tot onnodige kostenverspillingen te komen.
Aanvaardbaarheid, haalbaarheid en implementatie
Naleving van deze richtlijn door het opstellen van lokale protocollen kan er toe leiden tot uniform beleid, acceptatie en implementatie van best practice medicine.
Aanvullende punten met betrekking tot het neonataal beleid
Met de modulaire opbouw van de huidige richtlijn Schildklier en zwangerschap is het beleid ten aanzien van de neonaat weggevallen. Desalniettemin zijn een aantal vraagstukken met betrekking tot het neonataal beleid waarover de werkgroep zich gebogen heeft, zoals het wel/niet cito bepalen van schildklier hormonen en TRAb, en/of – en hoe lang – een neonaat geobserveerd moet worden na de geboorte.
a. Wel/niet cito bepaling van schildklier hormonen en TRAb:
De werkgroep is van mening dat een snelle (lees cito) bepaling van schildklier hormonen en TRAb uit navelstrengbloed aangewezen is. Dit ten gunste van een snellere diagnostiek voor de kinderarts, maar ook ter geruststelling van ouders bij onvoldoende of twijfelachtige diagnostiek tijdens de zwangerschap.
b. Consult kinderarts e/o opname van de neonaat:
Hiervoor verwijzen wij naar het NVK werkboek Kinderendocrinologie. NB: hierbij benadrukt de werkgroep dat het werkboek geen officieel kwaliteitsdocument is.
Onderbouwing
Achtergrond
Neonatal hyperthyroidism in the context of maternal Graves’ disease is caused by the transplacental passage of maternal TSH receptor antibodies (TRAb). As presented in another chapter of this guideline (Module Afkapwaarde TSH-receptor antistof bepaling), the lowest level of maternal TRAb leading to neonatal Graves’ disease is ≥3 times the upper limit of the assay reference interval (or the upper limit of normal, ULN). In addition, maternal TRAb concentrations <3 ULN are very unlikely to cause neonatal Graves’ disease, as presented previously (Besançon, 2014). Nearly all cases (>95 percent) of neonatal hyperthyroidism occur when the maternal TRAb concentration is >5 ULN (Banigé, 2017). However, even in this range, only approximately 25% of infants develop neonatal hyperthyroidism (Besançon, 2014; Banigé, 2017). Ensuring tight biochemical control of thyroid function and the lowest possible maternal TRAb concentrations in the preconception period and during pregnancy are important to achieve favorable fetal and/or neonatal outcome.
Neonatal Graves’ disease refers to the hyperthyroidism that is seen in a small percentage of infants born to mothers with Graves’ disease. Maternal Graves’ disease is by far the most common cause of neonatal hyperthyroidism. The risk of neonatal Graves’ disease is directly related to the concentration of maternal stimulatory TRAb during the third trimester of pregnancy. In most women with Graves’ disease, the TRAb titer is not sufficient to cause neonatal Graves’ disease, which explains why this condition occurs in only 1-5% of pregnancies in women with Graves’ disease. Although neonatal Graves’ disease is usually self-limiting, it can be severe with deleterious effects on neurodevelopment. Babies who go on to develop neonatal Graves’ disease are almost always hyperthyroid at birth or within the first week of life. Neonatal Graves’ disease resolves spontaneously in 3 to 12 weeks as the maternal TRAb is metabolized and disappears from the infant circulation.
The time of onset and severity of symptoms are variable, depending upon whether the mother is taking an antithyroid drug at the time of delivery:
- Without maternal antithyroid drug treatment: infants born to mothers not receiving an antithyroid drug but with active disease are hyperthyroid at birth.
- With maternal antithyroid drug treatment: infants of mothers taking an antithyroid drug may be euthyroid or even hypothyroid at birth and become hyperthyroid as the antithyroid drug is metabolized and excreted by 4 to 10 days after birth.
Neonatal Graves’ disease is diagnosed in a newborn based on elevated fT4 and low TSH levels, typically measured in a baby born to a mother with Graves’ disease. However, should the mother use thyrostatic drugs (propylthiouracil (PTU), carbimazole, or thiamazole (methimazole)) during pregnancy, umbilical cord blood levels of fT4 can be normal or even low in combination with high levels of TSH. In that case, the newborn baby can become hyperthyroid within a few days due to stimulatory TRAb.
Confirmation of the diagnosis in the neonate can be done either immediately (umbilical cord blood) or days after birth (serum). Up till now, international guidelines have recommended a number of algorithms describing pathways from diagnosis to treatment of neonates, illustrated by two main pillars of diagnostic tools:
- Umbilical cord blood: for infants born to mothers with known positive TRAb, the diagnosis neonatal Graves’ disease can be assessed by measuring TRAb, TSH and fT4, in umbilical cord blood. Infants with abnormal results require serial laboratory monitoring after birth, whereas those with normal results can be followed clinically.
- Testing of the neonate: if the mother has a history of Graves’ disease but the maternal TRAb status is unknown, infant thyroid function should be assessed by measuring TRAb, serum free T4, and TSH at birth or soon thereafter. If the mother has a significantly elevated stimulatory TRAb level and was not treated with an antithyroid drug during pregnancy, hyperthyroidism usually will be present in the affected infant on initial testing. In cases where the mother was treated with an antithyroid drug up to delivery, thyroid function tests on the first day of life may be normal or may even show hypothyroidism.
Although these international guidelines were established in the last decade based on the best evidence at the time, the critical appraisal of this chapter assesses whether new evidence has emerged since then to address the question when umbilical cord blood samples should be considered in women with (a history of) Graves' disease during pregnancy.
Conclusies / Summary of Findings
|
- GRADE |
No studies were found that addressed the question when umbilical cord blood samples should be considered in women with - a history of - Graves' disease during pregnancy because none fulfilled the inclusion criteria.
Source: - |
Samenvatting literatuur
Summary of the available literature excluded from the initial search but found relevant for directing the recommendations.
Description of the available studies
Besançon (2014): in a prospective observational study aimed to evaluate the course of thyroid function and clinical outcomes, 68 neonates born to mothers with Graves’ disease (GD) were divided into three groups based on TRAb and anti-thyroid drug (ATD) status in the mother. Thyroid function tests in the neonates were examined and described (umbilical cord blood sampling, serum blood sampling in the neonate, timing) as well as clinical course. None of the infants born to TRAb negative mothers with GD developed neonatal hyperthyroidism, warranting an expectant management. Almost 73% of neonates born to mothers with positive TRAb using ATD had positive TRAb in umbilical cord blood, and one third of these neonates developed neonatal hyperthyroidism. This study demonstrates the importance of umbilical cord blood sampling directly at birth, and the presence of TRAb is predictive for an increased risk of neonatal hyperthyroidism. A management and practice guideline is presented in the paper.
Van der Kaay (2016): this review paper summarizes a literature-based management algorithm for the management of neonates born to mothers with GD based on the best available evidence at the time. Key issues in the management of newborns of mothers with GD including the timing of first determination of free T4 and TSH levels, the means on how to determine umbilical cord blood sampling, serum blood sampling in the neonate, the frequency and duration of follow-up, are presented in this paper by addressing relevant questions such as the utility to determine TRAb levels in umbilical cord blood, but also the value of TSH and fT4 in the prediction of neonatal hyperthyroidism, and if TSH and fT4 levels should be measured in the ‘increased risk for neonatal hyperthyroidism’ newborn. A management algorithm is presented based on the literature search.
Illouz (2018): this recommendation paper summarizes a critical approach of the management of both mothers and babies in the scope of maternal GD. An elaborate appraisal on the management of GD in pregnancy and in the newborn are presented (albeit beyond the scope of this research question), as are the timing of blood sampling (either umbilical or serum) and practical issues described.
Van Trotsenburg (2020): this review paper focusses on the consequences of maternal thyroid dysfunction during pregnancy on the fetal and neonatal outcome and provides a practical approach to clinical management of neonates born to mothers with thyroid dysfunction. Relevant practical issues such as timing and means of blood sampling, as well as discrimination pathways in the prediction of neonatal hyperthyroidism, are discussed. A management algorithm is presented based on a comprehensive literature search.
Del Campo Cano (2022): the aim of this Spanish prospective study was to describe clinical characteristics of neonates born to mothers with active or past GD. Among nearly 6000 neonates born between 2019 en 2021 in a single center, less than 1% were born to mothers with GD. The proportion of mothers with TRAb was very low, and no cases of neonatal hyperthyroidism were described. Practical issues of blood sampling are discussed.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
When should umbilical cord blood samples be considered in women with – a history of – Graves' disease during pregnancy?
| P: patients |
Clinically healthy neonate (no craniosynostosis, no tachycardia, no fetal growth restriction, etc.) born to mothers with Graves’ disease with positive TRAb |
| I: intervention | Umbilical cord determination of TRAb, TSH, fT4 |
| C: control | No umbilical cord determination of TRAb, TSH, fT4 |
| O: outcome measure |
Timely diagnosis and treatment of hypo- or hyperthyroidism, time to hospital discharge, number of neonate blood tests |
Relevant outcome measures
The guideline development group considered timely diagnosis and treatment of hypo- or hyperthyroidism as a critical outcome measure for decision making; and time to hospital discharge and number of neonate blood tests as important outcome measures for decision making.
The working group defined a 25% difference for dichotomous outcomes (RR < 0.8 or > 1.25) and 0.5 SD for continuous outcomes was taken as minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 12-09-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 78 hits.
Studies were selected based on the following criteria:
- Systematic review (that searched in at least two databases, included a detailed search strategy, risk of bias assessment and results of individual studies), randomized controlled trial, or observational studies;
- Studies according to PICO; and
- Full-text English language publication.
Thirty-two studies were initially selected based on title and abstract screening. After reading the full text, all thirty-two studies were excluded (see the table with reasons for exclusion under the tab Methods), and no studies were included.
Five papers, of which two studies, were found that did report some form of diagnosis and management of neonates born to mothers with Graves’ disease. Diagnostic tools, timing and means of diagnostics, all of which could help indirectly to answer the above question, were described in these papers. The working group chose to describe the analysis of this literature because it is relevant for the direction of the recommendations. However, no GRADE-assessment is performed.
Results
No studies were initially included in the analysis of the literature, since none of the studies resulting from the literature search matched the PICO. Hence, no studies were included in the literature analysis and no evidence tables or risk of bias tables were constructed. However, five papers of which two studies reported some form of diagnosis and management of neonates born to mothers with Graves’ disease which the working group considered relevant for the direction of the recommendations were found. These will be discussed below.
Referenties
- 1 - Banigé M, Estellat C, Biran V, Desfrere L, Champion V, Benachi A, Ville Y, Dommergues M, Jarreau PH, Mokhtari M, Boithias C, Brioude F, Mandelbrot L, Ceccaldi PF, Mitanchez D, Polak M, Luton D. Study of the Factors Leading to Fetal and Neonatal Dysthyroidism in Children of Patients With Graves Disease. J Endocr Soc. 2017 Jun;1(6):751-761.
- 2 - Besançon A, Beltrand J, Le Gac I, Luton D, Polak M. Management of neonates born to women with Graves' disease: a cohort study. Eur J Endocrinol. 2014 Jun;170(6):855-62.
- 3 - Del Campo Cano I, Alarza Cano R, Encinas Padilla B, Lacámara Ornaechea N, Royuela Vicente A, Marín Gabriel MÁ. A prospective study among neonates born to mothers with active or past Graves disease. Gynecol Endocrinol. 2022 Jun;38(6):495-498.
- 4 - Van Dijk M, Smits I, Fliers E, Bisschop H. Thyrotropin receptor antibody concentration and the risk of fetal and neonatal thyrotoxicosis: a systematic review. Thyroid. 2018 Feb. 257-264
- 5 - Illouz F, Luton D, Polak M, Besançon A, Bournaud C. Graves' disease and pregnancy. Ann Endocrinol (Paris). 2018 Dec;79(6):636-646.
- 6 - van der Kaay DC, Wasserman JD, Palmert MR. Management of Neonates Born to Mothers With Graves' Disease. Pediatrics. 2016 Apr;137(4):e20151878.
- 7 - van Trotsenburg ASP. Management of neonates born to mothers with thyroid dysfunction, and points for attention during pregnancy. Best Pract Res Clin Endocrinol Metab. 2020 Jul;34(4):101437.
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, Grobman WA, Laurberg P, Lazarus JH, Mandel SJ, Peeters RP, Sullivan S. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. 2017 Mar;27(3):315-389. doi: 10.1089/thy.2016.0457. Erratum in: Thyroid. 2017 Sep;27(9):1212. doi: 10.1089/thy.2016.0457.correx. PMID: 28056690. |
Wrong study design |
|
Besançon A, Beltrand J, Le Gac I, Luton D, Polak M. Management of neonates born to women with Graves' disease: a cohort study. Eur J Endocrinol. 2014 Jun;170(6):855-62. doi: 10.1530/EJE-13-0994. Epub 2014 Mar 26. PMID: 24670885. |
Wrong comparison: umbilical cord blood was taken from all neonates |
|
Chan GW, Mandel SJ. Therapy insight: management of Graves' disease during pregnancy. Nat Clin Pract Endocrinol Metab. 2007 Jun;3(6):470-8. doi: 10.1038/ncpendmet0508. PMID: 17515891. |
Wrong study design |
|
Chopra IJ, Santini F, Hurd RE, Chua Teco GN. A radioimmunoassay for measurement of thyroxine sulfate. J Clin Endocrinol Metab. 1993 Jan;76(1):145-50. doi: 10.1210/jcem.76.1.8421080. PMID: 8421080. |
Other study aim: radioimmunoassay for thyroxine sulfate measurement |
|
Chopra IJ, Wu SY, Teco GN, Santini F. A radioimmunoassay for measurement of 3,5,3'-triiodothyronine sulfate: studies in thyroidal and nonthyroidal diseases, pregnancy, and neonatal life. J Clin Endocrinol Metab. 1992 Jul;75(1):189-94. doi: 10.1210/jcem.75.1.1619009. PMID: 1619009. |
Other study aim: radioimmunoassay for 3,5,3'-triiodothyronine sulfate |
|
Choudhary SS, Langade RA, Kshirsagar VY. Normal values and variation of thyroid stimulating hormone (Tsh) in cord blood of babies born over a period of 1 year. International Journal of Research in Pharmaceutical Sciences 2020 July;11(3):3177-3182 |
Wrong population: no Graves's disease. Wrong comparison: umbilical cord blood was taken from all neonates |
|
Das DV, Baro A. GUIDANCE TO THE MATERNAL, FETAL AND NEONATAL MANAGEMENT OF RESISTANCE GRAVE'S DISEASE IN PREGNANCY. Acta Endocrinol (Buchar). 2021 Oct-Dec;17(4):517-520. doi: 10.4183/aeb.2021.517. PMID: 35747867; PMCID: PMC9206161. |
Wrong study design; resistant Graves’ disease |
|
Delay F, Dochez V, Biquard F, Cheve MT, Gillard P, Arthuis CJ, Winer N. Management of fetal goiters: 6-year retrospective observational study in three prenatal diagnosis and treatment centers of the Pays De Loire Perinatal Network. J Matern Fetal Neonatal Med. 2020 Aug;33(15):2561-2569. doi: 10.1080/14767058.2018.1555803. Epub 2019 Jan 8. PMID: 30513035. |
Other study aims: assess wheter goiter was hypo- or hyperthyroid and tools used to diagnose and characterize goiters and the management; effectiveness of in utero treatments and strategy for monitoring |
|
Del Campo Cano I, Alarza Cano R, Encinas Padilla B, Lacámara Ornaechea N, Royuela Vicente A, Marín Gabriel MÁ. A prospective study among neonates born to mothers with active or past Graves disease. Gynecol Endocrinol. 2022 Jun;38(6):495-498. doi: 10.1080/09513590.2022.2073347. Epub 2022 May 12. PMID: 35548945. |
Not mentioned that umbilical cord blood was analyzed |
|
Dwarakanath CS, Ammini AC, Kriplani A, Shah P, Paul VK. Graves' Disease during pregnancy--results of antithyroid drug therapy. Singapore Med J. 1999 Feb;40(2):70-3. PMID: 10414160. |
Other study aim: results of antithyroid drug therapy |
|
Eisenstein Z, Boruchowsky S, Bank H, Czerniak P. Triiodothyronine radioimmunoassay and its application to thyroid disorders. Isr J Med Sci. 1976 Jan;12(1):1-10. PMID: 943381. |
Other study aim: use of triiodiothyronine radioimmunoassay |
|
Fisher DA. Fetal thyroid function: diagnosis and management of fetal thyroid disorders. Clin Obstet Gynecol. 1997 Mar;40(1):16-31. doi: 10.1097/00003081-199703000-00005. PMID: 9103947. |
Wrong study design |
|
Horsley J, Ogilvy-Stuart AL. The infant of the mother with thyroid disease. Paediatrics and Child Health. 2007 Jun 1;17(6):228-32 |
Wrong study design |
|
Karri SR, Roy PS, Nandi N, Shenoy V, Watson D. Management of fetal hyperthyroidism caused by persistent autoimmune antibodies in a case of previously treated maternal Graves' disease. Obstet Med. 2024 Jun;17(2):108-111. doi: 10.1177/1753495X221146340. Epub 2022 Dec 19. PMID: 38784189; PMCID: PMC11110752. |
Wrong intervention: amniotic fluid testing |
|
Luton D, Le Gac I, Vuillard E, Castanet M, Guibourdenche J, Noel M, Toubert ME, Léger J, Boissinot C, Schlageter MH, Garel C, Tébeka B, Oury JF, Czernichow P, Polak M. Management of Graves' disease during pregnancy: the key role of fetal thyroid gland monitoring. J Clin Endocrinol Metab. 2005 Nov;90(11):6093-8. doi: 10.1210/jc.2004-2555. Epub 2005 Aug 23. PMID: 16118343. |
Other study aim: new approach to the fetal diagnosis of thyroid dysfunction and validated the usefulness of fetal thyroid ultrasonograms |
|
Luz IR, Martins JR, Jerónimo M, Caetano JS, Cardoso R, Dinis I, Mirante A. Neonates Born to Mothers with Graves' Disease: 15 Year Experience of a Pediatric Endocrinology Department. Acta Med Port. 2020 Jul 1;33(7-8):483-490. doi: 10.20344/amp.12279. Epub 2020 Jul 1. PMID: 32669187. |
Wrong comparison: umbilical cord blood was taken from all neonates |
|
Matsuura N, Harada S, Ohyama Y, Shibayama K, Fukushi M, Ishikawa N, Yuri K, Nakanishi M, Yokota Y, Kazahari K, Oguchi H. The mechanisms of transient hypothyroxinemia in infants born to mothers with Graves' disease. Pediatr Res. 1997 Aug;42(2):214-8. doi: 10.1203/00006450-199708000-00014. PMID: 9262225. |
Wrong comparison: antibodies in neonatal thyrotoxicosis, transient hypothyroxinemia, euthyroid |
|
Maximiano C, Silva MR, Carvalho F, Almeida J, Gomes MM, Martins S, Marques O, Estrada A, Pereira A, Antunes A. Follow-up of infants born to mothers with Graves' disease. Endocrinol Diabetes Nutr (Engl Ed). 2021 Aug-Sep;68(7):472-480. doi: 10.1016/j.endien.2021.11.005. PMID: 34863412. |
Wrong population: in none of the newborns was umbilical cord blood collected |
|
Momotani N, Yamashita R, Makino F, Noh JY, Ishikawa N, Ito K. Thyroid function in wholly breast-feeding infants whose mothers take high doses of propylthiouracil. Clin Endocrinol (Oxf). 2000 Aug;53(2):177-81. doi: 10.1046/j.1365-2265.2000.01078.x. PMID: 10931098. |
Other study aim: to investigate whether mothers can breast-feed without adverse effects on infants' thyroid status while taking 300 mg or more daily of PTU |
|
Munro DS, Dirmikis SM, Humphries H, Smith T, Broadhead GD. The role of thyroid stimulating immunoglobulins of Graves's disease in neonatal thyrotoxicosis. Br J Obstet Gynaecol. 1978 Nov;85(11):837-43. doi: 10.1111/j.1471-0528.1978.tb15839.x. PMID: 581471. |
Thyroid stimulating immunoglobulines |
|
Nachum Z, Rakover Y, Weiner E, Shalev E. Graves' disease in pregnancy: prospective evaluation of a selective invasive treatment protocol. Am J Obstet Gynecol. 2003 Jul;189(1):159-65. doi: 10.1067/mob.2003.321. PMID: 12861156. |
No comparison (start umbilical blood sampling at 20 to 24 weeks of gestation) |
|
Polak M. Hyperthyroidism in early infancy: pathogenesis, clinical features and diagnosis with a focus on neonatal hyperthyroidism. Thyroid. 1998 Dec;8(12):1171-7. doi: 10.1089/thy.1998.8.1171. PMID: 9920374. |
Wrong study design |
|
Polak M, Le Gac I, Vuillard E, Guibourdenche J, Leger J, Toubert ME, Madec AM, Oury JF, Czernichow P, Luton D. Fetal and neonatal thyroid function in relation to maternal Graves' disease. Best Pract Res Clin Endocrinol Metab. 2004 Jun;18(2):289-302. doi: 10.1016/j.beem.2004.03.009. PMID: 15157841. |
About fetal ultrasonography |
|
Polak M, Leger J, Luton D, Oury JF, Vuillard E, Boissinot C, Czernichow P. Fetal cord blood sampling in the diagnosis and the treatment of fetal hyperthyroidism in the offsprings of a euthyroid mother, producing thyroid stimulating immunoglobulins. Ann Endocrinol (Paris). 1997;58(4):338-42. PMID: 9436485. |
Wrong study design; fetal hyperthyroidism was suspected on the basis of fetal tachycardia, growth retardation, fetal goiter and fetal cord blood sampling |
|
Radetti G, Persani L, Moroder W, Cortelazzi D, Gentili L, Beck-Peccoz P. Transplacental passage of anti-thyroid auto-antibodies in a pregnant woman with auto-immune thyroid disease. Prenat Diagn. 1999 May;19(5):468-71. PMID: 10360517. |
Wrong study design |
|
Ramsay I, Kaur S, Krassas G. Thyrotoxicosis in pregnancy: results of treatment by antithyroid drugs combined with T4. Clin Endocrinol (Oxf). 1983 Jan;18(1):73-85. doi: 10.1111/j.1365-2265.1983.tb03188.x. PMID: 6682725. |
Other study aim: treatment with antithyroid drugs combined with T4 |
|
Smith C, Thomsett M, Choong C, Rodda C, McIntyre HD, Cotterill AM. Congenital thyrotoxicosis in premature infants. Clin Endocrinol (Oxf). 2001 Mar;54(3):371-6. doi: 10.1046/j.1365-2265.2001.01173.x. PMID: 11298090. |
About TSH receptor binding immunoglobulin index (TBII) in maternal serum; no cord blood determination |
|
Svensson J, Lindberg B, Ericsson UB, Olofsson P, Jonsson B, Ivarsson SA. Thyroid autoantibodies in cord blood sera from children and adolescents with autoimmune thyroiditis. Thyroid. 2006 Jan;16(1):79-83. doi: 10.1089/thy.2006.16.79. PMID: 16487018. |
Wrong comparison: children later developing autoimmune thyroiditis versus control children |
|
Takeoka K, Amino N, Tamaki H, Aozasa M, Tachi J, Iwatani Y, Mori M, Tanizawa O, Miyai K. [Prediction of postpartum relapse of Graves' thyrotoxicosis and the development of neonatal Graves' disease by the highly sensitive TSH immunoradiometric assay]. Rinsho Byori. 1988 Apr;36(4):455-8. Japanese. PMID: 3404742. |
Article in Japanese |
|
Tamaki H, Amino N, Takeoka K, Iwatani Y, Tachi J, Kimura M, Mitsuda N, Miki K, Nose O, Tanizawa O, et al. Prediction of later development of thyrotoxicosis or central hypothyroidism from the cord serum thyroid-stimulating hormone level in neonates born to mothers with Graves disease. J Pediatr. 1989 Aug;115(2):318-21. doi: 10.1016/s0022-3476(89)80093-9. PMID: 2569036. |
Only cord TSH values were determined; no comparison |
|
van der Kaay DC, Wasserman JD, Palmert MR. Management of Neonates Born to Mothers With Graves' Disease. Pediatrics. 2016 Apr;137(4):e20151878. doi: 10.1542/peds.2015-1878. Epub 2016 Mar 15. PMID: 26980880. |
Wrong study design |
|
Wada M, Kita M, Kawasaki K, Kusakabe T, Tagami T, Satoh-Asahara N, Shimatsu A, Hashimoto K. False-positive TSH receptor antibody-a pitfall of third-generation TSH receptor antibody measurements in neonates. Endocr J. 2018 May 28;65(5):587-592. doi: 10.1507/endocrj.EJ17-0426. Epub 2018 Mar 10. PMID: 29526990. |
Other study aim: false-positive TRAb using lithium-heparin plasma from umbilical cord blood; wrong comparison: umbilical cord blood was taken from all neonates |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 04-04-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor vrouwen met een schildklieraandoening voor, tijdens en na de zwangerschap.
Werkgroep
- Prof. Dr. R.C. (Rebecca) Painter, gynaecoloog, NVOG (voorzittter)
- Dr. J.W. (Ellen) Nijkamp, gynaecoloog, NVOG
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog, NVOG
- Dr. I.M. (Inge) Evers, gynaecoloog, NVOG
- Dr. N. (Nienke) Kok, gynaecoloog, NVOG
- Drs. A.M. (Marjoleine) van Hengel-Jacobs, kinderarts-neonatoloog, NVK
- Dr. T. (Tim) Korevaar, obstetrisch internist, endocrinoloog, NIV
- Prof. Dr. A.C. (Annemieke) Heijboer, klinisch-chemicus-endocrinoloog, NVKC
- Mw. J. (Jet) Bulk, verloskundige, KNOV
- Dr. A.A. (Anneke) Bouman, voorzitter kenniscommissie, SON
Met ondersteuning van
- Drs. D.A.M. (Danique) Middelhuis, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Jana) Tuijtelaars, adviseur, Kennisinstituut van de Federatie Medsich Specialisten
- Dr. H.H. (Hanneke) van der Lee, senior-adviseur, Kennisinstituut van de Federatie Medsich Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Painter (voorzitter) |
Hoogleraar verloskunde en hoofd subafdelings verloskunde Erasmus MC |
Alle nevenfuncties zijn onbetaald: Wetenschappelijk adviseur Stichting ZEHG Lid ROAZ werkgroep "Wensen en Grenzen' Regio Rijnmond Lid (namens NVOG) in Cluster Diabetes RL commissie Lid Gezondheidsraadcommissie 'Vitamine K beleid neonaten' Trustee Bikkja Trust |
Leading the Change, TANGO DM (projectleider)
ZonMw: GGG SugarDip, Inclusieversneller TANGO DM, Meer kennis minder dieren (Metformine Dierstudies), Regionetwerk Noord West Nederland, Aanvraag implementatie Basiskader VSVs (geen projectleider), overige ZonMw wél projectleider. ZEGG: Implementatie TANGO DM "Moet alles dat kan, en kan alles dat moet?", projectleider. A'dam UMC: Scholarship promovenda Lois vd Minnen (projectleider)
|
Geen restricties |
|
Nijkamp |
Gynaecoloog WKZ Utrecht |
Geen |
Geen |
Geen restricties |
|
Van der Heijden |
Gynaecoloog perinatoloog Werkgever: Radboudumc Nijmegen |
Diverse MDR werkgroepen NTOG deelredacteur Perinatologie |
Geen |
Geen restricties |
|
Evers |
Gynaecoloog-perinatoloog Meander MC Amersfoort |
Opleider Werkgroep Otterlo NVOG Bestuurslid werkgroep WPMZ NVOG Lid SIG Diabetes en Zwangerschap NVOG |
Geen |
Geen restricties |
|
Kok |
Gynaecoloog te Amsterdam UMC |
Geen |
Geen |
Geen restricties |
|
Korevaar |
Obstetrisch internist, endocrinoloog |
Mede voorzitter ATA richtlijn Thyroid and Pregnancy (onbetaald) |
Lectureship fee (max 1500 euro) van Goodlife Healthcare, Berlin Chemie, Merck, IBSA, Quidell
Gepubliceerde werk kan gebruikt worden om bepaalden aanbevelingen te ondersteunen of verwerpen, er is geen relevante mogelijkheid tot vermarketing, geen boegbeeldfunctie. |
Geen restricties; er worden in de richtlijn geen adviezen gegeven voor het gebruik van specifieke medicijnen of assays |
|
Van Hengel-Jacobs |
Kinderarts-neonatoloog Franciscus Gasthuis & Vlietland |
Geen |
Geen |
Geen restricties |
|
Bulk |
Waarnemend 1e lijns verloskundige/verloskundig echoscopist, zelfstandig (mn Verloskundingenpraktijk Midden Groningen). Betaald. |
Masterstudent Evidence Based Practice in Healthcare (UvA) |
Geen |
Geen restricties |
|
Bouman |
Vrijwilliger; Schildklier Organisatie Nederland (SON) |
Geen |
Als vrijwilliger bij SON behartigt ze belangen van schildklierpatiënten |
Geen restricties |
|
Heijboer |
klinisch chemicus-endocrinoloog, hoofd endocrinologisch laboratorium, plaatsvervangend afdelingshoofd Laboratoriumgeneeskunde Amsterdam UMC |
Lid van Bone committee van de IFCC (International Federation of Clinical Chemistry), onbetaald Voorzitter van de commissie endocrinologie (Nederlandse Vereniging voor Klinische Chemie), onbetaald Lid van cluster wetenschap en innovatie (Nederlandse Vereniging voor Klinische Chemie), onbetaald Lid van research board Amsterdam Gastrointestinal Endocrinology Metabolism research institute (Amsterdam UMC), onbetaald Lid van onderwijscommissie (Nederlandse Vereniging voor Endocrinologie), onbetaald Lid van advisory panel DEQAS (http://www.deqas.org/), onbetaald |
Geen |
Geen restricties |
|
De Vries-Metzlar |
Verloskundige in eigen praktijk (eerste lijn) |
Echografie (basis) |
Geen |
Geen restricties |
|
Visser |
Supervisor Tim Korevaar uit NVE (NIV)
Internist-endocrinoloog, hoofd sector endocrinologie, Erasmus MC, Rotterdam |
Niet relevant |
Voorzitter medische advies raad SON (patientenorganisatie schildklierpatienten) |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenfederatie en Schildklier Organisatie Nederland (SON) voor de schriftelijke knelpunteninventarisatie en afvaardiging namens SON in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie per module ook “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie en Schildklier Organisatie Nederland (SON) en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Schildklierwaarden bepalingen uit de navelstreng
|
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor vrouwen met een schildklieraandoening voor, tijdens en na de zwangerschap. Tevens zijn er knelpunten aangedragen door de Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) via een schriftelijke knelpuntenanalyse.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.