Chirurgische behandeling - laag risico en > 1 cm en ≤ 4 cm
Uitgangsvraag
Welke chirurgische behandelstrategie is van toepassing op patiënten met een “laag risico” schildkliercarcinoom >1 en ≤ 4cm?
Aanbeveling
Bij een patiënt met een tumor die voldoet aan alle criteria voor laag risico tumoren zoals beschreven in de module Risicostratificatie en een afmeting heeft van > 1 cm en ≤ 4 cm kan een hemithyreoïdectomie als behandeling gevolgd door follow-up overwogen worden. Neem hierbij de factoren zoals beschreven in Tabel 1 en 2 in ogenschouw.
Neem het definitieve besluit over de behandeling van patiënten met een laag risico tumor van > 1 cm en ≤ 4 cm pas nadat het postoperatieve histologisch onderzoek van de primaire tumor heeft plaatsgevonden.
Betrek de patiënt bij de besluitvorming en pas de algemene principes van adequaat gedeelde besluitvorming toe.
Voer een hoge kwaliteit echografie uit bij alle patiënten die in aanmerking komen voor de behandelingskeuze tussen een totale thyreoïdectomie en een hemithyreoïdectomie. Dit dient om de aanwezigheid van cervicale lymfkliermetastasen en eventuele macroscopische extrathyreoidale extensie van de tumor uit te sluiten, zie module Organisatie van zorg.
Bovendien moet deze echografie worden uitgevoerd, indien deze niet eerder is gedaan, wanneer er een beslissing moet genomen worden over een rest-thyreoïdectomie na een initiële hemithyreoïdectomie.
Verricht bij echografisch suspecte lymfklieren en/of noduli in de contralaterale schildklierkwab een cytologische punctie ter uitsluiten van maligniteit.
Gebruik als leidraad de indicaties zoals in de modules Diagnostiek zijn beschreven.
Betrek bij het maken van de behandelingskeuze de klinische en demografische factoren, de voorkeuren van de patiënt en de beschikbaarheid van hoge kwaliteit echografie voor de preoperatieve evaluatie en voor de follow-up. Overweeg hierbij om gebruik te maken van een keuzehulp.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de verschillen in klinische uitkomsten tussen twee verschillende chirurgische behandelingen, namelijk hemithyreoïdectomie (HT) vs. totale thyreoïdectomie (TT). Tot en met 18 juli 2022 werden er 2 systematische reviews en 2 observationele cohortstudies gevonden. De wens van de werkgroep was om onderscheid te maken tussen multifocale en unifocale schildkliercarcinomen. In de huidige literatuur is dit onderscheid beperkt. Om deze reden is besloten om de PICO vraag te focussen op low risk schildkliercarcinomen met een diameter van > 1 cm en ≤ 4 cm.
De conclusies voor de cruciale uitkomstmaten ‘overall survival’ en ‘disease specific survival’ zijn gegradeerd met GRADE laag. Er wordt niet afgewaardeerd. De gepoolde effectschatters tonen geen klinisch relevante verschillen aan tussen de twee interventies. Ditzelfde geldt voor de sensitiviteitsanalyses waarin alleen studies zijn geïncludeerd die data rapporteren van meer dan 1000 patiënten per arm. De conclusie voor de cruciale uitkomstmaat recurrence rate wordt gegradeerd met GRADE zeer laag. Er wordt afgewaardeerd voor inconsistentie, omdat de studies wisselende resultaten laten zien.
De overall bewijskracht is ‘zeer laag’. Dit is gebaseerd op de laagste bewijskracht van de cruciale uitkomstmaten.
De conclusie voor de uitkomstmaat disease free survival wordt gegradeerd met GRADE
laag. Er wordt afgewaardeerd voor inconsistentie, omdat de effectschatter van de verschillende studies wisselende resultaten laten zien. De gepoolde effectschatter toont geen klinisch relevant verschil aan tussen de twee interventies.
De conclusie voor de uitkomstmaat complicaties wordt gegradeerd met GRADE zeer laag. Er is afgewaardeerd voor het risico op bias. Mogelijk is er een voordeel voor de HT groep. De geïncludeerde studies laten zien dat complicaties vaker voorkomen bij patiënten die TT ondergaan in vergelijking met HT (Rodriquez-Schaap, 2020; Xu, 2021).
Het is niet mogelijk om een conclusie te trekken voor kwaliteit van leven, omdat deze uitkomstmaat niet gerapporteerd is in de geïncludeerde studies.
Kwaliteit van leven
De huidige zoekstrategie heeft geen literatuur gevonden m.b.t. de uitkomstmaat kwaliteit van leven. In 2022 heeft Landry (2022) een systematische review gepubliceerd waarin kwaliteit van leven na een TT of HT wordt beschreven. Circa 25 internationale studies zijn geïncludeerd in deze review. In deze studies zijn verschillende meetinstrumenten gebruikt om de uitkomstmaat te onderzoeken. De review beschrijft dat patiënten die een TT ondergaan meer beperkingen ervaren in vergelijking met patiënten die een HT ondergaan. Er is echter geen overtuigend bewijs dat er blijvende verschillen zijn tussen patiënten die een TT of een HT ondergaan. Een uitgebreidere beschrijving van de bevindingen zijn weergegeven in hieronder weergegeven.
Omdat de zoekstrategie geen publicaties over kwaliteit van leven heeft opgeleverd, zullen we de belangrijkste bevindingen bespreken uit een systematische review die in 2022 is gepubliceerd (Landry, 2022).
Landry (2022) voerden een systematische review uit, geregistreerd in PROSPERO (CRD4202155007), over onderzoeken die de kwaliteit van leven van patiënten na TT of lobectomie (LT) rapporteerden. De eerste zoekopdracht leverde 2507 hits op; na het verwijderen van duplicaten en het screenen op geschiktheid, bevatten ze uiteindelijk 25 artikelen. Deze 25 onderzoeken kwamen voornamelijk uit China (n=6), de VS (n=4) en Nederland (n=4; de Van Gerwen-studie in het overzicht is ten onrechte toegewezen aan de VS, maar bevatte gegevens uit Nederland) en er werd gebruik gemaakt van 23 onderzoeken. Van deze onderzoeken hadden 9 onderzoeken een vergelijking voor fysieke kwaliteit van leven, 10 voor psychologische kwaliteit van leven en 7 sociale kwaliteit van leven tussen TT en LT.
Van de negen onderzoeken die rapporteerden over de fysieke kwaliteit van leven, rapporteerden er vier een verlaging van een van de subscores. Merk op dat in 3 van de 4 onderzoeken uitsluitend micro PTC-patiënten werden geïncludeerd. In één onderzoek werd een voorbijgaande beperking gevonden die zes en twaalf maanden postoperatief niet meer significant was. Drie onderzoeken vonden geen verschillen en twee onderzoeken rapporteerden verbeterde kwaliteit van leven in de TT versus LT-groep. Slechts 3 van de 9 onderzoeken hadden meer dan 50 patiënten per arm.
Van de tien onderzoeken die rapporteerden over de psychologische kwaliteit van leven, vonden er vier geen verschillen (1 onderzoek: >50 patiënten/arm). In vier onderzoeken werd een verlaging van een subscore van het psychologische KvL-instrument waargenomen, waaronder drie onderzoeken met <50 patiënten/arm en één onderzoek waarin de KvL werd beoordeeld < 1 maand na de operatie, in de TT versus LT-groep. Eén onderzoek rapporteerde een maand na de operatie meer angst, depressie en psychologische symptomen in de TT- versus LT-groep; dit verdween echter na 3, 6 en 12 maanden. Eén onderzoek rapporteerde een verbetering van de psychologische kwaliteit van leven in de TT versus LT-groep (>50 patiënten/arm).
Van de zeven onderzoeken die rapporteerden over de sociale kwaliteit van leven, vonden er drie een verminderde sociale kwaliteit van leven in de TT versus LT-groep (alle <50 patiënten/arm). Twee onderzoeken vonden een voorbijgaande afname in de TT versus LT-groep (>50 patiënten/arm), die na één jaar verdween. Eén onderzoek vond geen verschillen en één onderzoek vond een verbetering (>50 patiënten/arm).
Van de 7 onderzoeken die rapporteerden over de mondiale kwaliteit van leven, vonden 4 onderzoeken geen verschillen (3 onderzoeken: < 50 patiënten/arm), één vond een afname in de TT versus LT-groep (<50 patiënten/arm). De twee andere onderzoeken (>50 patiënten/arm) vonden een voorbijgaande afname.
Van de 3 onderzoeken die rapporteerden over het gebruik van LT4 na een operatie, gebruikten in 2 onderzoeken alle patiënten in de TT- en LT-groepen LT4-suppletie en in 1 onderzoek gebruikte 100% en 66% in de TT- en LT-groep LT4-suppletie.
De onderzoeken met het meest robuuste ontwerp (prospectief ontwerp, >50 patiënten/arm) duiden op een voorbijgaande afname van sommige domeinen van kwaliteit van leven in de TT- versus LT-groepen, die allemaal verdwenen na 6 en 12 maanden postoperatief.
Samen met de beschikbare kwaliteit van leven-instrumenten is er geen overtuigend bewijs dat er aanhoudende verschillen in kwaliteit van leven bestaan tussen patiënten met gedifferentieerde schildklierkanker die worden behandeld met TT of LT.
Overige literatuur
Er zijn 4 studies verricht welke de TT vergeleken hebben met de HT m.b.t. overall survival (OS) op basis van de National Cancer Database (NCDB). Een van deze studies (Rajjoub 2018) is niet gevonden via de zoekterm uitvraag. Daarnaast is een van de studies (Stevens 2023) gepubliceerd na de zoekterm uitvraag. De benoemde studies zijn gebaseerd op dezelfde database waarop het artikel van MacKinney (2022) gebaseerd is. Omdat deze studies verschillende uitkomsten laten zien op basis van dezelfde database en de basis zijn voor meerdere internationale richtlijnen worden deze separaat besproken.
De eerste studie van Bilimoria (2007) werd verricht in de periode 1985-1998 en het betrof 52173 patiënten met een papillair schildkliercarcinoom. Voor tumoren < 1 cm, was er geen significant verschil tussen een TT en een HT m.b.t. OS. Voor tumoren ≥ 1 cm, en 1 - 2 cm was er echter een significant verschil in OS ten faveure van de TT. Op basis van deze resultaten werd geconcludeerd dat een TT verricht moest worden bij een PTC ≥ 1 cm. Commentaar op deze studie was dat de multivariabele analyse geen rekening hield met comorbiditeit, multifocaliteit, extra-thyreoidale extensie en radicaliteit.
Adam (2014) verrichte daarom een retrospectieve studie met dezelfde NCDB maar nu met 61775 PTC patiënten met een tumor > 1 cm uit een latere periode (1998-2006) waarbij nu wel rekening werd gehouden met bovenstaande prognostische factoren. In de TT-groep werden ongunstiger tumoren behandeld met vaker een positieve marge, extra-thyreoidale extensie en multifocaliteit. Ongecorrigeerde data toonden net zoals in de studie van Bilimoria (2007) een betere OS ten faveure van de TT (Figuur 1). Na multivariabele correctie voor bovenstaande factoren verdween dit verschil echter bij zowel patiënten met een tumor van 1-2 cm als 2.1-4.0 cm. Opvallend was een schijnbaar tegenstrijdig positief effect van RAI-behandeling op OS in alle groepen, wat suggereert dat er een selectie bias zou kunnen zijn. Echter wordt in deze studie geen onderscheid gemaakt tussen de patiënten die een ablatieve (gericht op het vernietigen van resten normaal schildklierweefsel) en een adjuvante (gericht het vernietigen van eventuele microscopische resten schildkliercarcinoom) RAI-behandeling hebben ondergaan, dat ook een bias bron kan zijn. Bovendien was in deze studie niet bij alle geïncludeerde patiënten data betreffende prognostische factoren bekend.
Rajjoub (2018) verrichte vanuit dezelfde NCDB-database een studie met 33816 patiënten uit een nog latere periode (2004-2008), echter verdeelde deze patiënten op basis van hun histologie in een groep van klassieke PTC (n= 21589, CPTC) en een groep met de folliculaire variant van het papillair schildklier carcinoom (n=10917, FVPTC). Bovendien werden alle patiënten waarbij multifocaliteit en extra-thyreoidale extensie onbekend was, geëxcludeerd. Alle tumoren waren tussen de 1 en 3.9 cm. Er werd gecorrigeerd voor dezelfde factoren als in de studie van Adam (2014). De ongecorrigeerde OS was significant beter voor TT in de CPTC-groep, terwijl dit niet het geval was voor de FVPTC-groep. Na multivariabele correctie voor de bekende factoren verdween het verschil tussen TT en HT in de gehele CPTC-groep met tumoren van 1-3.9 cm. Stratificatie op tumorgrootte liet nog steeds geen significant verschil ten faveure van de TT in de CPTC-groep 1-2 cm, echter wel bij patiënten met een tumor 2-3.9 cm (HR 1.53, CI 1.06-2.19, p=0.03). Commentaar op deze studie zou kunnen zijn dat de gemiddelde follow-up duur van 6.5 jaar relatief kort is ten opzichte van de andere studies en de relatieve gunstige prognose van het schildkliercarcinoom, echter zelfs in deze relatieve korte follow-up werd reeds een significant verschil gevonden ten faveure van de TT in de groep 2-3.9 cm.
Stevens (2023) verrichtte de meest recente cohortstudie gebruikmakend van NCDB-data van 84.300 patiënten met een papillair schildkliercarcinoom over de periode 2004-2017. Er werden geen patiënten geïncludeerd die RAI hadden ontvangen. OS was de primaire uitkomstmaat. De unieke aspecten van deze studie waren de complexe robuuste statistische methoden, waarbij de invloed van leeftijd, tumorgrootte en risicoclassificatie niet dichotoom met een afkapwaarde werden onderzocht, zoals in voorgaande studies, maar incrementeel in kleine stappen van respectievelijk 10 jaar, 1 cm, en 5 risicogroepen. De belangrijkste conclusie was dat voor geen enkele leeftijdscategorie, tumorgrootte of risicogroep er een verschil was tussen HT en TT met betrekking tot overall survival. Belangrijk om te beseffen is dat in deze studie geen RAI werd toegepast en dat er geen uitspraken konden worden gedaan ten aanzien van recidief risico, complicatie risico, kans op re-interventie en verschil in kwaliteit van leven tussen HT en TT. Echter deze analyse bevestigt dat de keuze voor een TT dan wel HT geen invloed heeft op de overleving in deze populatie.
Verschillen in Nederlandse work-up vs. internationaal beleid
Nederland heeft wereldwijd een uniek beleid ten aanzien van de work-up van schildkliernoduli. Dit wordt ook weerspiegeld in de epidemiologie van de schildkliercarcinomen in Nederland. Zie voor een uitgebreidere toelichting het onderdeel Epidemiologie in de module Algemene inleiding. Het meer restrictieve beleid ten aanzien van diagnostiek van schildkliernoduli die niet als klinisch relevant worden geschat (zoals de schildklier incidentalomen) maakt dat er in Nederland vaker meer uitgebreide ziekte (bijvoorbeeld lymfkliermetastasen) wordt getroffen zelfs bij kleine primaire tumoren. Om de internationale literatuur te vertalen naar de Nederlandse situatie is het wenselijk deze verschillen inzichtelijk te hebben.
Dat het verschil in diagnostische work-up mogelijk tot verschillen in bronpopulaties leidt, wordt gereflecteerd door een artikel waarin een Nederlandse database en een Duitse database met elkaar vergeleken zijn t.a.v. PTC/FTC’s tussen 2002 en 2015 (van Velsen, 2023). Nederlandse PTC’s <4 cm hadden significant vaker lymfekliermetastasen (36 vs. 22%, berustend op een significant verschil in de groep van patiënten met PTC <1 cm) en metastasen op afstand (6% vs. 3%, berustend op een significant verschil in de groep van patiënten met PTC < 2 cm). Een recente analyse van laag risico PTC’s (<4 cm, cN0) uit Nederland (IKNL/ PALGA) heeft gekeken naar de kans op ipsilaterale multifocaliteit (41.8%) en het risico op bilaterale ziekte. Bij unifocale ziekte had 25% contralateraal een maligniteit, bij multifocale ziekte was dit 43% (Rodriguez Schaap, 2023). Dit is vergelijkbaar met de internationale literatuur. Vanuit diezelfde database is gekeken naar de recidief risico’s na behandeling van een laag risico PTC (1-4cm PTC, cN0M0, NIFTP niet geïncludeerd) in Nederland (Lin, 2022). In die tijdsperiode werd 84% (n=756) behandeld met een TT+ RAI en heeft 5% (n=49) een HT als definitieve behandeling ondergaan. Bij 137 personen werd geen RAI gegeven na een TTx. In totaal was het recidief risico 2.6% na een mediane follow-up duur van 7.7 jaar. Dit is aanzienlijk lager dan gemeld in de internationale literatuur, hetgeen verklaard kan worden door selectie bias van de “beste patiënten” voor deze de-escalerende strategie. Na een propensity matched analyse was een HT geen risicofactor voor het krijgen van recidief ziekte. Deze studie kent beperkingen omdat deze is gebaseerd op de IKNL/PALGA registratie, wat geen gebruik maakt van volledige klinische gegevens van de patiënten. Daarnaast geldt dat deze retrospectieve studies niet voldoende statistische power hebben om een significant verschil vast te stellen.
Kortom, verschillen in diagnostische work-up leiden mogelijk tot verschuivingen in de kenmerken van bronpopulaties. Door de aanwezigheid van grote proporties gediagnosticeerde kleine indolente PTCs in de internationale cohorten kunnen de ziekte specifieke mortaliteitsrisico’s, recidiefrisico’s en metastaserisico’s groter zijn voor de Nederlandse populatie. In het algemeen zijn de overlevingscijfers voor patiënten met een goed gedifferentieerd schildkliercarcinoom in Nederland uitmuntend.
Factoren die geschikt worden geacht voor het maken van een behandelingskeuze bij patiënten met een laag risico schildkliercarcinoom
Deze zijn gebaseerd op expert opinie en consensus naar aanleiding van de bestaande literatuur en rekening houdend met de toepassing in de Nederlandse situatie. Deze factoren kunnen in de praktijk gebruikt worden als handvat/ondersteuning bij de gedeelde besluitvorming tussen een HT gevolgd door follow-up of een TT eventueel gevolgd door RAI. De factoren worden samengevat in Tabel 1 en Tabel 2.
Tabel 1. Voorwaarden waaraan moet worden voldaan om een adequate gedeelde besluitvorming over een de-escalerend beleid te kunnen verrichten
|
- Alleen indien het laag risico schildkliercarcinoom van > 1 cm en ≤ 4 cm op basis van klinische, radiologische en (indien beschikbaar) histologische karakteristieken voldoet aan de criteria zoals in de initiële risicoclassificatie module is gedefinieerd.# |
|
|
- Hoge kwaliteit echo hals en radiologische expertise is beschikbaar voor de besluitvorming en tijdens de follow-up (Park, 2018) |
|
|
- Indien bij de patiënt het schildkliercarcinoom is vastgesteld als toevalsbevinding na een schildklieroperatie voor een andere (diagnostische) indicatie dient opnieuw een echo van de hals plaats te vinden. |
|
|
- Indien bij de patiënt het schildkliercarcinoom is vastgesteld op basis van een FNAC en men een de-escalerend beleid overweegt, is het te overwegen de echo van de hals te herhalen met de wetenschap van de aanwezige maligniteit.
|
|
|
- Patiënt moet adequaat geïnformeerd kunnen worden over beide behandelstrategieën. Specifiek dient aan bod te komen: |
Na een HT zal follow-up alleen door middel van echografie van de hals plaatsvinden (er kan niet betrouwbaar gebruik worden gemaakt van Tg-bepalingen in de follow-up na een HT) |
|
Uitleg over de kans op alsnog een latere completerende thyreoïdectomie op de langere termijn bij een recidief en/of noodzaak tot RAI. De kans op een aansluitende completerende thyreoïdectomie na initieel een hemithyreoïdectomie is na histologisch onderzoek waarschijnlijk rond de 20-50%. (Kluijfhout, 2017; Dhir, 2018; Lang, 2017). |
|
#Uitzondering: een hemithyreoïdectomie kan overwogen worden in specifieke gevallen, wanneer men vooraf aan de primaire operatie heeft besloten na gedeelde besluitvorming dat er geen behandeling met radioactief jodium zal plaats vinden. Dit kan ook het geval zijn wanneer men na de hemithyreoïdectomie een pT3a tumor heeft gevonden die afgezien van de pT3a stadium voldoet aan de criteria voor een laag risico en na gedeelde besluitvorming besluit om af te zien van de behandeling met radioactief jodium. Bij tumoren die preoperatief laag risico lijken, maar dus wel in de intermediaire risicogroep zitten puur qua afmeting (pT3a) is een preoperatieve behandelstrategie bepaald door endocrinoloog, chirurg en nucleair geneeskundige extra van belang. Dit om te voorkomen dat men als chirurg, met de intentie om RAI te geven, een totale thyreoïdectomie heeft verricht waar vervolgens door de nucleaire geneeskunde van afgezien wordt. Deze situaties zullen zich weinig voordoen in de praktijk.
Tabel 2. Argumenten voor een hemithyreoïdectomie vs. totale thyreoïdectomie.
|
Mogelijke argumenten voor een HT gevolgd door echografische follow-up |
Mogelijke argumenten voor een primaire TT of aansluitende completerende thyreoïdectomie (na een initiële HT) (eventueel) gevolgd door behandeling met RAI |
|
Een laag risico schildkliercarcinoom incidentaloom, aangezien deze patiëntencategorie beter overeenkomt met de patiënten geïncludeerd in de grote retrospectieve series. |
Radiotherapie op kinderleeftijd in de voorgeschiedenis. |
|
Behoud van schildklierfunctie wordt gewenst. Voorkomen van blijvende hypothyreoïdie waarvoor substitutietherapie noodzakelijk is. |
Familiegeschiedenis van schildkliercarcinoom. |
|
Aanwezigheid van comorbiditeit die escalatie naar TT obsoleet maken. |
Radiologisch suspecte en/of pathologische lymfklieren die niet bereikbaar zijn voor FNAC |
|
|
Bij echografische (verdenking op) extrathyreoidale extensie en/of intra-operatieve bevindingen en/of histologisch bewezen extrathyreoidale uitbreiding. |
|
|
Er zijn enkele factoren die in de literatuur onvoldoende bestudeerd zijn als factor in een de-escalerende setting. De onzekerheid omtrent deze factoren kan een reden zijn om de TTx met RAI te verkiezen boven de HT, zeker indien meerdere factoren aanwezig zijn. Deze factoren zijn:
|
|
|
Intentie om adjuvante therapie met RAI mogelijk te maken. |
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De chirurgische behandeling van patiënten met een laag risico schildkliercarcinoom is voorkeursgevoelig. Om die reden is het noodzakelijk om de behandelingsbeslissing te nemen door arts en patiënt in de vorm van gedeelde besluitvorming waarbij de voor- en de nadelen van de behandelopties en ook de persoonlijke waarden van de patiënt aan de orde komen. Samen met de artsen en patiënten zijn hiervoor in Nederland instrumenten ontwikkeld die gebruikt kunnen worden bij het gedeelde besluitvormingsgesprek. In het gesprek dienen de verschillende uitkomstmaten besproken te worden met de patiënt (en hun naasten). De risico’s op complicaties van een uitgebreidere operatie en blijvende hypothyreoïdie met de gevolgen van dien bij een TT moeten afgezet worden tegen de noodzaak tot aanvullende echografische onderzoeken voor follow-up in plaats van Tg-bepaling alleen bij een HT en de mogelijkheid dat een initieel beperktere operatie gevolgd dient te worden door een totaliserende schildklieroperatie wanneer de tumor uitgebreider blijkt te zijn dan preoperatief verwacht.
Kosten (middelenbeslag)
Het is onzeker of een de-escalerend beleid ten aanzien van de chirurgische behandeling voor schildkliercarcinoom tot kostenbesparing kan leiden. Bij patiënten die uiteindelijk met HT voldoende worden geholpen kunnen de operatiekosten gereduceerd worden (kortere operatietijd), evenals de kosten voor levenslange controles vanwege de blijvende hypothyreoïdie, en er zijn geen kosten gerelateerd aan de behandeling met radioactief jodium (Paluskievicz, 2022). In de follow-up zullen echter meer echografische onderzoeken plaatsvinden aangezien Tg als tumormarker bij deze patiënten niet gebruikt kan worden. Verder kunnen bij een aantal patiënten die een re-operatie moeten ondergaan voor een rest-thyreoïdectomie de kosten toenemen door deze tweede operatie. Aangezien het risico op recidief ongeveer gelijk is, zullen de kosten voor eventuele behandeling van een recidief ook gelijk zijn bij de twee behandelopties.
Aanvaardbaarheid, haalbaarheid en implementatie
Om een de-escalerend beleid met gedeelde besluitvorming samen met de patiënt vorm te kunnen geven dient aan een aantal belangrijke voorwaarden te voldoen. Dit kan betekenen dat de protocollen met betrekking tot preoperatieve diagnostiek en follow-up aangepast moeten worden. Zo dient een preoperatieve echografie van de hals van hoge kwaliteit geïmplementeerd te worden bij alle patiënten die een operatie ondergaan voor een (verdenking op) schildkliercarcinoom (zie ook module Diagnostiek voor de aanvullende voorwaarden). Deze echografie moet ook geïmplementeerd worden bij de patiënten die vervolgd worden na de HT. De artsen die patiënten met schildkliercarcinoom behandelen (in het bijzonder de chirurg) worden geacht om in het gesprek met de patiënten de gedeelde besluitvorming toe te passen. De arts wordt ook geacht bekend te zijn met de principes en de uitvoering van een gedeelde besluitvorming gesprek. Dit kan bijvoorbeeld door een specifieke training (online of fysiek) voor toepassing van gedeelde besluitvorming te volgen. Ook praatkaarten voor artsen ontwikkeld door de Nederlandse Federatie van Kankerpatiënten organisaties (NFK) kunnen gebruikt worden, zie bijv. hier. De instrumenten voor gedeelde besluitvorming dienen geactualiseerd te worden naar aanleiding van de toekomstige literatuur. Voor de patiënten die de Nederlandse taal niet beheersen zijn deze instrumenten momenteel niet beschikbaar. Engelstalige instrumenten zijn wel beschikbaar, echter deze zijn nog niet in grote studies gevalideerd. Ook bij het besluitgesprek met patiënten met een migratieachtergrond dient rekening worden te houden met de culturele achtergrond van de patiënt, dit gesprek dient (bij voorkeur) plaats te vinden in aanwezigheid van een gecertificeerde onafhankelijke tolk.
Voor de implementatie van dit beleid adviseert de werkgroep om kandidaten voor een de-escalerend beleid te bespreken in een MDO in aanwezigheid van een level 1 expertisecentrum. De implementatie van meer gepersonaliseerde zorg dient goed gemonitord te worden in de praktijk.
Rationale van de aanbeveling:
In de literatuur wordt de patiëntenpopulatie die in aanmerking komt voor de behandelingskeuze TT vs. HT vaak gedefinieerd op basis van de afmeting van de tumor (tussen 1-4 cm). Andere klinische en histologische kenmerken die gebruikt worden om het laag risico te definiëren zijn vaak niet of onvoldoende gedefinieerd. Om de behandelingskeuze te kunnen maken voor deze patiënten is het essentieel dat al deze factoren meegewogen worden. Een hoge kwaliteit preoperatieve echografie van de hals kan informeren over een deel van deze factoren (zoals aanwezigheid van cervicale lymfkliermetastasen en/of extrathyreoidale extensie).
Om in aanmerking te komen voor een HT als optie voor definitieve behandeling voor een laag risico >1 en < 4 cm schildkliercarcinoom, dient aan alle criteria te voldoen die bij de definitie van laag risico (zie module Risicostratificatie) horen. Aangezien een deel van deze criteria alleen maar peroperatief of bij histologisch onderzoek vastgesteld kunnen worden, bestaat er een kans dat de patiënt na een initieel besluit tot HT alsnog een rest-thyreoïdectomie moet krijgen. In de literatuur, inclusief in een Nederlandse serie, blijkt dat bij 20-50% van de patiënten het geval te zijn. De patiënten dienen wel hierover geïnformeerd te worden vooraf aan de initiële operatie. Gezien het feit dat de Nederlandse schildkliercarcinoom populatie relatief meer patiënten betreft met meer uitgebreide ziekte (zoals cervicale lymfkliermetastasen) bij presentatie, inclusief in de categorie van patiënten met kleine tumoren, als gevolg van terughoudendheid in diagnostiek van klinisch niet relevante schildkliernoduli, is de verwachting dat een de-escalerend chirurgisch beleid minder vaak van toepassing kan zijn dan internationaal. In Nederland worden de klinisch relevante tumoren al in een diagnostische fase voorgesorteerd. Desalniettemin blijven de twee behandelopties ook in Nederland van toepassing voor de patiënten die aan alle genoemde voorwaarden voldoen. Omdat de toepassing van een de-escalerend beleid relatief nieuw is en nog niet uitgebreid geïmplementeerd is in Nederland, is de werkgroep van mening dat het definitieve besluit over de behandeling bij voorkeur besproken wordt in een MDO met een centrum die expertise heeft met de-escalatie beleid, zoals een level 1 ziekenhuis.
Voor het vaststellen of een patiënt met een tumor tussen 1-4 cm in aanmerking kan komen voor de behandelingskeuze TT vs. HT is het nodig om preoperatief de uitgebreidheid van de tumor vast te stellen (extrathyreoidale extensie, mogelijke multifocaliteit) en cervicale lymfkliermetastasen uit te sluiten. Indien bij de patiënt het schildkliercarcinoom is vastgesteld als toevalsbevinding bij een schildklieroperatie voor een andere indicatie en de echografie van de hals (inclusief het beoordelen van de cervicale lymfklieren) niet heeft plaats gevonden, dient deze alsnog plaats te vinden voordat de behandelingskeuze besproken wordt met de patiënt.
Multifocaliteit komt relatief vaak voor bij het schildkliercarcinoom, met bilaterale multifocaliteit vaker voorkomend bij multifocale ipsilaterale ziekte. Bij contralaterale noduli vastgesteld preoperatief middels echografie die suspect zijn voor maligniteit dient zo nodig een maligniteit uitgesloten te worden door middel van een FNA. Noduli met niet-suspecte kenmerken kunnen echografisch vervolgd worden.
De prognose van patiënten met een laag risico gedifferentieerd schildkliercarcinoom is uitstekend. De patiënten hebben een zeer lange ziekte specifieke overleving en een lage kans op recidief na volledige resectie van de tumor. Er zijn aanwijzingen in de literatuur dat deze uitkomstmaten vergelijkbaar zijn bij de patiënten die een uitgebreide primaire behandeling middels een TT en bij de patiënten die een minder uitgebreide operatie hebben ondergaan, in de vorm van een HT. Daarentegen zijn de risico’s op complicaties hoger bij de meer uitgebreide operatie en de patiënten die een TT ondergaan moeten levenslang schildklierhormoon substitutie krijgen. Blijvende hypothyreoïdie waarvoor substitutietherapie noodzakelijk is wordt echter ook gerapporteerd bij ongeveer 29,9% (24,6-35,2%) van patiënten na HT in een recente meta-analyse (Li, 2021). Er zijn geen aanwijzingen dat de uitgebreidheid van de operatie een blijvend effect heeft op de lange termijn kwaliteit van leven. Of binnen de groep van patiënten met 1-4 cm grote klassieke papillaire schildkliercarcinomen een subgroep met grotere tumoren (tussen 2-4 cm) een OS-voordeel heeft bij een TT (gevolgd door 131I behandeling) blijft controversieel. De TT wordt in de praktijk gevolgd door een behandeling met 131I voor ablatie van de resten (normaal) schildklierweefsel. Er zijn geen aanwijzingen in de literatuur dat deze ablatieve behandeling bijdraagt aan de oncologische uitkomsten van de laag risico patiënten. In de literatuur wordt in de grote retrospectieve studies geen onderscheid gemaakt tussen het toedienen van ablatieve behandeling en de adjuvante 131I behandeling bij de patiënten met 1-4 cm tumoren. De ablatieve behandeling kan echter wel zorgen voor een niet aantoonbaar Tg waardoor deze gebruikt kan worden als tumormarker in de follow-up. Voor oncologische eindpunten is een TT alleen maar van toepassing als deze gevolgd wordt door een behandeling met 131I. De bewijslast van de literatuur wordt gegradeerd als zeer laag (mede door de retrospectieve aard van de cohortstudies en het feit dat er geen onderscheid wordt gemaakt tussen wel/geen RAI).
Onderbouwing
Achtergrond
De voormalige richtlijn beschreef dat bij patiënten met een goed gedifferentieerd unifocaal schildklier carcinoom > 1 cm een totale thyreoïdectomie en aanvullend RAI geïndiceerd is. De laatste tijd is er toenemend aandacht voor een de-escalerend beleid in de behandeling van het laag risico gedifferentieerd schildkliercarcinoom (zie module Risicostratificatie). Als alternatief zou men kunnen volstaan met een hemithyreoïdectomie. Beide behandelstrategieën hebben voor- en nadelen. In deze module pogen wij een zo compleet mogelijk overzicht te geven met handvaten voor juiste behandelkeuzen.
Conclusies / Summary of Findings
|
Low GRADE |
The evidence suggests that a hemithyroidectomy does not affect overall survival when compared total thyroidectomy (with/without RAI) in patients with low-risk differentiated thyroid cancer (tumorsize >1 and < 4 cm).
Source: Bojoga, 2020; MacKinney, 2022. |
|
Low GRADE |
The evidence suggests that a hemithyroidectomy does not reduce or increase disease-specific survival when compared total thyroidectomy (with/without RAI) in patients with differentiated thyroid cancer (tumorsize >1 and < 4 cm).
Source: Bojoga, 2020. |
|
Very low GRADE |
The evidence is very uncertain about the effect of hemithyroidectomy on recurrence rate when compared total thyroidectomy (with/without RAI) in patients with differentiated thyroid cancer (tumorsize >1 and < 4 cm).
Source: Bojoga, 2020; Rodriquez-Schaap, 2020; Xu, 2021 |
|
Very low GRADE |
The evidence is very uncertain about the effect of hemithyroidectomy on disease-free survival when compared total thyroidectomy (with/without RAI) in patients with differentiated thyroid cancer (tumorsize >1 and < 4 cm).
Source: Bojoga, 2020. |
|
Very low GRADE |
The evidence is very uncertain about the effect of hemithyroidectomy on complications when compared total thyroidectomy in patients with differentiated thyroid cancer (tumorsize >1 and < 4 cm).
Source: Rodriquez-Schaap, 2020; Xu, 2021 |
|
- GRADE |
No evidence was found regarding the effect of hemithyroidectomy on quality of life when compared with total thyroidectomy (with/without RAI) in patients with differentiated thyroid cancer (tumorsize >1 and < 4 cm).
Source: Bojoga, 2020; Rodriquez-Schaap, 2020; MacKinney, 2022; Xu, 2021. |
Samenvatting literatuur
Description of studies – systematic reviews
The systematic review (SR) and meta-analysis by Bojoga (2020) assessed clinical outcomes in patients with differentiated non-medullary thyroid cancer (DTC) 1-4 cm in diameter and without evidence of locoregional and/or distant metastases (defined as low-risk DTC). Thyroid hemithyroidectomy (HT) was compared with total thyroidectomy (TT) combined with or without postoperative radioactive iodine (RAI) therapy. According to the SR, RAI was not administered to some patients in the included studies. RAI was not administered in the study by Vaisman (2011), information on RAI was not available in the studies by Sanders (1998) and Shaha (1997), while in other studies only some of the patients received RAI (Shah (1993) - “only a few received RAI”; Samaan (1983) - 34% received RAI; Hassanain (2010) - 28% of the patients received RAI; Ito (2010) - 0.1% of the patients had RAI therapy).
The meta-analysis by Bojoga (2020) estimated the risk ratio (RR) of any thyroid cancer-related recurrence rate, overall survival (OS), disease-free survival (DFS) and disease specific survival (DSS). Recurrence rate was defined exclusively as new structural recurrences (either in the thyroid bed or in the nonremoved thyroid tissue, the (cervical) lymph nodes, or distant metastases) confirmed by imaging and/or pathological examination (Bojoga, 2020). In total 16 retrospective (population-based) cohort studies with 175,430 patients met the inclusion criteria. The meta-analysis of any DTC-related recurrence was based on 60,534 patients in 11 studies with a median follow-up of 10 years. For the meta-analysis of DFS, data of 5,967 patients from 7 studies with a median follow-up of 10 years were used. Pooled RR for OS was based on 160,084 patients in 11 studies with a median follow-up of 7 years. The meta-analysis of DSS included 43,715 patients in 10 studies with a median follow-up of 11 years. There was a high degree of heterogeneity in the included studies.
The systematic review and meta-analysis by Rodriguez-Schaap (2020) assessed the effect of HT versus TT with or without RAI therapy on the recurrence and overall mortality in patients with differentiated (papillary or follicular) T1–2N0 thyroid cancer 0-4 cm in diameter. The primary endpoints were recurrence rate and time to recurrence. Secondary endpoints were overall survival and perioperative morbidity, including laryngeal nerve damage, hypoparathyroidism and hypocalcemia. The SR included 10 articles, which all were observational cohort series, representing a total of 23,134 patients, of which 17,699 patients with low-risk differentiated thyroid cancer 0-4 cm were included in the meta-analysis. Six studies included patients who had TT followed by RAI treatment. However, the SR included only 3 studies that reported outcomes for thyroid tumors sized 1-4 cm. These studies were included in the current summary of literature.
Description of studies – additional studies
MacKinney (2022) described a retrospective cohort based on data from a national database in the USA. They examined whether surgery extent and iodine radiation administration affect overall survival for cT2N0M0 classic papillary thyroid cancer according to age and sex.
In total 32147 patients were included as they met the inclusion criteria (see evidence tables for details). Of them 16534 (51%) were aged between 18-45 years, 7203 (22%) between 46-55 years, and 8410 (27%) older than 55 years. The median follow-up was not mentioned.
Data were described per age category. An overview of the number of patients per treatment is shown in Table 1. The following relevant outcomes were included: overall survival. The risk of bias is assessed as ‘some concerns’.
Table 1. Patients’ characteristics MacKinney (2022)
|
Surgery |
All |
18-45 years |
46-55 years |
> 55 years |
|
Lobectomy without RAI |
1189 (3.7%) |
559 (3.4%) |
260 (3.6%) |
370 (4.4%) |
|
Total thyroidectomy without RAI |
9,314 (29.0%) |
4,786 (28.9%) |
2,016 (28.0%) |
2,512 (29.9%) |
|
Total thyroidectomy with RAI |
21,644 (67.3%) |
11,189 (67.7%) |
4,927 (68.4%) |
5,528 (65.7%) |
Xu (2021) described a retrospective cohort based on data from a hospital in China. They evaluated the benefits and harms of HT and TT in 1-4 cm DTC.
In total 795 patients were included as they met the inclusion criteria (see evidence tables for details). Thereafter, patients were matched according to propensity score matching. Therefore, 552 patients were included in the analyses. The median age of the patients who underwent HT was 37, 77% were female, and the duration of follow-up was 53.8 months. The median age of the patients who underwent TT was 38, 77% were female, and the duration of follow-up was 59.0 months. The following relevant outcomes were included: disease-free survival (total recurrence), and complications. The risk of bias is low.
Results
The results are described per outcome measure. If possible, outcomes were pooled using a random effect model. Sensitivity analyses were performed for studies including more than 1000 patients per arm.
Overall survival (crucial)
The outcome ‘Overall survival’ was reported in two of the selected articles (Bojoga, 2020; Mackinney, 2022).
In total 160084 patients from 11 studies with a median follow-up of 7 years were included in the study of Bojoga (2020).
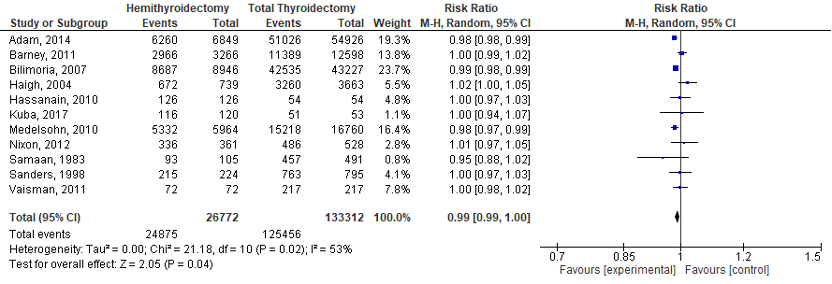
This outcome was achieved in 24875/26772 (93%) of the patients in the HT group, compared with 125456/133312 (94%) of the patients in the TT group. This resulted in a RR of 0.99 (95% 0.99 to 1.00) see Figure 1. This difference is not clinically relevant.
Figure 1. Forrest plot for overall survival.
Mackinney (2022) reported the ten-year overall survival estimates from propensity score-matched patients age group. For the age group 18-45 years (n=16534) the estimates for overall survival were 98.5, 97.1, and 99.1 for patients undergoing HT, TT, and TT with RAI, respectively. For the age group 46-55 years (n=7203) the estimates for overall survival were 95.2, 92.9, and 97.6 for patients undergoing HT, TT, and TT with RAI, respectively. And for the age group >55 years (n=8410) the estimates were 70.3, 73 and, 79.2 for patients undergoing HT, TT, and TT with RAI, respectively. No effect estimates for the comparisons were provided.
In addition to ten-year overall survival estimates, a multivariable Cox proportional hazards model (correcting for race, insurance, comorbidity, and facility type) was performed to reported hazard ratio (HR) for overall survival per age category, see Table 1. The effect estimates for the comparison HT vs. TT with RAI are clinically relevant, in favor of the TT with RAI group. The effect estimates for the other comparison are not.
Table 1. Hazard ratio with 95% confidence for overall survival.
|
Comparison |
Age 18-45 year |
Age 46-55 year |
Age > 55 years |
|
HT vs. TT with RAI |
1.75 (0.70- 4.38) |
1.61 (0.77 - 3.35)
|
1.95 (1.46 - 2.60) |
|
HT vs. TT without RAI |
1.01 (0.40 - 2.57) |
0.74 (0.35 - 1.58) |
0.82 (0.61 - 1.10) |
Sensitivity analyses
Four studies included in the SR of Bojoga (2020) included more than 1000 patients per arm, i.e., Adam (2014), Barney (2011), Bilimoria (2007), and Mendelsohn (2010). This outcome occurred in 23245/25025 (94%) of the patients in the HT group, compared with 120168/127511 (94%) of the patients in the TT group. This resulted in a RR of 0.99 (95% 0.98 to 1.00). This is in line with the overall analysis.
Disease specific survival (crucial)
The outcome ‘Disease specific survival’ was reported in one of the selected articles (Bojoga, 2020). In total 43715 patients from 10 studies with a median follow-up of 11 years were included.
This outcome was achieved in 11161/11342 (98%) of the patients in the HT group, compared with 31485/32373 (97%) of the patients in the TT group. This resulted in a RR of 1.01 (95% 1.00 to 1.01) see Figure 2. This is not clinically relevant.
Figure 2. Forrest plot for disease specific survival.

Sensitivity analyse
Two studies included in the SR of Bojoga (2020) included more than 1000 patients per arm, i.e., Barney (2011) and Medelsohn (2010). This outcome occurred in 9210/9356 (98%) of the patients in the HT group, compared with 28584/29412 (97%) of the patients in the TT group. This resulted in a RR of 1.01 (95% 1.01 to 1.02). This result is in line with the overall analysis.
Recurrence rate (crucial)
The outcome ‘Recurrence rate’ was reported in three of the selected articles (Bojoga, 2020; Rodriquez-Schaap, 2020; Xu, 2021).
Bojoga (2020) defined this outcome as any thyroid cancer-related recurrence.
In total 60534 patients from 11 studies with a median follow-up of 10 years were included in the study of Bojoga (2020).
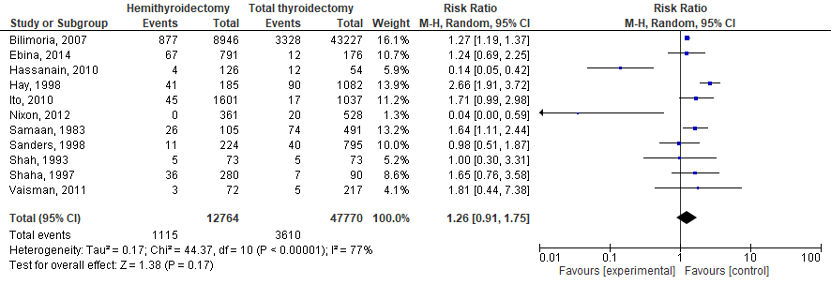
This outcome occurred in 1115/12764 (8.7%) of the patients in the HT group, compared with 3610/47770 (7.6%) of the patients in the TT group. This resulted in a RR of 1.26 (95% 0.91 to 1.75) see Figure 3. The risk difference was 0.01 (95%CI -0.01 to 0.04).
Figure 3. Forrest plot for any thyroid related recurrence.
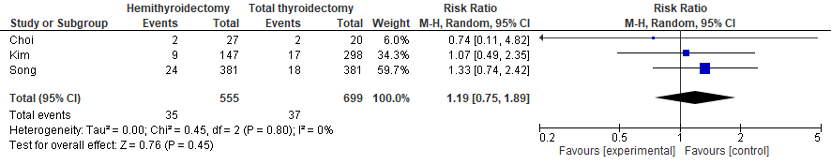
Rodriquez-Schaap (2020) used the definition of the included studies, which was mostly ‘recurrence as proven by cytology and/or pathology’.
In total 1254 patients from 3 studies with a follow-up ranging from 4.8 to 9.8 years were included the subanalyses.
This outcome occurred in 35/555 (6%) of the patients in the HT group, compared with 37/699 (5%) of the patients in the TT group. This resulted in a RR of 1.19 (95% 0.75 to 1.89), see Figure 4. The risk difference was 0.01 (95%CI -0.02 to 0.04). This is not clinically relevant.
Figure 4. Forrest plot for recurrence.
Xu (2021) defined this outcome as structural persistent/recurrent disease development. This occurred in 10/276 (4%) of the patients in the HT group, compared with 12/276 (4%) of the patients in the TT group. This resulted in a HR of 0.86 (95% 0.37 to 2.00), in favor of the HT group. This is not clinically relevant.
Sensitivity analyses
Two studies included in the SR of Bojoga (2020) included more than 1000 patients per arm, i.e., Bilimoria (2007) and Ito (2010). This outcome occurred in 922/10547 (9%) of the patients in the HT group, compared with 3345/44264 (8%) of the patients in the TT group. This resulted in a RR of 1.30 (95% 1.13 to 1.49), in favor of the TT group. The risk difference was 0.02 (95%CI 0.01 to 0.03).
Disease-free survival (important)
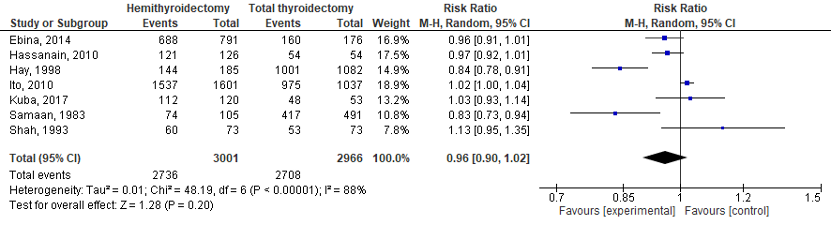
The outcome ‘Disease-free survival’ was reported in two of the selected articles (Bojoga, 2020; Xu, 2021).
In total 5967 patients from 7 studies with a median follow-up of 10 years were included in the study of Bojaga (2020).
This outcome was achieved in 2736/3001 (91%) of the patients in the HT group, compared with 2708/2966 (91%) of the patients in the TT group. This resulted in a RR of 0.96 (95% 0.89 to 1.03) see Figure 5. This difference is not clinically relevant.
Figure 5. Forrest plot for disease-free survival.
Xu (2021) reported disease-free survival before and after propensity score matching. Before matching the HR between HT (n=276) vs. TT (n=276) was 0.60 (95%CI 0.21 to 1.23). After matching, the HR was 0.88 (95%CI 0.37 to 2.00). This is not clinically relevant.
Sensitivity analyses
Only study included in the SR of Bojoga (2020) included more than 1000 patients per arm, i.e., Ito (2010). This outcome occurred in 1537/1601 (96%) of the patients in the HT group, compared with 975/1037 (94%) of the patients in the TT group. This resulted in a RR of 1.02 (95% 1.00 to 1.04).
Complications (important)
The outcome ‘complications’ was reported in two of the selected articles (Rodriquez-Schaap, 2020; Xu, 2021).
One of the three relevant studies in the review of Rodriquez-Schaap reported complications as follows: hypoparathyroidism(permanent/transient), recurrent laryngeal nerve (RLN) damage (permanent/transient). RLN damage occurred in 0% of the patients in the HT group, compared with 4.4% in the TT group. Permanent hypoparathyroidism occurred in 0% of the patients in the HT group, compared to 7.7% of the patients in the TT group. As details about number of patients were provided, it was not possible to calculate an effect estimate.
Xu (2021) reported the following complications: neck haematoma, hypoparathyroidism(permanent/transient), recurrent laryngeal nerve (RLN) palsy (permanent/transient). Any complications occurred in 43/276 (15.6%) of the patients in the HT group, and in 78/276 (28.3%) of the patients in the TT group. This resulted in HR of 0.47 (95%CI 0.31 to 0.71), in favour of the HT group. This is clinically relevant.
Quality of life (important)
The outcome quality of life was not reported in the selected articles (Bojoga, 2020; Rodriquez-Schaap, 2020; MacKinney, 2022; Xu, 2021).
Level of evidence of the literature
The level of evidence (GRADE method) is determined per comparison and outcome measure and is based on results from observational studies and therefore starts at level “low”. Subsequently, the level of evidence was downgraded if there were relevant shortcomings in one of the several GRADE domains: risk of bias, inconsistency, indirectness, imprecision, and publication bias.
The level of evidence regarding the outcome measure overall survival started as low, because the studies were observation studies. The level of evidence was not downgraded. The level of evidence for the outcome ‘overall survival’ is low.
The level of evidence regarding the outcome measure disease specific survival started as low, because the studies were observation studies. The level of evidence was not downgraded. The level of evidence for the outcome ‘disease-specific survival’ is low.
The level of evidence regarding the outcome measure recurrence rate started as low, because the studies were observation studies. The level of evidence was downgraded by one level because of inconsistency (effect estimates are inconsistent between studies). The level of evidence for the outcome ‘recurrence rate’ is very low.
The level of evidence regarding the outcome measure disease-free survival started as low, because the studies were observation studies. The level of evidence was downgraded by one level because of inconsistency (effect estimates are inconsistent between studies). The level of evidence for the outcome ‘disease-free survival’ is very low.
The level of evidence regarding the outcome measure complication started as low, because the studies were observation studies. The level of evidence was downgraded by one level because of risk of bias (due to study limitations). The level of evidence for the outcome ‘complications’ is very low.
The level of evidence regarding the outcome measure quality of life could not be assessed with GRADE. The outcome measures were not studied in the included studies.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the favorable and unfavorable effects of hemithyroidectomy compared with total thyroidectomy combined with postoperative radioactive iodine on the recurrence rate, survival rate, postoperative complication rates and quality of life in patients with a low-risk differentiated non-medullary thyroid cancer (> 1 cm en ≤ 4 cm without evidence of metastases) (see module Risicostratificatie)?
P: Patients with thyroid carcinoma (> 1 cm en ≤ 4 cm)
I: Hemithyroidectomy (also referred to as a thyroid lobectomy or partial thyroidectomy)
C: Total thyroidectomy with(out) postoperative radioactive iodine therapy
O: Overall survival, disease-free survival (DFS), disease specific survival (DSS), recurrence rate, complications, quality of life
Relevant outcome measures
The guideline development group considered overall survival, DSS and recurrence rates critical outcome measures for decision making; DFS, complications and QoL as important outcome measures for clinical decision making.
A priori, the working group did not define the outcome measures listed above, but used the definitions used in the studies.
The working group defined based on consensus between the experts within the guidelines committee a risk difference (RD) of 5% (RD = 0.05) as minimally clinically (patient) important difference for all outcomes (disease-specific survival, overall survival, recurrence rate). This for a minimal survival time of 10 years.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the 18th of July 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 839 hits. Studies were selected based on the following criteria: systematic reviews (SR), randomized controlled trials (RCTs) and comparative observational studies answering the PICO question. First the most recent systematic reviews were selected. Thereafter, additional studies were selected based on title and abstract screening. After reading the full text, 7 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 2 additional studies were included.
Results
Two systematic reviews (Bojoga, 2020; Rodriguez-Schaap, 2020) and two individual studies (MacKinney, 2022; Xu, 2021) were included in the analysis of literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Adam MA, Pura J, Gu L, Dinan MA, Tyler DS, Reed SD, Scheri R, Roman SA, Sosa JA. Extent of surgery for papillary thyroid cancer is not associated with survival: an analysis of 61,775 patients. Ann Surg. 2014 Oct;260(4):601-5; discussion 605-7. doi: 10.1097/SLA.0000000000000925. PMID: 25203876; PMCID: PMC4532384.
- Apostolou K, Paunovic I, Frountzas M, Zivaljevic V, Tausanovic K, Karanikas M, Koutelidakis I, Schizas D. Posthemithyroidectomy Hypothyroidism: Updated Meta-Analysis of Risk Factors and Rates of Remission. J Surg Res. 2024 Jan;293:102-120. doi: 10.1016/j.jss.2023.08.020. Epub 2023 Sep 19. PMID: 37734294.
- Bilimoria KY, Bentrem DJ, Ko CY, Stewart AK, Winchester DP, Talamonti MS, Sturgeon C. Extent of surgery affects survival for papillary thyroid cancer. Ann Surg. 2007 Sep;246(3):375-81; discussion 381-4. doi: 10.1097/SLA.0b013e31814697d9. PMID: 17717441; PMCID: PMC1959355.
- Bojoga A, Koot A, Bonenkamp J, de Wilt J, IntHout J, Stalmeier P, Hermens R, Smit J, Ottevanger P, Netea-Maier R. The Impact of the Extent of Surgery on the Long-Term Outcomes of Patients with Low-Risk Differentiated Non-Medullary Thyroid Cancer: A Systematic Meta-Analysis. J Clin Med. 2020 Jul 21;9(7):2316. doi: 10.3390/jcm9072316. PMID: 32708218; PMCID: PMC7408649.
- Dhir M, McCoy KL, Ohori NP, et al.. Correct extent of thyroidectomy is poorly predicted preoperatively by the guidelines of the American Thyroid Association for low and intermediate risk thyroid cancers. Surgery. 2018;163(1):81–87
- Kluijfhout WP, Pasternak JD, Drake FT, Beninato T, Shen WT, Gosnell JE, Suh I, C L, Duh QY. Application of the new American Thyroid Association guidelines leads to a substantial rate of completion total thyroidectomy to enable adjuvant radioactive iodine. Surgery. 2017 Jan;161(1):127-133. doi: 10.1016/j.surg.2016.05.056. Epub 2016 Nov 14. PMID: 27855968.
- Landry V, Siciliani E, Henry M, Payne RJ. Health-Related Quality of Life following Total Thyroidectomy and Lobectomy for Differentiated Thyroid Carcinoma: A Systematic Review. Curr Oncol. 2022 Jun 21;29(7):4386-4422. doi: 10.3390/curroncol29070350. PMID: 35877210; PMCID: PMC9323259.
- Lang BH, Shek TW, Wan KY. The significance of unrecognized histological high-risk features on response to therapy in papillary thyroid carcinoma measuring 1-4 cm: implications for completion thyroidectomy following lobectomy. Clin Endocrinol (Oxf). 2017 Feb;86(2):236-242. doi: 10.1111/cen.13165. Epub 2016 Sep 1. PMID: 27467318.
- Li Z, Qiu Y, Fei Y, Xing Z, Zhu J, Su A. Prevalence of and risk factors for hypothyroidism after hemithyroidectomy: a systematic review and meta-analysis. Endocrine. 2020 Nov;70(2):243-255. doi: 10.1007/s12020-020-02410-5. Epub 2020 Jul 7. PMID: 32638212.
- Lin JF, Rodriguez Schaap PM, Metman MJH, Nieveen van Dijkum EJM, Dickhoff C, Links TP, Kruijff S, Engelsman AF. Thyroid Lobectomy for Low-Risk 1-4 CM Papillary Thyroid Cancer is not Associated with Increased Recurrence Rates in the Dutch Population with a Restricted Diagnostic Work-Up. World J Surg. 2023 May;47(5):1211-1218. doi: 10.1007/s00268-022-06813-5. Epub 2022 Oct 27. PMID: 36303039; PMCID: PMC10070212.
- MacKinney EC, Kuchta KM, Winchester DJ, Khokar AM, Holoubek SA, Moo-Young TA, Prinz RA. Overall survival is improved with total thyroidectomy and radiation for male patients and patients older than 55 with T2N0M0 Stage 1 classic papillary thyroid cancer. Surgery. 2022 Jan;171(1):197-202. doi: 10.1016/j.surg.2021.08.025. Epub 2021 Oct 16. PMID: 34666913.
- Nickel B, Tan T, Cvejic E, Baade P, McLeod DSA, Pandeya N, Youl P, McCaffery K, Jordan S. Health-Related Quality of Life After Diagnosis and Treatment of Differentiated Thyroid Cancer and Association With Type of Surgical Treatment. JAMA Otolaryngol Head Neck Surg. 2019 Mar 1;145(3):231-238. doi: 10.1001/jamaoto.2018.3870. PMID: 30653212; PMCID: PMC6439749.
- Paluskievicz CM, Chang DR, Blackburn KW, Turner DJ, Munir KM, Mullins CD, Olson JA Jr, Hu Y. Low-Risk Papillary Thyroid Cancer: Treatment De-Escalation and Cost Implications. J Surg Res. 2022 Jul;275:273-280. doi: 10.1016/j.jss.2022.01.019. Epub 2022 Mar 18. PMID: 35306263.
- Park S, Jeon MJ, Song E, Oh HS, Kim M, Kwon H, Kim TY, Hong SJ, Shong YK, Kim WB, Sung TY, Kim WG. Clinical Features of Early and Late Postoperative Hypothyroidism After Lobectomy. J Clin Endocrinol Metab. 2017 Apr 1;102(4):1317-1324. doi: 10.1210/jc.2016-3597. PMID: 28324106.
- Park HK, Kim DW, Ha TK, Heo YJ, Baek JW, Lee YJ, Cho YJ, Lee DK, Kim DH, Jung SJ, Ahn KJ, Ahn HS, Baek HJ. Utility of routine ultrasonography follow-up after total thyroidectomy in patients with papillary thyroid carcinoma: a single-center study. BMC Med Imaging. 2018 May 15;18(1):12. doi: 10.1186/s12880-018-0253-9. PMID: 29764382; PMCID: PMC5952628.
- Rajjoub SR, Yan H, Calcatera NA, Kuchta K, Wang CE, Lutfi W, Moo-Young TA, Winchester DJ, Prinz RA. Thyroid lobectomy is not sufficient for T2 papillary thyroid cancers. Surgery. 2018 May;163(5):1134-1143. doi: 10.1016/j.surg.2017.12.026. Epub 2018 Feb 13. PMID: 29426618.
- Rodriguez Schaap PM, Botti M, Otten RHJ, Dreijerink KMA, Nieveen van Dijkum EJM, Bonjer HJ, Engelsman AF, Dickhoff C. Hemithyroidectomy versus total thyroidectomy for well differentiated T1-2 N0 thyroid cancer: systematic review and meta-analysis. BJS Open. 2020 Oct 6;4(6):987–94. doi: 10.1002/bjs5.50359. Epub ahead of print. PMID: 33022150; PMCID: PMC7709359.
- Rodriguez Schaap PM, Lin JF, Metman MJH, Dreijerink KMA, Links TP, Bonjer HJ, Nieveen van Dijkum EJM, Dickhoff C, Kruijff S, Engelsman AF. Bilaterality, not multifocality, is an independent risk factor for recurrence in low risk papillary thyroid cancer. J Natl Cancer Inst. 2023 Jun 2:djad105. doi: 10.1093/jnci/djad105. Epub ahead of print. PMID: 37267155.
- Stevens A, Meier J, Bhat A, Knight SJ, Vanness DJ, Balentine C. Reassessing surgical guidelines for papillary thyroid cancer impact on survival: Expanding indications for lobectomy. Surgery. 2023 Jun 29:S0039-6060(23)00328-8. doi: 10.1016/j.surg.2023.05.033. Epub ahead of print. PMID: 37393154.
- Ullmann TM, Papaleontiou M, Sosa JA. Current Controversies in Low-Risk Differentiated Thyroid Cancer: Reducing Overtreatment in an Era of Overdiagnosis. J Clin Endocrinol Metab. 2023 Jan 17;108(2):271-280. doi: 10.1210/clinem/dgac646. PMID: 36327392; PMCID: PMC10091361.
- Verloop H, Louwerens M, Schoones JW, Kievit J, Smit JW, Dekkers OM. Risk of hypothyroidism following hemithyroidectomy: systematic review and meta-analysis of prognostic studies. J Clin Endocrinol Metab. 2012 Jul;97(7):2243-55. doi: 10.1210/jc.2012-1063. Epub 2012 Apr 17. PMID: 22511795.
- van Velsen EFS, Peeters RP, Stegenga MT, Mäder U, Reiners C, van Kemenade FJ, van Ginhoven TM, Visser WE, Verburg FA. Tumor size and presence of metastases in differentiated thyroid cancer: comparing cohorts from two countries. Eur J Endocrinol. 2023 Jun 7;188(6):519-525. doi: 10.1093/ejendo/lvad061. PMID: 37314433.
- Xu Y, Huang K, Huang P, Ke N, Zeng J, Wang L, Liu C, Shi X, Guo F, Su L, Lin M, Li X, Xiao F. Benefits and harms of hemithyroidectomy, total or near-total thyroidectomy in 1-4 cm differentiated thyroid cancer. Clin Endocrinol (Oxf). 2021 Oct;95(4):668-676. doi: 10.1111/cen.14495. Epub 2021 May 30. PMID: 33948971.
Evidence tabellen
Evidence tables
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Bojoga, 2020 |
SR and meta-analysis of cohort studies
Literature search up to may 2019
A: Samaan, 1983 B: Shah, 1993 C: Shaha, 1997 D: Hay, 1998 E: Sanders, 1998 F: Haigh, 2004 G: Bilmoria, 2007 H: Mendelsohn, 2010 I:Hassanain, 2010 J: Ito, 2010 P Kuba, 2017 .
Study design: Retrospective cohort, see article
Setting and Country: USA, Japan, Canada, see article
Source of funding and conflicts of interest: None.
|
Inclusion criteria SR: (1) articles reporting comparison outcomes for TL and TT in patients with “low-risk” DTC (PTC and FTC subtypes) regardless of the definition used and (2) the outcomes of interest were recurrence rates, overall survival (OS), disease free survival (DFS) and/or disease specific survival (DSS).
Exclusion criteria SR: (1) abstracts, reviews, age 18, non-English language, (2) duplicate data, (3) no reported outcomes mentioned, (4) studies focusing exclusively on microcarcinoma, (5) with less than 50 patients per arm. Patients were classified using various scoring systems (AJCC/TNM, AMES, ATA).
16 studies included
Important patient characteristics at baseline:
N, mean age A: na B: 57 C: 31 D: 43 E: 44 F: NA G: 43 H: 44 I: NA P 53
Sex: female (%) A: 73 B: 62 C: 74 D: NA E: 72 F: 77 G: 76 H: 78 I: 73 P 86 . Postoperative, RAI (y/n/n.a.), (%): A: y (34) B: y (“only a few received RAI”) C: n.a. D: y E: n.a. F: y G: y H: y I: y (28) J: y K: y L: no M: y N: y O: y P: y
Groups comparable at baseline? |
Describe intervention:
thyroid lobectomy A: 105 B: 73 C: 280 D: 185 E: 224 F: 739 G: 8946 H: 5964 I: 126 P 120
|
Describe control:
total thyroidectomy (TT) +/- postoperative radioactive iodine (RAI) A: 491 B: 73 C: 90 D: 1082 E: 795 F: 3663 G: 43227 H: 16760 I: 54 P 53
|
End-point of follow-up:
A: 6-30 years B: 20 years C: 20 years D: 16 years E: 0-47 years F: 1 month – 12 years G: 5.8 years H: 9.1 years I: 4-25 years J: 0.5 – 34 years K: 2 months – 19.9 years L: 0.5 – 34 years M: 13 months – 24.3 years N: 3 – 20 years O: 5 - 14.9 years P: 11 months – 20.8 years
For how many participants were no complete outcome data available? (intervention/control) n.a.
|
Recurrence rate Defined as indicated in the individual studies and defined exclusively as new structural recurrences (either in the thyroid bed or in the nonremoved thyroid tissue, the (cervical) lymph nodes, or distant metastases) confirmed by imaging and/or pathological examination.
Total N (I/C), patients: 12,754/ 47,744 Effect measure: RR [95% CI]: A: 1.64 [1.11; 2.44] B: 1.00 [0.30; 3.31] C: 1.65 [0.76; 3.58] D: 2.66 [1.91; 3.72] E: 0.98 [0.51; 1.87] G: 1.27 [1.19; 1.37] I: 0.13 [0.03; 0.68] J: 1.71 [0.99; 2.98] L: 1.81 [0.44; 7.39] M: 0.04 [0.00; 0.59] N: 1.24 [0.69; 2.25]
Pooled effect (random effects model): RR 1.10 [95% CI 0.61-1.96] Heterogeneity (I2): 72%
Disease free survival Total N (I/C), patients: 3,001/ 2,966 Effect measure: RR [95% CI]: A: 0.83 [0.73; 0.94] B: 1.13 [0.95; 1.35] D: 0.84 [0.78; 0.91] I: 0.96 [0.93; 1.00] J: 1.02 [1.00; 1.04] N: 0.96 [0.91; 1.01] P: 1.03 [0.93; 1.14]
Pooled effect (random effects model): RR 0.96 [95% CI 0.89-1.03] Heterogeneity (I2): 85%
Overall survival Total N (I/C), patients: 26,772 / 133,312 Effect measure: RR [95% CI]: B: 0.95 [0.88; 1.02] C: 1.00 [0.97; 1.03] D: 1.02 [1.00; 1.05] E: 0.99 [0.98; 0.99] H: 0.98 [0.97; 0.99] I: 1.00 [0.97; 1.03] K: 1.00 [0.99; 1.02] L: 1.01 [0.98; 1.02] M: 0.98 [0.98; 0.99] N: 1.00 [0.94; 1.07]
Pooled effect (random effects model): RR 0.99 [95% CI 0.99 - 1.00] Heterogeneity (I2): 53%
Disease specific survival Total N (I/C), patients: 11,342 / 32,373 Effect measure: RR [95% CI]: B: 1.09 [0.94; 1.26] C: 1.00 [0.98; 1.03] D: 0.98 [0.96; 1.01] E: 1.00 [0.97; 1.03] H: 1.01 [1.01; 1.01] I: 1.08 [0.98; 1.19] K: 1.02 [1.01; 1.02] L: 1.00 [0.98; 1.02] M: 1.00 [1.00; 1.01] N: 1.00 [0.98; 1.02]
Pooled effect (random effects model): RR 1.01 [95% CI 1.00 - 1.01] Heterogeneity (I2): 74%
|
Risk of bias (high, some concerns or low): One article showed low risk of bias, and five articles showed immediate risk of bias. Only 2 of the included studies had a matched cohort design to control for confounding.
Reporting of RAI treatment was adequate in 13 of the 16 articles.
The authors conclude that ‘TL is a safe procedure for treatment of low-risk DTC patients, with excellent oncological outcomes and potentially lower treatment side effects.’
|
|
Rodriguez-Schaap, 2020
individual study characteristics extracted from Rodriguez-Schaap, 2020
|
SR and meta-analysis of cohort studies
Literature search up to November 2019
A: Cross 2006 B: Hassanain 2010 C: Lee 2013 D: Kim 2017 E: Kim 2017 F: Kwon 2017 G: Choi 2019 H: Jeon 2019 I: Ji 2019 J: Song 2019
Study design: retrospective cohort
Setting and Country: Amsterdam University Medical Centre, The Netherlands and University of Pavia, Italy
Source of funding and conflicts of interest: no funding; the authors declare no conflict of interest |
Inclusion criteria SR: any English-language original reports comparing HT with TT ± RAI for the treatment of 0 – 4-cm, well differentiated, low-risk thyroid cancer (node-negative (N0), T1 and T2 cancers)
Exclusion criteria SR: studies describing recurrent disease only, those including patients under 18 years of age, letters, reviews, editorials, case series with fewer than ten patients, and conference abstracts
10 studies included
Important patient characteristics at baseline:
N, patients A: 962 B: 180 C: 2014 D: 1150 E: 8676 F: 2031 G: 5266 H: 255 I: 255 J: 2345
N patients, AMES low / high risk A: 746 / 207 B: 161 / 17 C: n.a. D: n.a. E: n.a F: n.a G: 47 / 5219 H: 255 / 0 I: n.a. J: n.a.
Median age, yrs A: 43 B: n.a. C: HT: 43.9; TT: 47.7 D: 44 E: 47.2 F: 47 G: 45.4 H: 49 I: HT: 44.6; TT: 45.2 J: HT: 44; TT: 46.9
Sex, female, N A: 260 B: 131 C: 1827 D: 1073 E: 7057 F: 1790 G: 4462 H: 226 I: 201 J: 2042
Tumor size, mean (±SD) A: n.a. B: n.a. C: < 5 mm in 894 and > 5 mm in 1120-> 5.7 mm in HT group versus 6.9 mm in TT group D: 16 mm ( ± 6) E: 6 mm ( ± 2) F: 6 mm G: HT: 16 mm ( ± 5.6); TT 19.3 ( ± 8.1) H: 6.5 mm I: HT: 7.2 mm ( ± 3.1), TT: 7.3 mm ( ± 3.1) J: HT: 14 mm ( ± 6); TT 18 mm (± 7)
Patients in TT group treated with RAI (%) A: n.a B: n.a C: n.a D: 74 E: 71.7 F: 87 G: 92.7 H: postop RAI was exclusion criterion I: 92.4 J: 93.9
Pathology A: PTC, FTC B: PTC (150), FTC (24), other (6) C: PTMC D: n.a. E: PTMC F: PTMC G: PTC (31), minimally invasive FTC (16) H: PTMC I: PTC J: n.a.
|
Describe intervention: hemithyroidectomy (HT)
|
Describe control: total thyroidectomy (TT) +/- postoperative radioactive iodine (RAI)
|
End-point of follow-up:
A: mean 15.3 years B: median 10 years C: medium 11.8 years D: mean 7 years E: median 5.4 years F: mean 8.5 years G: median 4.8 years H: median 7.9 years I: mean 5.5 years J: mean 9.8 years
For how many participants were no complete outcome data available? (intervention/control) n.a.
|
Recurrence rate, HT versus TT_+/- RAI, (%) E: 1.5 versus 1.7 G: 7.4 versus 10 (low-risk group, n = 47) J: 6⋅3 versus 4⋅7
Overall survival (20 years), HT versus TT_+/- RAI, (%) E: n.a G: n.a J: n.a.
Meta-analysis
Recurrence rate Effect measure: OR (95% CI): E: 0.92 (0.65, 1.30) G: 1.36 (0.72, 2.54) J: 0.49 (0.04, 5.56)
Pooled effect (fixed effects model): OR 1.12 (95% CI 0.82-1.53) Heterogeneity (I2): 31%
Recurrence in papillary thyroid carcinoma 1-4 cm Effect measure: OR (95% CI): E: 1.08 (0.47, 2.48) G: 0.72 (0.09, 5.60) J: 1.36 (0.72, 2.54)
Pooled effect (fixed effects model): OR 1.21 (95% CI 0.75-1.97) Heterogeneity (I2): 0%
|
The authors conclude that ‘for patients with low-risk, well differentiated thyroid cancer, low recurrence rates and high survival can be achieved with both HT and TT ± RAI treatment’.
Only three studies relevant for current question
Kim, Choi, Song |
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
MacKinney, 2022 |
Type of study:
Setting and country: USA, data from national database.
Funding and conflicts of interest: None. |
Inclusion criteria: 18 years of age or older, had a tumor size of 2.0 to 3.9 cm, clinical stage N0 or Nx, and had a lobectomy without radiation (lobectomy), total thyroidectomy without radiation (TT), or total thyroidectomy with radiation (TTþR).
Exclusion criteria: if they had more than one primary malignancy, distant metastases, received chemotherapy, unknown radiation history, or clinical N1 disease
N total at baseline: Intervention: 1189 Control1:9314 Control2: 21644
Important prognostic factors2:
Per age category
18-45 – 80% F 46-55 – 71.2% F >55 – 67.8% F
Groups comparable at baseline?
|
Describe intervention (treatment/procedure/test):
Lobectomy without radiation
|
Describe control (treatment/procedure/test):
Control 1: Total thyroidectomy without radiation Control 2: Total thyroidectomy with radiation
|
Length of follow-up: Not mentioned
Loss-to-follow-up: n.a.
Incomplete outcome data: N.a.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Overall survival [HR, 95%CI]:
Surgery type Lobe w/o rad* vs total w/ rady 18-45y: 1.75 (0.70- 4.38) 46-55y: 1.61 (0.77e3.35) >55y: 1.95 (1.46 - 2.60)
Lobe w/o rad* vs total w/o radz
Ten-year overall survival estimates from propensity score matched patients 18-45y I: 98.5 C1: 97.1 C2:99.1
46-55y I:95.2 C1:92.9 C2: 97.6
>55y I: 70.3 C1: 73 C2:79.2
|
Results described per age category |
|
Xu, 2021 |
Type of study: Retrospective cohort study
Setting and country: Hospital, China
Funding and conflicts of interest: |
Inclusion criteria: N.a.
Exclusion criteria: Non DTC types, aged <18 years, history of previous thyroidectomy, cervical LN metastasis or ETE at preoperative evaluation, combined with other malignant tumours and incomplete data or loss to follow-up.
N total at baseline: Intervention: 276 Control: 276 **machting
Important prognostic factors2: For example age median I: 37 C: 38
Sex: I: 77% F C: 77% F
Groups comparable at baseline?
|
Describe intervention (treatment/procedure/test):
Hemithyroidectomy
|
Describe control (treatment/procedure/test):
Total thyroidectomy
|
Length of follow-up: Median in months I: 59.0 C: 53.8
Loss-to-follow-up: n.a.
Incomplete outcome data: n.a.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Total recurrence/ disease free survival I: 10/276 (3.6%) C: 12/276 (4.3%) HR: 0.86 (95%CI 0.37 to 2.00)
Complication C: 78/276 (28.3%) HR: 0.47 (95%CI 0.31 to 0.71)
|
Retrospective analyses Relative small sample size and follow-up period.
|
Risk of bias tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Bojoga, 2020 |
Yes, low-risk DTC based on two surgical modes, TL versus TT, and discuss in that light the arguments for and against TL and TT in low-risk DTC according to the definition and recommendation of the ATA. |
Yes, Reviews and Meta-analysis (PRISMA) guidelines [24]. We searched for relevant studies up to May 2019 using MEDLINE (Pubmed) database. Additional studies were identified by hand searching references in original articles and review articles. |
Yes, see evidence tables |
Yes, see evidence tables |
Unclear, not mentioned |
Yes, see supplementary file |
Yes, see evidence tables |
Yes, funnel plot was performed |
Yes, was reported. |
|
Rodriquez Schaap, 2020 |
Yes, The study was registered in the International Prospective Register of Systematic Reviews (PROSPERO) (registration number CRD42018115971). A literature search was performed based on the PRISMA14 and MOOSE15 guidelines. To identify all relevant publications on HT for differentiated T1–2N0 thyroid cancer, systematic searches in the bibliographic databases PubMed, EMBASE.com and the Cochrane Library (via Wiley) (Tables S1–S3, supporting information) were performed from inception to 11 November 2019 |
Yes, see previous
|
Yes, see evidence tables |
Yes, see evidence tables |
Unclear, not mentioned |
Yes, see supplementary file |
No, therefore stratified analyses were performed |
Yes, funnel plot was performed |
Yes, was reported. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables?
|
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
MacKinney, 2022 |
Definitely yes: all data was drawn from the same database. |
Definitely yes: all data was drawn from the same database. |
Definitely no: retrospective data was used. |
Probably yes
Reason: Several factors were included. |
Probably no / Definitely no
Reason: Adjustments were made, but not for the outcome of interest. |
Definitely no
Reason: Adjustments were made, but not for the outcome of interest. |
Definitely yes
Reason: Retrospective data.
|
Probably yes
Reason: Separate analysis for TT and TT+r. |
Som concers for the oucome ‘survival’. |
|
Xu, 2021 |
Definitely yes: all data was drawn from the same database. |
Definitely yes: all data was drawn from the same database. |
Definitely no: retrospective data was used. |
Probably yes
Reason: Patients were matched. |
Definitely yes
Reason: Patients were matched. |
Definitely no
Reason: Patients were matched. |
Definitely yes
Reason: Retrospective data.
|
Probably yes
Reason: Patients were matched. . |
Low |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Nickel B, Tan T, Cvejic E, Baade P, McLeod DSA, Pandeya N, Youl P, McCaffery K, Jordan S. Health-Related Quality of Life After Diagnosis and Treatment of Differentiated Thyroid Cancer and Association With Type of Surgical Treatment. JAMA Otolaryngol Head Neck Surg. 2019 Mar 1;145(3):231-238. doi: 10.1001/jamaoto.2018.3870. PMID: 30653212; PMCID: PMC6439749. |
Not according to P of PICO |
|
Colombo C, De Leo S, Di Stefano M, Trevisan M, Moneta C, Vicentini L, Fugazzola L. Total Thyroidectomy Versus Lobectomy for Thyroid Cancer: Single-Center Data and Literature Review. Ann Surg Oncol. 2021 Aug;28(8):4334-4344. doi: 10.1245/s10434-020-09481-8. Epub 2021 Feb 10. PMID: 33566240; PMCID: PMC8253713. |
Not according to P of PICO, and subgroup less than 50 patients |
|
Zhang HS, Lee EK, Jung YS, Nam BH, Jung KW, Kong HJ, Won YJ, Park B. Total thyroidectomy's association with survival in papillary thyroid cancers and the high proportion of total thyroidectomy in low-risk patients: Analysis of Korean nationwide data. Surgery. 2019 Mar;165(3):629-636. doi: 10.1016/j.surg.2018.08.030. Epub 2018 Oct 17. PMID: 30342774. |
Not according to P of PICO, |
|
Suman P, Razdan SN, Wang CE, Tulchinsky M, Ahmed L, Prinz RA, Winchester DJ. Thyroid Lobectomy for T1b-T2 Papillary Thyroid Cancer with High-Risk Features. J Am Coll Surg. 2020 Jan;230(1):136-144. doi: 10.1016/j.jamcollsurg.2019.09.021. Epub 2019 Oct 28. PMID: 31672668. |
Control not according to PICO |
|
Li LQ, Hey SY, Andreeva D, Tornari C, Sawant R, Harding NE, Adamson R, Hay A, Simo R, Nixon IJ. A UK based two-centre review of multifocality and its role in the treatment of papillary thyroid cancer. Eur J Surg Oncol. 2022 Jan;48(1):14-20. doi: 10.1016/j.ejso.2021.06.033. Epub 2021 Jun 29. PMID: 34253424. |
Not according to P of PICO |
|
Woo J, Kwon H. Optimal Surgical Extent in Patients with Unilateral Multifocal Papillary Thyroid Carcinoma. Cancers (Basel). 2022 Jan 15;14(2):432. doi: 10.3390/cancers14020432. PMID: 35053595; PMCID: PMC8773701. |
Not according to P of PICO, and subgroup less than 40 patients |
|
Rajjoub SR, Yan H, Calcatera NA, Kuchta K, Wang CE, Lutfi W, Moo-Young TA, Winchester DJ, Prinz RA. Thyroid lobectomy is not sufficient for T2 papillary thyroid cancers. Surgery. 2018 May;163(5):1134-1143. doi: 10.1016/j.surg.2017.12.026. Epub 2018 Feb 13. PMID: 29426618. |
Not according to O |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 30-09-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met (verdenking op) schildkliercarcinoom).
Expertisegroep
- Prof. dr. R.T. Netea-Maier (voorzitter), internist-endocrinoloog, werkzaam in Radboud Universitair Medische Centrum, NIV.
- Prof dr. W.E. Visser, internist-endocrinoloog, werkzaam in Erasmus Universitair Medisch Centrum, NIV.
- Dr. A.N.A. van der Horst-van der Schrivers, internist-endocrinoloog/specialist ouderengeneeskunde i.o., werkzaam bij SOON, Maastricht University.
- Dr. G.S. Bleumink, internist-endocrinoloog, werkzaam in Rijnstate, NIV.
- Dr. B. Havekes, internist-endocrinoloog, werkzaam in Maastricht Universitair Medisch Centrum Plus, NIV.
- Drs. K.E. Broekman, internist-oncoloog, werkzaam in Universitair Medisch Centrum Groningen, NIV.
- Dr. W. Zandee, internist-endocrinoloog, werkzaam in Universitair Medisch Centrum Groningen, NIV.
- Dr. M. Snel, internist-endocrinoloog, werkzaam in Leids Universitair Medisch Centrum, NIV.
- Dr. K.M.A. Dreijerink, internist-endocrinoloog, werkzaam in Amsterdam Universitair Medische Centra, NIV.
- Dr. J.P. de Boer, internist-oncoloog, werkzaam in Antoni van Leeuwenhoek Ziekenhuis, NIV.
- Dr. G.A.P. Nieuwenhuijzen, chirurg, werkzaam in Catharina Ziekenhuis, NVvH.
- Dr. T.M. van Ginhoven, chirurg, werkzaam in Erasmus Medische Centrum, NVvH.
- Prof dr. J. Morreau, patholoog, werkzaam in Leids Universitair Medisch Centrum, NVVP.
- Dr. M. de Ridder, radiotherapeut, werkzaam in Universitair Medisch Centrum Utrecht, NVRO.
- Drs. H. Ahmad, radioloog, werkzaam in Erasmus Medisch Centrum, NVvR.
- Dr. ir. J.J.G. Hillebrand, klinische chemicus, werkzaam in Amsterdam Universitair Medisch Centrum, NVKC.
- Prof. Dr. F.A. Verburg, nucleair geneeskundige, werkzaam in Erasmus Medisch Centrum, NVNG.
- Dr. B. de Keizer, nucleair geneeskundige, werkzaam in Universitair Medisch Centrum Utrecht, NVNG.
- Mw. M. Porrey, patiëntvertegenwoordiger, NFK/ Schildklierorganisatie Nederland.
Klankbordgroep
- Mw. E. Schrama, patiëntvertegenwoordiger, Schildklier Organisatie Nederland.
- Mw. C.C. van Zweeden- van Leeuwen, diëtist, Reinier de Graaf Ziekenhuis, Nederlandse Vereniging van Diëtisten.
Met ondersteuning van
- Drs. L. Niesink-Boerboom, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten.
- MSc. F.A. Pepping, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf mei 2024).
- Dr. J. Tra, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. M.M.A. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Expertiselid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. R.T. Netea-Maier (voorzitter) |
internist-endocrinoloog, werkzaam in Radboud Universitair Medische Centrum |
"Bestuurlid Dutch Thyroid Cancer Group (vicevoorzitter) (onbetaald) Bestuurlid Dutch Thyroid Research Foundation (penningmeester) (onbetaald) Voorzitter Radboudumc Expertisecenter Schildkliercarcinoom en vertegenwoordiger van dit center in de ERN Rare Cancers en EndoERN (onbetaald). Associate Editor European Journal Endocrinology (onbetaald)" |
|
Geen deelname adviesraden vanaf de start van de ontwikkeling van de richtlijn (vanaf start raamwerk). |
|
Dr. W.E. Visser |
internist-endocrinoloog, werkzaam in Erasmus Universitair Medisch Centrum |
- |
- |
Geen |
|
Dr. A.N.A. van der Horst-van der Schrivers |
Internist-endocrinoloog/specialist ouderengeneeskunde i.o, |
- |
- |
Geen |
|
Dr. G.S. Bleumink |
internist-endocrinoloog, werkzaam in Rijnstate |
- |
- |
Geen |
|
Dr. B. Havekes |
Internist-endocrinoloog, werkzaam in Universitair Medisch Centrum Maastricht |
- |
KWF subsidie E-Nose, hoofdaanvrager is Prof. dr. Nicole Bouvy (schildklierchirurg) |
Geen |
|
Drs. K.E. Broekman |
Internist-oncoloog, werkzaam in Universitair Medisch Centrum Groningen |
- |
Lokale PI Libretto-531 studie |
Exclusie participatie als trekker opstellen aanbeveling voor module 7.3 |
|
Dr. W. Zandee |
internist-endocrinoloog, werkzaam in Universitair Medisch Centrum Groningen |
- |
Adviesraad Lilly (selpercatinib), uitbetaald aan onderzoeksrekening UMCG |
Exclusie participatie als trekker opstellen aanbeveling voor module 7.3 |
|
Dr. M. Snel |
Internist-endocrinoloog, werkzaam in Leids Universitair Medisch Centrum |
Secretaris van de Dutch Thyroid Cancer Group |
- |
Geen |
|
Dr. K.M.A. Dreijerink |
internist-endocrinoloog, werkzaam in Amsterdam Universitair Medisch Centrum |
- |
Advisory Board, Lilly, betaald, mbt selpercatinib als behandeling bij gemetastaseerd gedifferentieerd en medullair schildkliercarcinoom |
Exclusie participatie als trekker opstellen aanbeveling voor module 7.3 |
|
Dr. J.P. de Boer, |
Internist-oncoloog, werkzaam in Antoni van Leeuwenhoek Ziekenhuis |
Advisory Board MSD Head and neck cancer |
- |
Geen |
|
Dr. G.A.P. Nieuwenhuijzen, |
Nieuwenhuijzen, chirurg, werkzaam in Catharina Ziekenhuis |
- |
- |
Geen |
|
Dr. T.M. van Ginhoven |
chirurg, werkzaam in Erasmus Medische Centrum |
- Voorzitter regionale SchildklierNetwerk (onbetaald) - Secretaris Werkgroep Endocriene chirurgie NVVH (onbetaald) - Penningmeester Dutch Thyroid Study Group (onbetaald) - bestuurslid Dutch Hypo/hyper parathyroid Study Group (onbetaald) |
- |
Geen |
|
Prof dr. J. Morreau |
patholoog, werkzaam in Leids Universitair Medisch Centrum |
Adviseur Genome Scan BV Leiden |
- |
Geen |
|
Dr. M. de Ridder |
radiotherapeut, werkzaam in Universitair Medisch Centrum Utrecht |
Lid algemeen bestuur NWHHT - onbetaald Lid bestuur UWHHT - onbetaald |
- |
Geen |
|
Drs. H. Ahmad |
radioloog, werkzaam in Erasmus Medisch Centrum |
- |
- |
Geen |
|
Dr. ir. J.J.G. Hillebrand |
klinische chemicus, werkzaam in Amsterdam Universitair Medisch Centrum |
trekker NVE commissie harmoniseren functietesten, tijdelijk betaald via SKMS gelden |
- |
Geen |
|
Prof. Dr. F.A. Verburg |
nucleair geneeskundige, werkzaam in Erasmus Medisch Centrum |
Algemeen directeur Cyclotron Rotterdam B.V. ; gedetacheerd vanuit Erasmus MC; management; 0,2 FTE, betaald" |
Adviseur: GE healthcare (honoraria betaald aan werkgever) Spreker: AstraZenica (honoraria betaald aan werkgever), Sanofi (honoraria betaald aan werkgever. KWF/Alpe d'Huzes: TFB PET/CT bij schildkliercarcinoom FDA: radionuclide beeldvorming Daniel den Hoedstichting |
|
|
Dr. B. de Keizer |
nucleair geneeskundige, werkzaam in Universitair Medisch Centrum Utrecht |
- |
- Sentinel node imaging bij mondholte ca -FDG PET voor lymfeklierstadiering bij patiënten met klinisch negatieve hals -TFB PET voor schildklierkanker beeldvorming KIKA -MFBG PET-CT voor neuroblastoma beeldvorming HANART FONDS -Al op FDG PET- CT voor voorspellen van respons op immuun therapie bij patiënten met gemetastaseerd niercelkanker |
Geen |
|
Mw. M. Porrey |
patiëntvertegenwoordiger |
- |
- |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van patiëntvertegenwoordigers voor de invitational conference en deelname in de expertisegroep. Het verslag van de invitational conference is besproken in de expertisegroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module behandeling – chirurgische interventies |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de expertisegroep de knelpunten in de zorg voor patiënten met (verdenking op) goed gedifferentieerd schildkliercarcinoom. Tevens zijn er knelpunten aangedragen door IKNL, NAPA, DTCG, NVD, NVNG, NVVP, NVvR, NVRO, SON, NIV via een invitational conference. Een beknopt verslag hiervan is opgenomen onder bijlage.
De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens de invitational conference.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg (zoals centralisatie) worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
