Hypofractionering bij prostaatcarcinoom
Uitgangsvraag
Wat is de plaats van hypofractionering in de behandeling van patiënten met gelokaliseerd (of lokaal gevorderd), niet-gemetastaseerd prostaatcarcinoom?
Aanbeveling
Pas een hypofractioneringsschema toe bij patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Gebruik de volgende hypofractioneringsschema bij patiënten in de laag en matig-risico groep:
- 5 fracties per week;
- 20x3 Gy;
- behandel tijd: 4.5 weken.
Gebruik androgene deprivatie therapie bij hypofractionering op dezelfde manier als voorheen gebruikelijk (zie de vorige richtlijn).
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Gelet op de conclusies en kwaliteit van het bewijs, kunnen patiënten met een gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom bestraald worden met een hypofractioneringsschema. De bewijskracht laat zien dat er geen verschil is in de uitkomsten: biochemisch recidief, klinisch recidief, totale mortaliteit, prostaatcarcinoom specifieke mortaliteit, late gastro-intestinale toxiciteit, acute urogenitale toxiciteit, late urogenitale toxiciteit, biochemisch of klinisch recidief tussen patiënten bestraald met een hypofractioneringsschema en patiënten behandeld met een conventioneel radiotherapieschema.
De bewijskracht laat alleen voor de uitkomstmaat acute gastro-intestinale toxiciteit een statistisch significant verschil zien (graad 3 toxiciteit), in het voordeel van het conventionele radiotherapieschema. Dit verschil zien we terug in de HYPRO-trial. Hoewel de bewijskracht een statistisch significant verschil laat zien, kunnen we echter niet spreken van een klinisch relevant verschil omdat het 95%BI interval van de puntschatter (RD= 0,08; 95%BI= (0,03 tot 0,14)) binnen de grenzen van klinische besluitvorming valt. Graad ≥2 acute- en late urogenitale toxiciteit en late gastro-intestinale toxiciteit zijn statistisch niet significant in hypofractioneringschema’s in vergelijking met het conventionele schema.
Bovenstaande bevindingen gelden in het algemeen voor alle risicogroepen (laag-, redelijk en hoog-risico). In sommige studies werden bepaalde groepen geëxcludeerd, bijvoorbeeld cT3b of risico op vesicula seminalis invasie >30% (bijvoorbeeld CHHiP trial). Daarnaast bedraagt de follow-up van de onderzochte studies (minstens) 5 jaar. Er dient rekening te worden gehouden dat er nadelige effecten van hypofractionering kunnen optreden na 5 jaar, alhoewel dit niet verwacht wordt.
Hypofractionering leidt tot een verkorte behandeltijd, waardoor patiënten minder vaak naar het ziekenhuis hoeven te komen. Hierdoor kan een hypofractioneringsschema ervoor zorgen dat patiënten en mantelzorgers minder worden belast wat mogelijk bijdraagt aan een hogere patiënttevredenheid. Hoewel niet specifiek onderzocht, kunnen hypofractioneringsschema’s bijdragen aan een efficiënter gebruik van de bestralingstoestellen dit heeft tevens een positief effect op de behandelkosten van patiënten met gelokaliseerd (of lokaal gevorderd), niet-gemetastaseerd prostaatcarcinoom. Echter, kosten-baten analyses van standaard en hypofractioneringsschema’s zijn nog niet onderzocht.
Gezien het grote aantal behandelde patiënten in de CHHiP-trial (Dearnaley, 2016), de gunstige toxiciteit resultaten, het gemak van het schema van 5 fracties per week met een totale behandeltijd van 4.5 weken, wordt 20x3 Gy aanbevolen als het nieuwe standaard schema voor patiënten in de lage- en matig-risico groep, en/of beperkte hoog-risico kenmerken (T3a of Gleason 8 en/of PSA < 30 ug/l).
Onderbouwing
Achtergrond
Voorheen werd er bij prostaatcarcinoom meestal zeven tot acht weken bestraald. Tegenwoordig wordt een hogere dosis straling per fractie gegeven, waardoor er minder bestralingen nodig zijn, dit is hypofractionering. De hele bestralingsbehandeling is daardoor korter met dezelfde hoeveelheid straling. De meeste radiotherapieafdelingen in Nederland zijn overgestapt op hypofractionering, maar er zijn nog verschillen. Er zijn recente, gerandomiseerde fase III studies voorhanden.
Conclusies / Summary of Findings
|
Redelijk1 GRADE |
Het risico op biochemisch recidief is bij hypofractionering vergelijkbaar met conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Bronnen: (PROFIT, IRE, RTOG, HYPRO, RAH, MDACC,LUKKA) |
|
Laag2 GRADE |
Het risico op biochemisch of klinisch recidief is bij hypofractionering vergelijkbaar met conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Bronnen: (PROFIT, CHHiP, HYPRO, FCCC, MDACC, LUKKA) |
|
Redelijk3 GRADE |
Het risico op totale mortaliteit is bij hypofractionering vergelijkbaar met conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Bronnen: (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC, RAH, LUKKA) |
|
Redelijk4 GRADE |
Het risico op prostaatcarcinoom specifieke mortaliteit is bij hypofractionering vergelijkbaar met conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Bronnen: (PROFIT, IRE, RTOG, HYPRO, FCCC, RAH, MDACC, LUKKA) |
|
Laag5 GRADE |
Het risico op acute gastro-intestinale toxiciteit (≥2) is bij hypofractionering groter dan bij conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Bronnen: (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC) |
|
Laag6 GRADE |
Het risico op late gastro-intestinale toxiciteit (≥2) is bij hypofractionering vergelijkbaar met conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Bronnen: (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC, MDACC) |
|
Laag7 GRADE |
Het risico op acute urogenitale toxiciteit (≥2) is bij hypofractionering vergelijkbaar met conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Bronnen: (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC) |
|
Laag8 GRADE |
Het risico op late urogenitale toxiciteit (≥2) is bij hypofractionering vergelijkbaar met conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd of lokaal gevorderd, niet-gemetastaseerd prostaatcarcinoom.
Bronnen: (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC, MDACC) |
Samenvatting literatuur
De systematische zoekactie leverde één recente SR op die de literatuur dekt tot april 2017 (Datta, 2017). De SR includeert alléén prospectieve fase III RCT’s met een minimale follow-up periode van ≥5 jaar, die een behandeling beschrijven met uitsluitend externe radiotherapie (bestraling) en Engelstalige artikelen. Wanneer meerdere publicaties dezelfde studie beschrijven, werden updates meegenomen in de systematisch meta-analyse. Studies die niet zijn gerandomiseerd, een retrospectief onderzoeksdesign hebben, een vorm van radiotherapeutische dosisescalatie onderzoeken, die protonen of brachytherapie als onderdeel van de behandeling beschrijven, rapporten beschrijven van shortlist RCT’s en een kortere follow-up tijd hebben dan 5 jaar werden niet meegenomen in de analyse. In totaal werden 19 publicaties geselecteerd waarin negen verschillende studiepopulaties worden beschreven. Alle RCT’s vergelijken hypofractionering met conventionele radiotherapie in de behandeling van patiënten met gelokaliseerd (of lokaal gevorderd), niet-gemetastaseerd prostaatcarcinoom. De SR is van goede kwaliteit (zie kwaliteitsbeoordeling onder het tabblad verantwoording).
Om de (on)gunstige effecten van hypofractionering te onderzoeken, includeerde de SR van Datta (2017) fase 3 klinische trials waarin patiënten in de interventiegroep werden behandeld met hypofractionering en patiënten in de controle groep met conventionele radiotherapie.
De SR van Datta (2017) selecteerde biochemisch recidief, klinisch recidief, prostaatcarcinoom specifieke mortaliteit, gastro-intestinale acute toxiciteit (gradering ≥2), urogenitale acute toxiciteit (gradering ≥2), gastro-intestinale late toxiciteit (gradering ≥2), urogenitale late toxiciteit (gradering ≥2). Aangezien de geselecteerde uitkomsten van de studies over meerdere publicaties zijn gerapporteerd zullen de acroniemen van de studies worden gebruikt in de verdere uitwerking van de literatuur. De volgende RCT’s zijn geïncludeerd: Prostate Fractionated Irradiation Trial (PROFIT; n=1206) (Catton, 2017), Regina Elena National Cancer Institute trial (IRE; n=168) (Arcangeli, 2010; Arcangeli, 2011; Arcangeli, 2017), Radiation Therapy Oncology Group (RTOG 0415 study; n=1092) (Lee, 2016), Conventional or Hypofractionated High-dose Intensity Modulated Radiotherapy in Prostate Cancer (CHHiP; n=3216) (Dearnaley, 2016), Hypofractionated Irradiation for Prostate Cancer (HYPRO; n=804) (Aluwini, 2015; Aluwini, 2016; Incrocci, 2016), Fox Chase Cancer Center (FCCC; n=303) (Pollack, 2006; Pollack, 2013; Shaikh, 2017), Royal Adelaide Hospital (RAH; n=217) (Yeoh, 2003; Yeoh, 2006; Yeoh, 2011), MD Anderson Cancer Center (MDACC; n=204) (Kuban, 2010; Hoffman, 2014) en LUKKA (n=936) (Lukka, 2005; Mirabell, 2012).
Tabel 1 Overzicht RCT’s met bijbehorende publicaties
|
Study |
Publicaties |
|
PROFIT |
Catton, 2017 |
|
IRE |
Arcangeli, 2010; Arcangeli, 2011; Arcangeli, 2017 |
|
RTOG |
Lee, 2016 |
|
CHHiP |
Dearnaley, 2016 |
|
HYPRO |
Aluwini, 2015; Aluwini, 2016; Incrocci, 2016 |
|
FCCC |
Pollack, 2006; Pollack, 2013; Shaikh, 2017 |
|
RAH |
Yeoh, 2003; Yeoh, 2006; Yeoh, 2011 |
|
MDACC |
Kuban, 2010; Hoffman, 2014 |
|
LUKKA |
Lukka, 2005; Mirabell, 2012 |
De geïncludeerde RCT’s zijn van goede kwaliteit en hebben een overwegend laag risico op bias (assessment middels Cochrane Collaboration tool). De belangrijkste studie karakteristieken van de geïncludeerde RCT’s zijn opgenomen in de evidencetabel (zie tabblad “Verantwoording”). In totaal werden negen RCT’s opgenomen in de systematische literatuur analyse. Aangezien de CHHiP studie twee verschillende hypofractioneringsschema’s (HRT60, 60 Gy/20 fracties; HRT57, 57 Gy/ 19 fracties) vergelijkt met conventionele radiotherapie (74 Gy/37 fracties) (Dearnaley, 2016), zijn deze twee vergelijkingen afzonderlijk meegenomen in de meta-analyse. Dit leidt tot 10 gerandomiseerde vergelijkingen, die de effecten van hypofractionering onderzoeken ten opzichte van conventionele radiotherapie (Datta, 2017). Tabel 2 geeft een weergave van de geïncludeerde studies met bijbehorende radiotherapie schema’s.
In totaal werden 8146 patiënten geïncludeerd in deze 9 RCT’s (CRT: n= 3520; HRT: n= 4626). In drie RCT’s werden de patiënten behandeld met een 3-dimensionale conformatie radiotherapie (3D-CRT) (IRE; RAH; Lukka, 2005). Intensiteit gemoduleerde radiotherapie (IMRT) werd uitsluitend toegepast in drie RCT’s (CHHIiP; FCCC; MDACC). In de overige RCT’s werd de behandeling uitgevoerd met behulp van zowel 3D conventionele radiotherapie en IMRT, waarbij de meeste patiënten werden behandeld met IMRT (PROFIT; RTOG; HYPRO). Geen significante baseline verschillen werden gevonden tussen patiënten die werden behandeld met hypofractionering of met conventionele radiotherapie (zie evidencetabel onder het tabblad “Verantwoording”). In totaal includeerden vijf studies een gevarieerde patiëntgroep, met zowel laag-, matig- als hoog-risico patiënten. (CHHIiP; FCCC; Lukka, 2005; MDACC; RAH). Er zijn ook studies die alleen laag-risico patiënten (RTOG), matig-risico patiënten (PROFIT) of zowel matig als hoog-risico patiënten (HYPRO) includeerden.
De volgende primaire eindpunten werden meegenomen in de meta-analyse: biochemisch recidief, klinisch recidief, totale mortaliteit, prostaatcarcinoom specifieke mortaliteit, acute en late gastro-intestinale (gradering ≥2) en acute en late urogenitale toxiciteit (gradering ≥2). Definities met betrekking tot vroege of late toxiciteit worden niet expliciet geformuleerd en kunnen heterogeen zijn in de afzonderlijke studies.
Tabel 2 Samenvatting van RCT’s naar effecten van hypofractionering versus conventionele radiotherapie.
|
|
|
|
|
|
|
Risico groep(%) |
|
Radiotherapie schema |
||||||
|
Study |
ARM |
Total (n) |
T stage |
GS |
PSA (ng/mL) |
L |
M |
H |
ADT (%) |
TD (Gy) |
D/Fx (Gy) |
Fx (n) |
OTT (d) |
FU (y) |
|
PROFIT |
CRT |
598 |
T1-T2 |
≤7 |
≤20 |
0 |
100 |
0 |
5,1 |
78,0 |
2,0 |
39 |
53 |
5 |
|
HRT |
608 |
T1-T2 |
≤7 |
≤20 |
0 |
100 |
0 |
6,0 |
60,0 |
3,0 |
20 |
26 |
|
|
|
IRE |
CRT |
85 |
T1-T3 |
≤10 |
≤100 |
0 |
0 |
100 |
100 |
80,0 |
2,0 |
40 |
54 |
10 |
|
HRT |
83 |
T1-T3 |
≤10 |
≤100 |
0 |
0 |
100 |
100 |
62,0 |
3,1 |
20 |
33 |
|
|
|
RTOG 0415 |
CRT |
542 |
T1-T2 |
≤6 |
≤10 |
100 |
0 |
0 |
0 |
73,8 |
1,8 |
41 |
57 |
5 |
|
HRT |
550 |
T1-T2 |
≤6 |
≤10 |
100 |
0 |
0 |
0 |
60,0 |
2,5 |
24 |
38 |
|
|
|
CHHiP(HRT60) |
CRT |
1065 |
T1-T3 |
≤8 |
≤40 |
15 |
73 |
12 |
97,3 |
74,0 |
2,0 |
37 |
51 |
5 |
|
HRT |
1074 |
T1-T3 |
≤8 |
≤40 |
15 |
73 |
12 |
96,8 |
60,0 |
3,0 |
20 |
26 |
|
|
|
CHHiP(HRT57) |
CRT |
1065 |
T1-T3 |
≤8 |
≤40 |
15 |
73 |
12 |
97,3 |
74,0 |
2,0 |
37 |
51 |
5 |
|
HRT |
1077 |
T1-T3 |
≤8 |
≤40 |
15 |
73 |
12 |
96,8 |
57,0 |
3,0 |
19 |
25 |
|
|
|
HYPRO |
CRT |
397 |
T1-T4 |
≤10 |
≤60 |
0 |
27 |
73 |
67,2 |
78,0 |
2,0 |
39 |
53 |
5 |
|
HRT |
407 |
T1-T4 |
≤10 |
≤60 |
0 |
26 |
74 |
66,3 |
64,6 |
3,4 |
19 |
43 |
|
|
|
FCCC |
CRT |
152 |
T1-T3 |
≤10 |
≤80 |
15,8 |
55,9 |
28,3 |
46,7 |
76,0 |
2,0 |
38 |
52 |
5 |
|
HRT |
151 |
T1-T3 |
≤10 |
≤80 |
14,6 |
57 |
28,5 |
45 |
70,2 |
2,7 |
26 |
36 |
|
|
|
RAH |
CRT |
109 |
T1-T2 |
≤10 |
≤80 |
31,2 |
57,8 |
11 |
0 |
64,0 |
2,0 |
32 |
44 |
7,5 |
|
HRT |
108 |
T1-T2 |
≤10 |
≤80 |
24,1 |
52,8 |
23,1 |
0 |
55,0 |
2,75 |
20 |
26 |
|
|
|
MDACC |
CRT |
102 |
T1-T2 |
≤8 |
≤20 |
29 |
71 |
1 |
19,6 |
75,6 |
1,8 |
42 |
58 |
5 |
|
HRT |
102 |
T1-T2 |
≤8 |
≤20 |
27 |
72 |
1 |
22,5 |
72,0 |
2,4 |
30 |
40 |
|
|
|
LUKKA |
CRT |
470 |
T1-T2 |
≤9 |
≤40 |
24 |
59,1 |
16,8 |
0 |
66,0 |
2,0 |
33 |
45 |
5 |
|
HRT |
466 |
T1-T2 |
≤9 |
≤40 |
24,2 |
56,9 |
75,8 |
0 |
52,5 |
2,62 |
20 |
26 |
|
|
ADT= androgeen deprivatie therapie; CRT= conventionele radiotherapie; D= dosis; FU= follow-up; F= Fractie; GS= Gleason score; H= hoog; HRT= hypofractionering; M= matig; L= laag; OTT= totale behandeltijd; TD= totale dosis.
Resultaten
Biochemisch recidief
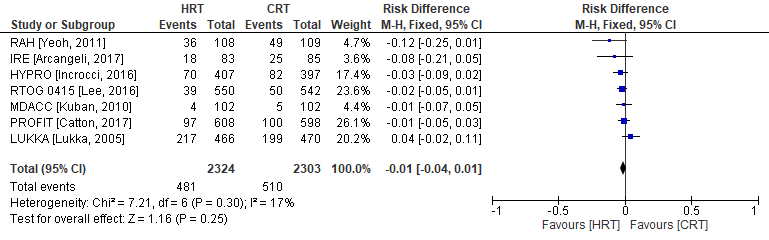
Biochemisch recidief is in zeven van de 9 RCT’s onderzocht (PROFIT, IRE, RTOG, HYPRO, RAH, MDACC, LUKKA). Biochemisch recidief werd in de meeste gevallen bepaald aan de hand van de Phoenix criteria (PROFIT, IRE, RTOG, HYPRO, RAH, MDACC). Lukka (2005) maakte gebruik van de American Society for Radiation Oncology guidelines om biochemisch recidief te bepalen. De mediane follow-up tijd was 5 jaar (range: 5 tot 10 jaar). Biochemisch recidief werd geconstateerd in 481 patiënten (= 20,6%) die zijn behandeld met hypofractionering versus 510 patiënten behandeld met conventionele radiotherapie (=22,1%). Het gemiddelde verschil in risico voor biochemisch recidief is Risk Difference (RD)= -0,01 (95%BI= (-0,04 tot 0,01); p= 0,25; n= 4627), geen statistisch significant verschil tussen de twee groepen (Figuur 1). Random effect-model laat geen statistische heterogeniteit zien: I2=17% (p= ns).
Figuur 1 Verschil in risico (Risk Difference, RD) voor biochemisch recidief tussen patiënten behandeld met HRT (n= 2324) en patiënten behandeld met CRT (n=2303). HRT= Hypofractionering radiotherapie en CRT= Conventionele radiotherapie
Biochemisch of klinisch recidief
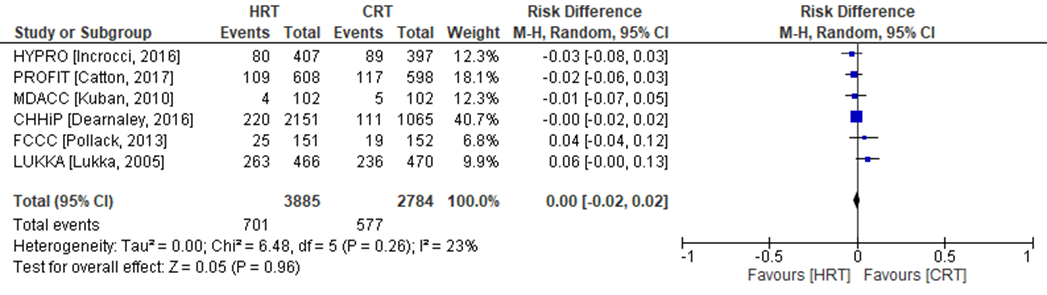
Biochemisch of klinisch recidief is in zes van de negen RCT’s onderzocht (PROFIT, CHHiP, HYPRO, FCCC, MDACC, LUKKA). De mediane follow-up tijd was 5 jaar (range: 5 tot 10 jaar). In de CHHiP trial zijn twee hypofractioneringsschema’s onderzocht (CHHiP57 en CHHiP60), welke in deze analyse zijn samengevoegd (Figuur 2). Biochemisch of klinisch recidief werd geconstateerd in 701 patiënten (=18,0%) die zijn behandeld met hypofractionering versus 577 patiënten behandeld met conventionele radiotherapie (=20,7%). Het gemiddelde verschil in risico voor biochemisch of klinisch recidief is RD= -0,00 (95%BI= (-0,02 tot 0,02); p= 0,96; n= 6669), geen statistisch significant verschil tussen de twee groepen. Random effect-model laat geen statistische heterogeniteit zien: I2= 23% (p= ns).
Figuur 2. Verschil in risico (Risk Difference, RD) voor biochemisch of klinisch recidief tussen patiënten behandeld met hypofractionering (n= 3885) en patiënten behandeld met conventionele radiotherapie (n=2784). HRT= Hypofractionering radiotherapie en CRT= Conventionele radiotherapie
Totale mortaliteit
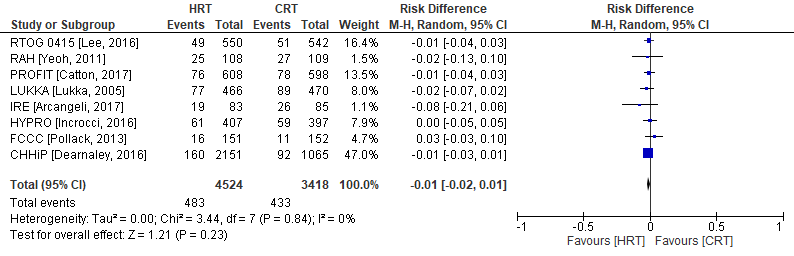
Totale mortaliteit is in acht van de negen RCT’s onderzocht (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC, RAH, LUKKA). De mediane follow-up tijd was 5 jaar (range: 5 tot 10 jaar). In de CHHiP trial zijn twee hypofractioneringsschema’s onderzocht (CHHiP57 en CHHiP60), welke in de analyse zijn samengevoegd (Figuur 3). Totale mortaliteit werd geconstateerd in 483 patiënten (=10,7%) die zijn behandeld met hypofractionering versus 433 patiënten behandeld met conventionele radiotherapie (= 12,7%). Het gemiddelde verschil in risico voor totale mortaliteit is RD= -0,01 (95%BI= (-0,02 tot 0,01); p= 0,23; n= 7942), geen statistisch significant verschil tussen de twee groepen. Random effect-model laat geen statistische heterogeniteit zien: I2= 0% (p= ns).
Figuur 3 Verschil in risico (Risk Difference, RD) voor totale mortaliteit tussen patiënten behandeld met hypofractionering (n=4524) en patiënten behandeld met conventionele radiotherapie (n=3418). HRT= Hypofractionering radiotherapie en CRT= Conventionele radiotherapie
Prostaatcarcinoom specifieke mortaliteit
Prostaatcarcinoom specifieke mortaliteit is in acht van de negen RCT’s onderzocht (PROFIT, IRE, RTOG, HYPRO, FCCC, RAH, MDACC, LUKKA). De mediane follow-up tijd was 5 jaar (range: 5 tot 10 jaar). Prostaatcarcinoom specifieke mortaliteit werd geconstateerd in 49 patiënten (=2,0%) die zijn behandeld met hypofractionering versus 62 patiënten behandeld met conventionele radiotherapie (= 2,5%). Het gemiddelde verschil in risico voor prostaatcarcinoom specifieke mortaliteit is RD= -0,00 (95%BI= (-0,01 tot 0,00); p= 0,37; n= 4930), geen statistisch significant verschil tussen de twee groepen. Random effect-model laat geen statistische heterogeniteit zien: I2= 0% (p= ns) (Figuur 4).
Figuur 4 Verschil in risico (Risk Difference, RD) voor totale prostaatcarcinoom specifieke mortaliteit tussen patiënten behandeld met hypofractionering (n=2475) en patiënten behandeld met conventionele radiotherapie (n=2455). HRT= Hypofractionering radiotherapie en CRT= Conventionele radiotherapie

Acute gastro-intestinale toxiciteit
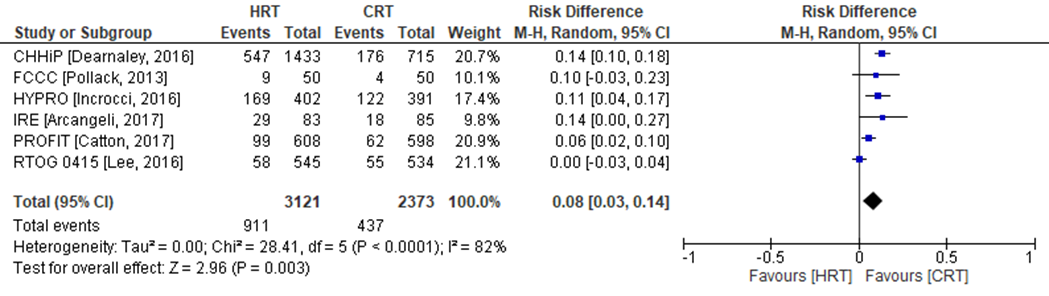
Acute gastro-intestinale toxiciteit is in zes van de negen RCT’s onderzocht (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC). In de CHHiP trial zijn twee hypofractioneringsschema’s onderzocht (CHHiP57 en CHHiP60), welke in de analyse zijn samengevoegd (Figuur 5). Acute gastro-intestinale toxiciteit (≥ 2) werd geconstateerd in 911 patiënten (= 29,2%) die zijn behandeld met hypofractionering versus 437 patiënten behandeld met conventionele radiotherapie (= 19,9%). Het gemiddelde verschil in risico voor acute gastro-intestinale toxiciteit is RD= 0,08 (95%BI= (0,03 tot 0,14); p= 0,003; n= 5494), statistisch significant in het voordeel voor patiënten behandeld met conventionele radiotherapie. Random effect-model laat een overall statistische heterogeniteit zien van I2= 82% (p< 0,001). Vanwege de statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd.
Figuur 5 Verschil in risico (Risk Difference, RD) voor acute gastro-intestinale toxiciteit tussen patiënten behandeld met hypofractionering (n=3121) en patiënten behandeld met conventionele radiotherapie (n=2373). HRT= Hypofractionering radiotherapie en CRT= Conventionele radiotherapie
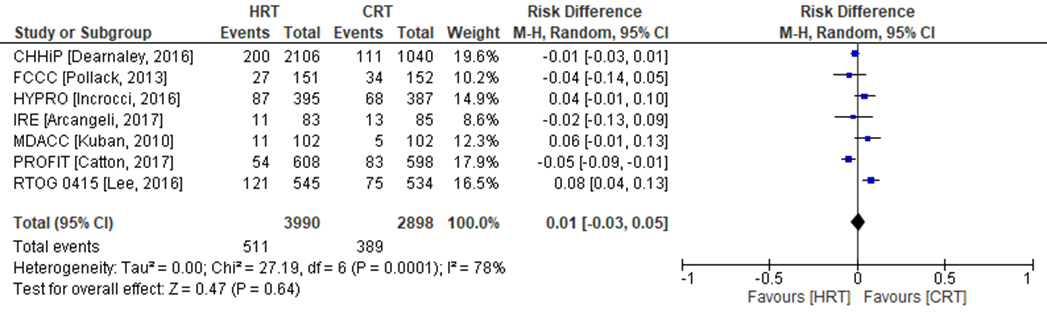
Late gastro-intestinale toxiciteit
Late gastro-intestinale toxiciteit is in zeven van de negen RCT’s onderzocht (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC, MDACC). In de CHHiP trial zijn twee hypofractionerings-schema’s onderzocht (CHHiP57 en CHHiP60), welke in de analyse zijn samengevoegd (Figuur 6). Late gastro-intestinale toxiciteit (≥2) werd geconstateerd in 511 patiënten (= 12,8%) die zijn behandeld met hypofractionering versus 389 patiënten behandeld met conventionele radiotherapie (=13,4%). Het gemiddelde verschil in risico voor acute gastro-intestinale toxiciteit is RD= 0,01 (95%BI= (-0,03 tot 0,05); p= 0,64; n= 6888), geen statistisch significant verschil tussen de twee groepen. Random effect-model laat een overall statistische heterogeniteit zien van I2= 78% (p< 0,001). Vanwege de statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd.
Figuur 6 Verschil in risico (Risk Difference, RD) voor late gastro-intestinale toxiciteit tussen patiënten behandeld met hypofractionering (n=3990) en patiënten behandeld met conventionele radiotherapie (n=2898). HRT= Hypofractionering radiotherapie en CRT= Conventionele radiotherapie
Acute urogenitale toxiciteit
Acute urogenitale toxiciteit is in zes van de negen RCT’s onderzocht (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC). In de CHHiP trial zijn twee hypofractioneringsschema’s onderzocht (CHHiP57 en CHHiP60), welke in de analyse zijn samengevoegd (Figuur 7). Acute urogenitale toxiciteit (≥2) werd geconstateerd in 3122 patiënten (=42,3%) die zijn behandeld met hypofractionering versus 947 patiënten behandeld met conventionele radiotherapie (=39,9%). Het gemiddelde verschil in risico voor acute urogenitale toxiciteit is RD= 0,01 (95%BI= (-0,02 tot 0,03); p= 0,53; n= 5495), geen statistisch significant verschil tussen de twee groepen. Random effect-model laat geen statistische heterogeniteit zien: I2= 0% (p= ns).
Figuur 7 Verschil in risico (Risk Difference, RD) voor acute urogenitale toxiciteit tussen patiënten behandeld met hypofractionering (n=3122) en patiënten behandeld met conventionele radiotherapie (n=2373). HRT= Hypofractionering radiotherapie en CRT= Conventionele radiotherapie

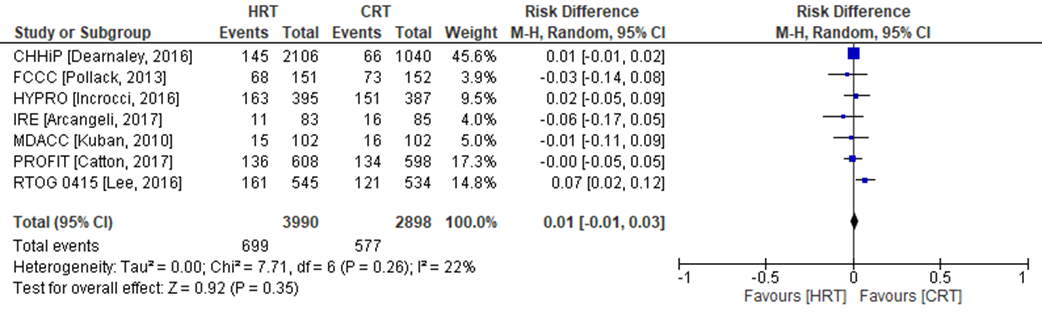
Late urogenitale toxiciteit
Late urogenitale toxiciteit is in zeven van de negen RCT’s onderzocht (PROFIT, IRE, RTOG, CHHiP, HYPRO, FCCC, MDACC). In de CHHiP trial zijn twee hypofractioneringsschema’s onderzocht (CHHiP57 en CHHiP60), welke in de analyse zijn samengevoegd (Figuur 8). Late urogenitale toxiciteit (≥2) werd geconstateerd in 699 patiënten (= 17,5%) die zijn behandeld met hypofractionering versus 577 patiënten behandeld met conventionele radiotherapie (=19,9%). Het gemiddelde verschil in risico voor late urogenitale toxiciteit is RD= 0,01 (95%BI= (-0,01 tot 0,03); p= 0,35; n= 6888), geen statistisch significant verschil tussen de twee groepen. Random effect-model laat geen statistische heterogeniteit zien: I2= 22% (p= ns).
Figuur 8 Verschil in risico (Risk Difference, RD) voor late urogenitale toxiciteit tussen patiënten behandeld met hypofractionering (n=3990) en patiënten behandeld met conventionele radiotherapie (n=2898). HRT= Hypofractionering radiotherapie en CRT= Conventionele radiotherapie
Bewijskracht van de literatuur
De bewijskracht (GRADE-methodiek) is bepaald per uitkomstmaat, de nummering verwijst naar de opeenvolgende literatuurconclusies:
- Biochemisch recidief: de bewijskracht is met één niveau verlaagd vanwege heterogeniteit (diversiteit in hypofractioneringsschema’s en conventionele radiotherapie-schema’s). De bewijskracht is REDELIJK.
- Biochemisch of klinisch recidief: de bewijskracht is met één niveau verlaagd vanwege risico van bias (geen blindering van interventie, mogelijke invloed op bepaling van biochemisch of klinisch recidief en daarmee van invloed op de uitkomstmaat), en één niveau vanwege heterogeniteit (diversiteit in hypofractioneringsschema’s en conventionele radiotherapieschema’s). De bewijskracht is LAAG.
- Totale mortaliteit: de bewijskracht is met één niveau verlaagd vanwege heterogeniteit (diversiteit in hypofractioneringsschema’s en conventionele radiotherapieschema’s). De bewijskracht is REDELIJK.
- Prostaatcarcinoom specifieke mortaliteit: de bewijskracht is met één niveau verlaagd vanwege heterogeniteit (diversiteit in hypofractioneringsschema’s en conventionele radiotherapieschema’s). De bewijskracht is REDELIJK.
- Acute gastro-intestinale toxiciteit: de bewijskracht is met één niveau verlaagd vanwege risico op bias (geen blindering van interventie, mogelijke invloed op bepaling van acute gastro-intestinale toxiciteit en daarmee van invloed op de uitkomstmaat), en één niveau vanwege heterogeniteit (diversiteit in hypofractioneringsschema’s en conventionele radiotherapieschema’s). De bewijskracht is LAAG.
- Late gastro-intestinale toxiciteit: de bewijskracht is met één niveau verlaagd vanwege risico op bias (geen blindering van interventie, mogelijke invloed op bepaling van late gastro-intestinale toxiciteit en daarmee van invloed op de uitkomstmaat), en één niveau vanwege heterogeniteit (diversiteit in hypofractioneringsschema’s en conventionele radiotherapieschema’s). De bewijskracht is LAAG.
- Acute urogenitale toxiciteit: de bewijskracht is met één niveau verlaagd vanwege risico op bias (geen blindering van interventie, mogelijke invloed op bepaling van acute urogenitale toxiciteit en daarmee van invloed op de uitkomstmaat), en één niveau vanwege heterogeniteit (diversiteit in hypofractioneringsschema’s en conventionele radiotherapieschema’s). De bewijskracht is LAAG.
- Late urogenitale toxiciteit: de bewijskracht is met één niveau verlaagd vanwege risico op bias (geen blindering van interventie, mogelijke invloed op bepaling van late urogenitale toxiciteit en daarmee van invloed op de uitkomstmaat), en één niveau vanwege heterogeniteit (diversiteit in hypofractioneringsschema’s en conventionele radiotherapieschema’s). De bewijskracht is LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: Wat zijn de (on)gunstige effecten van hypofractionering ten opzichte van het conventionele radiotherapieschema bij patiënten met niet-gemetastaseerd prostaatcarcinoom?
Zoekvraag
Wat zijn de (on)gunstige effecten van hypofractionering ten opzichte van het standaard radiotherapieschema bij patiënten met niet-gemetastaseerd prostaatcarcinoom?
Patiënten: volwassen patiënten (≥18 jaar) met niet-gemetastaseerd prostaatcarcinoom;
Interventie: hypofractionering;
Comparison: conventionele radiotherapie (standaard schema);
Outcome: biochemisch recidief, biochemisch of klinisch recidief, totale mortaliteit, prostaatcarcinoom specifieke mortaliteit, acute gastro-intestinale toxiciteit, late gastro-intestinale toxiciteit, acute urogenitale toxiciteit, late urogenitale toxiciteit.
Relevante uitkomstmaten
De werkgroep achtte totale overleving een voor de besluitvorming cruciale uitkomstmaat; tumor recidief, progressievrije overleving, bijwerkingen (erectiele disfunctie), complicaties en kwaliteit van leven voor de besluitvorming zijn daarnaast belangrijke secundaire uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID, Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 18 mei 2018 met relevante zoektermen gezocht vanaf het jaar 2000 naar systematische reviews (SR’s) en RCT’s die de waarde van hypofractionering vergelijken met conventionele radiotherapie in de behandeling van mannen met niet-gemetastaseerd prostaatcarcinoom. De zoekverantwoording is weergegeven onder het tabblad “Verantwoording”. De literatuurzoekactie leverde 466 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: volwassenen met niet-gemetastaseerd prostaatcarcinoom, behandeld met hypofractionering versus conventionele radiotherapie, vergelijkend onderzoek en daarbij een door de werkgroep geselecteerde uitkomstmaat. Op basis van titel en abstract werden in eerste instantie 42 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 41 studies geëxcludeerd (zie exclusietabel onder het tabblad verantwoording), en één studie definitief geselecteerd. De literatuuranalyse is gebaseerd op één recente SR (Datta, 2017). De SR includeert 19 publicaties en beschrijft een meta-analyse met daarin een directe vergelijking tussen de effectiviteit van hypofractionering versus conventionele radiotherapie bij volwassen patiënten met gelokaliseerd (of lokaal gevorderd), niet-gemetastaseerd prostaatcarcinoom (Datta, 2017). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- 1 - Catton CN, Lukka H, Gu CS, et al. Randomized trial of a hypofractionated radiation regimen for the treatment of localized prostate cancer. J Clin Oncol 2017;35:1884-1890.
- 2 - Arcangeli G, Saracino B, Arcangeli S, et al. Moderate hypofractionation in high-risk, organ-confined prostate cancer: Final results of a phase III randomized trial. J Clin Oncol 2017;35:1891-1897.
- 3 - Arcangeli G, Fowler J, Gomellini S, et al. Acute and late toxicity in a randomized trial of conventional versus hypofractionated threedimensional conformal radiotherapy for prostate cancer. Int J Radiat Oncol Biol Phys 2011;79:1013-1021.
- 4 - Arcangeli G, Saracino B, Gomellini S, et al. A prospective phase III randomized trial of hypofractionation versus conventional fractionation in patients with high-risk prostate cancer. Int J Radiat Oncol Biol Phys 2010;78:11-18.
- 5 - Lee WR, Dignam JJ, Amin MB, et al. Randomized phase III noninferiority study comparing two radiotherapy fractionation schedules in patients with low-risk prostate cancer. J Clin Oncol 2016;34:2325-2332.
- 6 - Dearnaley D, Syndikus I, Mossop H. Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-Year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 2016;17:1047-1060.
- 7 - Incrocci L, Wortel RC, Alemayehu WG, et al. Hypofractionated versus conventionally fractionated radiotherapy for patients with localised prostate cancer (HYPRO): Final efficacy results from a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol 2016;17:1061-1069.
- 8 - Aluwini S, Pos F, Schimmel E, et al. Hypofractionated versus conventionally fractionated radiotherapy for patients with prostate cancer (HYPRO): Acute toxicity results from a randomised noninferiority phase 3 trial. Lancet Oncol 2015;16:274-283.
- 9 - Aluwini S, Pos F, Schimmel E, et al. Hypofractionated versus conventionally fractionated radiotherapy for patients with prostate cancer (HYPRO): Late toxicity results from a randomised, noninferiority, phase 3 trial. Lancet Oncol 2016;17:464-474.
- 10 - Pollack A, Walker G, Horwitz EM, et al. Randomized trial of hypofractionated external-beam radiotherapy for prostate cancer. JClin Oncol 2013;31:3860-3868.
- 11 - Pollack A, Hanlon AL, Horwitz EM, et al. Dosimetry and preliminary acute toxicity in the first 100 men treated for prostate cancer on a randomized hypofractionation dose escalation trial. Int J Radiat Oncol Biol Phys 2006;64:518-526.
- 12 - Shaikh T, Li T, Handorf EA, et al. Long-term patient-reported outcomes from a phase 3 randomized prospective trial of conventional versus hypofractionated radiation therapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2017;97:722-731.
- 13 - Yeoh EE, Botten RJ, Butters J, et al. Hypofractionated versus conventionally fractionated radiotherapy for prostate carcinoma: Final results of phase III randomized trial. Int J Radiat Oncol Biol Phys 2011;81:1271-1278.
- 14 - Yeoh EEK, Fraser RJ, McGowan RE, et al. Evidence for efficacy without increased toxicity of hypofractionated radiotherapy for prostate carcinoma: Early results of a phase III randomized trial. Int J Radiat Oncol Biol Phys 2003;55:943-955.
- 15 - Yeoh EE, Holloway RH, Fraser RJ, et al. Hypofractionated versus conventionally fractionated radiation therapy for prostate carcinoma: Updated results of a phase III randomized trial. Int J Radiat Oncol Biol Phys 2006;66:1072-1083.
- 16 - Kuban DA, Nogueras-Gonzalez GM, Hamblin L, et al. Preliminary report of a randomized dose escalation trial for prostate cancer using hypofractionation. Int J Radiat Oncol Biol Phys 2010;78:S58-S59.
- 17 - Hoffman KE, Voong KR, Pugh TJ, et al. Risk of late toxicity in men receiving dose-escalated hypofractionated intensity modulated prostate radiation therapy: Results from a randomized trial. Int J Radiat Oncol Biol Phys 2014;88:1074-1084.
- 18 - Lukka H, Hayter C, Julian JA, et al. Randomized trial comparing two fractionation schedules for patients with localized prostate cancer. J Clin Oncol 2005;23:6132-6138.
- 19 - Miralbell R, Roberts SA, Zubizarreta E, et al. Dose-fractionation sensitivity of prostate cancer deduced from radiotherapy outcomes of 5,969 patients in seven international institutional datasets: Alpha/beta Z 1.4 (0.9-2.2) Gy. Int J Radiat Oncol Biol Phys 2012;82:e17-e24.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Datta, 2017 |
SR van phase III RCT’s. Prospective randomized clinical trials of HRT and CRT for LLPaC; a minimum follow-up period of 5 years; studies that treated patients exclusively with external beam photon RT |
Patients with localized or locally advanced prostate cancer |
Hypofractionated radiation therapy (HRT) |
Conventional radiation therapy (CRT) |
5 y
|
Biochemical Failure RD= -0,01 (95%BI= [-0,04 tot 0,01]; p= 0,25; n= 4627
Biochemical or Clinical Failure RD= -0,00 (95%BI= [-0,02 tot 0,02]; p= 0,96; n= 6669
Overall mortality RD= -0,01 (95%BI= [-0,02 tot 0,01]; p= 0,23; n= 7942
Prostate cancer-specific mortality RD= -0,00 (95%BI= [-0,01 tot 0,00]; p= 0,37; n= 4930
Gastro-intestinal toxicity acute RD= 0,08 (95%BI= [0,03 tot 0,14]; p= 0,003; n= 5494
Gastro-intestinal toxicity late RD= 0,01 (95%BI= [-0,03 tot 0,05]; p= 0,64; n= 6888
Genitourinary toxicity acute RD= 0,01 (95%BI= [-0,02 tot 0,03]; p= 0,53; n= 5495 Genitourinary toxicity late RD= 0,01 (95%BI= [-0,01 tot 0,03]; p= 0,35; n= 6888 |
‘HRT provides similar therapeutic outcomes to CRT in LLPCa, except for a significantly greater risk of acute GI toxicity.’ |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Datta, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
YEs |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Tabel Overzicht RCT’s met bijbehorende publicaties
|
Study |
Publicaties |
|
PROFIT |
Catton, 2017 |
|
IRE |
Arcangeli, 2010; Arcangeli, 2011; Arcangeli, 2017 |
|
RTOG |
Lee, 2016 |
|
CHHiP |
Dearnaley, 2016 |
|
HYPRO |
Aluwini, 2015; Aluwini, 2016; Incrocci, 2016 |
|
FCCC |
Pollack, 2006; Pollack, 2013; Shaikh, 2017 |
|
RAH |
Yeoh, 2003; Yeoh, 2006; Yeoh, 2011 |
|
MDACC |
Kuban, 2010; Hoffman, 2014 |
|
LUKKA |
Lukka, 2005; Mirabell, 2012 |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Wilson, 2018 |
Subgroep analyse van CHHiP trial (<75y vs >75) |
|
Wang, 2018 |
Ernstige RoB, small sample size (n= 40) |
|
Fonteyne, 2018 |
Komt niet overeen met PICO: (hypofractioneringsschema) geen controle. |
|
Chang, 2018 |
Komt niet overeen met PICO: geen vergelijkend onderzoek (controle) |
|
Wortel, 2017 |
Subanalyses van de HYPRO trial (assess differences between centers) |
|
Tiberi, 2017 |
Exerpt review voldoet in aan studieselectiecriteria |
|
Shaikh, 2017 |
In SR van Datta (2017) |
|
Pervez, 2017 |
Komt niet overeen met PICO: geen vergelijkend onderzoek (controle) |
|
Pasquier, 2017 |
Komt niet overeen met PICO: geen follow-up |
|
Onjukka, 2017 |
Komt niet overeen met PICO: geen vergelijkend onderzoek (controle) |
|
Lieng, 2017 |
Komt niet overeen met PICO: (Image Guided-IMRT) |
|
Kozuka, 2017 |
Komt niet overeen met PICO: assessment of complicatie (outcome) |
|
Faria, 2017 |
Komt niet overeen met PICO: geen vergelijkend onderzoek (controle) |
|
Catton, 2017 |
In SR van Datta (2017) |
|
Arcangeli, 2017 |
In SR van Datta (2017) |
|
Shaikh, 2017 |
In SR van Datta (2017) |
|
Zimmermann, 2016 |
Komt niet overeen met PICO |
|
Wortel, 2016 |
Komt niet overeen met PICO: andere uitkomstmaten in analyse |
|
Sanguineti, 2016 |
Komt niet overeen met PICO: andere uitkomstmaten in analyse |
|
Lee, 2016 |
In SR van Datta (2017) |
|
Dearnaley, 2016 |
In SR van Datta (2017) |
|
Incrocci, 2016 |
In SR van Datta (2017) |
|
Hoffman, 2016 |
Komt niet overeen met PICO: andere uitkomstmaten in analyse |
|
Aluwini, 2016 |
In SR van Datta (2017) |
|
Wilkins, 2016 |
Follow-up van twee jaar: voldoet niet aan inclusiecriteria Datta (2017) |
|
Aluwini, 2015 |
In SR van Datta (2017) |
|
Hoffman, 2014 |
In SR van Datta (2017) |
|
Pollack, 2013 |
In SR van Datta (2017) |
|
Dearnaley, 2012 |
Follow-up van twee jaar |
|
Mirabell, 2012 |
In SR van Datta (2017) |
|
Yeoh, 2011 |
In SR van Datta (2017) |
|
Vogelius, 2011 |
Komt niet overeen met PICO: andere uitkomstmaten in analyse |
|
Arcangeli, 2011 |
In SR van Datta (2017) |
|
Arcangeli, 2010 |
In SR van Datta (2017) |
|
Kuban, 2010 |
In SR van Datta (2017) |
|
Kupelian, 2007 |
Komt niet overeen met PICO |
|
Yeoh, 2006 |
In SR van Datta (2017) |
|
Pollack, 2006 |
In SR van Datta (2017) |
|
Lukka, 2005 |
In SR van Datta (2017) |
|
Kupelian, 2005 |
Komt niet overeen met PICO |
|
Yeoh, 2003 |
In SR van Datta (2017) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-01-2020
Beoordeeld op geldigheid : 06-05-2019
|
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
|
Hypofractionering |
NVU |
2019 |
2024 |
5 jaar |
NVU |
Ontwikkeling nieuwe therapieën of nieuwe publicaties |
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep:
- Dr. T.M. de Reijke, uroloog, werkzaam in het Amsterdam Universitair Medische Centra, locatie AMC, NVU, voorzitter
- Prof. dr. J.O. Barentsz, radioloog, werkzaam in het RadboudUMC, NVvR
- Drs. J.L.L.M. Coenen, internist-oncoloog, werkzaam bij Isala, NIV
- Dhr. R. van der Giessen, patiënten vertegenwoordiger, Prostaatkankerstichting
- Prof. dr. J.A. Gietema, internist-oncoloog, werkzaam in het Universitair Medisch Centrum Groningen, NIV
- Prof. dr. L. Incrocci, radiotherapeut-oncoloog, werkzaam in het Erasmus Medisch centrum, NVRO
- Dr. M.J.R. Janssen, nucleair geneeskundige, werkzaam in het RadboudUMC, NVvN
- Dr. G.J.L.H. van Leenders, patholoog, werkzaam in het Erasmus Medisch Centrum, NVvP
- Prof. dr. R.J.A. van Moorselaar, uroloog, werkzaam in het Amsterdam Universitair Medische Centra, locatie VUmc, NVU
- Drs. H. Niekus, patiënten vertegenwoordiger, Prostaatkankerstichting
- Dr. I. van Oort, uroloog, werkzaam bij het RadboudUMC, NVU
- Dr. I. Schoots, radioloog, werkzaam bij het Erasmus MC, NVvR
- C. Tillier, verpleegkundig specialist urologie, V&VN
- Drs. H.A.M. Vanhauten, werkzaam in het Universitair Medisch Centrum Groningen, radiotherapeut-oncoloog, NVRO
- Dr. E. Vegt, nucleair geneeskundige, werkzaam in het Antoni van Leeuwenhoek ziekenhuis, NVvN
Met ondersteuning van:
- Dr. I. Mostovaya, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
de Reijke |
Uroloog, Amsterdam UMC, locatie AMC |
Geen |
AMGEN, Ferring, Astellas, Janssen |
Geen actie |
|
van Leenders |
Patholoog, Erasmus MC, Rotterdam |
Geen |
Consulent Roche (betaald) |
Geen actie |
|
Van Oort |
Uroloog, RadboudUMC Nijmegen |
Geen |
Astellas, Janssen, Bayer, Sanofi, Mdxhealth |
Geen actie |
|
Vegt |
Nucleair geneeskundige NKI-AVL, Amsterdam |
Geen |
Geen |
Geen actie |
|
Coenen |
Internist, medisch oncoloog Isala, Zwolle |
Lid adviesraad cabazitaxel; Sanofi (betaald 1x / jaar) |
- |
Geen actie |
|
Tillier |
Verpleegkundig Specialist Urologie, NKI-AVL, Amsterdam |
Geen |
Geen |
Geen actie |
|
van Moorselaar |
Uroloog, Amsterdam UMC, locatie VUmc |
Geen |
adviescommissie: |
Geen actie |
|
Barentsz |
radioloog, RadboudUMC Nijmegen |
Geen |
- |
Geen actie |
|
Gietema |
Internist-oncoloog |
Geen |
Geen |
Geen actie |
|
Niekus |
Patiënt/Donateur PKS/lid kwaliteitscommissie PKS |
Geen |
Kapitaal in belegginsdossier in allerlei regio's. |
Geen actie |
|
Schoots |
Radioloog ErasmusMC, Rotterdam |
Geen |
Geen |
Geen actie |
|
Incrocci |
Radiotherapeut, |
Geen |
Geen |
Geen actie |
|
Vanhauten |
Radiotherapeut, UMC Groningen. |
Geen |
2017 spreker diversen nascholing < 10 uur op jaarbasis, vergoeding en onkostenvergoeding |
Geen actie |
|
Giessen |
Gepensioneerd. Geen bestaand dienstverband. |
Als vrijwilliger lid van: |
Uitkomst richtlijnen kan geen financieel voordeel opleveren. |
Geen actie |
|
Janssen |
Nucleair geneeskundige, RadboudUMC Nijmegen |
- Voorzitter onderwijscommissie NVNG, onbetaald |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van een patiëntenvereniging, de ProstaatKankerStichting, in de werkgroep te laten participeren.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door werkgroep/commissie Prostaatcarcinoom van de NVU (2017) bleek dat er een noodzaak was voor (revisie) van deze richtlijnmodule.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad Zoekverantwoording voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR – voor systematische reviews.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor: Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij één van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en welke worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die een randvoorwaarde zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de bijlage Kennislacunes. Deze bijlage is te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via: secretariaat@kennisinstituut.nl.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000 – mei 2018
|
1 exp *Prostatic Neoplasms/ or (prostat* adj2 (cancer* or carcinoma* or tumor* or tumour* or neoplasm* or adenocarcinoma)).ti. or (PCa or mPCa or mHSPC).ti. (111488) 2 (exp *Dose Fractionation/ or exp *Dose Hypofractionation/ or hypofraction*.ti. or fractionat*.ti. or fraction.ti. or high dose.ti. or short course.ti.) and (radiotherap* or radiation therap* or rt).ti. (4172) 3 1 and 2 (588) 4 limit 3 to (english language and yr="2000 -Current") (552)
Gebruikte filters: Systematic Reviews: (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (355615)
Randomized Controlled Trials (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1758069)
Observationele designs: Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2976333)
= 401 |
466 |
|
Embase (Elsevier) |
(('hypofractionated radiotherapy'/exp/mj OR ((hypofraction*:ti OR fractionat*:ti OR fraction:ti OR 'high dose':ti OR 'short course':ti) AND (radiotherap*:ti OR 'radiation therap*':ti OR rt:ti))) AND ('prostate cancer'/exp/mj OR ((prostat* NEAR/2 (cancer* OR carcinoma* OR tumor* OR tumour* OR neoplasm*)):ti) OR pca:ti OR mpca:ti OR mhspc:ti) AND [english]/lim AND [2000-2018]/py NOT 'conference abstract':it)
Gebruikte filters: Systematic Reviews: (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))
Randomized Controlled Trials (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it))
(('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti))
= 293 |
