Aanvullende diagnostiek bloedverlies per anum
Uitgangsvraag
Wanneer is er een indicatie voor een colonoscopie bij patiënten met (gering) bloedverlies per anum?
Aanbeveling
Voor patiënten jonger dan 50 jaar met bloedverlies per anum zonder risico-indicatoren voor CRC* kan colonoscopie achterwege worden gelaten (volgens de vigerende de NHG standaard uit 2017).
Voor patiënten jonger dan 50 jaar met bloedverlies per anum, met risico-indicatoren voor CRC* dient een colonoscopie verricht te worden (gelijk aan de NHG standaard).
Bij persisterend bloedverlies per anum, na behandeling voor proctologische aandoeningen, dient in samenspraak met de patiënt een colonoscopie overwogen te worden.
Bij patiënten met een hoog risico op complicaties bij een colonoscopie dient individueel afgewogen te worden of een colonoscopie verricht moet worden ter uitsluiting van CRC of een hoog-risico adenoom (HRA). Zo nodig kan voor een CT colografie gekozen worden.
*Risico-indicatoren voor CRC bij patiënten met bloedverlies per anum (veranderd defecatiepatroon, ontlasting vermengd met bloed, afwezigheid perianale afwijkingen en intra-anale afwijkingen, CRC-familie).
Zie ook het stroomdiagram bij de aanverwante producten van deze module.
*Bij verdenking op andere pathologie zie de betreffende richtlijn.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De multicenter, dubbel-geblindeerde diagnostische accuratesse studie van Hicks (2021) (NICE FIT studie) onderzocht of de fecale immunochemische test (FIT) veilig colorectale kanker kan uitsluiten bij patiënten met rectaal bloedverlies. Van de 9822 patiënten die in de studie werden geïncludeerd, werden er 3143 (32,0%) doorverwezen met rectaal bloedverlies. Bij 4,7% van de patiënten met rectale bloedingen was er sprake van een colorectaal carcinoom, terwijl bij 2,7% van de patiënten zonder rectaal bloedverlies sprake was van een colorectaal carcinoom. Fecaal hemoglobine was aantoonbaar bij 44,1% van de patiënten met rectaal bloedverlies en 33,9% zonder rectaal bloedverlies. De sensitiviteit van de FIT-test voor colorectaal carcinoom bij rectaal bloedverlies versus geen rectaal bloedverlies was 98,6% (95% BI 95,2 tot 99,8%). De sensitiviteit voor fecaal hemoglobine >2 µg/g voor patiënten met rectaal bloedverlies was 95,6% (95% BI 91,5 tot 98,1) en 86,3% (95% BI 80,4 tot 90,9) voor fecale hemoglobine >10 µg/g. Concluderend is fecale hemoglobine niet altijd aantoonbaar bij patiënten met rectaal bloedverlies. Zesenvijftig procent van de patiënten had niet-detecteerbare fecale hemoglobine (<2 µg/g) en colorectaal carcinoom was aanwezig in 0,1% van de patiënten. De hoge sensitiviteit van de FIT-test is bruikbaar voor het uitsluiten van een colorectaal carcinoom bij patiënten met rectaal bloedverlies.
De pilotstudie van D’Souza (2020) onderzocht de haalbaarheid voor het gebruik van de fecale immunochemische test (FIT) bij symptomatische patiënten met een laag en hoog risico op colorectale kanker. In de studie werd er bij 298 patiënten een fecale immunochemische test afgenomen voorafgaand aan een colonoscopie. Er bleek geen significante variatie te zijn in fecale hemoglobinegehalten ten aanzien van leeftijd, geslacht of etniciteit. De algehele detectiewaarde van colorectale kanker was 100% bij 2 µg/g en 92% bij >10 µg/g. Indien een drempelwaarde voor fecaal hemoglobine voor onderzoek van 2 µg/g (d.w.z. traceerbaar) of 10 µg/g zou zijn gehanteerd, zou het aantal colonoscopieën bij alle symptomatische patiënten met respectievelijk 70% en 84% zijn gedaald. Voor patiënten met een laag risico bleef de sensitiviteit van de fecale immunochemische test voor colorectale kanker bij beide drempelwaarden van 2 µg/g of 10 µg/g 100%, waarbij het aantal colonoscopieën met respectievelijk 80% en 91% werd verminderd. Concluderend toont de studie aan dat de fecale immunochemische test een veelbelovende technologie is die colorectale kanker kan aantonen bij symptomatische patiënten met hoog of laag risico bij een drempelwaarde van detecteerbare fecale hemoglobine.
Patiënten ouder dan 50 jaar met bloedverlies per anum krijgen volgens de NHG-standaard een colonoscopie. Er zijn vooralsnog in de literatuur geen redenen om hier van de NHG-standaard af te wijken. Het is echter de vraag hoe er gehandeld dient te worden bij patiënten onder de 50 jaar die geen risico-indicatoren (veranderd defecatiepatroon, ontlasting vermengd met bloed, afwezigheid perianale afwijkingen, CRC familie <70e jaar) of verdenking op een inflammatoir darmlijden hebben. Hieronder worden de beschikbare literatuur en overwegingen beschreven.
In hoeverre kan men bij patiënten <50 jaar met bloedverlies per anum en hemorroïden zonder risico-indicatoren afzien van colonoscopie?
Bij patiënten met een fissuur, fistel of een anuscarcinoom is bloedverlies per anum meestal niet het enige symptoom, zodat deze discussie zich toespitst op hemorroïden. Er zijn weinig studies die deze vraag direct beantwoorden.
In de studie van Hussian (2019) werd bij 318 patiënten met milde tot matige bloedingen in het onderste maagdarmkanaal (met en zonder diarree) een sigmoïdoscopie uitgevoerd. Bij 23 patiënten (7.2%) werd een gevorderd adenoom of CRC gevonden. Hemorroïden werden bij 111 patiënten (34.9%) en poliepen bij 54 patiënten (17,0%) gevonden.
Een retrospectieve, observationele studie (Lu, 2019) die de algehele diagnostische waarde van een colonoscopie onderzocht bij jonge patiënten (≤40 jaar) met helderrood rectaal bloedverlies vond bij 10 patiënten (5,0%) een gevorderd adenoom of CRC.
In de studie van Müller (2019) werd bij één patiënt (0,5%) met een rectale bloeding veroorzaakt door anale problematiek een gevorderd adenoom of CRC geconstateerd. Van de totale studiepopulatie werden er bij 130 patiënten (69,5%) hemorroïden en bij 60 patiënten (32,1%) poliepen gevonden.
In de studie van Khalid (2011) werd bij 379 patiënten met helderrood rectaal bloedverlies zonder risicofactoren een colonoscopie verricht. Hemorroïden werden gevonden bij 219 patiënten (57.2%), waarvan bij 198 patiënten hemorroïden de enige bevinding waren (52,2%). In de totale populatie werd bij de 248 patiënten <40 jaar (65%) bij 7 (2,8%) een gevorderd adenoom of CRC gevonden, allemaal gelokaliseerd in het distale colon. Bij de patiënten >40 jaar was dit 7%, waarbij één tumor in het proximale colon was gevonden (Khalid,2011). Het is echter de vraag in hoeverre deze resultaten uit Zuid-Azië geëxtrapoleerd kunnen worden naar de Nederlandse situatie. In een Nederlandse studie waarin alle patiënten met rectaal bloedverlies en hemorroïden een colonoscopie ondergingen, werden bij 861 (45,1%) patiënten enkel hemorroïden gevonden; bij 1049 (54,9%) patiënten werden hemorroïden plus een additionele vondst gevonden. In totaal hadden 48 (4,7%) patiënten een CRC. Carcinomen en andere colonpathologie werd vaker gezien bij ouderen (Koning, 2010). In deze studie werden patiënten met risicofactoren echter niet geëxcludeerd.
Een Britse studie bij 604 patiënten die een “open acces” diagnostische kliniek bezochten in verband met bloedverlies (alle soorten), toonde dat bij patiënten met hemorroïden (n=159 (26,3%)) bij 2% een CRC aanwezig was (Robertson, 2006). In studie uit Iran werd bij 404 patiënten met rectaal bloedverlies zonder risicofactoren een colonoscopie verricht. Bij 218 (54,2%) werden hemorroïden gevonden (<40 jaar: 62 (35,0%) en >40 jaar 156 (69,3). In totaal werd bij 6,5% een CRC (<40 jaar: 4 (2,3%); >40 jaar: 22 (9,8%)) en bij 7,5% adenomateuze poliepen gevonden. Slechts bij twee patiënten werd er een laesie in het transversum gevonden, waarbij beide patiënten wel hemorroïden hadden (Nikpour, 2008). Het is in deze studie echter onduidelijk bij hoeveel van de patiënten met hemorroïden een carcinoom gevonden werd.
Een studie in USA bij in een tertiair centrum door eenzelfde endoscopist was de indicatie voor colonoscopie (9098 patiënten) bij 703 (7,7 %) helderrood bloedverlies. Bij deze 703 patiënten werd bij 47 (6,7%) een CRC of een advanced polyp gevonden. Bij de 182 patiënten <50 jaar hadden slechts 3 (1,6) een CRC of een advanced polyp. De plaats van deze bevindingen werd in de studie niet gerapporteerd (Marderstein, 2008).
Koning (2010) keek prospectief naar bijkomende pathologie bij patiënten verwezen voor hemorroïden behandeling. Bij 961 van de 1005 (95%) waren hemorroïden aanwezig. Bij acht patiënten werd een maligniteit gevonden, allen ouder dan 40 jaar. Zij suggereren een sigmoïdoscopie boven het 40e jaar. In hoeverre er alarmsymptomen aanwezig waren en wat de locatie was bij deze acht patiënten wordt niet helemaal duidelijk (Vening, 2010).
Al deze studies laten zien dat de kans dat een patiënt met minimaal helderrood bloedverlies en hemorroïden onder de 50 jaar en vooral onder de 40 jaar een (rectaal) CRC heeft als oorzaak van rectaal bloedverlies, uitermate klein is.
Het voorkomen van een colorectaal carcinoom onder het 50e jaar volgens gegevens van het NKI in 2020 bedraagt 700, waarvan bijna 400 tussen de 45 en 50 jaar. De vigerende richtlijn uit de NHG-standaard waarbij de leeftijdsgrens van 50 wordt gehanteerd is uit februari 2017.
De werkgroep is daarom van mening dat bij persisterend bloedverlies, waarbij er na behandeling geen effect optreedt en er geen sprake is van aanwezigheid van risicofactoren, ook een colonoscopie dient te krijgen. Patiënten met een leeftijd <45 jaar waarbij andere risico-indicatoren ontbreken, komen niet in aanmerking om standaard aanvullende diagnostiek in te zetten om CRC uit te sluiten.
Daarnaast zijn er situaties waarbij aanvullende diagnostiek zeer wenselijk kan zijn. Bij sommige patiënten treedt na behandeling van hemorroïden geen verbetering in de klachten op (zie ook de module behandelalgoritme hemorroïden). Bij deze patiënten moet zeker opnieuw worden overwogen colonoscopie in te zetten. In alle gevallen moet de mogelijke winst van het inzetten van aanvullende diagnostiek worden afgewogen tegen de mogelijk nadelige effecten, die overigens minimaal zijn, zeker bij de jongere patiënt.
Een colonoscopie heeft een geringe kans op complicaties. Het risico op een ernstige complicatie (perforatie, nabloeding) is 0,02%. Factoren die het risico op deze complicaties verhogen zijn: instrumentatie (poliepectomie), stollingsproblemen (bloedingen) en afhankelijk van de soort ingreep is het risico hoger. Patiënten met ASA-klasse 3 tot 4 hebben een verhoogd risico op cardiopulmonale problemen (Church, 2013). Bij patiënten met een verhoogd risico op complicaties bij de colonoscopie (ASA IV) kan overwogen worden om een CT-colografie te doen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het doel is om te voorkomen dat er een colorectaal carcinoom of een inflammatoire darmziekte wordt gemist. Het is dan ook een dringend advies om een colonoscopie te ondergaan.
Bij een colonoscopie wordt het laxeren als onplezierig ervaren. Daarnaast bestaat er, zoals eerder beschreven, altijd een kleine kans op een complicatie. Bij patiënten met een hoog risico op complicaties kan een CT colografie worden overwogen. Zie voor het patiëntenperspectief de module Patiëntenperspectief bij proctologie.
Kosten (middelenbeslag)
De kosten voor een coloscopie zijn standaard en is geen extra kostenpost, omdat deze binnen ‘good clinical practice’ vallen. Er is geen literatuur aangaande de kosten over specifieke voorkeuren van de patiënt.
Aanvaardbaarheid, haalbaarheid en implementatie
Een coloscopie is een algemeen aanvaard diagnosticum voor onbegrepen rectaal bloedverlies en ook in de preventieve zorg bij het Bevolkingsonderzoek (BVO) op dikke darmkanker en is al geaccepteerd, haalbaar gebleken en geïmplementeerd. Het doen van een colonoscopie tussen de 45 en 50 jaar die voor proctologisch spreekuur verwezen worden is door voortschrijdend inzicht verkregen uit de gegevens van BVO dikke darmkanker en moet als zodanig besproken worden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De richtlijn rectaal bloedverlies is uit 2017 en geeft aan dat beneden het 50e jaar bij ontbreken van andere risicofactoren buiten het rectaal bloedverlies om, er geen indicatie voor een coloscopie is. Voortschrijdend inzicht uit gegevens van het BVO-darmkanker hebben aangetoond dat er een stijgende tendens is bij patiënten tussen de 45 en 50 jaar. Om die reden adviseren wij een coloscopie ook voor die leeftijdsgroep. De nadelen zijn een extra coloscopie met lavage en een minimaal risico op een complicatie. Het voordeel is het uitsluiten van een colorectaal carcinoom en het kunnen behandelen van een (pre) maligne aandoening middels poliepectomie (poliep) of een operatie (maligniteit). Een onderzoek op fecaal occult bloed vervangt nooit een coloscopie.
Onderbouwing
Achtergrond
Bloedverlies per anum kan een symptoom zijn van anale afwijkingen, zoals aambeien, fissuren, anale carcinomen, maar ook van afwijkingen met een hoger risico, zoals (procto-)colitis, hoog-risico adenomen (“advanced” adenomen of “advanced” poliepen in de Angelsaksische literatuur) en colorectale carcinomen (CRC).
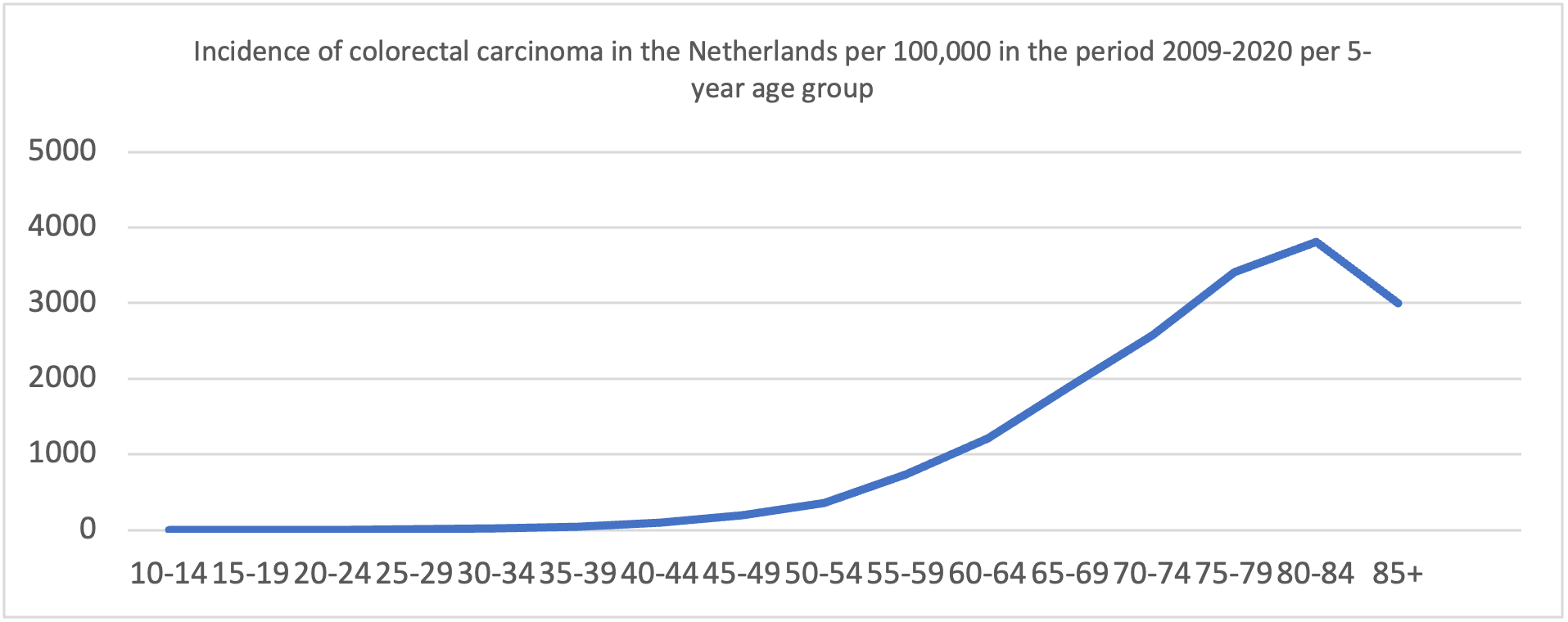
De incidentie van CRC in de Nederlandse bevolking van 2008 tot 2020 is goed weergegeven in onderstaande figuur (IKNL, 2021). De incidentie bij mannen is iets hoger dan bij vrouwen.
Er bestaat een NHG-Standaard voor rectaal bloedverlies. In deze standaard wordt een colonoscopie aanbevolen bij mensen met rectaal bloedverlies en een van de volgende risico-indicatoren: leeftijd boven de 50 jaar, veranderd defecatiepatroon, ontlasting gemengd met bloed, afwezigheid van perianale afwijkingen, CRC in de familie voor het 70e levensjaar of bij verdenking op inflammatoire darmziekten (Damoiseaux , 2017).
In 2013 werd de richtlijn colonoscopiesurveillance voltooid, die de methode van surveillance bespreekt na het vinden van poliepen, carcinomen en in geval van familiair risico op colorectaal carcinoom. Deze richtlijn beschrijft de kwaliteit van aanvullend onderzoek (colonoscopie/sigmoïdoscopie) (hoofdstuk 2), en stelt dat er geen indicatie is voor aanvullende diagnostiek door sigmoïdoscopie (NVMDL, 2013).
Voor patiënten jonger dan 50 jaar met een bloeding per anum zonder risico-indicatoren is er in de praktijk geen eenduidig beleid voor het inzetten van aanvullende diagnostiek om een colorectaal carcinoom uit te sluiten. Hier moet een afweging worden gemaakt tussen de belasting, de kosten en het risico van endoscopie versus het risico op het missen van een colorectaal carcinoom.
Conclusies / Summary of Findings
Colonoscopy
(Advanced) adenoma/colorectal carcinoma (critical)
|
No GRADE |
The incidence of advanced adenoma/colorectal carcinoma with a colonoscopy in patients younger than 50 years ranges from 0.5% to 5.0%.
Sources: Koning (2010); Lu (2020); Muller (2019); Nikpour (2008); Khalid (2011). |
Hemorrhoids
|
No GRADE |
The incidence of hemorrhoids with a colonoscopy in patients younger than 50 years of age with minor anesthetic blood loss ranged from 35.0% to 80.0%.
Sources: Muller (2019); Nikpour (2008); Khalid (2011). |
|
No GRADE |
The incidence of polyps with a colonoscopy in patients younger than 50 years of age with minor blood loss per anum ranges from 21.2% to 34.0%.
Sources: Koning (2010); Muller (2019). |
Pain
|
No GRADE |
The outcome measures of pain and patient satisfaction in patients with minor anomalous blood loss were not reported in the included studies.
Sources: - |
Sigmoidoscopy
|
No GRADE |
The incidence of advanced adenoma/colorectal carcinoma with a sigmoidoscopy is 7.2% in patients younger than 50 years of age with minor blood loss per anum.
Sources: Hussian (2019) |
|
No GRADE |
The incidence of hemorrhoids with a sigmoidoscopy is 34.9% in patients with minor blood loss per anum.
Sources: Hussian (2019). |
|
No GRADE |
The incidence of polyps with a sigmoidoscopy is 17.0% in patients with minor blood loss per anum.
Sources: Hussian (2019). |
Samenvatting literatuur
Description of studies
The prospective, observational study of Hussian (2019) evaluated the role of sigmoidoscopy in identifying bleeding in the lower gastrointestinal tract (with or without diarrhea) before gastrointestinal surgery or long-term medication. Hussian (2019) included patients who presented to the outpatient clinic or were admitted to the hospital with mild to moderate bleeding in the lower gastrointestinal tract with and without diarrhea. All patients underwent a rectal examination and were prepared by bowel preparation for colonoscopy with an oral polyethylene glycol solution (six liters in two different doses) the day before the procedure. A total of 600 patients were included in the study. The study categorized patients by their age (<10, 11-20, 21-30, 31-40, 41-50, 51-60,61-70, 71-80). The patients were divided into two groups. The first group (n=318) consisted of patients in whom the most common complaint was rectal bleeding only. The most common complaint in the second group was chronic diarrhea with blood and cramps. The study reported the incidence of colorectal carcinoma, hemorrhoids, and polyps as relevant outcome measures.
The retrospective, observational study of Lu (2019) examined the overall diagnostic value of a colonoscopy in young patients with bright red rectal blood loss. Lu (2020) included young adults (≤40 years) in whom a diagnostic colonoscopy was performed during the study period. A total of 454 patients were included in the study. The primary outcome measure was the diagnostic value for diseases of the colon, such as inflammatory bowel disease, microscopic colitis, advanced adenoma, and colorectal carcinoma. The study reported the incidence of advanced adenoma and colorectal carcinoma as relevant outcome measures.
The prospective, observational study of Muller (2019) examined the results of colonoscopy in young patients with anal problems and rectal bleeding. Muller (2019) included patients (<50 years) with rectal bleeding and with a diagnosis of anal problems, which could have been the cause of the anal bleeding. All colonoscopies were performed by experienced endoscopists. Hospital protocol was followed for bowel prep. The hospital protocol consisted of (1) feeding without residue from two days prior to the examination; (2) administration of two tablets of bisacodyl (five mg twice daily) prior to the examination; and (3) ingestion of a solution containing 500 ml of 20% mannitol approximately six hours prior to the examination. A total of 187 patients were included in the study. Histological evaluation was performed by experienced gastrointestinal pathologists. Polyps were classified as advanced adenomas (high-risk lesions) if they had a flaky histology, were more than one centimeter in size, or showed a high dysplasia grade. Sclerosed adenomas were also considered high-risk lesions. The study reported the incidence of colorectal carcinoma and hemorrhoids as relevant outcome measures.
The cross-sectional study of Khalid (2011) examined the frequency and location of endoscopic lesions in young patients with rectal bleeding and whether colonoscopic examination is necessary in patients with rectal bleeding. The study included patients aged 18 to 50 years old who reported complaints of rectal blood loss within six months of the study period. Rectal blood loss was defined as passing blood from the rectum, noticing blood in the stool, blood on the toilet paper or blood in the toilet. The study included 379 patients in the study. The study divided the patients into two groups. Group one consisted of patients with age <40 years and group two consisted of patients with age 40-50 years. The study reported the incidence of colorectal carcinoma, hemorrhoids, and polyps as relevant outcome measures.
The retrospective study of Koning (2010) examined the prevalence of abnormalities in the colon and rectum in patients with hemorrhoids. The study stratified the results by age to investigate in which age group a complete endoscopy is necessary. The study included patients with hemorrhoids in the study. Patients with risk factors for colorectal cancer were not excluded. A total of 1910 patient were included in the study. The study reported the incidence of colorectal carcinoma and polyps as relevant outcome measures.
The prospective, observational study of Nikpour (2008) examined the prevalence of clinically significant lesions in patients with minimal bright red rectal blood loss. Nikpour (2008) included ambulatory patients who underwent colonoscopy. A total of 402 patients were included. The study divided the patients into two groups. The first group consisted of patients aged younger than 40 years and the second group consisted of patients older than 40 years of age. The study reported the incidence of colorectal carcinoma, hemorrhoids and polyps as relevant outcome measures.
Results
Colonoscopy
(Advanced) adenoma/colorectal carcinoma (critical)
The incidence of (advanced) adenoma/colorectal carcinoma with a colonoscopy was reported in five studies (King, 2010; Lu, 2020; Muller, 2019; Nikpour, 2008; Khalid, 2011).
- The incidence of colorectal carcinoma in the study of King (2010) was 1/97 (1.03%)
- The incidence of advanced adenoma/colorectal carcinoma in the study of Lu (2020) was 10/194 (5.0%)
- The incidence of a malignant tumor in the study of Muller (2019) in the entire population was 1/187 (0.5%).
- The incidence of colorectal carcinoma in the study of Nikpour (2008) was 4/177 (2.3%).
- The incidence of adenomatous polyp/colorectal carcinoma in the study of Khalid (2011) was 17/379 (4.5%).
Hemorrhoids
The incidence of hemorrhoids with a colonoscopy was reported in three studies (Muller, 2019; Nikpour, 2008; Khalid, 2011).
- The incidence of hemorrhoids in the Muller (2019) study was 130/187 (69.5%). The incidence of hemorrhoids in the Muller (2019) study in the patients with adenoma was 28/35 (80.0%) and 102/128 (67.1%) in patients without adenoma.
- The incidence of hemorrhoids in the study of Nikpour (2008) was 62/177 (35.0%).
- The incidence of hemorrhoids in the study of Khalid (2011) was 219/ 379 (57.8%).
Polyps
The incidence of hemorrhoids was reported in one study (Muller, 2019).
- The incidence of polyps in the study of Muller (2019) was 60/187 (32.1%).
Pain
None of the included studies reported information regarding the incidence of pain during colonoscopy.
Patient satisfaction
None of the included studies reported information regarding the level of patient satisfaction with a colonoscopy.
Tabel 1: Incidence colonoscopy
|
|
Total N colonoscopy |
Advanced adenoma/colorectal carcinoma |
Hemorrhoids |
Polyps |
|
Koning, 2010 |
N=97 |
1/97 (1,03%) |
- |
33/97 (34,0%) |
|
Lu, 2020 |
N=194 |
10/194 (5,0%) |
- |
- |
|
Muller, 2019 |
N=187 Adenoma: N=35 No adenoma N=152 |
1/187 (0,5%) |
Total: 130/187 (69,5%) Adenoma: 28/35 (80,0%) No adenoma: 102/128 (67,1%) |
60/187 (32,1%) |
|
Nikpour, 2008 |
N=177 |
4/177 (2,3%) |
62/177 (35,0%) |
- |
|
Khalid, 2011 |
N=379 <40 year: N=248 40-50 year: N=131 |
17/379 (4,5%) <40 year: 7/248 (2,8%) 40-50 year: 10/131 (7,6%) |
219/379 (57,8%) <40 year: - 40-50 year: - |
- |
Sigmoidoscopy
(Advanced) adenoma/colorectal carcinoma (critical)
The incidence of advanced adenoma/colorectal carcinoma with a sigmoidoscopy was reported in one study (Hussian, 2019).
- The incidence of colorectal carcinoma in the study of Hussian (2019) was 23/318 (7.2%).
Hemorrhoids
The incidence of hemorrhoids with a sigmoidoscopy was reported in one study (Hussian, 2019).
- The incidence of hemorrhoids in the study of Hussian (2019) was 111/318 (34.9%).
Polyps
The incidence of hemorrhoids at sigmoidoscopy was reported in one study (Hussian, 2019).
- The incidence of polyps in the study of Hussian (2019) was 54/318 (17.0%).
Pain
None of the included studies reported information regarding the incidence of pain during a sigmoidoscopy.
Patient satisfaction
None of the included studies reported information regarding the level of patient satisfaction with a sigmoidoscopy.
Level of evidence
Due to the inclusion of non-comparative studies, it is not possible to assess the level of evidence of the literature by GRADE for the outcome measures advanced adenoma/colorectal carcinoma, hemorrhoids, polyps, pain, and patient satisfaction with a colonoscopy and/or sigmoidoscopy.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: When is there an indication for a colonoscopy in patients with (minor) blood loss per anum?
P: patients younger than 50 years of age with rectal bleeding
I: Colonoscopy
C: Sigmoidoscopy; no further intervention; expectative policy
O: Advanced adenoma/colorectal carcinoma; pain; patient satisfaction.
Relevant outcome measures
The guideline development group considered advanced adenoma/colorectal carcinoma as a critical outcome measure for decision making; and hemorrhoids, polyps, pain, and patient satisfaction as important outcome measures for decision making.
The workgroup defined a difference in relative risk <0.80 and >1.25 as a minimal clinically (patient) important difference.
Search and select (methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 4 February 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 342 hits. Studies were selected based on the following criteria: systematic reviews, RCTs, and observational studies regarding colonoscopy in patients with rectal bleeding. Eleven studies were initially selected based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods), and six studies were included.
Results
Six studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Evidence tabellen
Evidence table
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Outcome measures and effect size 4 |
Comments / author’s conclusion |
|
Lu, 2020 |
Type of study: Retrospective observational study.
Setting and country: Two midwestern institutions in the USA.
Funding and conflicts of interest: The authors have no conflicts of interest to declare
|
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 194
Important prognostic factors2: Age, median (IQR): 32 (27-36) years.
Sex, n/N (%): 76/194 (39.2%)
Indication colonoscopy, n/N (%) Bright red blood per rectum: N = 194 (43%) |
Describe intervention (treatment/procedure/test):
Colonoscopy
|
Diagnostic yield in patients with BRBPR
Overall DY, n/N (%): N=43/194 (22%)
Inflammatory bowel disease, n/N (%): N=28/194 (15%)
Microscopic colitis, n/N (%): N=6/194 (3%)
Advanced adenoma/CRC, n/N (%): N=10/194 (5%)
|
A significant proportion of young adults presenting with BRBPR had abnormal pathology (22%) justifying endoscopic evaluation. For other lower GI symptoms without BRBPR, necessity of endoscopic evaluation should be determined clinically on a case-to-case basis. The prevalence of MC is low (2%) in young adults below 40 years of age.
|
|
Hussian, 2019 |
Type of study: Prospective descriptive study
Setting and country: Gastro-intestinal and Hepatology center at Azadi Teaching hospital in Kirkuk, Irak
Funding and conflicts of interest: The authors have no financial, consultative, institutional, and other relationships that might lead to bias or conflict of interest. Therefore,we declare that we have no conflict of interest.
|
Inclusion criteria:
Exclusion criteria: Not described.
N total at baseline: N = 318
Patients with rectal bleeding: N = 318
Important prognostic factors2:
Sex, n/N (%): N=197/318 (62%) M
|
Describe intervention (treatment/procedure/test):
Sigmoidoscopy
|
Incidence, N (%)
Hemorrhoids, N: Sigmoidoscopy: N=111
Polyps, N: Sigmoidoscopy: N=54
Cancer, N: Sigmoidoscopy: N=23
Proctitis, N: Sigmoidoscopy: N=36
Solitary rectal ulcer, N: Sigmoidoscopy: N=16
No visible lesion, N: Sigmoidoscopy: N=10
|
At any age group, sigmoidoscopy has indicated in any patient with lower GIT bleeding or chronic diarrhea with blood followed by elective colonoscopy after proper preparation with conscious sedation. The reason of this preparation was to avoid unnecessary and unplanned anorectal surgery or unnecessary empirical medication. Nevertheless, on the base that, the complication rate of total colonoscopy is so negligible, especially with an increase in right-sided colonic pathology including tumer. Furthermore, this study revealed that a colonoscopy is a golden procedure in the diagnosis of colonic pathology and in a colonic screening program.
Comments: - The study only reports findings for sigmoidoscopy for patients <50 years of age in table 3. Table 4 is not applicable since these numbers are based on the whole cohort with age varying from <10 years of age to 80 years of age. |
|
Muller, 2019 |
Type of study: A prospective study
Setting and country: Coloproctology Clinic within Hospital de Clinicas de Porto Alegre, Southern Brazil.
Funding and conflicts of interest: Not reported. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 187
Patients were divided in two groups. The first group consisted of patients with adenoma. The second group consisted of patients without adenoma.
1st group: N=35 2nd group: N=152
Important prognostic factors2:
Total population: Age, mean (SD): 40.2 (6.8) years
Sex, n/N (%): N=94/187 (50.3%) F
Main symptoms: Bleeding, n/N (%): N=125/187 (66.8%)
Anal pain, n/N (%): N=20/187 (10.7%)
Anal prolapse, n/N (%): N=15/187 (8.0%)
Drainage of secretion, n/N (%): N=27/187 (14.4%)
1st group (adenoma)
Sex, n/N (%) N=16/35 (45.7%) F
Age, n/N (%): <40 years of age, n/N (%): N=12/35 (34.3%)
≥40 years of age, n/N (%): N=23/35 (65.7%)
Main symptoms: Bleeding, n/N (%): N=22/35 (62.9%)
Other, n/N (%): N=13/35 (10.7%)
2nd group (no adenoma)
Sex, n/N (%) N=78/152 (51.3%) F
Age, n/N (%) <40 years of age, n/N (%): N=60/152 (39.5%)
≥40 years of age, n/N (%): N=92/152 (60.5%)
Main symptoms: Bleeding, n/N (%): N=103/152 (67.8%)
Other, n/N (%): N=49/152 (32.2%)
Family history of CRC* Positive family history of CRC, n/N (%): N=13/152 (8.5%)
Negative family history of CRC, n/N (%): N=139/152 (91.5%) |
Describe intervention (treatment/procedure/test):
Colonoscopy
|
Incidence, n/N (%)
Number of findings in the total population
Total colonoscopic findings, N (%): N=75 (100%)
Specific findings, n/N (%):
Polyp, n/N (%): N=60/75 (80%)
Malignant tumor, n/N (%): N=1/75 (1.3%)
Diverticula, n/N (%): N=10/75 (13.3%)
Non-specific inflammation, n/N (%): N=3/75 (4%)
Angiodysplasia, n/N (%): N=1/75 (1.3%)
Number of findings in both groups
Main diagnosis: Hemorrhoids, n/N (%): 1st group: N=28/35 (80%) 2nd group: N=102/152 (67.1%) P=0.107
Anal fissure, n/N (%): 1st group: N=1/35 (2.9%) 2nd group: N=25/152 (16.4%)
Anal fistula, n/N (%): 1st group: N=6/35 (17.1%) 2nd group: N=25/152 (16.4%)
|
Despite the limitations of the present study, a single-center study with a somewhat limited number of patients, we addressed a new aspect in colorectal cancer prevention that had not been investigated to this date. We were able to document a high prevalence of adenomatous polyps in patients younger than 50 years of age who initially presented with symptoms related to benign anal problems. Our results seem to be in line with the recently reported increasing incidence of colorectal cancer in young individuals and the new tendency to start screening at an early age. Our data suggested that a colonoscopy might be considered as a valid strategy of investigation in such a frequent clinical situation. Further studies with a larger number of patients and assessment of long-term outcomes are needed to define the ultimate role of colonoscopy in these patients.
|
|
Koning, 2010 |
Opzet: Retrospectief
Setting: Ziekenhuis
Land: Nederland
|
Patiënten: N=1910 Group 1: N=861 Group 2: N=1049
Indicaties voor endoscopie: normal clinical indications in daily practice (abdominal complaints, diarrhoea, rectal bleeding, anaemia, changes in bowel habits, family history of colorectal cancer and screening)
Age: <50: N=97
|
Describe intervention (treatment/procedure/test):
Colonoscopie versus Sigmoïdoscopie: |
Incidentie, N (%)
Endoscopie Polyps 33/97 (34%)
Cancer 1/97 (1.03%)
|
Author’s conclusion In normal daily practice, especially bright rectal bleeding without further abdominal complaints will mostly be due to haemorrhoids in patients below the age of fifty. In case no other symptoms are present, haemorrhoids are seen during rectal examination, and there is no family history of colorectal cancer, the clinician could refrain from total colonoscopy in these patients. In patients above the age of fifty years endoscopic evaluation of the rectum and colon is advocated. |
|
Khalid, 2011 |
Opzet: retrospectief
Setting: Tertiair ziekenhuis
Land: Irak
|
Inclusie criteria:
Exclusie criteria:
N total at baseline: N=379
257 men (67.8 %) and 122 women (32.2 %).
Subgroepen qua leeftijd: N=131 patients (34.6 %) in the 40 – 50 years age group. N=248 (65.4%) under 40 years old. |
Describe intervention (treatment/procedure/test):
Colonoscopie |
Incidentie, N (%)
Hemorroïden: N=219 (57.8%)
Enkel hemorroïden: N=198 (52.2%)
Hemorroïden + andere laesies: N=21 (5.5%)
Adenomateuze poliep/CRC: <40: N=7 (2.8%) 40-50: N=10 (7.6%)
|
|
|
Nikpour, 2008 |
Soort onderzoek:
Setting:
Land: Iran
Excl: colorectal neoplasm, IBD, first degree family history of colorectal neoplasm, history of altered bowel habits, iron deficiency anemia, neoplastic polyps, colorectal carcinoma
|
Inclusie criteria:
Exclusie criteria:
N total at baseline: N=401
Male: N=219 (54.5%) Female: N=183 (45.5%).
Mean age (range) 43.6 ± 15.7 years (13 to 86).
There were another 94 young patients (41 male, 53 female; aged 27.6 ± 5.8 years), who met the eligibility criteria, but did not agree to participate and undergo colonoscopy.
|
Describe intervention (treatment/procedure/test):
Colonoscopie |
Incidentie, N (%)
Hemorrhoiden: N= (54.2) <40 jaar: N=62 (35.0%)
Carcinoom: <40jr: N=4 (2.3%)
|
Our study showed that significant lesions in the proximal colon are infrequent in patients with minimal BRBPR. Colonoscopy is recommended for the evaluation of rectal bleeding in patients who are at increased risk for colorectal neoplasms (‘red flags’)[3], but there are no specific recommendations for the appropriate evaluation of the majority of patients who lack these risk factors. The decision about the extent of the evaluation of these patients should be based on the prevalence of clinically significant lesions, potential need for a repeat procedure, costs and availability of the facility. Some experts recommend that young patients do not require further evaluation, if the presentation and history do not suggest an increased risk of cancer and a potential source of bleeding (such as hemorrhoids or an anal fissure) is identified in the clinical evaluation. |
Risk of bias table
|
Study reference
|
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Lu, 2020 |
Unlikely
“Diagnostic colonoscopies performed in young adults with age ≤40 during the study period from the participating institutions were included. Patients with familial hereditary colon cancer syndromes, those who received colonoscopy for CRC screening on account of having a first degree relative diagnosed with colon cancer at age.” |
Unlikely |
Unlikely |
Unlikely
“Univariate logistic regression analysis was performed to identify variables that predict a positive DY. A multivariate analysis was then performed using variables found significant on univariate analysis.” |
|
Hussian, 2019 |
Unlikely
Patients were selected from the same population. |
Unlikely |
Unlikely |
Unlikely |
|
Muller, 2019 |
Unlikely
“patients younger than 50 years of age who attend to the Coloproctology Clinic within Hospital de Clínicas de Porto Alegre, Southern Brazil, between January 2014 and January 2018. In order to be included in the study, patients had to present with complaint of rectal bleeding and subsequently had a diagnosis of anal disorder, which clearly could be the cause of the bleeding, established at the physical examination. Patients with symptoms suggesting the possibility of a colorectal carcinoma, such as melena, weight loss, anemia, and altered bowel habit, were not included in the study. Other exclusion criteria were inflammatory bowel disease, family history of inherited colorectal cancer syndrome, history of diverticular disease, anticoagulation, and history of a previous colonoscopy. Patients with a first-degree family history of CRC, which represents a formal indication to perform a colonoscopy before the age of 50, were not included in the study. In addition, patients who failed to achieve adequate bowel preparation for the exam (Boston scale for bowel preparation, scores 0 and 1) were also excluded from the analysis.” |
Unlikely |
Unlikely |
Unlikely |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
He (2019) |
Studiepopulatie voldoet niet aan de PICO |
|
Ibrahim (2019) |
Studiepopulatie voldoet niet aan de PICO |
|
Cross (2019) |
Studiepopulatie voldoet niet aan de PICO |
|
Kim (2018) |
Studiepopulatie voldoet niet aan de PICO |
|
Lai (2016) |
Studiepopulatie voldoet niet aan de PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 27-05-2024
Beoordeeld op geldigheid : 07-05-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor hemorroïden, anusscheurtjes en perianale fistels.
Belangenverklaringen
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mw. dr. M.S. (Mich) Dunker |
Colorectaal chirurg |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen restricties. |
|
Dhr. dr. D.D.E. (David) Zimmerman |
Colorectaal chirurg |
* Lid Executive Committee European Society Coloproctology (onbetaald) * Lid Education Committee European Society Coloproctology (onbetaald) * Voorzitter werkgroep richtlijn 'Perianal Fistula', European Society Coloproctology (onbetaald) * Secretaris Examencommissie UEMS, Divisie Coloproctologie (onbetaald) * Vice voorzitter Dutch Society of Colorectal Surgery (onbetaald).
|
Persoonlijke financiële belangen Adviseur, Takeda, eenmalig, onkostenvergoeding ontvangen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen restricties. |
|
Mw. dr. S.O. (Stefanie) Breukink |
Chirurg |
Chair guideline commitee ESCP, onbetaald. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek PI RCT Napoleon study: Cost-effectiveness and effectiveness of rubber band ligation versus sutured mucopexy versus haemorrhoidectomy in patients with recurrent haemorrhoidal disease: a multicentre, randomized controlled trial. ZonMw subsidie.
Intellectuele belangen en reputatie PI van richtlijn ESCP haemorrhoidal disease
ESCP = European Society of Coloproctology
escp.eu.com/images/guidelines/documents/escp-guidelines-haemorrhoidal-disease.
Overige belangen Geen.
|
Geen restricties. |
|
Mw. dr. O. (Oddeke) van Ruler
|
Chirurg |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek PI ALERT-CD trial. Onderzoek naar praktijkvariatie en kwaliteit van leven bij patiënten met Crohnse perianale fistels. Funding TAKEDA. Crohnse fistels zijn geen onderdeel van deze richtlijn.
Intellectuele belangen en reputatie PI onderzoek naar autologe celtherapie bij cryptoglandulaire en Crohnse perianale fistels. Nog in experimentele fase derhalve geen onderdeel van deze richtlijn.
Overige belangen Geen.
|
Geen restricties. |
|
Mw. dr. J.M.T. (Jikke) Omloo |
Chirurg, Gelre ziekenhuizen |
Geen. |
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Niet van toepassing.
|
Geen restricties. |
|
Mw. dr. R.J.F. (Richelle) Felt - Bersma |
Maag- Darm – Leverarts |
MDL-arts aan de VU regulier, daarbij 1 dag ge/outsourced naar de Proctoskliniek te Bilthoven. Voorts 12/13x per jaar op de vrijdagmiddag Proctologie in MCV de Veluwe. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen restricties. |
|
Mw. dr. N.H.N. (Nynke) Meijer – de Vrieze |
Dermatoloog |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen restricties. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland voor de schriftelijke knelpuntenanalyse. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Implementatie
|
Aanbeveling |
Tijdspad voor implementatie: 1 tot 3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
Alle aanbevelingen |
< 1 jaar |
Geen. |
Geen. |
Geen. |
Promoten verschijnen nieuwe richtlijn Proctologie |
Werkgroepleden en Kennisinstituut. Nederlandse Vereniging voor Heelkunde |
Geen. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die hemorroïden, anusscheurtjes of perianale fistels ervaren. Tevens zijn er knelpunten aangedragen door middel van een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
|
Database |
Zoektermen |
|||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Gastrointestinal Hemorrhage/ or ((rectal or anal or anus or ani or ano or rectum or recto* or perianal or 'peri anal' or anorectal or 'ano rectal' or gastrointestinal) adj2 (bleed* or 'blood loss' or hemorrhag* or haemorrhag*)).ti,ab,kf. or (blood* adj2 (faeces or feces or stool*)).ti,ab,kf. or (haematochezia or hematochezia or proctorrhagia or rectorrhagia).ti,ab,kf. (71070) 2 exp Colonoscopy/ or (colonoscop* or colonograph*).ti,ab,kf. (47194) 3 1 and 2 (4891) 4 limit 3 to ((english or dutch) and yr="2015 -Current") (1247) 5 4 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (1206) 6 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (480877) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2087471) 8 5 and 6 (43) – SRs 9 (5 and 7) not 8 (87) - RCTs 10 8 or 9 (130) |
