Naaldaspiratie versus thoraxdrainplaatsing bij primaire spontane pneumothorax
Uitgangsvraag
Heeft behandeling met naaldaspiratie de voorkeur boven thoraxdrainplaatsing bij patiënten met primaire spontane pneumothorax?
Aanbeveling
Er bestaat geen voorkeur voor thoraxdrainplaatsing in vergelijking met naaldaspiratie als eerste keuze behandeling bij patiënten met een primaire spontane pneumothorax.
Bespreek met de patiënt voor- en nadelen van beide behandelingen (naaldaspiratie en thoraxdrainplaatsing) en kom gezamenlijk tot een geschikte behandelstrategie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er zijn zeven RCT’s gevonden die naaldaspiratie vergelijken met plaatsing van een thoraxdrain bij patiënten met een eerste episode of recidief primaire spontane pneumothorax. Over de uitkomstmaten direct succes, recidiefkans, complicaties en patiënttevredenheid kan worden gezegd dat naaldaspiratie even effectief is als thoraxdrainaplaatsing bij patiënten met een primaire spontane pneumothorax. Opgemerkt moet worden dat de definities van “direct succes” in alle studies verschillen tussen naaldaspiratie en thoraxdrainplaatsing. Waar naaldaspiratie een procedure is waarvan direct succes daadwerkelijk direct na de procedure te beoordelen is (meestal met een observatieperiode van 6 of 12 uur), is dit niet het geval bij thoraxdrainplaatsing. Bij laatstgenoemde behelst de definitie in de meeste studies een termijn van drainverwijdering < 72 uur of 5 dagen. Thoraxdrainplaatsing is dus (vaak) langere therapie dan naaldaspiratie.
De langere behandelduur bij thoraxdrainplaatsing weerspiegelt zich ook in het verschil in opnameduur voor beide procedures. Waar patiënten die naaldaspiratie ondergaan vaak enkele uren tot een halve dag worden geobserveerd, op de SEH of een ziekenhuisafdeling, worden patiënten met een geplaatste thoraxdrain altijd opgenomen. Waarschijnlijk resulteert naaldaspiratie daarom in een kortere opnameduur (gemiddeld verschil -2,27 dagen) vergeleken met thoraxdrainplaatsing. De gemiddelde opnameduur in de geïncludeerde studies was voor naaldaspiratie ruim 2 dagen, en voor thoraxdrainplaatsing ongeveer 4,5 dagen.
Een deel van de studies rapporteert complicaties van beide procedures. Op theoretische gronden zou beargumenteerd kunnen worden dat drainplaatsing een groter risico geeft op bloedingen en (intrapleurale of wond) infecties gezien voor een thoraxdrainaplaatsing een (kleine) incisie moet worden gemaakt en het feit dat deze drain gedurende meerdere dagen in situ blijft. Er lijkt echter geen verschil te zijn in het risico op complicaties tussen aspiratie en thoraxdrainaplaatsing, de bewijskracht hiervan is echter zeer laag. Alleen de studie van Ho excludeerde expliciet patiënten met een stollingsstoornis. In de praktijk zou een stollingsprobleem wel een reden kunnen zijn om eerder voor aspiratie dan voor drainplaatsing te kiezen. De studie van Thelle (2017) is in de samenvatting van de literatuur buiten beschouwing gelaten voor deze uitkomstmaat, omdat er geen onderscheid wordt gemaakt tussen primaire en secundaire pneumothorax. Echter is belangrijk om te benoemen dat complicaties vaker zijn gerapporteerd in de drainagegroep ten opzichte van de aspiratie groep (41% versus 0%).
Een mogelijk nadeel van naaldaspiratie is dat soms meer dan één poging noodzakelijk is om direct succes te bereiken. De definitie van “direct succes” bij naaldaspiratie omvat bij de meerderheid van de studies maximaal twee pogingen. Alleen Ho accepteerde slechts één poging om nog te kunnen spreken van direct succes. De resultaten van Ho zijn door de uitzonderlijk strikte definitie van direct succes voor beide interventies erg laag: (13% bij naaldaspiratie en 12% bij thoraxdrainplaatsing). Ze zijn ook niet goed vergelijkbaar met andere studies die ruimere definities hanteren. Voor de zes andere studies geldt dat naaldaspiratie succesvol was bij de 1e poging in 50 tot 66% van de patiënten, en bij de 2e poging in 0 tot 81% van de patiënten. Alleen in de studie van Noppen was een 2e poging voor naaldaspiratie nooit succesvol. Ze zijn daarmee, om onduidelijke redenen, de enige studie met een dermate lage kans op succes. Bij de andere studies ligt dit percentage tussen 42% en 81%. De a priori kans dat een patiënt die naaldaspiratie ondergaat niet met deze therapie uitkomt, en een andere interventie nodig heeft, ligt tussen 9% en 41%. Dezes percentages zijn vergelijkbaar met de 6 tot 37% kans dat thoraxdrainplaatsing niet succesvol was en er andere (vaak operatieve) therapie nodig was.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De primaire spontane pneumothorax wordt veelal bij jonge patiënten zonder comorbiditeit gezien. Zij vormen een patiëntengroep met vaak hoge belastbaarheid door wie ziekenhuisopname vaker als belastend dan ontlastend wordt beschouwd. Om deze reden zou naaldaspiratie voor deze groep patiënten de voorkeur kunnen hebben. Na een geslaagde naaldaspiratie zouden zij, na een aantal uren observatie, met goede uitleg en instructie over alarmsymptomen en leefregels kunnen worden ontslagen, met een poliklinisch bezoek op korte termijn. Er zal echter ook een groep patiënten zijn die zich veiliger voelt bij een (korte) klinische opname. De mobiliteit tijdens ziekenhuisopname is aanzienlijk minder beperkt zonder drain.
Kosten (middelenbeslag)
Geen van de gevonden studies deed onderzoek naar kosten(-besparing) van aspiratie versus thoraxdrainaplaatsing. De verkorte opnameduur bij aspiratie zal waarschijnlijk resulteren in lagere kosten, ondanks dat patiënten na aspiratie kort na ontslag (< 3 tot 7 dagen) vaak een extra poliklinisch bezoek afleggen.
Aanvaardbaarheid, haalbaarheid en implementatie
Van oudsher wordt in de Nederlandse praktijk vaak gekozen voor plaatsing van een thoraxdrain. Het is echter van belang dat behandelaren ook bekend zijn met naaldaspiratie om de implementatie in de Nederlandse praktijk te bevorderen. Naaldaspiratie heeft als technische handeling grote overeenkomsten met het verdoven voorafgaand aan thoraxdrainplaatsing of het verrichten van een pleurapunctie. Dit zijn handelingen die in ieder Nederlands ziekenhuis op de polikliniek of SEH frequent worden verricht: benodigde materialen, personeel, tijd en plaats zijn niet anders. Wanneer naaldaspiratie bij een primaire spontane pneumothorax vaker wordt verricht, wordt een behandelaar bekend met de uitvoering. De procedure komt niet standaard aan bod binnen de opleiding tot longarts of SEH-arts: in het nationale opleidingsplan Longziekten en Tuberculose uit 2016 wordt naaldaspiratie niet genoemd, in tegenstelling tot bijvoorbeeld thoraxdrainplaatsing waarvoor een minimaal aantal verrichtingen is gesteld. Wanneer de procedure standaard aanbod komt binnen de opleiding zal dit mogelijk de implementatie bevorderen.
Rationale van de aanbeveling
Naaldaspiratie is even effectief als thoraxdrainplaatsing als het gaat om direct succes, recidiefkans en complicaties, maar resulteert waarschijnlijk in een kortere behandelduur en kortere ziekenhuisopname. Een nadeel ervan kan zijn dat erbij ongeveer 1/2 tot 2/3 van de patiënten die naaldaspiratie ondergaan twee pogingen nodig zijn alvorens de pneumothorax succesvol behandeld is. Ook zal naaldaspiratie voor de behandelaar een tijdrovender procedure zijn in vergelijking met thoraxdrainplaatsing: hij of zij blijft immers doorgaans tijdens de procedure bij de patiënt tot de naaldcatheter wordt verwijderd en de procedure is beëindigd. Voorwaarde voor toepassing van beide interventies is dat de behandelaar zich bekwaam acht voor het uitvoeren van de gekozen procedure. Voor naaldaspiratie moet er bovendien een adequaat (poliklinisch) vervolg worden geregeld om de patiënt met de succesvol geaspireerde PSP op korte termijn terug te kunnen zien. Er kan ook worden gekozen voor een klinische behandeling, zie de module ‘Ambulante versus klinische behandeling’.
Onderbouwing
Achtergrond
De primaire spontane pneumothorax ontstaat als er lucht komt in de pleurale ruimte: de ruimte tussen de pariëtale en viscerale pleura. Er is dan ingeademde lucht via geruptureerde alveoli in de viscerale pleura gedrongen, waarna de viscerale pleura ruptureert en er lucht in de pleurale ruimte komt waardoor de long collabeert. Dit kan behandeld worden door drainplaatsing middels naaldaspiratie of door plaatsing van een thoraxdrain. Mogelijke voordelen van naaldaspiratie ten opzichte van plaatsing van een thoraxdrain zijn de kortere behandelduur (na re-expansie van de long wordt de patiënt doorgaans niet opgenomen bij aspiratie) en de mogelijkheid de patiënt poliklinisch te vervolgen omdat ziekenhuis opname niet noodzakelijk is. Hiermee worden mogelijk kosten gereduceerd.
Er worden in de literatuur verschillende benamingen voor naaldaspiratie en thoraxdrainplaatsing gehanteerd. Wat in de literatuur “simple aspiration”, “needle aspiration” of “manual aspiration” wordt genoemd, is naaldaspiratie met een 16G of 18G catheter (vaak voor intraveneuze toepassing). Met “(chest) tube drainage” of “tube thoracostomy” wordt plaatsing van een thoraxdrain (doorgaans 12-20F) voor langduriger gebruik bedoeld.
Conclusies / Summary of Findings
Direct succes
|
Laag GRADE |
Naaldaspiratie lijkt, in vergelijking met thoraxdrainplaatsing, hetzelfde effect te hebben op direct succes of succes na 1 week bij patiënten met een primaire spontane pneumothorax.
Bronnen: (Ayed, 2006; Ho, 2011; Kim, 2019; Noppen, 2002; Ramouz, 2018; Thelle, 2017) |
Recidiefkans
|
Laag GRADE |
Naaldaspiratie lijkt, in vergelijking met thoraxdrainplaatsing, hetzelfde effect te hebben op recidiefkans bij patiënten met een primaire spontane pneumothorax.
Bronnen: (Ayed, 2006; Harvey, 1994; Noppen, 2002; Ramouz, 2018) |
Opnameduur
|
Redelijk GRADE |
Naaldaspiratie resulteert waarschijnlijk in een kortere opnameduur in vergelijking met thoraxdrainplaatsing bij patiënten met een primaire spontane pneumothorax.
Bronnen: (Ayed, 2006; Harvey, 1994; Kim, 2019; Noppen, 2002; Ramouz, 2018) |
Noodzaak tot ziekenhuisopname
|
Laag GRADE |
Naaldaspiratie lijkt, in vergelijking met thoraxdrainplaatsing, hetzelfde effect te hebben op noodzaak tot ziekenhuisopname bij patiënten met een primaire spontane pneumothorax.
Bronnen: (Ayed, 2006; Ho, 2011; Noppen, 2002) |
Complicaties
|
Zeer laag GRADE |
Het wetenschappelijk bewijs is zeer onzeker over het effect van naaldaspiratie versus thoraxdrainplaatsing op complicaties bij patiënten met een primaire spontane pneumothorax.
Bronnen: (Ayed, 2006; Ho, 2011; Noppen, 2002; Ramouz, 2018) |
Patiënttevredenheid
|
Zeer laag GRADE |
Het wetenschappelijk bewijs is onzeker over het effect van naaldaspiratie versus thoraxdrainplaatsing op patiënttevredenheid bij patiënten met een primaire spontane pneumothorax.
Bronnen: (Ho, 2011; Harvey, 1994) |
Samenvatting literatuur
Beschrijving studies
Ayed (2006) verrichtte in Koeweit een RCT waarin 137 symptomatische patiënten met een eerste PSP werden geïncludeerd. Er waren twee behandelarmen: plaatsing van een naaldcatheter (16G) aangesloten op -10 tot -15 cmH2O zuigdrainage gedurende maximaal 30 minuten (n=65) versus plaatsing van een thoraxdrain (20F) aangesloten op -20cmH2O zuigdrainage (n=72). Wanneer er bij de patiënten met een thoraxdrain geen luchtlek meer was en de long volledig was ontplooid werd zuigdrainage gestaakt en 24 uur waterslot gehandhaafd tot controle X-thorax goed was en de patiënt werd ontslagen. De follow-up duur van de studie was 2 jaar. Primaire uitkomstmaat was het directe succespercentage: complete re-expansie in de aspiratiegroep en afwezigheid van luchtlek, complete re-expansie en verwijdering van de drain < 3 dagen in de drainplaatsingsgroep. Secundaire uitkomstmaten waren 1-week succespercentage, recidiefkans, opnameduur, gebruikte hoeveelheid pijnstilling, complicaties en hervatting van werk.
Harvey (1994) beschreef een RCT waarin 73 patiënten met een (recidief) primaire spontane pneumothorax werden geïncludeerd. Simpele aspiratie (n=35) werd verricht door plaatsing van een catheter (16 tot 18G) aangesloten op een 3-weg kraan met waterslot, die werd verwijderd wanneer er geen lucht meer kon worden geaspireerd of bij een maximum van 3L lucht. Details over de gevolgde procedure bij plaatsing van een thoraxdrain (n=38) zijn niet beschreven. Ook details over de gevolgde stappen na de aspiratie-procedure ontbreken. De follow-up duur van de studie was 1 jaar. Gerapporteerde uitkomstmaten zijn succespercentage, recidiefpercentage, opnameduur en pijnscores.
Ho (2011) verrichte een RCT in Singapore waarin 48 stabiele patiënten met een PSP werden geïncludeerd. Randomisatie vond plaats tussen eenmalige manuele aspiratie met een pleuracatheter (16G) (n=23) versus plaatsing van een catheter (12F) met Heimlich klep (n=25). Patiënten die eenmalig aspiratie ondergingen werden ontslagen indien de X-thorax na 6 uur volledige re-expansie (< 10% residuale pneumothorax) van de long liet zien. Indien dit niet het geval was, werd een tweede interventie (drainplaatsing of aspiratie) verricht en werd de patiënt opgenomen. De andere groep werd ontslagen wanneer op de X-thorax na zes uur geen verslechtering werd gezien. Alle ontslagen patiënten werden binnen drie dagen poliklinisch gezien. Primaire uitkomstmaten waren het percentage therapie-falen en opnames. Secundaire uitkomstmaten waren opnameduur, complicatiepercentage, pijn, patiënttevredenheid en succespercentage.
Kim (2019) beschreef een RCT met 40 patiënten van alle leeftijden met een eerste primaire spontane pneumothorax, groter dan 25%. Randomisatie vond plaats tussen eenmalige naaldaspiratie met een intraveneuze angio-catheter (16G) (n=21) versus plaatsing van een pleuracatheter (12F) (n=19). Bij de groep patiënten die eenmalig naaldaspiratie onderging werd een 3-wegkraan met een mechanisch zuigsysteem aangesloten. De procedure werd beëindigd en de catheter verwijderd wanneer er bij manuele aspiratie aan het einde weerstand werd gevoeld. X-thorax werd direct en 12 uur na de procedure verricht. Bij de groep patiënten die drainplaatsing middels pleuracatheter onderging werd een waterslotsysteem met -10 tot -15 cmH2O zuigdrainage aangesloten. De pleuracatheter werd verwijderd wanneer luchtlekkage was gestopt en er complete re-expansie op X-thorax te zien was. Follow-up duur was een jaar. Gerapporteerde uitkomstmaten waren direct succespercentage, succespercentage na een maand en na een jaar en opnameduur.
Noppen (2002) publiceerde een multicenter, prospectieve, gerandomiseerde studie in België waarin 60 symptomatische patiënten met een eerste PSP werden geïncludeerd. Er waren twee behandelarmen: manuele aspiratie van lucht door een dunne intraveneuze naaldcatheter (16G) (n=27) versus plaatsing van een drain (16F of 20F) met een vier-kamer drainagesysteem op waterslot of -5 cmH2O zuigdrainage (n=33). Patiënten werden na succesvolle behandeling met aspiratie (complete re-expansie van de long) direct ontslagen; indien de eerste aspiratie niet succesvol was, werd een tweede poging verricht. Patiënten die werden behandeld middels drainplaatsing werden ontslagen nadat de long volledig was ontplooid en er tenminste 24 uur geen luchtlek optrad. Er werd een controle X-thorax gemaakt na 48 uur, 7 dagen, 2 en 6 maanden, 1 jaar en tussendoor indien nodig. De follow-up duur van de studie was 1 jaar. Primaire uitkomstmaten waren direct succespercentage, 1-week en 1-jaar succespercentage. Secundaire uitkomstmaten waren veiligheid, opnamepercentage en opnameduur.
Ramouz (2018) publiceerde resultaten van een RCT in Iran waarin 70 volwassen patiënten met een symptomatische primaire spontane pneumothorax werden geïncludeerd. Randomisatie vond plaats tussen naaldaspiratie (n=35) en thoraxdrainplaatsing (n=35). Naaldaspiratie werd verricht met een 16G intraveneuze angiocath, via welke lucht manueel werd verwijderd met een 50mL spuit tot er geen lucht meer te aspireren was, of bij een maximum van 3.5L aspiraat. De catheter werd verwijderd indien X-thorax 6 uur later < 20% rest pneumothorax liet zien en symptomen waren verdwenen. Als dit niet het geval was, werd een tweede aspiratie verricht. Bij slechte re-expansie of > 4L aspiraat bij de tweede poging, werd een thoraxdrain geplaatst. Plaatsing van een thoraxdrain werd met een 16F of 20F drain verricht met aansluiten op een H2O slot. Adequate respons op behandeling met drain was het stoppen van bubbelen in het H2O slot met verdwijnen van klachten of < 10% restpneumothorax. De drain werd verwijderd na 24 uur, en de patiënt werd na nog een keer 24 uur ontslagen met een goede X-thorax. In beide behandelarmen kregen alle patiënten ook 3L O2/minuut. Follow-up duur was een jaar. Primaire uitkomstmaten waren succespercentage direct, na een week en na een jaar. Andere gerapporteerde uitkomstmaten waren duur van de procedure, complicaties (bloeding en pleura-effusie), tijd tot recidief pneumothorax en opnameduur.
Thelle (2017) beschreef een RCT in Noorwegen waarin 127 volwassen patiënten met een grote en/of symptomatische spontane (primaire en secundaire) pneumothorax werden geïncludeerd. Van deze groep hadden 79 patiënten (62%) een primaire spontane pneumothorax. Voor deze module zijn alleen de resultaten van deze groep meegenomen. Randomisatie vond plaats tussen naaldaspiratie (n=42 PSP) en thoraxdrainplaatsing (n=37 PSP). Naaldaspiratie werd verricht met een subclavia catheter (16G) aangesloten op een driewegkraan, 60 mL spuit en drainzakje. Aspiratie werd gestaakt indien er vacuüm werd gezogen of er > 3,5L werd geaspireerd. Patiënten werden ontslagen na 6 uur observatie wanneer de pneumothorax < 20% op controle X-thorax was en de patiënt niet meer kortademig was. Indien een van beide wel het geval was, werd er een tweede aspiratie poging gedaan. Plaatsing van de thoraxdrain (12 tot 28 Ch) werd verricht met aansluiting op een drainagesysteem met waterslot. Primaire uitkomstmaat was duur van ziekenhuisopname. Secundaire uitkomstmaten waren direct succes en succes na 1 week.
Een overzicht van de succeskans van de verschillende procedures is weergegeven in tabel 1.
Tabel 1 De kans op een succesvolle procedures in de studies
|
|
aspiratie pogingen |
Aspiratie succesvol |
Alsnog andere therapie |
Succes drain |
Falen drain |
|
|
|
1e poging |
2e poging |
|
|
|
|
|
Ayed, 2006 |
2 |
62% (41/66) |
52% (13/25) |
18% (12/66 tube thoracostomy), 5/12 succesvol <1 week, 7/12 VATS >1 week |
68% (49/73) |
32% (23/72) namelijk: 19% (14/72) drain >3 dagen tot max 1 week en 13% (9/72) VATS in verband met LLL |
|
Harvey, 1994 |
2 |
66% (23/35) |
42% (5/12) |
20% (7/35 tube thoracostomy) |
|
|
|
Ho, 2011 |
2 |
13% (3/23) |
NR |
26% (6/23, pleurodese) |
12% (3/25) |
12% (3/25) thoracoscopische pleurodese |
|
Kim, 2019 |
2 |
52% (11/21) |
60% (6/10) |
19% (4/21 thoracostomy), 2/4 operatie |
63% (12/19) |
37% (7/19) operatie nodig |
|
Noppen, 2002 |
2 |
59% (16/27) |
0% (0/6) |
33% (9/27) drainplaatsing, 7% (2/27) talkage |
64% (21/33) |
36% (12/33) namelijk: 21% (7/33) LLL, 12% (4/33) talkage, 3% (1/33) thoracotomy |
|
Ramouz, 2018 |
2 |
54% (19/35) |
81% (13/16) |
9% (3/35 talk pleurodese) |
69% (24/35) |
6% (2/35) waarvan: 1 talk pleurodese en de ander VATS pleurectomie |
|
Thelle, 2017 |
2 |
50% (32/64) |
46% (11/24) |
31% (20/64 drainplaatsing, 8 drainplaatsingen na 1e mislukte aspiratie, 12 drainplaatsingen na 2e mislukte aspiratie) |
38% (14/37) |
22% (8/37), tevens 16 nieuwe drainplaatsingen nodig vanwege dysfunctie |
NR: niet gerapporteerd
Resultaten
Direct succes
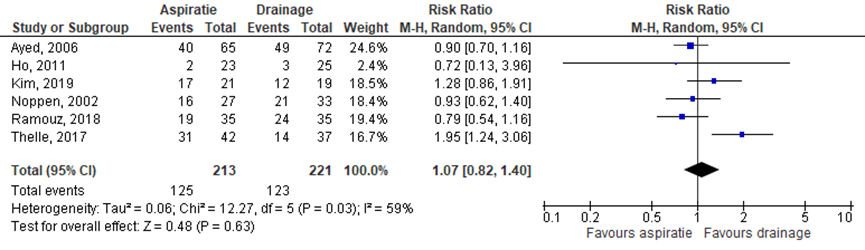
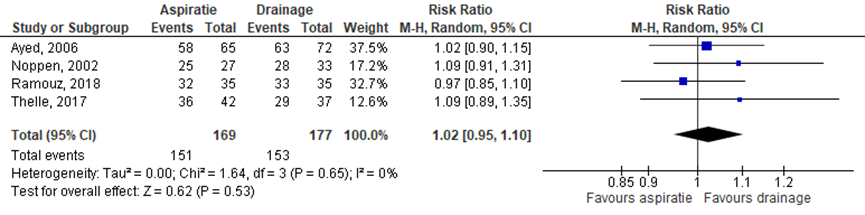
Behandeling met naaldaspiratie of thoraxdrainplaatsing resulteerde in een vergelijkbare kans op direct succes met een risico ratio (RR) van 1,07 (95%-BI: 0,82 tot 1,40) (figuur 1). Het effect van naaldaspiratie in vergelijking met drainplaatsing op succes na 1 week was tevens vergelijkbaar (RR 1,02 (95%-BI: 0,95 tot 1,10) (figuur 2). Ho (2011), Ramouz (2018) en Thelle (2017) hadden ook patiënten met een recidief pneumothorax geïncludeerd. Exclusie van deze studies resulteerde in vergelijkbare resultaten op zowel direct succes (RR: 0,99 (95%-BI: 0,81 tot 1,20)) als op succes na 1 week (RR 1,04 (95%-BI: 0,95 tot 1,10).
Figuur 1 Het effect van aspiratie versus drainplaatsing op direct succes
Figuur 2 Het effect van aspiratie versus drainplaatsing op succes na 1 week
Recidiefkans
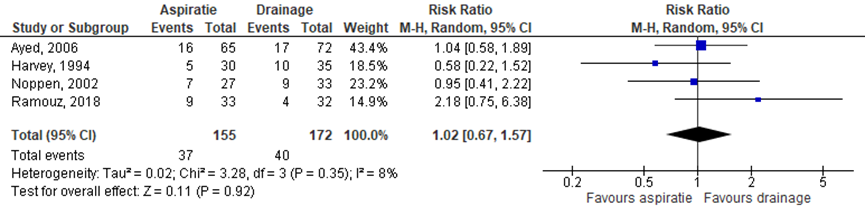
Vier studies hebben tevens gekeken naar de recidiefkans na 1 jaar (figuur 3), waarbij naaldaspiratie en thoraxdrainplaatsing resulteerden in een vergelijkbare recidiefkans (RR: 1,02 (95%-BI: 0,67 tot 1,57).
Figuur 3 Het effect van aspiratie versus drainplaatsing op de recidiefkans
Opnameduur
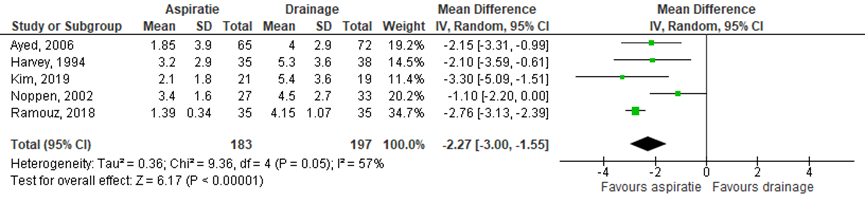
De meerderheid van de studies rapporteerde de opnameduur in dagen als gemiddelde met een standaarddeviatie. Deze studies laten zien dat naaldaspiratie resulteerde in een kortere opnameduur in vergelijking met thoraxdrainplaatsing (gemiddeld verschil: -2,27 (95%-BI: -3,00 tot -1,55) (Figuur 4). Twee studies rapporteerde de opnameduur als mediaan met een interkwartiel afstand en vonden ook een korte opnameduur in de naaldaspiratiegroep (Ho (2011): naaldaspiratie: 4,5 (1 tot 7); thoraxdrainplaatsing: 7 (1 tot 12); p=0,34), Thelle (2017) naaldaspiratie: 2,2 (1,2 tot 4,5); thoraxdrainplaatsing: 4,1 (2,2 tot 5,9); p=0,008).
Figuur 4 Het effect van aspiratie versus drainplaatsing op opnameduur
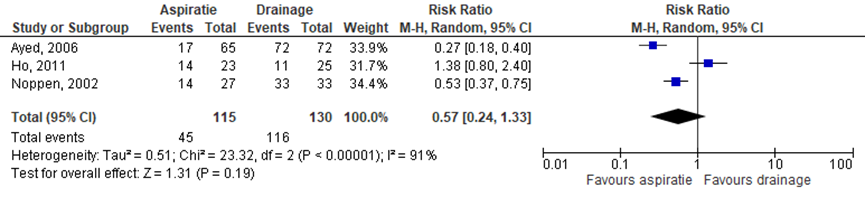
Noodzaak tot ziekenhuisopname
De noodzaak tot een ziekenhuisopname was lager in de studie van Ayed (2006) en Noppen (2002) (Figuur 5). De studie van Ho (2011) vond geen verschil op het aantal ziekenhuisopnames in de naaldaspiratie en thoraxdrainplaatsing groep (RR 1,38 (95%-BI: 0,80 tot 2,40). Het gepoolde RR was 0,57 (95%-BI: 0,24 tot 1,33).
Figuur 5 Het effect van naaldaspiratie versus thoraxdrainplaatsing op noodzaak tot ziekenhuisopname
Complicaties
Vier studies hebben complicaties als gevolg van naaldaspiratie of drainplaatsing gerapporteerd, die zijn beschreven in tabel 2. De incidentie van complicaties was relatief laag, maar de resultaten van de verschillende studies zijn inconsistent. Alleen de studie van Ramouz (2018) vond meer complicaties in de thoraxdrainplaatsing groep in vergelijking met naaldaspiratie. Thelle (2017) rapporteerde complicaties zonder onderscheid te maken tussen primaire en secundaire pneumothorax, dus dit is niet meegenomen in de resultaten.
Tabel 2 Het effect van aspiratie versus drainplaatsing op het ontstaan van complicaties
|
|
Aspiratie |
Drainplaatsing |
p-waarde |
||
|
|
% (n) |
|
% (n) |
|
|
|
Ayed, 2006 |
2% (1) |
subcutaan emfyseem |
7% (5) |
subcutaan emfyseem (n=2), verstopte buis (n=2), infectie wonduitgang (n=1) |
0,2 |
|
Ho, 2011 |
8.7% (2) |
subcutaan emfyseem |
4% (1) |
spanningspneumothorax |
- |
|
Noppen, 2002 |
0 |
- |
0 |
- |
|
|
Ramouz, 2018 |
2,8% (1) |
bloeding |
17,1% (5) |
wond infectie (n=1), bloeding (n=3), subcutaan emfyseem (n=2) |
0,05 |
Patiënttevredenheid
Ho (2011) rapporteerde patiënttevredenheid scores en vond vergelijkbare resultaten in de naaldaspiratie (mediaan 7,5 (IQR: 5 tot 9) en thoraxdrainplaatsing groep (mediaan 8 (IQR: 6,25 tot 9)) (p=0,58).
Bewijskracht van de literatuur
De bewijskracht voor RCT’s begint op hoog.
- De uitkomstmaat succes (direct/na één week) is met twee niveaus verlaagd tot laag gezien beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering) en inconsistentie in studieresultaten.
- De uitkomstmaat recidiefkans is met twee niveaus verlaagd tot laag gezien beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering) en inconsistentie in studieresultaten.
- De uitkomstmaat opnameduur is met één niveau verlaagd tot redelijk gezien beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering).
- De uitkomstmaat noodzaak tot ziekenhuisopname is met drie niveaus verlaagd tot zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering) en met twee niveaus voor het geringe aantal patiënten (imprecisie).
- De uitkomstmaat complicaties is met drie niveaus verlaagd tot zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering) en met twee niveaus voor het geringe aantal patiënten (imprecisie).
- De uitkomstmaat patiënttevredenheid is met drie niveaus verlaagd tot zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias: ontbreken van blindering) en met twee niveaus voor het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Heeft behandeling met naaldaspiratie de voorkeur boven thoraxdrainplaatsing bij primaire spontane pneumothorax?
P: patiënten patiënten met een primaire spontane pneumothorax (PSP);
I: interventie naaldaspiratie;
C: controle plaatsing van thoraxdrain;
O: outcome direct succes, recidiefkans, opnameduur, noodzaak tot ziekenhuisopname, complicaties, patiënttevredenheid.
Relevante uitkomstmaten
De werkgroep achtte direct succes en complicaties voor de besluitvorming cruciale uitkomstmaten; en opnameduur, recidiefkans en patiënttevredenheid voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases PubMed en Embase is op 26 augustus 2019 met relevante zoektermen gezocht naar studies die aspiratie en drainplaatsing vergelijken bij patiënten met een primaire spontane pneumothorax. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 261 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews, RCT’s en ander vergelijkend onderzoek gepubliceerd na 2000. Op basis van titel en abstract werden in eerste instantie 22 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 16 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 6 studies geselecteerd. Één RCT gepubliceerd voor 2000 werd toegevoegd uit de systematische reviews. Uiteindelijk werden 7 studies definitief geselecteerd.
Resultaten
7 RCT’s zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Ayed, A. K., Chandrasekaran, C., & Sukumar, M. (2006). Aspiration versus tube drainage in primary spontaneous pneumothorax: a randomised study. European Respiratory Journal, 27(3), 477-482.
- Harvey, J., & Prescott, R. J. (1994). Simple aspiration versus intercostal tube drainage for spontaneous pneumothorax in patients with normal lungs. Bmj, 309(6965), 1338-1339.
- Ho, K. K., Ong, M. E. H., Koh, M. S., Wong, E., & Raghuram, J. (2011). A randomized controlled trial comparing minichest tube and needle aspiration in outpatient management of primary spontaneous pneumothorax. The American journal of emergency medicine, 29(9), 1152-1157.
- Kim, I. H., Do Kyun Kang, H. K. M., & Hwang, Y. H. (2019). A Prospective Randomized Trial Comparing Manual Needle Aspiration to Closed Thoracostomy as an Initial Treatment for the First Episode of Primary Spontaneous Pneumothorax. The Korean journal of thoracic and cardiovascular surgery, 52(2), 85.
- Noppen, M., Alexander, P., Driesen, P., Slabbynck, H., & Verstraeten, A. (2002). Manual aspiration versus chest tube drainage in first episodes of primary spontaneous pneumothorax: a multicenter, prospective, randomized pilot study. American Journal of Respiratory and Critical Care Medicine, 165(9), 1240-1244.
- Ramouz, A., Lashkari, M. H., Fakour, S., & Rasihashemi, S. Z. (2018). Randomized controlled trial on the comparison of chest tube drainage and needle aspiration in the treatment of primary spontaneous pneumothorax. Pakistan journal of medical sciences, 34(6), 1369.
- Thelle, A., Gjerdevik, M., SueChu, M., Hagen, O. M., & Bakke, P. (2017). Randomised comparison of needle aspiration and chest tube drainage in spontaneous pneumothorax. European Respiratory Journal, 49(4), 1601296.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Ayed, 2006 |
Type of study: RCT
Setting: Chest diseases Hospital
Country: Kuwait
Source of funding: ns |
Inclusion criteria: - Symptomatic pneumothorax regardless of size OR - Asymptomatic pneumothorax size >20% of the hemithorax
Exclusion criteria: - History of previous PT - Secondary spontaneous, tension, bilateral or iatrogenic PT - Asymptomatic PSP or hemipneumothorax size <20%
N total at baseline: Intervention: 65 Control: 72
Important prognostic factors2: Age (mean ± SD): I: 24.38 ±4.4 C: 23.5±4.8
Sex (%male) I: 91% C: 96%
Smokers: I: 82% C: 76%
BMI (kg/m2 ± SD): I: 19.1 ±2.8 C: 19.8±3.6
Groups comparable at baseline? Yes |
Simple aspiration:
Patient in semi-supine position. Local anaesthetic. Insertion of plastic catheter (16G, Argyle) second anterior intercostal space on the midclavicular line. Connection to one-bottle water seal vacuum system, negative pressure of 10-15 cm H2O. Aspiration until cessation of air occurred in water seal bottle for maximum of 30 mins. Withdrawal of catheter and performance of chest radiograph. Complete lung expansion or small rim of apical pneumothorax present à discharge. Second attempt if not enough expansion. Tube thoracostomy if second attempt unsuccessful.
|
Tube thoracostomy:
Local anaesthetic. 20F plastic tube in fourth or fifth intercostal space at the midaxillary line and direct towards the apex. Connection to an underwater seal suction with a negative pressure of 20cm H2O. When air stopped bubbling and a chest radiograph had confirmed lung expansion, the drain was left connected to the water seal for a further 24h. After a control chest radiograph, the drain was removed and the patient was allowed home. After 7 days of persistent air leak or incomplete expansion VATS was performed.
|
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: 0 (0%) Control: 0 (0%)
Incomplete outcome data: Intervention: 0 (0%) Control: 0 (0%)
|
Immediate success: Intervention: 40/65 (62%) Control: 49/72 (68%) 95% CI: -0.225-0.094 p-value: 0.4
1-week success: Intervention: 58/65 (89%) Control: 63/72 (88%) 95% CI: -0.09-0.124 p-value: 0.7
Hospitalization rate: Intervention: 17/65 (26%) Control: 72/72 (100%) 95% CI: -0.845- -0.631 p-value: <0.0001
Duration hospitalization (mean days, SD): Intervention: 1.85 ± 3.9 Control: 4 ± 2.9 95% CI: -3.3- -0.995 p-value: 0.0003
1-yr recurrence: Intervention: 16/65 (25%) Control: 17/72 (24%) 95% CI: -0.133-0.153 p-value: 1
2-yr recurrence: Intervention: 20/65 (30%) Control: 18/72 (25%) 95% CI: -0.092-0.208 p-value: 0.5
Complications: Intervention: 1/65 (2%) Control: 5/72 (7%) 95% CI: -0.119-0.011 p-value: 0.2 |
Only first episode PT included
No of attempts NA: 25/65 (38%) patients in simple aspiration group underwent 2nd aspiration. Tube thoracostomy if second attempt unsuccessful (n=12).
Tube thoracostomy was performed with a negative pressure of 20cm H2O. |
|
Harvey, 1994
|
Type of study: RCT
Setting: not specified, hospital assumed
Country: Verenigd Koninkrijk
Source of funding: ns |
Inclusion criteria: Patients with pneumothorax for whom the admitting team thought a drainage procedure was required
Exclusion criteria: - Signs of tension PT - Lung disease other than previous PT
N total at baseline: Intervention: 35 Control: 38
Age (mean ± SD): I: 34.6 ±15.0 C: 34.6 ±13.1
Sex (%male) I: 80% C: 76%
Size of pneumothorax: Small rim: I: 9% C: 3% Partial collapse: I: 46% C: 32% Complete collapse: I: 29% C: 47%
Previous PT I: 6/35 (17%) C: 8/38 (21%)
Groups comparable at baseline? Yes |
Simple aspiration:
Local anaesthetic. Insertion of 16-18G catheter. Aspiration of air through three way tap with exit tube under water. The procedure continued until no more air could be aspirated, patient became uncomfortable, or maximum of three litres had been removed. |
Intercostal drainage:
Managed according to participating physician's usual practice. No sclerosing drugs allowed with either technique.
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 5/35 (17%) Control: 3/38 (8%)
Incomplete outcome data: Intervention: 5/35 (17%) Control: 3/38 (8%)
|
Immediate success: Intervention: 28/35 (80%) Control: 38 (100%) p-value: ns
Duration hospitalization (mean days, SD): Intervention: 3.2 ±2.9 Control: 5.3 ±3.6 p-value: 0.005
Total pain score (SD): Intervention: 2.7 ± 3.3 Control: 6.7 ± 3.6 p-value: <0.001
1-yr recurrence: Intervention: 5/30 (17%) Control: 10/35 (29%) p-value: 0.4
|
Unclear inclusion criteria.
Recurrent PT also included
No of attempts aspiration: 5/35 (14%) patients in simple aspiration group underwent 2nd aspiration
Very minimalistic description of intercostal drainage technique
No clear definition of outcome measures
No significant differences found in the recurrence rate at one year, but more patients who had intercostal drainage required pleurectomy than those patients who had had aspiration (P=0.02). |
|
Ho, 2010 |
Type of study: RCT
Setting: Singapore general hospital, acute tertiary hospital
Country: Singapore
Source of funding: ns |
Inclusion criteria: - Spontaneous PT without previous lung disease
Exclusion criteria: - Secondary spontaneous, tension, traumatic or minor PT (<3 cm from apex) - Fluid level on CXR - Unstable vital signs /respiratory distress - Bleeding disorders - Underlying pulmonary disease - Smokers > 50 years. - Indication for chest tube (eg. Recurrent pneumothorax, >2 episodes of pneumothorax on the same side)
N total at baseline: Intervention: 23 Control: 25
Important prognostic factors2: Age (mean ± SD): I: 26 ± 8.6. C: 24.3 ± 6.1
Sex (%male): I: 91.3% C: 92%
Smokers (%current): I: 30.4% C: 36%
Size pneumothorax >5 from apex: I:65.2% C:36%
Recurrent pneumothorax: I:26.1% C:20%
Groups comparable at baseline? No
|
Needle aspiration:
Manual aspiration in ED by resident under the supervision of attending emergency physician. 16G cannula inserted in second intercostal space at midclavicular line CXR done to confirm re-expansion. Complete re-expansion (<10% residual PT) were observed for 6 hours followed by CXR to confirm sustained re-expansion and absence of recurrence. Discharge if repeat CXR showed <10% PT. Chest tube insertion when >10% PT, and admission to ward.
|
Mini chest tube: + Heimlich valve
Insertion of mini chest tube (12F) in ED by resident under supervision by attending emergency physician. Tube was connected to Heimlich valve, CXR was done to confirm tube placement and re-expansion. Monitoring for 6 hours and CXR was repeated. Discharge with Heimlich valve if repeat CXR did not show any worsening of PT. Otherwise, chest tube insertion before being admitted to inpatient ward. |
Length of follow-up: ns
Loss-to-follow-up: Intervention: none Control: none
Incomplete outcome data: Intervention: none Control: none
|
Failure-rate: Intervention: 21/23 (91.3%) Control: 22/25 (88%) 95% CI: ns p-value: 0.541
Hospitalization from ED: Intervention: 12/23 (52%) Control: 7/25 (28%) 95% CI: -0.028-0.511 p-value: ns
Hospitalization from 1st clinic review (<3 days): Intervention: 2/23 (9%) Control: 4/25 (16%) 95% CI: -0.257-0.111 p-value: ns
No of second procedures: Intervention: 8/23 (35%) Control: 5/25 (20%) 95% CI: -0.012-0.398 p-value: ns
Duration of hospital stay from ED (days median, IR): Intervention: 4.5 (1-7) Control: 7 (1-12) 95% CI: ns p-value: 0.344
Pain scale: Intervention: 3 (2-5) Control: 3 (1.75-4.2) 95% CI: ns p-value: 0.308
Satisfaction scale: Intervention: 7.5 (5-9) Control: 8 (6.25-9) 95% CI: ns p-value:.583
Complications: Intervention: 2 (8.7%) Control: 1 (4%) 95% CI: ns p-value: ns |
Needle aspiration more PT >5cm from apex (65.2% versus 36% in mini chest tubes) and more recurrent PT (26.1% versus 20% in mini chest tubes)
No of attempts aspiration: 8/23 (35%) patients in simple aspiration group underwent 2nd procedure (4 2nd needle aspiration, 4 chest tube).
Exclusion criteria included patients with indication for chest tube (eg. Recurrent pneumothorax, >2 episodes of pneumothorax on the same side) but table with patient characteristics describe 22.9 versus 26.1% with recurrent episode PT.
No complete adherence to study protocol: not all incomplete re-expansions underwent a second procedure. It remains unclear what happened to them.
Unclear timing and reporting of pain-scale and satisfaction-scale.
|
|
Kim, 2019 |
Type of study: RCT
Setting: ns
Country: South Korea
Source of funding: ns |
Inclusion criteria: - First episode PSP - PT with size > 25% as estimated by Collins method
Exclusion criteria: - Hemodynamic instability - Severe comorbidity - Recurrent, bilateral or tension PT - Pregnancy - Underlying lung disease
N total at baseline: Intervention: 21 Control: 19
Important prognostic factors2: Age (mean ± SD): I:24.0±10.9 C:24.8±11.5
Sex (%male) I: 95% C: 89%
Smokers (% current or ex): I: 24% C: 16%
BMI (kg/m2 ± SD): I: 20.2 ± 2.8 C: 20.7 ± 3.3
Size PT (%) I: 56.0% ±23.3 C: 65.6 % ±22.1
Groups comparable at baseline? Yes |
Needle aspiration:
Patients placed in semi-Fowler position and skin disinfection performed. Local anesthesia using 2% lidocaine, a 16-gauge intravenous angio-catheter (1.7 mm diameter) introduced through second intercostal space, on midclavicular line. Catheter placed at the apex of thoracic cavity and connected to 3-way valve and syringe. After confirming functionality of catheter with a syringe, the air in pleural cavity was suctioned using a mechanical suction system. After sufficient mechanical suction, manual aspiration was performed until resistance was felt. When no more air was evacuated, catheter was removed and the procedure was terminated.
|
Chest tube drainage
Under local anesthesia using 2% lidocaine, closed thoracostomy was performed using a 12-French (F) catheter (Argyle Suture Rib Trocar Catheter; Covidien, Mansfield, MA, USA) through the fourth intercostal space, on anterior axillary line. Catheter was connected to underwater seal drainage system with a negative pressure of −10 to −15 mm H2O. When complete lung expansion on chest radiography was confirmed and there was no air leakage, chest tube was removed. |
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: 0 Control: 0
Incomplete outcome data: Intervention: 0 Control: 0
|
Immediate success: Intervention: 17/21 (81%) Control: 12/19 (63%) 95% CI: ns p-value: 0.16
1-month recurrence: Intervention: 3/21 (14%) Control: 1/19 (5%) 95% CI: ns p-value: 0.34
Hospital stay (days, SD): Intervention: 2.1 ± 1.8 Control: 5.4 ± 3.6 95% CI: ns p-value: <0.01
1-yr recurrence: Intervention: 4/21 (19%) Control: 3/19 (16%) 95% CI: ns p-value: 0.79
|
Only first episode PSP included
No of attempts manual aspiration: 10/21 (48%) of first attempts was unsuccessful. All of them underwent 2nd aspiration, 6/10 (60%) were successful. |
|
Noppen, 2002 |
Type of study: RCT
Setting: one tertiary care academic hospital, and four regional general hospitals
Country: Belgium
Source of funding: ns |
Inclusion criteria: - Symptomatic PT regardless of size - PT with size > 20% as estimated by Light’s formula
Exclusion criteria: - Underlying lung disease - History of previous PT - Tension PT
N total at baseline: Intervention: 27 Control: 33
Important prognostic factors2: Age (mean ± SD): I:28.2 ± 11.6 C:28.9 ± 8.9
Sex (%male) I: 74% C: 85%
Smokers (% current or ex): I: 60% C: 81%
BMI (kg/m2 ± SD): I: 20.9 ± 3.2 C: 21 ± 2.5
Groups comparable at baseline? Yes |
Manual aspiration:
Semi-supine position. Local anesthesia with 2% lidocaine. Insertion small-caliber polyethane intravenous needle catheter (Intracath, 16 Ga) in the second or third intercostal space, at the midclavicular line. Needle direction apically and catheter advancement into pleural space for 5–10 cm, fixation to the skin. After needle withdrawal connection via a three-way valve to a 50-ml syringe. Air manually aspirated, until resistance and air was no longer aspirated. |
Chest tube drainage
Local anesthesia, with 16 F or 20 F plastic (Argyle; Sherwood Medical, Tullamore, Ireland) tubes, at the anterior midclavicular second intercostal space, or at the fourth or fifth intercostal space, at the midaxillar line, and directed to the apex. Drain connection to a fourchamber system at water seal (0 cm H2O) or slight aspiration (-5 cm H2O).
|
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: 0 Control: 0
Incomplete outcome data: Intervention: 0 Control: 0
|
Immediate success: Intervention: 16/27 (59%) Control: 21/33 (64%) 95% CI: ns p-value: 0.90
1-week success: Intervention: 25/27 (93%) Control: 28/33 (85%) 95% CI: ns p-value: 0.40
Hospitalization rate: Intervention: 14/27 (52%) Control: 33/33 (100%) 95% CI: ns p-value: <0.0001
Hospital stay (days, SD): Intervention: 3.41 ± 1.6 Control: 4.5 ± 2.7 95% CI: ns p-value: 0.20
1-yr recurrence: Intervention: 7/27 (26%) Control: 9/33 (27%) 95% CI: ns p-value: 0.90
Time of recurrence (weeks, SD): Intervention: 13.4 ± 10.2 Control: 9 ± 8.47 95% CI: ns p-value: 0.36
Urgent readmission: Intervention: 0 Control: 0 |
Only first episode PSP included
No of attempts manual aspiration: 11/27 (41%) of first attempts were unsuccessful. 6 of them underwent 2nd aspiration, none were successful. |
|
Ramouz, 2018 |
Type of study: RCT
Setting: two academic hospitals
Country: Iran
Source of funding: ns |
Inclusion criteria: - Symptomatic PT - > 18 years
Exclusion criteria: - Tension or bilateral PT - Severe respiratory failure - Indication for mechanical ventilation
N total at baseline: Intervention: 35 Control: 35
Important prognostic factors2: Age (mean ± SD): I: 48.9 ± 9.4 C: 49.8 ± 7.5
Sex (%male) I: 44% C: 41%
Smokers (% current): I: 23% C: 16%
BMI (kg/m2 ± SD): I: 21.2 ± 2.4 C: 22.3± 2.6
Size PT (mean % ± SD) I: 53.8% ± 12.5 C: 49.3 % ± 9.6
Groups comparable at baseline? Yes |
Needle aspiration:
Patient in semi-supine position. Local anesthesia. 16G intravenous angiocath inserted at midclavicular line, 2nd or third intercostal space. Air suction performed using a 50-ml syringe till the end of the air aspiration or up to 3.5 liters of air suctioning. Without catheter removal, patients underwent CXR and discharged six-hour later in case of symptoms resolution, and lung expansion with a narrow rim of pneumothorax (<20%). However, in case of poor lung expansion, re-aspiration performed via the primary catheter. If more than 4 liters of air was aspirated or lung expansion was failed after the second try for needle aspiration, patients underwent CTD implementation.
|
Chest tube drainage
Patient in semi-supine position. Local anesthesia. Insertion of 16F or 20F (based on patients’ physical status) sterile plastic tube at midaxillary line, 4th or 5th intercostal space. Connection of tube to two-chest water seal canisters. Cease of bubbling in water seal canisters with symptoms resolution or pneumothorax size <10% were considered an adequate response to CTD treatment. CT remained for 24 hours, and patients discharged after CXR repeated 24 hours following to CT removal. |
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: 0 Control: 0
Incomplete outcome data: Intervention: 0 Control: 0 |
Immediate success: Intervention: 19/35 (54%) Control: 24/35 (69%) 95% CI: ns p-value: 0.16
1-week success: Intervention: 32/35 (91%) Control: 33/35 (94%) 95% CI: ns p-value: 0.5
Hospital stay (mean days ± SD): Intervention: 1.39 ± 0.34 Control: 4.15 ± 1.07 95% CI: ns p-value: <0.001
1-yr recurrence: Intervention: 9/33 (27%) Control: 4/32 (13%) 95% CI: ns p-value: 0.11
Short term complications Intervention: 1/35 (3%) Control: 6/35 (17%) 95% CI: ns p-value: 0.053
Pain (after intervention, mean VAS ± SD) Intervention: 6.47 ± 1.04 Control: 7.68 ± 0.97 95% CI: 0.87-1.53 (mean difference) p-value: <0.001 |
High mean age. This suggests also some missed secondary PT. Before the intervention, patients underwent chest radiography to confirm the primary SP diagnosis.
No of attempts manual aspiration: 16/35 (46%) of first attempts was unsuccessful. All of them underwent 2nd aspiration, 3/16 (19%) were successful.
During hospital admission, as a standard treatment, 3 L/min-1 supplementary oxygen administered for ll patients |
Thelle, 2017 |
Type of study: RCT
Setting: Three university hospitals
Country: Norway
Source of funding: ns |
Inclusion criteria: - SP in need for intervention - Age >18 years - size >30% in PSP or >20% in SSP OR significantly more breathless than usual
Exclusion criteria: - Severe respiratory failure or assisted ventilation - Bilateral or tension PT - Included in study for ipsilateral PT
N total at baseline: Intervention: 64 (PSP n=42) Control: 63 (PSP n=37)
Important prognostic factors2: (PSP and SSP) Age (mean ± SD): I: 40.5 ± 21.5 C: 40.9 ± 19.5
Sex (%male) I: 84.4% C: 84.1%
Smokers (% current): I: 47.6%. C: 44.3%
BMI (kg/m2 ± SD): I: 21.3 ± 3.2 C: 22.1± 3.2
Size PT (mean % ± SD) I: 47.5% ± 19.8 C: 57.0 % ± 25.0
% PSP I: 65%. C: 59%
First episode of PT: I: 69.1%. C: 72.4%
Groups comparable at baseline? Yes |
Needle aspiration:
Patient in semi supine position. Local anesthesia. Insertion of 16G subclavian catheter (Secalon-T©; Argon critical care systems, Singapore) most commonly in the second intercostal space immediately lateral to the mid-clavicular level. Connection to three-way valve, 60-mL syringe and a drainage bag. Procedure terminated when no more air could be aspirated, or if the amount of aspirated air exceeded 3.5 L. CXR performed. 6 hour observation if <20% PT and no breathlessness. If >20% PT, still breathlessness or deterioration after 6 hours observation à second aspiration.
|
Chest tube drainage:
Local anesthesia. Insertion of a 12–28 Ch (commonly 14–20 Ch) chest tube (Kendall Argyle; Tyco healthcare, Ireland) commonly in the 4th or 5th intercostal space in the mid-axillary line. Connection to a chest drainage system (Pleur-evac©; Genzyme corporation, USA) with water seal. Chest radiograph performed shortly after drain insertion to evaluate drain position and preliminary effect. Suction applied only if re-expansion of the lung was modest, at the discretion of the physician. Clamping of drain for some hours was allowed before removal. Referral for surgery if >7days air leakage. Alternative options: chemical pleurodesis and autologous blood patch.
|
Length of follow-up: 7-10 days after discharge
Loss-to-follow-up: Intervention: none Control: none
Incomplete outcome data: Intervention: none Control: none
|
Results for only PSP:
Immediate success: Intervention: 31/42 (74%) Control: 14/37 (38%) 95% CI: ns p-value: 0.001
Hospital stay days (median, IQR): Intervention: 2.2 (1.2-4.5) Control: 4.1 (2.2-5.9) 95% CI: ns p-value: 0.008
1-week success: Intervention: 36/42 (86%) Control: 29/37 (78%) 95% CI: ns p-value: 0.394
Complications (PSP and SSP): Intervention: none Control: wound infection (n=4), bleeding (n=2), subcutaneous emphysema (n=7), pneumonia (n=1), empyema (n=1)
Chest drain replacement (PSP and SSP): Control: 16 (25%) |
Recurrent PT was not an exclusion criterion.
No of aspiration attempts (PSP and SSP): 1 (n=64, 50% successful), 2 (n=24, 46% successful), 3 (n=1, 100% successful).
Also secondary pneumothoraces included. Subgroup analysis for PSP in some outcomes
Needle aspiration more PT size >30% (47.5% versus 57% in chest tube drainage)
All patients were given supplementary oxygen 3L/min standard |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participant to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Ayed, 2006 |
Sealed envelopes |
Unlikely |
Likely
Blinding is not possible, but this will probably not influence the results |
Likely
Blinding not possible |
Likely
Blinding not possible |
Unlikely |
Unlikely |
Unlikely |
|
Harvey, 1994 |
Not described |
Unclear |
Likely
Blinding is not possible, but this will probably not influence the results |
Likely
Blinding not possible |
Likely
Blinding not possible |
Unlikely
|
Unlikely
|
Unlikely
|
|
Ho, 2011 |
blocked randomization using sealed envelopes |
Unlikely |
Likely
Blinding is not possible, but this will probably not influence the results |
Likely
Blinding not possible |
Likely
Blinding not possible |
Unlikely |
Unlikely
Follow up seems complete |
Unlikely |
|
Kim, 2019 |
random number table. |
Unlikely |
Likely
Blinding is not possible, but this will probably not influence the results |
Likely
Blinding not possible |
Likely
Blinding not possible |
Unlikely |
Unlikely
Follow up seems complete |
Unlikely |
|
Noppen, 2002 |
computer-generated table |
Unlikely |
Likely
Blinding is not possible, but this will probably not influence the results |
Likely
Blinding not possible |
Likely
Blinding not possible |
Unlikely |
Unlikely
Follow up is complete |
Unlikely |
|
Ramouz, 2018 |
Randlist software |
Unlikely |
Likely
Blinding is not possible, but this will probably not influence the results |
Likely
Blinding not possible |
Likely
Blinding not possible |
Unlikely |
Unlikely
+/- 95% complete in both groups. |
Unlikely |
|
Thelle |
Not described |
Unlikely |
Likely
Blinding is not possible, but this will probably not influence the results |
Likely
Blinding not possible |
Likely
Blinding not possible |
Unlikely |
Unlikely
Follow up is complete |
Unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Aguinagalde, 2010 |
Inclusie individuele RCTs |
|
Carson-Chahhoud, 2017 |
Inclusie individuele RCTs |
|
Devanand, 2004 |
Inclusie individuele RCTs |
|
Kadena, 2013 |
Inclusie individuele RCTs |
|
Koscynski, 2015 |
Zowel patiënten met primaire als secundaire pneumothorax |
|
Masood, 2007 |
Zowel patiënten met primaire als secundaire pneumothorax |
|
Parlak, 2012 |
Zowel patiënten met primaire als secundaire pneumothorax |
|
Parlak, 2012 |
Conference abstract |
|
Smith, 2015 |
Inclusie individuele RCTs |
|
Tupchong, 2018 |
Inclusie individuele RCTs |
|
Vuong, 2018 |
Inclusie individuele RCTs |
|
Wakai, 2007 |
Inclusie individuele RCTs |
|
Wakai, 2011 |
Inclusie individuele RCTs |
|
Wang, 2017 |
Inclusie individuele RCTs |
|
Zehtabchi, 2008 |
Inclusie individuele RCTs |
|
Zhu, 2019 |
Inclusie individuele RCTs |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-01-2022
Beoordeeld op geldigheid : 20-01-2022
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2026 bepaalt het bestuur van de NVALT of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Voor goedkering van deze richtlijn wordt hij aangeboden aan de Patiëntenfederatie Nederland.
Doel en doelgroep
Doel
Deze richtlijn geeft aanbevelingen ten aanzien van behandeling van volwassen patiënten (leeftijd ≥ 18 jaar) met een primaire spontane pneumothorax. Doel van deze gedeeltelijke herziening is om een richtlijn te verkrijgen waarin de meeste recente medische kennis omtrent de zorg voor patiënten met een primaire spontane pneumothorax wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met een primaire spontane pneumothorax.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een primaire spontane pneumothorax.
Werkgroep
- Dr. F.M.N.H. Schramel, longarts, werkzaam in St. Antonius ziekenhuis, NVALT, voorzitter van de werkgroep.
- Drs. A.K.M. Korte, longarts, werkzaam in het Erasmus MC, NVALT.
- Drs. S. Boerman, longarts, werkzaam in St. Antonius ziekenhuis, NVALT.
- Drs. B.C. Klap, longarts, werkzaam in het Tergooi ziekenhuis, Hilversum, NVALT.
- Drs. M.D.M. Bolmers, chirurg, werkzaam in het Dijklander Ziekenhuis, NVvL.
- Drs. H.H. Dol, SEH-arts, werkzaam in het Jeroen Bosch Ziekenhuis, NVSHA.
- Drs. W.W.L. Li, cardio-thoracaal chirurg, werkzaam in het Radboudumc Nijmegen, NVT.
- Dr. F.A.A. Mohamed Hoesein, radioloog, werkzaam in het UMC Utrecht, NVvR.
- Drs. C.S. Sie (sinds augustus 2020), anesthesioloog, werkzaam in het Ikazia Ziekenhuis Rotterdam, NVA.
- Mw. N.M.C. Torrenga-Sieling, MSc, verpleegkundig specialist AGZ/longgeneeskunde, werkzaam in onder andere G.C. Lombok, Utrecht en het Diakonessenhuis, V&VN.
Met ondersteuning van
- Drs. I. van Dusseldorp, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. S.R. Zwakenberg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. M.M.A. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. Schramel, longarts, NVALT, voorzitter |
Longarts, St. Antonius ziekenhuis Utrecht/Nieuwegein |
Geen |
Geen |
Geen |
|
Drs. Korte, longarts, NVALT |
Longarts, Erasmus MC Rotterdam |
Geen |
Geen |
Geen |
|
Drs. Boerman, longarts, NVALT |
Longarts, St. Antonius ziekenhuis |
Geen |
Geen |
Geen |
|
Drs. Klap, longarts, NVALT |
Longarts, Tergooi ziekenhuis, Hilversum |
Geen |
Geen |
Geen |
|
Drs. Bolmers, chirurg, NVvL |
Chirurg, Dijklander ziekenhuis |
Geen |
Geen |
Geen |
|
Drs. Dol, SEH-arts, NVSHA |
SEH-arts, KNMG, Jeroen Bosch Ziekenhuis 's-Hertogenbosch |
Geen |
Geen |
Geen |
|
Drs. Li, cardio-thoracaal chirurg, NVT |
Cardiothoracaal chirurg, Radboudumc Nijmegen |
Bestuurslid NVT |
Geen |
Geen |
|
Dr. Mohamed Hoesein, radioloog, NVvR |
Radioloog. UMC Utrecht |
Geen |
Geen |
Geen |
|
Drs. Sie (sinds augustus 2020), anesthesioloog, NVA |
Anesthesioloog, Ikazia Ziekenhuis Rotterdam |
Geen |
Betrokken bij studie naar meest optimale pijnstilling bij VATS lobectomieën. Dit start pas na ontwikkeling van de richtlijn. |
Geen |
|
MW. Torrenga, MSc (sinds september 2020), verpleegkundig specialist, V&VN |
Verpleegkundig Specialist AGZ, gespecialiseerd in longgeneeskunde. Verpleegkundige longafdeling Diakonessenhuis Utrecht |
Scholingscommissie V&VN longverpleegkundige, lid commissie richtlijn COPD bij KNGF, “zinnige zorg” deelnemer/aanspreekpunt V&VN longverpleegkundigen (onbetaald). Mede-auteur boek "Ik heb COPD, wat kan ik doen?", Pharos, juni 2020. Sinds 2018 lid werkgroep Medicatietrouw van het Instituut Verantwoord Medicijngebruik, Utrecht |
Geen |
Geen |
Inbreng patiëntenperspectief
Het was niet haalbaar om een patiëntvertegenwoordiger te laten plaatsnemen aan de werkgroep. De richtlijn wordt wel aangeboden aan verschillende patiëntvertegenwoordigers om het patiëntperspectief te waarborgen.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de leden van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Richtlijn Primaire Spontane Pneumothorax, 2001) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door middel van een schriftelijke Invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep en de adviseur concept-uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De gespecificeerde zoekstrategieën zijn op te vragen bij het Kennisinstituut.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (eindconclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een eindconclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialist.
Zoekverantwoording
Databases: PubMed, Embase
Periode: 2000-
Datum: 26 augustus 2019
|
Studietype |
Totaal |
Ontdubbeld |
|
SR |
38 |
26 |
|
RCT |
111 |
66 |
|
Vergelijkend overig |
286 |
169 |
PubMed
|
Search |
Query |
Items found |
|
Search #14 AND #22 |
||
|
Search #13 AND #22 |
||
|
Search #11 AND #22 |
||
|
Search #15 NOT ("Comment" (Publication Type) OR "Letter" (Publication Type)) NOT ((“Animals”(Mesh) OR dog(tiab)) NOT “Humans”(Mesh)) |
||
|
Search #4 AND #9 Filters: Publication date from 2000/01/01 |
||
|
Search #4 AND #9 |
||
|
Search "Epidemiologic Studies"(Mesh) OR cohort(tiab) OR (case(tiab) AND (control(tiab) OR controll*(tiab) OR comparison(tiab) OR referent(tiab))) OR risk(tiab) OR causation(tiab) OR causal(tiab) OR "odds ratio"(tiab) OR etiol*(tiab) OR aetiol*(tiab) OR "natural history"(tiab) OR predict*(tiab) OR prognos*(tiab) OR outcome(tiab) OR course(tiab) OR retrospect*(tiab) |
||
|
Search randomized controlled trial(pt) OR controlled clinical trial(pt) OR randomized(tiab) OR placebo(tiab) OR drug therapy(sh) OR randomly(tiab) OR trial(tiab) OR groups(tiab) |
||
|
Search ("Meta-Analysis as Topic"(Mesh) OR “Meta-Analysis”(Publication Type) OR metaanaly*(tiab) OR metanaly*(tiab) OR meta-analy*(tiab) OR meta synthes*(tiab) OR metasynthes*(tiab) OR meta ethnograph*(tiab) OR metaethnograph*(tiab) OR meta summar*(tiab) OR metasummar*(tiab) OR meta-aggregation(tiab) OR metareview(tiab) OR meta-review(tiab) OR overview of reviews(tiab) OR ((systematic*(ti) OR scoping(ti) OR umbrella(ti) OR meta-narrative(ti) OR metanarrative(ti) OR evidence based(ti)) AND (review*(ti) OR overview*(ti))) OR ((evidence(ti) OR narrative(ti) OR metanarrative(ti) OR qualitative(ti)) AND synthesis(ti)) OR systematic review(pt) OR prisma(tiab) OR preferred reporting items(tiab) OR quadas*(tiab) OR systematic review*(tiab) OR systematic literature(tiab) OR structured literature search(tiab) OR systematic overview*(tiab) OR scoping review*(tiab) OR umbrella review*(tiab) OR mapping review*(tiab) OR systematic mapping(tiab) OR evidence synthes*(tiab) OR narrative synthesis(tiab) OR metanarrative synthesis(tiab) OR research synthesis(tiab) OR qualitative synthesis(tiab) OR realist synthesis(tiab) OR realist review(tiab) OR realist evaluation(tiab) OR systematic qualitative review(tiab) OR mixed studies review(tiab) OR mixed methods synthesis(tiab) OR Mixed research synthesis(tiab) OR quantitative literature review(tiab) OR systematic evidence review(tiab) OR evidence-based review(tiab) OR comprehensive literature search(tiab) OR integrated review*(tiab) OR integrated literature review(tiab) OR integrative review*(tiab) OR integrative literature review*(tiab) OR structured literature review*(tiab) OR systematic search and review(tiab) OR meta-narrative review*(tiab) OR metanarrative review(tiab) OR systematic narrative review(tiab) OR systemic review(tiab) OR systematized review(tiab) OR systematic research synthesis(tiab)) NOT ("Comment" (Publication Type) OR "Letter" (Publication Type)) NOT (“Animals”(Mesh) NOT “Humans”(Mesh)) |
||
|
Search "Endoscopic Ultrasound-Guided Fine Needle Aspiration"(Mesh) OR aspiration(tiab) OR suction(tiab) OR catheterization(tiab) OR catheterisation(tiab) |
||
|
Search ("Pneumothorax"(Mesh) AND spontaneous*(tiab)) OR spontaneous pneumothorax(tiab) |
Embase
|
No. |
Query |
Results |
|
#33 |
#31 AND #32 |
10 |
|
#32 |
#4 OR #6 OR #8 OR #10 OR #12 OR #14 OR #16 OR #18 OR #20 |
11 |
|
#31 |
#26 OR #28 OR #30 |
221 |
|
#30 |
#24 AND #29 |
183 |
|
#29 |
cohort:ab,ti OR (case:ab,ti AND (control:ab,ti OR controll*:ab,ti OR comparison:ab,ti OR referent:ab,ti)) OR risk:ab,ti OR causation:ab,ti OR causal:ab,ti OR 'odds ratio':ab,ti OR etiol*:ab,ti OR aetiol*:ab,ti OR 'natural history':ab,ti OR predict*:ab,ti OR prognos*:ab,ti OR outcome:ab,ti OR course:ab,ti OR retrospect*:ab,ti OR 'epidemiology'/de |
7542624 |
|
#28 |
#24 AND #27 |
62 |
|
#27 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract'/it |
2276950 |
|
#26 |
#24 AND #25 |
25 |
|
#25 |
('meta-analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
447814 |
|
#24 |
#3 AND (1-1-2000)/sd |
369 |
|
#23 |
#3 AND #22 |
0 |
|
#22 |
kim AND pneumothorax AND adults AND 2017 |
5 |
|
#21 |
#3 AND #20 |
2 |
|
#20 |
wakai AND simple AND aspiration AND 2007 |
2 |
|
#19 |
#3 AND #18 |
1 |
|
#18 |
devanand AND simple AND aspiration AND 2004 |
1 |
|
#17 |
#3 AND #16 |
1 |
|
#16 |
korczynski AND catheter AND aspiration AND 2015 |
1 |
|
#15 |
#3 AND #14 |
1 |
|
#14 |
gaudio AND simple AND aspiration AND 2009 |
1 |
|
#13 |
#3 AND #12 |
2 |
|
#12 |
thelle AND chest AND tube AND drainage AND 2017 |
2 |
|
#11 |
#3 AND #10 |
1 |
|
#10 |
parlak AND pneumothorax AND therapy AND 2012 |
1 |
|
#9 |
#3 AND #8 |
1 |
|
#8 |
noppen AND manual AND aspiration AND versus AND chest AND tube AND drainage AND 2002 |
1 |
|
#7 |
#3 AND #6 |
1 |
|
#6 |
ayed AND aspiration AND versus AND tube AND drainage AND 2006 |
1 |
|
#5 |
#3 AND #4 |
1 |
|
#4 |
ho AND minichest AND tube AND needle AND aspiration AND 2011 |
1 |
|
#3 |
#1 AND #2 |
535 |
|
#2 |
'aspiration needle'/exp OR 'bronchial aspiration procedure'/exp OR 'suction'/exp OR 'catheterization'/exp OR 'aspiration'/exp OR suction:ti,ab,kw OR aspiration:ti,ab,kw OR catheterizaton:ti,ab,kw OR catheterisation:ti,ab,kw |
331374 |
|
#1 |
'primary spontaneous pneumothorax'/exp OR 'spontaneous pneumothorax'/exp OR 'spontaneous pneumothorax':ti,ab |
6300 |
