Verlaging valrisico ouderen in verpleeghuis
Uitgangsvraag
Welke valrisico verlagende interventies zijn effectief bij ouderen wonend in het verpleeghuis?
Aanbeveling
Verricht een multifactoriële interventie gericht op de geïdentificeerde risicofactoren.
Behandel verpleeghuisbewoners met vitamine D-suppletie (vitamine D3, vitamine D2 of multivitaminen).
Overweeg een gecombineerde interventie waar een oefenprogramma onderdeel van is, aangepast op individueel niveau, met voldoende uitdaging en voldoende intensiteit.
Overweeg valrisicoverhogende medicatie aan te passen naar aanleiding van de medicatiebeoordeling. Zie voor de uitvoering van de medicatiebeoordeling de richtlijn polyfarmacie ouderen https://richtlijnendatabase.nl/richtlijn/polyfarmacie_bij_ouderen/uitvoering_medicatiebeoordeling.html.
Overwegingen
Samenvattend is het wetenschappelijk bewijs met betrekking tot effectieve valpreventie bij verpleeghuisbewoners beperkt toegenomen in de laatste decade. De literatuur levert diverse studies met multifactoriële interventies op. Er is bewijs dat het uitvoeren van multifactoriële interventies effectief is op het aantal vallers en valfrequentie, naast mogelijke fractuurreductie. De werkgroep is van mening dat het toepassen van een multifactoriële interventie gericht moet zijn op de individuele valrisico analyse van de bewoners.
Het gebruik van vitamine D (vitamine D3, vitamine D2 of multivitaminen) verlaagt niet het aantal vallers, echter wel de valfrequentie bij verpleeghuisbewoners vergeleken met reguliere zorg.
Omdat vitamine D-supplementen ook nog eens gemakkelijk toegediend kunnen worden bij ouderen en goedkoop zijn, adviseert de werkgroep om verpleeghuisbewoners met vitamine D te behandelen. Hierbij is het advies om niet intermitterend hoog te doseren, maximaal 25.000 IE per maand, omdat bij hogere doseringen het valrisico weer toeneemt (Sanders, 2010).
Uit de systematische zoekactie bleek dat lichamelijke oefeningen geen effect hebben op het aantal vallers of valfrequentie onder verpleeghuisbewoners vergeleken met reguliere zorg. Lichamelijke oefeningen daarentegen verlagen potentieel wel het risico op een botbreuk vergeleken met reguliere zorg onder verpleeghuisbewoners. Daarom is de werkgroep van mening dat een op het individu afgestemd oefenprogramma met spierkracht- en balansverbetering zinvol kan zijn voor het verlagen van het fractuurrisico. Van belang hierbij is om rekening te houden met compliance, uitdaging, adequate duur en intensiteit van de lichamelijke oefeningen. De werkgroep is van mening dat individueel bekeken moet worden bij wie een oefenprogramma zinvol kan zijn en bij voorkeur ingebed in een multifactoriële interventie. Luister hierbij goed naar de wens van de patiënt. Het is belangrijk om de activiteiten die de bewoner binnen zijn context van het verpleeghuis uitvoert te analyseren en dit te integreren binnen de behandeling.
Ondanks dat in de literatuur het uitvoeren van een medicatiebeoordeling als individuele interventie niet als effectief voor valpreventie in de verpleeghuisomgeving is aangetoond, acht de werkgroep het uitvoeren van een medicatiebeoordeling (kritische evaluatie van voorgeschreven medicatie) zinvol bij deze kwetsbare populatie. Het kan negatieve uitkomsten (overlijden, ziekenhuisopname), bijwerkingen, overdosering, intoxicaties, etc voorkomen. Daarnaast is het in de praktijk makkelijk te integreren in de dagelijkse praktijk. De momenten waarop een medicatiebeoordeling kan worden uitgevoerd door de arts zijn: standaard twee keer per jaar bij alle bewoners, bij elke nieuwe opname in het verpleeghuis en na een ziekenhuisopname.
Voor het uitvoeren van een medicatiebeoordeling moet wel kennis aanwezig zijn bij de arts omtrent medicatievoorschrift, interacties en mogelijke bijwerkingen van medicatie bij ouderen. Mogelijk is specifieke educatie met betrekking tot medicatiegebruik van de voorschrijvend arts een zinvolle interventie. Het betrekken van de apotheker in de medicatiebeoordeling kan van toegevoegde waarde zijn.
Vanwege het verschil in enkelvoudige interventies en kleine studiegrootte per trial is het niet mogelijk om een conclusie te formuleren over het effect op het aantal vallers, valfrequentie of het risico op botbreuken.
Naast bovengenoemde overwegingen, is de werkgroep van mening dat bewustwording van valgevaar, zowel bij de bewoner als omgeving, belangrijk is, evenals betrokkenheid van het multidisciplinair team bij het signaleren van potentieel gevaarlijke situaties en bij het uitvoeren van interventies. Bij de verschillende interventies is het belangrijk om bij de bewoner zelf aandacht te hebben voor: zijn/ haar autonomie, zoveel mogelijk aansluiten bij de wensen en behoefte van de bewoner, een goede uitleg over het belang van valpreventie en zorg te dragen voor een goede motivatie.
Onderbouwing
Achtergrond
In Nederland lijkt de doelgroeppopulatie verpleeghuisbewoners de laatste jaren door maatschappelijke ontwikkelingen veranderd, ook al hebben we hier geen duidelijke populatievergelijkingen beschikbaar. We gaan in deze module uit van beschikbare literatuur waarin als omgeving het verpleeghuis inclusief intramurale revalidatieomgeving wordt gebruikt. De doelgroep Geriatrische Revalidatiezorg is meer vergelijkbaar met de thuiswonendenpopulatie, daarvoor is dan ook het advies om voor de individuele behandeling de interventies van deze thuiswonendenpopulatie te hanteren.
Behandeling
Valpreventie binnen de verpleeghuisomgeving is van belang om de valgerelateerde morbiditeit, mortaliteit, verlies van zelfstandigheid en ziekenhuisopnames terug te dringen. Heupfracturen vormen een belangrijke oorzaak van deze ziekenhuisopnames, morbiditeit en mortaliteit. Gezien het feit dat de etiologie multifactorieel bepaald is, is het belangrijk om een uitgebreid behandelplan op te stellen. Het kan nuttig zijn om de interventies binnen het behandelplan op te splitsen in de intrinsieke, modificeerbare risicofactoren versus de omgevingsgerelateerde factoren. Daarnaast is het belangrijk dat het behandelplan multidisciplinair binnen de organisatie wordt opgezet en uitgevoerd.
In deze richtlijn worden geen interventies opgenomen waarbij onvoldoende bewijs aanwezig is (op basis van vergelijkend onderzoek en/of observationeel onderzoek), en waarbij tevens de verwachting is dat op deze interventie/behandeling geen nieuwe studies zullen komen die dit onderzoeken. Hierdoor worden de interventies vrijheidsbeperkende maatregelen en bedalarmsystemen niet meer in deze richtlijn behandeld.
Conclusies / Summary of Findings
1. Lichamelijke oefeningen versus reguliere zorg
Aantal vallers
|
Zeer laag GRADE |
Lichamelijke oefeningen hebben geen effect op het aantal vallers onder verpleeghuisbewoners vergeleken met reguliere zorg.
Bronnen (Faber, 2008; Kovacs, 2012; Kovacs, 2013; Mulrow, 1994; Rosendahl, 2008) |
Valfrequentie
|
Zeer laag GRADE |
Lichamelijke oefeningen hebben geen effect op valfrequentie onder verpleeghuisbewoners vergeleken met reguliere zorg.
Bronnen (Cadore, 2014; Faber, 2006; Kovacs, 2013; Mulrow, 1994; Rosendahl, 2008; Schoenfelder, 2000) |
Botbreuken
|
Zeer laag GRADE |
Lichamelijke oefeningen verlagen potentieel het risico op een botbreuk vergeleken met reguliere zorg onder verpleeghuisbewoners.
Bronnen (Rosendahl, 2008) |
2. Medicatie beoordeling versus reguliere zorg
Aantal vallers
|
Matig GRADE |
Het beoordelen van medicatiegebruik in verpleeghuisbewoners heeft geen effect op het aantal vallers vergeleken met reguliere zorg.
Bronnen (Crotty 2004a; Crotty, 2004b; Garcia-Gollarte, 2014; Lapane, 2011; Zermansky, 2006) |
3. Vitamine D supplementen versus geen vitamine D supplementen
Aantal vallers
|
Matig GRADE |
Het gebruik van vitamine D (vitamine D3, vitamine D2 of multivitaminen) heeft geen effect op het aantal vallers onder verpleeghuisbewoners vergeleken met reguliere zorg, placebo of calcium.
Bronnen (Cameron, 2012) |
Valfrequentie
|
Matig GRADE |
Het gebruik van vitamine D (vitamine D3, vitamine D2 of multivitaminen) verlaagt de valfrequentie bij verpleeghuisbewoners vergeleken met reguliere zorg, placebo of calcium.
Bronnen (Cameron, 2012) |
4. Omgevingsinterventies versus reguliere zorg
|
Geen GRADE |
Er zijn te weinig gegevens beschikbaar om een conclusie te trekken het effect van het gebruik van een pleister/plakker voor het monitoren van de positie van de patiënt op de valfrequentie. |
5. Sociale interventies versus reguliere zorg
|
- GRADE |
Vanwege verschillende interventies is het niet mogelijk om een conclusie te trekken over het effect van sociale interventies op het aantal vallers, valfrequentie of het risico op botbreuken.
Bronnen (Teresi, 2013; Cameron, 2012) |
6. Andere enkele interventies versus reguliere zorg
|
- GRADE |
Vanwege het verschil in interventies en kleine studiegrootte per trial is het niet mogelijk om een conclusie te formuleren over het effect van lavendel geur of zonlicht expositie op het aantal vallers, valfrequentie of het risico op botbreuken.
Bronnen (Buckinx, 2014; Cameron, 2012) |
7. Multifactoriële interventies versus reguliere zorg
Aantal vallers
|
Zeer laag GRADE |
Een multifactoriële interventie leidt mogelijk tot een verlaging van het aantal vallers onder verpleeghuisbewoners vergeleken met reguliere zorg.
Bronnen (Cameron, 2012) |
Valfrequentie
|
Zeer laag GRADE |
Valfrequentie is mogelijk verlaagd bij een multifactoriële interventie vergeleken met reguliere zorg bij oudere patiënten in een verpleeghuis.
Bronnen (Cameron, 2012) |
Botbreuken
|
Zeer laag GRADE |
Een multifactoriële interventie verlaagt mogelijk het risico op een botbreuk bij verpleeghuisbewoners vergeleken met reguliere zorg.
Bronnen (Cameron, 2012) |
Samenvatting literatuur
Beschrijving studies
Cameron, (2012) ondernamen een systematische literatuur zoekactie naar de effecten van interventies ter preventie van vallen bij oudere patiënten wonend in een zorginstelling of opgenomen in een ziekenhuis. De zoekactie was in maart 2012 uitgevoerd. In totaal waren 60 trials met 60.345 deelnemers wonend in een zorginstelling of opgenomen in een ziekenhuis geïncludeerd. Voor het beantwoorden van deze vraag wordt alleen data van interventies in een verpleeghuispopulatie beschreven. 43 trials met 30.373 deelnemers betrof een populatie uit een zorginstelling. De volgende interventies ter preventie van vallen waren beschreven in de Cochrane review:
- lichamelijke oefeningen versus reguliere zorg;
- medicatie review door apothekers versus reguliere zorg;
- vitamine D supplementen versus geen vitamine D supplementen;
- omgeving interventies versus reguliere zorg;
- sociale omgeving versus controle;
- andere enkele interventies versus controle;
- multifactoriële interventies versus reguliere zorg.
In de originele Cochrane review werd de trial van Schnelle (2003) gecategoriseerd als een trial met meerdere interventies vergeleken met reguliere zorg. Als interventie evalueerde Schnelle (2003) lichamelijke oefeningen, behandeling van incontinentie en vloeistofbehandeling ter valpreventie. Gezien de overlap met multifactoriële interventies heeft de werkgroep ervoor gekozen om deze trial te hercategoriseren onder multifactoriële interventies. Ook een interventiegroep uit de trial van Sambrook (2012) werd gecategoriseerd onder meerdere interventies, aangezien zonlicht blootstelling tezamen met calcium aan deelnemers werd gegeven. Aangezien deze gecombineerde interventie niet duidelijk onder een andere interventiegroep valt, worden de gegevens van deze interventiegroep buiten beschouwing gelaten.
Beschrijving nieuwe studies
Uit de update van de Cochrane review werden acht nieuwe trials geïncludeerd. In totaal werden additionele data van 8751 deelnemers geïncludeerd. De variatie in trialgrootte was groot tussen trials. Vijf trials includeerde in totaal minder dan 125 deelnemers en twee trials meer dan 1.000 deelnemers. Alle acht gevonden trials hebben interventies geëvalueerd ook beschreven in de Cochrane review; vijf trials vergeleken lichamelijke oefeningen met reguliere zorg, één trial bekeek het effect van medicatie review versus reguliere zorg en twee trials evalueerden een andere enkele interventie vergeleken met controle. De resultaten van de update zullen tezamen met de al reeds gepubliceerde data uit de Cochrane review van (Cameron, 2012) per (categorie van) interventie worden beschreven.
Interventies ter preventie van vallen
1. Lichamelijke oefeningen versus reguliere zorg
In de Cochrane review van Cameron (2012) hadden 13 trials lichamelijke oefeningen vergeleken met reguliere zorg. Drie additionele trials werden gevonden en worden hieronder kort beschreven.
Cadore (2014) ondernam een gerandomiseerd gecontroleerde trial naar de effecten van een multicomponent training op het risico op vallen en functionele uitkomsten in fragiele negentigjarigen. Deelnemers ouder dan 85 jaar en fragiel volgens de Fried’s criteria voor fragiliteit kwamen in aanmerking. In totaal werden 32 deelnemers gerandomiseerd, 16 ontvingen de multicomponent training en 16 deelnemers reguliere zorg. Multicomponent training bestond uit boven- en onderlichaam weerstandtraining gecombineerd met balans- en loopoefeningen tweemaal per week voor 12 weken. Trainingsessies duurde ongeveer 40 minuten. Deelnemers in de controlegroep voerden viermaal per week mobiliteitsoefeningen uit die bestonden uit kleine actieve en passieve bewegingen als een serie van rekoefeningen. Dit soort oefeningen maakte deel uit van de reguliere zorg.
Kovács (2013) onderzocht of de effecten van een multimodaal oefenprogramma op statische en dynamische balans en het risico op vallen in oudere volwassenen met een milde of matige cognitieve stoornissen. Deelnemers met cognitieve stoornissen wonend in een verpleeghuis kwamen in aanmerking. Randomisatie was op de cognitieve stoornissen gestratificeerd. 43 deelnemers ontvingen een multimodaal oefenprogramma met kracht- en evenwichtsoefeningen voor 12 maanden. 43 deelnemers aan de controlegroep ontvingen reguliere zorg wat bestond uit deelname aan sociale activiteiten, zoals simpele bordspelletjes, bekijken van foto’s of films, luisteren naar muziek en hobby activiteiten.
Kovács (2012) vergeleek de effecten van twee oefenprogramma op evenwicht en het risico op vallen in oudere vrouwen met leeftijds-gerelateerde visuele beperking. 41 deelnemers waren naar een multimodaal oefenprogramma bovenop standaard osteoporose oefeningen (n=21) of naar alleen standaard osteoporose oefeningen (n=20) gerandomiseerd. De interventiegroep ontving tweemaal per week het multimodaal oefenprogramma van 30 minuten en tweemaal per week standaard osteoporose oefeningen van 30 minuten voor zes maanden. De controlegroep ontving viermaal per week standaard osteoporose oefeningen voor zes maanden.
Resultaten
I. Vallen
I.I Het aantal vallers
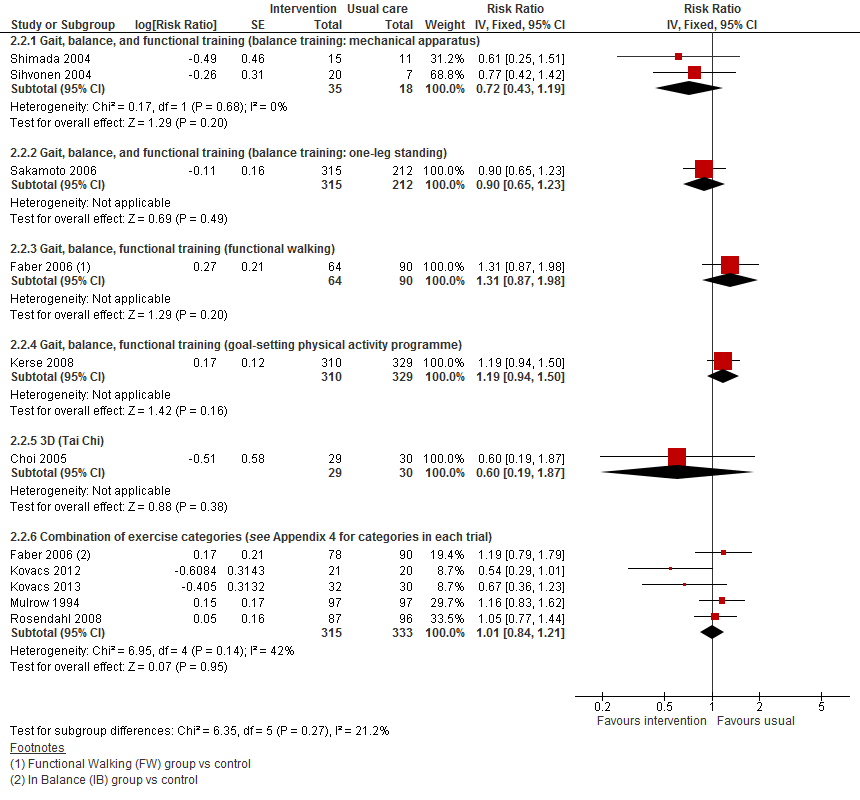
Gepoolde data van vijf trials (totaal 648 deelnemers) liet zien dat er geen effect is van lichamelijke oefeningen vergeleken met reguliere zorg op het aantal vallers (RR 1,01 95%BI: 0,84 tot 1,21).
Figuur 1
II. Valfrequentie
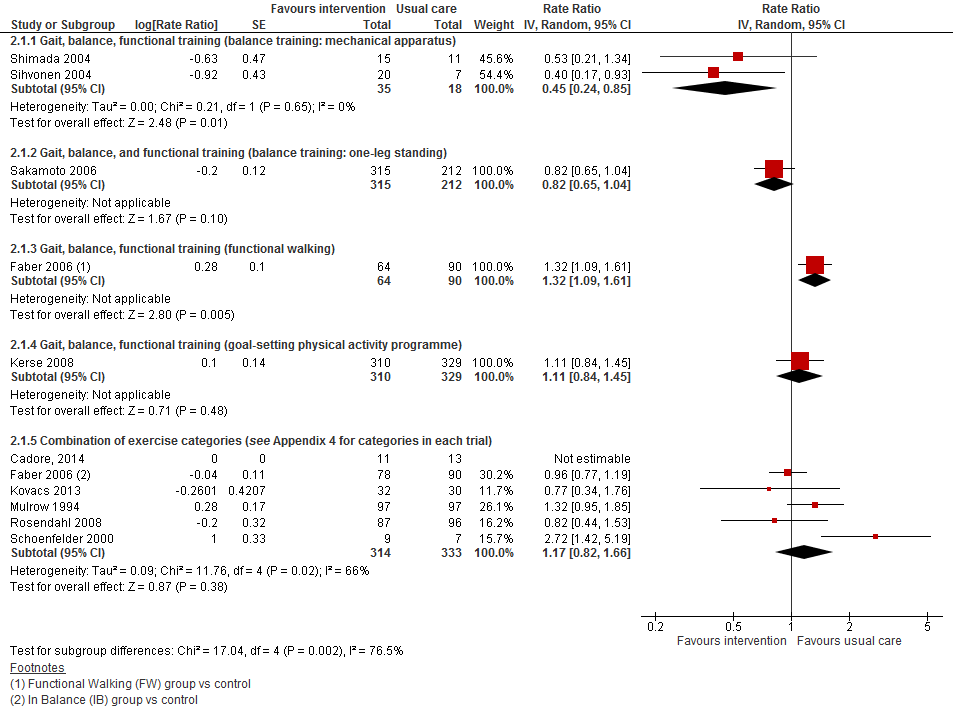
Van zes trials met data over valfrequentie bleek één trial geen data zodanig te rapporteren dat het mogelijk was om de data mee te nemen in de meta-analyse. Het gepoolde effect van vijf trials (totaal 647 deelnemers) liet geen effect zien van lichamelijke oefeningen op valfrequentie vergeleken met reguliere zorg (RR 1,17 95%BI: 0,82 tot 1,66).
Figuur 2
III. Botbreuken
Eén trial rapporteerde data over het risico op een botbreuk bij lichamelijke oefeningen. Onder totaal 183 deelnemers was het risico op een botbreuk potentieel 84% verlaagd vergeleken met reguliere zorg (RR 0,16 95%BI: 0,01 tot 2,81).
Figuur 3

Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aantal vallers is met drie niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie, drie trials rapporteerden een potentieel verlaagd effect en vier trials geen effect), extrapoleerbaarheid (bias ten gevolge van indirectheid, reguliere zorg verschillend per trial) en het geringe aantal patiënten (imprecisie, laag aantal vallers).
De bewijskracht voor de uitkomstmaat valfrequentie is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (merendeel assessor niet geblindeerd), tegenstrijdige resultaten (inconsistentie, twee trials rapporteerden een potentieel verlaagd effect, twee trials rapporteerden een potentieel verhoogd effect) en extrapoleerbaarheid (bias ten gevolge van indirectheid, reguliere zorg verschillend per trial).
De bewijskracht voor de uitkomstmaat botbreuken is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (outcome assessor was niet geblindeerd) en het geringe aantal patiënten en een breed betrouwbaarheidsinterval (imprecisie)
2. Medicatie beoordeling versus reguliere zorg
In de Cochrane review van Cameron (2012) hebben vijf trials medicatie beoordeling vergeleken met reguliere zorg. Eén additionele trial werd gevonden en wordt hieronder kort beschreven.
Garcia-Gollarte (2014) onderzocht het effect van een educatieve interventie gericht op het verminderen van ongepast voorschrijven van medicatie onder verpleeghuisartsen en het verbeteren van gezondheid en het benutten van hulpbronnen. Auteurs ondernamen een gerandomiseerd multicenter studie van een privaat gefinancierde organisatie van verpleeghuizen in Spanje. 60 verpleeghuisartsen werkzaam in 37 verpleeghuizen werden per verpleeghuis gerandomiseerd. Het gehele verpleeghuis ontving dezelfde interventie. 30 verpleeghuisartsen (uit 19 verpleeghuizen) ontvingen de interventie en 30 verpleeghuisartsen (uit 18 verpleeghuizen) zaten in de controlegroep. Verpleeghuisartsen in de interventiegroep ontvingen een gestructureerde educatieve programma over algemene aspecten bij het voorschrijven van medicamenten aan oudere patiënten, hoe het aantal medicamenten te verminderen, regelmatig een beoordeling van medicijngebruik uit te voeren, het vermijden van oneigenlijk gebruik van medicatie, het stoppen met medicatie die geen verbetering laten zien en het vermijden van onderbehandeling door medicatie met bewezen positieve effecten. Uit de behandelde patiënten werd een random sample getrokken en gebruikt voor de analyse. 516 patiënten werden behandeld door een verpleeghuisarts die de interventie heeft ontvangen en 502 patiënten stonden onder behandeling van een arts uit de controlegroep.
Resultaten
I. Vallen
I.I Het aantal vallers
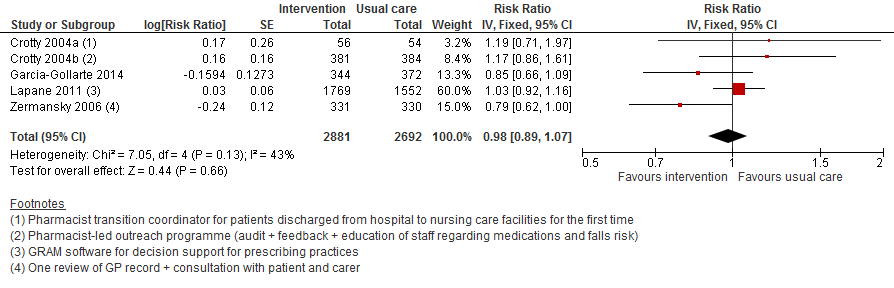
Onder 5573 deelnemers heeft het beoordelen van medicatiegebruik geen effect op het aantal vallers in verpleeghuizen vergeleken met reguliere zorg (RR 0,98 95%BI:0,89 tot 1,07).
Figuur 4
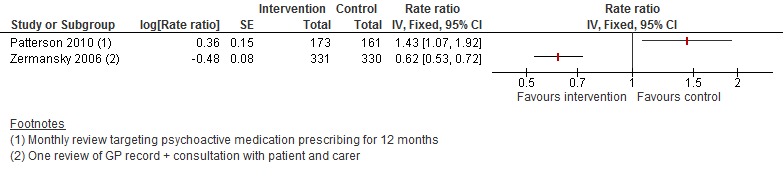
II. Valfrequentie
Twee trials hebben valfrequentie geëvalueerd na een medicatie beoordeling. Vanwege een tegengesteld effect is ervoor gekozen om de resultaten niet te poolen. Als gevolg is ook geen uitspraak te doen over het effect van medicatie beoordeling op valfrequentie.
Figuur 5
III. Botbreuken
Geen van de trials rapporteerden data over botbreuken.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat aantal vallers is met één niveau verlaagd gezien extrapoleerbaarheid (bias ten gevolge van indirectheid, verschil in interventies gericht op medicatie beoordeling).
Vanwege tegenstrijdige resultaten uit twee trials is het niet mogelijk om de bewijskracht te graderen en een conclusie te formuleren.
Vanwege het ontbreken van data over de uitkomst botbreuken is het niet mogelijk om de bewijskracht te graderen.
3. Vitamine D supplementen versus geen vitamine D supplementen
De update van Cameron (2012) vond geen trials met als interventie vitamine D supplementen onder oudere patiënten in een verpleeghuis. In de huidige Cochrane review zijn meerdere trials die hebben gekeken naar het geven van vitamine D supplementen. Hierbij werd verschillende interventies bekeken, zoals het geven van vitamine D3 en calcium versus alleen calcium of placebo.
Resultaten
I. Vallen
I.I Het aantal vallers
Gecombineerd lieten de verschillende interventies zien dat het geven van vitamine D geen effect heeft op het aantal vallers (RR 0,99 95%BI: 0,90 tot 1,08). Ook al werden verschillende interventies gegeven en vergeleken met verschillende controles, ook per interventie type was geen effect waar te nemen op het aantal vallers.
Figuur 6
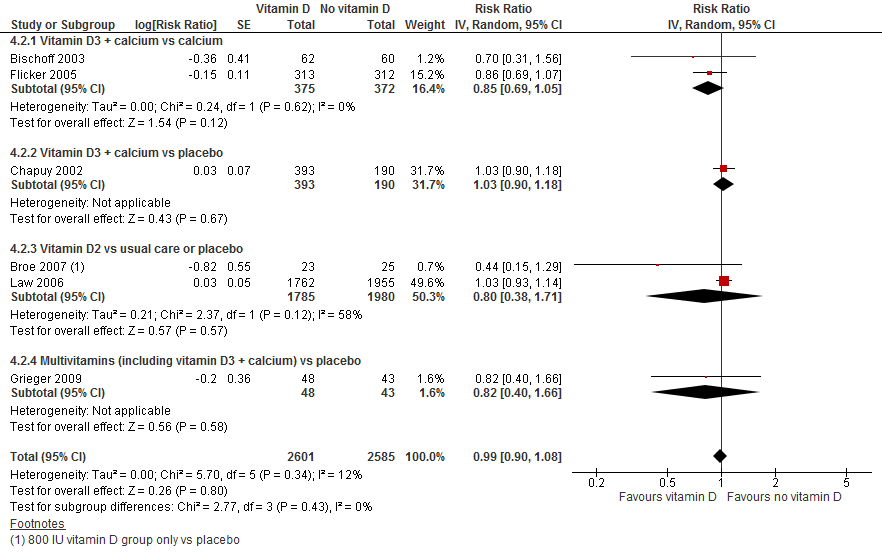
II. Valfrequentie
Gecombineerd lieten de verschillende interventies zien dat het geven van vitamine D valfrequentie verlaagt met 37% vergeleken met controlegroep (RR 0,63 95%BI: 0,46 tot 0,86). De richting van het effect was consistent voor verschillende interventies en controlegroepen.
Figuur 7
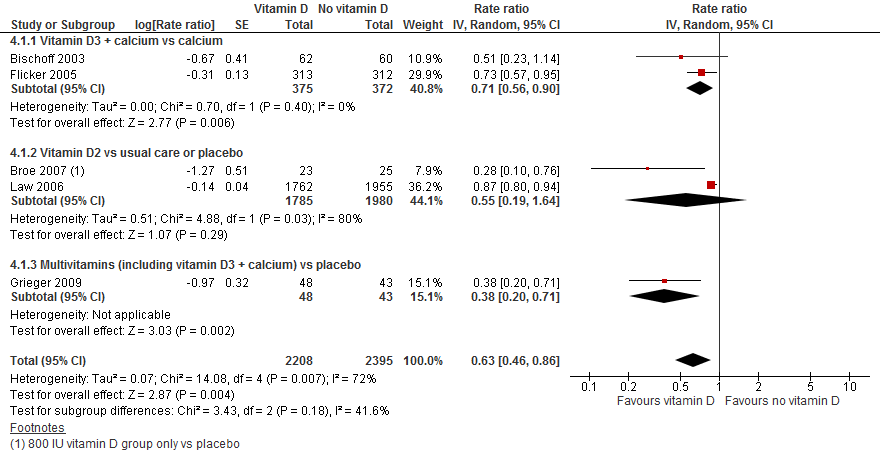
III. Botbreuken
Vanwege een tegengesteld effect is ervoor gekozen om de resultaten niet te poolen. Als gevolg is ook geen uitspraak te doen over het effect van vitamine D op botbreuken.
Figuur 8
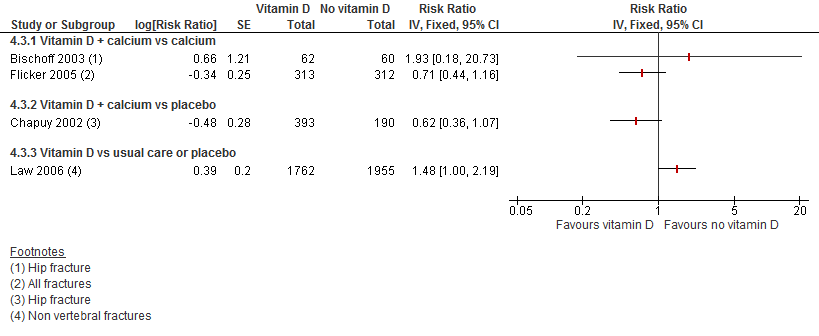
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten aantal vallers en valfrequentie is met één niveau verlaagd gezien extrapoleerbaarheid (bias ten gevolge van indirectheid, verschillende type interventies en vergeleken met verschillende controlegroepen).
Vanwege tegenstrijdige resultaten over het effect op botbreuken is het niet mogelijk om de bewijskracht te graderen en een conclusie te formuleren.
4. Omgevingsinterventies versus reguliere zorg
De update van (Cameron, 2012) vond geen trials met een interventie gericht op de omgeving onder oudere patiënten in een verpleeghuis. In de huidige Cochrane review werd één trial (Clifton, 2009) geïncludeerd die het effect van een pleister/plakker voor het monitoren van de positie van de patiënt vergeleek met reguliere zorg. De pleister/plakker werd op de dij geplakt en werkte via draadloze technologie.
Resultaten
I. Vallen
I.I Het aantal vallers
Clifton (2009) rapporteerde geen data over het aantal vallers.
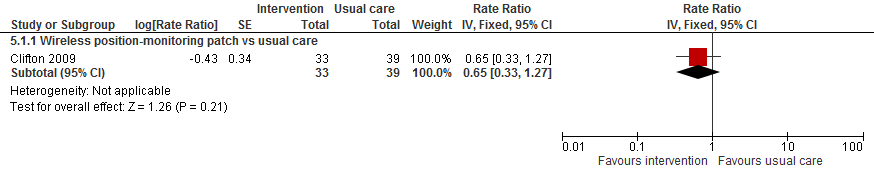
II. Valfrequentie
In de trial van (Clifton, 2009) was valfrequentie verlaagd bij gebruik van een pleister/plakkers voor het monitoren van de positie van de patiënt vergeleken met reguliere zorg (RR 0,65 95%BI: 0,33 tot 1,27).
Figuur 9
III. Botbreuken
Clifton (2009) rapporteerde geen data over het risico op een botbreuk.
Bewijskracht van de literatuur
Vanwege het ontbreken van data over het aantal vallers en botbreuken is het niet mogelijk om de bewijskracht te graderen.
De bewijskracht voor de uitkomstmaat valfrequentie is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, effect beoordelaar was niet geblindeerd), het geringe aantal patiënten (imprecisie) en dat de resultaten niet gepubliceerd zijn (worden slechts vermeld in trialregister). Op basis van bovenstaande gegevens is geen conclusie te trekken.
5. Sociale interventies versus reguliere zorg
In de huidige Cochrane review (Cameron, 2012) vergeleken vier trials een sociale interventie met reguliere zorg gericht op de organisatie van het verpleeghuis. Dit type interventies richt zich op werknemers en veranderingen in de organisatie in plaats van gericht op patiënten. De update van Cameron, 2012 vond één trial over scholing gericht op het verminderen van vallen in oudere patiënten in een verpleeghuis.
Teresi (2013) ondernam een vergelijkend effectiviteitsstudie om het effect op vallen, negatief gedrag en kosten te schatten over het implementeren van scholing en best-practice programma’s in verpleeghuizen. Auteurs randomiseerde 45 verpleeghuizen naar drie groepen waarbij een clusterrandomisatie op regio was toegepast. Auteurs hebben een systematische literatuur review uitgevoerd naar mogelijk scholing- en best-practice programma’s gericht op valpreventie. Er werd echter geen evidence-based, direct beschikbaar training pakket gevonden. In plaats hiervan zijn twee trainingspakketten gekozen die zich respectievelijk richten op valpreventie onder ouderen met een zicht beperking en op het baden van patiënten met dementie (ter beperking van agitatie). In de controlegroep werd training van deze programma’s verzorgd door het verpleeghuis. Interventiegroep 1 betrof verpleeghuizen bij wie stafleden additionele training ontvingen van de ontwikkelaars van de programma’s. Verpleeghuizen in interventiegroep 2 ontvingen training en werden beoordeeld door inspecteurs getraind door de ontwikkelaars van de programma’s. Op basis van een aantal inclusiecriteria werd een steekproef van patiënten genomen. Data van 2179 patiënten in een controle verpleeghuis, 2255 verpleeghuisbewoners met interventie 1 en 2926 verpleeghuisbewoners met interventie 2 werd beschreven en geanalyseerd. Op baseline bleek er een verschil tussen groepen te zijn wat betreft het aantal patiënten dat gevallen was in de laatste 180 dagen. Auteurs gaven geen verklaring voor dit verschil en het is onduidelijk of de analyse gecorrigeerd was voor dit verschil. Daarnaast werd alleen een odds ratio met p-waarde gepresenteerd zonder een betrouwbaarheidsinterval. Het was daarom niet mogelijk om dit resultaat te poolen met de reeds geïncludeerde trials uit de Cochrane review van Cameron (2012).
Resultaten
I. Vallen
I.I Het aantal vallers
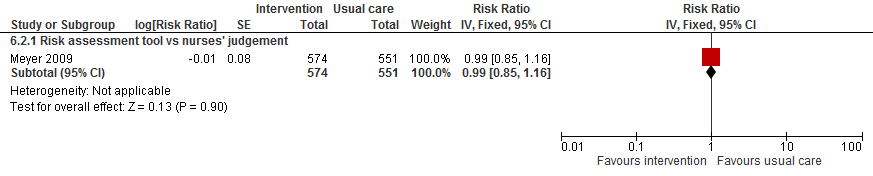
Meyer (2009) vond geen effect van een risk assessment tool vergeleken met een oordeel van verpleegkundigen op het aantal vallers onder oudere patiënten in een verpleeghuis.
Figuur 10
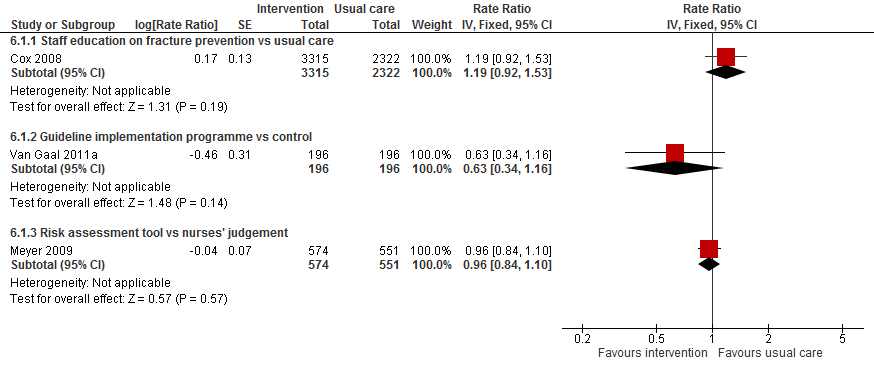
II. Valfrequentie
Drie trials met verschillende interventies hebben het effect op valfrequentie beoordeeld. Vanwege verschillen in resultaat en interventies zijn de resultaten niet gepoold.
Figuur 11
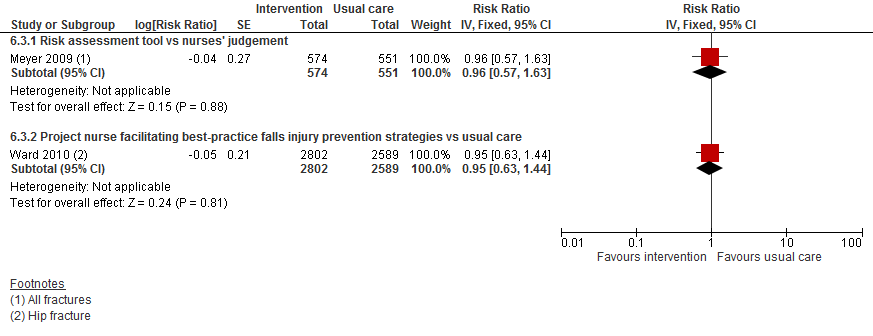
III. Botbreuken
Twee trials hebben het effect op botbreuken geanalyseerd en vonden beide geen verschil tussen interventie en controle op het risico op een botbreuk. Vanwege een verschil in interventie en uitkomst (alle botbreuken of alleen heupbotbreuken) zijn de resultaten niet gepoold.
Figuur 12
Bewijskracht van de literatuur
Vanwege verschillende interventies en uitkomsten is het niet mogelijk om het bewijs te graderen.
6. Andere enkele interventies versus reguliere zorg
In Cochrane review van (Cameron, 2012) beschreven twee trials andere enkele interventies. Sakamato (2012) evalueerde het effect van een pleister met lavendelgeur met placebo op vallen onder 145 verpleeghuisbewoners met cognitieve stoornissen. Sambrook (2012) onderzocht of een toename van blootstelling aan zonlicht (met of zonder calcium) tot verlaging van het valrisico leidden. De update van de Cochrane review van (Cameron, 2012) leverde één trial op. Buckinx (2014) evalueerde de impact van een zes maanden training met whole body vibration op functionele en motorische capaciteiten onder verpleeghuisbewoners over twaalf maanden. Oudere patiënten in twee verpleeghuizen kwamen in aanmerking voor inclusie als zij konden blijven staan en bewegen met of zonder ondersteuning van technologie. Randomisatie vond plaats in blokken van vier. 31 patiënten kregen een zes maanden training met whole body vibration driemaal per week. Alle sessies werden begeleid door een fysiotherapeut of onderzoeker. 31 patiënten in de controlegroep werden gevraagd hun levensstijl niet te veranderen of te gaan deelnemen aan fysieke activiteiten gedurende de studie.
Resultaten
I. Vallen
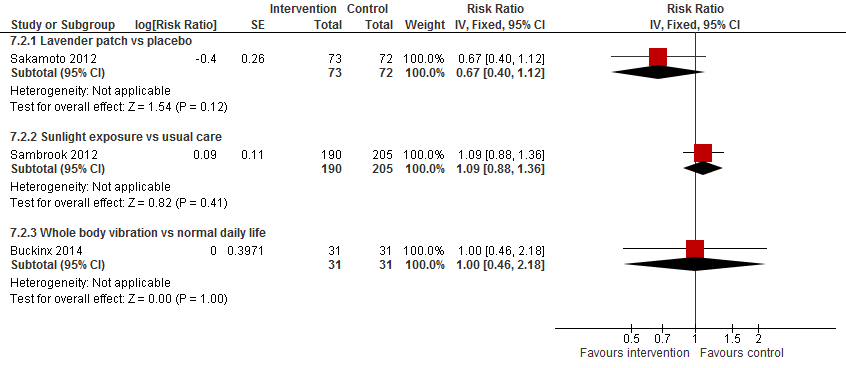
I.I Het aantal vallers
Vanwege het verschil in interventies worden de resultaten niet gepoold. Sakamoto (2012) observeerde dat het aantal vallers mogelijk verlaagd is bij gebruik van een pleister met lavendelgeur (RR 0,67 95%BI: 0,40 tot 1,12). Sambrook, 2012 vond geen effect van additionele blootstelling aan zonlicht op het aantal vallers (RR 1,09 95%BI: 0,88 tot 1,36). Buckinx, 2014 vond geen verschil in het aantal vallers tussen een training met whole body vibration en het normale dagelijkse leven (RR 1,00 95%BI: 0,46 tot 2,18).
Figuur 13
II. Valfrequentie
Sakamoto (2012) vond een verlaging in valfrequentie van 43% bij gebruik van een pleister met lavendelgeur vergeleken met placebo (RR 0,57 95%CI: 0,32 tot 1,01). Sambrook, 2012 observeerde geen verschil in valfrequentie tussen zonlichtblootstelling en reguliere zorg (RR 1,05 95%BI: 0,71 tot 1,56).
Figuur 14
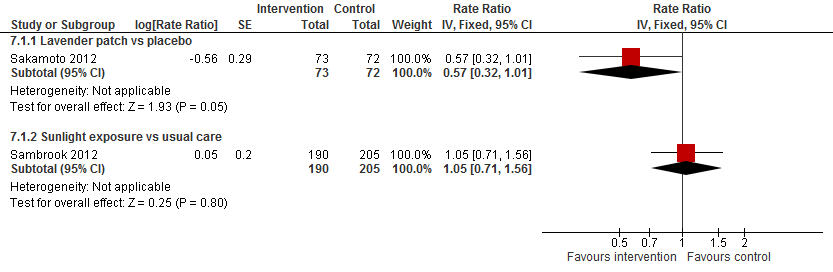
III. Botbreuken
Sambrook (2012) observeerde geen verschil in het risico op een botbreuk tussen zonlichtblootstelling en reguliere zorg (RR 1,07 95%BI: 0,53 tot 2,07).
Figuur 15
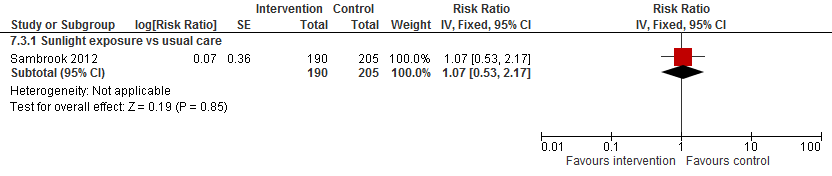
Bewijskracht van de literatuur
Vanwege het verschil in interventies en een kleine studiegrootte per trial is het niet mogelijk om de bewijskracht te graderen.
7. Multifactoriële interventies versus reguliere zorg
Cameron (2012) includeerde acht trials waarbij een multifactoriële interventie werd vergeleken met een controlegroep. Een update van de review vond geen additionele trials.
Resultaten
I. Vallen
I.I Het aantal vallers
In acht trials met data over het aantal vallers leidde een multifactoriële interventie mogelijk tot een verlaging in het aantal vallers vergeleken met reguliere zorg (RR 0,87 95%BI: 0,76 tot 1,00).
Figuur 16
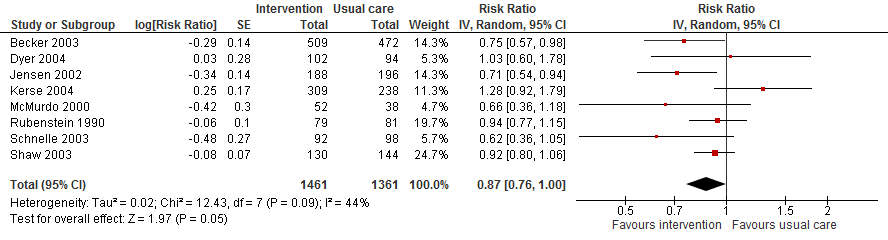
II. Valfrequentie
Zeven trials hebben als uitkomst valfrequentie geëvalueerd en vonden een potentiele verlaagde valfrequentie bij een multifactoriële interventie vergeleken met reguliere zorg (RR 0,76 95%BI: 0,59 tot 1,00).
Figuur 17
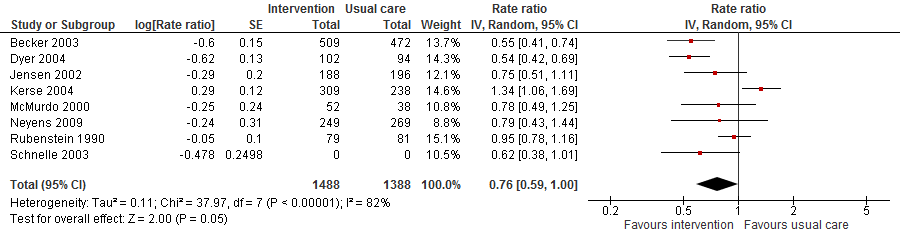
III. Botbreuken
Drie trials hebben ook data over het risico op een botbreuk verzameld. Het risico op botbreuk is potentieel met 34% verlaagd vergeleken met reguliere zorg (RR 0,66 95%BI: 0,25 tot 1,72).
Figuur 18
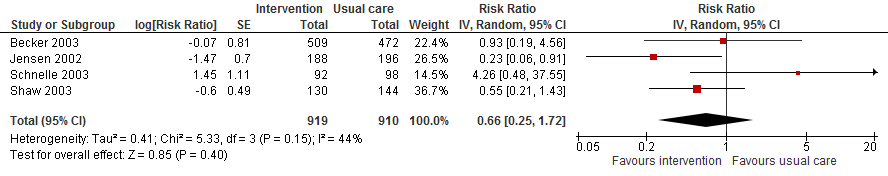
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten aantal vallers, valfrequentie en botbreuken is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, effectbeoordelaar was niet geblindeerd); tegenstrijdige resultaten (inconsistentie) en brede betrouwbaarheidsintervallen (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en):
Wat is de effectiviteit van valpreventieve interventies vergeleken met geen interventies of andere interventie bij ouderen wonend in een verpleeghuis?
P ouderen wonend in een verpleeghuis;
I interventies ter preventie van vallen;
C geen/ andere interventies die geen effect hebben op vallen;
O valrisico (het aantal vallers en valfrequentie) / fracturen.
Relevante uitkomstmaten
De werkgroep achtte vallen een voor de besluitvorming kritieke uitkomstmaat en fracturen een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde het voorkomen van een of meer valincidenten binnen een jaar in het verpleeghuis als een klinisch relevant verschil.
Zoeken en selecteren (Methode)
Voor de uitwerking van deze vraag wordt een bestaande Cochrane review geüpdatet. (Cameron,2012) ondernamen een systematische literatuur zoekactie naar interventies om de incidentie van vallen bij ouderen in verpleeghuizen of ziekenhuizen te verlagen. De Cochrane Bone, Joint and Muscle Trauma Group Specialised register, CENTRAL, Medline, EMBASE, CINAHL en online trial registers waren met relevante zoektermen doorzocht. Dezelfde zoekstrategie is gebruikt om de Cochrane review te updaten. Voor het beantwoorden van deze vraag wordt alleen de data van ouderen wonend in een verpleeghuis beschreven
De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 2.923 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerde trials met interventies ter preventie van vallen bij ouderen wonend in een verpleeghuis. Op basis van titel en abstract werden in eerste instantie 47 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 41 studies geëxcludeerd (zie exclusietabel), en zes studies definitief geselecteerd.
Resultaten
Zes onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De evidence-tabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Buckinx F, Beaudart C, Maquet D, et al. Evaluation of the impact of 6-month training by whole body vibration on the risk of falls among nursing home residents, observed over a 12-month period: a single blind, randomized controlled trial. Aging Clin Exp Res. 2014;26(4):369-76. doi: 10.1007/s40520-014-0197-z. PubMed PMID: 24469903.
- Cadore EL, Casas-Herrero A, Zambom-Ferraresi F, et al. Multicomponent exercises including muscle power training enhance muscle mass, power output, and functional outcomes in institutionalized frail nonagenarians. Age. 2014;36(2):773-85.
- Cameron ID, Gillespie LD, Robertson MC, et al. Interventions for preventing falls in older people in care facilities and hospitals. Cochrane Database Syst Rev. 2012;12:CD005465. doi: 10.1002/14651858.CD005465.pub3. Review. PubMed PMID: 23235623.
- CBO. Kwaliteitsinstituut voor de Gezondheidszorg. Richtlijn Preventie van valincidenten bij ouderen. Alphen a/d Rijn: van Zuiden Communications BV. 2004.
- Clifton GD, Shonkwiler JS, Kelly KE. Report of a randomized, controlled trial to assess reduction in falls and related injuries using the FallSaver position monitor. Unpublished report. 2009.
- Crotty M, Rowett D, Spurling L, et al. Does the addition of a pharmacist transition coordinator improve evidence-based medication management and health outcomes in older adults moving from the hospital to a long-term care facility? Results of a randomized, controlled trial. American Journal of Geriatric Pharmacotherapy. 2004a;2(4):25764.
- Crotty M, Whitehead C, Rowett D, et al. An outreach intervention to implement evidence based practice in residential care: A randomized controlled trial (ISRCTN67855475). BMC Health Services Research. 2004b;4(1):6.
- Faber MJ, Bosscher RJ, Chin A PawMJ, et al. Effects of exercise programs on falls and mobility in frail and pre-frail older adults: A multicenter randomized controlled trial. Archives of Physical Medicine & Rehabilitation. 2006;87(7):88596.
- García-Gollarte F, Baleriola-Júlvez J, Ferrero-López I, et al. An educational intervention on drug use in nursing homes improves health outcomes resource utilization and reduces inappropriate drug prescription. J Am Med Dir Assoc. 2014;15(12):885-91. doi: 10.1016/j.jamda.2014.04.010. PubMed PMID: 24895001.
- Halfens RJG, Meijers JMM, Meesterberends E, et al. Landelijke Prevalentiemeting Zorgproblemen Rapportage resultaten. 2014.
- Hartholt KA, Velde N van der, Looman CW, et al. Trends in fall-related hospital admissions in older persons in the Netherlands. Arch Intern Med. 2010;170:905-11.
- Kovács E, Sztruhár Jónásné I, Karóczi CK, et al. Effects of a multimodal exercise program on balance, functional mobility and fall risk in older adults with cognitive impairment: a randomized controlled single-blind study. Eur J Phys Rehabil Med. 2013;49(5):639-48. PubMed PMID: 23820879.
- Kovács E, Tóth K, Dénes L, et al. Effects of exercise programs on balance in older women with age-related visual problems: a pilot study. Arch Gerontol Geriatr. 2012;55(2):446-52. doi: 10.1016/j.archger.2012.01.009. PubMed PMID: 22326480.
- Lapane KL, Hughes CM, Daiello LA, et al. Effect of a pharmacist-led multicomponent intervention focusing on the medication monitoring phase to prevent potential adverse drug events in nursing homes. Journal of the American Geriatrics Society. 2011;59(7):123845.
- Mulrow CD, Meghan BG, Kanten D, et al. A randomized trial of physical rehabilitation for very frail nursing home residents. JAMA. 1994;271(7):51924.
- Rosendahl E, Gustafson Y, Nordin E, et al. A randomized controlled trial of fall prevention by a high-intensity functional exercise program for older people living in residential care facilities. Aging Clinical and Experimental Research. 2008;20(1):6775.
- Sanders KM, Stuart AL, Williamson EJ, et al. Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA. 2010;303(18):1815-22. doi: 10.1001/jama.2010.594. Erratum in: JAMA. 2010 Jun 16;303(23):2357. PubMed PMID: 20460620.
- Schnelle JF, Kanika K, Alessi C, et al. Does an exercise and incontinence intervention save healthcare costs in a nursing home population?. Journal of the American Geriatrics Society. 2003;51(2):1618.
- Schoenfelder DP. A fall prevention program for elderly individuals. Exercise in long-term care settings. Journal of Gerontological Nursing. 2000;26(3):4351.
- Teresi JA, Ramirez M, Remler D, et al. Comparative effectiveness of implementing evidence-based education and best practices in nursing homes: effects on falls, quality-of-life and societal costs. Int J Nurs Stud. 2013;50(4):448-63. doi: 10.1016/j.ijnurstu.2011.07.003. PubMed PMID: 21807366.
- Tinetti ME, Kumar C. The patient who falls: Its always a trade-off. JAMA. 2010;303:258-66.
- VeiligheidNL Rapportage Letsels en letselpreventie. Amsterdam: VeiligheidNL. 2013.
- Zermansky AG, Alldred DP, Petty DR, et al. Clinical medication review by a pharmacist of elderly people living in care homes randomised controlled trial. Age and Ageing. 2006;35(6): 58691.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Exercises |
|||||||
|
Cadore, 2014 |
Type of study: Randomized trial
Setting: Institutionalized oldest old patients
Country: Spain
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 16 (11 analysed) Control: 16 (13 analysed)
Important prognostic factors2: Age ± SD: I: 93 (3) C: 90 (1)
Sex: I: 27% M out of 11 C: 23% M out of 13
Groups comparable at baseline? Yes |
Twice-weekly, 12-week multicomponent exercise program composed of upper and lower body resistance training with progressively increased loads that optimized the muscle power output in this population (8–10 repetitions, 40–60 % of 1RM) using resistance variable machines.
A minimum of 2 days elapsed between consecutive training sessions.
All training sessions were carefully supervised by one experienced physical trainer.
The training sessions lasted for approximately 40 min. The approximate duration of each part of the training was 5 min of warm-up, 10 min balance and gait retraining, 20 min of resistance training, and 5 min of stretching. |
Mobility exercises 30 min per day, at 4 days per week, which consisted of small active and passive movements applied as a series of stretches in a rhythmic fashion to the individual joints. These are routinely encouraged in most Spanish nursing homes. |
Length of follow-up: 12 weeks
Loss-to-follow-up: N=8 (25%) Reasons: Five died and three had medical complications
Incomplete outcome data: N=8 (25%) Reasons: Five died and three had medical complications. |
1. Falls Indicated as the incidence of falls, unclear by how many person-years
Rate of falls, incidence Pre-training I: 0.77 (SD 0.44) C: 0.93 (SD 0.3) Post-training I: 0.0 (SD 0.0) C: 0.8 (SD 0.4) P<0.001
2. Fractures Not reported |
Before the exercise intervention, the participants were carefully familiarized with the training procedures.
Data on falls was collected via questionnaires to participants. |
|
Kovács, 2013 |
Type of study: Randomized trial
Setting: Cognitively impaired individuals aged over 60 years in a long-term institute
Country: Hungary
Source of funding: Not stated |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 43 Control: 43
Important prognostic factors2: Age ± SD: I: 76 (10) C: 79 (13)
Sex: I: 17% M C: 21% M
MMSE, mean (SD) I: 20.85 (3.2) C: 20.93 (3.8)
Groups comparable at baseline? Yes |
Multimodal exercise program twice a week for 12 months
Program delivered by two physiotherapists (with extensive experience in geriatric physiotherapy)
Exercise class consisted of a five minutes warm-up period with flexibility exercise of hips, knees and ankles followed by a progressive exercise program including strengthening and balance exercise and ended with cooling down for five minutes |
Usual care
Participation in social activities such as simple board games, viewing pictures or films, listening to music, arts and crafts activities (embroidery, needlework, conversations). |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N=11 (26%) Reasons: 1 thrombosis, 1 femur necrosis, 4 deaths, 1 fracture not related to a fall, 2 moving out, 2 hospitalizations not related to fall
Control: N=13 (30%) Reasons: 1 amputation, 1 hospitalization, 10 deaths, 1 hospitalization
Incomplete outcome data: Intervention: N=11 (26%) Reasons: 1 thrombosis, 1 femur necrosis, 4 deaths, 1 fracture not related to a fall, 2 moving out, 2 hospitalizations not related to fall
Control: N=13 (30%) Reasons: 1 amputation, 1 hospitalization, 10 deaths, 1 hospitalization. |
3. Falls Measured as the number of fallers, n (%) and the rate of falls per 1,000 patient days
Number of fallers, risk ratio I: 16 (50%) C: 20 (67%) RR 0.67 (95%CI: 0.36-1.23)
Number of falls, rate ratio I: 22 C: 29 RR 0.77 (95%CI: 0.34-1.50)
4. Fractures Not reported |
Incidence of falling was assessed with a fall calendar for 12 months. Fall calendar was given to the care persons at baseline who were asked to record each day if participants had fallen, where they had fallen and the had suffered any injuries. |
|
Kovács, 2012 |
Type of study: Randomized trial
Setting: National Institution for Blind People, a residential setting for those living with partial sightedness or blindness
Country: Hungary
Source of funding: Not sponsored |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 21 Control: 20
Important prognostic factors2: Age ± SD: I: 68 (7) C: 69 (7)
Sex: I: 0% M C: 0% M
MMSE, median (IQR) I: 26.5 (25-27)) C: 26 (24-28)
Groups comparable at baseline? Yes, except for sex |
Multimodal exercise program twice a week for 30 min and standard osteoporosis exercise program twice a week
Included balance and strength exercises based on Otago Exercise Program |
Standard osteoporosis exercise program four times a week for 30 min
Based on the guideline of physiotherapy for osteoporotic patients which included general strengthening and flexibility exercises |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: N=0 (0%)
Control: N=0 (0%)
Incomplete outcome data: Intervention: N=0 (0%)
Control: N=0 (0%) |
1. Falls Measured as the number of fallers, n (%)
Number of fallers, risk ratio I: 8 (38%) C: 14 (70%) RR 0.54 (95%CI: 0.29-1.01)
2. Fractures Not reported |
Number of falls in the follow-up period were collected from medical and nursing documentations. |
|
Medication |
|||||||
|
Garcia-Gollarte, 2014 |
Type of study: Randomized trial
Setting: Private organisation of nursing homes
Country: Spain
Source of funding: Not stated |
N total at baseline: Intervention: 30 physicians (n=516 participants) Control: 30 physicians (n=502 participants)
Important prognostic factors2: Age ± SD: I: 84 (15) C: 84 (10)
Sex: I: 26% M C: 28% M
Groups comparable at baseline? Yes |
10 hours structured educational program, followed by on demand support by phone
The program included general aspects of prescription and drug use in geriatric patients, how to reduce the number of drugs, to perform a regular review of medications, to avoid inappropriate drug use, to discontinue drugs that do not show benefits, and to avoid undertreatment with drugs that have shown benefits. |
No intervention or information about an educational intervention |
Length of follow-up: 6 months
Loss-to-follow-up: N = 302 (30%) Reasons: 101 died, 130 discharged from the nursing homes and 71 declined participation or were in need of palliative care
Incomplete outcome data: N = 302 (30%) Reasons: 101 died, 130 discharged from the nursing homes and 71 declined participation or were in need of palliative care |
1. Falls Measured as the number of fallers, n (%)
Number of fallers, risk ratio I: 82 (24) out of 344 C: 104 (28) out of 372 RR 0.85 (95%CI: 0.66 -1.09)
2. Fractures Not reported |
Outcomes were assessed in a random group of residents cared by the physicians involved in the study. Persons older than 65 years, who had been living in the nursing home for at least three months and expected to stay in it for the length of the study, were clinically stable (no changes in prescription in the last 2 months) and accepted that their clinical data were used for the study were included. Residents receiving palliative care or usually cared by other primary care providers outside the nursing home were excluded.
Falls are systematically registered in the clinical records of all the participant nursing homes. |
|
Social intervention |
|||||||
|
Teresi, 2013 |
Type of study: Cluster randomized trial
Setting: Nursing homes
Country: United States of America
Source of funding: Non-commercial |
Exclusion criteria: For nursing homes
N total at baseline: I1: 2255 I2: 2926 C: 2179
Important prognostic factors2: Age ± SD: I1: 81 (11) I2: 82 (10) C: 81 (11)
Sex: I1: 28% M I2: 26% M C: 28% M
Groups comparable at baseline? Yes |
I1: Facilities receiving selected training/implementation modules
I2: Facilities receiving selected training modules in which nursing home surveyors responsible for quality oversight have also received training |
Standard training offered by the facility(ies) |
Length of follow-up: Unknown
Loss-to-follow-up: Unknown
Incomplete outcome data: Unknown |
Measured as the odds on falls per year
I1 vs C: OR 0.85, p=0.0041 I2 vs C: OR 0.91, p=0.0668
Not reported |
Facilities in the control region were randomly selected from among those meeting the eligibility criteria. Experimental facilities were matched to the control facilities based on bedsize, fall status and case mix index. Facilities in the experimental groups were selected at random from among those meeting the matching criteria.
Authors stated: “The percentage of individuals who reported having fallen in the ‘last 180 days’ was somewhat higher (42%) in I2 than in the other groups (35%, 31%) at baseline.” However, it is unclear whether model was adjusted for this baseline difference. |
|
Other |
|
|
|
|
|
|
|
|
Buckinx, 2014 |
Type of study: Randomized controlled trial
Setting: Nursing homes
Country: Belgium
Source of funding: Unclear |
Exclusion criteria:
N total at baseline: Intervention: 31 Control: 31
Important prognostic factors2: Age ± SD: I: 82 (9) C: 84 (7)
Sex: I: 35% M C: 13% M
MMSE, median (IQR) I: 26 (19-28) C: 23 (15-27)
Groups comparable at baseline? No, except for age |
Whole body vibration
Three times per week for six months on a sinusoidal vibration platform
5 series of 15 seconds of vibrations at 30 Hz intensity, 2mm of amplitude, alternating with 30 seconds of rest |
Requested neither to change their lifestyle during the study nor to get involved in any new type of physical activity
|
Length of follow-up: 12 months
Loss-to-follow-up: T0-T6 Intervention: N = 8 (26%) Reasons: 1 died, 3 medical reasons, 2 wrong inclusion, 1 hospitalization, 1 refusal to continue Control: N = 9 (29%) Reasons: 2 died, 4 refusal, 1 moved, 2 physically inability
T6-T12 Intervention: N = 4 (13%) Reasons: 3 physical inability, 1 hospitalization Control: N = 5 (23%) Reasons: 1 died, 1 physical inability, 1 hospitalization, 2 refusals
Incomplete outcome data: T0-T6 Intervention: N = 1 (3%) Reasons: 1 died Control: N = 9 (29%) Reasons: 2 died, 4 refusal, 1 moved, 2 physically inability
T6-T12 Intervention: N = 4 (13%) Reasons: 3 physical inability, 1 hospitalization Control: N = 5 (23%) Reasons: 1 died, 1 physical inability, 1 hospitalization, 2 refusals |
1. Falls Measured as the number of fallers, n (%)
T0-T6 Number of fallers, risk ratio I: 9 (29) C: 9 (29) RR 1.00 (95%CI: 0.46 -2.18)
T6-T12 Number of fallers, risk ratio I: 6 (25) C: 8 (35) RR 0.71 (95%CI: 0.31-1.62)
2. Fractures Not reported
|
Falls were recorded by the nurses in the nursing homes. Nurses completed the fall record with the date, time, and circumstances of the falls. They also noted possible consequences of falls. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Exercises |
||||||||
|
Cadore, 2014 |
“The randomization sequence was generated by http://www.randomization.com […].“ |
Unclear. Stated that interventions were concealed until interventions were assigned, but the manner of concealment was not stated. |
Likely. Patients were not blinded. |
Unclear. Not stated |
Unlikely. “Each specific test was overseen by the same investigator, who was blinded to the training group of the subjects, and was conducted on the same equipment with identical subject/equipment positioning.” |
Unlikely. Sidenote: in the abstract and introduction it was mentioned that the risk of falls would be evaluated; however, only the incidence of falls is reported. |
Unclear. 25% was lost to follow-up; however, it was unclear how many were lost to follow-up in the intervention group and in the control group. |
Unclear; however, assumed that participants were analysed according to assignment. |
|
Kovács, 2013 |
“[…] using a stratified randomization method. Participants were grouped separately within each group using blocked randomization with a block size of four.” |
Unlikely. Consecutively numbered opaque identical sealed envelopes were used for allocation. |
Likely. Patients were not blinded. |
Likely. Patients were not blinded. |
Unlikely. […], assessor blind trial […]. |
Unlikely. Outcomes mentioned in the methods section were reported in the results section. |
Unlikely. Lost to follow-up in this elderly population was less than 40% with a slight discrepancy in the number of deaths in intervention and control group. |
Likely. Data was analysed per protocol. |
|
Kovács, 2012 |
“After baseline assessment eligible participants were randomly assigned to Group I or Group II. Blocked randomization was performed (with a block size of 4) using consecutively numbered opaquely identical sealed envelopes. The envelopes were prepared by |
Unlikely. Consecutively numbered opaque identical sealed envelopes were used for allocation. |
Likely. Patients were not blinded. |
Likely. Patients were not blinded. |
Unlikely. […], assessor blind trial […]. |
Unlikely. Outcomes mentioned in the methods section were reported in the results section. |
Unlikely. None were lost to follow-up. |
Unlikely. Data was analysed as per assigned intervention. |
|
Medication |
||||||||
|
Garcia-Gollarte, 2014 |
“Randomization was done using random number tables […].” |
Unclear. Manner of allocation concealment not stated |
Unclear. Although physicians were blinded, it is unclear whether residents were made aware of the intervention. |
Unlikely. Physicians in both groups were informed that there was a company program aimed to improve drug prescription but were blinded to the fact that the educational intervention was being assessed. |
Unclear. Falls were registered systemtatically in clinical records, but it is unclear by whom. |
Unlikely. Outcomes mentioned in the methods section were reported in the results section. |
Unclear. 30% lost to follow-up, but reasons were not separately reported for the intervention and control group. |
Unlikely. Assumed residents were analysed according to assignment. |
|
Social intervention |
||||||||
|
Teresi, 2013 |
“The design was a variant of a cluster randomized trial […].” |
Unclear. Manner of allocation concealment not stated |
Unclear. Not statement about blinding |
Unclear. Not statement about blinding |
Unclear. Not statement about blinding |
Unlikely. Outcomes mentioned in the methods section were reported in the results section. |
Unclear. Lost to follow-up not stated |
Unlikely. Residents were analysed according to assigned intervention. |
|
Other |
||||||||
|
Buckinx, 2014 |
“We performed the randomization by blocks of four with a computer generated randomization procedure.” |
Unclear. Manner of allocation concealment not stated |
Likely. Patients were not blinded. |
Likely. Patients were not blinded. |
Unlikely. “The outcomes were blindly assessed.” |
Unlikely. Outcomes mentioned in the methods section were reported in the results section. |
Unclear. Although a large proportion of included participants were lost to follow-up, reasons for lost to follow-up are slightly different. Number were too few to deduce whether this could have influenced the results. |
Unlikely. “Intention-to-treat analyses were performed.” |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Abdelbari, 2012 |
Ziekenhuispatiënten en geen vergelijkende groep |
|
Allen, 2012 |
Review |
|
Balzer, 2012 |
Review |
|
Batchelor, 2013 |
Review |
|
Beaudart, 2013 |
Zelfde populatie als Buckinx, 2014 maar met kortere follow-up |
|
Booth, 2015 |
Review |
|
Bösner, 2012 |
Geen adequate randomisatie methode toegepast |
|
Buckinx, 2014 |
Zelfde als Buckinx, 2014 |
|
Burland, 2013 |
Niet gerandomiseerd onderzoek |
|
Calder, 2013 |
Relevante uitkomstmaten niet gerapporteerd |
|
Chunhu, 2014 |
Beschrijving van de Cochrane review van Cameron, 2012 |
|
Da Costa-Dias, 2014 |
Betreft de beschrijving van de risk assessment tools waaronder STRATIFY |
|
Drahota, 2013 |
Ziekenhuispatiënten |
|
Duffy, 2013 |
Narratieve review |
|
Ebihara, 2013 |
Letter to the editor |
|
Gasparotto, 2012 |
Mening en ideeën over vallen van patiënten |
|
Ghezeljeh, 2014 |
Geen vergelijkende groep |
|
Gill, 2013 |
Geen vergelijkende groep |
|
Guo, 2014 |
Review |
|
Hill, 2012 |
Review |
|
Houghton, 2014 |
Conference abstract |
|
Jung, 2014 |
Ontwikkeling van een richtlijn |
|
Juola, 2014 |
Conference abstract |
|
Kang, 2014 |
Uitkomstmaat: Assessment van het val risico volgens de Tetrax fall index |
|
Kopke, 2012 |
Gevonden in review van Cameron, 2012 en geëxcludeerd (geen interventie gericht op valpreventie) |
|
Kosse, 2013 |
Review |
|
Kuczynski, 2014 |
Geen vergelijkende groep |
|
Lach, 2013 |
Review |
|
Lang, 2014 |
Review |
|
Lee, 2012 |
Geen gerandomiseerd onderzoek naar interventie ter preventie van vallen |
|
Marsh, 2014 |
Conference abstract |
|
Neyens, 2013 |
Niet gerandomiseerd |
|
Nitz, 2012 |
Geen vergelijkende groep |
|
Pichierri, 2012 |
Geen relevante uitkomstmaten gerapporteerd |
|
Said, 2012 |
Patiënten opgenomen op een revalidatie afdeling |
|
Sakamoto, 2012 |
Al geïncludeerd in review |
|
Saravanakumar, 2014 |
Uitkomstmaat wordt niet helder gerapporteerd |
|
Shakeel, 2015 |
Review |
|
Silva, 2013 |
Review |
|
Sitja-Rabert, 2012 |
Review |
|
Sitja-Rabert, 2015 |
Studieprotocol |
|
Streim, 2012 |
Conference abstract |
|
Stubbs, 2015 |
Review |
|
Vieira, 2013 |
Cohortstudie |
|
Vlaeyen. 2015 |
Review |
|
Voigt-Radloff, 2012 |
Review |
|
Yokoi, 2015 |
Te zelfstandige populatie (mobiel zonder hulpmiddel) die niet overeenkomt met de Nederlandse verpleeghuisbewoners |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 31-03-2017
Beoordeeld op geldigheid : 01-02-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel in stand gehouden. Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Vereniging voor Klinische Geriatrie of de modules van deze richtlijn nog actueel zijn, behalve de module over het beoordelen van valrisicoverhogende medicatie. De actualiteit van deze module dient uiterlijk 2019 te worden beoordeeld, vanwege de verwachting dat een tegen die tijd gepubliceerde systematische review over valrisicoverhogende medicatie de aanbevelingen kan aanscherpen. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Klinische Geriatrie is regiehouder van deze richtlijnen eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het expliciteren van goed medisch handelen. De doelstelling is het ontwikkelen van een multidisciplinaire evidence-based richtlijn gericht op de secundaire en tertiaire preventie van valincidenten bij ouderen vanaf 65 jaar, toepasbaar in thuissituatie (zelfstandig wonende ouderen), verzorgingshuis, verpleeghuis en ziekenhuis.
Doelgroep
De gebruikers van de richtlijn zijn alle zorgverleners die met een oudere patiënt met een verhoogd valrisico te maken krijgen. Hierbij kan worden gedacht aan hulpverleners in de drie volgende omgevingen:
- thuissituatie (zelfstandig wonende ouderen);
- verzorgings- en verpleeghuis;
- ziekenhuis.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij valpreventie van ouderen van 65 jaar of ouder.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. N. (Nathalie) van der Velde, geriater en internist-ouderengeneeskunde, AMC Amsterdam, NVKG, (voorzitter)
- Dr. Y. (Yvonne) Schoon, geriater, RadboudUMC, Nijmegen, NVKG
- Dr. M.H. (Mariëlle) Emmelot-Vonk, geriater, UMCU Utrecht, NVKG
- Prof. dr. A.B. (Andrea) Maier, internist-ouderengeneeskunde, VUmc, Amsterdam, (tot januari 2016), NIV
- Drs. H.H.M. (Harianne) Hegge, internist-ouderengeneeskunde, UMCG, Groningen, (vanaf januari 2016), NIV
- Dr. J.H.W. (Joost) Rutten, internist-vasculair geneeskundig, RadboudUMC, Nijmegen, NIV
- Prof. dr. J.G. (Gert) van Dijk, neuroloog, LUMC, Leiden, NVN
- Dr. A.J.J. (Arnaud) Aerts, cardioloog, Stichting Zuyderland Medisch Centrum, Sittard-Geleen/Heerlen, NVVC
Klankbordgroep:
- Dr. E. (Ellen) Smulders, wetenschappelijk onderzoeker, RadboudUMC, Nijmegen, KNGF
- M. (Myrthe) Pruijn, ergotherapeut, Slotervaartziekenhuis, Amsterdam, EN
- M. (Miran) van Eijk, verpleegkundig specialist, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, V&VN
- R. (Rinie) Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
- C. (Charlotte) Scherphof, beleidsmedewerker, Patiëntenfederatie Nederland (tot september 2016)
- W. (Willem) Vos, huisarts, huisartsenpraktijk W. Vos, NHG (tot maart 2016)
- C.S. (Corrie) Jongsma, huisarts, W.J.M. Brunninkhuis en C.S. Jongsma, huisartsen, Drachten, NHG (vanaf april 2016)
- Prof. dr. W. (Willem) Lems, reumatoloog, VUmc, Amsterdam, NVR
- M. (Marion) de Rooi, MSc, SEH-arts KNMG, Zaans Medisch Centrum, Zaandam, NVSHA
- Drs. A. (Anneke) van Strien- van Merkestein, specialist ouderengeneeskunde, Saffier de Residentie groep, Den Haag, Verenso
Met ondersteuning van:
- Dr. B.H. (Bernardine) Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
- Drs. E.E. (Eva) Volmeijer, adviseur, Kennisinstituut van Medisch Specialisten
- A.A. (Toon) Lamberts, MSc, beleidsadviseur, NVKG
- M. (Monique) Wessels, MSc, medisch informatiespecialist, Kennisinstituut van Medisch Specalisten
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Met dank aan:
- Dr. G. (Geeske) Peters, (senior) research fellow, Global Brain Health Institute, Brisbane Australië
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van der Velde |
Geriater en internist-ouderengeneeskunde |
Postdoc geriatrie Erasmus MC (onbetaald) werkgroeplid werkgroep wetenschap (onbetaald) Lid sectie NIV ouderengeneeskunde (vacatiegelden) Voorzitter SIG valnetwerk NVKG (onbetaald) Werkgroeplid EUGMS SIG falls fractive preventies (onbetaald) Voorzitter EU werkgroep “knowledge dissmination on fall-risk-increasing drugs (onbetaald) |
B-PROOF-NED ZonMW-effect. Genetische variatie op medicatie gerelateerd vallen Amsterdams Universitair Fonds: 'Val me Bij'project (kennisdissiminatie valrisicoverhogende medicatie) 'Gepersonaliseerde medicatieaanpassing bij oudere vallers' ZonMW 'SeniorStap' (medeaanvrager) RAAK: 'Bewegingsregistratie en Analyse voor Valrisicoschatting bij Ouderen' (medeaanvrager) |
Geen actie (valt buiten de afbakening van de richtlijn) |
|
Schoon |
Geriater |
Voorzitter regionaal valpreventie Netwerk Nijmegen |
Projectleider KWF beleidsprojecten |
Geen actie (vallen buiten de afbakening van de richtlijn) |
|
Emmelot-Vonk |
Geriater |
Bestuurslid stichting IWO (interdisciplinaire werkgroep osteoporose) (onkostenvergoeding). Voorzitter werkgroep wetenschap NVKG (onbetaald). Werkgroeplid SIG valnetwerk NVKG (onbetaald). Werkgroeplid EUGMS SIG Falls and fractures prevention (onbetaald). Full board member EUGMS (onbetaald). Lid werkgroep richtlijnen NVKG (onbetaald). |
- |
Geen actie |
|
Maier |
Internist-ouderengeneeskunde |
Bestuur Vilans |
Onderzoek met Nutricia sacropenie; onderzoek naar myalgie (FP7-project) |
Geen actie (vallen buiten de afbakening van de richtlijn) |
|
Hegge |
Geriater en internist-ouderengeneeskunde |
- |
- |
Geen actie |
|
Rutten |
Internist-vasculair geneeskundige |
- |
- |
Geen actie |
|
Van Dijk |
Neuroloog |
Voorzitter werkgroep Syncope |
- |
Geen actie |
|
Aerts |
Cardioloog |
Lid richtlijnenforum commissie kwaliteit NVVC Lid werkgroep Syncope |
Carelink studie stichting Epilepsie Instellingen Nederland |
Geen actie (valt buiten de afbakening van het de richtlijn) |
|
Smulders |
Hoofddocent Master Geriatric Physical Therapy Avans+ Wetenschappelijk onderzoeker Radboud UMC afdeling revalidatie |
Cursusleider en docent Paramedisch instituut (betaald)
|
- |
Geen actie |
|
Pruijn |
Ergotherapeut |
- |
- |
Geen actie |
|
Van Eijk |
Verpleegkundig specialist |
Gastdocent Radboud Zorgacademie (betaald) |
- |
Geen actie |
|
Lammers |
Beleidsmedewerker |
- |
- |
Geen actie |
|
Scherphof |
Beleidsmedewerker |
- |
- |
Geen actie |
|
Vos |
Huisarts |
- |
- |
Geen actie |
|
Jongsma |
Huisarts |
Bestuur Laego (betaald) |
- |
Geen actie |
|
Lems |
Reumatoloog |
Adviesraden (betaald) :MSD, Amgen, Eli Lilly, Takeda, Will Pharma, Pfizer, Servier, Novartis, Roche. Wetenschappelijk secretaris NV Reumatologie Hoofdredacteur tijdschrift reumatologie. |
- |
Geen actie (betreft advies over reumamedicatie of ostoeporose medicatie ) |
|
De Rooi |
SEH-arts KNMG |
- |
- |
Geen actie |
|
Van Strien-van Merkestein |
Specialist ouderengeneeskunde |
- |
- |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland in de klankbordgroep op te nemen. Daarnaast is gebruik gemaakt van informatie uit kwalitatieve studies (compliantie en patiëntenpreferenties) die naar voren zijn gekomen door het zoekfilter patiëntenperspectief toe te passen. Tot slot is gebruik gemaakt van regionaal verkregen patientenfocusgroep informatie (regio Nijmegen).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn “Richtlijn Preventie van valincidenten bij ouderen” NVKG 2004 op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door Ergotherapie, KNGF, KNMP, NHG, NIV, NVKG, NVSHA, NVZ, NVZA, V&VN, VeiligheidNL, Verenso en Zorginstituut Nederland via invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|||||||||||||||||||||||||||||||||||||||
|
Medline (OVID) Aug. 2015 |
1 Accidental Falls/ (16942) 2 (falls or faller$1).tw. (32735) 3 1 or 2 (40806) 4 exp Aged/ (2494674) 5 (senior? or elderly or older).tw. (468589) 6 4 or 5 (2694517) 7 3 and 6 (17530) 8 limit 7 to yr="2012 -Current" (4769) 9 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial or comparative study).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2576065) 10 8 and 9 (1304) – 1190 uniek |
2923 |
|||||||||||||||||||||||||||||||||||||||
|
Embase (Elsevier) |
'falling'/exp OR falls:ab,ti OR fallers:ab,ti AND ('aged'/exp OR elderly:ab,ti OR senior*:ab,ti OR older:ab,ti) AND [2012-2015]/py AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR 'comparative study'/exp OR placebo*:ab,ti) NOT 'conference abstract':it AND [embase]/lim (1142) - 699 uniek |
||||||||||||||||||||||||||||||||||||||||
|
Cochrane (Wiley) |
#1 MeSH descriptor: [Accidental Falls] explode all trees #2 ("falls" or "faller*"):ti,ab #3 #1 or #2 #4 MeSH descriptor: [Aged] explode all trees #5 ("older" or "senior*" or "elderly"):ti,ab #6 #4 or #5 #7 #3 and #6 Publication Year from 2012 to 2015 (395) – 89 uniek |
||||||||||||||||||||||||||||||||||||||||
|
Cinahl |
|
