Doelgericht vochtbeleid (normovolemie)
Uitgangsvraag
Wat is het effect van doelgericht vochtbeleid (normovolemie) bij volwassen patiënten die chirurgische ingrepen ondergaan op de preventie van postoperatieve wondinfecties?
Aanbeveling
Pas doelgericht vochtbeleid toe bij patiënten in een perioperatief traject ter preventie van postoperatieve wondinfecties. Doelgericht vochtbeleid is op meerdere gelijkwaardige manieren (invasief en non-invasief) te meten en uit te voeren.
Indien er geen algemene hoog-risico indicatie is voor niet invasieve monitoring of dit niet mogelijk is (vanwege bijvoorbeeld type operatie, anesthesietechniek en/of patiënten karakteristieken) dan is het toepassen van invasieve monitoring voor doelgericht vochtbeleid met als enige doel preventie van postoperatieve wondinfecties niet geïndiceerd.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De systematische literatuur analyse en meta-analyse van Jalalzadeh (2024, ongepubliceerd) onderzocht het effect van doelgericht vochtbeleid op het ontstaan van postoperatieve wondinfecties (POWI) in patiënten die chirurgie ondergaan. Er werd bewijs met redelijke GRADE gevonden dat het risico op POWI vermindert met het gebruik van doelgericht vochtbeleid protocol, in vergelijking met geen specifiek vochtbeleid (RR 0.68; 95%CI 0.60 - 0.79). Het gunstige effect werd ook gezien voor de uitkomsten pneumonie (RR 0.79; 95% CI 0.68 - 0.93), urineweginfectie (RR 0.72; 95%CI 0.53 - 0.97), en het aantal patiënten met één of meer complicaties (RR 0.81; 95%CI 0.73 - 0.89).
Het gunstige effect wordt gezien bij gastro-intestinale en niet-gastro-intestinale chirurgie. Ook bij schone versus gecontamineerde chirurgie wordt er een gunstig effect gezien van een doelgericht vochtbeleid protocol, hoewel dit effect wel groter lijkt bij schone chirurgie.
Doelgericht vochtbeleid is op meerdere manieren (invasief en non-invasief) te meten en uit te voeren. Er lijkt geen verschil in uitkomsten te zijn tussen invasieve en non-invasieve methoden.
De geïncludeerde studies lieten een hoge heterogeniteit zien van patiëntenpopulatie en behandelingsalgoritmen zoals beschreven in het 5T raamwerk (Saugel), dat de nadruk legt op (T1) adequate doelpopulatie, (T2) timing van de interventie, (T3) type interventie, (T4) doelvariabele, en (T5) doelwaarde. In de meta-regressie analyse, waarin de individuele componenten in de studies zijn onderzocht, werd geen sterk statistisch bewijs gevonden dat elk van de losse componenten significant effectief is. Er is geen bewijs dat doelgericht vochtbeleid niet effectief zou zijn bij populaties met een laag risico volgens ASA-classificatie of CDC-wondclassificatie. Ook ontbreekt het bewijs dat de effecten van doelgericht vochtbeleid beperkt zijn tot gastro-intestinale chirurgie of cardiothoracale chirurgie.
De toename in de grootte van het effect dat werd waargenomen bij elke T die werd aangehouden, suggereert dat dit wel kan helpen bij het sturen van een goed algoritme van het doelgerichte vochtbeleid.
Echter, het hebben van een algoritme voor doelgericht vochtbeleid is niet voldoende om verbetering in klinische uitkomsten te krijgen. Er is ook kennis en training nodig om doelgericht vochtbeleid toe te kunnen passen.
Internationale richtlijnen
De WHO adviseert het gebruik van intra-operatieve doelgerichte normovolemie om het risico op POWI te verminderen. De NICE richtlijn van het Verenigd Koninkrijk adviseert “Overweeg cardiale output monitoring voor grote of complexe operaties of operaties met een hoog risico om complicaties te verminderen”. De Amerikaanse CDC richtlijn heeft geen aanbeveling omtrent het gebruik van doelgerichte normovolemie.
Waarden en voorkeuren van patiënten
Er zijn geen voorkeuren van patiënten met betrekking tot het gebruik van doelgericht vochtbeleid op patiënt gerelateerde uitkomsten. Het inbrengen van een arterielijn kan door de patiënt als hinderlijk worden ervaren.
Kosten
Er zijn geen studies gevonden die de kosteneffectiviteit van doelgerichte chirurgie hebben onderzocht op POWI. POWI is echter een dure complicatie en het voorkomen van POWI draagt bij aan de kostenreductie.
Aanvaardbaarheid, haalbaarheid en implementatie
Doelgericht vochtbeleid is een interventie die nog niet breed wordt toegepast, en veel ziekenhuizen hebben niet de juiste apparatuur. De aanschafprijs en onderhoud van de apparaten kunnen en belemmering zijn voor de haalbaarheid implementatie. Voor de toepassing van doelgerichte vochtbeleid is het ook van belang dat de uitvoerder op de hoogte is van het protocol en de besturing/interpretatie van het protocol. Hiervoor zal training en onderwijs verzorgd moeten worden.
Bij niet alle patiënten en ingrepen is een arterielijn geïndiceerd en aangesloten. Dan kan er overwogen worden om een niet-invasieve methode van doelgericht vochtbeleid toe te passen. Indien een patiënt wel een arterielijn heeft of krijgt kan er een invasieve methode van doelgericht vochtbeleid worden gekozen.
De werkgroep doet geen aanbeveling voor een specifiek protocol van doelgericht vochtbeleid. Enkele instellingen hebben lokale protocollen voor doelgericht vochtbeleid.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er is een gunstig effect van de toepassing van een doelgerichte vochtbeleid protocol ten opzichte van geen specifiek vochtbeleid protocol bij de preventie van POWI bij chirurgische patiënten. Er wordt geen verschil in effect gezien in patiënten met hoge of lage ASA-classificaties, typen wondclassificaties, of typen chirurgie.
Voor protocollen omtrent doelgericht vochtbeleid verwijst de werkgroep naar lokale instellingsprotocollen. Voor de effectiviteit en de uitvoering van doelgericht vochtbeleid bij hoog risico patiënten verwijst de werkgroep naar de richtlijn Perioperative Goal Directed Therapy (PGDT).
Onderbouwing
Achtergrond
Postoperatieve wondinfecties (POWI) zijn een van de meest voorkomende zorg-gerelateerde infecties en een zeer relevante oorzaak van postoperatieve morbiditeit en mortaliteit. De groei van het aantal patiënten dat chirurgische ingrepen ondergaat en het toenemende aantal patiënten met comorbiditeit met een hoog risico op POWI onderstreept de noodzaak voor de preventie van POWI.
Adequate oxygenatie van het weefsel is essentieel voor wondgenezing, en omgekeerd is perioperatieve weefselhypoxie gerelateerd aan slechte uitkomsten voor de patiënt. Omdat zowel hypervolemie als hypovolemie leiden tot verminderde weefseloxygenatie, is perioperatief vocht beleid cruciaal om adequate weefseloxygenatie te bereiken. Conventioneel vochtbeleid wordt uitgevoerd door de anesthesist op basis van klinische beoordeling en hemodynamische metingen, die mogelijk niet adequaat de veranderingen in het intravasculaire volume weergeven. Zowel hypovolemie als hypervolemie blijven veelvoorkomend bij chirurgische patiënten. Algoritmen voor doelgerichte vochttherapie (Goal Directed Fluid Therapy; GDFT) zijn ontwikkeld om het vochtbeleid te standaardiseren en optimaliseren, waarbij specifieke hemodynamische streefwaarden sturend zijn voor de intraveneuze vloeistof, vasopressor en inotrope medicatie toediening.
Conclusies / Summary of Findings
Surgical site infections
|
Hoge GRADE |
Peroperatief doelgericht vochtbeleid vermindert het aantal postoperatieve wondinfecties in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Mortaliteit
|
Redelijke GRADE |
Peroperatief doelgericht vochtbeleid resulteert waarschijnlijk niet in een vermindering van mortaliteit in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Sepsis
|
Redelijke GRADE |
Peroperatief doelgericht vochtbeleid resulteert waarschijnlijk niet in een vermindering van sepsis in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Pneumonie
|
Hoge GRADE |
Peroperatief doelgericht vochtbeleid vermindert het aantal pneumoniën in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Urineweginfectie
|
Hoge GRADE |
Peroperatief doelgericht vochtbeleid lijkt het aantal urineweginfecties te verminderen in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Acute nierinsufficiëntie
|
Lage GRADE |
Peroperatief doelgericht vochtbeleid lijkt het aantal acute nierinsufficiëntie te verminderen in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Paralytische ileus
|
Redelijke GRADE |
Peroperatief doelgericht vochtbeleid vermindert waarschijnlijk het aantal paralytische ileus in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Reoperatie
|
Redelijke GRADE |
Peroperatief doelgericht vochtbeleid resulteert waarschijnlijk niet of nauwelijks in een vermindering van het aantal reoperaties in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Aantal patiënten met één of meer complicaties
|
Redelijke GRADE |
Peroperatief doelgericht vochtbeleid vermindert waarschijnlijk het aantal patiënten met één of meer complicaties in vergelijking met geen specifiek vochtbeleid protocol bij patiënten die een operatie ondergaan.
Bron: Jalalzadeh (2024, unpublished) |
Samenvatting literatuur
Description of studies
Study characteristics of the included studies can be found in the Study characteristics. Multiple haemodynamic monitoring devices were used to perform GDFT, and the haemodynamic management goals and protocols varied greatly between studies. Most studies used one or more of the following variables: stroke volume (SV), stroke volume variation (SVV), pulse pressure variation (PPV), cardiac index (CI) and mean arterial pressure (MAP).
Of the 68 included studies, used a haemodynamic monitoring device connected to an arterial line to monitor the haemodynamic goals. Fourteen studies used an oesophageal Doppler, six studies used a non-invasive haemodynamic monitoring sensor, two studies used a device connected to a central venous line, one used blood sampling, one used the pulse variability index, one used a non-invasive cardiac output monitor, and one study used the cardiopulmonary bypass device.
Ten of the studies started with GDFT before the induction of anaesthesia.
In 52 studies, GDFT was ceased at the end of the surgery, and in the remaining 16 studies, GDFT was continued between 1 one and 24 hours postoperatively.
Results
The results of the primary outcome, subgroup and sensitivity analyses are summarized in table 1.
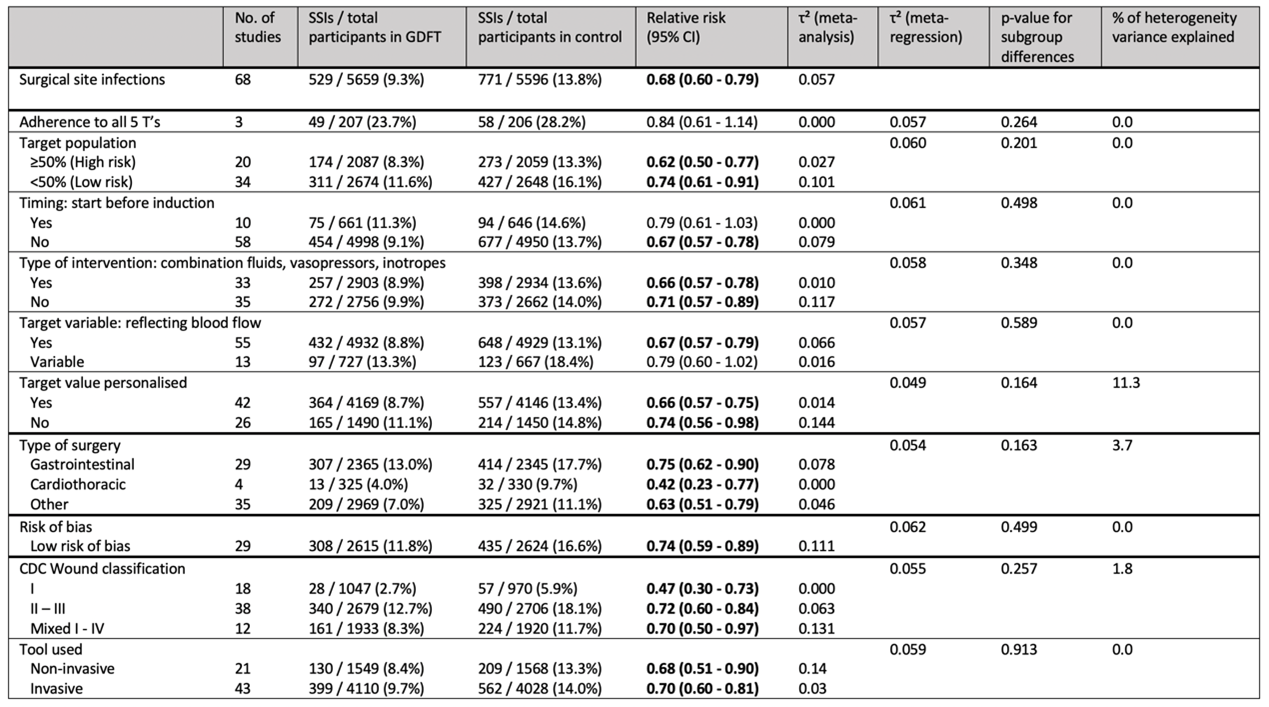
Table 1. Meta-analysis of primary, secondary and subgroup analyses incidence of surgical site infection associated with goal-directed fluid therapy
Surgical site infections (critical)
Surgical site infections were reported in 68 trials, retrieved from the systematic review (Jalalzadeh 2023, unpublished).
A total of 11.255 patients were included in the systematic review. Meta-analysis indicated that the incidence of SSI was reduced from 13.8% in the control group to 9.3% in the intervention group resulting in a RR of 0.68 (95% CI 0.60 - 0.79). Heterogeneity between studies was moderate (τ2 = 0.0573, p = 0.049, I2 = 23.7%). The result of the primary outcome is shown in Table 1 and Figure 2.
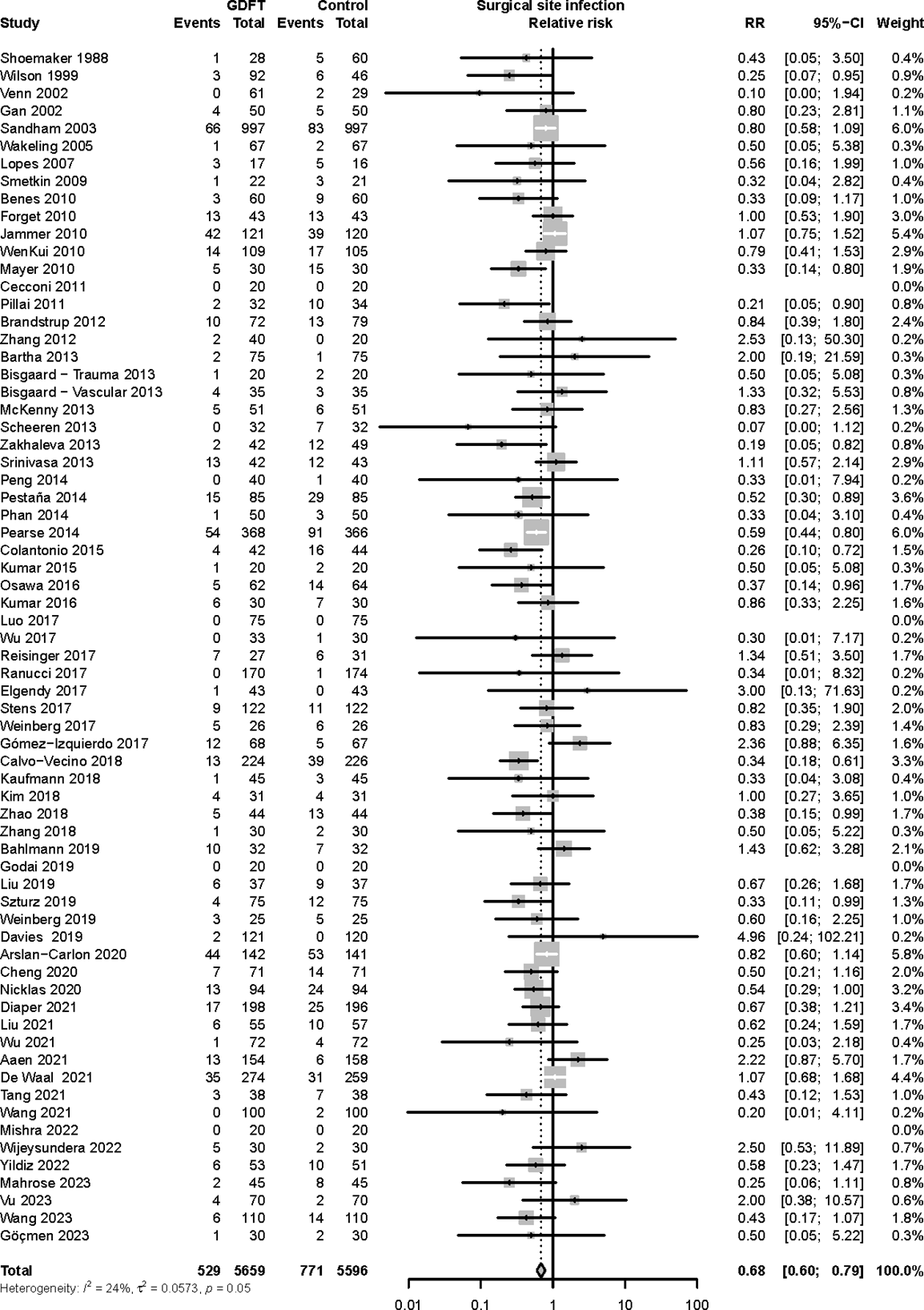
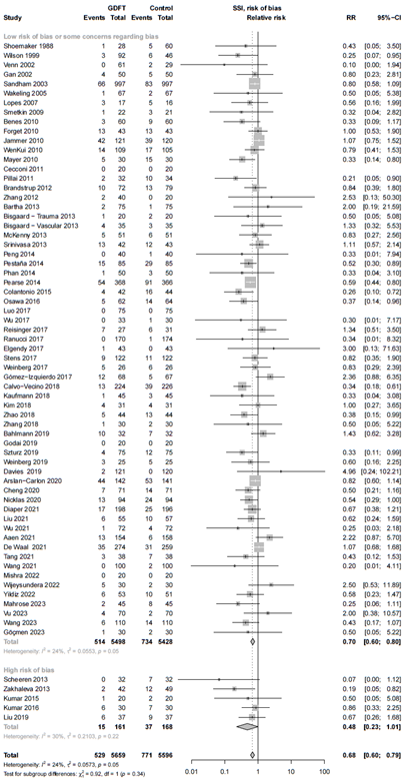
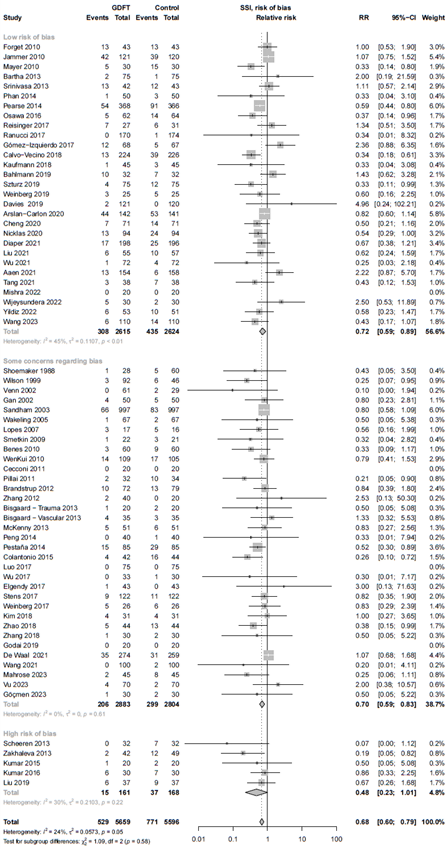
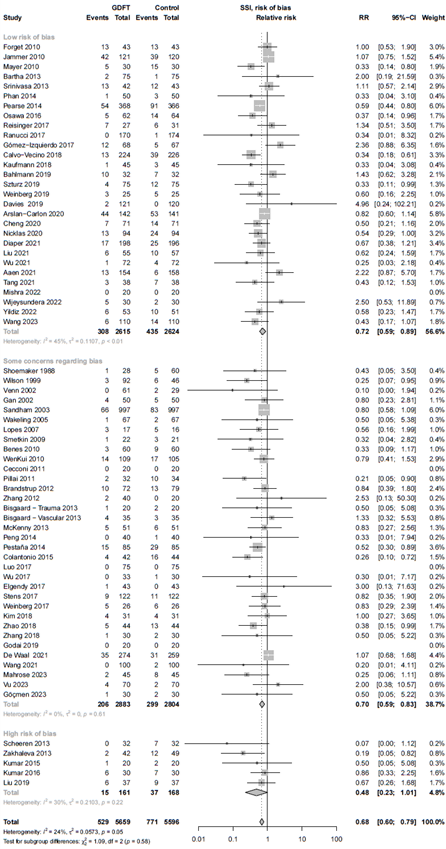
Figure 1. Forest plot showing the comparison between goal-directed fluid therapy versus no specific fluid management protocol for surgical site infections. Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; CI: confidence interval.
Secondary outcomes
The results of the secondary outcomes are summarized in table 2. For outcomes pneumonia, urinary tract infection and number of patients with ≥1 complication showed a significant benefit for goal-directed fluid therapy. The forest plots of the secondary outcomes can be found in Forest plots of secondary outcomes.

Table 2. Results of meta-analysis of the secondary outcomes.
Subgroup and sensitivity analyses
5T’s
To explore heterogeneity, we performed random effects meta-regression and subgroup analyses according to the “5 T’s of perioperative goal-directed haemodynamic therapy” by Saugel and colleagues. We defined the high risk target population as studies with ≥50% of patients classified as ASA 3 or higher, adequate timing as GDFT algorithms initiated before induction of anaesthesia, adequate type of GDFT algorithm as algorithms incorporating both fluids, vasopressors and inotropes, adequate target variables as variables reflecting blood flow (stroke volume (SV), stroke volume index (SVI), cardiac output (CO), cardiac index (CI), or oxygen delivery (dO2)) and adequate target values as personalised target values. We performed meta-regression and subgroup analyses for each T and the total number of T’s adhered to, and calculated the proportion of heterogeneity variance explained for each subgroup (τ² main analysis - τ² meta regression) / τ² main analysis).
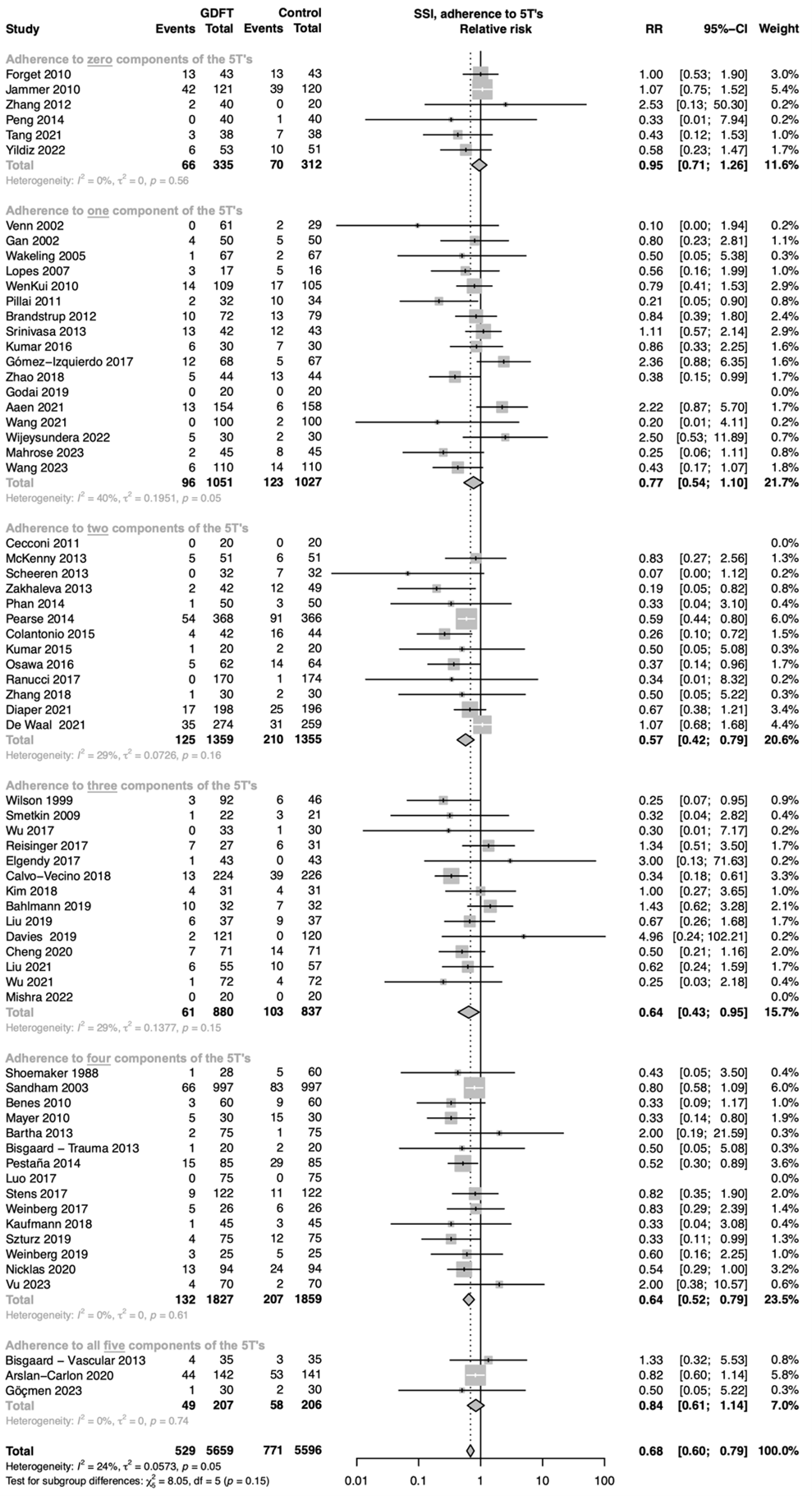
In the subgroup analysis of adherence to the 5 T’s of Saugel et al., only three studies complied with all five components of the proposed framework. Meta-regressions indicated that every additional component complied to led to a 5-point increase in relative risk reduction, but the confidence interval was wide and included no effect (ß -0.05; 95% CI -0.14 – +0.04). Meta regression of each of the separate components indicated no strong evidence for an association with the effect size for any of individual component. (Sub-analysis: 5T’s)
Risk of bias
The sensitivity analysis of the 29 studies with low risk of bias showed an RR of 0.74 (95% CI 0.59 - 0.89; Sub-analysis: risk of bias).
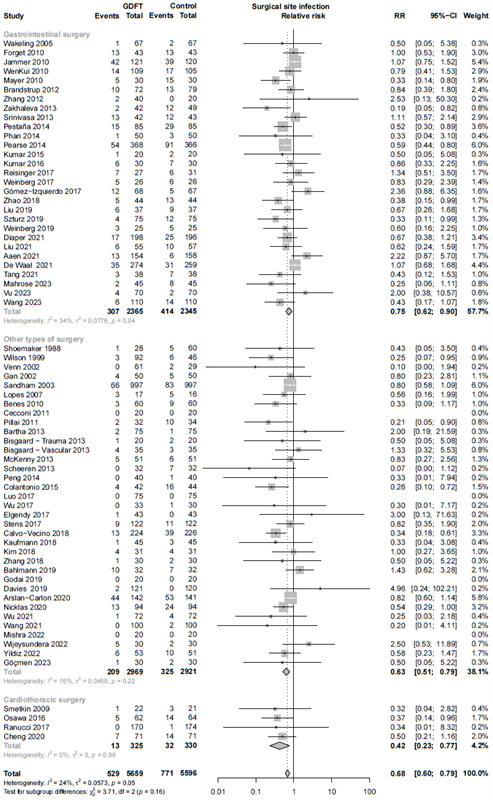
Type of surgery
We explored three types of surgery; gastrointestinal, cardiothoracic, and other types of surgery. We found an RR of 0.75 (95% CI 0.62 – 0.90) for gastrointestinal surgery, an RR of 0.42 (0.23 - 0.77) for cardiothoracic surgery, and an RR of 0.63 (0.51 - 0.79) for other types of surgery. ( Sub-analysis: Type of surgery)
Wound contamination level (CDC classification)
We also performed subgroup analysis based on wound contamination according to the CDC classification (clean, clean-contaminated, contaminated, and dirty) because of their differences in baseline event rate, and type of surgery (gastrointestinal, cardiothoracic and other) because of the differences in haemodynamic consequences.
In 18 studies only clean surgeries (CDC class 1) were included, with an RR of 0.47 (0.30 - 0.73). Thirty-eight studies investigated clean-contaminated (CDC class 2) or contaminated surgeries (CDC class 3), totaling to an RR of 0.72 (0.60 - 0.84). (Sub-analysis: Level of wound contamination)
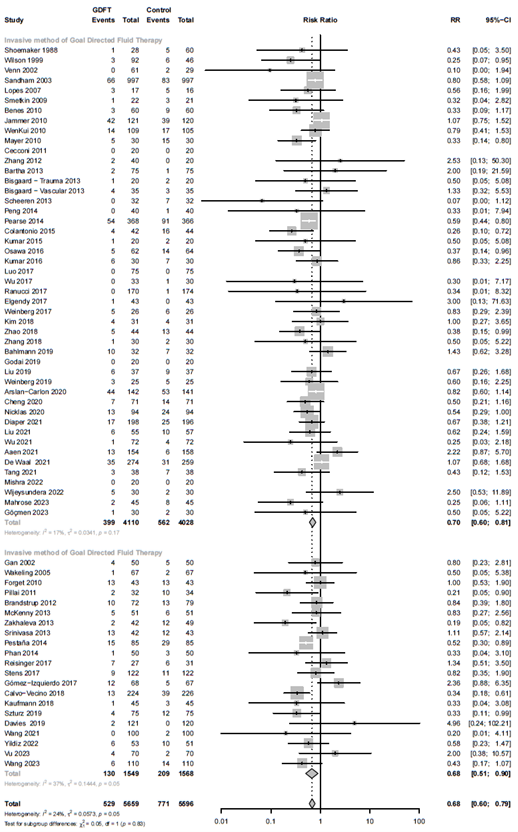
Invasive vs non-invasive tools
We found no difference in results when using invasive (RR 0.70; 95% CI 0.60 - 0.81) or non-invasive (RR 0.68; 95% CI 0.51 - 0.90) tools of measuring (τ2 = 0.059, p-value for subgroup differences = 0.913, 0% of heterogeneity variance explained). (Sub-analysis: invasive vs. non-invasive)
Trial Sequential Analysis
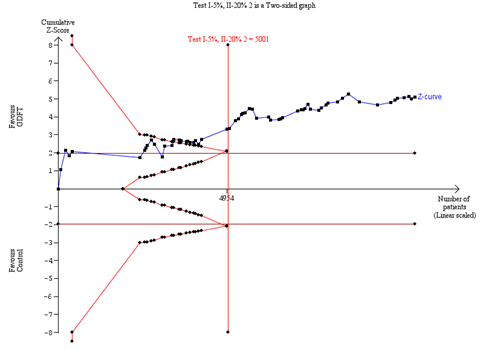
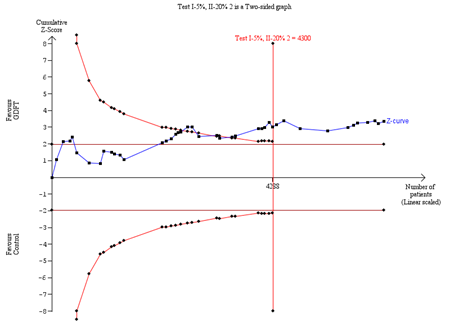
We conducted a trial sequential analysis (TSA) to assess the reliability and robustness of the primary outcome. Diversity-adjusted information size and estimated trial sequential monitoring boundaries were based on a type I error of 5%, a power of 80%, a relative risk reduction of 25% and an SSI risk in the control group of 13.9% as found in the meta-analysis. We carried out a TSA sensitivity analysis limited to low risk of bias studies, with an SSI risk of 16.7% in the control group. When the cumulative Z-curve crosses into the trial sequential monitoring boundary, further data collection is unlikely to change the effect estimate.
TSA showed that the cumulative Z-curve crossed the trial sequential monitoring boundary for benefit (Fig. 3A), indicating that sufficient evidence exists for a 25% relative risk reduction in SSI. This was substantiated in a sensitivity analysis for low risk of bias studies. (Trial sequential analysis)
Level of evidence of the literature
Surgical site infections (critical)
The result of the GRADE assessment is shown in Table 3. The starting certainty of evidence was high as all included studies were RCT’s, however, the certainty of evidence was downgraded to moderate. Although there was some risk of bias (Elaborate risk of bias assessment), the sensitivity analysis results were comparable with the main analysis (Sub-analysis: risk of bias), and we decided not to downgrade for risk of bias.
We did not downgrade for inconsistency as despite clinical heterogeneity between protocols of GDFT used in the different trials there was no unexplained heterogeneity. There was no indirectness as all included studies investigated the same patients (patients undergoing surgery), intervention (GDFT), comparison (no specific fluid management protocol) and outcome (SSI). There was no imprecision as appreciable harm was excluded from the 95% confidence interval, and the optimal information size was met (1388 patients per arm). The contour-enhanced comparison-adjusted funnel plot showed no asymmetry, indicating no publication bias (Comparison-adjusted funnel plot).

Table 3. GRADE assessment for all outcomes
Forest plots of secondary outcomes
4A. Mortality
Relative risk of mortality in studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.

4B. Sepsis
Relative risk of the incidence of sepsis in studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.

4C. Pneumonia
Relative risk of the incidence of pneumonia in studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.

4D. Urinary tract infection
Relative risk of the incidence of urinary tract infection in studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.

4E. Acute kidney injury
Relative risk of the incidence of acute kidney injury in studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
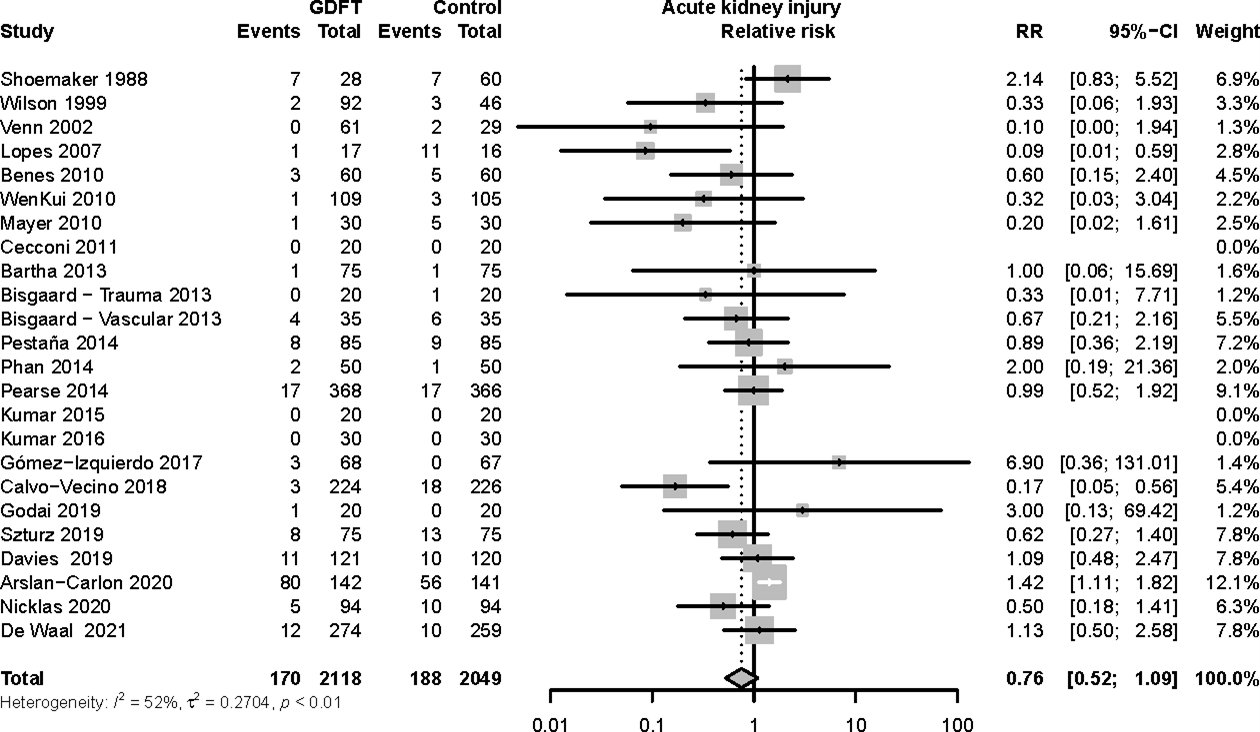
4F. Paralytic ileus
Relative risk of the incidence of paralytic ileus in studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.

4G. Reoperation
Relative risk of the incidence of reoperation in studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.

4H. Number of patients with ≥1 complication
Relative risk of the incidence of patients with 1 or more complications in studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.

Sub-analysis: 5T’s
5A. Target population
Relative risk of studies grouped for a high-risk patient population (at least 50% of the study population has an American Society of Anaesthesiologists (ASA) score higher than 2) or a low risk patient population, and comparing studies with goal-directed fluid therapy (GDFT) versus no specific fluid management. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.

5B. Timing of intervention
Relative risk of studies grouped for those starting with goal-directed fluid therapy (GDFT) before induction of anaesthesia versus studies starting with GDFT during or after induction of anaesthesia. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
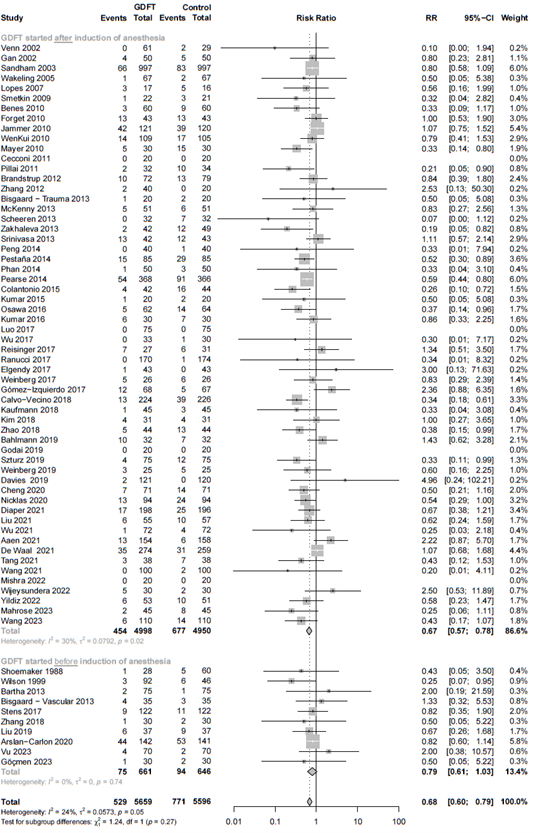
5C. Type of intervention
Relative risk of studies grouped for those including fluids, inotropes, and vasopressors in their goal-directed fluid therapy (GDFT) algorithm versus studies not including all three types of interventions in their GDFT algorithm. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
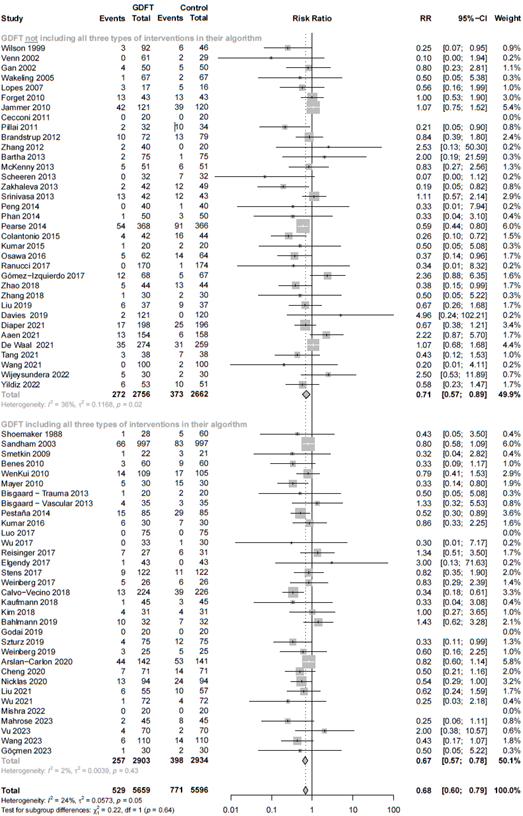
5D. Target variable
Relative risk of studies grouped for those including a target variable, reflecting blood flow (stroke volume, stroke volume index, cardiac output, cardiac index) in their the goal-directed fluid therapy (GDFT) algorithm versus studies not including a target variable in their GDFT algorithm. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
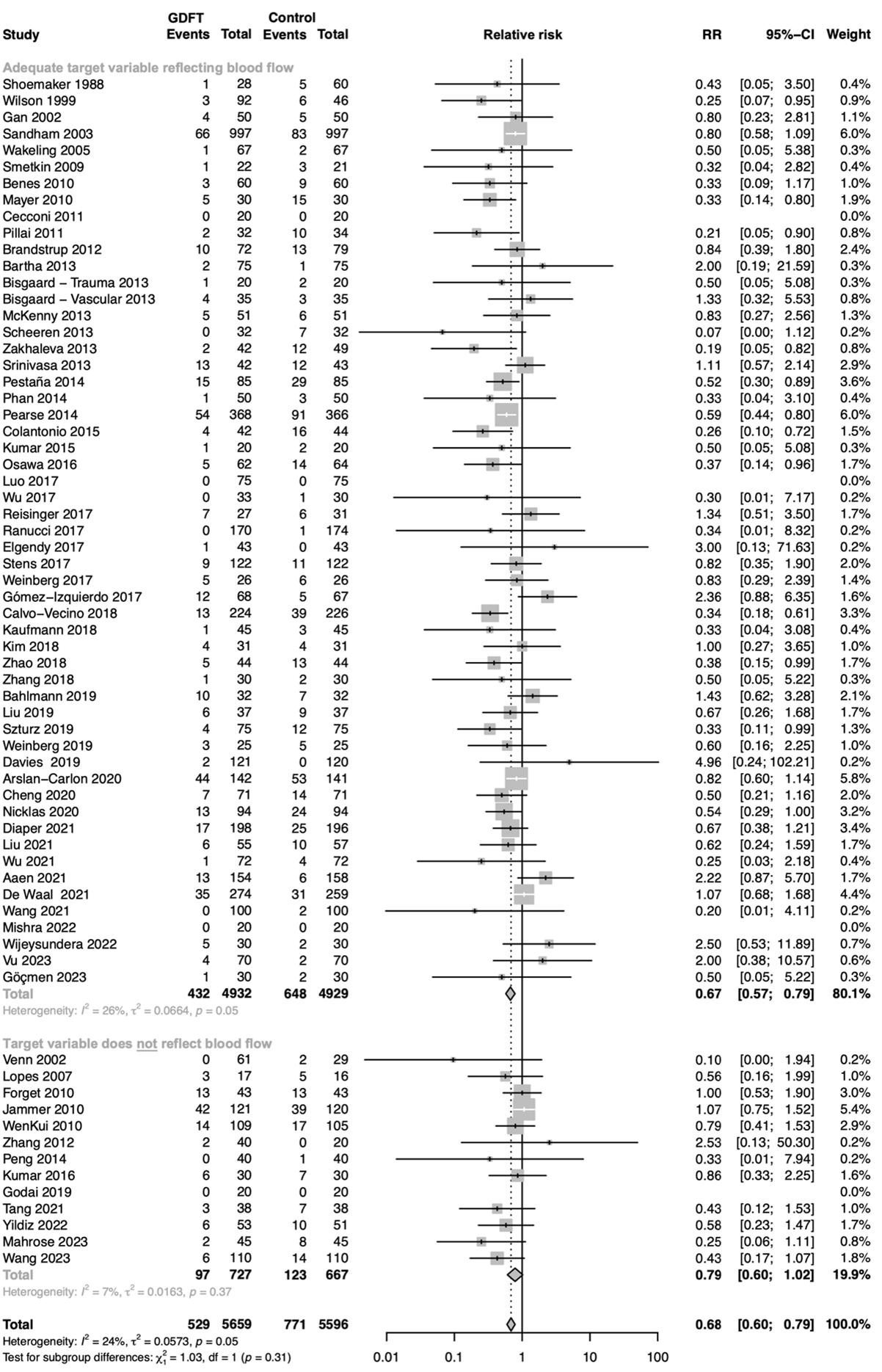
5E. Target value
Relative risk of studies grouped for those including a personalised target value in their goal-directed fluid therapy (GDFT) algorithm versus studies not including a personalised target value in their GDFT algorithm. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
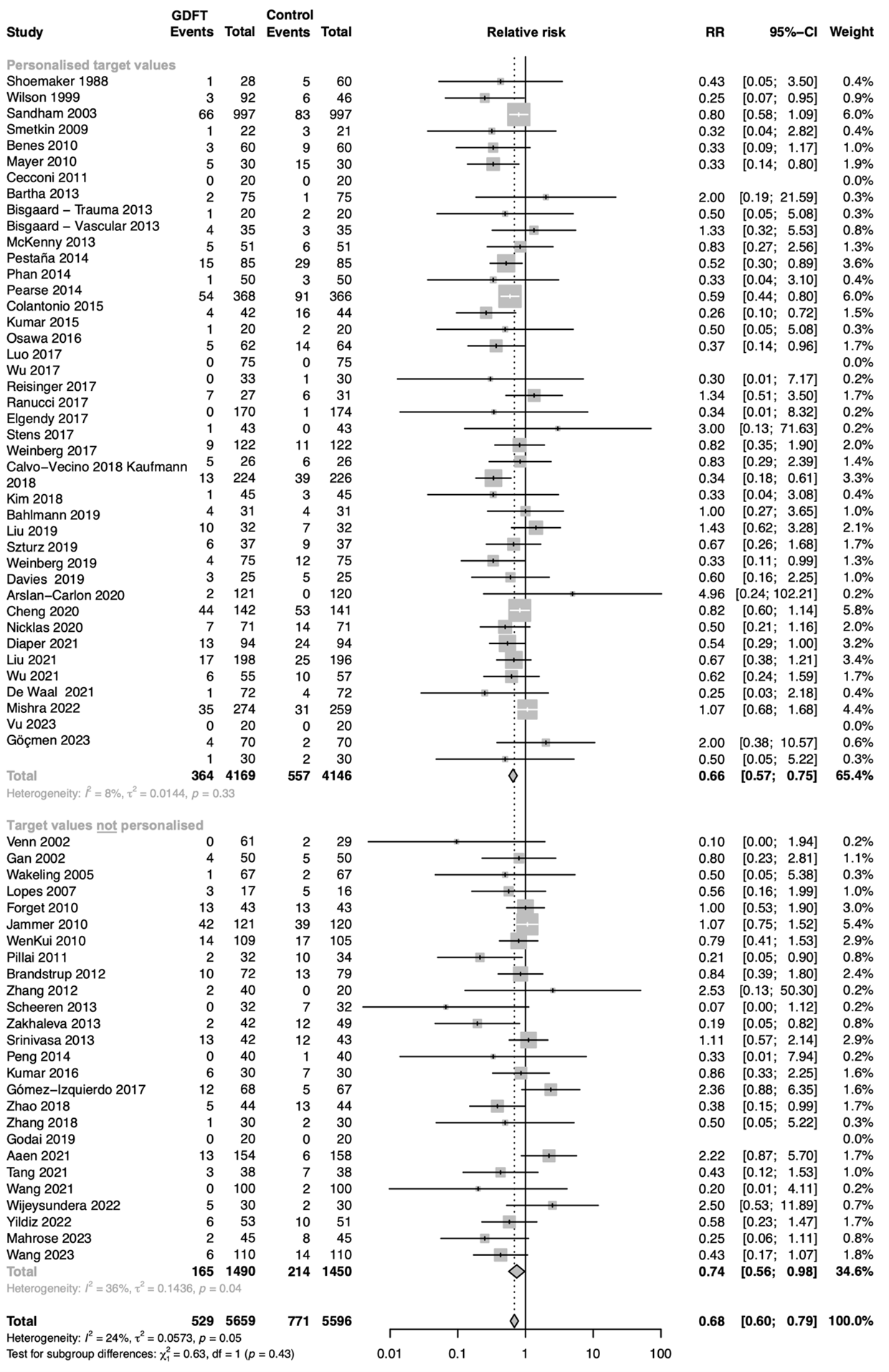
5F. Sum of 5Ts
The 5T’s of Saugel represent target population, timing of intervention, type of intervention, target variable, and personalised target variables
Relative risk of five distinct groups associated with a different sum of the adherence to the 5Ts. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
5G. Meta-regression bubble plot of the sum of all components of the 5Ts
The 5T’s of Saugel represent target population, timing of intervention, type of intervention, target variable, and personalised target variables.
Meta-regressions showed that adherence to the 5 T’s was not a significant effect size predictor with a regression coefficient of -0.05 (95% CI -0.14 - 0.04). This means that for every ‘additional T’, the effect size (relative risk) is expected to decline by 0.05.

Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effect of goal-directed fluid therapy (c) versus no specific fluid management protocol (i) in adult patients undergoing surgical procedures (p) in the prevention of SSI?
P: Patients undergoing any surgical procedure
I: Goal-directed fluid therapy
C: No specific fluid management protocol
O: Surgical site infections, mortality, other postoperative complications
Relevant outcome measures
The guideline development group considered surgical site infections (SSI) a critical outcome measure for decision making. Mortality, sepsis, pneumonia, urinary tract infection, acute kidney injury, paralytic ileus, reoperation, and number of patients with at least one complication were important outcome measures for decision making.
The working group defined a threshold of 10% for continuous outcomes and a relative risk (RR) for dichotomous outcomes of <0.80 and >1.25 as a minimal clinically (patient) important difference.
Search and select (Methods)
We performed systematic review and searched in Embase and Ovid/Medline for publications up to August 3rd 2023, for RCTs comparing goal-directed fluid therapy to no specific fluid management protocol. Search terms included: surgical site infection, postoperative wound infection, haemodynamic monitoring, fluid therapy, normovolaemia, goal-directed fluid therapy and other related terms. The detailed search strategy is available on request via https://richtlijnendatabase.nl/. Additional studies were identified by backward and forward citation tracing of previously published meta-analyses and included studies.
The database search resulted in 1451 potential studies, and 35 additional studies were identified by backward and forward citation tracking. We assessed 141 full-text publications, of which 68 studies were included in the systematic review and meta-analyses. The selection process is shown in Flowchart of selected studies. The reason for exclusion after full-text review can be found in the table of excluded studies under the 'evidence tabellen' tab.
Results
Sixty-eight studies were included in the analysis of the literature under the tab 'Samenvatting literatuur'. Important study characteristics and results and quality assessments are summarized in the evidence tables and risk of bias tables under the 'evidence tabellen' tab.
Referenties
- Aaen AA, Voldby AW, Storm N, et al. Goal-directed fluid therapy in emergency abdominal surgery: a randomised multicentre trial. Br J Anaesth 2021; 127(4): 521-31.
- Arslan-Carlon VT, Kay See: Dalbagni, Guido: Pedoto, Alessia C.: Herr, Harry W.: Bochner, Bernard H.: Cha, Eugene K.: Donahue, Timothy F.: Fischer, Mary: Donat, S. Machele. Goal-directed versus Standard Fluid Therapy to Decrease Ileus after Open Radical Cystectomy: A Prospective Randomized Controlled Trial. Anesthesiology 2020; 133(2): 293-303.
- Bahlmann HH, I.: Nilsson, L. Goal-directed therapy during transthoracic oesophageal resection does not improve outcome: Randomised controlled trial. European Journal of Anaesthesiology 2019; 36(2): 153-61.
- Bartha EA, C.: Imnell, A.: Fernlund, M. E.: Andersson, L. E.: Kalman, S. Randomized controlled trial of goal-directed haemodynamic treatment in patients with proximal femoral fracture. British Journal of Anaesthesia 2013; 110(4): 545-53., C.: Imnell, A.: Fernlund, M. E.: Andersson, L. E.: Kalman, S. Randomized controlled trial of goal-directed haemodynamic treatment in patients with proximal femoral fracture. British Journal of Anaesthesia 2013; 110(4): 545-53.
- Benes JC, I.: Altmann, P.: Hluchy, M.: Kasal, E.: Svitak, R.: Pradl, R.: Stepan, M. Intraoperative fluid optimization using stroke volume variation in high risk surgical patients: Results of prospective randomized study. Critical Care 2010; 14(3): R118.
- Bisgaard JG, T.: RØnholm, E.: Toft, P. Optimising stroke volume and oxygen delivery in abdominal aortic surgery: A randomised controlled trial. Acta Anaesthesiologica Scandinavica 2013; 57(2): 178-88.
- Bisgaard JG, T.: RØnholm, E.: Toft, P. Haemodynamic optimisation in lower limb arterial surgery: Room for improvement? Acta Anaesthesiologica Scandinavica 2013; 57(2): 189-98.
- Brandstrup BS, P. E.: Rasmussen, M.: Belhage, B.: Rodt, S. Å: Hansen, B.: Moller, D. R.: Lundbech, L. B.: Andersen, N.: Berg, V.: Thomassen, N.: Andersen, S. T.: Simonsen, L. Which goal for fluid therapy during colorectal surgery is followed by the best outcome: Near-maximal stroke volume or zero fluid balance? British Journal of Anaesthesia 2012; 109(2): 191-9.
- Calvo-Vecino JMR-M, J.: Mythen, M. G.: Casans-Francés, R.: Balik, A.: Artacho, J. P.: Martínez-Hurtado, E.: Serrano Romero, A.: Fernández Pérez, C.: Asuero de Lis, S.: Errazquin, A. T.: Gil Lapetra, C.: Motos, A. A.: Reche, E. G.: Medraño Viñas, C.: Villaba, R.: Cobeta, P.: Ureta, E.: Montiel, M.: Mané, N.: Martínez Castro, N.: Horno, G. A.: Salas, R. A.: Bona García, C.: Ferrer Ferrer, M. L.: Franco Abad, M.: García Lecina, A. C.: Antón, J. G.: Gascón, G. H.: Peligro Deza, J.: Pascual, L. P.: Ruiz Garcés, T.: Roberto Alcácer, A. T.: Badura, M.: Terrer Galera, E.: Fernández Casares, A.: Martínez Fernández, M. C.: Espinosa, Á: Abad-Gurumeta, A.: Feldheiser, A.: López Timoneda, F.: Zuleta-Alarcón, A.: Bergese, S. Effect of goal-directed haemodynamic therapy on postoperative complications in low–moderate risk surgical patients: a multicentre randomised controlled trial (FEDORA trial). British Journal of Anaesthesia 2018; 120(4): 734-44.
- Cecconi MF, N.: Langiano, N.: Divella, M.: Costa, M. G.: Rhodes, A.: Rocca, G. D. Goal-directed haemodynamic therapy during elective total hip arthroplasty under regional anaesthesia. Critical Care 2011; 15(3): R132.
- Cheng XQZ, J. Y.: Wu, H.: Zuo, Y. M.: Tang, L. L.: Zhao, Q.: Gu, E. W. Outcomes of individualized goal-directed therapy based on cerebral oxygen balance in high-risk patients undergoing cardiac surgery: A randomized controlled trial. Journal of Clinical Anesthesia 2020; 67: 110032.
- Colantonio LC, C.: Fabrizi, L.: Marcelli, M. E.: Sofra, M.: Giannarelli, D.: Garofalo, A.: Forastiere, E. A randomized trial of goal directed vs. standard fluid therapy in cytoreductive surgery with hyperthermic intraperitoneal chemotherapy. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract 2015; 19(4): 722-9.
- Davies SJ, Yates DR, Wilson RJT, Murphy Z, Gibson A, Allgar V, Collyer T. A randomised trial of non-invasive cardiac output monitoring to guide haemodynamic optimisation in high risk patients undergoing urgent surgical repair of proximal femoral fractures (ClearNOF trial NCT02382185). Perioper Med (Lond) 2019; 8: 8.
- Diaper JS, E.: Barcelos, G. K.: Luise, S.: Schorer, R.: Ellenberger, C.: Licker, M. Goal-directed hemodynamic therapy versus restrictive normovolemic therapy in major open abdominal surgery: A randomized controlled trial. Surgery (United States) 2021; 169(5): 1164-74.
- Elgendy MA, Esmat IM, Kassim DY. Outcome of intraoperative goal-directed therapy using Vigileo/FloTrac in high-risk patients scheduled for major abdominal surgeries: a prospective randomized trial. Egyptian Journal of Anaesthesia 2017; 33(3): 263-9.
- Forget PL, F.: De Kock, M. Goal-directed fluid management based on the pulse oximeter-derived pleth variability index reduces lactate levels and improves fluid management. Anesthesia and Analgesia 2010; 111(4): 910-4.
- Gan TJ, Soppitt A, Maroof M, et al. Goal-directed intraoperative fluid administration reduces length of hospital stay after major surgery. Anesthesiology 2002; 97(4): 820-6.
- Godai KM, A.: Kanmura, Y. The effects of hemodynamic management using the trend of the perfusion index and pulse pressure variation on tissue perfusion: a randomized pilot study. Ja Clin Rep 2019; 5(1): 72.
- Gomez-Izquierdo JC, Trainito A, Mirzakandov D, et al. Goal-directed Fluid Therapy Does Not Reduce Primary Postoperative Ileus after Elective Laparoscopic Colorectal Surgery: A Randomized Controlled Trial. Anesthesiology 2017; 127(1): 36-49.
- Jammer IU, A.: Erichsen, C.: Lødemel, O.: Østgaard, G. Does central venous oxygen saturation-directed fluid therapy affect postoperative morbidity after colorectal surgery?: A randomized assessor-blinded controlled trial. Anesthesiology 2010; 113(5): 1072-80.
- Kaufmann KBB, W.: Rexer, J.: Loeffler, T.: Heinrich, S.: Konstantinidis, L.: Buerkle, H.: Goebel, U. Evaluation of hemodynamic goal-directed therapy to reduce the incidence of bone cement implantation syndrome in patients undergoing cemented hip arthroplasty - a randomized parallel-arm trial. BMC Anesthesiology 2018; 18(1): 63.
- Kim HJK, E. J.: Lee, H. J.: Min, J. Y.: Kim, T. W.: Choi, E. C.: Kim, W. S.: Koo, B. N. Effect of goal-directed haemodynamic therapy in free flap reconstruction for head and neck cancer. Acta Anaesthesiologica Scandinavica 2018; 62(7): 903-14.
- Kumar L, Kanneganti YS, Rajan S. Outcomes of implementation of enhanced goal directed therapy in high-risk patients undergoing abdominal surgery. Indian J Anaesth 2015; 59(4): 228-33.
- Kumar L, Rajan S, Baalachandran R. Outcomes associated with stroke volume variation versus central venous pressure guided fluid replacements during major abdominal surgery. J Anaesthesiol Clin Pharmacol 2016; 32(2): 182-6.
- Liu FL, Jing: Zhang, Weixia: Liu, Zhongkai: Dong, Ling: Wang, Yuelan. Randomized controlled trial of regional tissue oxygenation following goal-directed fluid therapy during laparoscopic colorectal surgery. International journal of clinical and experimental pathology 2019; 12(12): 4390-9.
- Liu XZ, P.: Liu, M. X.: Ma, J. L.: Wei, X. C.: Fan, D. Preoperative carbohydrate loading and intraoperative goal-directed fluid therapy for elderly patients undergoing open gastrointestinal surgery: a prospective randomized controlled trial. BMC Anesthesiology 2021; 21(1): 157.
- Lopes MRO, M. A.: Pereira, V. O. S.: Lemos, I. P. B.: Auler Jr, J. O. C.: Michard, F. Goal-directed fluid management based on pulse pressure variation monitoring during high-risk surgery: A pilot randomized controlled trial. Critical Care 2007; 11(5): R100.
- Luo JX, J.: Liu, J.: Liu, B.: Liu, L.: Chen, G. Goal-directed fluid restriction during brain surgery: a prospective randomized controlled trial. Annals of Intensive Care 2017; 7(1): 16.
- Mahrose, R. A., & Kasem, A. A. (2023). Pulse Pressure Variation-Based Intraoperative Fluid Management Versus Traditional Fluid Management for Colon Cancer Patients Undergoing Open Mass Resection and Anastomosis: A Randomized Controlled Trial. Anesthesiology and Pain Medicine, 13(4).
- Mayer J, Boldt J, Mengistu AM, Rohm KD, Suttner S. Goal-directed intraoperative therapy based on autocalibrated arterial pressure waveform analysis reduces hospital stay in high-risk surgical patients: a randomized, controlled trial. Crit Care 2010; 14(1): R18.
- McKenny MC, P.: Wong, A.: Farren, M.: Gleeson, N.: Walsh, C.: O'Malley, C.: Dowd, N. A randomised prospective trial of intra-operative oesophageal Doppler-guided fluid administration in major gynaecological surgery. Anaesthesia 2013; 68(12): 1224-31.
- Mishra N, Rath GP, Bithal PK, Chaturvedi A, Chandra PS, Borkar SA. Effect of Goal-Directed Intraoperative Fluid Therapy on Duration of Hospital Stay and Postoperative Complications in Patients Undergoing Excision of Large Supratentorial Tumors. Neurol India 2022; 70(1): 108-14.
- Nicklas JYD, O.: Leistenschneider, M.: Sellhorn, C.: Schön, G.: Winkler, M.: Daum, G.: Schwedhelm, E.: Schröder, J.: Fisch, M.: Schmalfeldt, B.: Izbicki, J. R.: Bauer, M.: Coldewey, S. M.: Reuter, D. A.: Saugel, B. Personalised haemodynamic management targeting baseline cardiac index in high-risk patients undergoing major abdominal surgery: a randomised single-centre clinical trial. British Journal of Anaesthesia 2020; 125(2): 122-32.
- Osawa EA, Rhodes A, Landoni G, et al. Effect of Perioperative Goal-Directed Hemodynamic Resuscitation Therapy on Outcomes Following Cardiac Surgery: A Randomized Clinical Trial and Systematic Review. Crit Care Med 2016; 44(4): 724-33.
- Pearse RM, Harrison DA, MacDonald N, et al. Effect of a perioperative, cardiac output-guided hemodynamic therapy algorithm on outcomes following major gastrointestinal surgery: a randomized clinical trial and systematic review. JAMA 2014; 311(21): 2181-90.
- Peng KL, J.: Cheng, H.: Ji, F. H. Goal-directed fluid therapy based on stroke volume variations improves fluid management and gastrointestinal perfusion in patients undergoing major orthopedic surgery. Medical Principles and Practice 2014; 23(5): 413-20.
- Pestaña DE, E.: Eden, A.: Nájera, D.: Collar, L.: Aldecoa, C.: Higuera, E.: Escribano, S.: Bystritski, D.: Pascual, J.: Fernández-Garijo, P.: De Prada, B.: Muriel, A.: Pizov, R. Perioperative goal-directed hemodynamic optimization using noninvasive cardiac output monitoring in major abdominal surgery: A prospective, randomized, multicenter, pragmatic trial: POEMAS study (PeriOperative goal-directed thErapy in Major Abdominal Surgery). Anesthesia and Analgesia 2014; 119(3): 579-87.
- Phan TDDS, B.: Rattray, M. J.: Johnston, M. J.: Cowie, B. S. A randomised controlled trial of fluid restriction compared to oesophageal Doppler-guided goal-directed fluid therapy in elective major colorectal surgery within an Enhanced Recovery After Surgery program. Anaesth Intens Care 2014; 42(6): 752-60.
- Pillai PM, I.: Gaughan, M.: Snowden, C.: Nesbitt, I.: Durkan, G.: Johnson, M.: Cosgrove, J.: Thorpe, A. A double-blind randomized controlled clinical trial to assess the effect of doppler optimized intraoperative fluid management on outcome following radical cystectomy. Journal of Urology 2011; 186(6): 2201-6.
- Ranucci M, Johnson I, Willcox T, et al. Goal-directed perfusion to reduce acute kidney injury: A randomized trial. J Thorac Cardiovasc Surg 2018; 156(5): 1918-27 e2.
- Reisinger KW, Willigers HM, Jansen J, Buurman WA, Von Meyenfeldt MF, Beets GL, Poeze M. Doppler-guided goal-directed fluid therapy does not affect intestinal cell damage but increases global gastrointestinal perfusion in colorectal surgery: a randomized controlled trial. Colorectal Dis 2017; 19(12): 1081-91.
- Sandham JD, Hull RD, Brant RF, et al. A randomized, controlled trial of the use of pulmonary-artery catheters in high-risk surgical patients. N Engl J Med 2003; 348(1): 5-14.
- Scheeren TWLW, C.: Gerlach, H.: Marx, G. Goal-directed intraoperative fluid therapy guided by stroke volume and its variation in high-risk surgical patients: A prospective randomized multicentre study. Journal of Clinical Monitoring and Computing 2013; 27(3): 225-33.
- Shoemaker WC, Appel PL, Kram HB, Waxman K, Lee TS. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients. Chest 1988; 94(6): 1176-86.
- Smetkin AA, Kirov MY, Kuzkov VV, et al. Single transpulmonary thermodilution and continuous monitoring of central venous oxygen saturation during off-pump coronary surgery. Acta Anaesthesiol Scand 2009; 53(4): 505-14.
- Srinivasa S, Taylor MH, Singh PP, Yu TC, Soop M, Hill AG. Randomized clinical trial of goal-directed fluid therapy within an enhanced recovery protocol for elective colectomy. Br J Surg 2013; 100(1): 66-74.
- Stens J, Hering JP, van der Hoeven CWP, et al. The added value of cardiac index and pulse pressure variation monitoring to mean arterial pressure-guided volume therapy in moderate-risk abdominal surgery (COGUIDE): a pragmatic multicentre randomised controlled trial. Anaesthesia 2017; 72(9): 1078-87.
- Szturz PF, P.: Kula, R.: Neiser, J.: Ševčík, P.: Benes, J. Multi-parametric functional hemodynamic optimization improves postsurgical outcome after intermediate risk open gastrointestinal surgery: A randomized controlled trial. Minerva Anestesiologica 2019; 85(3): 244-54.
- Tang W, Qiu Y, Lu H, Xu M, Wu J. Stroke Volume Variation-Guided Goal-Directed Fluid Therapy Did Not Significantly Reduce the Incidence of Early Postoperative Complications in Elderly Patients Undergoing Minimally Invasive Esophagectomy: A Randomized Controlled Trial. Front Surg 2021; 8: 794272.
- Venn RS, A.: Richardson, P.: Poloniecki, J.: Grounds, M.: Newman, P. Randomized controlled trial to investigate influence of the fluid challenge on duration of hospital stay and perioperative morbidity in patients with hip fractures. British Journal of Anaesthesia 2002; 88(1): 65-71.
- Vu, P. H., Duong, N. D. A., Tran, V. D., Tran, T. H., Luu, X. V., Truong, Q. T., ... & Ochiai, R. (2023). Effectiveness of goal-directed fluid therapy guided by estimated continuous cardiac output (esCCO) in major gastrointestinal surgeries: a randomized controlled trial. Anaesthesia, Pain & Intensive Care, 27(3), 371-378.
- de Waal EEC, Frank M, Scheeren TWL, et al. Perioperative goal-directed therapy in high-risk abdominal surgery. A multicenter randomized controlled superiority trial. J Clin Anesth 2021; 75: 110506.
- Wakeling HGM, M. R.: Jenkins, C. S.: Woods, W. G. A.: Miles, W. F. A.: Barclay, G. R.: Fleming, S. C. Intraoperative oesophageal Doppler guided fluid management shortens postoperative hospital stay after major bowel surgery. British Journal of Anaesthesia 2005; 95(5): 634-42.
- Wang, Y., Zhang, Y., Zheng, J., Dong, X., Wu, C., Guo, Z., & Wu, X. (2023). Intraoperative pleth variability index-based fluid management therapy and gastrointestinal surgical outcomes in elderly patients: a randomised controlled trial. Perioperative Medicine, 12(1), 1-10.
- Wang DD, Li Y, Hu XW, Zhang MC, Xu XM, Tang J. Comparison of restrictive fluid therapy with goal-directed fluid therapy for postoperative delirium in patients undergoing spine surgery: a randomized controlled trial. Perioper Med (Lond) 2021; 10(1): 48.
- Weinberg L, Ianno D, Churilov L, et al. Restrictive intraoperative fluid optimisation algorithm improves outcomes in patients undergoing pancreaticoduodenectomy: A prospective multicentre randomized controlled trial. PLoS One 2017; 12(9): e0183313.
- Weinberg L, Ianno D, Churilov L, et al. Goal directed fluid therapy for major liver resection: A multicentre randomized controlled trial. Ann Med Surg (Lond) 2019; 45: 45-53.
- WenKui YN, L.: JianFeng, G.: WeiQin, L.: ShaoQiu, T.: Zhihui, T.: Tao, G.: JuanJuan, Z.: FengChan, X.: Hui, S.: WeiMing, Z.: Jie-Shou, L. Restricted peri-operative fluid administration adjusted by serum lactate level improved outcome after major elective surgery for gastrointestinal malignancy. Surgery 2010; 147(4): 542-52.
- Wijeysundera D, Duncan D, Moreno Garijo J, et al. A randomised controlled feasibility trial of a clinical protocol to manage hypotension during major non‐cardiac surgery. Anaesthesia 2022.
- Wilson JW, I.: Fawcett, J.: Whall, R.: Dibb, W.: Morris, C.: McManus, E. Reducing the risk of major elective surgery: Randomised controlled trial of preoperative optimisation of oxygen delivery. British Medical Journal 1999; 318(7191): 1099-103.
- Wu JM, Y.: Wang, T.: Xu, G.: Fan, L.: Zhang, Y. Goal-directed fluid management based on the auto-calibrated arterial pressure-derived stroke volume variation in patients undergoing supratentorial neoplasms surgery. Int J Clin Exp Med 2017; 10(2): 3106-14.
- Wu QFK, H.: Xu, Z. Z.: Li, H. J.: Mu, D. L.: Wang, D. X. Impact of goal-directed hemodynamic management on the incidence of acute kidney injury in patients undergoing partial nephrectomy: a pilot randomized controlled trial. BMC Anesthesiology 2021; 21(1): 67.
- Yildiz GO, Hergunsel GO, Sertcakacilar G, Akyol D, Karakas S, Cukurova Z. Perioperative goal-directed fluid management using noninvasive hemodynamic monitoring in gynecologic oncology. Braz J Anesthesiol 2022; 72(3): 322-30.
- Zakhaleva J, Tam J, Denoya PI, Bishawi M, Bergamaschi R. The impact of intravenous fluid administration on complication rates in bowel surgery within an enhanced recovery protocol: a randomized controlled trial. Colorectal Dis 2013; 15(7): 892-9.
- Zhang JQ, H.: He, Z.: Wang, Y.: Che, X.: Liang, W. Intraoperative fluid management in open gastrointestinal surgery: Goal-directed versus restrictive. Clinics 2012; 67(10): 1149-55.
- Zhang N, Liang M, Zhang DD, et al. Effect of goal-directed fluid therapy on early cognitive function in elderly patients with spinal stenosis: A Case-Control Study. Int J Surg 2018; 54(Pt A): 201-5.
- Zhao GP, P.: Zhou, Y.: Li, J.: Jiang, H.: Shao, J. The accuracy and effectiveness of goal directed fluid therapy in plateau-elderly gastrointestinal cancer patients: a prospective randomized controlled trial. Int J Clin Exp Med 2018; 11(8): 8516-22.
Evidence tabellen
Sub-analysis: risk of bias
Risk of bias; low and some concerns vs high risk of bias
Relative risk of studies grouped for those with low and some concerns risk of bias versus studies with a high risk of bias. The figure shows the pooled relative risk (RR). The squares and horizontal lines. represent point estimates and corresponding 95% CIs of the individual studies.
Risk of bias; low vs some concerns vs high risk of bias
Relative risk of studies grouped for low, some concerns, or high risk of bias. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
Sub-analysis: Type of surgery
Relative risk of studies including cardiothoracic, gastrointestinal, or other surgeries. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
Sub-analysis: Level of wound contamination
Relative risk of studies grouped for those including clean surgery, clean-contaminated and contaminated surgery, or mixed contaminated surgery. The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
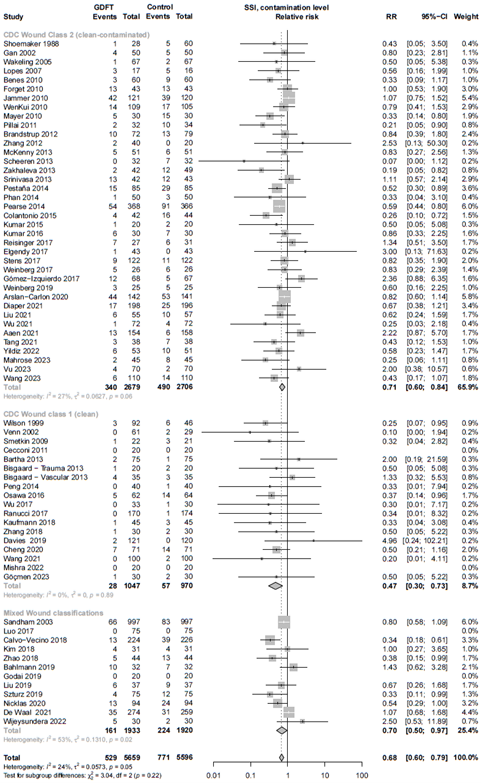
Sub-analysis: invasive vs. non-invasive
Relative risk of studies using invasive or non-invasive methods of goal-directed fluid therapy (GDFT). The figure shows the pooled relative risk (RR). The squares and horizontal lines represent point estimates and corresponding 95% CIs of the individual studies.
A Trial sequential analysis
A. TSA of all randomised controlled trials
Trial sequential analysis (TSA) was based on a relative risk reduction (RRR) of 25%, surgical site infection risk in the control group of 13.9%, a type I error of 5% and a type II error of 20%.
B. TSA of only studies with low risk of bias
Trial sequential analysis (TSA) was based on a relative risk reduction (RRR) of 25%, surgical site infection risk in the control group of 16.7%, a type I error of 5% and a type II error of 20%.
Elaborate risk of bias assessment
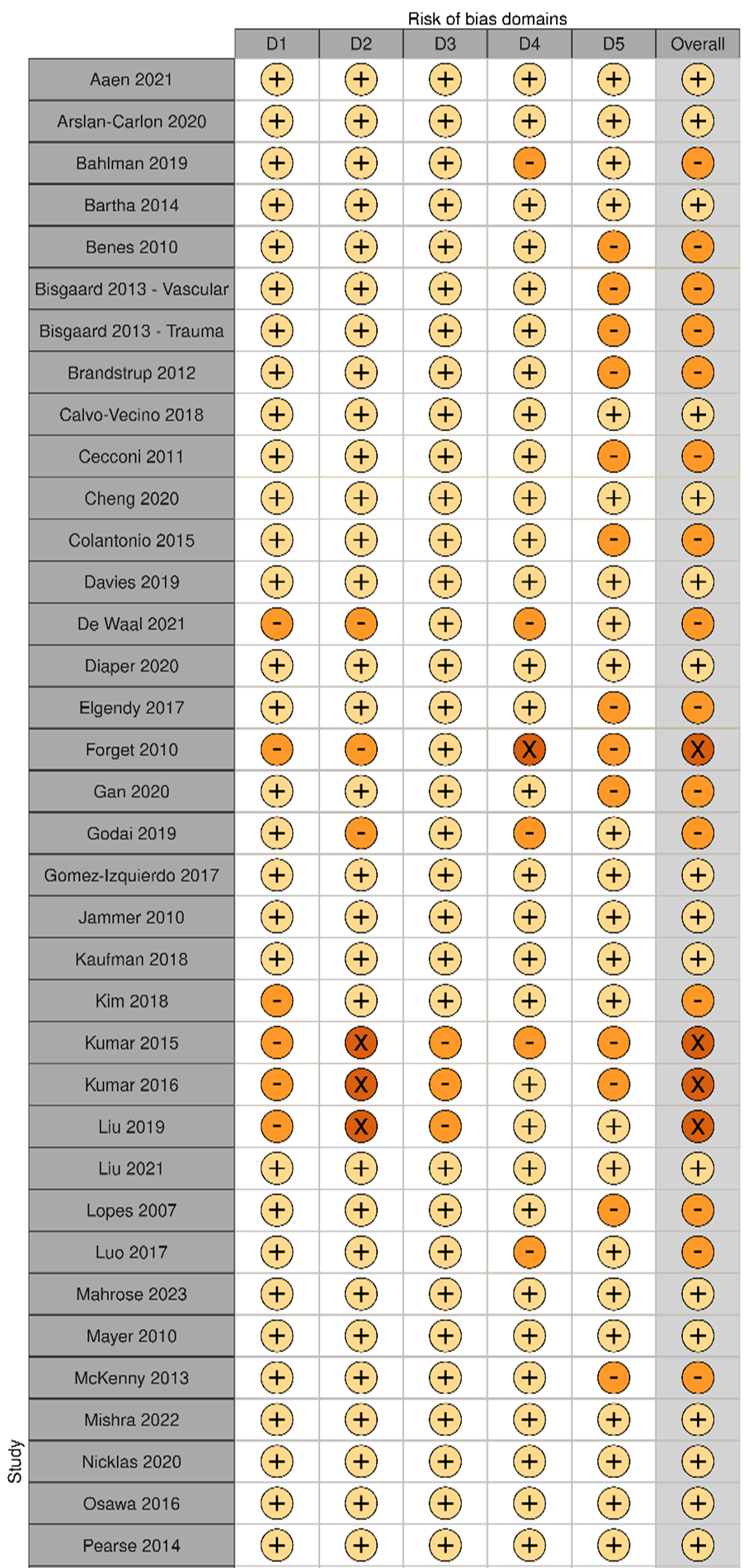
Domains:
D1 Bias arising from the randomisation process
D2 Bias due to deviations from the intended intervention
D3 Bias due to missing outcome data
D4 Bias in the measurement of the outcome
D5 Bias in the selection of the reported result
High risk of bias
Some concerns
Low risk of bias
Comparison-adjusted funnel plot
The comparison-adjusted funnel plot shows the effect estimate of a study (relative risks) versus its precision (standard error) for surgical site infection (SSI). The funnel plot shows symmetry indicating no differences between small and large studies regarding the effect of the treatment (small-study effect). Comparison-adjusted funnel plot asymmetry can be caused by publication bias. Since we find no asymmetry (no small-study effect), publication bias is less likely.
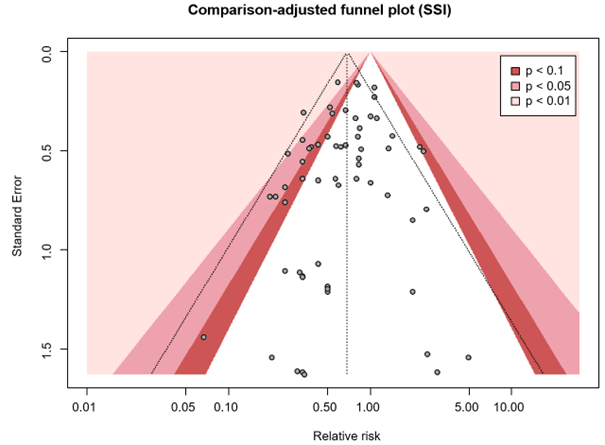
Table of excluded studies
|
|
Author, Year |
Reason for exclusion |
|
1 |
Feng, 20231 |
Outcome not of interest |
|
2 |
Hrdy, 20233 |
Outcome not of interest |
|
3 |
Ji, 20234 |
Postoperative GDFT |
|
4 |
Ma, 20235 |
Outcome not of interest |
|
5 |
Schaller, 20236 |
Outcome not of interest |
|
6 |
Chui, 20227 |
Outcome not of interest |
|
7 |
Froghi, 20228 |
Postoperative GDFT |
|
8 |
Hokenek, 20229 |
Outcome not of interest |
|
9 |
Hokenek, 20229 |
Duplicate |
|
10 |
Mishra, 202210 |
Duplicate |
|
11 |
Turkut, 202211 |
Outcome not of interest |
|
12 |
Wongtangman, 202212 |
Outcome not of interest |
|
13 |
Wongtangman, 202112 |
Duplicate |
|
14 |
Bloria, 202113 |
Outcome not of interest |
|
15 |
Cho, 202114 |
Outcome not of interest |
|
16 |
Li, 202115 |
Outcome not of interest |
|
17 |
Liu, 202116 |
Comparison not of interest |
|
18 |
Omar, 202117 |
Outcome not of interest |
|
19 |
Taylor, 202118 |
Outcome not of interest |
|
20 |
Tribuddharat, 202119 |
Outcome not of interest |
|
21 |
Wang, 202120 |
Outcome not of interest |
|
22 |
Chui, 202021 |
Outcome not of interest |
|
23 |
Fischer, 202022 |
Outcome not of interest |
|
24 |
Martin, 202023 |
Postoperative GDFT |
|
25 |
Cesur, 201924 |
Outcome not of interest |
|
26 |
Coeckelenbergh, 201925 |
Comparison not of interest |
|
27 |
Bahlmann, 201826 |
Comparison not of interest |
|
28 |
Calvo-Vecino, 201827 |
Duplicate |
|
29 |
Gerent, 201828 |
Postoperative GDFT |
|
30 |
Liu, 201829 |
Outcome not of interest |
|
31 |
Myles, 201830 |
Comparison not of interest |
|
32 |
Yin, 201831 |
Outcome not of interest |
|
33 |
Kaufmann, 201732 |
Outcome not of interest |
|
34 |
Liang, 201733 |
Outcome not of interest |
|
35 |
Xu, 201734 |
Outcome not of interest |
|
36 |
Broch, 201635 |
Outcome not of interest |
|
37 |
Deschamps, 201636 |
Comparison not of interest |
|
38 |
Kassim, 201637 |
Comparison not of interest |
|
39 |
Li, 201638 |
Not available through library |
|
40 |
Schmid, 201639 |
Outcome not of interest |
|
41 |
Ackland, 201540 |
Outcome not of interest |
|
42 |
Benes, 201541 |
Comparison not of interest |
|
43 |
Correa-Gallego, 201542 |
Comparison not of interest |
|
44 |
Funk, 201543 |
Outcome not of interest |
|
45 |
Jammer, 201544 |
Outcome not of interest |
|
46 |
Lai, 201545 |
Outcome not of interest |
|
47 |
Mikor, 201546 |
Outcome not of interest |
|
48 |
Cowie, 201447 |
Comparison not of interest |
|
49 |
Zeng, 201448 |
Retracted |
|
50 |
Chattopadhyay, 201349 |
No randomisation |
|
51 |
Goepfert, 201350 |
Outcome not of interest |
|
52 |
Jones, 201351 |
Postoperative GDFT |
|
53 |
Salzwedel, 201352 |
Outcome not of interest |
|
54 |
Challand, 201253 |
Outcome not of interest |
|
55 |
Cohn, 201054 |
Comparison not of interest |
|
56 |
Rhodes, 201055 |
Outcome not of interest |
|
57 |
Van Der Linden, 201056 |
Outcome not of interest |
|
58 |
Senagore, 200957 |
Comparison not of interest |
|
59 |
Harten, 200858 |
Outcome not of interest |
|
60 |
Chytra, 200759 |
Postoperative GDFT |
|
61 |
Donati, 200760 |
Outcome not of interest |
|
62 |
Murkin, 200761 |
Comparison not of interest |
|
63 |
Lobo, 200662 |
Comparison not of interest |
|
64 |
Noblett, 200663 |
Outcome not of interest |
|
65 |
Pearse, 200564 |
Outcome not of interest |
|
66 |
Pearse, 200564 |
Duplicate |
|
67 |
McKendry, 200465 |
Postoperative GDFT |
|
68 |
Conway, 200266 |
Outcome not of interest |
|
69 |
Ueno, 199867 |
Postoperative GDFT |
|
70 |
Bender, 199768 |
Comparison not of interest |
|
71 |
Sincleair, 199769 |
Postoperative GDFT |
|
72 |
Boyd, 199370 |
Comparison not of interest |
|
73 |
Joyce, 199071 |
Comparison not of interest |
|
1. Feng A, Lu P, Yang Y, Liu Y, Ma L, Lv J. Effect of goal-directed fluid therapy based on plasma colloid osmotic pressure on the postoperative pulmonary complications of older patients undergoing major abdominal surgery. World J Surg Oncol. 2023;21(1):67. Published 2023 Feb 28. doi:10.1186/s12957-023-02955-5. 2. Hrdy O, Duba M, Dolezelova A, et al. Effects of goal-directed fluid management guided by a non-invasive device on the incidence of postoperative complications in neurosurgery: a pilot and feasibility randomized controlled trial. Perioper Med (Lond). 2023;12(1):32. Published 2023 Jul 5. doi:10.1186/s13741-023-00321-3. 3. Ji J, Ma Q, Tian Y, et al. Effect of inferior vena cava respiratory variability-guided fluid therapy after laparoscopic hepatectomy: a randomized controlled clinical trial. Chin Med J (Engl). 2023;136(13):1566-1572. Published 2023 Jul 5. doi:10.1097/CM9.0000000000002484. 4. Ma H, Li X, Wang Z, et al. The effect of intraoperative goal-directed fluid therapy combined with enhanced recovery after surgery program on postoperative complications in elderly patients undergoing thoracoscopic pulmonary resection: a prospective randomized controlled study. Perioper Med (Lond). 2023;12(1):33. Published 2023 Jul 10. doi:10.1186/s13741-023-00327-x. 5. Schaller SJ, Fuest K, Ulm B, et al. Goal-directed Perioperative Albumin Substitution Versus Standard of Care to Reduce Postoperative Complications - A Randomized Clinical Trial (SuperAdd Trial) [published online ahead of print, 2023 Jul 21]. Ann Surg. 2023;10.1097/SLA.0000000000006030. doi:10.1097/SLA.0000000000006030. 6. Chui J, Craen R, Dy-Valdez C, et al. Early Goal-directed Therapy During Endovascular Coiling Procedures Following Aneurysmal Subarachnoid Hemorrhage: A Pilot Prospective Randomized Controlled Study. J Neurosurg Anesthesiol. 2022;34(1):35-43. doi:10.1097/ANA.0000000000000700. 7. Froghi F, Gopalan V, Anastasiou Z, Koti R, Gurusamy K, Eastgate C, et al. Effect of postoperative goal-directed fluid therapy (GDFT) on organ function after orthotopic liver transplantation: Secondary outcome analysis of the COLT randomised control trial. Int J Surg. 2022;99:106265. 8. Hokenek UD, Gurler HK, Saracoglu A, Kale A, Saracoglu KT. Pleth Variability Index Guided Volume Optimisation in Major Gynaecologic Surgery. J Coll Physicians Surg Pak. 2022;32(8):980-6. 9. Mishra N, Rath GP, Bithal PK, Chaturvedi A, Chandra PS, Borkar SA. Effect of Goal-Directed Intraoperative Fluid Therapy on Duration of Hospital Stay and Postoperative Complications in Patients Undergoing Excision of Large Supratentorial Tumors. Neurol India. 2022;70(1):108-114. doi:10.4103/0028-3886.336329. 10. Turkut N, Altun D, Canbolat N, Uzuntürk C, Şen C, Çamcı AE. Comparison of Stroke Volume Variation-based goal-directed Therapy Versus Standard Fluid Therapy in Patients Undergoing Head and Neck Surgery: A Randomized Controlled Study. Balkan Med J. 2022;39(5):351-357. doi:10.4274/balkanmedj.galenos.2022.2022-1-88. 11. Wongtangman K, Wilartratsami S, Hemtanon N, Tiviraj S, Raksakietisak M. Goal-Directed Fluid Therapy Based on Pulse-Pressure Variation Compared with Standard Fluid Therapy in Patients Undergoing Complex Spine Surgery: A Randomized Controlled Trial. Asian Spine J. 2022;16(3):352-60. 12. Bloria SD, Panda NB, Jangra K, Bhagat H, Mandal B, Kataria K, et al. Goal-directed Fluid Therapy Versus Conventional Fluid Therapy During Craniotomy and Clipping of Cerebral Aneurysm: A Prospective Randomized Controlled Trial. J Neurosurg Anesthesiol. 2022;34(4):407-14. 13. Cho HJ, Huang YH, Poon KS, Chen KB, Liao KH. Perioperative hemodynamic optimisation in laparoscopic sleeve gastrectomy using stroke volume variation to reduce postoperative nausea and vomiting. Surg Obes Relat Dis. 2021;17(9):1549-57. 14. Li M, Peng M. Prospective comparison of the effects of intraoperative goal-directed fluid therapy and restrictive fluid therapy on complications in thoracoscopic lobectomy. J Int Med Res. 2021;49(12):3000605211062787. 15. Liu Y, Chen G, Gao J, Chi M, Mao M, Shi Y, et al. Effect of different levels of stroke volume variation on the endothelial glycocalyx of patients undergoing colorectal surgery: A randomised clinical trial. Exp Physiol. 2021;106(10):2124-32. 16. Omar IH, Okasha AS, Ahmed AM, Saleh RS. Goal Directed Fluid Therapy based on Stroke Volume Variation and Oxygen Delivery Index using Electrical Cardiometry in patients undergoing Scoliosis Surgery. Egyptian Journal of Anaesthesia. 2021;37(1):241-7. 17. Taylor RJ, Patel R, Wolf BJ, Stoll WD, Hornig JD, Skoner JM, et al. Intraoperative vasopressors in head and neck free flap reconstruction. Microsurgery. 2021;41(1):5-13. 18. Tribuddharat S, Sathitkarnmanee T, Ngamsangsirisup K, Nongnuang K. Efficacy of Intraoperative Hemodynamic Optimization Using FloTrac/EV1000 Platform for Early Goal-Directed Therapy to Improve Postoperative Outcomes in Patients Undergoing Coronary Artery Bypass Graft with Cardiopulmonary Bypass: A Randomized Controlled Trial. Med Devices (Auckl). 2021;14:201-9. 19. Wang X, Duan Y, Gao Z, Gu J. Effect of Goal-directed Fluid Therapy on the Shedding of the Glycocalyx Layer in Retroperitoneal Tumour Resection. J Coll Physicians Surg Pak. 2021;31(10):1179-85. 20. Chui J, Craen R, Dy-Valdez C, Alamri R, Boulton M, Pandey S, et al. Early Goal-directed Therapy During Endovascular Coiling Procedures Following Aneurysmal Subarachnoid Hemorrhage: A Pilot Prospective Randomized Controlled Study. J Neurosurg Anesthesiol. 2022;34(1):35-43. 21. Fischer MO, Lemoine S, Tavernier B, Bouchakour CE, Colas V, Houard M, et al. Individualised Fluid Management Using the Pleth Variability Index: A Randomised Clinical Trial. Anesthesiology. 2020;133(1):31-40. 22. Martin D, Koti R, Gurusamy K, Longworth L, Singh J, Froghi F, et al. The cardiac output optimisation following liver transplant (COLT) trial: a feasibility randomised controlled trial. HPB (Oxford). 2020;22(8):1112-20. 23. Cesur S, Cardakozu T, Kus A, Turkyilmaz N, Yavuz O. Comparison of conventional fluid management with PVI-based goal-directed fluid management in elective colorectal surgery. J Clin Monit Comput. 2019;33(2):249-57. 24. Coeckelenbergh S, Delaporte A, Ghoundiwal D, Bidgoli J, Fils JF, Schmartz D, et al. Pleth variability index versus pulse pressure variation for intraoperative goal-directed fluid therapy in patients undergoing low-to-moderate risk abdominal surgery: a randomised controlled trial. BMC Anesthesiol. 2019;19(1):34. 25. Bahlmann H, Hahn RG, Nilsson L. Pleth variability index or stroke volume optimisation during open abdominal surgery: a randomised controlled trial. BMC Anesthesiol. 2018;18(1):115. 26. Calvo-Vecino JM, Ripolles-Melchor J, Mythen MG, Casans-Frances R, Balik A, Artacho JP, et al. Effect of goal-directed haemodynamic therapy on postoperative complications in low-moderate risk surgical patients: a multicentre randomised controlled trial (FEDORA trial). Br J Anaesth. 2018;120(4):734-44. 27. Gerent ARM, Almeida JP, Fominskiy E, Landoni G, de Oliveira GQ, Rizk SI, et al. Effect of postoperative goal-directed therapy in cancer patients undergoing high-risk surgery: a randomised clinical trial and meta-analysis. Crit Care. 2018;22(1):133. 28. Liu TJ, Zhang JC, Gao XZ, Tan ZB, Wang JJ, Zhang PP, et al. Clinical research of goal-directed fluid therapy in elderly patients with radical resection of bladder cancer. J Cancer Res Ther. 2018;14(Supplement):S173-S9. 29. Myles PS, Bellomo R, Corcoran T, Forbes A, Peyton P, Story D, et al. Restrictive versus Liberal Fluid Therapy for Major Abdominal Surgery. N Engl J Med. 2018;378(24):2263-74. 30. Yin K, Ding J, Wu Y, Peng M. Goal-directed fluid therapy based on non-invasive cardiac output monitor reduces postoperative complications in elderly patients after gastrointestinal surgery: A randomised controlled trial. Pak J Med Sci. 2018;34(6):1320-5. 31. Kaufmann KB, Stein L, Bogatyreva L, Ulbrich F, Kaifi JT, Hauschke D, et al. Oesophageal Doppler guided goal-directed haemodynamic therapy in thoracic surgery - a single centre randomised parallel-arm trial. Br J Anaesth. 2017;118(6):852-61. 32. Liang M, Li Y, Lin L, Lin X, Wu X, Gao Y, et al. Effect of goal-directed fluid therapy on the prognosis of elderly patients with hypertension receiving plasmakinetic energy transurethral resection of prostate. Int J Clin Exp Med. 2017;10(1):1290-6. 33. Xu H, Shu SH, Wang D, Chai XQ, Xie YH, Zhou WD. Goal-directed fluid restriction using stroke volume variation and cardiac index during one-lung ventilation: a randomised controlled trial. J Thorac Dis. 2017;9(9):2992-3004. 34. Broch O, Carstens A, Gruenewald M, Nischelsky E, Vellmer L, Bein B, et al. Non-invasive hemodynamic optimisation in major abdominal surgery: a feasibility study. Minerva Anestesiol. 2016;82(11):1158-69. 35. Deschamps A, Hall R, Grocott H, Mazer CD, Choi PT, Turgeon AF, et al. Cerebral Oximetry Monitoring to Maintain Normal Cerebral Oxygen Saturation during High-risk Cardiac Surgery: A Randomized Controlled Feasibility Trial. Anesthesiology. 2016;124(4):826-36. 36. Kassim DY, Esmat IM. Goal directed fluid therapy reduces major complications in elective surgery for abdominal aortic aneurysm: Liberal versus restrictive strategies. Egyptian Journal of Anaesthesia. 2016;32(2):167-73. 37. Li S, Ma Q, Yang Y, Lu J, Zhang Z, Jin M, et al. Novel Goal-Directed Hemodynamic Optimization Therapy Based on Major Vasopressor during Corrective Cardiac Surgery in Patients with Severe Pulmonary Arterial Hypertension: A Pilot Study. Heart Surg Forum. 2016;19(6):E297-E302. 38. Schmid S, Kapfer B, Heim M, Bogdanski R, Anetsberger A, Blobner M, et al. Algorithm-guided goal-directed haemodynamic therapy does not improve renal function after major abdominal surgery compared to good standard clinical care: a prospective randomised trial. Crit Care. 2016;20:50. 39. Ackland GL, Iqbal S, Paredes LG, Toner A, Lyness C, Jenkins N, et al. Individualised oxygen delivery targeted haemodynamic therapy in high-risk surgical patients: a multicentre, randomised, double-blind, controlled, mechanistic trial. Lancet Respir Med. 2015;3(1):33-41. 40. Benes J, Haidingerova L, Pouska J, Stepanik J, Stenglova A, Zatloukal J, et al. Fluid management guided by a continuous non-invasive arterial pressure device is associated with decreased postoperative morbidity after total knee and hip replacement. BMC Anesthesiol. 2015;15:148. 41. Correa-Gallego C, Tan KS, Arslan-Carlon V, Gonen M, Denis SC, Langdon-Embry L, et al. Goal-Directed Fluid Therapy Using Stroke Volume Variation for Resuscitation after Low Central Venous Pressure-Assisted Liver Resection: A Randomised Clinical Trial. J Am Coll Surg. 2015;221(2):591-601. 42. Funk DJ, HayGlass KT, Koulack J, Harding G, Boyd A, Brinkman R. A randomised controlled trial on the effects of goal-directed therapy on the inflammatory response open abdominal aortic aneurysm repair. Crit Care. 2015;19(1):247. 43. Jammer I, Tuovila M, Ulvik A. Stroke volume variation to guide fluid therapy: is it suitable for high-risk surgical patients? A terminated randomised controlled trial. Perioper Med (Lond). 2015;4:6. 44. Lai CW, Starkie T, Creanor S, Struthers RA, Portch D, Erasmus PD, et al. Randomised controlled trial of stroke volume optimisation during elective major abdominal surgery in patients stratified by aerobic fitness. Br J Anaesth. 2015;115(4):578-89. 45. Mikor A, Trasy D, Nemeth MF, Osztroluczki A, Kocsi S, Kovacs I, et al. Continuous central venous oxygen saturation assisted intraoperative hemodynamic management during major abdominal surgery: a randomised, controlled trial. BMC Anesthesiol. 2015;15:82. 46. Cowie DA, Nazareth J, Story DA. Cerebral oximetry to reduce perioperative morbidity. Anaesth Intensive Care. 2014;42(3):310-4. 47. Zeng K, Li Y, Liang M, Gao Y, Cai H, Lin C. The influence of goal-directed fluid therapy on the prognosis of elderly patients with hypertension and gastric cancer surgery. Drug Des Devel Ther. 2014;8:2113-9. 48. Chattopadhyay S, Mittal S, Christian S, Terblanche AL, Patel A, Biliatis I, et al. The role of intraoperative fluid optimisation using the esophageal Doppler in advanced gynecological cancer: early postoperative recovery and fitness for discharge. Int J Gynecol Cancer. 2013;23(1):199-207. 49. Goepfert MS, Richter HP, Zu Eulenburg C, Gruetzmacher J, Rafflenbeul E, Roeher K, et al. Individually optimised hemodynamic therapy reduces complications and length of stay in the intensive care unit: a prospective, randomised controlled trial. Anesthesiology. 2013;119(4):824-36. 50. Jones C, Kelliher L, Dickinson M, Riga A, Worthington T, Scott MJ, et al. Randomised clinical trial on enhanced recovery versus standard care following open liver resection. Br J Surg. 2013;100(8):1015-24. 51. Salzwedel C, Puig J, Carstens A, Bein B, Molnar Z, Kiss K, et al. Perioperative goal-directed hemodynamic therapy based on radial arterial pulse pressure variation and continuous cardiac index trending reduces postoperative complications after major abdominal surgery: a multi-center, prospective, randomised study. Crit Care. 2013;17(5):R191. 52. Challand C, Struthers R, Sneyd JR, Erasmus PD, Mellor N, Hosie KB, et al. Randomised controlled trial of intraoperative goal-directed fluid therapy in aerobically fit and unfit patients having major colorectal surgery. Br J Anaesth. 2012;108(1):53-62. 53. Cohn SM, Pearl RG, Acosta SM, Nowlin MU, Hernandez A, Guta C, et al. A prospective randomised pilot study of near-infrared spectroscopy-directed restricted fluid therapy versus standard fluid therapy in patients undergoing elective colorectal surgery. Am Surg. 2010;76(12):1384-92. 54. Rhodes A, Cecconi M, Hamilton M, Poloniecki J, Woods J, Boyd O, et al. Goal-directed therapy in high-risk surgical patients: a 15-year follow-up study. Intensive Care Med. 2010;36(8):1327-32. 55. Van der Linden PJ, Dierick A, Wilmin S, Bellens B, De Hert SG. A randomised controlled trial comparing an intraoperative goal-directed strategy with routine clinical practice in patients undergoing peripheral arterial surgery. Eur J Anaesthesiol. 2010;27(9):788-93. 56. Senagore AJ, Emery T, Luchtefeld M, Kim D, Dujovny N, Hoedema R. Fluid management for laparoscopic colectomy: a prospective, randomised assessment of goal-directed administration of balanced salt solution or hetastarch coupled with an enhanced recovery program. Dis Colon Rectum. 2009;52(12):1935-40. 57. Harten J, Crozier JE, McCreath B, Hay A, McMillan DC, McArdle CS, et al. Effect of intraoperative fluid optimisation on renal function in patients undergoing emergency abdominal surgery: a randomised controlled pilot study (ISRCTN 11799696). Int J Surg. 2008;6(3):197-204. 58. Chytra I, Pradl R, Bosman R, Pelnar P, Kasal E, Zidkova A. Esophageal Doppler-guided fluid management decreases blood lactate levels in multiple-trauma patients: a randomised controlled trial. Crit Care. 2007;11(1):R24. 59. Donati A, Loggi S, Preiser JC, Orsetti G, Munch C, Gabbanelli V, et al. Goal-directed intraoperative therapy reduces morbidity and length of hospital stay in high-risk surgical patients. Chest. 2007;132(6):1817-24. 60. Murkin J, Adams S. novick RJ, Quantz M, Bainbridge D, iglesias i, Cleland A, Schaefer B, irwin B, Fox S: Monitoring brain oxygen saturation during coronary bypass surgery: A randomised, prospective study. Anesth Analg. 2007;104:51-8. 61. Lobo SM, Lobo FR, Polachini CA, Patini DS, Yamamoto AE, de Oliveira NE, et al. Prospective, randomised trial comparing fluids and dobutamine optimisation of oxygen delivery in high-risk surgical patients [ISRCTN42445141]. Crit Care. 2006;10(3):R72. 62. Noblett SE, Snowden CP, Shenton BK, Horgan AF. Randomised clinical trial assessing the effect of Doppler-optimised fluid management on outcome after elective colorectal resection. Br J Surg. 2006;93(9):1069-76. 63. Pearse R, Dawson D, Fawcett J, Rhodes A, Grounds RM, Bennett ED. Early goal-directed therapy after major surgery reduces complications and duration of hospital stay. A randomised, controlled trial [ISRCTN38797445]. Crit Care. 2005;9(6):R687-93. 64. McKendry M, McGloin H, Saberi D, Caudwell L, Brady AR, Singer M. Randomised controlled trial assessing the impact of a nurse delivered, flow monitored protocol for optimisation of circulatory status after cardiac surgery. BMJ. 2004;329(7460):258. 65. Conway DH, Mayall R, Abdul-Latif MS, Gilligan S, Tackaberry C. Randomised controlled trial investigating the influence of intravenous fluid titration using oesophageal Doppler monitoring during bowel surgery. Anaesthesia. 2002;57(9):845-9. 66. Ueno S, Tanabe G, Yamada H, Kusano C, Yoshidome S, Nuruki K, et al. Response of patients with cirrhosis who have undergone partial hepatectomy to treatment aimed at achieving supranormal oxygen delivery and consumption. Surgery. 1998;123(3):278-86. 67. Bender JS, Smith-Meek MA, Jones CE. Routine pulmonary artery catheterisation does not reduce morbidity and mortality of elective vascular surgery: results of a prospective, randomised trial. Ann Surg. 1997;226(3):229-36; discussion 36-7. 68. Sinclair S, James S, Singer M. Intraoperative intravascular volume optimisation and length of hospital stay after repair of proximal femoral fracture: randomised controlled trial. BMJ. 1997;315(7113):909-12. 69. Boyd O, Grounds RM, Bennett ED. A randomised clinical trial of the effect of deliberate perioperative increase of oxygen delivery on mortality in high-risk surgical patients. JAMA. 1993;270(22):2699-707. 70. Joyce WP, Provan JL, Ameli FM, McEwan MM, Jelenich S, Jones DP. The role of central haemodynamic monitoring in abdominal aortic surgery. A prospective randomised study. Eur J Vasc Surg. 1990;4(6):633-6. |
||
Study characteristics
|
Study |
Type of surgery |
Goal directed fluid therapy |
Conventional fluid therapy |
Riskof Bias |
Definition SSI |
||
|
Tools and goals |
Intervention |
Tools and goals |
Intervention |
||||
|
Aaen 2021 |
Emergency surgery for obstructive bowel disease or GI perforation |
Arterial line (FloTrac/EV1000)
|
Colloids |
- |
Crystalloids, colloids, vasopressors |
Low |
Superficial wound infection: Wound rupture, surgical revision or medical treatment |
|
SV increase <10%, MAP >65 mmHg |
Vasopressors |
MAP >65 mmHg, UO >0.5 ml/kg/h |
Vasopressors |
||||
|
Arslan-Carlon 2020 |
Open radical cystectomy |
Arterial line (FloTrac/Vigileo)
|
Crystalloids, colloids |
- |
Colloids, RBC |
Low |
NI |
|
SV increase ≤10%, SVV <8% MAP ≥60 mmHg, CI 2.5 |
Inotropes, vasoconstrictors |
Hb >7 mg/dl
|
Ephedrine, phenylephrine |
||||
|
Bahlmann 2019 |
Open thoracotomy |
Arterial line (FloTrac/Vigileo) |
Crystalloids, colloids, fresh frozen plasma, RBC |
- |
Colloids |
SC |
Superficial SSI: Local inflammatory signs and specific antibiotic treatment |
|
SV <10%, CI ≥2.5 l/min/m2, MAP >65 mmHg |
Dobutamine, phenylephrine, norepinephrine |
Discretion anaesthetist (Hb >90/100 g/l) |
Dobutamine, phenylephrine, norepinephrine |
||||
|
Bartha 2014 |
Proximal femoral fracture surgery |
Arterial line (LiDCO) |
Colloids
|
- |
Crystalloids |
Low |
Deep and/or superficial with purulent exudate and treated by antibiotic |
|
SV <10% increase, DO2I ≥600 ml/min, SBP decrease <30% |
Dobutamine |
SBP decrease <30% |
Vasoactive substances |
||||
|
Benes 2010 |
Major abdominal surgery >120 min (colorectal or pancreatic resections, intra-abdominal vascular surgery) |
Arterial line (FloTrac/Vigileo)
|
Colloid |
- |
Crystalloids, colloids |
SC |
CDC |
|
SVV <10% , CVP >15 mmHg, CI 2.5-4.0 l/min/m2, SAP >90 mmHg, MAP >65 mmHg |
Dobutamine, ephedrine, norepinephrine |
MAP >65 mmHg, HR<100 bpm, CVP 8-15 mmHg, UO>0.5 ml/kg/h |
Vasoactive substances |
||||
|
Bisgaard 2013 – Trauma |
Open elective lower limb arterial surgery |
Arterial line (LiDCO)
|
Colloids |
Arterial line |
Fluid therapy |
SC |
NI |
|
SVI increase >10%, DO2I <600 ml/min/m2, HR <100 or <20% above baseline, acute hypotension |
Phenylephrine, ephedrine, |
MAP 60–100 mmHg, SaO2 > 94%, Hb ≥ 9.3 g/l, Temp > 36.5°C, HR <100 or <20% above baseline |
Phenylephrine, ephedrine |
||||
|
Bisgaard 2013 – Vascular
|
Open elective abdominal aortic surgery |
Arterial line (LiDCOplus)
|
Colloids |
Arterial line |
Colloids, RBCs |
SC |
NI |
|
SVI increase >10%, DO2I <600 ml/min/m2, MAP >65 mmHg or >70% of baseline |
Phenylephrine, ephedrine |
MAP >65 mmHg or >70% of baseline |
Phenylephrine, ephedrine, dobutamine |
||||
|
Brandstrup 2012 |
Colorectal resection, open and laparoscopic |
Oesophageal Doppler (CardioQ) |
Colloids |
- |
Colloids
|
SC |
NI |
|
SV increase <10% |
Phenylephrine, ephedrine
|
MAP >60 mmHg |
Phenylephrine, ephedrine |
||||
|
Calvo-Vecino 2018 |
Abdominal, urological, gynaecological, orthopaedic surgery (estimated duration ≥2h, blood loss >15%, or ≥2 packs RBC) |
Oesophageal Doppler (CardioQ)
|
Crystalloids, colloids |
- |
Discretion anaesthetist: crystalloids, colloids |
Low |
Presumably CDC |
|
SV <10% increase, MAP >65 mmHg, CI >2.5 l/min/m2 |
Vasopressors, inotropes |
Avoid extremes of clinical practice misalignment |
Discretion anaesthetist: dobutamine, norepinephrine |
||||
|
Cecconi 2011 |
Total hip arthroplasty |
Arterial line (FloTrac/Vigileo)
|
Crystalloids, colloids |
- |
Colloids |
SC |
¶ |
|
SV increase <10%, DO2I ≥600ml/min/m2 |
Dobutamine |
Discretion anaesthetist MAP >65 mmHg |
Ephedrine |
||||
|
Cheng 2020 |
Cardiac surgery (valvular surgery and/or coronary artery bypass grafting with CPB) |
Arterial line (LiDCOrapid), INVOS, BIS |
Crystalloids, RBCs
|
INVOS, BIS |
Crystalloids, RBCs
|
Low |
NI |
|
rScO2 decline <20%, MAP <20% decline, CI ≥2 l/min/m2, BIS 40-45/45-60 |
Norepinephrine, dobutamine, propofol |
HR 60-100 bpm, ScVO2 >70%, lactate <3 mmol/L, Ht >28%, UO >0.5 mL/kg/h, MAP = 65mmHg |
Norepinephrine, dobutamine |
||||
|
Colantonio 2015 |
Open peritonectomy and HIPEC |
Arterial line (FloTrac/Vigileo)
|
Colloids |
CVC, arterial line |
Colloids |
SC |
NI |
|
CI ≥2.5 l/min/m2, SVI ≥35ml/m2, SVV <15% |
Dobutamine |
MAP 65-90 mmHg or >70% pre-induction, CVP >15 mmHg, diuresis >1 ml/kg/h |
Dopamine |
||||
|
Davies 2019 |
Emergency proximal femoral fracture surgery |
Finger cuff (Clearsight system)
|
Colloids |
- |
Crystalloids |
Low |
Wound infection: Deep and/or superficial with purulent exudate and treated by antibiotics |
|
SVV <10%, MAP within 30% of baseline |
Phenylephrine, metaraminol |
Discretion anaesthetist |
Inotropes, vasopressors |
||||
|
De Waal 2021 |
High risk abdominal surgery (esophagectomy, pancreaticoduode- nectomy, open abdominal aortic aneurysm repair, major abdominal resections for soft tissue malignancy) |
Arterial line (FloTrac/Vigileo)
|
Crystalloids, colloids |
Arterial and central venous line |
Crystalloids, colloids |
SC |
NI |
|
CI ≥ 2.8/2.6/2.4 or <10% increase l min/m2, SVV <12%
|
Inotropes |
HR <100 min or ≤25% above individual baseline MAP ≥ 60 mmHg or ≤25% below individual baseline, saturation ≥ 95% |
Vasopressors |
||||
|
Diaper 2021 |
Major abdominal, urological, or vascular surgery via open laparotomy (≥2h)
|
Arterial line (LiDCO)
|
Crystalloids, colloids |
Arterial line (LiDCO)
|
Crystalloids, colloids |
Low |
CD ³2 |
|
SVI <10%, MAP decrease <20% or >65-70 mmHg, PPV <10% |
Ephedrine, phenylephrine, norepinephrine |
MAP >65-70 mmHg, fluid losses, hypovolemia, metabolic acidosis |
Ephedrine, phenylephrine, noradrenaline |
||||
|
Elgendy 2017 |
Major abdominal surgery (duration >120 min or blood loss >20%) |
Arterial line (FloTrac/Vigileo)
|
Colloids |
- |
Colloids |
SC |
NI |
|
SVV <12%, CI >2.5, MAP >65mmHg |
Dobutamine, norepinephrine |
60 and 90 mmHg with CVP in range of 8–12 mmHg and UO of >0.5 ml/kg/h |
Dobutamine, norepinephrine |
||||
|
Forget 2010 |
Gastrointestinal of hepato-biliary surgery |
Pulse oximeter (Masimo)
|
Colloids |
- |
Colloids |
Low |
NI |
|
PVI <13%, MAP >65 mmHg |
Norepinephrine |
Blood loss <50 ml, MAP >65 mmHg, CVP >6 mmHg |
Norepinephrine |
||||
|
Gan 2002 |
Major elective general, urologic, and gynaecologic surgery (blood loss >500 ml) |
Oesophageal Doppler |
Colloids
|
- |
Fluids |
SC |
NI |
|
FTc >350 ms, SV increase <10%
|
- |
UO >0.5 ml/kg/h, HR <120% baseline or <110 bpm, SBP decrease <20% baseline or >90 mmHg, CVP decrease <20% of baseline |
- |
||||
|
Göçmen 2023 |
Proximal femoral nail surgery |
Arterial line, MostcarTM monitor
SVV<13%, PPV<10%, CI>2.5L/min/m2, MAP>65 mmHg
|
Colloids, crystalloids
Norepinephrine |
According to ‘4-2-1 formula’ |
Crystalloids, colloids
|
SC |
NI |
|
Godai 2019
|
Elective open gynaecological surgery |
Arterial line (FloTrac/Vigileo), Life Scope J |
Colloids |
Life Scope J |
Discretion anaesthetist |
SC |
Postop complications: including infection of organs and leakage at the anastomosis site |
|
MAP <60 mmHg, PPV ≤13%, pulse index increasing in 15 min |
Phenylephrine, dobutamine |
MAP >60 mmHg |
Discretion anaesthetist |
||||
|
Gómez-Izquierdo 2017 |
Laparoscopic colorectal surgery |
Oesophageal Doppler
|
Colloids |
- |
Discretion anaesthetist |
Low |
CDC |
|
SV <10%
|
Discretion anaesthetist |
Discretion anaesthetist |
Discretion anaesthetist |
||||
|
Jammer 2010 |
Elective open colorectal and lower intestinal surgery |
Central venous line
|
Colloids |
- |
Crystalloids |
Low |
¤ |
|
ScvO2 >75%, MAP >60 mmHg
|
- |
- |
- |
||||
|
Kaufmann 2018 |
Hip arthroplasty |
Oesophageal Doppler (Deltex)
|
Crystalloids, RBC |
- |
Crystalloids |
Low |
Wound healing disorder: drainage of pus from the surgical wound |
|
MAP >70 mmHg, SV increase <10%, CI >2.5 l/min/m2 |
Norepinephrine, ephedrine |
MAP >60 mmHg or <20% decrease from baseline, UO >0.5 ml/kg/h, HR <20% increase from baseline |
Norepinephrine, dobutamine, epinephrine, ephedrine |
||||
|
Kim 2018 |
Free flap reconstruction |
Arterial line (FloTrac)
|
Colloids |
- |
Crystalloids |
SC |
NI |
|
SVV <12%, CI ≥2.5 l/min/m2, MAP ≥65 mmHg, HR <100 bpm |
Dobutamine, ephedrine, norepinephrine |
MAP >65 mmHg, UO >0.5ml/kg/h |
Ephedrine, norepinephrine |
||||
|
Kumar 2016 |
Major abdominal surgery (pancreaticoduode-nectomy, low anterior resection, retroperitoneal tumour resection, gastrectomy) |
Arterial line (FloTrac/Vigileo) |
Crystalloids, colloids |
- |
Discretion anaesthetist
|
High |
NI |
|
SVV <10% |
-
|
CVP 10-12 mmHg |
- |
||||
|
Kumar 2015 |
‘High-risk’ (patient or surgery related factors) abdominal surgery |
Arterial line (FloTrac/Vigileo) |
Crystalloids, colloids
|
- |
Crystalloids, colloids |
High |
NI |
|
CI ≥2.5 L/min, O2ER ≤ 27%, MAP 65 mmHg, SVV <10% |
Dopamine, dobutamine, norepinephrine |
MAP ≥65 mmHg, CVP ≥8–10 mmHg, UO ≥0.5 mL/kg/h, ScVO2 ≥70% |
Dobutamine, noradrenaline |
||||
|
Liu 2021 |
Elective open gastrointestinal surgery (duration >2h) |
Arterial line (Vigileo/FloTrac)
|
Colloids |
- |
Discretion anaesthetist: crystalloids, colloids |
Low |
SSI: clinical diagnosis Intra-abdominal infection: CT-confirmed |
|
SVV <12%, CI ≥2.5 l/min/m2, MAP >65 mmHg |
Inotropes, vasoactive agents |
HR <100 bpm, MAP >65 mmHg, UO >0.5ml/kg/h |
Discretion anaesthetist: vasoactive agents |
||||
|
Liu 2019 |
Laparoscopic colorectal surgery |
Arterial line (FloTrac/Vigileo)
|
Colloids |
- |
Crystalloids, colloids |
High |
NI |
|
SVV <13%, CI >2.5 l/min/m2 |
Dobutamine |
UO > 5-10 ml/kg/h, SBP and HR variation <20% |
Dobutamine, norepinephrine, nitroglycerin |
||||
|
Lopes 2007 |
‘High-risk’ surgery (gastrointestinal, hepatobiliary, urology) |
IBPplus/DX 2020
|
Colloids |
- |
- |
SC |
NI |
|
ΔPP ≤10% |
- |
Discretion of anaesthetist
|
- |
||||
|
Luo 2017 |
Elective craniotomy (duration >2h) |
Arterial line (FloTrac/Vigileo)
|
Colloids |
- |
Discretion anaesthetist and intensivist |
SC |
NI |
|
MAP ≥65 mmHg, CI ≥2.5 l/min/m2, SVV <15% |
Vasopressors |
Discretion anaesthetist and intensivist |
Discretion anaesthetist and intensivist |
||||
|
Mahrose 2023 |
Elective open resection colon cancer mass with anastomosis |
Arterial line (CARESCAPETM B650) |
Colloids |
Central venous catheter (Certofix) |
Crystalloids, colloids |
SC |
NI |
|
PPV <12%, MAP >65 mmHg |
Ephedrine |
MAP <0-30% baseline or >65 mmHg |
Ephedrine |
||||
|
Mayer 2010 |
Open major abdominal surgery (pancreaticoduo-denectomy, intestine, gastric liver, or oesophageal resection) |
Arterial line (FloTrac/Vigileo)
|
Crystalloids, Colloids |
- |
Crystalloids, colloids |
Low |
Wound infection: clinical diagnosis. Abdominal infection: Abdominal CT |
|
CI >2.5L/min/m2, MAP >65mmHg, SVI >35mL/m2 |
Norepinephrine, dobutamine |
MAP 65-90 mmHg, CVP 8-12 mmHg, UO >0.5 mL/kg/h |
- |
||||
|
McKenny 2013 |
Open excision of malignancy of the uterus and/or adnexa |
Oesophageal Doppler |
Colloids
|
Arterial line |
Discretion anaesthetist |
SC |
Infection: on antibiotics and/or Temperature >38 °C in last 24h |
|
SV increase <10%
|
- |
UO >0.5ml/kg/h, HR, SBP, CVP, blood loss |
Discretion anaesthetist |
||||
|
Mishra 2022 |
Neurosurgery (excision supratentorial tumours ≥4 cm) |
Arterial line (FloTrac/Vigileo)
|
Crystalloids, colloids |
- |
Colloids |
Low |
NI |
|
SVV <12%, CI > 2.5L/min/m2, MAP >60 mmHg, |
Dobutamine, ephedrine |
MAP 65-90 mmHg, CVP 8-12 mmHg, UO >0.5 ml/kg/h |
Vasoactive agents |
||||
|
Nicklas 2020 |
Major abdominal surgery (≥90 min or blood loss >1000 ml) |
Arterial line (ProAQT)
|
Colloids |
Arterial line |
Discretion anaesthetist: crystalloids, colloids |
Low |
NI |
|
CI ≥ personal baseline, MAP 65-90 mmHg, HR <120 BPM |
Dobutamine, phenylephrine, norepinephrine |
MAP >65 mmHg |
Discretion anaesthetist: norepinephrine |
||||
|
Osawa 2016 |
Cardiac surgery (coronary artery bypass grafting (CABG) and/or valvular surgery) |
Arterial line (LiDCOrapid)
|
Crystalloids, RBCs |
- |
Crystalloids, RBCs |
Low |
CDC |
|
CI >3L/min/m2, SVI >35ml/m2, Ht >28%, CVP increase >4% |
Dobutamine |
HR 70-100 bpm, Svco2 >70%, lactate <3 mmol/L, Ht >28%, UO >0.5 mL/kg/h |
Dobutamine |
||||
|
Pearse 2014 |
Major gastrointestinal surgery (>90 min, high-risk patient criteria) |
Arterial line (LiDCOrapid)
|
Colloids |
CVC |
- |
Low |
CDC |
|
SV <10% increase, HR <120% baseline or <100 bpm
|
Dopexamine |
‘Usual perioperative care’ (dynamic central venous pressure target) |
- |
||||
|
Peng 2014 |
Elective major orthopaedic surgery (blood loss >800 ml) |
Arterial line (FloTrac/Vigileo)
|
Colloid, RBCs |
CVC, arterial line |
Crystalloids, colloids, RBCs |
SC |
NI |
|
SVV increase <10/14%, MAP >65 mmHg, Hb >10 g/l |
Ephedrine |
MAP >65 mmHg, HR <100 bpm, CVP 8–14 mmHg, UO >0.5 ml/kg/h, Hb >10 g/l
|
Ephedrine |
||||
|
Pestaña 2014 |
Open colorectal surgery, gastrectomy, small bowel resection |
NICOM |
Colloids
|
|
Discretion anaesthetist and ICU specialist |
SC |
Pus expressed from the incision or aspired from mass within the wound |
|
MAP ≥65 mmHg, CI ≥2.5 L/min/m2 |
Dobutamine, norepinephrine, |
‘Standard of care’ |
Discretion anaesthetist and ICU specialist |
||||
|
Phan 2014 |
Elective open or laparoscopic major colorectal surgery |
Oesophageal Doppler |
Colloids
|
- |
Crystalloids
|
Low |
NI |
|
SVI >35ms/m2, %, FTc <360 msec
|
- |
Replace blood loss or hypotension not responsive to vasopressor |
Vasopressors |
||||
|
Pillai 2011 |
Open radical cystectomy |
Oesophageal Doppler
|
Colloids |
- |
Fluids |
SC |
NI |
|
SV increase <10%, FTc >350ms
|
- |
Discretion anaesthetist |
- |
||||
|
Ranucci 2018 |
Cardiopulmonary bypass (≥90 min) |
NI
|
RBCs, increasing pump flow |
- |
- |
Low |
NI |
|
DO2 >280 mL/min/m2, SvO2 >68%, oxygen extraction rate <40% |
- |
Arterial pump flow 2.4 L/min/m2 at normothermia. Local standards |
- |
||||
|
Reisinger 2017 |
Elective open or laparoscopic colorectal surgery |
Oesophageal Doppler
|
Crystalloids, colloids |
- |
Crystalloids, colloids |
Low |
NI |
|
SVI increase <10%
|
Vasoactive drugs, inotropic drugs |
Standard hemodynamic and clinical parameters |
Vasoactive drugs, inotropic drugs |
||||
|
Sandham 2003 |
Major surgery (abdominal, thoracic, vascular, orthopaedic) |
Pulmonary-artery catheter
|
Fluids, RBCs |
Central venous catheter |
- |
SC |
CDC |
|
DO2I 550-600 ml/min/m2 body-surface area, CI 3.5-4.5 L/m2, MAP >70 mmHg, PCWP 18 mmHg, HR <120 bpm, Ht >27% |
Inotropes, vasodilator therapy, vasopressors |
Central venous pressure |
- |
||||
|
Scheeren 2013 |
‘High risk’ surgery with postoperative ICU care |
Arterial line (FloTrac/Vigileo)
|
Colloids |
- |
- |
High |
NI |
|
SVV <10%, SV decrease <10% |
- |
Standardised protocol
|
- |
||||
|
Shoemaker 1988 |
Mixed surgery in high-risk patients |
Pulmonary artery catheter (CO computer Model 9520) |
Crystalloids, colloids, RBCs
|
Pulmonary artery catheter or CVP |
Crystalloids, colloids, RBCs
|
SC |
NI |
|
CO >4.5 L/min/m2, DO2 >600 ml/min/m2, VO2 >170 ml/min/m2 |
Inotropes, vasodilators, vasopressors |
Normative standards of pulmonary arterial pressures, HR, MAP, CVP, pulmonary capillary wedge pressure |
Inotropes, vasodilators, vasopressors |
||||
|
Smetkin 2009 |
Coronary surgery (off-Pump Coronary Artery Bypass Grafting) |
Arterial line (PiCCOplus/CeVOX)
|
Colloids, RBCs |
Arterial line |
Colloids |
SC |
NI |
|
ITBVI 850-1000 ml/m2, CI >2L/min/m2, HR <90 bpm, MAP 60-90 mmHg, ScvO2 >60% |
Nitroglycerine, furosemide, verapamil, phenylephrine, ephedrine, dobutamine |
CVP 6-14 mmHg, HR <90 bpm, MAP 60-100 mmHg |
Nitroglycerine, furosemide, dobutamine, verapamil, phenylephrine, ephedrine |
||||
|
Srinivasa 2013 |
Elective open or laparoscopic colectomy |
Oesophageal Doppler
|
Colloids |
Arterial line (optional) |
Crystalloids, colloids |
Low |
NI |
|
FTc >350ms, SV increase <10%
|
Discretion anaesthetist: vasopressor |
HR, BP, UO
|
Discretion anaesthetist: vasopressor |
||||
|
Stens 2017 |
Moderate-risk abdominal surgery (grade-2 risk Modified Johns Hopkins Surgical Criteria) |
Finger arterial blood pressure (ccNexfin device) |
Crystalloids, colloids |
- |
Discretion anaesthetist |
SC |
† |
|
MAP >70 mmHg, CI >2.5 l/min/m2 PPV <12% |
Dobutamine, noradrenaline |
MAP >70 mmHg |
Discretion anaesthetist: vasopressors, inotropes |
||||
|
Szturz 2019 |
Open gastrointestinal surgery (>120 min or blood loss >15%) |
Oesophageal Doppler (CardioQ) |
Crystalloids
|
|
Discretion anaesthetist |
Low |
NI |
|
CI 2.5-3.8 l/min/m2, FTc <330ms, PV <70/m, systemic vascular resistance index1000-18000 cdyn.s.cm-5.m-2 |
Dobutamine, norepinephrine, isosorbide dinitrate |
Based on HR, MAP, CVP, diuresis, clinical findings |
Discretion anaesthetist |
||||
|
Tang 2021 |
Minimally invasive oesophagectomy |
Arterial line (PiCCO, Pulsion)
|
Colloids |
|
Crystalloids, colloids |
Low |
NI |
|
SVV <9%
|
- |
According to ‘4-2-1 formula’ |
|
||||
|
Venn 2002 |
Hip fracture surgery |
Oesophageal Doppler
|
Crystalloids, colloids |
CVC |
Colloids |
SC
|
NI |
|
Flow time <0.4s, SV increase <10% |
|
CVP >14 mmHg |
- |
||||
|
Vu 2023 |
Major gastrointestinal surgery |
esCCO monitor |
Crystalloids |
- |
Crystalloids |
SC |
NI |
|
esSVI ≥10%, esCCI >2.5 l/min/m2, |
Dobutamine, ephedrine, phenylephrine |
SBP > 90 mmHg or decrease < 20% of baseline, CV <5 cm cmH2O |
Ephedrine or phenylephrine |
||||
|
Wakeling 2005 |
(Semi-)elective large bowel surgery |
Oesophageal Doppler
|
Colloids |
Routine cardiovascular monitoring |
Routine fluid management |
SC |
Ω |
|
SV <10%, CVP <3 mmHg
|
- |
CVP 12-15 mmHg |
- |
||||
|
Wang 2021 |
Spine surgery
|
Arterial line (InfinityC700)
|
Crystalloids |
- |
Crystalloids |
SC |
NI |
|
PPV <14%, SV increase <10%, MAP >60 mmHg |
Ephedrine, norepinephrine |
MAP >60 mmHg or SBP >90 mmHg, |
Ephedrine, norepinephrine |
||||
|
Wang 2023 |
Major gastrointestinal surgery (gastrectomy, small bowel resection, colorectal surgery) |
Finger sensor (Rainbow R2-25a)
|
Crystalloids, colloids |
CVC |
Crystalloids, colloids |
Low |
Presumably CDC |
|
MAP >65 mmHg, PVI <13% |
Phenylephrine, ephedrine, norepinephrine |
MAP >65 mmHg, CVP >5 mmHg |
Phenylephrine, ephedrine, norepinephrine |
||||
|
Weinberg 2019 |
Hepatic resection |
Arterial line (FloTrac/EV1000)
|
Fluids |
|
Discretion of the anaesthetist |
Low |
CDC |
|
SVV <15/20%, MAP within 20% of baseline, CI >2.2 L/min/m2 |
Venoconstrictor, inotropes, inodilator, vasoconstrictor, antihypertensive, beta-blocker, diuretic |
CVP <8 mmHg |
Discretion of the anaesthetist |
||||
|
Weinberg 2017 |
Pancreaticoduode- nectomy |
Arterial line (FloTrac/EV1000) |
Crystalloids
|
- |
Discretion anaesthetist |
SC |
CDC |
|
SVV <20%, MAP within 20% of baseline, CI >2.0L/min/ m2 |
Inotropes, vasoconstrictors, inodilators, arterial-dilator, beta-blocker, antihypertensive |
Discretion anaesthetist |
Vasoactive medication Discretion anaesthetist |
||||
|
WenKui 2010 |
Elective gastrointestinal neoplasm surgery |
Serum lactate
|
Colloids |
- |
Fluids |
SC |
Surgical evacuation of pus |
|
Serum lactate <1.6 mmol/L
|
- |
HR, BP, UO, CVP, changed body weight |
- |
||||
|
Wijeysundera 2022 |
Elective non-cardiac surgery (postoperative stay >48h |
Arterial line (Flotrac /EV1000)
|
Crystalloids, colloids |
|
Discretion anaesthetist |
Low |
NI |
|
PPV <9%, SVV <5%, SV increase <10%, MAP >60 mmHg, SBP >90 mmHg |
Ephedrine, phenylephrine, norepinephrine |
MAP >60 mmHg, SBP >90 mmHg |
Discretion anaesthetist |
||||
|
Wilson 1999 |
Major surgery (urology, general and vascular surgery) |
Arterial line
|
- |
- |
Discretion anaesthetist |
SC |
NI |
|
DO2I ≥600 ml/min
|
Adrenaline or dopexamine |
- |
Discretion anaesthetist |
||||
|
Wu 2021 |
Elective open or laparoscopic partial nephrectomy |
Arterial line (LiDCO)
|
Crystalloids
|
- |
Crystalloids
|
Low |
§ |
|
SVV <6%, CI 3.0-4.0 l/min/ m2, MAP >95 mmHg |
Dobutamine, norepinephrine |
BP <20% baseline, UO >0.5 ml/kg/h |
Ephedrine |
||||
|
Wu 2017 |
Neurosurgery (supratentorial neoplasm surgery) |
Arterial line (FloTrac/Vigileo), CVC |
Colloids
|
CVC |
Colloids |
SC |
Clinical diagnosis |
|
SVV ≤12%, MAP >70 mmHg, CI ≥2.5 l/min/ m2 |
Ephedrine, phenylephrine, dobutamine |
CVP ≥8 mmHg, MAP ≥70 mmHg or >80% of baseline |
Ephedrine, phenylephrine |
||||
|
Yildiz 2022 |
Open major gynaecologic oncologic surgery (duration >2h) |
Finger sensor |
Crystalloids |
- |
Crystalloids
|
Low |
NI |
|
PVI <13%, MAP >65 mmHg |
Norepinephrine |
MAP >65 mmHg |
Norepinephrine
|
||||
|
Zakhaleva 2013
|
Elective open or laparoscopic bowel resection with primary anastomosis |
Oesophageal Doppler (CardioQ)
|
Colloids |
- |
Crystalloids |
High |
NI |
|
SV increase <10%, FTc >350ms |
- |
Based on loss
|
- |
||||
|
Zhang 2018 |
Spinal stenosis surgery
|
Arterial line (FloTrac/Vigileo) |
Colloids
|
- |
Crystalloids, colloids |
SC |
NI |
|
SVV <14%, SV increase <10% |
- |
According to ‘4-2-1 formula’
|
- |
||||
|
Zhang 2012 |
Elective open gastrointestinal surgery (blood loss <500 ml) |
Arterial line (Datex Ohmeda S/5 Monitor) |
Crystalloids, colloids |
- |
Crystalloids |
SC |
NI |
|
PPV ≤11% |
- |
UO >0.5 ml/kg/h, CVP ≥4 mmHg |
- |
||||
|
Zhao 2018 |
Radical operation of gastrointestinal cancers (stomach, colon, rectum) |
Arterial line (FloTrac/Vigileo)
|
Colloids, Wan Wen, RBCs |
- |
Crystalloids, colloids, RBC |
SC |
NI |
|
SVV <13%, SV <10% increase, Hb ≥ 80 g/l |
Vasoactive agents |
MAP ≥65 mmHg or +/-30% of baseline, HR 60-90 bpm |
- |
||||
|
Abbreviations Bpm = beats per minute; CD = Clavien-Dindo; CDC: Centers for Disease Control and Preventiona; CI = cardiac index; CPB = cardiopulmonary bypass; CVC = central venous catheter; CVP = central venous pressure; CRC = colorectal cancer; FTc = flow time corrected; Hb = haemoglobin; HR = heart rate; Ht = haematocrit; GI = gastrointestinal; ITBVI = intrathoracic blood volume index; MAP = mean arterial pressure; NI = no information; O2ER= oxygen extraction ratio; PCWP = pulmonary-capillary wedge pressure; PP = pulse pressure; PPV = pulse pressure variation; RBC = red blood cell; ROB = risk of bias; rScO2 = regional cerebral oxygen saturation; SaO2 = arterial oxygen saturation; SBP = systolic blood pressure; SC = some concerns; ScVO2 = central venous oxygen saturation; SVI / SV = stroke volume (index); SVV = stroke volume variation; UO = urine output
Definition SSI §: Fever > 38 °C, increased white blood cell count (> 12 × 109/L) and elevated inflammatory biomarkers necessitating upgrading antibiotic treatment ¶ Major complication: Infection (proven Infection, i.e. respiratory, urinary, abdominal, wound with signs of SEPSIS). Minor complication: Uncomplicated infections (not requiring intravenous antibiotic therapy and with no signs of sepsis, i.e. uncomplicated urinary tract infections). ¤ Wound infection: phlegmona + antibiotics or drainage. Intra-abdominal infection: computed tomography + antibiotics Ω Wound complication: wound dehiscence requiring surgical exploration or drainage of pus from the operation wound with or without isolation of organisms. † Postoperative complications were diagnosed by a combination of high clinical suspicion, radiograph or ultrasound evidence (pneumonia, hypervolemia, anastomotic leakage), or laboratory testing (wound infection, pneumonia, urinary tract infection), according to generally applicable guidelines and as reported by a physician in the patient’s medical file.
|
|||||||
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-12-2024
Beoordeeld op geldigheid : 01-12-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules 2 tot 16 is in 2020 op initiatief van de NVvH een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor preventie van postoperatieve wondinfecties. Daarnaast is in 2022 op initiatief van het Samenwerkingsverband Richtlijnen Infectiepreventie (SRI) een separate multidisciplinaire werkgroep samengesteld voor de herziening van de WIP-richtlijn over postoperatieve wondinfecties: module 17-22. De ontwikkelde modules van beide werkgroepen zijn in deze richtlijn samengevoegd.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. prof. dr. M.A. Boermeester |
Chirurg |
* Medisch Ethische Commissie, Amsterdam UMC, locatie AMC * Antibiotica Commissie, Amsterdam UMC |
Persoonlijke financiële belangen Hieronder staan de beroepsmatige relaties met bedrijfsleven vermeld waarbij eventuele financiële belangen via de AMC Research B.V. lopen, dus institutionele en geen persoonlijke gelden zijn: Skillslab instructeur en/of spreker (consultant) voor KCI/3M, Smith&Nephew, Johnson&Johnson, Gore, BD/Bard, TELABio, GDM, Medtronic, Molnlycke.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Institutionele grants van KCI/3M, Johnson&Johnson en New Compliance.
Intellectuele belangen en reputatie Ik maak me sterk voor een 100% evidence-based benadering van maken van aanbevelingen, volledig transparant en reproduceerbaar. Dat is mijn enige belang in deze, geen persoonlijk gewin.
Overige belangen Geen.
|
Extra kritische commentaarronde. |
|
Dhr. dr. M.J. van der Laan |
Vaatchirurg |
Vice voorzitter Consortium Kwaliteit van Zorg NFU, onbetaald
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen.
|
Geen.
|
|
Dhr. dr. W.C. van der Zwet |
Arts-microbioloog |
Lid Regionaal Coördinatie Team, Limburgs infectiepreventie & ABR Zorgnetwerk (onbetaald) |
||
|
Dhr. dr. D.R. Buis |
Neurochirurg |
Lid Hoofdredactieraad Tijdschrift voor Neurologie & Neurochirurgie - onbetaald |
||
|
Dhr. dr. J.H.M. Goosen |
Orthopaedisch Chirurg |
Inhoudelijke presentaties voor Smith&Nephew en Zimmer Biomet. Deze worden vergoed per uur. |
||
|
Mw. drs. H. Jalalzadeh |
Arts-onderzoeker |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen.
|
|
Dhr. dr. N. Wolfhagen |
AIOS chirurgie |
|||
|
Mw. drs. H. Groenen |
Arts-onderzoeker |
|||
|
Dhr. dr. F.F.A. Ijpma |
Traumachirurg |
|||
|
Dhr. dr. P. Segers |
Cardiothoracaal chirurg |
|||
|
Mw. Y.E.M. Dreissen |
AIOS neurochirurgie |
|||
|
Dhr. R.R. Schaad |
Anesthesioloog |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt. Voor de modules 17-22 was de patiëntfederatie vertegenwoordigd in de werkgroep.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn.
Voor module 8 (Negatieve druktherapie) geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000 - 40.000 patiënten). Tevens volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
Voor de overige modules en aanbevelingen geldt dat uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten). Tevens volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Ook wordt geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners verwacht of een wijziging in het opleidingsniveau van zorgpersoneel. Er worden daarom geen substantiële financiële gevolgen verwacht.
Methode ontwikkeling
Evidence based
Implementatie
Zie voor de implementatie het implementatieplan in het tabblad 'Bijlagen'.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroepen de knelpunten in de zorg voor patiënten die chirurgie ondergaan. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. De verslagen hiervan zijn opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Adaptatie
Een aantal modules van deze richtlijn betreft een adaptatie van modules van de World Health Organization (WHO)-richtlijn ‘Global guidelines for the prevention of surgical site infection’ (WHO, 2018), te weten:
- Module Normothermie
- Module Immunosuppressive middelen
- Module Glykemische controle
- Module Antimicrobiële afdichtingsmiddelen
- Module Wondbeschermers bij laparotomie
- Module Preoperatief douchen
- Module Preoperatief verwijderen van haar
- Module Chirurgische handschoenen: Vervangen en type handschoenen
- Module Afdekmaterialen en operatiejassen
Methode
- Uitgangsvragen zijn opgesteld in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- De inleiding van iedere module betreft een korte uiteenzetting van het knelpunt, waarbij eventuele onduidelijkheid en praktijkvariatie voor de Nederlandse setting wordt beschreven.
- Het literatuuronderzoek is overgenomen uit de WHO-richtlijn. Afhankelijk van de beoordeling van de actualiteit van de richtlijn is een update van het literatuuronderzoek uitgevoerd.
- De samenvatting van de literatuur is overgenomen van de WHO-richtlijn, waarbij door de werkgroep onderscheid is gemaakt tussen ‘cruciale’ en ‘belangrijke’ uitkomsten. Daarnaast zijn door de werkgroep grenzen voor klinische besluitvorming gedefinieerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten, en is de interpretatie van de bevindingen primair gebaseerd op klinische relevantie van het gevonden effect, niet op statistische significantie. In de meta-analyses zijn naast odds-ratio’s ook relatief risico’s en risicoverschillen gerapporteerd.
- De beoordeling van de mate van bewijskracht is overgnomen van de WHO-richtlijn, waarbij de beoordeling is gecontroleerd op consistentie met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten (GRADE-methode; http://www.gradeworkinggroup.org/). Eventueel door de WHO gerapporteerde bewijskracht voor observationele studies is niet overgenomen indien ook gerandomiseerde gecontroleerde studies beschikbaar waren.
- De conclusies van de literatuuranalyse zijn geformuleerd in overeenstemming met de standaardprocedures van het Kennisinstituut van de Federatie Medisch Specialisten.
- In de overwegingen heeft de werkgroep voor iedere aanbeveling het bewijs waarop de aanbeveling is gebaseerd en de aanvaardbaarheid en toepasbaarheid van de aanbeveling voor de Nederlandse klinische praktijk beoordeeld. Op basis van deze beoordeling is door de werkgroep besloten welke aanbevelingen ongewijzigd zijn overgenomen, welke aanbevelingen niet zijn overgenomen, en welke aanbevelingen (mits in overeenstemming met het bewijs) zijn aangepast naar de Nederlandse context. ‘De novo’ aanbevelingen zijn gedaan in situaties waarin de werkgroep van mening was dat een aanbeveling nodig was, maar deze niet als zodanig in de WHO-richtlijn was opgenomen. Voor elke aanbeveling is vermeld hoe deze tot stand is gekomen, te weten: ‘WHO’, ‘aangepast van WHO’ of ‘de novo’.
Voor een verdere toelichting op de procedure van adapteren wordt verwezen naar de Bijlage Adapteren.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
World Health Organization. Global guidelines for the prevention of surgical site infection,
second edition. Geneva: World Health Organization; 2018. (https://www.who.int/publications/i/item/9789241550475, accessed 12 June 2023).
Zoekverantwoording
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H,
Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
World Health Organization. Global guidelines for the prevention of surgical site infection,
second edition. Geneva: World Health Organization; 2018. (https://www.who.int/publications/i/item/9789241550475, accessed 12 June 2023).
