Progesteron voor het voorkomen van vroeggeboorte
Uitgangsvraag
Disclaimertekst t.b.v. opname richtlijnendatabase
Lopend onderzoek
De waarde van behandeling met progesteron danwel een pessarium bij vrouwen met een cervix ≤ 35 mm (eenlingen) of < 38 mm (tweelingen) tijdens het structureel echoscopisch onderzoek om vroeggeboorte te voorkomen is momenteel onderdeel van een lopende studie, de QUADRUPLE P-studie. De NVOG adviseert centra om hierin te participeren. Zie ook https://www.zorgevaluatienederland.nl/projects/39
De uitgangsvraag omvat de volgende deelvragen:
- Voorkomt het gebruik van progesteron vroeggeboorte bij vrouwen met vroeggeboorte in de voorgeschiedenis?
- Voorkomt het gebruik van progesteron vroeggeboorte bij vrouwen met een korte cervix?
Aanbeveling
Bied een zwangere van een eenling met een spontane vroeggeboorte onder de 34 weken in de voorgeschiedenis het gebruik van progesteron aan.
Overweeg en bespreek bij een zwangere van een eenling met een spontane vroeggeboorte tussen de 34 en 37 weken in de voorgeschiedenis het gebruik van progesteron.
Bespreek met een zwangere van een eenling en een asymptomatische korte cervix ≤ 25 mm < 24 weken dat progesteron waarschijnlijk de kans op een vroeggeboorte en de daarmee gepaard gaande morbiditeit verkleint.
Overwegingen
Preventie spontane vroeggeboorte
In de afgelopen jaren zijn er vele placebo gecontroleerde trials verricht waarin het effect van toediening van progesteron is onderzocht bij vrouwen met een verhoogd risico op spontane vroeggeboorte. In de huidige richtlijn hebben wij ons gericht op twee hoogrisicogroepen; vrouwen met een vroeggeboorte in de voorgeschiedenis en vrouwen met een korte cervix zonder een vroeggeboorte in de voorgeschiedenis. Het positieve effect van progesteron op vroeggeboorte en geassocieerde morbiditeit en mortaliteit komt in de overgrote meerderheid van de studies overeen en recente analyses van geaggregeerde data stellen ons in staat om sterke aanbevelingen te doen voor het gebruik van progesteron in de huidige richtlijn. De in deze module geformuleerde aanbevelingen voor vrouwen met een verhoogd risico op spontane vroeggeboorte is in lijn met de richtlijn van de Society for Maternal-Fetal Medicine (Society for Maternal-Fetal Medicine (SMFM) Publications Committee, 2017) en RCOG (NICE guideline, Preterm Labour and birth, 2015). Hoewel er op basis van de gepubliceerde resultaten uit drie studies (Norman, 2007, Northen, 2007 en Willing, 2016) geen redenen zijn om aan te nemen dat er negatieve effecten zijn op lange termijn, zijn de lange-termijn-effecten nog onvoldoende uitgezocht.
Vroeggeboorte in de voorgeschiedenis tussen de 34-37 weken
Vrouwen met een spontane vroeggeboorte in de voorgeschiedenis hebben baat bij het gebruik van progesteron in volgende zwangerschappen en de projectgroep adviseert dan ook het gebruik van progesteron voor deze indicatie. De inclusiecriteria voor de trials verschilden, met name qua bovengrens van zwangerschapsduur. De grootste studie, Meis, 2003, includeerde alle vrouwen met een vroeggeboorte < 37 weken in de voorgeschiedenis. Ook vrouwen met een vroeggeboorte tussen de 34 en 37 weken hebben een verhoogd risico op vroeggeboorte in de volgende zwangerschap (Koullali, 2017). Er is reden om aan te nemen dat het effect ook in deze groep vrouwen aanwezig is (Meis, 2003) en de projectgroep adviseert dan ook het gebruik van progesteron in deze groep te bespreken.
Screening cervixlengte bij 20 weken echo
De effectiviteit van progesteron bij vrouwen met een korte cervix zonder vroeggeboorte in de voorgeschiedenis brengt ons bij het dilemma of er een universele screeningsstrategie moet worden geïnitieerd in Nederland. Verschillende mechanismes kunnen leiden tot een spontane vroeggeboorte en een korte cervix rond de 20 weken is een marker die slechts een deel van de vrouwen opspoort die een verhoogd risico hebben op een vroeggeboorte. Er zijn aanwijzingen dat de implementatie van een universele cervixlengte screening bij de 20 wekenecho kosteneffectief is (Werner, 2015, Son, 2016). Dit impliceert dat er een heroverweging geïndiceerd is van de module “Prenatale zorg bij dreigende vroeggeboorte” in de richtlijn “Basis prenatale zorg”. De projectgroep is van mening dat een korte cervix een belangrijke risicofactor is voor spontane vroeggeboorte. Dit onderdeel wordt meegenomen tijdens de ontwikkeling van de nieuwe richtlijn preventie spontane vroeggeboorte.
Toedieningsvorm
De studies gebruikt in deze analyse verschilden ten aanzien van het gebruik van progesteron qua toedieningsvorm en doseringen. Er is geen reden om aan te nemen dat één toedieningsvorm effectiever is in de preventie van vroeggeboorte (Saccone, 2017) en het is daarom goed om de keuze met betrekking tot de toedieningsvorm met de zwangere te bespreken en op haar wensen toe te spitsen. De intramusculaire vorm is het best onderzocht voor de indicatie vroeggeboorte in de voorgeschiedenis. De vaginale toediening van progesteron is het best onderzocht in vrouwen met een korte cervix zonder vroeggeboorte in de voorgeschiedenis.
Doseringen
Gangbare doseringen in Nederland zijn:
- 17-Hydroxyprogesteron. 1 x per week 250 mg i.m. van 16 tot 36 weken AD;
- progesteron 1 dd 200 mg capsules van 16 tot 36 weken AD.
Onderbouwing
Achtergrond
In Nederland bevallen jaarlijks 12.000 zwangeren voor 37 weken, waarvan 1.500 door spontane vroeggeboorte voor 32 weken (Van Zijl, submitted). Spontane vroeggeboorte is de meest belangrijke oorzaak van neonatale mortaliteit en morbiditeit, en ook van complicaties op de lange termijn van het kind (McCormick, 1985). Voor meer informatie over de het risico op een vroeggeboorte in Nederland kan het abstract van Koullali (2016) worden geraadpleegd. Vrouwen met een hoog risico op spontane vroeggeboorte hebben mogelijk baat bij het gebruik van progesteron. In deze module hebben wij ons gericht op twee belangrijke risicofactoren, te weten een vroeggeboorte in de voorgeschiedenis en vrouwen met een korte cervix in het tweede trimester.
Conclusies
Zoekvraag 1: Wat is de effectiviteit van progesteron ten opzichte van een placebobehandeling op het risico op een premature bevalling, samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit en neonatale mortaliteit bij zwangeren van een eenling met vroeggeboorte in de voorgeschiedenis?
|
Redelijk GRADE |
Waarschijnlijk reduceert progesteron ten opzichte van een placebo het risico op een premature bevalling (<37 weken) bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis.
Dodd, 2013 (Cetingoz, 2011, Da Fonseca, 2003, Glover, 2011, Ibrahim, 2010, Johnson, 1975, Meis, 2003, O’Brien, 2007, Rai, 2009), Azargoon, 2016 |
|
Laag GRADE |
Er zijn aanwijzingen dat progesteron ten opzichte van een placebo het risico op een premature bevalling (<34 weken) bij vrouwen zwanger van een eenling met vroeggeboorte in de voorgeschiedenis reduceert.
Dodd, 2013 (Cetingoz, 2011, Da Fonseca, 2003, Meis, 2003, O’Brien, 2007, Rai, 2009), Azargoon, 2016 |
|
Laag GRADE |
Er zijn aanwijzingen dat progesteron ten opzichte van een placebo het risico op een premature bevalling (<28 weken) bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis niet verlaagt.
O’Brien, 2007, Johnson, 1975, Rai, 2009 |
|
Laag GRADE |
Er zijn aanwijzingen dat progesteron ten opzichte van een placebo bij vrouwen zwanger van een eenling met vroeggeboorte in de voorgeschiedenis het risico op respiratoir distress syndroom bij de neonaat niet verlaagt.
Dodd, 2013 (Meis, 2003, O’Brien, 2007, Rai, 2009) |
|
Zeer laag GRADE |
Het is onduidelijk of progesteron ten opzichte van een placebo bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis het risico op intraventriculaire bloeding bij de neonaat reduceert.
Dodd, 2013 (Meis, 2003, O’Brien, 2007) |
|
Laag GRADE |
Er zijn aanwijzingen dat progesteron ten opzichte van een placebo bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis het risico op necrotiserende enterocolitis bij de neonaat niet verlaagt.
Dodd, 2013 (Meis, 2003, O’Brien, 2007) |
|
Laag GRADE |
Er zijn aanwijzingen dat progesteron ten opzichte van een placebo bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis het risico op bewezen neonatale sepsis bij de neonaat niet verlaagt.
Dodd, 2013 (Meis, 2003) |
|
Hoog GRADE |
Progesteron reduceert bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis ten opzichte van een placebo het risico op neonatale mortaliteit.
Dodd, 2013 (Ibrahim, 2010, Johnson, 1975, Meis, 2003, O’Brien, 2007, Rai, 2009) |
|
Hoog GRADE |
Progesteron reduceert bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis ten opzichte van een placebo het risico op perinatale mortaliteit.
Dodd, 2013 (Ibrahim, 2010, Johnson, 1975, Meis, 2003, O’Brien, 2007, Rai, 2009) |
|
Geen GRADE |
Wegens het ontbreken van data is er geen conclusie mogelijk over het effect van progesteron ten opzichte van een placebo bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis op het risico op de samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit. |
Zoekvraag 2: Wat is de effectiviteit van progesteron ten opzichte van een placebobehandeling op het risico op een premature bevalling, samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit, en neonatale mortaliteit bij zwangeren van een eenling met een asymptomatische korte cervix rond 20 weken.
|
Hoog GRADE |
Ten opzichte van een placebo reduceert progesteron het risico op een premature bevalling (<37 weken) niet bij vrouwen zwanger van een eenling met een korte cervix.
Romero, 2018 |
|
Redelijk GRADE |
Waarschijnlijk reduceert progesteron ten opzichte van een placebo het risico op een premature bevalling (<34 weken) bij vrouwen zwanger van een eenling met een korte cervix.
Romero, 2018 |
|
Redelijk GRADE |
Waarschijnlijk vermindert progesteron ten opzichte van een placebo het risico op een premature bevalling (<28 weken) bij vrouwen zwanger van een eenling met een korte cervix.
Romero, 2018 |
|
Redelijk GRADE |
Waarschijnlijk reduceert progesteron bij vrouwen zwanger van een eenling met een korte cervix ten opzichte van een placebo het risico op respiratoir distress syndroom bij de neonaat.
Romero, 2018 |
|
Laag GRADE |
Er zijn aanwijzingen dat progesteron bij vrouwen zwanger van een eenling met een korte cervix ten opzichte van een placebo het risico op intraventriculaire bloeding, necrotiserende enterocolitus, bewezen neonatale sepsis, neonatale mortaliteit of perinatale mortaliteit bij de neonaat niet verlaagt.
Romero, 2018 |
|
Redelijk GRADE |
Waarschijnlijk reduceert progesteron bij vrouwen zwanger van een eenling met een korte cervix ten opzichte van een placebo het risico op de samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit.
Romero, 2018 |
Samenvatting literatuur
Zoekvraag 1: Wat is de effectiviteit van progesteron ten opzichte van een placebobehandeling op het risico op een premature bevalling, samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit en neonatale mortaliteit bij zwangeren van een eenling met vroeggeboorte in de voorgeschiedenis?
Beschrijving studies
Dodd, 2013, heeft in een Cochrane review de effectiviteit bepaald van een behandeling met progesteron bij zwangeren met een verhoogd risico op een vroeggeboorte. Op 14 januari 2013 werd de search verricht. Acht van de 36 geïncludeerde studies beantwoordden zoekvraag één (Cetingoz, 2011, da Fonseca, 2003, Glover, 2011, Ibrahim, 2010, Johnson, 1975, Meis, 2003, O’Brien, 2007, Rai, 2009) en in totaal namen 1636 patiënten (range: 36-659) deel aan deze acht studies. Aangezien Dodd, 2013, geen gegevens heeft gepubliceerd over de ‘samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit’ en een vroeggeboorte <28 weken, zijn voor deze uitkomstmaat ook de individuele artikelen geraadpleegd. De geïncludeerde studies varieerden sterk qua timing van de start van de behandeling en de toedieningsvorm en de dosering van de medicatie.
Azargoon, 2016, was een gerandomiseerd gecontroleerde studie waarin een vergelijking werd gemaakt tussen dagelijks 400mg progesteron vaginaal en een placebo. Er werden vier subgroepen onderscheiden: 1) vrouwen met vroeggeboorte in de geschiedenis; 2) vrouwen met een vroeggeboorte in de geschiedenis en een korte cervix (≤28mm) die al cerclage hadden ondergaan; 3) vrouwen met uterus anomalie; 4) zwangerschappen met intramurale myomen ≥7cm. Alleen de gegevens van de eerste subgroep (n=53) worden hier geïncludeerd. Azargoon, 2016, heeft alleen de gegevens voor de uitkomstmaat premature bevalling (<37 weken) voor deze subgroep gerapporteerd.
Resultaten
Voor meer specifieke informatie met betrekking tot het aantal cases per uitkomstmaat wordt verwezen naar de evidencetabellen.
1. Premature bevalling (<37 weken)
Acht van de geïncludeerde studies in Dodd, 2013 (Dodd heeft de resultaten van Rai, 2009 voor deze uitkomstmaat waarschijnlijk ten onrechte niet meegenomen), en Azargoon, 2016, hebben het effect van progesteron ten opzichte van placebo op het aantal vroeggeboorten (<37 weken) onderzocht bij vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis. De resultaten van deze studies zijn gepoold (Figuur 1). Uit de meta-analyses blijkt dat progesteron het risico op een vroeggeboorte reduceert met een factor 0,62 (95%BI= 0,48 tot 0,80). Invullen van de gegevens uit de meta-analyse geeft een Number Needed to Treat (NNT) van 8,4 (1/((340/722)-(313/888)).
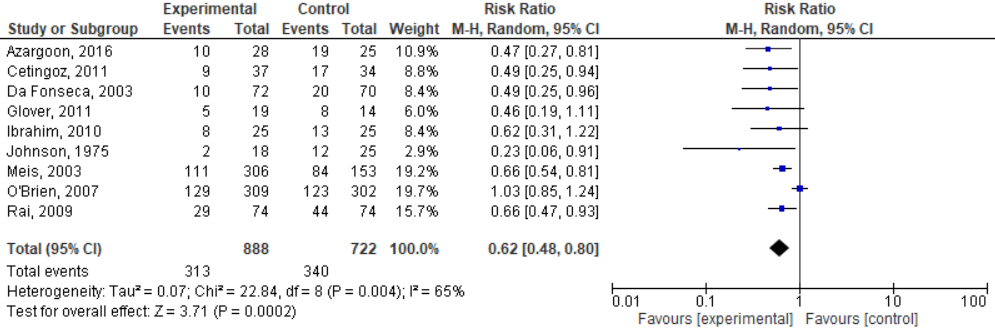
Figuur 1. Effectiviteit van behandeling met progesteron op premature bevalling (<37 weken) bij vrouwen met een vroeggeboorte in de voorgeschiedenis.
2. Premature bevalling (<34 weken)
Vijf van de geïncludeerde studies in Dodd, 2013, en Azargoon, 2016, hebben het effect van progesteron ten opzichte van placebo op het aantal vroeggeboorten voor 34 weken onderzocht (voor Meis, 2003 en O’Brien, 2007 zijn de resultaten voor een vroeggeboorte <32 weken geïncludeerd). De resultaten zijn gepoold; progesteron vermindert het risico op een vroeggeboorte met een factor 0,55 (95%BI: 0,38 tot 0,79; figuur 2), met een NNT van 11,6. De resultaten van Johnson, 1975, zijn alleen uit een figuur af te lezen, en het totale aantal geboortes <34 weken is niet helemaal duidelijk te zien. We hebben net als Dodd, 2013, besloten om de resultaten van deze studie hier niet te includeren.
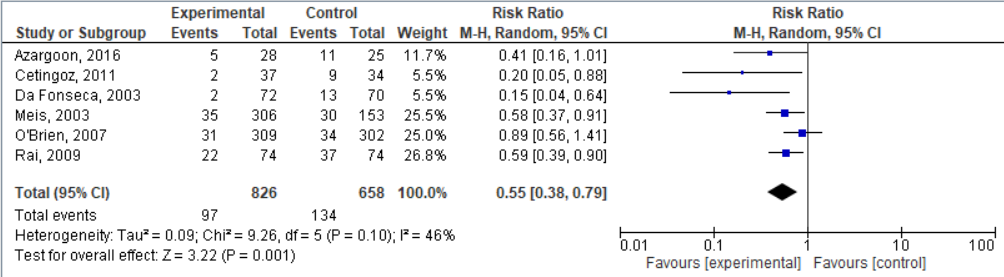
Figuur 2. Effectiviteit van behandeling met progesteron op premature bevalling (<34 weken) bij vrouwen met een vroeggeboorte in de voorgeschiedenis.
3. Premature bevalling (<28 weken)
Deze uitkomstmaat was één van de secundaire uitkomstmaten in Dodd, 2013, maar de resultaten voor deze specifieke populatie zijn niet opgenomen. O’Brien, 2007 en Rai, 2008 (beide studies geïncludeerd in Dodd, 2013) hebben de resultaten voor deze uitkomstmaat wel gerapporteerd. Voor de studie van Johnson, 1975, zijn de resultaten af te lezen uit figuur 1 van het artikel (vier cases in de placebogroep en nul cases in de interventiegroep). Het aantal vroeggeboorten in de interventiegroep van O’Brien, 2007 (n=10, 3,2%) was niet afwijkend van het aantal vroeggeboorten in de placebogroep (n=9, 3,0%; OR=1,07, 95%BI=0,38 tot 2,96). Rai, 2008, rapporteerde drie cases in de controlegroep en nul in de interventiegroep.
Azargoon, 2016 heeft het effect van progesteron op deze uitkomstmaat niet onderzocht.
De resultaten zijn gepoold; er wordt geen statistisch significant effect gevonden van de progesteronbehandeling, RR=0,49 (95%BI: 0,11 tot 2,21; figuur 3).
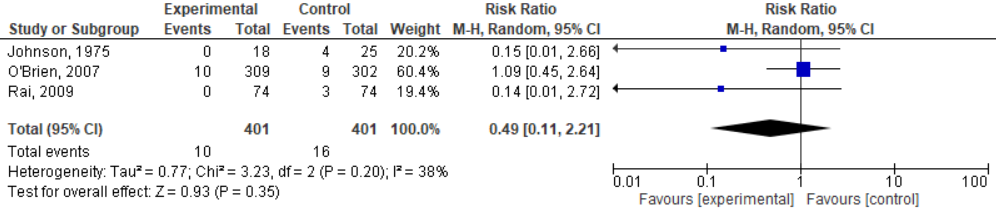
Figuur 3. Effectiviteit van behandeling met progesteron op premature bevalling (<28 weken) bij vrouwen met een vroeggeboorte in de voorgeschiedenis.
4. Respiratoir distress syndroom
Drie van de studies geïncludeerd in Dodd, 2013, hebben het effect van progesteron op het risico op het respiratoir distress syndroom onderzocht (Meis, 2003, O’Brien, 2007, en Rai, 2009). De resultaten van deze studies zijn weergegeven in figuur 4. Progesteron zorgde niet voor een significante afname van het aantal neonaten met het respiratoir distress syndroom (RR=0,45, 95%BI=0,17 tot 1,16).
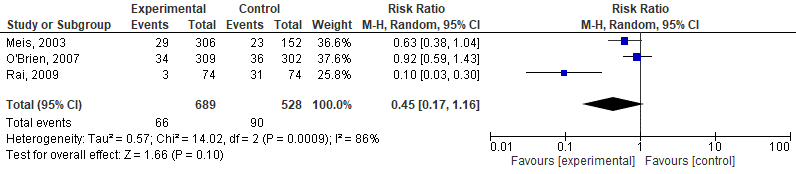
Figuur 4. Effectiviteit van behandeling met progesteron bij vrouwen met een vroeggeboorte in de voorgeschiedenis op de neonatale uitkomstmaat ‘respiratoir distress syndroom’.
5. Intraventriculaire bloeding (alle graderingen)
Slechts twee studies geïncludeerd in Dodd, 2013, die een vergelijking hebben gemaakt tussen progesteron en een placebo bij vrouwen met een vroeggeboorte in de voorgeschiedenis hebben data met betrekking tot de uitkomstmaat intraventriculaire bloeding gerapporteerd. In de studie van Meis, 2003, werd een significant effect gevonden, waarbij progesteron het risico op een intraventriculaire bloeding met een factor 0,25 verkleinde (RR=0,25, 95BI=0,08 tot 0,82). O’Brien, 2007, rapporteerde echter een niet significant effect: RR=1,17, 95%BI=0,36 tot 3,80. Opgemerkt moet worden dat deze uitkomtmaat slechts 12 keer voorkwam in de studie van Meis, 2003 en 11 keer in de studie van O’Brien, 2007.
6. Necrotiserende enterocolitis
Twee studies geïncludeerd in Dodd, 2013, hebben het effect van progesteron op deze uitkomstmaat onderzocht bij vrouwen met een vroeggeboorte in de voorgeschiedenis, en samen rapporteerde deze studies 12 cases. In Meis, 2003 waren er nul cases in de interventiegroep en vier cases in de placebogroep (RR=0,06, 95%BI=0,00 tot 1,03). O’Brien, 2007, rapporteerde drie cases in de interventiegroep en vijf in de placebogroep (RR=0,59, 95%BI=0,14 tot 2,43).
7. Bewezen neonatale sepsis
Alleen Meis, 2003 – geïncludeerd in Dodd, 2013 – heeft het effect van progesteron op deze uitkomstmaat onderzocht en rapporteerde dat de groepen niet significant van elkaar verschilden (RR=1,13, 95%BI=0,35 tot 3,59).
8. Neonatale mortaliteit
Vijf studies geïncludeerd in Dodd, 2013, hebben het effect van progesteron versus placebo bij vrouwen zwanger van een eenling met een vroeggeboorte in de geschiedenis op neonatale mortaliteit onderzocht. De resultaten van deze studies zijn gepoold. Ten opzichte van placebo reduceert progesteron de kans op neonatale mortaliteit met een factor 0,50 (95%BI= 0,28 tot 0,90), met een NNT van 39,4.
Azargoon, 2016, heeft het effect op neonatale mortaliteit niet voor de relevante subgroep weergegeven.
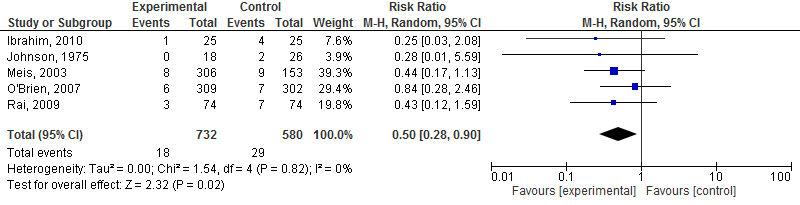
Figuur 5. Effectiviteit van behandeling met progesteron bij vrouwen met een vroeggeboorte in de voorgeschiedenis op de neonatale mortaliteit.
9. Perinatale mortaliteit
Vijf studies geïncludeerd in Dodd, 2013, hebben deze uitkomstmaat onderzocht, de resultaten zijn weergegeven in figuur 5. Progesteron reduceert de kans op perinatale mortaliteit bij vrouwen zwanger van een eenling met een vroeggeboorte in de geschiedenis met een factor 0,54 (95%BI= 0,32 tot 0,92), met en NNT van 24,5.
Azargoon, 2016, heeft het effect op perinatale mortaliteit niet voor de relevante subgroep weergegeven.
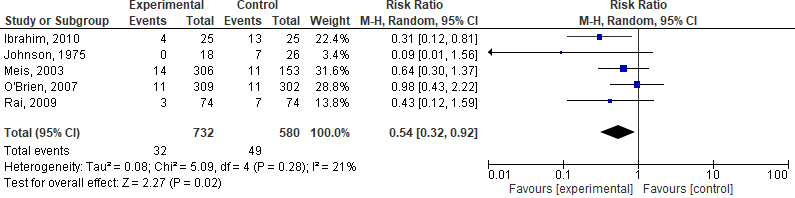
Figuur 6. Effectiviteit van de behandeling met progesteron bij vrouwen met een vroeggeboorte in de voorgeschiedenis op de perinatale mortaliteit.
10. Samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit
Dodd, 2013, (en de geïncludeerde studies) en Azargoon, 2016, hebben geen gegevens gerapporteerd over deze uitkomstmaat.
Bewijskracht van de literatuur
RCT’s beginnen op een hoge bewijskracht. De bewijskracht voor de uitkomstmaat premature bevalling <37 weken is met één niveau verlaagd wegens imprecisie (de bovengrens van het betrouwbaarheidsinterval overschrijdt de grens van de klinische relevantie (0,75)). Er lijkt op basis van de I2 (65%) sprake te zijn van heterogeniteit, maar aangezien de resultaten van de studies redelijk overeen lijken te komen, is besloten de bewijskracht niet verder te verlagen. De uiteindelijke bewijskracht voor deze uitkomstmaat is ‘redelijk’.
De bewijskracht voor de uitkomstmaat premature bevalling <34 weken is met twee niveaus verlaagd wegens imprecisie (de bovengrens van het betrouwbaarheidsinterval overschrijdt de grens van de klinische relevantie (0,75) en de inconsistentie (verschil in resultaten tussen studies). De uiteindelijke bewijskracht voor deze uitkomstmaat is ‘laag’.
De bewijskracht voor de uitkomstmaat premature bevalling <28 weken is met twee niveaus verlaagd wegens imprecisie (zeer beperkt aantal cases (n=26) in slechts drie studies, het brede betrouwbaarheidsinterval dat aan beide kanten de grens van klinische relevant overlapt). De uiteindelijke bewijskracht voor deze uitkomstmaat is ‘laag’.
De bewijskracht voor de uitkomstmaat respiratoir distress syndroom is met twee niveaus verlaagd gezien de inconsistentie (resultaten van studie verschillen) en de imprecisie (ondergrens van het betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie (0,75)). De uiteindelijke bewijksracht is ‘laag’.
De bewijskracht voor de uitkomstmaat intraventriculaire bloeding is met drie niveaus verlaagd gezien de inconsistentie (resultaten van de studies verschillen) en de imprecisie (inclusie van twee studies met een klein aantal cases, n=23 en brede betrouwbaarheidsintervallen). Het uiteindelijke bewijskracht is ‘zeer laag’
De bewijskracht voor de uitkomstmaat necrotiserende enterocolitis is met twee niveaus verlaagd gezien de imprecisie (inclusie van twee studies met een zeer beperkte aantal cases (n=12)). Het uiteindelijke niveau is ‘laag’.
De bewijskracht voor de uitkomstmaat bewezen neonatale sepsis is met twee niveaus verlaagd gezien de imprecisie (zeer beperkte aantal cases (n=13) en het brede betrouwbaarheidsinterval). Het uiteindelijke niveau is ‘laag’.
De bewijskracht voor de uitkomstmaat neonatale mortaliteit is niet verlaagd. Het uiteindelijke niveau is ‘hoog’.
De bewijskracht voor de uitkomstmaat perinatale mortaliteit is niet verlaagd. Het uiteindelijke niveau is ‘hoog’.
De bewijskracht voor de samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit kan niet worden gegradeerd wegens het ontbreken van data.
Zoekvraag 2: Wat is de effectiviteit van progesteron ten opzichte van een placebobehandeling op het risico op een premature bevalling, samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit, en neonatale mortaliteit bij zwangeren van een eenling met een asymptomatische korte cervix rond 20 weken.
Beschrijving studies
Romero, 2018, was een review met meta-analyse van individuele patiëntgegevens waarin werd onderzocht of vaginale progesteron gegeven aan vrouwen met een korte cervix (≤25mm) ten opzichte van een placebo/geen behandeling vroeggeboorte voorkomt en de perinatale uitkomsten verbetert. Onder andere de databases MEDLINE, EMBASE, LILACS, CINAHL en de Cochrane Central Register of Controlled Trials werden doorzocht tot september 2017. Alleen RCT’s werden geïncludeerd. Studies werden geschikt geacht als zij als primaire doel hadden om het gebruik van progesteron te onderzoeken in vrouwen zwanger van een eenling met een verkorte cervix, of als zij het effect van progesteron onderzochten bij zwangeren met risicofactoren anders dan een verkorte cervix, maar waarbij de uitkomsten voorhanden waren voor vrouwen met een cervicale lengte ≤25 mm voorafgaand aan de randomisatie. Data werden geanalyseerd op basis van intention-to-treat. Eerst werden de effectgroottes voor elke studie berekend en vervolgens werden de resultaten van de afzonderlijke studies gepoold.
Van zes studies werden de individuele patiëntgegevens opgevraagd. De data uit de studie van Os, 2015, kon door Romero, 2018, niet worden verkregen. De samengestelde uitkomstmaat neonatale morbiditeit kwam voor in 14% (1/9) in de placebogroep en in 8% (1/13) in de progesteron-groep (RR 0,58 (0,043 tot 7,94) in het voordeel van progesteron. Neonatale mortaliteit kwam voor in respectievelijk 11% (1/9) en 8% (1/13) (RR 0,69 (0,049 tot 9,69) in het voordeel van progesteron. Gezien de kleine aantallen gaan we in deze literatuursamenvatting verder uit van de door Romero, 2018, gerapporteerde gegevens.
Uiteindelijk kon Romero, 2018 de patiëntgegevens van vijf dubbelblinde gerandomiseerde studies (n=974, waarbij 498 vrouwen voor de progesteron-groep hadden geloot en 476 vrouwen voor de placebogroep) includeren. De voorgeschreven dagelijkse dosis van vaginale progesteron varieerde tussen de 90-200 mg en werd gegeven vanaf 18-25 weken tot 34-36 weken. Twee studies waren speciaal ontworpen om het effect van vrouwen met een korte cervix te onderzoeken. Daarnaast onderzocht één studie het gebruik van vaginale progesteron bij vrouwen met een spontane vroeggeboorte in de voorgeschiedenis (data van 31 van de 659 gerandomiseerde patiënten konden worden geïncludeerd in de IPD-meta-analyse), één studie onderzocht het effect van progesteron bij vrouwen met een eerdere vroeggeboorte in de voorgeschiedenis, uterine malformations of tweelingzwangerschappen (data van 8 van de 160 gerandomiseerde patiënten konden worden geïncludeerd in de IPD-meta-analyse) en één studie onderzocht het effect van vaginale progesteron bij vrouwen at risk voor een vroeggeboorte gezien de eerste spontane vroeggeboorte in de voorgeschiedenis, een cervicale lengte van ≤25 mm, of een positieve fetal fibronectin-test samen met andere klinische risicofactoren voor een vroeggeboorte (data van 251 van de 1228 gerandomiseerde patiënten konden in de IPD-meta-analyse worden geïncludeerd). In totaal had ongeveer 30% van geïncludeerde patiënten in de IPD-meta-analyse een vroeggeboorte in de voorgeschiedenis (n=147 in de progesteron-groep en n=141 in de placebogroep).
De beperkingen in studieopzet werd gescoord aan de hand van de domeinen beschreven in het Cochrane Handbook for Systematic Reviews of Interventions. De bewijskracht werd vastgesteld met behulp van GRADE (zie ook de evidence tabel). Gezien de door de werkgroep vastgestelde grenzen van de klinische relevantie is deze beoordeling niet overgenomen in deze literatuursamenvatting, maar voor zover mogelijk opnieuw beoordeeld; helaas zijn de forest plots niet voor de afzonderlijke uitkomstmaten gepresenteerd, waardoor sommige aspecten van GRADE minder goed te beoordelen zijn. Twee van de co-auteurs van deze review hebben of hadden banden met farmaceutische bedrijven die ook vaginaal progesteron produceren of verkopen. In de review is alleen voor de OPPTIMUM- studie benoemd hoe deze studie gefinancierd was geweest.
Resultaten
Voor meer specifieke informatie met betrekking tot het aantal cases per uitkomstmaat wordt ook verwezen naar de evidencetabellen.
1. Premature bevalling (<37 weken)
Romero, 2018, rapporteerde dat het aantal premature bevallingen <37 weken niet verschilden tussen de groepen: RR= 0,90, 95%BI=0,77 tot 1,05, I2=0%.
2. Premature bevalling (<34 weken)
Romero, 2018, rapporteerde dat het risico op een premature bevalling <34 weken significant lager was bij de vrouwen behandeld met progesteron dan bij vrouwen behandeld met placebo, RR= 0,65, 95%BI=0,51 tot 0,83, Number needed to treat (NNT)=11, 95%BI=8 tot 22, I2=0%.
3. Premature bevalling (<28 weken)
Romero, 2018, rapporteerde dat het risico op een premature bevalling <28 weken significant lager was bij de vrouwen behandeld met progesteron dan bij vrouwen behandeld met placebo: RR= 0,67, 95%BI=0,45 tot 0,99, NNT=27, 95%BI=16 tot 881, I2=0%.
4. Respiratoir distress syndroom
Romero, 2018, rapporteerde dat het risico op respiratoir distress syndroom bij de neonaat lager was in de groep vrouwen behandeld met progesteron dan in de groep vrouwen behandeld met een placebo: RR= 0,47, 95%BI=0,27 tot 0,81, NNT= 18, 95%CI=13 tot 51, I2=0%).
5. Intraventriculaire bloeding (alle graderingen)
Romero, 2018, rapporteerde dat het aantal keer voorkomen van intraventriculaire bloeding niet verschilden tussen de groepen: RR= 0,50, 95%BI=0,18 tot 1,38, I2=0%).
6. Necrotiserende enterocolitis
Romero, 2018, rapporteerde dat het aantal keer voorkomen van necrotiserende enterocolitis niet verschilden tussen de groepen: RR= 0,89, 95%BI=0,41 tot 1,93, I2=0%.
7. Bewezen neonatale sepsis
Romero, 2018, rapporteerde dat het aantal keer voorkomen van bewezen neonatale sepsis niet verschilden tussen de groepen: RR= 0,61, 95%BI=0,34 tot 1,08, I2=0%.
8. Neonatale mortaliteit
Uit de meta-analyses van Romero, 2018, blijkt dat progesteron ten opzichte van een placebobehandeling van vrouwen met een korte cervix het risico op neonatale mortaliteit niet significant had verminderd, RR= 0,44, 95%BI=0,18 tot 1,07, I2=0%.
9. Perinatale mortaliteit
Uit de meta-analyses van Romero, 2018, blijkt dat progesteron ten opzichte van een placebobehandeling van vrouwen met een korte cervix het risico op perinatale mortaliteit niet significant had verminderd, RR= 0,66, 95%BI=0,35 tot 1,22, I2=0%.
10. Samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit
Romero, 2018, rapporteerde een significant effect tussen de groepen, waarbij progesteron ten opzichte van de placebo het risico op deze uitkomstmaat met een factor 0,59 had verkleind (RR= 0,59, 95%BI=0,38 tot 0,91, NNT=18, 95%BI=12 tot 81, I2=0%).
Bewijskracht van de literatuur
RCT’s beginnen op een hoge bewijskracht. De bewijskracht voor de uitkomstmaat vroeggeboorte (≤37 weken) is niet verlaagd.
De bewijskracht voor de uitkomstmaat vroeggeboorte (≤34 weken) is met één niveau verlaagd gezien de imprecisie (bovengrens betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie (0,75) en het relatief beperkte aantal cases (<300)). Het uiteindelijke niveau is ‘redelijk’.
De bewijskracht voor de uitkomstmaat vroeggeboorte (≤28 weken) is met één niveau verlaagd gezien de imprecisie (bovengrens betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie (0,75) en het relatief beperkte aantal cases (<300)). Het uiteindelijke niveau is ‘redelijk’.
De bewijskracht voor de uitkomstmaat respiratoir distress syndroom is met één niveau verlaagd gezien de imprecisie (bovengrens betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie (0,75) en het relatief beperkte aantal cases (54)). Het uiteindelijke niveau is ‘redelijk’.
De bewijskracht voor de uitkomstmaat intraventriculaire bloeding is met twee niveaus verlaagd gezien de imprecisie (betrouwbaarheidsinterval overschrijdt aan weerszijde de grens van klinische relevantie (0,75 en 1,25) en het zeer beperkte aantal cases (n=15)). Het uiteindelijke niveau is ‘laag’.
De bewijskracht voor de uitkomstmaat necrotiserende enterocolitis is met twee niveaus verlaagd gezien de imprecisie (betrouwbaarheidsinterval overschrijdt aan weerszijde de grens van klinische relevantie (0,75 en 1,25) en het zeer beperkte aantal cases (n=23)). Het uiteindelijke niveau is ‘laag’.
De bewijskracht voor de uitkomstmaat bewezen neonatale sepsis is met twee niveaus verlaagd gezien de imprecisie (ondergrens betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie (0,75) en het zeer beperkte aantal cases (n=46)). Het uiteindelijke niveau is ‘laag’.
De bewijskracht voor de uitkomstmaat neonatale mortaliteit is met twee niveaus verlaagd gezien de imprecisie (brede betrouwbaarheidsinterval en het zeer beperkte aantal cases (n=22)). Het uiteindelijke niveau is ‘laag’.
De bewijskracht voor de uitkomstmaat perinatale mortaliteit is met twee niveaus verlaagd gezien de imprecisie (brede betrouwbaarheidsinterval en het zeer beperkte aantal cases (n=39)). Het uiteindelijke niveau is ‘laag’.
De bewijskracht voor de samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit is met één niveau verlaagd gezien de imprecisie (de bovengrens van het betrouwbaarheidsinterval overschrijdt de grens voor de klinische betrouwbaarheid (0.75)) en relatief beperkt aantal cases (n=78). Het uiteindelijke niveau van bewijskracht is ‘redelijk’.
Zoeken en selecteren
Om de uitgangsvragen te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
1. Wat is de effectiviteit van progesteron ten opzichte van een placebobehandeling op het risico op een premature bevalling, samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit, en neonatale mortaliteit bij zwangeren van een eenling met vroeggeboorte in de voorgeschiedenis?
P: Zwangeren van een eenling met spontane vroeggeboorte < 37 weken in de voorgeschiedenis.
I: Progesteron.
C: Placebo.
O: Premature bevalling (<28 weken, <34 weken, <37 weken),
(samengestelde) uitkomstma(a)t(en) van/voor neonatale morbiditeit en mortaliteit (respiratoir distress syndroom, intraventriculaire bloeding, necrotiserende enterocolitis, bewezen neonatale sepsis en neonatale mortaliteit), perinatale mortaliteit en neonatale mortaliteit.
2. Wat is de effectiviteit van progesteron ten opzichte van een placebobehandeling op het risico op een premature bevalling, samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit, en neonatale mortaliteit bij zwangeren van een eenling met een korte cervix?
P: Zwangeren van een eenling met een korte cervix (≤25mm).
I: Progesteron.
C: Placebo.
O: Premature bevalling (<28 weken, <34 weken, <37 weken), (samengestelde) uitkomstma(a)t(en) van/voor neonatale morbiditeit en mortaliteit (respiratoroir distress syndroom, intraventriculaire bloeding, necrotiserende enterocolitis, bewezen neonatale sepsis en neonatale mortaliteit), perinatale mortaliteit en neonatale mortaliteit.
Relevante uitkomstmaten
De werkgroep achtte premature bevalling <34 weken, samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit, en neonatale mortaliteit voor de besluitvorming kritieke uitkomstmaten.
De werkgroep definieerde de uitkomstmaat ‘premature bevalling’ als een bevalling voor 28, 34 of 37 weken zwangerschapsduur. Bij de uitkomstmaat ‘premature bevalling <34 weken’ werden - wanneer in een geïncludeerde studie het effect van progesteron op het risico op een premature bevalling <34 weken niet was gerapporteerd – waar mogelijk de resultaten op de uitkomstmaten ‘premature bevalling <32 weken’ of ‘premature bevalling <33 weken’ geïncludeerd. Op eenzelfde wijze zijn ook bij de uitkomstmaat ‘premature bevalling <37 weken’ eventueel de resultaten voor een premature bevalling <35 of <36 weken meegenomen.
De samengestelde uitkomstmaat van neonatale morbiditeit en mortaliteit is gedefinieerd als een samengestelde maat met respiratoir distress syndroom, intraventriculaire bloeding, necrotiserende enterocolitis, bewezen neonatale sepsis en neonatale mortaliteit. De werkgroep heeft gekozen om de resultaten op de afzonderlijke uitkomstmaten binnen deze samengestelde uitkomstmaat ook te rapporteren.
De werkgroep definieerde niet a priori de uitkomstmaten ‘neonatale mortaliteit’, ‘perinatale mortaliteit’, ‘respiratoir distress syndroom, ‘intraventriculaire bloeding’, ‘necrotiserende enterocolitis’ en ‘bewezen neonatale sepsis’ maar hanteerde de in de studies gebruikte definities.
Als grens voor de klinisch relevante verschillen werden door de werkgroep de default grenzen van GRADE Working Group gehanteerd (een verschil van 25% in het relatief risico; Schünemann, 2013). Voor mortaliteit definieerde de werkgroep ieder statistisch verschil als klinisch relevant.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 09-02-2017 met relevante zoektermen gezocht naar systematisch reviews en gerandomiseerd gecontroleerd onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 498 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en risk of bias beoordeling) of gerandomiseerde trials waarin vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis en/of met een korte cervix participeerden en waarin een vergelijking werd gemaakt tussen een behandeling met progesteron en een placebobehandeling. Daarnaast moest ten minste één van bovenstaande uitkomstmaten zijn geïncludeerd. Studies waarin patiënten in de controleconditie alleen standaardzorg ontvingen zijn geexcludeerd. Er is gekozen om als afkapwaarde voor een korte cervix ≤25 mm aan te houden, er zijn geen specifieke selectiecriteria opgesteld betreffende het startmoment en de duur van de behandeling, de dosis, het type en de toedieningsvorm van progesteron.
Op basis van titel en abstract werden in eerste instantie 74 studies voorgeselecteerd. Gezien het grote aantal systematische reviews in deze selectie (die bij geschiktheid als basis kunnen dienen voor de literatuursamenvatting) is er voor gekozen om alleen de 27 geselecteerde systematische reviews en gerandomiseerd trials die zijn verschenen na 01-01-2012 op te vragen. Na raadpleging van de volledige tekst, werden vervolgens 22 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vijf studies definitief geselecteerd. Op 15 november 2017 verscheen een meta-analyse van individuele patiëntdata (IPD-analyse) die de tweede zoekvraag (effectiviteit bij vrouwen met een korte cervix) beantwoordt. Er is besloten om deze IPD-analyse op te nemen in deze literatuursamenvatting, twee eerder geïncludeerde studies werden daarom alsnog geëxcludeerd (aangezien ze geïncludeerd of genoemd werden in de IPD).
Eén systematische review, één IPD-analyse en één gerandomiseerde gecontroleerde studie zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk-of-bias) van de geïncludeerde review, IPD-analyse en de gerandomiseerde studie zijn opgenomen in de risk-of-bias-tabellen. De risk-of-bias- beoordelingen door de auteurs van de systematische review en IPD-analyse zijn opgenomen in de evidencetabellen.
Referenties
- McCormick MC. The contribution of low birth weight to infant mortality and childhood morbidity. N Engl J Med. 1985 Jan 10;312(2):82-90.
- Azargoon A, Ghorbani R, Aslebahar F. Vaginal progesterone on the prevention of preterm birth and neonatal complications in high risk women: A randomized placebo-controlled double-blind study. Int. 2016;14(5):309-16.
- Cetingoz E, Cam C, Sakallı M, Karateke A, Celik C, Sancak A. Progesterone effects on preterm birth in high-risk pregnancies: a randomized placebo-controlled trial. Arch Gynecol Obstet. 2011 Mar;283(3):423-9. doi: 10.1007/s00404-009-1351-2. Epub 2010 Jan 22. PubMed PMID: 20091317.
- da Fonseca EB, Bittar RE, Carvalho MH, Zugaib M. Prophylactic administration of progesterone by vaginal suppository to reduce the incidence of spontaneous preterm birth in women at increased risk: a randomized placebo-controlled double-blind study. Am J Obstet Gynecol. 2003 Feb;188(2):419-24. PubMed PMID: 12592250.
- Dodd JM, Jones L, Flenady V, Cincotta R, Crowther CA. Prenatal administration of progesterone for preventing preterm birth in women considered to be at risk of preterm birth. Cochrane Database Syst Rev. 2013(7):CD004947.
- Glover MM, McKenna DS, Downing CM, Smith DB, Croom CS, Sonek JD. A randomized trial of micronized progesterone for the prevention of recurrent preterm birth. Am J Perinatol. 2011 May;28(5):377-81. doi: 10.1055/s-0031-1274509. Epub 2011 Mar PubMed PMID: 21380990
- Moustafa Ibrahim, Ahmed Ramy Mohamed Ramy, Moustafa Abdel-Fattah Younis, Progesterone supplementation for prevention of preterm labor: A randomized controlled trial, Middle East Fertility Society Journal, Volume 15, Issue 1, 2010, Pages 39-41, ISSN 1110-5690, https://doi.org/10.1016/j.mefs.2010.03.007. (http://www.sciencedirect.com/science/article/pii/S1110569010000087) Keywords: Preterm labor; Progesterone; Prevention of preterm labor
- Johnson JW, Austin KL, Jones GS, Davis GH, King TM. Efficacy of 17alpha-hydroxyprogesterone caproate in the prevention of premature labor. N Engl J Med. 1975 Oct 2;293(14):675-80. PubMed PMID: 1099445.
- Koullali B, Ravelli, AC, Kazemier BM, et al. 851: recurrence rate of spontaneous preterm birth. American Journal of Obstetrics & Gynecology , Volume 214 , Issue 1 , S443 - S444
- Koullali B, Kamphuis EI, Hof MH, Robertson SA, Pajkrt E, de Groot CJ, Mol BW, Ravelli AC. The Effect of Interpregnancy Interval on the Recurrence Rate of Spontaneous Preterm Birth: A Retrospective Cohort Study. Am J Perinatol. 2017 Jan;34(2):174-182. doi: 10.1055/s-0036-1584896. Epub 2016 Jul 1. PubMed PMID:27367283.
- Meis PJ, Klebanoff M, Thom E, Dombrowski MP, Sibai B, Moawad AH, Spong CY,Hauth JC, Miodovnik M, Varner MW, Leveno KJ, Caritis SN, Iams JD, Wapner RJ,Conway D, O'Sullivan MJ, Carpenter M, Mercer B, Ramin SM, Thorp JM, Peaceman AM, Gabbe S; National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Prevention of recurrent preterm delivery by 17 alpha-hydroxyprogesterone caproate. N Engl J Med. 2003 Jun 12;348(24):2379-85.Erratum in: N Engl J Med. 2003 Sep 25;349(13):1299. PubMed PMID: 12802023.
- NICE Guideline (2015). Preterm Labour and birth. Geraadpleegd op 30 januari 2018, via https://www.nice.org.uk/guidance/ng25
- Northen AT, Norman GS, Anderson K, Moseley L, Divito M, Cotroneo M, et al. Follow-up of children exposed in utero to 17 alpha-hydroxyprogesterone caproate compared with placebo. Obstet Gynecol. 2007 Oct;110(4):865–72.
- Norman JE, Marlow N, Messow CM, Shennan A, Bennett PR, Thornton S, et al. Vaginal progesterone prophylaxis for preterm birth (the OPPTIMUM study): a multicentre, randomised, double-blind trial. Lancet. 2016;387(10033):2106-16.
- O'Brien JM, Adair CD, Lewis DF, Hall DR, Defranco EA, Fusey S, Soma-Pillay P, Porter K, How H, Schackis R, Eller D, Trivedi Y, Vanburen G, Khandelwal M, Trofatter K, Vidyadhari D, Vijayaraghavan J, Weeks J, Dattel B, Newton E,Chazotte C, Valenzuela G, Calda P, Bsharat M, Creasy GW. Progesterone vaginal gelfor the reduction of recurrent preterm birth: primary results from a randomized, double-blind, placebo-controlled trial. Ultrasound Obstet Gynecol. 2007Oct;30(5):687-96. PubMed PMID: 17899572.
- Rai P, Rajaram S, Goel N, Ayalur Gopalakrishnan R, Agarwal R, Mehta S. Oral micronized progesterone for prevention of preterm birth. Int J Gynaecol Obstet.2009 Jan;104(1):40-3. doi: 10.1016/j.ijgo.2008.08.029. Epub 2008 Oct 16. PubMed PMID: 18929360.
- Romero R, Conde-Agudelo A, Da Fonseca E, O'Brien JM, Cetingoz E, Creasy GW,Hassan SS, Nicolaides KH. Vaginal progesterone for preventing preterm birth and adverse perinatal outcomes in singleton gestations with a short cervix: a meta-analysis of individual patient data. Am J Obstet Gynecol. 2018 Feb;218(2):161-180. doi: 10.1016/j.ajog.2017.11.576. Epub 2017 Nov 17. PubMed PMID: 29157866.
- Saccone G, Khalifeh A, Elimian A, Bahrami E, Chaman-Ara K, Bahrami MA, Berghella V. Vaginal progesterone vs intramuscular 17α-hydroxyprogesterone caproate for prevention of recurrent spontaneous preterm birth in singleton gestations: systematic review and meta-analysis of randomized controlled trials. Ultrasound Obstet Gynecol. 2017 Mar;49(3):315-321. doi: 10.1002/uog.17245. Epub 2017 Feb 6. Review. PubMed PMID: 27546354.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Society for Maternal-Fetal Medicine (SMFM) Publications Committee. The choice of progestogen for the prevention of preterm birth in women with singleton pregnancy and prior preterm birth. Am J Obstet Gynecol. 2017 Mar;216(3):B11-B13. doi: 10.1016/j.ajog.2017.01.022. Epub 2017 Jan 23. PubMed PMID: 28126367.
- Son M, Grobman WA, Ayala NK, Miller ES. A universal mid-trimester transvaginal cervical length screening program and its associated reduced preterm birth rate. Am J Obstet Gynecol. 2016 Mar;214(3):365.e1-5. doi: 10.1016/j.ajog.2015.12.020. PubMed PMID: 26928150.
- van Os MA, van der Ven AJ, Kleinrouweler CE, Schuit E, Kazemier BM, Verhoeven CJ, et al. Preventing Preterm Birth with Progesterone in Women with a Short Cervical Length from a Low-Risk Population: A Multicenter Double-Blind Placebo-Controlled Randomized Trial. Am J Perinatol. 2015;32(10):993-1000
- Werner EF, Hamel MS, Orzechowski K, Berghella V, Thung SF. Cost-effectiveness of transvaginal ultrasound cervical length screening in singletons without a prior preterm birth: an update. Am J Obstet Gynecol. 2015 Oct;213(4):554.e1-6. doi: 10.1016/j.ajog.2015.06.020. Epub 2015 Jun 10. PubMed PMID: 26071914.
- Willing J, Wagner CK. Exposure to the Synthetic Progestin, 17α-Hydroxyprogesterone Caproate During Development Impairs Cognitive Flexibility in Adulthood. Endocrinology. 2016 Jan;157(1):77–82.
- Van Zijl, M, Koullali, B, Oudijk, MA, et al. Trends in preterm birth in the Netherlands 2008-2015: a population-based study. Submitted (2019).
Evidence tabellen
Research question: Effectiveness of progesterone when compared to placebo on the risk for a preterm delivery, composite morbidity and neonatal death in women with a history of prior preterm birth
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Dodd, 2013
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to 14 january 2013
A: Cetingoz, 2011 B: Da Fonseca, 2003 C: Glover, 2011 D: Ibrahim, 2010 E: Johnson, 1975 F: Meis, 2003 G: O’Brien, 2007 H: Rai, 2009
Setting and Country: A: Istanbul, Turkey B: Sao Paulo, Brazil C: Miami, USA D: Cairo, Egypt E: Baltimore, USA F: Maternal-fetal medicine Network, USA G: 53 centers, Worldwide H: Delhi, India
Source of funding: [commercial / non-commercial / industrial co-authorship]
Not reported for the individual studies
Three auteurs of the review participate in a study on the use of progesterone for prevention of respiratory distress syndrome. |
Inclusion criteria SR:
Exclusion criteria SR:
36 studies included, of which 8 could be included in this part of the literature summary
Important patient characteristics at baseline:
N A: 71 (only the patients with at least 1 spontaneous preterm birth included) B: 157 C: 36 D: 50 E: 50 F: 463 (2:1 ratio) G: 659 H: 150
Groups comparable at baseline? A: Unknown B: Yes C: Yes D: not fully reported E: yes, although more (heavy) smokers in placebo group F: yes, although more previous preterm deliveries in placebo group G: yes H: yes
|
A: micronized progesterone, 100mg daily, vaginal suppository B: nightly intravaginal pessary of 100 mg progesterone C: 400 mg oral micronized progesterone MP. D: 17-a-hydroxy progesterone caproate, 250mg weekly, intramuscular E: 17-hydroxyprogesteron caproate, 250 mg weekly, intramuscular F: 17-hydroxyprogesteron caproate, 250 mg weekly, intramuscular G: progesterone gel, 90 mg nightly H: micronized progesterone, 100mg oral, twice daily
Duration of treatment A: 24-34 weeks of gestation B: 24-28 weeks C: start between 16 and 19 6/7 weeks and discontinuation at 33rd week D: until 36 weeks E: until 24 weeks, F: from 16-20 weeks until 36 weeks/birth, G: duration not reported, H: start between 18-24 weeks and discontinuation at 36 weeks or delivery. |
Placebo (with the same characteristics, unless stated otherwise): A, B, C, D, E, F, G, H
|
End-point of follow-up: Not reported
For how many participants were no complete outcome data available? A: 10 (6 from the placebo group) B: 15 (excluded after randomization) C: 3 (1 no preterm birth, 1 spontaneous abortion, 1 delivered elsewhere) D: 0 E: 7 (excluded after randomization) F: 0 G: 48 H: 2
|
Defined as a delivery before 37 completed weeks
Effect measure: RR [95% CI]: A: 0.49 (0.25;0.94) B: 0.49 (0.25;0.96) C: 0.46 (0.19;1.11) D: 0.62 (0.31;1.22) E: 0.23 (0.06;0.91) F: 0.66 (0.54;0.81) G: 1.03 (0.85;1.24) H: Calculated from article: 0.66 (0.46;0.93); “The number of women who had a preterm delivery was lower in the OMP group compared with the control group (29 vs 44 women, P=0.002; Table 2).”)
Defined as a delivery before 34 weeks A: 0.20 (0.05;0.88) B: 0.15 (0.04;0.64) C: Not reported D: Not reported E: Unclear. F: From article: 0.58 (0.37;0.91), before 32 weeks G: Calculated from article: 0.89 (0.56;1.41), before 32 weeks H: 0.59 (0.39;0.90)
Defined as a delivery before 28 weeks A: Not reported B: Not reported C: Not reported D: Not reported E: Fr4om article (figure 1), there were 0 cases in the intervention group and 4 in the control group. F: Not reported G: OR=1.07, 95%BI=0.38;2.96 (n=10 in the intervention group and 9 in the placebo group) H: Reported that there were 0 cases in the intervention group and 3 in the control group.
A: Not reported B: Not reported C: Not reported D: Not reported E: Not reported F: 0.63 (0.38;1.04) G: 0.92 (0.59;1.43) H: 0.10 (0.03;0.30)
Total: RR=0.45 (0.17;1.16)
A: Not reported B: Not reported C: Not reported D: Not reported E: Not reported F: 0.25 (0.08;0.82) G: 1.17 (0.36;3.80) H: Not reported
A: Not reported B: Not reported C: Not reported D: Not reported E: Not reported F: 0.06 (0.00;1.03) G: 0.59 (0.14;2.43) H: Not reported
A: Not reported B: Not reported C: Not reported D: Not reported E: Not reported F: 1.13 (0.35;3,59_ G: Not reported H: Not reported
Effect measure: RR [95% CI]: A: Not reported B: Not reported C: Not reported D: 0.25 (0.03;2.08) E: 0.28 (0.01;5.59) F: 0.44 (0.17;1.13) G: 0.84 (0.28;2.46) H: 0.43 (0.12;1.59)
A: Not reported B: Not reported C:Not reported D: 0.31 (0.12;0.81) E: 0.09 (0.01;1.56) F: 0.64 (0.30;1.37) G: 0.98 (0.43;2.22) H: 0.43 (0.12;1.59)
Total: RR=0.54 (0.54;0.92)
Composted of respiratory distress syndrome, intraventricular haemorrhage, necrotizing, enterocolitis, proven neonatal sepsis or neonatal death) A: Not reported B: Not reported C: Not-reported D: Not reported E: Not reported F: Not reported G: Not reported H: Not reported
|
Risk of bias (ROB): Random sequence generation Low ROB:A, B, C, F, G, H Unclear: D, E
Allocation concealment Low ROB:A, B, C, D, F, G, H Unclear: D
Blinding of patients and personnel Low ROB: A, B, C, E, F, G, H Unclear: D
Blinding of outcome assessment Low ROB: B, E, F, G Unclear: A, C, D, H
Incomplete outcome data Low ROB: A, B, C, D, E, F, G, H
Selective reporting Low ROB: A, B, D, E, F, G, H Unclear: C
Other bias Low ROB: B, C, E, F, G, H Unclear: A, D
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Dodd, 2015 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
yes |
Unclear for the individual studies |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: Effectiveness of progesterone when compared to placebo on the risk for a preterm delivery, composite morbidity and neonatal death in women with a history of prior preterm birth
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Azargoon, 2016 |
Type of study: RCT
Setting: Prentatal clinic, Amir-Al-Momenin Hospital
Country: Iran
Source of funding: No conflict of interest reported |
Inclusion criteria: Only the data of the subgroup of patients with a previous history of preterm birth (<37 weeks) were included.
Exclusion criteria:
N total at baseline: Intervention: 28 Control: 25
Important prognostic factors2: For example age ± SD: I:NR C:NR
Groups comparable at baseline? Unknown |
Vaginal suppository progesterone (400mg), one capsule every night. Start: 16-22 weeks GA End: 36 weeks GA.
|
Placebo vaginal suppository, one capsule every night
|
Length of follow-up: Not reported
Loss-to-follow-up/incomplete outcome data: Unknown for this subgroup. In total, 103 patients were randomized, of which 3 were excluded because of severe preeclampsia (n=2) or intra uterine growth retardation (n=1). Data of the remaining 100 women analysed. |
Defined as birth before 37 weeks, n(%) I: 10 (35.7) C: 19 (76) RR (95%CI)=2.13 (1.24;3.66)
No data of this subgroup available
Not reported
|
The calculated RR are incorrect. Given the reported number preterm births per group, the RR=0.47 (0.27;0.81) |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Azargoon, 2016 |
Computerized list of randomized numbers |
Unclear (not described, but double-blind study) |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Research question: Effectiveness of progesterone when compared to placebo on the risk for a preterm delivery, composite morbidity and neonatal death in women with a short cervix.
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Romero, 2018
PS., individual study characteristics are extracted from the SR (unless stated otherwise) |
SR and meta-analysis individual patient data
Literature search up to September 2017
A: Fonseca, 2007 B: O’Brien, 2007 C: Cetingoz, 2011 D: Hassan, 2011 E: Norman, 2016
Study design: All double-blind, placebo controlled trials .
Setting and Country: A: multicentre, UK, Chile, Brazil, and Greece B: multicentre, US, South Africa, India, Czech Republic, Chile, and El Salvador C: Single center, Turkey D: Multicenter, US, Belerarus, Chile, Czech Republic, India, Israel, Italy, Russia, South Africa, and Ukraine E: Multicenter, UK and Sweden.
Source of funding: Partly sponsored by Perinatology Research Branch, Division of Intramural Research, Eunice Kennedy Shriver National Institute of Child Health and Human Development, National Institutes of Health, Department of Health and Human Services. “ “The funder had no role in the design or conduct of the study; collection, management analysis or interpretation of the data; preparation, review, or approval of the manuscript or the decision to submit the manuscript for publication.
“JMO’B was involved in studies of progesterone gel treatment for preterm birth prevention sponsored by a maker of progesterone gel. He served on advisory boards and as a consultant for Watson Pharmaceuticals, a company with a financial interest in marketing vaginal progesterone gel for preterm birth prevention; he and others are listed in a patent on the use of progesterone compounds to prevent preterm birth (USA Patent Number 7884093: progesterone for the treatment and prevention of spontaneous preterm birth). He has received no royalty payments. GWC was an Employee of Columbia Laboratories, Inc. when the previous meta-analysis of individual patient data was conducted in 2011.” |
Inclusion criteria SR: * Randomized controlled trials; * primary aim: prevent preterm birth in women with a short cervix or to prevent preterm birth in women with risk factors other than short cervix but for whom outcomes were available in those with a pre-randomization cervical length ≤25 mm.
Exclusion criteria SR: * quasi-randomized trials; * trials that assessed vaginal progesterone in women with threatened or arrested preterm labour and trials in which vaginal progesterone was administered in the first trimester to prevent miscarriage.
5 studies included
Number of patients per study eligible for the IPDMA, population characteristics, per study A: 226. Original trial included 250 patients with singleton or twin gestation and cervical length ≤15mm. B: 31 Original trial included 659 patients with singleton gestation and previous spontaneous preterm birth. C: 8. Original trial included 160 patients with twin gestation, or singleton gestation with previous spontaneous preterm birth, or uterine malformation. D: 458. Original trial included 465 patients with a singleton gestation and a cervical length between 10-20 mm. E: 251. Original trial included 1228 patients with a singleton gestation and previous spontaneous preterm birth, or cervical length ≤25mm, or a positive fetal fibronectin test combined with other clinical risk factors for preterm birth.
Important patient characteristics for the total IPDMA at baseline:
N, mean age I: 498, 28.0 C: 476, 27.5
Obstetrical history Nulliparous: I: 225 (45.2) C:215 (45.2)
Parous with ≥1 previous spontaneous birth I: 147 (29.5) C: 141 (29.6)
Cervical length at randomization <10 mm, n (%) I: 48 (9.6) C: 57 (12.0)
10-20 mm, n (%) I: 379 (76.1) C: 362 (76.0)
21-25 mm, n(%) I:71 (14.3) C: 57 (12.0)
Groups comparable at baseline? Yes |
All: Vaginal progesterone
Specific: A: 200 mg/day, from 24-33 6/7 weeks of gestation. B: 90 mg/day, from 18-22 to 37 0/7 weeks of gestation, rupture of membranes or preterm delivery, whichever occurred first. C: suppository 100 mg/day from 24-34 weeks of gestation D: 90 mg/day from 20-23 6/7 to 36 6/7 weeks of gestation, rupture or membranes or preterm delivery, whichever occurred first. E: Progesterone 200 mg/day from 22-24 to 34 weeks of gestation or preterm delivery, whichever occurred first.
|
All: placebo
|
End-point of follow-up: NA
For how many participants were no complete outcome data available? See result section.
|
Defined as a delivery before 37 completed weeks, n cases/total (%) I: 187/498 (38) C: 199/476 (42)
RR: 0.90, 95%CI=0.77;1.05
Defined as a delivery before 34 weeks, n cases/total (%) I: 86/498 (17) C: 126/476 (26)
RR: 0.65, 95%CI=0.51;0.83 NNT:11, 95%CI=8-22
Defined as a delivery before 28 weeks, n cases/total (%) I: 38/498 (8) C: 54/476 (11)
RR: 0.67, 95%CI=0.45;0.99 NNT: 27, 95%CI=16-881
n cases/total (%) I: 17/365 (5) C: 37/358 (10)
RR: 0.47, 95%CI=0.27;0.81 NNT: 18, 95%CI=13-51
n cases/total (%) I: 5/494 (1) C: 10/475 (2)
RR: 0.50, 95%CI=0.18;1.38
n cases/total (%) I: 11/495 (2) C: 12/475 (3)
RR: 0.89, 95%CI=0.41;1.93
n cases/total (%) I: 18/494 (4) C: 28/470 (6)
RR: 0.61, 95%CI=0.34;1.08
n cases/total (%) I: 7/498 (1) C: 15/476 (3)
RR: 0.44, 95%CI=0.18;1.07
n cases/total (%) I: 16/498 (3) C: 23/476 (5)
RR: 0.66, 95%CI=0.35;1.22
Composted of respiratory distress syndrome, intraventricular haemorrhage, necrotizing, enterocolitis, proven neonatal sepsis or neonatal n cases/total (%) I: 29/365 (8) C: 49/358 (14)
RR: 0.59, 95%CI=0.38;0.91 NNT: 18, 95%CI=12-81
|
GRADE according to Romero, 2018
Before 37 weeks HIGH
Before 34 weeks HIGH
Before 28 weeks HIGH
HIGH
LOW (downgrade because of few events and 95%CI does not include effect and is imprecise)
LOW (downgrade because of few events and 95%CI does not include effect and is imprecise)
MODERATE (downgrade because of 95%CI does not include effect and is imprecise)
LOW (downgrade because of few events and 95%CI does not include effect and is imprecise)
MODERATE (downgrade because of 95%CI does not include effect and is imprecise)
HIGH
ROB A: low ROB B: low ROB C: low ROB D: low ROB E: high risk of compliance bias.
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Romero, 2018 |
Yes |
Yes |
yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Unclear, only for the review itself |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Ahn, 2017 |
Review, heeft alleen gekeken naar neonatal death, niet naar de andere uitkomstmaten. Alle indicaties geïncludeerd. |
|
Romero, 2016 |
Niet alle individuele data van de geïncludeerde studies geïncludeerd. CL<25 aangehouden. |
|
Chaman-Ara, 2016 |
Heeft alleen studies waarin vrouwen met zowel een korte cervix als een eerdere vroeggeboorte geïncludeerd. |
|
Romero, 2014 |
Review, niet systematisch |
|
Velez Edwards, 2013 |
Focus op drug route |
|
Schmouder, 2013 |
Search in Dodd, 2013 is recenter |
|
Conde-Agudelo, 2013 |
Vergelijking progesterone versus cerclage |
|
Sotiriadis, 2012 |
Verschenen voor Dodd, 2013 |
|
Society for Maternal-Fetal Medicine Publications Committee |
Niet binnen gekomen |
|
Romero, 2012 |
Eerdere versie van de Romero, 2016 |
|
Likis, 2012 |
Verschenen voor Dodd, 2013 |
|
Pirjani, 2017 |
Maakt vergelijking tussen twee typen progesteron bij patiënten met een korte cervix |
|
Haidar, 2017 |
Secundaire data-analyse, met focus op compliance |
|
Sentilhes, 2016 |
Richtlijn, geen individuele data |
|
Norman, 2016 |
Editiorial comment |
|
Barinov, 2016 |
Vergelijking tussen pessarium en progesteron, cerclage en progesteron, en alleen progesteron. Geen placebo groep. |
|
Winer, 2015 |
Geen placebo |
|
Maher, 2013 |
Vergelijking van twee typen progesteron |
|
Alfirevic, 2013 |
Vergelijking tussen cerclage, progesteron en pessarium |
|
Grobman, 2012 |
Al geïncludeerd in Dodd, 2013 |
|
Aboulghar, 2012 |
Al geïncludeerd in Dodd, 2013 |
|
Van Os, 2015 |
Besproken in Romero, 2018. |
|
Norman, 2016 |
Opgenomen in de IPD analyse van Romero, 2018. |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 21-08-2019
Laatst geautoriseerd : 21-08-2019
Geplande herbeoordeling : 01-01-2023
Voor het beoordelen van de actualiteit van deze richtlijn is de Otterlo werkgroep, die in stand zal blijven. Uiterlijk in 2022 bepaalt het bestuur van de Otterlo werkgroep van de NVOG of deze module nog actueel is. De geldigheid van deze module komt eerder te vervallen indien nieuwe ontwikkelingen hier aanleiding toe geven.
Disclaimertekst t.b.v. opname richtlijnendatabase
Lopend onderzoek
De waarde van behandeling met progesteron danwel een pessarium bij vrouwen met een cervix ≤ 35 mm (eenlingen) of < 38 mm (tweelingen) tijdens het structureel echoscopisch onderzoek om vroeggeboorte te voorkomen is momenteel onderdeel van een lopende studie, de QUADRUPLE P-studie. De NVOG adviseert centra om hierin te participeren. Zie ook https://www.zorgevaluatienederland.nl/projects/39
Algemene gegevens
De Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV), Nederlandse Vereniging voor Kindergeneeskunde (NVK) en Patiëntenfederatie Nederland zijn geconsulteerd.
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. De belangenformulieren zijn besproken binnen de betreffende werkgroep en de NVOG cie Kwaliteitsdocumenten, indien van toepassing. Geen van de belangen heeft tot een eventuele actie geleid.
Methode ontwikkeling
Evidence based
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
