Interventie (of behandeling) bij neonatale hypoglycemie
Uitgangsvraag
Op welke wijze dient interventie (of behandeling) van een neonatale hypoglycemie plaats te vinden?
Aanbeveling
In de aanbevelingen wordt onderscheid gemaakt op grond van het tijdstip na geboorte en al dan niet aanwezig zijn van symptomen passend bij hypoglycemie.
Bij symptomatische hypoglycemie adviseert de werkgroep om een glucosebolus iv toe te dienen van 200 mg/kg (=2 ml/kg glucose 10%) en daarop volgend een hoog gedoseerd continu infuus te geven om rebound hypoglycemie te voorkomen (minimaal 8 mg/kg/min (ca. 115 ml/kg/dag van een glucose 10% oplossing)).
Bij asymptomatische hypoglycemie is het verhogen van de koolhydraatintake de hoeksteen in de behandeling. De werkgroep adviseert een stapsgewijze aanpak waarbij voedingsinterventies de voorkeur hebben boven iv glucosetoediening.
De werkgroep adviseert om de keuze voor de interventie bij asymptomatische hypoglycemie te individualiseren op grond van:
- het tijdstip na geboorte;
- de ernst van de hypoglycemie;
- het beloop van de glucoseconcentratie en het effect van voorgaande interventies;
- klinische karakteristieken en omstandigheden van het kind (onder andere zwangerschapsduur, geboortegewicht, aantal en aard van de risicofactoren, bijkomende morbiditeit);
- voedingstolerantie en drinkgedrag.
Algemeen uitgangspunt is dat de interventies niet onnodig mogen leiden tot het scheiden van de moeder en het kind of onderbreking van de borstvoeding.
De werkgroep adviseert de volgende voedingsinterventies te overwegen als behandeling bij asymptomatische hypoglycemie:
- frequenter aanleggen bij borstvoeding en bijvoeden met afgekolfde moedermelk;
- indien beschikbaar kan buccale dextrose-gel (200 mg/kg 40% dextrose-gel) worden overwogen;
- bijvoeden met kunstvoeding (minimaal 5 ml/kg/keer), eventueel per sonde als het kind onvoldoende zelf drinkt, maar de voeding wel tolereert.
De werkgroep adviseert bij asymptomatische hypoglycemie een behandeling met iv glucosetoediening te overwegen bij:
- voedingsintolerantie;
- onvoldoende stijging van de glucoseconcentratie na voedingsinterventie;
- recidiverende hypoglycemie ondanks voedingsinterventies.
Bij iv glucosetoediening als behandeling voor asymptomatische neonatale hypoglycemie kan worden gestart met:
- 4 mg/kg/min bij à terme pasgeborenen (ca. 60 ml/kg/dag glucose 10%) iv;
- 6 mg/kg/min bij prematuren (ca. 90 ml/kg/dag glucose 10%) iv.
Bij persisterende of recidiverende hypoglycemie wordt de iv koolhydraatintake verder verhoogd met ten minste 1 tot 2 mg/kg/min (ca. 15 tot 30 ml/kg/dag glucose 10%). Bij een koolhydraatbehoefte hoger dan 10 mg/kg/min worden grotere stappen aanbevolen (ten minste 2 mg/kg/min). Houd hierbij rekening met de totale hoeveelheid vocht/kg/dag. Overweeg nadere diagnostiek naar onderliggende endocriene of metabole stoornissen.
Zie de aanverwante porducten voor formules voor het berekenen van de koolhydraatintake.
De werkgroep adviseert bij asymptomatische hypoglycemie met zeer lage glucoseconcentratie direct te starten met iv glucosetoediening in hoge dosering (minimaal 8 mg/kg/min (ca. 115 ml/kg/dag glucose 10%)).
Als snel herstel tot veilige waarden onwaarschijnlijk wordt geacht, kan een glucosebolus (200 mg/kg (2 ml/kg glucose 10%)) worden overwogen. Een glucosebolus dient altijd direct gevolgd te worden door een hoog gedoseerd continu infuus om rebound hypoglycemie te voorkomen.
De werkgroep adviseert om het effect van elke interventie in de behandeling van neonatale hypoglycemie te evalueren door een extra controle van de glucoseconcentratie na 30 tot 60 minuten.
De werkgroep adviseert om de iv glucosetoediening stapsgewijs af te bouwen indien glucosewaarden stabiel zijn.
Overwegingen
Er is een hoge mate van consensus in de internationale richtlijnen en lokale protocollen uit Nederlandse ziekenhuizen ten aanzien van de behandeling bij symptomatische neonatale hypoglycemie. De diagnose symptomatische hypoglycemie is gebaseerd op de trias van Whipple:
- een lage glucoseconcentratie;
- symptomen die passen bij hypoglycemie;
- verdwijnen van symptomen nadat de hypoglycemie is behandeld (Hay, 2003).
Bij symptomatische hypoglycemie wordt de kans op lange termijngevolgen hoog ingeschat. De glucoseconcentratie dient daarom snel gecorrigeerd te worden. Verhoging van de glucoseconcentratie wordt het snelst bereikt met toediening van een bolus glucose 10% (Lilien, 1977 en 1980). Na een glucosebolus dient direct een onderhoudsinfuus met hoge koolhydraatintake te worden gegeven om rebound hypoglycemie te voorkomen.
In de literatuur is geen omschrijving van een praktische handleiding ten aanzien van de behandeling van asymptomatische neonatale hypoglycemie, behoudens de internationale richtlijnen die gepubliceerd zijn. Veel literatuur omvat het beschrijven van een definitie, streefwaarde of interventiegrens (zie de module ‘Definitie van neonatale hypoglycemie’). De heterogeniteit in de beschrijving van de interventies, in zowel de internationale richtlijnen als de ingezonden lokale protocollen, maakte het onmogelijk om de resultaten te poolen. In de dagelijkse praktijk bestaat echter wel behoefte aan eenduidigheid in de adviezen in de behandeling van asymptomatische hypoglycemie. Daarom heeft de werkgroep er voor gekozen om de behandeling van neonatale hypoglycemie pragmatisch te evalueren en op basis van consensus te komen tot aanbevelingen en een stroomschema dat handzaam is in de praktijk.
Het doel van de behandeling van asymptomatische neonatale hypoglycemie is het voorkomen van neurologische schade door tijdig normaliseren van de glucoseconcentratie in het bloed. Glucose is hierbij het ontbrekende substraat. De hoeksteen in de behandeling van neonatale hypoglycemie is dan ook het verhogen van de koolhydraatintake. De keuze voor de interventie wordt bepaald door:
- het tijdstip na geboorte: één tot twee uur na geboorte mag rekening gehouden worden met de fysiologische dip in de glucoseconcentratie, waarbij spontaan herstel mogelijk is (zie de module ‘Definitie van neonatale hypoglycemie’);
- de ernst van de hypoglycemie: bij een zeer lage glucoseconcentratie is snel spontaan herstel tot veilige waarden niet te verwachten;
- het beloop van de glucoseconcentratie en het effect van voorgaande interventies;
- klinische karakteristieken en omstandigheden van het kind, zoals zwangerschapsduur, geboortegewicht, aantal en aard van de risicofactoren, en bijkomende morbiditeit;
- voedingstolerantie en drinkgedrag.
Algemeen uitgangspunt is dat de interventies niet onnodig mogen leiden tot het scheiden van de moeder en het kind of onderbreking van de borstvoeding. De behandeling bij asymptomatische neonatale hypoglycemie vraagt dan ook om een geïndividualiseerde aanpak bestaande uit een stapsgewijze behandelingsstrategie met voedingsinterventies, eventueel (indien beschikbaar) buccale dextrose-gel en iv glucosetoediening. Toediening van glucose via de enterale route heeft de voorkeur boven parenterale toediening.
Veel toegepaste voedingsinterventies zijn frequenter aanleggen bij borstvoeding of bijvoeden (met afgekolfde moedermelk of kunstvoeding), zo nodig per sonde als het kind onvoldoende zelf drinkt. Nadelen van bijvoeding met kunstvoeding zijn: onder andere een mogelijk nadelige invloed op het op gang komen van de borstvoeding, remming van de gluconeogenese, glycogenolyse en ketogenese, verhoogd risico op infecties en allergie, en veranderingen in het neonatale microbioom (Johnson, 2012). Daarnaast zijn er geen evidence-based richtlijnen voor de hoeveelheid voeding die nodig is om de glucoseconcentratie te normaliseren (Harris, 2014). Uit de studie van Harris is gebleken dat bijvoeden met kunstvoeding met een mediaan volume van 4,5 ml/kg wel een statistisch significante stijging gaf van de glucoseconcentratie, in tegenstelling tot bijvoeden met afgekolfde moedermelk (mediaan volume 0,5 ml/kg) (Harris, 2017). De stijging van de glucoseconcentratie was echter niet groot: ongeveer 4 mg/dL, overeenkomend met 0,22 mmol/L.
Buccale dextrose-gel is een veelbelovende interventie in de behandeling van neonatale hypoglycemie (Weston, 2016), maar nog niet in een vorm goedgekeurd voor pasgeborenen beschikbaar in Nederland. Indien dextrose-gel in Nederland beschikbaar is (verwachting: 2019 of 2020), kan toepassing hiervan als stap in de behandeling van neonatale hypoglycemie worden overwogen. Als alternatief kan in de tussentijd Glucogel (40%) gebruikt worden, hoewel dit product voor deze indicatie niet geregistreerd is. Zie de aanverwante producten voor aandachtspunten en toepassing van buccale dextrose-gel.
Bij voedingsintolerantie, recidiverende hypoglycemie, onvoldoende effect van eerdere (voedings)interventies of een zeer lage plasma glucoseconcentratie waarbij snel herstel tot veilige waarden niet te verwachten is, is iv glucosetoediening aangewezen. Bij asymptomatische hypoglycemie waarbij iv glucosetoediening noodzakelijk is, kan in het algemeen worden gestart met een continu infuus. Bij een (hoge) dosering van 8 mg/kg/min zal de glucoseconcentratie na gemiddeld 10 minuten boven de grens van 2,6 mmol/L zijn (Lilien, 1977 en 1980). De tijdwinst in het bereiken van een vergelijkbare plasma glucoseconcentratie na toediening van een glucosebolus gevolgd door een continu infuus (8 mg/kg/min) versus starten van een continu infuus (8 mg/kg/min) zonder voorafgaande bolus, is gemiddeld ongeveer 20 minuten.
Bij ernstige hypoglycemie zonder klinische symptomen kan een glucosebolus worden toegediend, maar is minder duidelijk hoe belangrijk de relatief korte tijdwinst is in het voorkomen van hersenschade. Aangezien er ook weinig bezwaar is tegen een glucosebolus -mits gevolgd door een hoog-gedoseerd continu infuus- kan overwogen worden om toch een glucosebolus toe te dienen bij ernstige hypoglycemie, ook als deze asymptomatisch is.
Een mogelijk risico bij frequente bolustoediening en/of hoge exogene glucosetoevoer is het ontstaan van iatrogeen hyperinsulinisme (Cowett, 1979). Behandeling van symptomatische of ernstige hypoglycemie heeft echter prioriteit boven het mogelijke risico op iatrogeen stimuleren van de insuline afgifte.
Borstvoeding mag altijd naast iv glucosetoediening worden gecontinueerd, aangezien het volume van colostrum in de eerste dagen klein is en de kans op overvulling gering (Aziz, 2004)
Om overvulling en hyponatriëmie te voorkomen wordt aangeraden om de orale plus iv vochttoediening niet (langdurig) hoger te laten zijn dan 100 tot 120 ml/kg/dag op de eerste levensdag (Aziz, 2004). Zo nodig moet een meer geconcentreerde glucose-oplossing worden toegediend, waarbij toediening via een centraal veneuze lijn de voorkeur heeft. Kortdurende overschrijding van de totale hoeveelheid toegediend vocht kan toegestaan worden, met name om de tijd te overbruggen tot de beschikbaarheid van een centraal veneuze lijn. Overweeg dan controle van de concentratie aan natrium in het bloed.
Het effect van geen enkele interventie is onomstotelijk bewezen. Het blijft dan ook belangrijk om de glucoseconcentratie kort na elke interventie te controleren en het beleid hierop aan te passen.
Onderbouwing
Achtergrond
Persisterende neonatale hypoglycemie is geassocieerd met neurologische ontwikkelingsachterstand (zie de module ‘Definitie van neonatale hypoglycemie’) (Aynsley-Green, 1996; Burns, 2008; Cornblath, 1997; Vannucci, 2000; Volpe, 2008). Daarom worden preventieve maatregelen toegepast om een persisterende hypoglycemie te voorkomen (zie de module ‘Preventie van neonatale hypoglycemie’) en wordt behandeling door middel van één of meer interventies gestart bij glucoseconcentraties onder de interventiegrens. Het doel van de behandeling van neonatale hypoglycemie is het voorkomen van neurologische schade door normaliseren van de glucoseconcentratie in het bloed. Glucose is hierin het ontbrekende substraat en dit dient daarom gesuppleerd te worden totdat homeostase is bereikt. De behandeling van neonatale hypoglycemie bestaat dan ook in eerste instantie uit het verhogen van de koolhydraatintake. De wijze waarop dit gebeurt – oraal, per sonde of intraveneus – is afhankelijk van de ernst van de hypoglycemie, klinische factoren en de onderliggende oorzaak van de neonatale hypoglycemie.
In deze uitgangsvraag wordt ingegaan op de mogelijke interventies bij neonatale hypoglycemie. Streefwaarden en interventiegrenzen zijn toegelicht in de module ‘Definitie van neonatale hypoglycemie’.
Conclusies / Summary of Findings
In de internationale richtlijnen en lokale protocollen van Nederlandse ziekenhuizen is er consensus dat symptomatische hypoglycemie direct behandeld dient te worden door middel van iv glucosetoediening. In de meeste internationale richtlijnen en lokale protocollen van Nederlandse ziekenhuizen wordt hierbij een glucosebolus aanbevolen, gevolgd door een onderhoudsinfuus met hoge dosering glucose.
Voor de verschillende interventies in de behandeling van asymptomatische neonatale hypoglycemie is weinig bewijs te vinden in de literatuur. Dit blijkt ook uit de internationale richtlijnen over neonatale hypoglycemie, waarin vooral expert- of consensus-based aanbevelingen gedaan worden.
De aanbevelingen over de verschillende interventies, in zowel de internationale richtlijnen als de nationale protocollen, verschillen.
Verhogen van de koolhydraatintake wordt beschouwd als de hoeksteen in de behandeling van neonatale hypoglycemie. Dit kan bereikt worden door voedingsinterventies, toediening van dextrose-gel of iv toediening van glucose. Zie de aanverwante producten voor formules voor het berekenen van de koolhydraatintake.
|
Zeer laag |
Voedingsinterventies, zoals frequenter aanleggen bij borstvoeding en bijvoeden met afgekolfde moedermelk of kunstvoeding, worden in de dagelijkse klinische praktijk vaak toegepast als eerste interventie bij milde tot matige asymptomatische neonatale hypoglycemie. Dit is in overeenstemming met de internationale richtlijnen, maar onderbouwing in de literatuur is schaars. |
|
Zeer laag |
Bij ernstige asymptomatische hypoglycemie, onvoldoende effect van voedingsinterventies of recidiverende hypoglycemie wordt continue iv glucosetoediening geadviseerd in de internationale richtlijnen en lokale protocollen. Ook hiervoor is de onderbouwing in de literatuur schaars en is er geen consensus over de definitie van de indicatie. |
|
Laag |
Buccale toediening van 40% dextrose-gel staat sinds enkele jaren in de belangstelling bij zowel de preventie als behandeling van asymptomatische neonatale hypoglycemie. Een Cochrane review uit 2016 concludeerde dat toediening van dextrose-gel overwogen kan worden als eerste stap in de behandeling bij neonatale hypoglycemie (Weston, 2016). Er werden echter slechts twee studies in dit review geïncludeerd en niet alle klinisch relevante uitkomsten zijn onderzocht in deze studies. Na de Cochrane review zijn nog geen nieuwe RCTs gepubliceerd. |
Samenvatting literatuur
Frequenter aanleggen bij borstvoeding
Frequenter aanleggen en huid-op-huidcontact zijn geassocieerd met het beter op gang komen van de borstvoeding (zie ook de module ‘Preventie van neonatale hypoglycemie’) (Boundy, 2016; De Carvalho, 1982 en 1983; Hawdon, 1992). Echter, ook als de borstvoeding goed op gang is, moeten glucosecontroles in risicogroepen gecontinueerd worden, omdat er niet altijd voldoende stijging van de glucoseconcentratie optreedt na een hypoglycemie (Harding, 2017).
Een retrospectief statusonderzoek van Voeten uit Nederland evalueerde de introductie van frequenter aanleggen (met een interval van anderhalf tot twee uur) als behandeling bij neonatale hypoglycemie (glucoseconcentratie <2,6 mmol/L) ten opzichte van het standaardbeleid met bijvoeden (Voeten, 2008). In de bijvoedingsgroep kreeg 63% (100/158) van de pasgeborenen een hypoglycemie, in de groep met frequenter aanleggen was dit 55% (41/74). De laatste groep had gemiddeld lagere glucoseconcentraties dan de bijvoedingsgroep. Dit verschil was alleen significant voor pasgeborenen zonder risicofactoren: 0,50 ± 0,69 mmol/L (95% CI: 0,06 tot 0,93; p =0,03) en niet voor de groep met risicofactoren (onder andere prematuren, SGA, LGA, IDM, maar ook zieke pasgeborenen): 0,20 ± 0,79 mmol/L (95% CI: –0.05 tot 0.45; p =0.14). Er was een afname van gebruik van bijvoeding bij 39% van de kinderen (95% CI: 28 tot 50). Symptomatische hypoglycemieën werden in beide groepen niet waargenomen.
Een cross-sectionele observationele studie met 218 gezonde pasgeborenen (met exclusie van SGA, IDM, stuitligging en kunstverlossing) beschreef de glucoseconcentratie en parameters voor metabole adaptatie bij 156 à terme pasgeborenen en 62 prematuren. In de groep à terme pasgeborenen was het interval tussen de voedingen de belangrijkste determinant voor de glucoseconcentratie, met lagere glucoseconcentraties bij een langduriger voedingsinterval. Ernstige hypoglycemie trad echter niet op. Borstgevoede pasgeborenen hadden de laagste glucoseconcentratie, maar tevens een effectieve counterregulatie (Hawdon, 1992).
Bijvoeding
Bijvoeden met afgekolfde moedermelk of kunstvoeding is een gebruikelijke interventie in de behandeling van neonatale hypoglycemie (Harris, 2014). Het is bovendien relatief goedkoop en gemakkelijk te geven (Flaherman, 2013). Harris beschrijft in een recente post-hoc analyse van de Sugar Babies study de invloed van het type voeding op de glucoseconcentratie (naast de studie-interventie: dextrose-gel of placebo) (Harris, 2013 en 2017). De keuze voor het type voeding werd door ouders gemaakt. Er werden 295 hypoglycemie-episodes geanalyseerd bij 227 pasgeborenen. Kunstvoeding (mediaan volume 4,5 ml/kg; range 0,6 tot 15,0) werd gegeven bij 55 (19%) hypoglycemie episodes. Er werden 186 (63%) episodes behandeld met alleen moedermelk in de vorm van borstvoeding, afgekolfde moedermelk (mediaan 0,5 ml/kg; range 0,0 tot 7,3) (voor of na de geboorte afgekolfd) of een combinatie daarvan. In 54 (18%) van de hypoglycemie episodes bij 50 (22%) van de pasgeborenen werd geen voeding gegeven, meestal omdat de moeder exclusief borstvoeding wilde geven. Alleen in de groep die kunstvoeding kreeg trad een significante stijging in de glucoseconcentratie op: 0,23 mmol/L (95% CI 1,3 tot 7,2; p =0,004) in de univariaatanalyse; en 0,21 mmol/L (95% CI 0,8 tot 6,7; p =0,01) in de multivariaatanalyse. In de multivariaatanalyse was de stijging in de glucoseconcentratie in de borstvoedinggroep net niet significant: 0,11 mmol/L (95% CI −0,3 tot 4,2; p =0,09). Wel was borstvoeding geassocieerd met een kleinere kans op een tweede behandeling met orale dextrose-gel (OR 0,52; 95% CI 0,28 tot 0,94; p =0,03). Na voeding met afgekolfde moedermelk trad geen significante stijging op in de glucoseconcentratie, mogelijk omdat het kleine hoeveelheden betrof (mediaan 0,5 ml/kg).
Ondanks het feit dat kunstvoeding een veel gebruikte behandelingsmethode is (Harris, 2014), zijn er naast de post-hoc analyse van Harris (2017) in een additionele search (formula[tiab] OR supplem*[tiab])AND (hypoglyc*[tiab]) AND (newborn[tiab] OR infant[tiab] OR preterm[tiab]) geen andere studies gevonden die het effect van kunstvoeding als interventie bij neonatale hypoglycemie beschrijven. Ook een Cochrane review benoemt dat er geen studies zijn gedaan naar het geven van kunstvoeding voor neonatale hypoglycemie: “Formula milk is often given to hypoglycaemic infants, although no studies have reported on this treatment” (Weston, 2016).
Dextrose-gel
Een Cochrane systematische review bespreekt toediening van dextrose-gel 200 mg/kg dat in de wangzak wordt gemasseerd als behandeling van neonatale hypoglycemie (Weston, 2016). In dit review zijn twee gerandomiseerde studies opgenomen (Harris, 2013; Troughton, 2000), waarin 312 kinderen (respectievelijk n =237 en n =75) waren bestudeerd. Primaire uitkomstmaten waren: correctie van de hypoglycemie en ernstige stoornis in de neurosensorische ontwikkeling op de leeftijd van twee jaar. In beide studies werd niet gerapporteerd of er herstel optrad van de hypoglycemie. Eén studie beschreef dat er geen verschil was in de neurosensorische uitkomst op de leeftijd van twee jaar tussen de groep behandeld met dextrose-gel, in vergelijking met placebo (risk ratio (RR) 6,27, 95% CI 0,77 tot 51,03; n =184 (Harris, 2016). De kwaliteit van evidence werd als zeer laag gescoord in deze Cochrane review. Er was geen verschil tussen de dextrose-gel en placebogroep voor de secundaire uitkomstmaat iv glucosetoediening (RR 0,81, 95% CI 0,29 tot 2,25; twee trials, n =312; Level of evidence: zeer laag). Het voordeel van behandeling met dextrose-gel in vergelijking met placebo was dat moeders en kinderen minder vaak van elkaar gescheiden werden (RR 0,54, 95% CI 0,31 tot 0,93; één trial; n =237; kwaliteit van evidence: matig) en dat meer kinderen exclusief borstvoeding kregen na ontslag (RR 1,10, 95% CI 1,01 tot 1,18; één trial; n =237; kwaliteit van evidence: matig). Negatieve effecten werden niet gezien. De overall kwaliteit van het bewijs werd als matig tot zeer laag beoordeeld vanwege imprecisie (variatie in de data), publicatie bias (conclusies gebaseerd op één trial en één publicatie in abstract vorm) en onvoldoende details om de risk of bias te beoordelen.
Na de Cochrane review zijn nog enkele publicaties verschenen: drie retrospectieve implementatie studies en een review. Eén retrospectieve cohortstudie naar het effect van dextrose-gel op iv glucosetoediening bij late prematuren en à terme pasgeborenen met asymptomatische hypoglycemie (glucoseconcentratie <45 mg/dL) (Rawat, 2016). Pasgeborenen kregen maximaal drie doses dextrose-gel (200 mg/kg 40% dextrose-gel). De glucoseconcentratie steeg bij 184/250 (74%) van de pasgeborenen behandeld met dextrose-gel in vergelijking met 144/248 (58%) van de pasgeborenen behandeld met alleen voeding (p <0,01). Overplaatsing van de kraamafdeling naar de neonatologie afdeling voor iv glucosetoediening was minder vaak nodig in de dextrose-gelgroep: daling van 35/1000 naar 25/1000 levend geborenen (p <0,01). Meer kinderen kregen exclusief borstvoeding: 19% naar versus 28% (p =0,03).
Een andere studie evalueerde de implementatie van dextrose-gel bij neonatale hypoglycemie op verloskamers en kraamafdeling in een tertiair perinataal centrum in Australië (Ter, 2017). In de pre-implementatie groep werd alleen bijvoeding gegeven; in de post-implementatie fase werd dextrose-gel naast bijvoeding gegeven. Er werd een daling in NICU-opnames gevonden van 29/100 (29%) naar 14/100 (14%) (p =0,01). Er was geen verschil in het bereiken van normoglycemie (71/100 (71%) versus 75/100 (75%), p =0,52). Een recidief van de hypoglycemie werd vaker gezien in de postimplementatie groep: 22/71 (31%) versus 37/75 (49%), p =0,02).
Een derde publicatie betreft ook een pre- en postimplementatie evaluatie van dextrose-gel bij de behandeling van neonatale hypoglycemie (n =870 at-risk pasgeborenen in de pre- en n =1089 postimplementatie) (Bennett, 2016). Het aantal NICU-opnames daalde met 73%: van 10,6% pre- naar 2,9% in de postimplementatie fase.
In een review wordt door Newnam een overzicht gegeven van de literatuur over 40% dextrose-gel bij de preventie en behandeling van asymptomatische neonatale hypoglycemie (Newnam, 2017). De auteurs concluderen dat het gebruik van 40% dextrose-gel bij asymptomatische neonatale hypoglycemie het aantal NICU-opnames kan verminderen, evenals de opnameduur en –kosten, en de moeder-kind-binding kan versterken door minder scheiding, exclusieve borstvoeding kan bevorderen, evenals de ouder-tevredenheid, zonder nadelige gevolgen voor de psychomotore ontwikkeling. Zij stellen echter ook dat meer goed opgezette studies nodig zijn naar de psychomotore ontwikkelingsuitkomst van verschillende behandelingsstrategieën voor asymptomatische neonatale hypoglycemie.
Andere interventies
In de literatuur werden geen studies gevonden die het verhogen van de voedingsfrequentie bij fles- of sondevoeding onderzochten als interventie bij neonatale hypoglycemie. Ook werden geen studies gevonden met als interventie orale of enterale glucosetoediening, of toevoeging van een koolhydraat- of lipidensupplement aan de orale of enterale voeding als behandeling bij neonatale hypoglycemie.
Intraveneuze glucosetoediening
Er werd geen literatuur gevonden waarbij iv glucosetoediening als interventie bij neonatale hypoglycemie werd vergeleken met orale/enterale voeding of placebo.
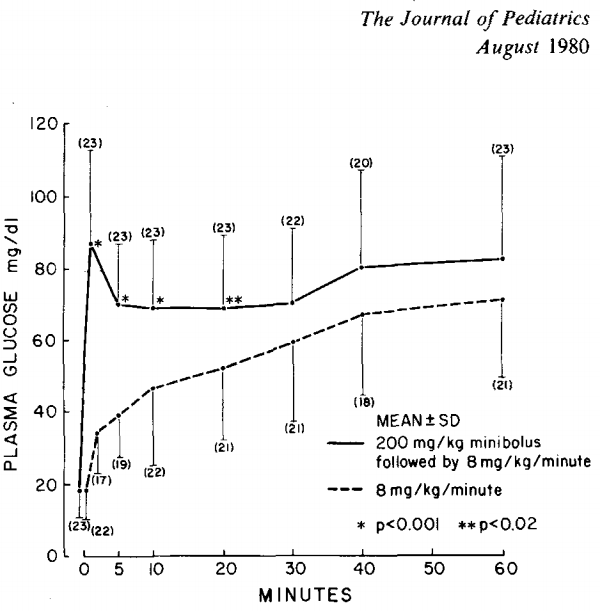
Lilien beschrijft de effectiviteit van een bolus glucose 10% gevolgd door continue intraveneuze glucosetoediening van 8 mg/kg/minuut bij pasgeborenen met een hypoglycemie (Lilien, 1980). Deze studie betrof 23 kinderen met een zwangerschapsduur van 28 tot 36 weken. Zij werden vergeleken met een eerdere studie door dezelfde onderzoeksgroep, waarin een continue iv glucosetoediening van 8 mg/kg/min werd toegediend, zonder bolus vooraf (Lilien, 1977).
Er was een significant verschil in de glucoseconcentratie in de eerste 20 minuten, waarbij een glucosebolus zorgt voor een directe stijging van de plasma glucoseconcentratie en daarom een goede interventie is bij zeer lage glucosewaarden of een symptomatische hypoglycemie. In de groep zonder bolus vooraf, was de gemiddelde glucoseconcentratie na 20 minuten ook >2,5 mmol/L. Vanaf 30 minuten was er geen verschil meer in glucoseconcentratie tussen de groepen. Hierbij moet benadrukt worden dat de dosering voor het continue infuus relatief hoog was (8 mg/kg/min).
Internationale richtlijnen (beoordeling middels AGREE II)
Voedingsinterventies
Alle internationale richtlijnen geven aan dat voeding geven een effectieve interventie is bij neonatale hypoglycemie, zonder dit te onderbouwen met referenties uit de literatuur.
Tabel 1 Indicaties voor een voedingsinterventie volgens de internationale richtlijnen
|
|
In de eerste uren na geboorte |
Vanaf de eerste uren tot 24 uur na geboorte |
|
AAP (2011) Overall quality 5/7) |
Eerste glucoseconcentratie 30 min. na de eerste voeding: <1,4 mmol/L.
Tussen één en vier uur na geboorte: glucose 1,4 tot 2,2 mmol/L. |
Glucoseconcentratie 1,9 tot 2,5 mmol/L. |
|
Canada (2016) Overall quality 5/7) |
Eerste glucose twee uur na geboorte (na een voeding) 1,8 tot 2,0 mmol/L. |
Glucose 2,0 tot 2,5 mmol/L. |
|
Australië (2015) Overall quality 5/7) |
|
|
|
NICE (2015) Overall quality 4/7) |
Glucose <2,6 mmol/L. |
Glucose <2,6 mmol/L. |
|
PES (2015) Overall quality 4/7) |
Niet vermeld. |
Niet vermeld. |
Dextrose-gel
Alleen de Australische (2013) richtlijn noemt buccale toediening van 40% dextrose-gel (200 mg/kg (=0,5 ml/kg)) in de wangzak masseren als interventie bij de behandeling van asymptomatische hypoglycemie bij verder gezonde pasgeborenen. De toediening mag eenmaal herhaald worden, als de glucoseconcentratie is gestegen, maar nog tussen 2,0 tot 2,5 mmol/L is. In de overige richtlijnen (AAP, Canada, NICE, PES) wordt dextrose-gel niet benoemd.
Iv glucosetoediening bij asymptomatische hypoglycemie
Onderhoudsinfuus
Alle richtlijnen benoemen symptomatische hypoglycemie als indicatie voor iv glucosetoediening (zie tabel 2).
Tabel 2 Indicatie voor iv glucosetoediening bij asymptomatische hypoglycemie in de internationale richtlijnen
|
|
In de eerste uren na geboorte |
Vanaf de eerste uren tot 24 uur na geboorte |
|
AAP (2011) Overall quality 5/7 |
|
|
|
Canada (2016) Overall quality 5/7 |
|
|
|
NICE (2015) Overall quality 5/7 |
|
Idem. |
|
Australië (2015) Overall quality 4/7 |
|
Idem. |
|
PES (2015) Overall quality 4/7 |
Niet vermeld. |
Niet vermeld. |
Opmerking: alle richtlijnen benoemen symptomatische hypoglycemie als indicatie voor intraveneuze glucosetoediening.
Tabel 3 Overzicht adviesdosering voor continue iv glucosetoediening in de internationale richtlijnen
|
Dosering |
|
|
AAP (2011) |
Glucose 10% 80 tot 100 ml/kg/dag (=5,5 tot 7 mg/kg/min). |
|
Canada (2016) |
Glucose 10% 80 ml/kg/dag (=5,5 mg/kg/min). |
|
NICE (2015) |
Niet vermeld. |
|
Australië (2015) |
Glucose 10% 60 ml/kg/dag (4,2 mg/kg/min) (of passend bij de leeftijd). |
|
PES (2015) |
Glucose 10% met een onderhoudssnelheid passend bij de leeftijd (na een glucosebolus vanwege ernstige symptomatische hypoglycemie). |
Glucosebolus
In tabel 4 worden de indicaties in de internationale richtlijnen van een glucosebolus weergegeven.
Tabel 4 Indicatie voor toediening van een glucosebolus in de internationale richtlijnen
|
|
In de eerste uren na geboorte |
Vanaf de eerste uren tot 24 uur na geboorte |
|
AAP (2011) |
|
|
|
Canada (2016) |
Niet expliciet benoemd. |
Niet expliciet benoemd. |
|
NICE (2015) |
Niet beschreven. |
Niet beschreven. |
|
Australië (2015) |
Overweeg bij glucoseconcentratie <1,5 mmol/L of niet meetbaar. |
Overweeg bij glucoseconcentratie <1,5 mmol/L of niet meetbaar. |
|
PES (2015) |
Ernstige symptomatische hypoglycemie. |
Ernstige symptomatische hypoglycemie. |
In de richtlijnen (AAP, Canada, Australië, PES) wordt voor een glucosebolus een dosering van 2 ml/kg glucose 10% geadviseerd. Dit komt overeen met 200 mg glucose per kg.
De WHO (2013) adviseert 2 tot 3 ml/kg glucose 10% (http://www.who.int/child_adolescent_health/documents/chd_97_1/en/index.html) en de NLS (resuscitation councel (UK) 2,5 ml per kg glucose 10% als bolus te geven.
Symptomatische hypoglycemie
Alle internationale richtlijnen benoemen symptomatische hypoglycemie als indicatie voor iv glucosetoediening.
De AAP-richtlijn geeft aan dat bij symptomen passend bij hypoglycemie én een glucoseconcentratie <2,2 mmol/L er een indicatie is voor een glucosebolus van 200 mg/kg (2 ml/kg glucose 10% iv) en/of continue iv glucosetoediening (glucose 10% 80 tot 100 ml/kg/dag; overeenkomend met 5,5 tot 7 mg/kg/min) (geen referentie).
De Canadese richtlijn geeft aan dat er consensus bestaat dat er gestart moet worden met iv glucosetoediening bij symptomatische hypoglycemie (geen referenties), waarbij gestreefd wordt naar een glucoseconcentratie >2,6 mmol/L. Bij onvoldoende stijging wordt het glucose-infuus stapsgewijs opgehoogd, zo nodig met een meer geconcentreerde glucose-oplossing om de totale vochtintake niet boven 100 tot 120 ml/kg/dag te laten komen.
De Australische richtlijn beschrijft bij zieke pasgeborenen, met of zonder klinische verschijnselen van hypoglycemie, te starten met iv glucose 60 ml/kg/dag (4,2 mg/kg/min). Overweeg glucosebolus 2 ml/kg glucose 10%. Bij onvoldoende stijging wordt het glucose-infuus stapsgewijs opgehoogd door de loopsnelheid te verhogen en/of een meer geconcentreerde glucose-oplossing te gebruiken om de totale vochtintake niet boven 100 ml/kg/dag te laten komen op de dag van geboorte.
De NICE-richtlijn beschrijft dat er consensus bestaat over iv glucosetoediening bij symptomatische hypoglycemie (Williams, 1997).
De PES-richtlijn geeft aan dat een ernstige hypoglycemie snel gecorrigeerd dient te worden met een glucosebolus 200 mg/kg, gevolgd door een glucose 10% infuus “at a maintenance rate for age” (geen referentie genoemd).
Controle van de glucoseconcentratie na een interventie
De AAP-richtlijn beschrijft een glucosecontrole van één uur na interventie bij asymptomatische hypoglycemie (geen advies bij symptomatische hypoglycemie).
De Canadese richtlijn geeft aan dat er consensus bestaat over het feit dat er gestart moet worden met iv glucosetoediening bij symptomatische hypoglycemie. Hierna dient de glucoseconcentratie elke 30 minuten gecontroleerd worden en wordt er gestreefd naar een glucoseconcentratie ≥2,6 mmol/L.
De Australische richtlijn beschrijft een glucosecontrole van 30 tot 60 minuten na een voedingsinterventie; 30 minuten na toediening van 40% dextrose-gel of na de start van iv glucose. Controleer vervolgens elk uur tijdens iv glucosetoediening, totdat de glucoseconcentratie ≥2,6 mmol/L is. Controleer daarna elke vier tot zes uur. Controleer de glucoseconcentratie 30 minuten na verandering in concentratie of loopsnelheid van de iv glucose, bij vermindering van de iv glucose en bij veranderingen in de orale/enterale voeding, zoals overgang van kunstvoeding op exclusief borstvoeding.
De NICE- en PES-richtlijnen vermelden niet wanneer de glucoseconcentratie gecontroleerd moet worden na een interventie.
Afbouwen iv glucose
De richtlijnen van de AAP, NICE en PES geven geen aanbevelingen ten aanzien van het afbouwen van iv glucose.
De Canadese richtlijn geeft aan dat de iv glucosetoediening kan worden afgebouwd als de glucoseconcentratie gedurende 12 uur stabiel is.
De Australische richtlijn geeft aan de iv glucosetoediening te verminderen als de glucoseconcentratie gedurende 12 uur stabiel is. Verlaag de iv glucosetoediening niet abrupt. Verminder de iv glucosetoediening geleidelijk als het volume van de enterale voeding opgehoogd wordt.
Ingezonden lokale protocollen
Voedingsinterventies
In alle lokale protocollen waarin behandeling bij neonatale hypoglycemie wordt beschreven (n =33) wordt “(bij)voeding” als eerste interventie genoemd. De wijze waarop de (bij)voeding verhoogd wordt is weergegeven in tabel 5. Frequenter aanleggen bij borstvoeding wordt in geen van de protocollen expliciet of als enige maatregel benoemd als interventie bij neonatale hypoglycemie (wel als preventieve maatregel). Een ingezonden protocol betrof een handleiding voor het toevoegen van glucose 50% aan de voeding.
In vier protocollen werd het overgaan van acht naar 12 voedingen genoemd als interventie bij neonatale hypoglycemie.
Tabel 5 Beschrijving voedingsinterventies in de lokale protocollen
|
Voedingsinterventie |
Aantal protocollen (%) |
|
(Extra) voeding, hoeveelheid niet omschreven |
11 (31%) |
|
(Bij)voeding in ml per voeding 10 ml 10 tot 15 ml 15 tot 20 ml 20 ml |
6 (17%) 1x 1x 1x 3x |
|
(Bij)voeding ophogen in mg/kg/min of ml/kg/dag 1 mg/kg/min (20 ml/kg/dag) 1 tot 2 mg/kg/min (20 tot 40 ml/kg/dag) 2 mg/kg/min (40 ml/kg/dag) 1.5 tot 3 mg/kg/min (30 tot 60 ml/kg/dag) 2 tot 3 mg/kg/min (40 tot 60 ml/kg/dag) 3 tot 4 mg/kg/min (60 tot 80 ml/kg/dag) |
17 (47%) 1x 6x 6x 1x 2x 1x |
|
Glucose 50% toevoegen aan de voeding |
1 (3%) |
|
Geen advies over behandeling bij hypoglycemie |
1 (3%) |
Dextrose-gel
Geen van de lokale protocollen benoemde dextrose-gel als optie voor de behandeling van neonatale hypoglycemie.
Iv glucosetoediening bij asymptomatische hypoglycemie
In 26/36 (72%) van de lokale protocollen van Nederlandse ziekenhuizen werd een advies gegeven over iv glucosetoediening bij asymptomatische hypoglycemie (tabel 6). Dit betrof het starten met een continu infuus en/of een glucosebolus bij een eenmalig lage glucoseconcentratie, bij een recidiverende hypoglycemie of combinatie hiervan. Sommige protocollen maken onderscheid tussen de eerste uren na de geboorte en daarna. Er is een grote van variatie in de gekozen criteria, zowel voor de eenmalige lage glucoseconcentraties als bij recidiverende hypoglycemie.
In 7/36 (19%) protocollen werd geen enkel advies gegeven ten aanzien van een interventie met iv glucose.
Tabel 6 Indicaties voor iv glucosetoediening bij asymptomatische hypoglycemie in de lokale protocollen (N=36)
|
Eerste uren na geboorte |
Aantal protocollen |
Vanaf de eerste uren |
Aantal protocollen |
|
Eenmalig lage glucose Start continu infuus als: ≤0,8 mmol/L ≤1,0 mmol/L 1,0 tot 1,5 mmol/L ≤1,1 mmol/L 1,1 tot 1,4 mmol/L 1,3 tot 2,0 mmol/L 1,4 tot 2,2 mmol/L <1,5 mmol/L 1,5 tot 2,0 mmol/L <2,0 mmol/L Niet gespecificeerd |
15 (42%) 1 1 1 1 1 1 1 4 2 1 1 |
Eenmalig lage glucose Start continu infuus als: dezelfde criteria als in de eerste uren.
Start continu infuus bij andere eenmalig lage glucosewaarde: <1,5 mmol/L <2,0 mmol/L
Eerste uren geen advies: <1,5 mmol/L (<6 uur) & <2,0 mmol/L (vanaf zes uur) 1,8 tot 2,2 mmol/L <2,0 mmol/L |
10 (28%)
3 (8%) 1 2
5 (14%)
1 1 3 |
|
Eenmalig lage glucose Glucosebolus (+continu infuus): <0,9 tot <1,3 mmol/L (afhankelijk van leeftijd tussen één tot drie uur) <1,0 mmol/L ≤1,0 mmol/L / <1,1 mmol/L <1,2 mmol/L <1,3 mmol/L ≤1,3 mmol/L / <1,4 mmol/L <1,5 mmol/L <1,8 mmol/L ≤1,9 mmol/L |
19 (53%)
1 5 2 1 3 2 3 1 1 |
Eenmalig lage glucose Glucosebolus (+continu infuus): Dezelfde criteria als in de eerste uren
Glucosebolus (+continu infuus): <1,5 (vier tot 12 uur) of <1,7 mmol/L (vanaf 12 uur)
Eerste uren geen advies: ≤1,1 mmol/L
|
16 (44%)
1 (3%)
1
1 (3%) 1 |
|
Recidiverende hypoglycemie Start continu infuus als: “Onvoldoende stijging” 2x <1,5 mmol/L 2x <1,5 of persisterend 1,5 tot 2,0 mmol/L 1,5 tot 2,5 mmol/L na interventie 2x <2,0 mmol/L <2,2 mmol/L na interventie 2x <2,6 mmol/L <2,6 mmol/L na interventie 2x ≤2,2 of 3x ≤2,6 mmol/L |
14 (39%) 1 3
1 1 2 1 3 1 1 |
Recidiverende hypoglycemie Dezelfde criteria als in de eerste uren.
Start continu infuus bij andere waarden vanaf de eerste uren: bij herhaling 2,0 tot 2,5 mmol/L 2x <2,0 mmol/L Persisterende hypoglycemie 2x <2,2 of 3x <2,6 mmol/L 2x <1,9 of 3x <2,3 mmol/L |
10 (28%)
9 (25%) 4 2 1 1 1 |
|
Recidiverende hypoglycemie Glucosebolus (+continu infuus): <1,5 mmol/L na interventie 3x 1,8 tot 2,2 mmol/L Persisterend <2,6 mmol/L |
3 (8%) 1 1 1 |
Recidiverende hypoglycemie Dezelfde criteria als in de eerste uren
|
3 (8%) |
Symptomatische hypoglycemie
In 22/36 (61%) van de lokale protocollen van Nederlandse ziekenhuizen worden interventies bij symptomatische hypoglycemie beschreven. In 16 protocollen worden alleen symptomen genoemd als criterium voor symptomatische hypoglycemie. In de andere protocollen wordt daar een glucoseconcentratie aan toegevoegd (4x <2,6 mmol/L; 1x <2,2 mmol/L en 1x <1,0 mmol/L). Alle 22 protocollen geven aan dat iv glucosetoediening geïndiceerd is bij symptomatische hypoglycemie; 19/22 protocollen adviseren een glucosebolus gevolgd door een onderhoudsinfuus; één adviseert alleen een glucosebolus en twee adviseren alleen een onderhoudsinfuus.
Doseringen glucosebolus en onderhoudsinfuus
De aanbevolen dosering voor het onderhoudsinfuus bij asymptomatische hypoglycemie varieert tussen de lokale protocollen (tabel 7). In 13 protocollen wordt geen dosering voor een onderhoudsinfuus beschreven.
Tabel 7 Aanbevolen dosering onderhoudsinfuus in de lokale protocollen
|
|
Aantal protocollen (%) |
|
4 mg/kg/min |
2 (6%) |
|
5 mg/kg/min |
4 (11%) |
|
6 mg/kg/min |
3 (8%) |
|
7 mg/kg/min |
1 (3%) |
|
4 tot 8 mg/kg/min |
2 (6%) |
|
5 tot 8 mg/kg/min |
4 (11%) |
|
AT 4 / pre 6 mg/kg/min |
4 (11%) |
|
40 tot 48 ml/kg/dag (2,8 tot 3,3 mg/kg/min) |
2 (6%) |
|
60 tot 85 ml/kg/dag (4,2 tot 5,6 mg/kg/min) |
1 (3%) |
NB: in sommige protocollen betreft het de totale intake (enteraal plus iv)
20 protocollen vermelden met welke stappen de iv koolhydraatintake opgehoogd moet worden als al iv glucose wordt toegediend (tabel 8).
Tabel 8 Ophogen van de iv koolhydraatintake in de lokale protocollen
|
|
Aantal protocollen (%) |
|
(min.) 1 tot 2 mg/kg/min |
2 (6%) |
|
(min.) 2 mg/kg/min of met 20% als KHI >10 mg/kg/min |
6 (17%) |
|
(min.) 2 mg/kg/min |
6 (17%) |
|
stap van 50% |
3 (8%) |
|
20 ml/kg/dag =1,4 mg/kg/min |
1 (3%) |
|
stappen van 2 ml/kg/uur =3,3 mg/kg/min |
1 (3%) |
|
als KHI <8 mg/kg/min: 2 mg/kg/min; en als KHI >8 mg/kg/min: 4 mg/kg/min |
1 (3%) |
In 25 protocollen wordt een dosering beschreven voor een glucosebolus. In het merendeel is dit een dosering van 200 mg/kg (18 protocollen); vijf protocollen adviseren 250 mg/kg. In twee protocollen wordt een dosering van 400 mg/kg genoemd bij convulsies en in één protocol tevens een dosering van 500 tot 1000 mg/kg bij zeer ernstige symptomatische hypoglycemie (convulsies en respiratoire bedreiging).
20 protocollen vermelden een dosering voor de iv koolhydraatintake na een glucosebolus en/of met welke stappen de iv koolhydraatintake opgehoogd moet worden als al iv glucose wordt toegediend (tabel 9).
Tabel 9 Dosering onderhoudsinfuus na glucosebolus in de lokale protocollen
|
|
Aantal protocollen (%) |
|
2 mg/kg/min |
2 (6%) |
|
3,3 mg/kg/min (2 ml/kg/uur) |
1 (3%) |
|
4 mg/kg/min |
1 (3%) |
|
5 mg/kg/min |
3 (8%) |
|
6 mg/kg/min |
5 (14%) |
|
6,7 mg/kg/min (4 ml/kg/uur) |
2 (6%) |
|
4 tot 8 mg/kg/min |
1 (3%) |
|
5 tot 8 mg/kg/min |
3 (8%) |
|
6 tot 8 mg/kg/min |
1 (3%) |
|
4,2 tot 6 mg/kg/min (60 tot 85 ml/kg/dag) |
1 (3%) |
|
Als al intraveneus glucose wordt toegediend ophogen met |
|
|
2 mg/kg/min |
4 (11%) |
|
2 mg/kg/min of 20% als KHI >10 mg/kg/min |
3 (8%) |
|
2 ml/kg/uur (3,3 mg/kg/min) |
1 (3%) |
|
met stappen van 50% |
2 (6%) |
Controle van de glucoseconcentratie na een interventie
Na een voedingsinterventie of start onderhoudsinfuus beschrijven de meeste lokale protocollen een extra glucosecontrole na één uur (tabel 10). Na een glucosebolus wordt vaker gekozen voor een kortere interval van 30 minuten.
Tabel 10 Extra glucosecontroles na een interventie in de lokale protocollen
|
|
Aantal protocollen (%) |
||
|
|
Voedingsinterventie |
Onderhoudsinfuus |
Na glucosebolus |
|
30 min |
1 (3%) |
1 (3%) |
7 (19%) |
|
1 uur |
27 (82%) |
21 (58%) |
8 (22%) |
|
1 tot 1,5 uur |
1 (3%) |
|
|
Afbouwen iv glucose
In 13/36 (36%) protocollen wordt beschreven wanneer en hoe de iv glucosetoediening afgebouwd kan worden (tabel 11).
Tabel 11 Advies voor afbouwen van de intraveneuze glucosetoediening in de lokale protocollen
|
Wanneer afbouwen? |
Aantal protocollen (%) |
|
na (minimaal) 24 uur |
5 (14%) |
|
per 12 tot 24 uur |
1 (3%) |
|
glucose 2x (bij herhaling) ≥2,6 (of “goed”) |
4 (11%) |
|
glucose 2x ≥3,0 |
1 (3%) |
|
glucose ≥3,5 |
2 (6%) |
|
Snelheid van afbouwen |
|
|
0,5 mg/kg/min |
1 (3%) |
|
1 mg/kg/min a zes uur |
1 (3%) |
|
2 mg/kg/min |
1 (3%) |
|
2,5 mg/kg/min |
2 (6%) |
|
10 tot 20% per drie tot zes uur |
1 (3%) |
|
10% per 12 tot 24 uur |
1 (3%) |
|
“gezond verstand” |
1 (3%) |
|
“langzaam afbouwen” |
2 (6%) |
|
niet vermeld |
3 (8%) |
Zoeken en selecteren
Deze uitgangsvraag kwam tot stand op basis van consensus met behulp van bestaande literatuur, internationale richtlijnen en ingezonden lokale protocollen. Twee recente reviews werden als basis gebruikt bij de beschrijving van de literatuur (Harding, 2017; Rozance 2016b) aangevuld met een literatuursearch (zie de zoekverantwoording).
Interventies algemeen
Algemeen uitgangspunt in veel richtlijnen en protocollen (zonder onderbouwing of literatuurreferenties) is dat de glucosewaarde en de wijze waarop interventies plaatsvinden afgestemd moeten worden op individuele karakteristieken (niet nader gedefinieerd) en de klinische situatie van de pasgeborene. Daarnaast mogen de interventies niet onnodig leiden tot het scheiden van de moeder en het kind en/of het onderbreken van de borstvoeding (Adamkin, 2011).
De behandeling bij neonatale hypoglycemie bestaat in eerste instantie uit het verhogen van de koolhydraatintake. Hiervoor kunnen verschillende interventies worden toegepast:
- frequenter aanleggen bij borstvoeding;
- bijvoeding;
- dextrose-gel;
- andere interventies: verhogen van de voedingsfrequentie bij fles- of sondevoeding; orale of enterale glucosetoediening;
- continue intraveneuze glucosetoediening;
- toediening van een glucosebolus gevolgd door een continu-infuus.
Zie de aanverwante producten voor formules voor het berekenen van de koolhydraatintake.
Referenties
- Adamkin DH. Neonatal hypoglycemia. Current Opinion in Pediatrics. 2016;28(2):150–155. https://doi.org/10.1097/MOP.0000000000000319.
- Adamkin DH. Postnatal Glucose Homeostasis in Late-Preterm and Term Infants. PEDIATRICS. 2011;127(3):575–579. https://doi.org/10.1542/peds.2010-3851.
- Agrawal RK, Lui K, Gupta JM. Neonatal hypoglycaemia in infants of diabetic mothers. Journal of Paediatrics and Child Health. 2000;36(4):354–356. https://doi.org/10.1046/j.1440-1754.2000.00512.x.
- Alkalay AL, Sarnat HB, Flores-Sarnat L, et al. Population meta-analysis of low plasma glucose thresholds in full-term normal newborns. American Journal of Perinatology. 2006;23(2):115–119. https://doi.org/10.1055/s-2006-931912.
- Andermann A, Blancquaert I, Beauchamp S, et al. Revisiting Wilson and Jungner in the genomic age: A review of screening criteria over the past 40 years. Bulletin of the World Health Organization. 2008;86(4):317–319. https://doi.org/10.2471/BLT.07.050112.
- Araz N, Araz M. Frequency of neonatal hypoglycemia in large for gestational age infants of non-diabetic mothers in a community maternity hospital. Acta Medica (Hradec Kralove). 2006;49(4):237-9.
- Atkin SH, Dasmahapatra A, Jaker MA, et al. Fingerstick glucose determination in shock. Annals of Internal Medicine. 1991;114(12):1020–1024. https://doi.org/10.7326/0003-4819-114-12-1020.
- Au CPY, Raynes-Greenow CH, Turner RM, et al. Antenatal management of gestational diabetes mellitus can improve neonatal outcomes. Midwifery. 2016;34:66–71. https://doi.org/10.1016/j.midw.2016.01.001.
- Aynsley-Green A. Glucose: A fuel for thought! Journal of Paediatrics and Child Health. 1991;27(1):21–30. https://doi.org/10.1111/j.1440-1754.1991.tb00340.x.
- Aynsley-Green, A. Glucose, the Brain and the Paediatric Endocrinologist. Hormone Research. 1996;46(1):8–25. https://doi.org/10.1159/000184971.
- Aziz K, Dancey, Canadian Paediatric Society Fetus and Newborn Committee. Screening guidelines for newborns at risk for low blood glucose. Paediatric Child Health. 2004;9(10):723–729. Reaffirmed 2018.
- Balion C, Grey V, Ismaila A, et al. Screening for hypoglycemia at the bedside in the neonatal intensive care unit (NICU) with the Abbott PCx glucose meter. BMC Pediatrics. 2006;6. https://doi.org/10.1186/1471-2431-6-28.
- Bazaes RA, Salazar TE, Pittaluga E, et al. Glucose and lipid metabolism in small for gestational age infants at 48 hours of age. Pediatrics. 2003;111(4 Pt 1):804–809. https://doi.org/10.1542/peds.111.4.804.
- Beardsall K. Measurement of glucose levels in the newborn. Early Human Development. 2010. https://doi.org/10.1016/j.earlhumdev.2010.05.005.
- Bennett C, Fagan E, Chaharbakhshi E, et al. Implementing a Protocol Using Glucose Gel to Treat Neonatal Hypoglycemia. Nursing for Women’s Health. 2016;20(1):64–74. https://doi.org/10.1016/j.nwh.2015.11.001.
- Bevolkingsonderzoeken en screeningen - RIVM. Retrieved April 22, 2018, from https://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen.
- Bhat MA, Kumar P, Bhansali A, et al. Hypoglycemia in small for gestational age babies. Indian Journal of Pediatrics. 2000;67(6):423–427. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/10932962.
- Boluyt N. Neurodevelopment After Neonatal Hypoglycemia: A Systematic Review and Design of an Optimal Future Study. PEDIATRICS. 2006;117(6):2231–2243. https://doi.org/10.1542/peds.2005-1919.
- Boundy EO, Dastjerdi R, Spiegelman D, et al. Kangaroo Mother Care and Neonatal Outcomes: A Meta-analysis. Pediatrics. 2016;137(1):e20152238. https://doi.org/10.1542/peds.2015-2238.
- Bragg J, Green G. Does early enteral feeding prevent hypoglycemia in small for gestational age neonates? Journal of Neonatal-Perinatal Medicine. 2013;6(2):131–135. Retrieved from http://iospress.metapress.com/content/121063/?p=e4b28739203a487a98e3ffa8f6e525e6&pi=51%5Cnhttp://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=reference&D=emex&NEWS=N&AN=369606153.
- Brand PL, Molenaar NL, Kaaijk C, et al. Neurodevelopmental outcome of hypoglycaemia in healthy, large for gestational age, term newborns. Archives of Disease in Childhood. 2005;90(1):78-81.
- Burns CM, Rutherford MA, Boardman JP, et al. Patterns of Cerebral Injury and Neurodevelopmental Outcomes After Symptomatic Neonatal Hypoglycemia. PEDIATRICS. 2008;122(1):65–74. https://doi.org/10.1542/peds.2007-2822.
- Burrin JM, Alberti KG. What is blood glucose: can it be measured? Diabetic Medicine : A Journal of the British Diabetic Association. 1990;7(3):199–206. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/2139389.
- Carraro P, Plebani M. Post-analytical errors with portable glucose meters in the hospital setting. Clinica Chimica Acta. 2009;404(1):65–67. https://doi.org/10.1016/j.cca.2009.03.013.
- Chan AYW, Swaminathan R, Cockram CS. Effectiveness of sodium fluoride as a preservative of glucose in blood. Clinical Chemistry. 1989;35(2):315–317.
- Chertok IRA, Raz I, Shoham I, et al. Effects of early breastfeeding on neonatal glucose levels of term infants born to women with gestational diabetes. Journal of Human Nutrition and Dietetics. 2009;22(2):166–169. https://doi.org/10.1111/j.1365-277X.2008.00921.x.
- Chi Luong K, Long Nguyen T, Huynh Thi DH, et al. Newly born low birthweight infants stabilise better in skin-to-skin contact than when separated from their mothers: A randomised controlled trial. Acta Paediatrica, International Journal of Paediatrics. 2016;105(4):381–390. https://doi.org/10.1111/apa.13164.
- Christensson K. Fathers can effectively achieve heat conservation in healthy newborn infants. Acta Paediatrica (Oslo, Norway : 1992). 1996;85(11):1354–1360. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/8955466.
- Clinical Guidelines, Queensland, Health Q. Maternity and Neonatal Clinical Guideline – Neonatal hypoglycemia. 2013. Retrieved from www.health.qld.gov.au/qcg.
- Cordero L, Treuer SH, Landon MB, et al. Management of Infants of Diabetic Mothers. Arch Pediatr Adolesc Med. 1998;152:249–254.
- Cornblath M, Hawdon JM, Williams AF, et al. Controversies Regarding Definition of Neonatal Hypoglycemia: Suggested Operational Thresholds. PEDIATRICS. 2000;105(5). https://doi.org/10.1542/peds.105.5.1141.
- Cornblath M, Reisner SH. Blood glucose in the neonate and its clinical significance. The New England Journal of Medicine. 1965;273(7):378–381. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/21417085.
- Cornblath M. Neonatal hypoglycemia 30 years later: does it injure the brain? Historical summary and present challenges. Acta Paediatrica Japonica : Overseas Edition. 1997;39(Suppl 1):S7-11. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/9200872.
- Cowett RM, D’Amico LB. Capillary (heelstick) versus venous blood sampling for the determination of glucose concentration in the neonates. Biology of the Neonate. 1992;62:32–36.
- Cowett RM, Oh W, Pollak A, et al. Glucose disposal of low birth weight infants: steady state hyperglycemia produced by constant intravenous glucose infusion. Pediatrics. 1979;63(3):389–396. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/440840.
- Coyle MC, Jacobs E, Chappie A, et al. Effects of Different Sample Types on Glucose Measurements A CLSI report for global application. Clinical and Laboratory Standards Institute. 2015;35. Retrieved from https://clsi.org/media/1501/poct06ed1_sample.pdf.
- Critchell CD, Savarese V, Callahan A, et al. Accuracy of bedside capillary blood glucose measurements in critically ill patients. Intensive Care Medicine. 2007;33(12):2079–2084. https://doi.org/10.1007/s00134-007-0835-4.
- Croke J, Sullivan M, Ryan-Drover A, et al. Two hour blood glucose levels in at-risk babies: An audit of Canadian guidelines. Paediatrics and Child Health. 2009;14(4):238–244. https://doi.org/10.1093/pch/14.4.238.
- D’Orazio P, Burnett RW, Fogh-Andersen N, et al. Approved IFCC recommendation on reporting results for blood glucose: International Federation of Clinical Chemistry and Laboratory Medicine Scientific Division, Working Group on Selective Electrodes and Point-of-Care Testing (IFCC-SD-WG-SEPOCT). Clinical Chemistry and Laboratory Medicine. 2006;44(12):1486–1490. https://doi.org/10.1515/CCLM.2006.275.
- De Carvalho M, Robertson S, Friedman A, et al. Effect of frequent breast-feeding on early milk production and infant weight gain. Pediatrics. 1983;72(3):307–311. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/6889034.
- De Carvalho M, Robertson S, Merkatz R, et al. Milk intake and frequency of feeding in breast fed infants. Early Human Development. 1982;7(2):155–163. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/7151727.
- De León DD, Thornton PBS, Stanley CBA, et al. Hypoglycemia in the Newborn and Infant PRINCIPLES OF GLUCOSE METABOLISM. 2014. Retrieved from https://www.clinicalkey.es.webproxy.uach.cl:2443/service/content/pdf/watermarked/3-s2.0-B9781455748587000159.pdf?locale=es_ES.
- De Rooy L, Hawdon J. Nutritional Factors That Affect the Postnatal Metabolic Adaptation of Full-Term Small- and Large-for-Gestational-Age Infants. PEDIATRICS. 2002;109(3):e42–e42. https://doi.org/10.1542/peds.109.3.e42.
- Devaskar SU, Garg M. 95 Disorders of Carbohydrate Metabolism in the Neonate Placental Transport of Nutrients: Maternal-Fetal Relationship. 2017. Retrieved from: https://obgynkey.com/disorders-of-carbohydrate-metabolism-in-the-neonate/.
- Dijk PH, De Vries TW, De Beer JJAH. [Guideline “Prevention, diagnosis and treatment of hyperbilirubinemia in the neonate with a gestational age of 35 or more weeks”]. Nederlands Tijdschrift Voor Geneeskunde. 2009;153:A93. Retrieved from https://www.nvk.nl/Portals/0/richtlijnen/hyperbili/richtlijnhyperbili.pdf.
- Doctor BA, O’Riordan MA, Kirchner HL, et al. Perinatal correlates and neonatal outcomes of small for gestational age infants born at term gestation. American Journal of Obstetrics and Gynecology. 2001;185(3):652–659. https://doi.org/10.1067/mob.2001.116749.
- Duvanel CB, Fawer CL, Cotting J, et al. Long-term effects of neonatal hypoglycemia on brain growth and psychomotor development in small-for-gestational-age preterm infants. The Journal of Pediatrics. 1999;134(4):492–498. https://doi.org/10.1016/S0022-3476(99)70209-X.
- Esakoff TF, Cheng YW, Sparks TN, et al. The association between birthweight 4000 g or greater and perinatal outcomes in patients with and without gestational diabetes mellitus. American Journal of Obstetrics & Gynecology. 2009;200(6):672.e1-4.
- Feig SA, Shohet SB, Nathan DG. Energy metabolism in human erythrocytes. I. Effects of sodium fluoride. The Journal of Clinical Investigation. 1971;50(8):1731–1737. https://doi.org/10.1172/JCI106662.
- Finfer S, Wernerman J, Preiser JC, et al. Clinical review: Consensus recommendations on measurement of blood glucose and reporting glycemic control in critically ill adults. Critical Care (London, England). 2013;17(3):229. https://doi.org/10.1186/cc12537.
- Flaherman VJ, Aby J, Burgos AE, et al. Effect of Early Limited Formula on Duration and Exclusivity of Breastfeeding in At-Risk Infants: An RCT. PEDIATRICS. 2013;131(6):1059–1065. https://doi.org/10.1542/peds.2012-2809.
- Flores-le Roux JA, Sagarra E, Benaiges D, et al. A prospective evaluation of neonatal hypoglycaemia in infants of women with gestational diabetes mellitus. Diabetes Research and Clinical Practice. 2012;97(2):217–222. https://doi.org/10.1016/j.diabres.2012.03.011.
- Gambino R. Glucose: A simple molecule that is not simple to quantify. Clinical Chemistry. 2007. https://doi.org/10.1373/clinchem.2007.094466.
- Ghavane S, Murki S, Subramanian S, et al. Kangaroo Mother Care in Kangaroo ward for improving the growth and breastfeeding outcomes when reaching term gestational age in very low birth weight infants. Acta Paediatrica, International Journal of Paediatrics. 2012;101(12):545–550. https://doi.org/10.1111/apa.12023.
- Groenendaal F, Elferink-Stinkens P. Hypoglycaemia and seizures in large-for-gestational-age (LGA) full-term neonates. Acta Paediatrica, International Journal of Paediatrics. 2006;95(7):874–876. https://doi.org/10.1080/08035250500544948.
- Güemes M, Rahman SA, Hussain K. What is a normal blood glucose? Archives of Disease in Childhood. 2016;101(6):569–574. https://doi.org/10.1136/archdischild-2015-308336.
- Guideline N. Diabetes in pregnancy. 2015;29(5):685-99. https://doi.org/10.1016/j.bpobgyn.2015.04.009.
- Gunn V, Nechyba C. The Harriet Lane Handbook. A Manual for Pediatric House Officers. Postgraduate Medical Journal. 2002;61(716):556–557. https://doi.org/10.1136/pgmj.61.716.556-a.
- Gyurkovits Z, Kálló K, Bakki J, et al. Neonatal outcome of macrosomic infants: an analysis of a two-year period. European Journal of Obstetrics, Gynecology, & Reproductive Biology. 2011;159(2):289-92.
- Hagvik J. Comment on: Bellini C, Serra G, Risso D, Mazzella M, Bonioli E. Reliability assessment of glucose measurement by HemoCue analyser in a neonatal intensive care unit. Clin Chem Lab Med 2007; 45(11):1549-54. Clinical Chemistry and Laboratory Medicine. 2008;46(5):729–30; author reply 731. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/18839476.
- Haninger NC, Farley CL. Screening for hypoglycemia in healthy term neonates: Effects on breastfeeding. Journal of Midwifery and Women’s Health. 2001;46(5):292–298. https://doi.org/10.1016/S1526-9523(01)00180-5.
- Harding JE, Harris DL, Hegarty JE, et al. An emerging evidence base for the management of neonatal hypoglycaemia. Early Human Development. 2017;104:51–56. https://doi.org/10.1016/j.earlhumdev.2016.12.009.
- Harris DL, Alsweiler JM, Ansell JM, et al. Outcome at 2 Years after Dextrose Gel Treatment for Neonatal Hypoglycemia: Follow-Up of a Randomized Trial. Journal of Pediatrics. 2016;170:54–59e2. https://doi.org/10.1016/j.jpeds.2015.10.066.
- Harris DL, Gamble GD, Weston PJ, et al. What Happens to Blood Glucose Concentrations After Oral Treatment for Neonatal Hypoglycemia? Journal of Pediatrics. 2017;190:136–141. https://doi.org/10.1016/j.jpeds.2017.06.034.
- Harris DL, Weston PJ, Battin MR, et al. A survey of the management of neonatal hypoglycaemia within the Australian and New Zealand Neonatal Network. Journal of Paediatrics and Child Health. 2014;50(10):E55–E62. https://doi.org/10.1111/j.1440-1754.2009.01599.x.
- Harris DL, Weston PJ, Harding JE. Incidence of neonatal hypoglycemia in babies identified as at risk. Journal of Pediatrics. 2012;161(5):787–791. https://doi.org/10.1016/j.jpeds.2012.05.022.
- Harris DL, Weston PJ, Harding JE. Lactate, rather than ketones, may provide alternative cerebral fuel in hypoglycaemic newborns. Archives of Disease in Childhood: Fetal and Neonatal Edition. 2015;100(2):F161–F164. https://doi.org/10.1136/archdischild-2014-306435.
- Harris DL, Weston PJ, Signal M, et al. Dextrose gel for neonatal hypoglycaemia (the Sugar Babies Study): A randomised, double-blind, placebo-controlled trial. The Lancet. 2013;382(9910):2077–2083. https://doi.org/10.1016/S0140-6736(13)61645-1.
- Harris DL, Weston PJ, Williams CE, et al. Cot-side electroencephalography monitoring is not clinically useful in the detection of mild neonatal hypoglycemia. Journal of Pediatrics. 2011;159(5):755–760. https://doi.org/10.1016/j.jpeds.2011.04.026.
- Hawdon J, Cheetham T, Schenk DJ, et al. Metabolic and endocrine disorders. In Rennie and Roberton’s Textbook of Neonatology (pp. 849–926). 2012. https://doi.org/10.1016/B978-0-7020-3479-4.00035-0.
- Hawdon JM, Platt MPW. Patterns of metabolic adaptation for preterm and term infants in the first neonatal week, (October 1991). 1992;357–365.
- Hawdon JM, Ward Platt MP, Aynsley-Green A. Patterns of metabolic adaptation for preterm and term infants in the first neonatal week. Archives of Disease in Childhood, 67(4 SPEC NO). 1992;357–365. https://doi.org/10.1136/adc.67.4_Spec_No.357.
- Hawdon JM. Best Practice Guidelines: Neonatal Hypoglycaemia. Early Human Development. 2010;86(5):261. https://doi.org/10.1016/j.earlhumdev.2010.05.007.
- Hawdon JM. Investigation, prevention and management of neonatal hypoglycaemia (impaired postnatal metabolic adaptation). Paediatrics and Child Health. 2012. https://doi.org/10.1016/j.paed.2011.08.006.
- Hawdon JM. Postnatal metabolic adaptation and neonatal hypoglycaemia. Paediatrics and Child Health (United Kingdom). 2016. https://doi.org/10.1016/j.paed.2015.12.001.
- Hawkes CP, Stanley CA. 53 Pathophysiology of Neonatal Hypoglycemia. 2017.
- Hay WW, Cornblath M. Historical Perspectives: Transient Symptomatic Neonatal Hypoglycemia. NeoReviews. 2003;4(1):1e–5. https://doi.org/10.1542/neo.4-1-e1.
- Heck LJ, Erenberg A. Serum glucose levels in term neonates during the first 48 hours of life. The Journal of Pediatrics. 1987;110(1):119–122. https://doi.org/10.1016/S0022-3476(87)80303-7.
- Hegarty J, Harding JE, Crowther C, et al. Oral dextrose gel for the prevention of hypoglycaemia in newborn infants (Protocol). Cochrane Database of Systematic Reviews, (4). 2016. https://doi.org/10.1002/14651858.CD012152.
- Hegarty JE, Harding JE, Crowther CA, et al. Oral dextrose gel to prevent hypoglycaemia in at-risk neonates. Cochrane Database of Systematic Reviews. 2017. https://doi.org/10.1002/14651858.CD012152.pub2.
- Hegarty JE, Harding JE, Gamble GD, et al. Prophylactic Oral Dextrose Gel for Newborn Babies at Risk of Neonatal Hypoglycaemia: A Randomised Controlled Dose-Finding Trial (the Pre-hPOD Study). PLoS Medicine. 2016;13(10):1–19. https://doi.org/10.1371/journal.pmed.1002155.
- Hoftiezer L, Hukkelhoven CWPM, Hogeveen M, et al. Geboortegewichtcurven - Perined. Retrieved April 22, 2018, from https://www.perined.nl/producten/geboortegewichtcurven.
- Holtrop PC. The Frequency of Hypoglycemia in Full-Term Large and Small for Gestational Age Newborns. American Journal of Perinatology. 1993;10(2):150–154. https://doi.org/10.1055/s-2007-994649.
- Hortensius J, Slingerland RJ, Kleefstra N, et al. Self-monitoring of blood glucose: The use of the first or the second drop of blood. Diabetes Care. 2011;34(3):556–560. https://doi.org/10.2337/dc10-1694.
- Inoue S, Egi M, Kotani J, et al. Accuracy of blood-glucose measurements using glucose meters and arterial blood gas analyzers in critically ill adult patients: systematic review. Critical Care (London, England). 2013;17(2):R48. https://doi.org/10.1186/cc12567.
- Ishikawa N. Natural progress of blood glucose in full-term low-grade low-birthweight infants. Pediatrics International. 2002;44(6):583–589. https://doi.org/10.1046/j.1442-200X.2002.01637.x.
- Jain R, Myers TF, Kahn SE, et al. How accurate is glucose analysis in the presence of multiple interfering substances in the neonate? (Glucose analysis and interfering substances). Journal of Clinical Laboratory Analysis. 1996;10(1):13–16. https://doi.org/10.1002/(SICI)1098-2825(1996)10:1<13::AID-JCLA3>3.0.CO;2-M.
- Jain V, Chen M, Menon RK. Chapter 94 – Disorders of Carbohydrate Metabolism. Avery’s Diseases of the Newborn. 2012;1320–1329. https://doi.org/10.1016/B978-1-4377-0134-0.10094-0.
- Janssen K, Delanghe J. Importance of the pre-analytical phase in blood glucose analysis. Acta Clinica Belgica. 2010;65(5):311–318. https://doi.org/10.1179/acb.2010.068.
- Johnson CL, Versalovic J. The human microbiome and its potential importance to pediatrics. Pediatrics. 2012;129(5):950–960. https://doi.org/10.1542/peds.2011-2736.
- Jonas D, Dietz W, Simma B. Hypoglycemia in newborn infants at risk. Klinische Padiatrie. 2014;226(5):287-91.
- Joosten KF, Schellekens AP, Waelkens JJ, et al. [Erroneous diagnosis “neonatal hypoglycemia” due to incorrect preservation of blood samples]. Ned Tijdschr Geneeskd. 1991;135(37):1691–1694. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/1922513.
- Kaiser JR, Bai S, Gibson N, et al. Association between transient newborn hypoglycemia and fourth-grade achievement test proficiency: A population-based study. JAMA Pediatrics. 2015;169(10):913–921. https://doi.org/10.1001/jamapediatrics.2015.1631.
- Kanji S, Buffie J, Hutton B, et al. Reliability of point-of-care testing for glucose measurement in critically ill adults. Critical Care Medicine. 2005;33(12):2778–2785. https://doi.org/10.1097/01.CCM.0000189939.10881.60.
- Kaplan M, Blondheim O, Alon I, et al. Screening for hypoglycemia with plasma in neonatal blood of high hematocrit value. Critical Care Medicine. 1989;17(3):279–282. https://doi.org/10.1097/00003246-198903000-00016.
- Kautzky-Willer A, Bancher-Todesca D, Weitgasser R, et al. The impact of risk factors and more stringent diagnostic criteria of gestational diabetes on outcomes in central European women. Journal of Clinical Endocrinology and Metabolism. 2008;93(5):1689–1695. https://doi.org/10.1210/jc.2007-2301.
- Kerstjens JM, Bocca-Tjeertes IF, de Winter AF, et al. Neonatal Morbidities and Developmental Delay in Moderately Preterm-Born Children. Pediatrics. 2012;130(2):e265–e272. https://doi.org/10.1542/peds.2012-0079.
- Kinnala A, Rikalainen H, Lapinleimu H, et al. Cerebral Magnetic Resonance Imaging and Ultrasonography Findings After Neonatal Hypoglycemia. Pediatrics. 1999;103(4). https://doi.org/10.1542/peds.103.4.724.
- Kishnani PS, Chen YT. Defects in Metabolism of Carbohydrates 87.1 Glycogen Storage Diseases. 2015.
- Kitsommart R, Ngerncham S, Wongsiridej P, et al. Accuracy of the StatStrip versus SureStep Flexx glucose meter in neonates at risk of hypoglycemia. European Journal of Pediatrics. 2013;172(9):1181–1186. https://doi.org/10.1007/s00431-013-2019-2.
- Koh HG, Aynsley-Green A, Tarbit M, et al. Neural dysfunction during hypoglycaemia. Archives of Disease in Childhood. 1988;63:1353–1358. Retrieved from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1779138/pdf/archdisch00680-0065.pdf.
- Lilien LD, Grajwer LA, Pildes RS. Treatment of neonatal hypoglycemia with continuous intravenous glucose infusion. The Journal of Pediatrics. 1977;91(5):779–782. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/909019.
- Lilien LD, Pildes RS, Srinivasan G, et al. Treatment of neonatal hypoglycemia with minibolus and intravenous glucose infusion. The Journal of Pediatrics. 1980;97(2):295–298. https://doi.org/10.1016/S0022-3476(80)80499-9.
- Linder N, Lahat Y, Kogan A, et al. Macrosomic newborns of non-diabetic mothers: anthropometric measurements and neonatal complications. Archives of Disease in Childhood Fetal & Neonatal Edition. 2014;99(5):F353-8.
- Lockyer MG, Fu K, Edwards RM, et al. Evaluation of the Nova StatStrip glucometer in a pediatric hospital setting. Clinical Biochemistry. 2014;47(9):840–843. https://doi.org/10.1016/j.clinbiochem.2014.01.004.
- Lucas A, Morley R, Cole TJ. et al. Adverse neurodevelopmental outcome of moderate neonatal hypoglycaemia. BMJ (Clinical Research Ed.). 1988;297(6659):1304–1308. https://doi.org/10.1136/bmj.297.6659.1304.
- Lucas A, Ynsley-Green A, Bloom SR. Gut hormones and the first meals. Clin Sci.(Lond). 1981;60(4):349–353. https://doi.org/10.1042/cs0600349.
- McIntyre S, Taitz D, Keogh J, et al. A systematic review of risk factors for cerebral palsy in children born at term in developed countries. Developmental Medicine and Child Neurology. 2013;55(6):499–508. https://doi.org/10.1111/dmcn.12017.
- McKinlay CJD, Alsweiler JM, Ansell JM, et al. Neonatal Glycemia and Neurodevelopmental Outcomes at 2 Years. New England Journal of Medicine. 2015;373(16):1507–1518. https://doi.org/10.1056/NEJMoa1504909.
- Meites S, Saniel-Banrey K. Preservation, distribution, and assay of glucose in blood, with special reference to the newborn. Clinical Chemistry. 1979;25(4):531–534.
- Mejri A, Dorval VG, Nuyt AM, et al. Hypoglycemia in term newborns with a birth weight below the 10th percentile. Paediatrics and Child Health. 2010;15(5):271–275.
- Metzger BE, Persson B, Lowe LP, et al. Hyperglycemia and adverse pregnancy outcome study: neonatal glycemia. Pediatrics. 2010;126(6):e1545-52.
- Mikesh LM, Bruns DE. Stabilization of glucose in blood specimens: mechanism of delay in fluoride inhibition of glycolysis. Clinical Chemistry. 2008;54(5):930–932. https://doi.org/10.1373/clinchem.2007.102160.
- Moore E, Bergman N, Anderson G, et al. Early skin-to-skin contact for mothers and their healthy newborn infants (Review) SUMMARY OF FINDINGS FOR THE MAIN COMPARISON. Cochrane Database of Systematic Reviews. 2016;(11). https://doi.org/10.1002/14651858.CD003519.pub4.www.cochranelibrary.com.
- NCC-WCH Diabetes in pregnancy Management of diabetes and its complications from preconception to the postnatal period. (2015). Retrieved from https://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0076657/pdf/PubMedHealth_PMH0076657.pdf.
- Nederlandse Vereniging voor Obstetrie & Gynaecologie. Diabetes mellitus en zwangerschap - Versie 2.0. 2010. Retrieved from http://www.nvog-documenten.nl/index.php?pagina=/richtlijn/item/pagina.php&id=27420&richtlijn_id=863.
- Newnam KM, Bunch M. Glucose Gel as a Treatment Strategy for Transient Neonatal Hypoglycemia. Advances in Neonatal Care : Official Journal of the National Association of Neonatal Nurses. 2017;17(6):470–477. https://doi.org/10.1097/ANC.0000000000000426.
- Ngerncham S, Piriyanimit S, Kolatat T, et al. Validity of two point-of-care glucometers in the diagnosis of neonatal hypoglycemia. Indian Pediatrics. 2012;49(8):621–625. https://doi.org/10.1007/s13312-012-0133-2.
- NICE. Diabetes in pregnancy: management from preconception to the postnatal period. 2015. Retrieved from http://linkinghub.elsevier.com/retrieve/pii/S1521693415000772.
- NICE. Diabetes in pregnancy: management from preconception to the postnatal period, (February). 2015;1–67. https://doi.org/978-1-4731-0993-3.
- NICE. Postnatal care up to 8 weeks after birth | Guidance and guidelines | NICE. 2015. Retrieved April 29, 2018, from https://www.nice.org.uk/guidance/CG37.
- Nicholl R. What is the normal range of blood glucose concentrations in healthy term newborns? Archives of Disease in Childhood. 2003;88(3):238–239. https://doi.org/10.1136/adc.88.3.238.
- NVK. Werkboek kinderendocrinologie- deel 2. (C. Kneepkens, Ed.) (Vol. 2). VU Uitgeverij, Amsterdam. 2010. Retrieved from https://www.nvk.nl/Kwaliteit/Werkboeken/Kinderendocrinologie.
- Onal EE, Hirfanoglu IM, Beken S, et al. Are the neonatal outcomes similar in large-for-gestational age infants delivered by women with or without gestational diabetes mellitus? World Journal of Pediatrics. 2012;8(2):136-9.
- Perined. Perinatale Zorg in Nederland 2016. Utrecht. 2016. Retrieved from https://assets.perined.nl/docs/7935f9c6-eaac-4f59-a150-307ae04efa27.pdf.
- Persson M, Fadl H, Hanson U, et al. Disproportionate Body Composition and Neonatal Outcome in Offspring of Mothers With and Without Gestational Diabetes Mellitus. 2013;36(11):3543-8. https://doi.org/10.2337/dc13-0899.
- Raizman JE, Shea J, Daly CH, et al. Clinical impact of improved point-of-care glucose monitoring in neonatal intensive care using Nova StatStrip: Evidence for improved accuracy, better sensitivity, and reduced test utilization. Clinical Biochemistry. 2016;49(12):879–884. https://doi.org/10.1016/j.clinbiochem.2016.05.002.
- Rawat M, Chandrasekharan P, Turkovich S, et al. Oral Dextrose Gel Reduces the Need for Intravenous Dextrose Therapy in Neonatal Hypoglycemia. Biomedicine Hub. 2016;1(3):1–1. https://doi.org/10.1159/000448511.
- RIVM. Bevolkingsonderzoeken en screeningen. 2018. Retrieved from https://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen.
- RIVM. Screening: de theorie. 2012. Retrieved from https://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen/Screening_de_theorie.
- Roth-Kleiner M, Stadelmann Diaw C, Urfer J, et al. Evaluation of different POCT devices for glucose measurement in a clinical neonatal setting. European Journal of Pediatrics. 2010;169(11):1387–1395. https://doi.org/10.1007/s00431-010-1243-2.
- Rozance PJ, Hay WW. Describing hypoglycemia--definition or operational threshold? Early Human Development. 2010;86(5):275–280. https://doi.org/10.1016/j.earlhumdev.2010.05.002.
- Rozance PJ, Hay WW. New approaches to management of neonatal hypoglycemia. Maternal Health, Neonatology and Perinatology. 2016a;2(1):3. https://doi.org/10.1186/s40748-016-0031-z.
- Rozance PJ. Update on neonatal hypoglycemia. Current Opinion in Endocrinology, Diabetes and Obesity. 2014. https://doi.org/10.1097/MED.0000000000000027.
- Sacks DB, Bruns DE, Horton J, et al. Point-of-Care Blood Glucose Testing in Acute and Chronic Care Facilities; Approved Guideline—Third Edition. Clinical and Laboratory Standards Institute (Vol. 33). Wayne, PA. 2013. Retrieved from https://clsi.org/media/1497/poct12a3_sample.pdf.
- Scott MG, Bruns DE, Boyd JC, et al. Tight glucose control in the intensive care unit: Are glucose meters up to the task? 2009. Clinical Chemistry. https://doi.org/10.1373/clinchem.2008.117291.
- Screening: de theorie - RIVM. 2018. Retrieved April 22, 2018, from https://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen/Screening_de_theorie.
- Semmekrot B. Hypoglykemie bij de pasgeborene: weet u wat u meet? - Artikel - Editie - Tijdschrift & E-learning - Praktische Pediatrie. Praktische Pediatrie. 2015;2:93–99. Retrieved from https://www.praktischepediatrie.nl/tijdschrift-elearning/editie/artikel/t/hypoglykemie-bij-de-pasgeborene-weet-u-wat-u-meet.
- Shorey S, He HG, Morelius E. Skin-to-skin contact by fathers and the impact on infant and paternal outcomes: an integrative review. Midwifery. 2016;40:207–217. https://doi.org/10.1016/j.midw.2016.07.007.
- Sidebottom RA, Williams PR, Kanarek KS. Glucose determinations in plasma and serum: Potential error related to increased hematocrit. Clinical Chemistry. 1982;28(1):190–192.
- Singhal PK, Singh M, Paul VK, et al. Prevention of hypoglycemia: a controlled evaluation of sugar fortified milk feeding in small-for-gestational age infants. Indian Pediatrics. 1992;29(11):1365–1369.
- Sperling MA, Ganguli S, Leslie N, et al. Fetal-perinatal catecholamine secretion: role in perinatal glucose homeostasis. The American Journal of Physiology. 1984;247(1 Pt 1):E69-74. https://doi.org/10.1152/ajpendo.1984.247.1.E69 [doi].
- Sperling MA. Hypoglycemia SIGNIFICANCE AND SEQUELAE. Nelson Textbook of Pediatrics, 2-Volume Set. 2016;773–788.e1. https://doi.org/10.1016/B978-1-4557-7566-8.00092-2.
- Suman RPN, Udani R, Nanavati R. Kangaroo mother care for low birth weight infants: a randomized controlled trial. Indian Pediatrics. 2008;45(1):17–23. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/18250500.
- Swenne I, Ewald U, Gustafsson J, et al. Inter-relationship between serum concentrations of glucose, glucagon and insulin during the first two days of life in healthy newborns. Acta Paediatrica, International Journal of Paediatrics. 1994;83(9):915–919. https://doi.org/10.1111/j.1651-2227.1994.tb13170.x.
- Tang Z, Du X, Louie RF, et al. Effects of pH on glucose measurements with handheld glucose meters and a portable glucose analyzer for point-of-care testing. Archives of Pathology and Laboratory Medicine. 2000;124(4):577–582. https://doi.org/10.1309/QAW1-X5XW-BVRQ-5LKQ.
- Tang Z, Lee JH, Louie RF, et al. Effects of different hematocrit levels on glucose measurements with handheld meters for point-of-care testing. Archives of Pathology and Laboratory Medicine. 2000;124(8):1135–1140. https://doi.org/10.1043/0003-9985(2000)124<1135:EODHLO>2.0.CO;2.
- Tang Z, Louie RF, Lee JH, et al. Oxygen effects on glucose meter measurements with glucose dehydrogenase- and oxidase-based test strips for point-of-care testing. Critical Care Medicine. 2001;29(5):1062–1070. https://doi.org/10.1097/00003246-200105000-00038.
- Ter M, Halibullah I, Leung L, et al. Implementation of dextrose gel in the management of neonatal hypoglycaemia. Journal of Paediatrics and Child Health. 2017;53(4):408–411. https://doi.org/10.1111/jpc.13409.
- The HAPO Study Cooperative. Hyperglycemia and Adverse Pregnancy Outcomes. New England Journal of Medicine. 2008;358(19):1991–2002. https://doi.org/10.1056/NEJMoa0707943.
- Thornton P, Stanley C, De Leon D, et al. Recommendations from the Pediatric Endocrine Society for evaluation and management of hersistent Hypoglycemia in neonates, infants and children. Journal of Pediatrics. 2015;167(2):238–245. https://doi.org/10.1016/j.jpeds.2015.03.057.
- Tozier PK. Colostrum Versus Formula Supplementation for Glucose Stabilization in Newborns of Diabetic Mothers. JOGNN - Journal of Obstetric, Gynecologic, and Neonatal Nursing. 2013;42(6):619–628. https://doi.org/10.1111/1552-6909.12260.
- Troughton K, Corrigan N, Tait R. Hypostop gel in the treatment of neonatal hypoglycaemia: a randomised controlled trial. Archives of Disease in Childhood. 2000;82(Suppl 1):A29–A32. https://doi.org/10.1136/adc.82.suppl_1.A29.
- Van Der Hagen EAE, Fokkert MJ, Kleefman AMD, et al. Technical and clinical validation of the Greiner FC-Mix glycaemia tube. Clinical Chemistry and Laboratory Medicine. 2017;55(10):1530–1536. https://doi.org/10.1515/cclm-2016-0944.
- Vannucci RC, Vannucci SJ. Glucose metabolism in the developing brain. Semin Perinatol. 2000;24(2):107–115. https://doi.org/10.1053/sp.2000.6361.
- Voeten M, Gerrits G, Voorhoeve P, et al. Behandeling van neonatale hypoglykemie: frequenter aanleggen aan de borst versus bijvoeden met flesvoeding; retrospectief statusonderzoek. Ned Tijdschr Geneeskd. 2008;152(31).
- Volpe JJ. Hypoglycemia and brain injury. Neurology of the Newborn. Volpe JJ. 2008;591–618.
- Wada Y, Nakamura T, Kaneshige M, et al. Evaluation of two glucose meters and interference corrections for screening neonatal hypoglycemia. Pediatrics International. 2015;57(4):603–607. https://doi.org/10.1111/ped.12543.
- Weissmann-Brenner A, Simchen MJ, Zilberberg E, et al. Maternal and neonatal outcomes of large for gestational age pregnancies. Acta Obstetricia et Gynecologica Scandinavica. 2012;91(7):844–849. https://doi.org/10.1111/j.1600-0412.2012.01412.x.
- Weston PJ, Harris DL, Battin M, et al. Oral dextrose gel for the treatment of hypoglycaemia in newborn infants. Cochrane Database of Systematic Reviews. 2016;(5). https://doi.org/10.1002/14651858.CD011027.pub2.
- WHO. Hypoglycemia in the newborn. 2014. https://doi.org/10.1016/S0022-3468(67)80157-X.
- Wiener K. Whole blood glucose: What are we actually measuring? Annals of Clinical Biochemistry. 1995;32(1):1–8. https://doi.org/10.1177/000456329503200101.
- Williams AF. Hypoglycaemia of the newborn: A review. Bulletin of the World Health Organization. World Health Organization. 1997. https://doi.org/10.1177/089033449801400227.
- Wilson JMG, Jungner G. Principles and Practice of Screening for Disease. Public Health Papers. 1966. https://doi.org/10.1001/archinte.1969.00300130131020.
- Woo HC, Tolosa L, El-Metwally D, et al. Glucose monitoring in neonates: Need for accurate and non-invasive methods. Archives of Disease in Childhood: Fetal and Neonatal Edition. 2014. https://doi.org/10.1136/archdischild-2013-304682.
- World Health Organization. Infant and young child feeding. 2018. Retrieved April 29, 2018, from http://www.who.int/en/news-room/fact-sheets/detail/infant-and-young-child-feeding.
- Zecca E, Costa S, Barone G, et al. Proactive Enteral Nutrition in Moderately Preterm Small for Gestational Age Infants: A Randomized Clinical Trial. The Journal of Pediatrics. 2014;165(6):1135–1139.e1. https://doi.org/10.1016/j.jpeds.2014.08.06.
Evidence tabellen
Frequenter aanleggen bij borstvoeding
|
First author, year |
Design |
Definition of hypoglycaemia |
Population |
Intervention |
Control |
Outcome |
Level of evidence |
|
Hawdon 1992 |
Cross-sectional |
Not given |
156 healthy singleton infants, born at term (39 wks and 3380 grams) |
NA |
NA |
Feed interval in minutes was significantly correlated with blood glucose concentration (β=-0.32, SE=0.001, p<0.05) |
4 |
|
Voeten, 2008 |
Retrospective cohort |
1.8-2.5 mmol/L met symptomen 1.3-1.7 mmol/L without symptoms |
232 children, average birthweight: 3481 and 3465 grams |
Higher frequency breastfeeding |
Supplemental feeding |
Hypoglycemia 63% in intervention, 55% in control |
2b |
Bijvoeding
|
First author, year |
Design |
Definition of hypoglycaemia |
Population |
Intervention |
Control |
Outcome |
Level of evidence |
|
Harris 2017 |
Post-hoc analysis of RCT |
<2.6 mmol/L |
227 infants with hypoglycaemia |
Supplemental formula feeding (median 4.5ml/kg) |
Supplemental human milk (median 0.5ml/kg) |
+0.22 mmol/L glucose concentration |
2b |
Dextrose-gel
|
First author, year |
Design |
Definition of hypoglycaemia |
Population |
Intervention |
Control |
Outcome |
Level of evidence |
|
Weston, 2016 |
Cochrane review |
|
2 (Harris 2013 and Throughton 2000), total infants: 317 |
Dextrose gel |
Placebo |
Differences in: Higher exclusive breastfeeding rates at discharge in dextrose group (RR 1.10, 95%CI 1.01; 1.18) Less separation between mother and infant in dextrose group (RR 0.53, 95%CI 0.61; 1.11)
No differences in: Increase in blood glucose 30-90 minutes after treatment (MD 0.4 mmol/L 95%CI -0.1; 0.94) Intravenous treatment for hypoglycaemia (RR 0.81, 95%CU 0.29; 2.25) Adverse effects Developmental disability at 2 years of age (RR 1.11, 95%CI 0.75; 1.63) Visual impairment at 2 years or older (RR 1.17, 95%CI 0.72; 1.89) Cerebral palsy (RR 5.16, 95%CI 0.25; 106.12) Developmental delay (RR1.07, 95%CI 0.71; 1.61) Bayley-III scale
No data on: Receiving medication for hypoglycaemia Number of episodes of hypoglycaemia Improved blood glucose greater than 2.6 mmol/L Rebound hypoglycaemia Duration of hypoglycaemia Neonatal seizures Abnormal MRI of brain in neonatal period Duration of hospital stay Any breastfeeding after discharge Exclusive breastfeeding at 6 months Hearing impairment Behavioural problems Abnormal MRI at 2 years of age. |
1a |
|
Harris 2013 |
RCT |
<2.6 mmol/L |
514 infants >35 weeks at risk, 242 randomised |
118 infants received 40% dextrose gel 0.5ml/kg |
119 infants received placebo |
Dextrose-gel reduced treatment failure 14% versus 29%, p =0.04 |
1b |
|
Harris 2016 |
Follow-up of RCT |
<2.6 mmol/L |
78% follow-up of initial cohort. |
90/118 infants |
94/119 infants |
No difference in major neurosensory disability (2-year follow) RR 1.11, 95% 0.75;1.63). |
1b |
|
Troughton, 2000 |
RCT |
<2.5 mmol/L |
75 infants >36 weeks of gestation admitted to NICU because of hypoglycaemia |
1ml/kg of dextrose 40% + feed(n=39) |
Feed alone (n=36) |
Additional increase of +0.4 mmol/L in bloodglucose in dextrose-gel group. No differences in: Requirement for IV dextrose (33% vs 26%, p =0.7) |
1b |
|
Rawat, 2016 |
Retrospective study (post-implementation study) |
<45 mg/dL (<2.5 mmol/L) |
Asymptomatic infants >35 weeks and <48 hours old |
Maximum of 3 doses of dextrose 200 mg/kg of 40% (n=250) |
Feeds only (n=248) |
Dextrose-gel increased blood glucose level Dextrose-gel decreased need for IV dextrose (ARR 15.54%, 95%CI 7.32; 23.76) NNT 7 (95%CI 4.2; 13.7) Need for admission to NICU decreased (20.6% to 14.8%, p<0.01)). Exclusive breastfeeding improved (19% vs 28%, p =0.03) |
2b |
|
Ter, 2017 |
Retrospective study (post-implementation study) |
<2.6 mmol/L |
200 infants with neonatal hypoglycaemia |
Dextrose with feeding (n=100) |
Feeding alone (n=100) |
Lower incidence of admission to NICU (29% vs 14%, p =0.01). No difference in establishing normoglycemia (71/100 (71%) versus 75/100 (75%), p =0.52), More often recurrent hypoglycemia in dextrose-gel group: 22/71 (31%) versus 37/75 (49%), p =0.02). |
2b |
|
Bennett, 2016 |
Retrospective study (post-implementation study) |
<35 mg/dL (<1.9 mmol/L) |
1959 infants with hypoglycemia |
Dextrose-gel 40% (n=1089) |
Feeding alone (n=870) |
73% decrease in NICU admission rate |
2b |
Iv glucose toediening
|
First author, year |
Design |
Definition of hypoglycaemia |
Population |
Intervention |
Control |
Outcome |
Level of evidence |
|
Lilien, 1977 |
Retrospective study |
Two plasma glucoses <25 mg/dL (<1.4 mmol/L) in children <2000 gram, and <35 mg/dL (<1.9 mmol/L) in children <2500 gram. |
22 hypoglycemic infants <24 hours |
Infants with 8 mg/kg/min glucose 10%. |
None |
Plasma glucose levels were raised above hypoglycemic levels within 50 minutes |
4 |
|
Lilien, 1980 |
Retrospective study |
Two plasma glucoses <25 mg/dL (<1.4 mmol/L) in children <2000 gram, and <35 mg/dL (<1.9 mmol/L) in children <2500 gram. |
23 hypoglycemic infants <24 hours, mean 1600±500 grams , and 32±2.7 weeks of gestation |
200 mg/kg glucose (2ml of 10% glucose/kg) in 1 minute with subsequent glucose infusion of 8 mg/kg/min (n=23) |
Infants only with 8 mg/kg/min glucose (from Lilien 1977 report, n=22) |
After bolus, the infants receiving a bolus had significantly higher glucose values over the first 20 minutes when compared to infants without a bolus. |
4 |
Kwaliteit van bewijs
Individuele studies uit search
- Weston, 2016 Level: 1a (Cochrane review)
- Boundy, 2016 Level: 1a (Systematic review and meta-analysis)
- Newnam, 2017 Level: 2a (Systematic review ook van observationele Studies, geen kwaliteit beschreven van studies)
- Troughton, 2000 Level: 1b (RCT, alleen abstract)
- Harris, 2016 Level: 1b (RCT met follow-up)
- Flaherman, 2013. Level: 1b (RCT)
- Harris, 2013 Level: 1b (RCT)
- Rawat, 2016 Level: 2b (retrospectief cohort)
- Harris 2017 Level: 2b (post-hoc analyse van RCT)
- Harris, 2014 Level: 2b (prospectief cohort <80% respons).
- Voeten, 2008 Level: 2b (retrospectief cohort)
- Ter, 2017 Level: 2b (retrospectief cohort met convenience inclusie)
- Bennett, 2016 Level: 2b (clinical decision rule validatie, retrospectief)
- Hawdon, 1992 Level: 4 (case series)
- Harding 2017 Level: 5 (niet-systematische review met expert opinion)
- Rozance 2016 Level: 5 (niet-systematische review met expert opinion)
- Lilien, 1980. Level: 4 (case series)
- Lilien, 1977 Level: 4 (case series)
Individuele studies naar gerefereerd:
- Aynsley-Green, 1996 Level: 5 (niet-systematische review met expert opinion)
- Burns, 2008 Level: 4 (case series)
- Cornblath, 1997 Level: 5 (niet-systematische review met expert opinion)
- Vannucci, 2000 Level: 5 (niet-systematische review met expert opinion)
- Volpe, 2008 Level: 5 (niet-systematische review met expert opinion)
- Williams, 1997 Level: 5 (niet-systematische review met expert opinion)
- Hay, 2003 Level: 5 (niet-systematische review met expert opinion)
- Johnson, 2012 Level: 5 (niet-systematische review met expert opinion)
- Cowett, 1979 Level 2c: (niet gerandomiseerd interventie onderzoek)
- De Carvalho, 1982 Level: 2b (prospectief cohort met onduidelijke inclusie)
- De Carvalho 1983 Level: 2b (prospectief niet-gerandomiseerd cohort met onduidelijke inclusie)
GRADE van het bewijs dextrose-gel als interventie
- Er werden twee RCT gevonden en een Cochrane review.
- Een gerandomiseerde studie laat een positief effect zien op de glucoseconcentratie na dextrose-gel. Er werd geen verschil gevonden in de lange termijn uitkomsten tussen de groep behandeld met dextrose-gel en placebo groep. In de andere studie werd geen verschil in glucose na behandeling met dextrose-gel gevonden (alleen abstract).
- De populatie bestond uit dezelfde kinderen als de richtlijn.
- Voldoende groot (Harris 2013), voor de andere studie onzeker (Troughton, alleen abstract).
- Mogelijk, gezien Troughton niet gepubliceerd, alleen abstract.
Kwaliteit: Laag
GRADE van het bewijs frequenter aanleggen bij borstvoeding
- Er werden geen gerandomiseerde studies gevonden.
- Een korter voedingsinterval lijkt in beide studies een gunstige invloed te hebben op de glucose concentratie.
- De populatie bestond uit dezelfde kinderen als de richtlijn.
- Voldoende groot.
- Niet te bepalen.
Kwaliteit: Zeer laag
GRADE van het bewijs bijvoeding
- Er werden geen gerandomiseerde studies gevonden. Er werd één post-hoc analyse gevonden.
- Niet van toepassing.
- De populatie bestond uit dezelfde kinderen als de richtlijn. Er was een verschil in de hoeveelheid voeding die de kinderen in de kunstvoedings-groep kregen en de borstvoedingsgroep.
- Voldoende groot.
- Niet te bepalen.
Kwaliteit: Zeer laag
GRADE van het bewijs iv glucose
- Er werden geen gerandomiseerde studies gevonden.
- Beide studies laten zien dat iv glucose de bloedsuiker laat stijgen.
- De populatie bestond grotendeels niet uit dezelfde kinderen als de richtlijn.
- Voldoende groot om het effect op de glucose concentratie (korte termijn uitkomst) te beoordelen. Onvoldoende groot voor lange termijn uitkomsten.
- Niet te bepalen.
Kwaliteit: Zeer laag
GRADE-tabel: Van bewijs naar aanbeveling
|
|
Beslissing |
Toelichting |
|
1. Kwaliteit van het bewijs Is de algehele kwaliteit van bewijs hoog? |
☐ Nee |
Voor alle interventies is er weinig bewijs. |
|
2. Balans tussen gewenste en ongewenste effecten |
|
|
|
In geval van een positieve aanbeveling: Overtreffen de gunstige effecten de ongunstige effecten aanzienlijk en is de werkgroep hier zeker van? |
☐ Ja |
In de dagelijkse praktijk wordt een ernstige of langdurige hypoglycemie altijd behandeld met iv glucose en de matige hypoglycemie in eerste instantie met een voedingsinterventie, om te voorkomen dat een ernstige hyopglycemie ontstaat waarvoor iv glucose nodig is. |
|
3. Patiëntenperspectief |
|
|
|
In het geval van een positieve aanbeveling: Hanteren vrijwel alle patiënten hetzelfde perspectief op de wenselijkheid van de conceptaanbeveling? |
☐ Ja |
In de dagelijkse praktijk zijn alle ouders akkoord met stapsgewijs behandelen van hypoglycemie. |
|
4. Professioneel perspectief |
|
|
|
In het geval van een positieve aanbeveling: Hanteren vrijwel alle zorgverleners hetzelfde perspectief op de wenselijkheid van de conceptaanbeveling? |
☐ Ja
|
Ja, er is behoefte aan consensus op welke wijze en bij welke grenzen hypoglycemie behandeld dient te worden. |
|
5. Middelenbeslag |
|
|
|
In het geval van een positieve aanbeveling: Zijn de netto-gunstige effecten de (extra) middelen waard? |
☐ Ja, waarschijnlijk |
Kosten van alle interventies zijn laag. |
|
6. Organisatie van zorg |
|
|
|
In geval van een positieve aanbeveling: Zijn voldoende condities van zorg-organisatorische of maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ Ja |
Ja, hypoglycemie wordt al behandeld in de huidige praktijk met de voorgestelde interventies. |
|
7. Maatschappelijk perspectief |
|
|
|
In geval van een positieve aanbeveling: Zijn voldoende condities van zorg-organisatorische of maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ Ja |
Zie punt 6. |
Indien meerdere factoren positief worden geëvalueerd (‘ja’) neemt de waarschijnlijkheid van een sterke aanbeveling toe.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 28-11-2020
De richtlijn wordt één keer per vijf jaar gereviseerd. De geldigheid van de richtlijn komt eerder te vervallen als nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten. Zo mogelijk wordt de richtlijn, indien financiering beschikbaar is, aangevuld met extra modules.
Doel en doelgroep
Het doel van deze richtlijn is om handvatten te bieden voor de algemene kindergeneeskundige zorg voor de (bijna) à terme pasgeborenen. In deze richtlijn gaan de uitgangsvragen over het beleid rondom neonatale hypoglycemie, beleid na vacuümextractie en de indicaties voor een consult kinderarts. Het gaat hierbij om pasgeborenen die vanwege een medische indicatie in het ziekenhuis geboren of opgenomen worden en bij wie de (algemeen) kinderarts zorg levert of zou moeten leveren. Prematuren met een zwangerschapsduur <35 weken en pasgeborenen met een indicatie voor intensive care opname vallen niet onder deze richtlijn. Deze richtlijn bevat aanbevelingen voor de zorg voor pasgeborenen waarbij de focus ligt op de algemeen kinderarts. Ook andere zorgverleners binnen de integrale geboortezorg kunnen gebruik maken van de informatie uit deze richtlijn, zoals huisartsen, verloskundigen, verpleegkundigen, kraamverzorgenden en ouderverenigingen.
Samenstelling werkgroep
Voor de ontwikkeling van deze richtlijn is een richtlijnwerkgroep samengesteld. Deze werkgroep bestond uit gemandateerde vertegenwoordigers van de NVK, de Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) en de Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV). Het ouderperspectief in de werkgroep werd vertegenwoordigd door participatie van Stichting Kind en Ziekenhuis. De werkgroep werd aangevuld met een arts-onderzoeker met expertise op het gebied van neonatale hypoglycemie. De werkgroep werd bij het literatuuronderzoek ondersteund door een epidemioloog van het NVK-bureau. Een epidemioloog van PROVA was betrokken voor methodologisch en procedureel advies. De werkgroep werd secretarieel ondersteund vanuit het bureau van de NVK. De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget van de SKMS.
Werkgroep
- Mw. L.H. van der Meer-Kappelle, werkzaam in Reinier de Graaf Groep, namens NVK (voorzitter)
- Dr. R.F. Kornelisse, neonatoloog, werkzaam in Erasmus MC-Sophia, namens NVK
- Dr. R.H.T. van Beek, neonatoloog, werkzaam in Amphia Ziekenhuis, namens NVK
- Drs. C.S. Barbian, kinderarts, werkzaam in Ziekenhuis Rivierenland, namens NVK
- Dr. A.A.M.W. van Kempen, neonatoloog, werkzaam in OLVG Amsterdam, namens NVK
- Drs. N.R. van Veenendaal, arts-onderzoeker werkzaam in OLVG Amsterdam, namens NVK
- Drs. H.G. Stas, neonatoloog, werkzaam in Maasstad Ziekenhuis Rotterdam, namens NVK
- Dr. P.H Dijk, neonatoloog, werkzaam in UMCG, namens NVK
- D. Joseph, MSc, verpleegkundige, werkzaam voor Kind en Ziekenhuis
- L. Zondag, beleidsmedewerker, werkzaam als verloskundige, namens KNOV
- NVOG, commissie Kwaliteitsdocumenten
Meelezers
- Mw. Dr. C. de Boer, verpleegkundige neonatologie, werkzaam in Erasmus MC, namens V&VN
- Dr. R.M.J. Moonen, neonatoloog, werkzaam in Zuyderland Medisch Centrum Heerlen, namens NVK
- Drs. S. Mulder, hoofd afdeling neonatologie, werkzaam in Isala Zwolle, namens NVK
- Dr. J.E. Bunt, neonatoloog, werkzaam in ETZ Elisabeth, namens NVK
- Dr. F. Maingay, neonatoloog, werkzaam in Noordwest Ziekenhuisgroep Alkmaar, namens NVK
- Dr. F.A.B.A. Schuerman, neonatoloog, werkzaam in Isala Zwolle, namens NVK
- Dr. W.J.M. van Heel, neonatoloog, werkzaam in Haga Ziekenhuis, namens NVK
- Dr. H.B. Burggraaff, verloskundige huisarts, werkzaam in H.B. Burggraaff, namens NHG
Met ondersteuning van
- Mw. Drs. M. Tuut, zelfstandig epidemioloog PROVA
- Mw. Dr. L.M.A.J. Venmans, epidemioloog NVK
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of zij in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek en belangen door kennisvalorisatie. De ingevulde belangenverklaringen zijn beoordeeld door de projectleider. Hieruit is geen belemmering voor participatie in de werkgroep naar voren gekomen. De verklaringen liggen ter inzage bij de NVK.
Inbreng patiëntenperspectief
Het perspectief van patiënten en ouders is gewaarborgd doordat Stichting Kind en Ziekenhuis vertegenwoordigd was in de werkgroep. Zij hadden een belangrijke bijdrage aan de patiëntenversie van de richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De definitieve richtlijn is onder de verenigingen verspreid, en via de website van de NVK (https://www.nvk.nl/) en de Richtlijnendatabase elektronisch beschikbaar gesteld. Op wetenschappelijke bijeenkomsten van de betrokken wetenschappelijke verenigingen en regionale bijeenkomsten kunnen de aanbevelingen van de richtlijn worden gepresenteerd.
Het uitgebreide implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Knelpuntanalyse, verzamelen protocollen en vaststellen uitgangsvragen
Door de leden van de werkgroep werd een schriftelijke knelpuntenanalyse uitgevoerd om de huidige werkwijze ten aanzien van neonatale hypoglycemie, beleid na vacuümextractie en opname- en ontslagcriteria in kaart te brengen.
De inhoud van deze praktische en specifiek op de Nederlandse situatie gerichte richtlijn, is mede gebaseerd op internationale richtlijnen. De evidence was niet altijd even sterk. Daarnaast leende een deel van de uitgangsvragen zich niet voor een literatuursearch.
Daarom werden, naast literatuur, internationale en nationale richtlijnen, ook regionale en lokale protocollen omtrent neonatale hypoglycemie, vacuümextracties en indicatie voor een consult kinderarts verzameld en gebruikt. Er werden 34 protocollen toegestuurd: 4 afkomstig uit NICU’s, 9 uit post-IC/HC-centra en 21 uit algemene ziekenhuizen. In december 2016 telde Nederland 79 ziekenhuisorganisaties, inclusief 10 NICU’S. Het aantal ingestuurde protocollen werd door de werkgroep als representatief voor de Nederlandse ziekenhuizen beschouwd.
Tijdens werkgroepvergaderingen werden de definitieve knelpunten en uitgangsvragen vastgesteld. De Nederlandse kinderarts werkt zo veel mogelijk evidence-based. Wanneer er een grote praktijkvariatie is, komt dit doordat evidence ontbreekt in de literatuur. Aangezien deze richtlijn als doel heeft de praktijkvariatie te beperken, is per vraag bekeken of een evidence-based search zinvol was om antwoord te geven op de uitgangsvraag of dat de uitgangsvraag door middel van consensus, met behulp van bestaande literatuur, (inter)nationale richtlijnen en lokale protocollen, binnen de werkgroep zou worden uitgewerkt.
Zoeken (inter)nationale richtlijnen
In eerste instantie werd gezocht naar evidence-based richtlijnen. Hierbij werd gebruik gemaakt van de volgende databases: Medline, SUMSEARCH2, Clinical evidence van BMJ, Scottish Intercollegiate Guidelines Network en de TRIP DATABASE. Inclusiecriteria waren als volgt:
- het betreft een evidence-based richtlijn of practical guideline;
- de populatie betreft pasgeborenen;
- de richtlijn moet gaan over postnatale zorg voor pasgeborenen;
- publicatie tot juli 2015 (datum van de search).
De gevonden richtlijnen werden op kwaliteit beoordeeld met behulp van AGREE II (https://www.agreetrust.org/). De resultaten van deze search en de kwaliteit van de gevonden richtlijnen is beschreven bij de verschillende modules.
Zoeken artikelen
Bij de vragen waarvoor een search werd gedaan, wordt beschreven welke databases en zoektermen zijn gebruikt en welke zoekperiode is aangehouden (zie de zoekverantwoording in de verschillende modules). Er werd gezocht naar de hoogste mate van bewijs: systematische reviews en gerandomiseerd en gecontroleerd onderzoek. Zoals te verwachten bij veel praktijkvariatie, was het bewijsniveau van de literatuur en richtlijnen over het algemeen laag.
Beoordeling artikelen
De uitgangsvragen waarvoor een search werd gedaan, werden met behulp van de GRADE-methodiek (Grading Recommendations Assessment, Development and Evaluation) uitgewerkt. De literatuur werd beoordeeld middels https://www.cebm.net/2009/06/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/. Aan het begin van het richtlijntraject werden hiertoe uitkomstmaten gedefinieerd. Resultaten werden per uitkomstmaat samengevat, waarbij tevens de overall kwaliteit van de onderliggende bewijslast (evidence) werd aangegeven. Bij de beoordeling werd gebruik gemaakt van GRADEpro (https://gradepro.org/). Met behulp van dit instrument werd bij elke uitgangsvraag een tabel met bevindingen (summary of findings) en een tabel met de beoordeling van het bewijs (GRADE evidence profile) gemaakt.
GRADE kent vier niveaus: high, moderate, low en very low. Per uitkomst werd een GRADE-niveau toegekend. Wanneer een uitkomst als high geclassificeerd werd, wil dit zeggen dat het onwaarschijnlijk is dat toekomstig onderzoek de schatting van de uitkomst zal veranderen. Met andere woorden: er is veel vertrouwen in de juistheid van de schatting van de uitkomst. Een very low-classificatie wil zeggen dat er veel onzekerheid is over de juistheid van de uitkomst.
Het onderzoeksdesign is een belangrijke factor binnen GRADE. Gerandomiseerde en gecontroleerde studies krijgen daarom in beginsel de kwalificatie high. Er zijn vijf factoren die kunnen zorgen voor een lagere kwalificatie:
- beperkingen in de onderzoeksopzet;
- inconsistentie: onverklaarde heterogeniteit van de resultaten;
- indirectheid: de populatie, interventie, controle en uitkomst (PICO) waarop de evidence gebaseerd is, wijken op een of meer punten af van de PICO die men wil onderzoeken. Ook het gebruik van surrogaatmarkers valt onder indirectheid;
- imprecisie: wijde betrouwbaarheidsintervallen rond een geschat effect duiden op onzekerheid in de grootte van het effect. Er is sprake van imprecisie bij een te kleine steekproef (lage statistische power), weinig events en een betrouwbaarheidsinterval dat wel statistisch significant is, maar zowel in het gebied van klinische relevantie als in het gebied van een verwaarloosbaar effect ligt;
- publicatiebias.
Indien de resultaten niet gepoold konden worden, werd volstaan met een globale inschatting van de kwaliteit van de onderliggende bewijslast. Voor een uitgebreidere beschrijving van GRADE verwijst de werkgroep naar http://www.gradeworkinggroup.org.
Van bewijs naar aanbeveling
Nadat de evidence was samengevat en gegradeerd, werden door de werkgroep aanbevelingen geformuleerd. Naast de evidence werden hierbij overwegingen uit de praktijk meegenomen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is rekening gehouden met de organisatie van zorg; alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur), hoewel deze in de algemeen kindergeneeskundige praktijken nog al verschillend zijn. Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Commentaar- en autorisatiefase
Na vaststelling van de conceptrichtlijn door de werkgroep werd de richtlijn naar de meelezers gestuurd ter becommentariëring. Na verwerking van alle suggesties, startte de commentaarfase en werd de richtlijn voorgelegd aan de volgende partijen: NVK, Stichting Kind en Ziekenhuis, NVOG, KNOV, V&VN, IGZ, VGVK, NHG.
In de definitieve richtlijn, die ter autorisatie is aangeboden aan de NVK, NVOG, KNOV en Stichting Kind & Ziekenhuis op 28 november, is het commentaar waar mogelijk en relevant verwerkt door de werkgroep.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op evidence gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien deze aanbevelingen hoofdzakelijk gebaseerd zijn op de gemiddelde patiënt kunnen zorgverleners op basis van hun professionele autonomie zo nodig afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
