Indicaties voor routinematige screening op neonatale hypoglycemie
Uitgangsvraag
Wat zijn de indicaties voor routinematige screening op neonatale hypoglycemie?
Aanbeveling
De werkgroep beveelt aan om gezonde, à terme AGA-pasgeborenen niet routinematig te screenen op neonatale hypoglycemie, omdat ervan uitgegaan mag worden dat zij over voldoende (contra)regulerende mechanismen en alternatieve brandstoffen beschikken om de fysiologische daling van de glucoseconcentratie in de eerste uren na geboorte adequaat op te vangen.
Bij verder gezonde pasgeborenen met een zwangerschapsduur ≥35 weken en geboortegewicht ≥2000 gram adviseert de werkgroep routinematige screening op neonatale hypoglycemie aan bij:
- prematuriteit, gedefinieerd als een zwangerschapsduur <37 weken;
- SGA, gedefinieerd als een geboortegewicht <P10;
- kinderen van moeders met diabetes (type 1, 2 of diabetes gravidarum) die in de zwangerschap behandeld zijn met insuline of orale bloedsuikerverlagende medicatie.
De werkgroep heeft een voorkeur om bij LGA-pasgeborenen de P90 als grens voor het geboortegewicht aan te houden waarboven zij routinematig screening op neonatale hypoglycemie (tot nader onderzoek heeft uitgewezen dat een hogere grens veilig is).
De werkgroep vindt op basis van consensus dat bij maternale diabetes gravidarum met dieet en met een geboortegewicht van het kind tussen de P10 en P90, er geen voorkeur uit te spreken is (bij gebrek aan onderbouwing in de literatuur) over het wel of niet routinematig screenen op neonatale hypoglycemie. Bij een geboortegewicht >P90 of <P10 wordt al routinematige screening op basis van het geboortegewicht aanbevolen.
Overwegingen
Gezonde, à terme AGA-pasgeborenen hebben voldoende (contra)regulerende mechanismen en alternatieve brandstoffen om de fysiologische daling van de plasma glucoseconcentratie in de eerste uren na geboorte adequaat op te vangen. Zij hoeven niet routinematig gescreend te worden.
Prematuriteit
Op grond van de literatuur, (inter)nationale richtlijnen en lokale protocollen is er 100% consensus over routinematige screening bij prematuriteit, gedefinieerd als een zwangerschapsduur <37 weken.
Te laag geboortegewicht
Bij pasgeborenen met een te laag geboortegewicht is er een hoge mate van consensus voor screening op hypoglycemie bij een geboortegewicht <P10. Op basis van de beschikbare literatuur, de internationale definitie van dysmaturiteit (<P10 volgens de WHO en internationale richtlijnen) en de lokale protocollen (2/3 gebruikt de P10 als grens), adviseert de werkgroep om de P10 als grens voor SGA te hanteren. Verder onderzoek naar de incidentie (en noodzaak tot behandeling) van hypoglycemie bij gebruik van verschillende geboortegewichtpercentielen is nodig alvorens de indicatie voor glucosescreening bij SGA aan te kunnen passen.
De werkgroep adviseert geen absoluut geboortegewicht toe te voegen aan de definitie voor SGA in relatie tot routinematige screening op neonatale hypoglycemie. Uiteraard is altijd oplettendheid geboden in situaties rondom afkapgrenzen en kan op individuele klinische gronden alsnog besloten worden om te screenen op hypoglycemie. Bij de geboortegewichtsgrenzen wordt uitgegaan van de curves of tabellen van Perined (Hoftiezer, 2018). In vergelijking met de voorgaande geboortegewichtcurven (2007) zal in de groep met een zwangerschapsduur van ≥37 weken met het gebruik van deze nieuwe curve (Hoftiezer 2018) gemiddeld één kind per ziekenhuis per week meer moeten worden gescreend (3.351 kinderen per jaar uitgaande van 70 ziekenhuizen in Nederland).
Te hoog geboortegewicht
Voor LGA-pasgeborenen hanteren de Canadese en Australische richtlijn, evenals 35% van de lokale protocollen, de WHO-definitie van een geboortegewicht >P90 als indicatie voor routinematige screening op neonatale hypoglycemie. Hoewel twee studies een hogere incidentie hypoglycemie laten zien bij toepassing van een hoger geboortegewichtpercentiel, kan daaruit niet worden geconcludeerd dat het veilig is om af te zien van screening bij LGA-pasgeborenen met een geboortegewicht tussen de P90 en P95 of P97,7. De werkgroep realiseert zich dat een groot aantal gezonde pasgeborenen zal worden gescreend op neonatale hypoglycemie en dat dit voor sommige ziekenhuizen die nu een hoger percentiel (P95 of P97,7) aanhouden, consequenties heeft voor de praktijk. De werkgroep is echter van mening dat eerst een goed opgezet onderzoek naar de incidentie en noodzaak tot behandeling van hypoglycemie bij LGA-pasgeborenen met verschillende geboortegewichtpercentielen nodig is alvorens de indicatie voor glucosescreening bij LGA aan te kunnen passen.
De werkgroep adviseert geen absoluut gewicht toe te voegen aan de definitie voor LGA in relatie tot routinematige screening op neonatale hypoglycemie. Bij de grenzen van het geboortegewicht wordt uitgegaan van de Perined (Hoftiezer) curves of tabellen (Hoftiezer, 2018).
Maternale diabetes
Bij kinderen van moeders met diabetes in de zwangerschap die behandeld worden met insuline is er consensus (100%) over de indicatie voor screening op neonatale hypoglycemie. Gezien de gevolgen van hypoglycemie in combinatie met de verwachte lage ketonlichaamproductie beveelt de werkgroep maternaal insulinegebruik aan als indicatie voor screening op neonatale hypoglycemie.
Het risico op neonatale hypoglycemie is niet lager bij maternaal gebruik van orale bloedsuikerverlagende medicatie in vergelijking met het gebruik van insuline (RR 2,13; 95%CI 1,32 tot 3,43) (algehele kwaliteit van het bewijs is laag). De werkgroep neemt de aanbeveling vanuit de richtlijn van de NVOG (2010 en 2018) over om pasgeborenen te screenen op hypoglycemie bij diabetes gravidarum behandeld met orale medicatie.
Onderbouwing voor het wel of niet screenen op neonatale hypoglycemie bij maternale diabetes gravidarum behandeld met een dieet is moeilijk te vinden in de literatuur en internationale richtlijnen. De meeste studies maken geen onderscheid in het type diabetes in de zwangerschap, de behandelingsmethoden en/of het geboortegewicht van het kind.
In Nederland bevalt een aanzienlijk deel van de vrouwen thuis, in tegenstelling tot veel andere (westerse) landen (Au, 2016). In Nederland is diabetes gravidarum behandeld met dieet geen indicatie om in het ziekenhuis te bevallen, als de diabetes goed is ingesteld en er geen bijkomende complicaties zijn (Verloskundige Indicatielijst (VIL), NVOG, Koninklijke Nederlandse Vereniging van Verloskundigen (KNOV)). De werkgroep heeft dit aspect meegewogen en vindt op basis van consensus dat bij maternale diabetes gravidarum met dieet met een geboortegewicht van het kind tussen de P10 en P90 er geen voorkeur uit te spreken is, bij gebrek aan onderbouwing in de literatuur, over het wel of niet routine matig screenen op neonatale hypoglycemie. Bij een geboortegewicht >P90 of <P10 wordt routinematige screening wel aanbevolen.
De patiënteninformatie voor ouders kan helpen om de ouders mee te laten beslissen of ze bij hun kind wel of niet glucosecontroles willen laten verrichten.
Onderbouwing
Achtergrond
In deze uitgangsvraag is uitgegaan van de definitie van screening, zoals die wordt gehanteerd door het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) en World Health Organization (WHO): “Screening is gericht op het vinden van ziekte, een erfelijke aanleg voor ziekte of risicofactoren die de kans op ziekte vergroten en gebeurt per definitie bij individuen die klachtenvrij zijn” (Andermann, 2008; RIVM, 2012 en 2018; Wilson, 1966).
Een groot deel van de pasgeborenen met neonatale hypoglycemie vertoont geen evidente klinische symptomen, zelfs niet bij zeer lage plasma glucoseconcentraties (Güemes, 2016; Rozance, 2016). Om hypoglycemie tijdig op te sporen, en daarmee hersenschade te voorkomen, worden verder gezonde pasgeborenen met verhoogd risico op neonatale hypoglycemie routinematig gescreend. In deze uitgangsvraag worden de meest voorkomende risicofactoren besproken (zie tabel 1A): prematuriteit, te laag geboortegewicht (SGA), te hoog geboortegewicht (LGA) en maternale diabetes (kinderen van een moeder met diabetes, IDM (infants of a diabetic mother)). Zij hebben een verhoogde kans op neonatale hypoglycemie vanwege een beperkte endogene glucoseproductiecapaciteit in combinatie met verhoogd verbruik en geringe intake van voeding in de eerste dagen na geboorte (Hawdon, 2016; Hawkes, 2017). Naast een gestoorde adaptatie van het glucosemetabolisme, kunnen zij mogelijk minder beschikken over alternatieve brandstoffen, waardoor de kans op hersenschade toeneemt.
In de internationale richtlijnen en ingezonden Nederlandse lokale protocollen worden vaak nog meer indicaties genoemd voor het controleren van glucose concentraties: zieke pasgeborenen, onderliggende ziektebeelden of antenatale blootstelling aan bepaalde maternale medicatie die (mogelijk) een verhoogd risico geven op hypoglycemie. De meest genoemde indicaties zijn samengevat in tabel 1B tot 1D, maar vallen buiten het bestek van deze uitgangsvraag en worden verder niet besproken.
Gezonde, à terme pasgeborenen met een normaal geboortegewicht beschikken over voldoende (contra)regulerende mechanismen en alternatieve brandstoffen om de fysiologische daling van de plasma glucoseconcentratie in de eerste uren na geboorte adequaat op te vangen. Zij hoeven niet routinematig gescreend te worden (Queensland Clinical Guidelines Newborn hypoglycemia, 2013 (herzien 2015); Adamkin, 2011; https://www.newbornwhocc.org/2014_pdf/hypoglycemia%202014.pdf).
Bij pasgeborenen met symptomen die kunnen wijzen op hypoglycemie (tabel 2) dient altijd onmiddellijk een glucoseconcentratie bepaald te worden. Aangezien het om symptomatische pasgeborenen gaat, is er dan per definitie geen sprake van screening, maar van diagnostiek.
Tabel 1 Indicaties voor routinematige screening op neonatale hypoglycemie genoemd in de internationale richtlijnen en ingezonden lokale protocollen uit Nederlandse ziekenhuizen
|
|
|
Veel genoemde aanvullende indicaties voor routinematige screening (deze lijst beoogt niet om volledig te zijn). |
|
|
|
|
|
|
*) wordt vaak genoemd, maar infecties veroorzaken vaker een hyperglycemie. Denk ook aan een metabole aandoening bij een kind met een sepsis-achtig beeld in combinatie met hypoglycemie.
Tabel 2 Symptomen die kunnen wijzen op neonatale hypoglycemie
|
Adrenerge en cholinerge verschijnselen |
Verschijnselen ten gevolge van neuroglycopenie |
|
|
Conclusies / Summary of Findings
Studies naar de incidentie van hypoglycemie bij pasgeborenen geven slechts gedeeltelijk antwoord op de vraag bij welke pasgeborenen screening noodzakelijk is. De incidentie varieert niet alleen met de definitie van de risicogroep, maar ook met onder andere het tijdstip en de duur van de screening, de bepalingsmethode en de aanwezigheid van één of meer risicofactoren. Wat het lange termijneffect van (milde) hypoglycemie bij pasgeborenen is, en bij welke glucoseconcentratie behandeling nodig is om hersenschade te voorkomen, is een discussie ongeacht risicofactoren.
Routinematige screening op neonatale hypoglycemie wordt (in de literatuur en internationale richtlijnen) geadviseerd bij prematuren, SGA, LGA en kinderen van moeders met diabetes. De definities van deze indicaties en de mate van consensus hierover in de lokale protocollen variëren. Bij prematuren, SGA en maternaal insulinegebruik is de consensus hoog, maar bij LGA en kinderen van moeders met diabetes gravidarum met dieet is er meer discussie.
|
Zeer laag |
Bij prematuren is het advies om routinematig te screenen op neonatale hypoglycemie eenduidig. De WHO-definitie van prematuriteit (zwangerschapsduur <37 weken) wordt gehanteerd in alle internationale richtlijnen en lokale protocollen. |
|
Zeer laag |
De WHO-definitie van SGA is een geboortegewicht <P10. Deze definitie wordt gehanteerd in twee internationale richtlijnen (de andere geven geen definitie voor SGA) en in 66% van de lokale protocollen. De literatuur biedt onvoldoende onderbouwing om een andere grens te adviseren. |
|
Zeer laag |
De WHO-definitie van LGA is een geboortegewicht >P90. Deze grens voor routinematige glucosescreening wordt ook gehanteerd in twee internationale richtlijnen (de anderen geven geen definitie voor LGA) en in 35% van de lokale protocollen. De incidentie van neonatale hypoglycemie bij LGA neemt mogelijk toe met een hoger geboortegewichtpercentiel. |
|
Zeer laag |
De internationale richtlijnen maken geen onderscheid ten aanzien van de indicatie voor routinematige screening op neonatale hypoglycemie bij de verschillende vormen of behandelingsmethoden bij diabetes in de zwangerschap. In de Nederlandse richtlijn en in de lokale protocollen is er consensus over routinematige screening bij insulinegebruik. |
|
Zeer laag |
Bij diabetes gravidarum met dieet adviseert de Nederlandse richtlijn Zwangerschap en Diabetes (2010/2018) om de pasgeborene alleen te screenen als het geboortegewicht >P90 is, evenals 26% van de lokale protocollen. Bijna de helft (16/34) van de lokale protocollen noemt geen grens voor het geboortegewicht om te screenen op hypoglycemie bij maternale diabetes gravidarum met dieet (en zouden dus alle pasgeborenen van deze moeders screenen, conform de internationale richtlijnen). De overige protocollen (26%) noemen diabetes gravidarum niet apart als indicatie voor screening op neonatale hypoglycemie. In de huidige literatuur is onvoldoende bewijs ten aanzien van het wel of niet routinematige screenen bij maternale diabetes gravidarum met dieet bij een geboortegewicht <P90. |
Samenvatting literatuur
De AAP, Canadese, Australische en PES-richtlijnen omschrijven vier risicogroepen bij wie routinematige screening op hypoglycemie geïndiceerd is: (laat) prematuren, SGA, LGA en kinderen van moeders met diabetes (IDM).
De NICE guideline is gericht op diabetes in de zwangerschap.
In de richtlijn van Queensland, de Pediatric Endocrine Society en de ingezonden lokale protocollen worden, naast de hiervoor genoemde risicogroepen, nog aanvullende indicaties genoemd voor screening op hypoglycemie bij pasgeborenen (zie tabel 1B tot D).
In de literatuur werd gezocht naar publicaties die de incidentie van neonatale hypoglycemie beschreven in de verschillende risicogroepen. Door de zeer uiteenlopende definities van hypoglycemie in de literatuur worden ook uiteenlopende incidenten binnen de verschillende risicogroepen gevonden. De in deze uitgangsvraag vermelde incidenten zijn gebaseerd op een plasma glucoseconcentratie <2,6 mmol/L als definitie van neonatale hypoglycemie, zoals in de module ‘Definitie van neonatale hypoglycemie’ is beschreven.
Incidenten kunnen gebruikt worden als een risico-inschatting (de kans om een hypoglycemie te krijgen) voor het individu. Tevens is, daar waar het mogelijk was, de number–needed-to-screen uitgerekend. Attributieve proportie voor geëxponeerden (APe) werd uitgerekend middels (1 – (1 / RR)) om aan te geven welk deel van de incidentie in de geëxponeerde groep is toe te schrijven aan de exposure voor de risicofactor.
De meest recente studie bij de vier risicogroepen die overeenkomen met de doelgroep van deze richtlijn geeft een incidentie neonatale hypoglycemie aan van ongeveer 50% (Harris, 2012). De incidentie is vergelijkbaar tussen de verschillende risicogroepen: late prematuren, SGA, LGA en IDM. Dit geldt zowel voor matige (<2,6 mmol/L), als voor ernstige hypoglycemie (≤2,0 mmol/L) als voor recidiverende hypoglycemieën (figuur 1 en 2). De incidentie voor ernstige of recidiverende hypoglycemie lag rond 20%. De setting van deze studie lijkt goed vergelijkbaar met de Nederlandse situatie. Daarnaast is de gebruikte definitie van hypoglycemie (<2,6 mmol/L) vergelijkbaar met de Nederlandse situatie en werd voldoende vaak en voldoende lang gescreend.
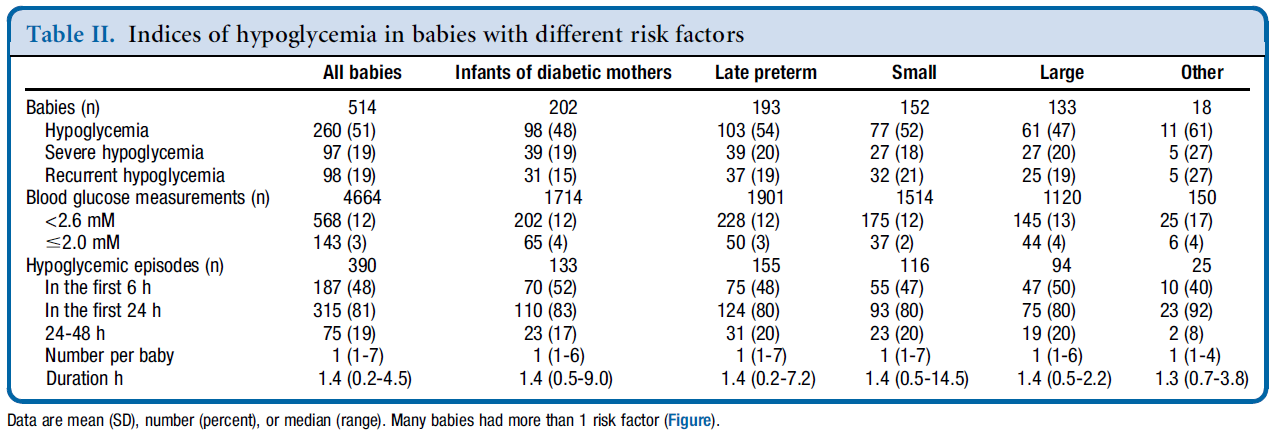
Figuur 1 Incidentie hypoglycemie in de verschillende risicogroepen (Harris, 2012). Een deel van de kinderen had meerdere risicofactoren (zie figuur 2)
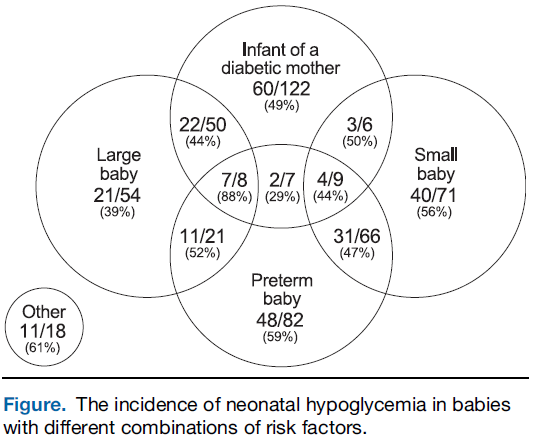
Figuur 2 Incidentie neonatale hypoglycemie bij pasgeborenen met verschillende combinaties van risicofactoren (Harris, 2012)
Hieronder wordt de overige literatuur, de inhoud van de richtlijnen en ingestuurde protocollen over de incidentie neonatale hypoglycemie per risicogroep besproken.
1. Prematuriteit
Literatuur
Bij prematuren is het risico op hypoglycemie verhoogd door een combinatie van een gering aanbod via voeding in de eerste dagen en beperkte endogene glucose productiecapaciteit door beperkte glycogeenvoorraden, gluconeogenese precursors en enzymactiviteit (Cheetham, 2012; Hawdon, 2016; Hawkes, 2017).
De incidentie van neonatale hypoglycemie (plasma glucoseconcentratie <2,6 mmol/L) bij prematuriteit was duidelijk verschillend in twee studies die uitsluitend de invloed van prematuriteit (zonder andere risicofactoren) beschreven. De incidentie was 14,5% bij 62 prematuren 25 tot 36 weken (mediane leeftijd 31 weken), met een geboortegewicht >P10 (Hawdon, 1992, level 2b) en 59,0% in 82 late prematuren 35 tot 37 weken, AGA, zonder andere risicofactoren (Harris, 2012 level 2b). Het verschil in incidentie tussen deze twee studies zou verklaard kunnen worden door de verschillende range in zwangerschapsduur en mogelijke verschillen in behandeling met intraveneus glucose of parenterale voeding. De andere studies die naar voren kwamen waren onduidelijk in de aanwezigheid van overige risicofactoren en worden daarom niet als representatief beschouwd.
Internationale richtlijnen en ingezonden lokale protocollen
In alle internationale richtlijnen en ingezonden lokale protocollen werd prematuriteit, gedefinieerd als een zwangerschapsduur <37 weken, genoemd als indicatie voor routinematige screening op hypoglycemie.
2. Te laag geboortegewicht
Literatuur
Bij pasgeborenen met een te laag geboortegewicht (SGA) is het risico op neonatale hypoglycemie, net als bij prematuren, verhoogd door een combinatie van een gering aanbod via voeding in de eerste dagen en beperkte endogene glucose productiecapaciteit door beperkte glycogeenvoorraden, gluconeogenese precursors en enzymactiviteit. Intra-uteriene groeirestrictie vermindert de mogelijkheid van de foetus om in utero belangrijke brandstoffen op te slaan en verstoort de hormonale regulatie na de geboorte (Hawdon, 2012; Hawdon, 2016; Hawkes, 2017).
Acht studies beschrijven de incidentie van hypoglycemie bij à terme SGA-pasgeborenen zonder andere risicofactoren (Bazaes, 2003; Bragg, 2013; Croke, 2009; Doctor, 2001; Harris, 2012; Heck, 1987; Ishikawa, 2002; PC, 1993).
In deze studies werden verschillende definities gebruikt voor SGA (gebaseerd op percentielen en/of absoluut gewicht) en ook voor hypoglycemie. Twee studies (Harris, 2012; Croke, 2009) kwamen overeen met de populatie in deze richtlijn (à terme pasgeborenen zonder andere risicofactoren behalve het geboortegewicht) en gebruikten 2,6 mmol/L als definitie voor hypoglycemie. In de studie van Harris werd een incidentie van 56% beschreven bij SGA gedefinieerd als een geboortegewicht <P10 of <2500 gram (Harris, 2012). In de andere studie van Croke werd een incidentie van 21% gevonden bij een geboortegewicht <P10 (Croke, 2009).
Een Canadese studie beschrijft het verschil in incidentie bij verschillende geboortegewichtpercentielen (Mejri, 2010). De incidentie hypoglycemie was 22% voor pasgeborenen met een geboortegewicht tussen de P5 en P10, en 28% voor kinderen met een geboortegewicht <P5. De number-needed-to-screen is 16. Oftewel: er moeten 16 kinderen met een geboortegewicht P5 tot 10 gescreend worden om één extra geval van hypoglycemie te vinden ten opzichte van kinderen <P5. In de studie door McKinlay werd een hoog percentage hypoglycemieën gevonden (65%), echter waren hier ook kinderen met prematuriteit als extra risicofactor bij.
Internationale richtlijnen
De definitie van SGA die door de WHO wordt gehanteerd is een geboortegewicht <P10 (WHO, 2014). Twee internationale richtlijnen hanteren een geboortegewicht <P10 als definitie voor SGA (Canada Aziz, 2004; Clinical Guidelines & Health, 2013). In de andere drie internationale richtlijnen wordt geen definitie voor SGA beschreven (AAP, Adamkin, 2011; NCC-WCH Diabetes in pregnancy Management of diabetes and its complications from preconception to the postnatal period, 2015; PES, Thornton, 2015).
Ingezonden lokale protocollen
In de ingezonden lokale protocollen was een laag geboortegewicht in 100% een indicatie voor routinematige screening, waarbij in 65% een geboortegewicht <P10 werd gehanteerd als definitie voor SGA en indicatie voor routinematige screening.
Tabel 3 Definitie van SGA in de ingezonden lokale protocollen
|
Geboortegewicht |
Aantal (%) lokale protocollen |
|
<P10 |
22 (65%) |
|
<P5 |
6 (18%) |
|
<P2.3 |
6 (18%) |
3. Te hoog geboortegewicht
Bij pasgeborenen met een te hoog geboortegewicht (LGA) wordt het risico op neonatale hypoglycemie verklaard door verhoogde insulineconcentraties bij het kind als gevolg van blootstelling aan hogere maternale glucoseconcentraties in utero. Bij gezonde pasgeborenen daalt na de geboorte de glucose- en insulineconcentratie en nemen de concentraties van catecholamines en glucagon toe. Dit zorgt voor de mobilisatie van glucose door middel van glycogenolyse en gluconeogenese, en tevens voor mobilisatie van alternatieve brandstoffen door middel van glycolyse (lactaat), proteolyse (aminozuren), lipolyse (glycerol en vrije vetzuren) en ketogenese (ketonen) (De León, 2014; Hawdon, 2012; Sperling, 1984). Als de insulineconcentratie verhoogd blijft, zoals bij antenatale blootstelling aan hogere maternale glucoseconcentraties kan gebeuren, worden de endogene glucoseproductie, proteolyse, lipolyse en ketogenese onderdrukt. Als gevolg daarvan ontstaat niet alleen hypoglycemie, maar zijn er ook minder alternatieve brandstoffen beschikbaar.
Het is de vraag in hoeverre de kans op hypoglycemie verhoogd is bij LGA-pasgeborenen als een gestoorde maternale glucosehuishouding (zo goed als mogelijk) is uitgesloten door middel van screening in de zwangerschap. Hiervoor werd een aparte literatuursearch verricht met als vragen:
- Wat is de incidentie van hypoglycemie bij à terme LGA-pasgeborenen met een geboortegewicht ≥P90, ≥P95 of ≥P97.7 zonder aanwezigheid van maternale diabetes?
- Dient er, op basis van deze incidentie, gescreend te worden op hypoglycemie in de verschillende groepen?
Literatuur
Er werd een Medline search (zie de zoekverantwoording) vanaf 2000 gedaan, omdat sindsdien de definitie van diabetes in de zwangerschap is aangescherpt. Er werden geen studiedesigns uitgesloten, op case- en dierstudies na. Niet-westerse studies werden geëxcludeerd.
Beschrijving geïncludeerde studies, inclusief kwaliteit van bewijs en resultaten
Vraag 1 Wat is de incidentie van hypoglycemie bij à terme LGA-pasgeborenen met een geboortegewicht ≥P90, ≥P95 of ≥P97,7 zonder aanwezigheid van maternale diabetes?
In de evidence-tabel zijn de studiekenmerken, de kwaliteit van het bewijs en de resultaten per studie beschreven. De studies waren erg heterogeen. Soms ontbrak het bewijs dat moeders adequaat gescreend waren om diabetes uit te sluiten. Daarnaast werden verschillende definities voor hypoglycemie en LGA (geboortegewicht >P90, >P95 of >P97,7 of een absoluut gewicht >4000 of >4500 gram) aangehouden waardoor het niet mogelijk was om de resultaten te poolen. De incidentie in de verschillende studies varieerde sterk (2,2 tot 88%). Dit verschil kan onder andere worden verklaard door de verschillende definities van hypoglycemie die werden gehanteerd, de tijdstippen en duur van de screening, de glucosebepalingsmethode, en het voedingsbeleid. De kwaliteit van het bewijs van het observationele onderzoek werd als zeer laag beoordeeld. Er waren geen factoren aanwezig die de kwaliteit van het bewijs konden verhogen.
Vraag 2 Dient er, op basis van de incidentie van hypoglycemie, gescreend te worden op hypoglycemie in de verschillende gewichtscategorieën?
De vraag of de grens van het geboortegewicht, waarbij glucosecontroles zinvol zijn, kan worden verhoogd van de P90 naar bijvoorbeeld de P95 of P97,7 is interessant. Met andere woorden: hoeveel kinderen met een hypoglycemie worden gemist als de grens van het geboortegewicht, waarboven gescreend moet worden, wordt verhoogd?
Drie studies uit de literatuursearch maakten onderscheid in groepen met verschillende geboortegewicht percentielen (>P90 en >P97,7 (Groenendaal, 2006), >P90 en >P95 (Croke, 2009), en >P90, >P95 en >P99 (Weissmann-Brenner, 2012)) (allen laag niveau van bewijs).
Groenendaal analyseerde de data van de Perinatale Registratie Nederland (PRN) bij à terme pasgeborenen zonder maternale diabetes (131.198 kinderen met een geboortegewicht >P90 en 36.109 met een geboortegewicht >P97,7). Bij de pasgeborenen die opgenomen waren op een neonatologie- of kinderafdeling vond hij een hypoglycemie (<2,5 mmol/L) bij 11,1% (2395/21647) in de groep met een geboortegewicht >P90 ten opzichte van 16,2% (1513/9318) bij een geboortegewicht >P97,7. Dat betekent dat de incidentie bij opgenomen pasgeborenen met een geboortegewicht tussen de P90 en P97,7 (882/12329) 7,1% is ten opzichte van 16,2% bij een geboortegewicht >P97,7. Uit het artikel zijn onvoldoende gegevens beschreven van de niet-opgenomen LGA-pasgeborenen. Met name is niet beschreven of er in die groep wel of geen sprake was van maternale diabetes of neonatale hypoglycemie. Op basis van deze gegevens is de number-needed-to-screen in de beschreven patiënten categorie 11. Dus 11 kinderen met een geboortegewicht tussen de P90 en P97,7 moeten gescreend worden om één hypoglycemie (<2,5 mmol/L) te onderkennen (Groenendaal, 2006).
In de review van Croke (2009) werd de Canadese richtlijn ge-audit in een groep van 374 pasgeborenen. Daarvan waren 148 kinderen à terme LGA en 85 à terme SGA. In de LGA-groep met een geboortegewicht tussen de P90 en P95 was de gemiddelde bloedsuiker twee uur na geboorte 3,52 mmol/L (SD=0,56) ten opzichte van 3,20 mmol/L (SD=0,68) in de groep met een geboortegewicht >P95 (p <0,01). De incidentie van hypoglycemie in deze subgroepen werd niet genoemd (Croke, 2009).
Weissmann-Brenner vond in een retrospectieve database studie een incidentie van hypoglycemie (niet nader gedefinieerd).
Tabel 4
|
|
N |
Hypoglycemie (%) |
|
P10 tot P90 |
30785 |
486 (1.58%) |
|
≥ P90 |
3900 |
922 (4.23) |
|
P90 tot 95 |
2098 |
757 (36.08) |
|
≥P95 |
1802 |
165 (9.16) |
|
P95 tot P99 |
1477 |
135 (9.14) |
|
≥P99 |
325 |
30 (9.23) |
De Odds ratio na correctie voor zwangerschapsduur, geslacht, maternale leeftijd en maternale diabetes was 2,53 bij geboortegewicht ≥P90 (95%CI 2,10 tot 3,03), 3,8 bij een geboortegewicht ≥P95 (95%CI 3,06 tot 4,72) en 5,19 bij een geboortegewicht ≥P99 (95%CI 3,47 tot 7,76) ten opzichte van de AGA kinderen. (Weissmann-Brenner, 2011).
Harris (2012) vond geen verschil in het optreden van hypoglycemie (gedefinieerd als <2,6 mmol/L) in de verschillende risicogroepen (LGA, SGA, maternale diabetes en prematuren) (Harris, 2012). De incidentie in LGA (>P90 of >4500 gram) was met 39% hoog. Ook de incidentie van ernstige hypoglycemie (≤2,2 mmol/L) of recidiverende hypoglycemie was vergelijkbaar met de andere risicogroepen.
Naast verschillende percentielen is ook het onderscheid geproportioneerd / gedisproportioneerd LGA beschreven in relatie tot de incidentie neonatale hypoglycemie. Persson publiceerde in 2013 een retrospectief database onderzoek in Zweden over het verschil tussen geproportioneerd en gedisproportioneerd LGA (>P90) ingedeeld op basis van de Ponderal-index (Persson, 2013). Van de geproportioneerde LGA-kinderen van moeders zonder diabetes had 1,6% binnen zes uur na geboorte een glucoseconcentratie <2,6 mmol/L ten opzichte van 1,9% van de gedisproportioneerde kinderen. Dit gaf een OR voor de incidentie van hypoglycemie bij gedisproportioneerde LGA-kinderen van 1,23 (95%CI 1,11 tot 1,37).
Internationale richtlijnen
De definitie van LGA die door de WHO wordt gehanteerd is een geboortegewicht >P90 (WHO, 2014). Twee internationale richtlijnen hanteren een geboortegewicht >P90 als definitie voor LGA (Canada, Aziz, 2004; Clinical Guidelines & Health, 2013). In de andere drie internationale richtlijnen wordt geen definitie voor LGA beschreven (AAP, Adamkin, 2011; NICE; 2015; PES, Thornton, 2015).
Ingezonden lokale protocollen
Van de 34 ingezonden lokale protocollen hielden 12 de P90 (35%), acht de P95 (24%) en 11 de P97 of P97,7 (32%) aan als indicatie voor routinematige glucose screening. In twee (6%) van de toegezonden protocollen was LGA geen indicatie voor routinematige screening op hypoglycemie. In één protocol werd een absoluut geboortegewicht (>4 kg) als indicatie voor screening genoemd.
Tabel 5 Definitie van LGA in de ingezonden lokale protocollen
|
Geboortegewicht |
Aantal (%) lokale protocollen |
|
>P90 |
12 (35%) |
|
>P95 |
8 (24%) |
|
>P97,7 |
11 (32%) |
|
LGA is geen indicatie tot screenen |
2 (6%) |
|
Alleen absoluut gewicht (>4 kg) |
1 (3%) |
4. Maternale diabetes
Bij kinderen van moeders met diabetes wordt het risico op neonatale hypoglycemie verklaard door verhoogde insulineconcentraties bij het kind als gevolg van blootstelling aan hogere maternale glucoseconcentraties in utero. Er wordt onderscheid gemaakt in moeders met diabetes mellitus, vrijwel altijd met insulinegebruik in de zwangerschap, en diabetes gravidarum.
De incidentie van diabetes gravidarum in Nederland is 2 tot 5% (Perined, 2016). Diabetes gravidarum is een stoornis in de koolhydraatstofwisseling die ontstaat of voor het eerst ontdekt wordt tijdens de zwangerschap. Hieronder vallen zowel niet eerder gediagnosticeerde, pre-existente, diabetes mellitus als diabetes die voor het eerst ontstaat tijdens de zwangerschap. De diagnose wordt gesteld op basis van een gestoorde orale glucose tolerantietest (OGTT) in het tweede trimester (NVOG, 2010; NICE, 2015a). Diabetes gravidarum kan behandeld worden met dieet of insuline. Indien de patiënt geen insuline wil spuiten, kan orale medicatie, zoals metformine en glibenclamide overwogen worden.
Zie ook de richtlijn Diabetes en Zwangerschap (NIV en NVOG, 2010): https://richtlijnendatabase.nl/richtlijn/diabetes_en_zwangerschap/startpagina_dm_en_zwangerschap.html).
Literatuur
Enkele studies beschrijven de incidentie van hypoglycemie bij kinderen van moeders met diabetes mellitus of diabetes gravidarum, al dan niet met gebruik van insuline. De definitie voor hypoglycemie verschilde tussen de studies, maar niet binnen een studie.
De eerste studie bespreekt het verschil in incidentie van neonatale hypoglycemie (<1,9 mmol/L) tussen AGA-kinderen van moeders met diabetes gravidarum (behandeld met en zonder insuline) en kinderen van moeders zonder diabetes gravidarum (Kautzky-Willer, 2008, level 1b). De incidentie was 2,5% (20/794) voor kinderen van moeders zonder en 9,1% (61/672) voor kinderen van moeders met diabetes gravidarum. De APe is hierbij 72,5%. Dat betekent dat 72,5% van de hypoglycemieën mag worden toegeschreven aan het feit dat deze moeders diabetes gravidarum hadden. De number-needed-to-screen in deze studie is 15. Dus 15 kinderen van moeders met diabetes gravidarum (met of zonder gebruik van insuline) met een geboortegewicht <P90 zullen gescreend moeten worden om één kind met hypoglycemie op te sporen. Er werd geen aparte analyse gedaan voor diabetes gravidarum met alleen dieet versus diabetes gravidarum met insulinegebruik.
De tweede studie is een retrospectieve cohortstudie in de USA (Cordero, 1998, level 2b). Deze analyseerde de uitkomsten van 530 pasgeborenen (192 LGA (36%), 327 AGA (62%), 11 SGA (2%)) van 332 moeders met diabetes gravidarum (behandeld met of zonder insuline) en 177 moeders met type 1-diabetes. De glucoseconcentraties van 514 pasgeborenen werden geregistreerd; 137 (27%) had één of meer episodes van hypoglycemie waarvan 10% twee of meer episodes had. De incidentie hypoglycemie was vergelijkbaar tussen kinderen van moeders met diabetes gravidarum zonder insuline (23%), diabetes gravidarum behandeld met insuline (24%) en type 1-diabetes (ontstaan op de leeftijd >20 jaar, of <10 jaar zonder vaatafwijkingen) (25%).
30 van de 137 pasgeborenen met hypoglycemie hadden een zwangerschapsduur <34 weken. 29% van de LGA (55/192), 15% van de AGA (50/327) en 18% van de SGA (2/11) hadden een hypoglycemie. Van de 74 pasgeborenen met een geboortegewicht >4000 gram had 28% een hypoglycemie.
De derde studie betreft die van Flores-le Roux (level 1b) die in een prospectieve studie de incidentie van hypoglycemie (<2,6 mmol/L) beschrijft bij 206 kinderen van moeders met diabetes gravidarum (Flores-le Roux, 2012). De incidentie van hypoglycemie in de totale groep (zowel SGA, AGA als LGA) was 25,2% in de eerste 24 uur na geboorte. Van de AGA-kinderen had 20,9% (31/148) een hypoglycemie versus 46,7% (14/30) van de LGA-kinderen (OR 3,30, 95%CI 1,46 tot 7,49, p =0,0043 (berekend door werkgroep)). Het betreft echter een kleine studiepopulatie, zonder een controlegroep van kinderen met hetzelfde geboortegewicht van moeders zonder diabetes gravidarum.
In de vierde studie werd in een cohort van 23.316 vrouwen in 15 landen gekeken naar het effect van de mate van diabetes gravidarum (gebaseerd op de OGTT) op negatieve geboorte-uitkomsten (The HAPO Study Cooperative, 2008, level 1b). In 480 (2,1%) pasgeborenen was er sprake van klinische hypoglycemie, gedefinieerd als een aantekening van hypoglycemie in het medisch dossier, symptomen van hypoglycemie, of behandeling met intraveneus glucose beschreven in het medisch dossier. Ook een glucoseconcentratie van <1,8 mmol/L gedurende de eerste 24 uur na geboorte of <2,6 mmol/L meer dan 24 uur na geboorte werd -ook zonder notitie in medisch dossier of behandeling- geduid als een hypoglycemie. Daarnaast werd er gekeken naar het aantal kinderen met een geboortegewicht >P90. De mate van diabetes gravidarum (gebaseerd op de OGTT) was significant geassocieerd met een geboortegewicht >P90. De associatie was minder duidelijk voor het optreden van klinische hypoglycemie. Bij moeders met een licht gestoorde OGTT was de incidentie van klinische hypoglycemie 2,1%. Bij een ernstig gestoorde OGTT was dit 4,2%. Wanneer gecorrigeerd werd voor confounders werd een niet-lineair (kwadratisch) statistisch significant verband gevonden voor de nuchtere maternale glucoseconcentratie en het optreden van klinische hypoglycemie bij de pasgeborene. De plasma glucoseconcentratie na één en twee uur in de OGTT bij de moeders was significant geassocieerd met het optreden van klinische hypoglycemie bij de pasgeborene.
(Inter)nationale richtlijnen
De internationale richtlijnen geven aan dat er een indicatie is voor screening op neonatale hypoglycemie als de moeder diabetes heeft, zonder daarbij onderscheid te maken tussen de verschillende typen diabetes.
De Nederlandse richtlijn Zwangerschap en Diabetes (2010) vermeldt dat “bij diabetes gravidarum de literatuur niet eenduidig is over de vraag of er bij de pasgeborenen een verhoogde incidentie van hypoglycemie bestaat”. Gezien de gevolgen van hypoglycemie in combinatie met de verwachte lage ketonlichaamproductie bij maternaal insulinegebruik, is het advies om bij met insuline behandelde diabetes gravidarum te screenen op hypoglycemie. Voor vrouwen met diabetes gravidarum behandeld met dieet, is de kans op lange termijnschade bij het kind als gevolg van hypoglycemie minder evident, aldus dus de NVOG-richtlijn. Hier staan echter geen referenties of andere onderbouwingen bij vermeld. In de richtlijn van de NVOG werden de concepten van de NICE-richtlijn wat betreft literatuursamenvatting integraal overgenomen.
Ingezonden lokale protocollen
In alle ingezonden lokale protocollen is maternaal insulinegebruik een indicatie voor routinematige screening op hypoglycemie bij de pasgeborene.
Er is variatie in de adviezen over het al dan niet routinematig screenen van kinderen van moeders met diabetes gravidarum met dieet, waarbij in een deel van de protocollen onderscheid gemaakt wordt tussen kinderen met een normaal of te hoog geboortegewicht. In 9/34 (26%) van de ingezonden protocollen wordt geadviseerd om kinderen van moeders met diabetes gravidarum met dieet alleen te screenen als het geboortegewicht >P90 is. 16 (47%) protocollen beschrijven dat kinderen van moeders met diabetes in de zwangerschap gescreend moet worden, zonder daarbij het type diabetes of geboortegewicht te benoemen. In geen van de lokale protocollen wordt maternale diabetes gravidarum, behandeld met alleen dieet, en een kind met een geboortegewicht <P90, expliciet benoemd als indicatie voor screening op neonatale hypoglycemie.
Zoeken en selecteren
Deze uitgangsvraag kwam tot stand op basis van consensus met behulp van bestaande literatuur (zie de zoekverantwoording), vijf internationale richtlijnen: AAP (Adamkin Committee on Fetus and Newborn, 2011), PES (Thornton, 2015), Canada (Aziz, 2004 (reaffirmed 2016)), NICE (National Collaborating Centre for Women's and Children's Health (UK), 2015) en Australië (Queensland Clinical Guidelines Newborn hypoglycemia, 2013 (herzien 2015)), één nationale richtlijn (Diabetes en zwangerschap NIV en NVOG, 2010 en 2018) (https://richtlijnendatabase.nl/richtlijn/diabetes_en_zwangerschap/startpagina_dm_en_zwangerschap.html) en ingezonden lokale protocollen uit Nederlandse ziekenhuizen.
Referenties
- Adamkin DH. Neonatal hypoglycemia. Current Opinion in Pediatrics. 2016;28(2):150–155. https://doi.org/10.1097/MOP.0000000000000319.
- Adamkin DH. Postnatal Glucose Homeostasis in Late-Preterm and Term Infants. PEDIATRICS. 2011;127(3):575–579. https://doi.org/10.1542/peds.2010-3851.
- Agrawal RK, Lui K, Gupta JM. Neonatal hypoglycaemia in infants of diabetic mothers. Journal of Paediatrics and Child Health. 2000;36(4):354–356. https://doi.org/10.1046/j.1440-1754.2000.00512.x.
- Alkalay AL, Sarnat HB, Flores-Sarnat L, et al. Population meta-analysis of low plasma glucose thresholds in full-term normal newborns. American Journal of Perinatology. 2006;23(2):115–119. https://doi.org/10.1055/s-2006-931912.
- Andermann A, Blancquaert I, Beauchamp S, et al. Revisiting Wilson and Jungner in the genomic age: A review of screening criteria over the past 40 years. Bulletin of the World Health Organization. 2008;86(4):317–319. https://doi.org/10.2471/BLT.07.050112.
- Araz N, Araz M. Frequency of neonatal hypoglycemia in large for gestational age infants of non-diabetic mothers in a community maternity hospital. Acta Medica (Hradec Kralove). 2006;49(4):237-9.
- Atkin SH, Dasmahapatra A, Jaker MA, et al. Fingerstick glucose determination in shock. Annals of Internal Medicine. 1991;114(12):1020–1024. https://doi.org/10.7326/0003-4819-114-12-1020.
- Au CPY, Raynes-Greenow CH, Turner RM, et al. Antenatal management of gestational diabetes mellitus can improve neonatal outcomes. Midwifery. 2016;34:66–71. https://doi.org/10.1016/j.midw.2016.01.001.
- Aynsley-Green A. Glucose: A fuel for thought! Journal of Paediatrics and Child Health. 1991;27(1):21–30. https://doi.org/10.1111/j.1440-1754.1991.tb00340.x.
- Aynsley-Green, A. Glucose, the Brain and the Paediatric Endocrinologist. Hormone Research. 1996;46(1):8–25. https://doi.org/10.1159/000184971.
- Aziz K, Dancey, Canadian Paediatric Society Fetus and Newborn Committee. Screening guidelines for newborns at risk for low blood glucose. Paediatric Child Health. 2004;9(10):723–729. Reaffirmed 2018.
- Balion C, Grey V, Ismaila A, et al. Screening for hypoglycemia at the bedside in the neonatal intensive care unit (NICU) with the Abbott PCx glucose meter. BMC Pediatrics. 2006;6. https://doi.org/10.1186/1471-2431-6-28.
- Bazaes RA, Salazar TE, Pittaluga E, et al. Glucose and lipid metabolism in small for gestational age infants at 48 hours of age. Pediatrics. 2003;111(4 Pt 1):804–809. https://doi.org/10.1542/peds.111.4.804.
- Beardsall K. Measurement of glucose levels in the newborn. Early Human Development. 2010. https://doi.org/10.1016/j.earlhumdev.2010.05.005.
- Bennett C, Fagan E, Chaharbakhshi E, et al. Implementing a Protocol Using Glucose Gel to Treat Neonatal Hypoglycemia. Nursing for Women’s Health. 2016;20(1):64–74. https://doi.org/10.1016/j.nwh.2015.11.001.
- Bevolkingsonderzoeken en screeningen - RIVM. Retrieved April 22, 2018, from https://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen.
- Bhat MA, Kumar P, Bhansali A, et al. Hypoglycemia in small for gestational age babies. Indian Journal of Pediatrics. 2000;67(6):423–427. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/10932962.
- Boluyt N. Neurodevelopment After Neonatal Hypoglycemia: A Systematic Review and Design of an Optimal Future Study. PEDIATRICS. 2006;117(6):2231–2243. https://doi.org/10.1542/peds.2005-1919.
- Boundy EO, Dastjerdi R, Spiegelman D, et al. Kangaroo Mother Care and Neonatal Outcomes: A Meta-analysis. Pediatrics. 2016;137(1):e20152238. https://doi.org/10.1542/peds.2015-2238.
- Bragg J, Green G. Does early enteral feeding prevent hypoglycemia in small for gestational age neonates? Journal of Neonatal-Perinatal Medicine. 2013;6(2):131–135. Retrieved from http://iospress.metapress.com/content/121063/?p=e4b28739203a487a98e3ffa8f6e525e6&pi=51%5Cnhttp://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=reference&D=emex&NEWS=N&AN=369606153.
- Brand PL, Molenaar NL, Kaaijk C, et al. Neurodevelopmental outcome of hypoglycaemia in healthy, large for gestational age, term newborns. Archives of Disease in Childhood. 2005;90(1):78-81.
- Burns CM, Rutherford MA, Boardman JP, et al. Patterns of Cerebral Injury and Neurodevelopmental Outcomes After Symptomatic Neonatal Hypoglycemia. PEDIATRICS. 2008;122(1):65–74. https://doi.org/10.1542/peds.2007-2822.
- Burrin JM, Alberti KG. What is blood glucose: can it be measured? Diabetic Medicine : A Journal of the British Diabetic Association. 1990;7(3):199–206. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/2139389.
- Carraro P, Plebani M. Post-analytical errors with portable glucose meters in the hospital setting. Clinica Chimica Acta. 2009;404(1):65–67. https://doi.org/10.1016/j.cca.2009.03.013.
- Chan AYW, Swaminathan R, Cockram CS. Effectiveness of sodium fluoride as a preservative of glucose in blood. Clinical Chemistry. 1989;35(2):315–317.
- Chertok IRA, Raz I, Shoham I, et al. Effects of early breastfeeding on neonatal glucose levels of term infants born to women with gestational diabetes. Journal of Human Nutrition and Dietetics. 2009;22(2):166–169. https://doi.org/10.1111/j.1365-277X.2008.00921.x.
- Chi Luong K, Long Nguyen T, Huynh Thi DH, et al. Newly born low birthweight infants stabilise better in skin-to-skin contact than when separated from their mothers: A randomised controlled trial. Acta Paediatrica, International Journal of Paediatrics. 2016;105(4):381–390. https://doi.org/10.1111/apa.13164.
- Christensson K. Fathers can effectively achieve heat conservation in healthy newborn infants. Acta Paediatrica (Oslo, Norway : 1992). 1996;85(11):1354–1360. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/8955466.
- Clinical Guidelines, Queensland, Health Q. Maternity and Neonatal Clinical Guideline – Neonatal hypoglycemia. 2013. Retrieved from www.health.qld.gov.au/qcg.
- Cordero L, Treuer SH, Landon MB, et al. Management of Infants of Diabetic Mothers. Arch Pediatr Adolesc Med. 1998;152:249–254.
- Cornblath M, Hawdon JM, Williams AF, et al. Controversies Regarding Definition of Neonatal Hypoglycemia: Suggested Operational Thresholds. PEDIATRICS. 2000;105(5). https://doi.org/10.1542/peds.105.5.1141.
- Cornblath M, Reisner SH. Blood glucose in the neonate and its clinical significance. The New England Journal of Medicine. 1965;273(7):378–381. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/21417085.
- Cornblath M. Neonatal hypoglycemia 30 years later: does it injure the brain? Historical summary and present challenges. Acta Paediatrica Japonica : Overseas Edition. 1997;39(Suppl 1):S7-11. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/9200872.
- Cowett RM, D’Amico LB. Capillary (heelstick) versus venous blood sampling for the determination of glucose concentration in the neonates. Biology of the Neonate. 1992;62:32–36.
- Cowett RM, Oh W, Pollak A, et al. Glucose disposal of low birth weight infants: steady state hyperglycemia produced by constant intravenous glucose infusion. Pediatrics. 1979;63(3):389–396. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/440840.
- Coyle MC, Jacobs E, Chappie A, et al. Effects of Different Sample Types on Glucose Measurements A CLSI report for global application. Clinical and Laboratory Standards Institute. 2015;35. Retrieved from https://clsi.org/media/1501/poct06ed1_sample.pdf.
- Critchell CD, Savarese V, Callahan A, et al. Accuracy of bedside capillary blood glucose measurements in critically ill patients. Intensive Care Medicine. 2007;33(12):2079–2084. https://doi.org/10.1007/s00134-007-0835-4.
- Croke J, Sullivan M, Ryan-Drover A, et al. Two hour blood glucose levels in at-risk babies: An audit of Canadian guidelines. Paediatrics and Child Health. 2009;14(4):238–244. https://doi.org/10.1093/pch/14.4.238.
- D’Orazio P, Burnett RW, Fogh-Andersen N, et al. Approved IFCC recommendation on reporting results for blood glucose: International Federation of Clinical Chemistry and Laboratory Medicine Scientific Division, Working Group on Selective Electrodes and Point-of-Care Testing (IFCC-SD-WG-SEPOCT). Clinical Chemistry and Laboratory Medicine. 2006;44(12):1486–1490. https://doi.org/10.1515/CCLM.2006.275.
- De Carvalho M, Robertson S, Friedman A, et al. Effect of frequent breast-feeding on early milk production and infant weight gain. Pediatrics. 1983;72(3):307–311. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/6889034.
- De Carvalho M, Robertson S, Merkatz R, et al. Milk intake and frequency of feeding in breast fed infants. Early Human Development. 1982;7(2):155–163. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/7151727.
- De León DD, Thornton PBS, Stanley CBA, et al. Hypoglycemia in the Newborn and Infant PRINCIPLES OF GLUCOSE METABOLISM. 2014. Retrieved from https://www.clinicalkey.es.webproxy.uach.cl:2443/service/content/pdf/watermarked/3-s2.0-B9781455748587000159.pdf?locale=es_ES.
- De Rooy L, Hawdon J. Nutritional Factors That Affect the Postnatal Metabolic Adaptation of Full-Term Small- and Large-for-Gestational-Age Infants. PEDIATRICS. 2002;109(3):e42–e42. https://doi.org/10.1542/peds.109.3.e42.
- Devaskar SU, Garg M. 95 Disorders of Carbohydrate Metabolism in the Neonate Placental Transport of Nutrients: Maternal-Fetal Relationship. 2017. Retrieved from: https://obgynkey.com/disorders-of-carbohydrate-metabolism-in-the-neonate/.
- Dijk PH, De Vries TW, De Beer JJAH. [Guideline “Prevention, diagnosis and treatment of hyperbilirubinemia in the neonate with a gestational age of 35 or more weeks”]. Nederlands Tijdschrift Voor Geneeskunde. 2009;153:A93. Retrieved from https://www.nvk.nl/Portals/0/richtlijnen/hyperbili/richtlijnhyperbili.pdf.
- Doctor BA, O’Riordan MA, Kirchner HL, et al. Perinatal correlates and neonatal outcomes of small for gestational age infants born at term gestation. American Journal of Obstetrics and Gynecology. 2001;185(3):652–659. https://doi.org/10.1067/mob.2001.116749.
- Duvanel CB, Fawer CL, Cotting J, et al. Long-term effects of neonatal hypoglycemia on brain growth and psychomotor development in small-for-gestational-age preterm infants. The Journal of Pediatrics. 1999;134(4):492–498. https://doi.org/10.1016/S0022-3476(99)70209-X.
- Esakoff TF, Cheng YW, Sparks TN, et al. The association between birthweight 4000 g or greater and perinatal outcomes in patients with and without gestational diabetes mellitus. American Journal of Obstetrics & Gynecology. 2009;200(6):672.e1-4.
- Feig SA, Shohet SB, Nathan DG. Energy metabolism in human erythrocytes. I. Effects of sodium fluoride. The Journal of Clinical Investigation. 1971;50(8):1731–1737. https://doi.org/10.1172/JCI106662.
- Finfer S, Wernerman J, Preiser JC, et al. Clinical review: Consensus recommendations on measurement of blood glucose and reporting glycemic control in critically ill adults. Critical Care (London, England). 2013;17(3):229. https://doi.org/10.1186/cc12537.
- Flaherman VJ, Aby J, Burgos AE, et al. Effect of Early Limited Formula on Duration and Exclusivity of Breastfeeding in At-Risk Infants: An RCT. PEDIATRICS. 2013;131(6):1059–1065. https://doi.org/10.1542/peds.2012-2809.
- Flores-le Roux JA, Sagarra E, Benaiges D, et al. A prospective evaluation of neonatal hypoglycaemia in infants of women with gestational diabetes mellitus. Diabetes Research and Clinical Practice. 2012;97(2):217–222. https://doi.org/10.1016/j.diabres.2012.03.011.
- Gambino R. Glucose: A simple molecule that is not simple to quantify. Clinical Chemistry. 2007. https://doi.org/10.1373/clinchem.2007.094466.
- Ghavane S, Murki S, Subramanian S, et al. Kangaroo Mother Care in Kangaroo ward for improving the growth and breastfeeding outcomes when reaching term gestational age in very low birth weight infants. Acta Paediatrica, International Journal of Paediatrics. 2012;101(12):545–550. https://doi.org/10.1111/apa.12023.
- Groenendaal F, Elferink-Stinkens P. Hypoglycaemia and seizures in large-for-gestational-age (LGA) full-term neonates. Acta Paediatrica, International Journal of Paediatrics. 2006;95(7):874–876. https://doi.org/10.1080/08035250500544948.
- Güemes M, Rahman SA, Hussain K. What is a normal blood glucose? Archives of Disease in Childhood. 2016;101(6):569–574. https://doi.org/10.1136/archdischild-2015-308336.
- Guideline N. Diabetes in pregnancy. 2015;29(5):685-99. https://doi.org/10.1016/j.bpobgyn.2015.04.009.
- Gunn V, Nechyba C. The Harriet Lane Handbook. A Manual for Pediatric House Officers. Postgraduate Medical Journal. 2002;61(716):556–557. https://doi.org/10.1136/pgmj.61.716.556-a.
- Gyurkovits Z, Kálló K, Bakki J, et al. Neonatal outcome of macrosomic infants: an analysis of a two-year period. European Journal of Obstetrics, Gynecology, & Reproductive Biology. 2011;159(2):289-92.
- Hagvik J. Comment on: Bellini C, Serra G, Risso D, Mazzella M, Bonioli E. Reliability assessment of glucose measurement by HemoCue analyser in a neonatal intensive care unit. Clin Chem Lab Med 2007; 45(11):1549-54. Clinical Chemistry and Laboratory Medicine. 2008;46(5):729–30; author reply 731. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/18839476.
- Haninger NC, Farley CL. Screening for hypoglycemia in healthy term neonates: Effects on breastfeeding. Journal of Midwifery and Women’s Health. 2001;46(5):292–298. https://doi.org/10.1016/S1526-9523(01)00180-5.
- Harding JE, Harris DL, Hegarty JE, et al. An emerging evidence base for the management of neonatal hypoglycaemia. Early Human Development. 2017;104:51–56. https://doi.org/10.1016/j.earlhumdev.2016.12.009.
- Harris DL, Alsweiler JM, Ansell JM, et al. Outcome at 2 Years after Dextrose Gel Treatment for Neonatal Hypoglycemia: Follow-Up of a Randomized Trial. Journal of Pediatrics. 2016;170:54–59e2. https://doi.org/10.1016/j.jpeds.2015.10.066.
- Harris DL, Gamble GD, Weston PJ, et al. What Happens to Blood Glucose Concentrations After Oral Treatment for Neonatal Hypoglycemia? Journal of Pediatrics. 2017;190:136–141. https://doi.org/10.1016/j.jpeds.2017.06.034.
- Harris DL, Weston PJ, Battin MR, et al. A survey of the management of neonatal hypoglycaemia within the Australian and New Zealand Neonatal Network. Journal of Paediatrics and Child Health. 2014;50(10):E55–E62. https://doi.org/10.1111/j.1440-1754.2009.01599.x.
- Harris DL, Weston PJ, Harding JE. Incidence of neonatal hypoglycemia in babies identified as at risk. Journal of Pediatrics. 2012;161(5):787–791. https://doi.org/10.1016/j.jpeds.2012.05.022.
- Harris DL, Weston PJ, Harding JE. Lactate, rather than ketones, may provide alternative cerebral fuel in hypoglycaemic newborns. Archives of Disease in Childhood: Fetal and Neonatal Edition. 2015;100(2):F161–F164. https://doi.org/10.1136/archdischild-2014-306435.
- Harris DL, Weston PJ, Signal M, et al. Dextrose gel for neonatal hypoglycaemia (the Sugar Babies Study): A randomised, double-blind, placebo-controlled trial. The Lancet. 2013;382(9910):2077–2083. https://doi.org/10.1016/S0140-6736(13)61645-1.
- Harris DL, Weston PJ, Williams CE, et al. Cot-side electroencephalography monitoring is not clinically useful in the detection of mild neonatal hypoglycemia. Journal of Pediatrics. 2011;159(5):755–760. https://doi.org/10.1016/j.jpeds.2011.04.026.
- Hawdon J, Cheetham T, Schenk DJ, et al. Metabolic and endocrine disorders. In Rennie and Roberton’s Textbook of Neonatology (pp. 849–926). 2012. https://doi.org/10.1016/B978-0-7020-3479-4.00035-0.
- Hawdon JM, Platt MPW. Patterns of metabolic adaptation for preterm and term infants in the first neonatal week, (October 1991). 1992;357–365.
- Hawdon JM, Ward Platt MP, Aynsley-Green A. Patterns of metabolic adaptation for preterm and term infants in the first neonatal week. Archives of Disease in Childhood, 67(4 SPEC NO). 1992;357–365. https://doi.org/10.1136/adc.67.4_Spec_No.357.
- Hawdon JM. Best Practice Guidelines: Neonatal Hypoglycaemia. Early Human Development. 2010;86(5):261. https://doi.org/10.1016/j.earlhumdev.2010.05.007.
- Hawdon JM. Investigation, prevention and management of neonatal hypoglycaemia (impaired postnatal metabolic adaptation). Paediatrics and Child Health. 2012. https://doi.org/10.1016/j.paed.2011.08.006.
- Hawdon JM. Postnatal metabolic adaptation and neonatal hypoglycaemia. Paediatrics and Child Health (United Kingdom). 2016. https://doi.org/10.1016/j.paed.2015.12.001.
- Hawkes CP, Stanley CA. 53 Pathophysiology of Neonatal Hypoglycemia. 2017.
- Hay WW, Cornblath M. Historical Perspectives: Transient Symptomatic Neonatal Hypoglycemia. NeoReviews. 2003;4(1):1e–5. https://doi.org/10.1542/neo.4-1-e1.
- Heck LJ, Erenberg A. Serum glucose levels in term neonates during the first 48 hours of life. The Journal of Pediatrics. 1987;110(1):119–122. https://doi.org/10.1016/S0022-3476(87)80303-7.
- Hegarty J, Harding JE, Crowther C, et al. Oral dextrose gel for the prevention of hypoglycaemia in newborn infants (Protocol). Cochrane Database of Systematic Reviews, (4). 2016. https://doi.org/10.1002/14651858.CD012152.
- Hegarty JE, Harding JE, Crowther CA, et al. Oral dextrose gel to prevent hypoglycaemia in at-risk neonates. Cochrane Database of Systematic Reviews. 2017. https://doi.org/10.1002/14651858.CD012152.pub2.
- Hegarty JE, Harding JE, Gamble GD, et al. Prophylactic Oral Dextrose Gel for Newborn Babies at Risk of Neonatal Hypoglycaemia: A Randomised Controlled Dose-Finding Trial (the Pre-hPOD Study). PLoS Medicine. 2016;13(10):1–19. https://doi.org/10.1371/journal.pmed.1002155.
- Hoftiezer L, Hukkelhoven CWPM, Hogeveen M, et al. Geboortegewichtcurven - Perined. Retrieved April 22, 2018, from https://www.perined.nl/producten/geboortegewichtcurven.
- Holtrop PC. The Frequency of Hypoglycemia in Full-Term Large and Small for Gestational Age Newborns. American Journal of Perinatology. 1993;10(2):150–154. https://doi.org/10.1055/s-2007-994649.
- Hortensius J, Slingerland RJ, Kleefstra N, et al. Self-monitoring of blood glucose: The use of the first or the second drop of blood. Diabetes Care. 2011;34(3):556–560. https://doi.org/10.2337/dc10-1694.
- Inoue S, Egi M, Kotani J, et al. Accuracy of blood-glucose measurements using glucose meters and arterial blood gas analyzers in critically ill adult patients: systematic review. Critical Care (London, England). 2013;17(2):R48. https://doi.org/10.1186/cc12567.
- Ishikawa N. Natural progress of blood glucose in full-term low-grade low-birthweight infants. Pediatrics International. 2002;44(6):583–589. https://doi.org/10.1046/j.1442-200X.2002.01637.x.
- Jain R, Myers TF, Kahn SE, et al. How accurate is glucose analysis in the presence of multiple interfering substances in the neonate? (Glucose analysis and interfering substances). Journal of Clinical Laboratory Analysis. 1996;10(1):13–16. https://doi.org/10.1002/(SICI)1098-2825(1996)10:1<13::AID-JCLA3>3.0.CO;2-M.
- Jain V, Chen M, Menon RK. Chapter 94 – Disorders of Carbohydrate Metabolism. Avery’s Diseases of the Newborn. 2012;1320–1329. https://doi.org/10.1016/B978-1-4377-0134-0.10094-0.
- Janssen K, Delanghe J. Importance of the pre-analytical phase in blood glucose analysis. Acta Clinica Belgica. 2010;65(5):311–318. https://doi.org/10.1179/acb.2010.068.
- Johnson CL, Versalovic J. The human microbiome and its potential importance to pediatrics. Pediatrics. 2012;129(5):950–960. https://doi.org/10.1542/peds.2011-2736.
- Jonas D, Dietz W, Simma B. Hypoglycemia in newborn infants at risk. Klinische Padiatrie. 2014;226(5):287-91.
- Joosten KF, Schellekens AP, Waelkens JJ, et al. [Erroneous diagnosis “neonatal hypoglycemia” due to incorrect preservation of blood samples]. Ned Tijdschr Geneeskd. 1991;135(37):1691–1694. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/1922513.
- Kaiser JR, Bai S, Gibson N, et al. Association between transient newborn hypoglycemia and fourth-grade achievement test proficiency: A population-based study. JAMA Pediatrics. 2015;169(10):913–921. https://doi.org/10.1001/jamapediatrics.2015.1631.
- Kanji S, Buffie J, Hutton B, et al. Reliability of point-of-care testing for glucose measurement in critically ill adults. Critical Care Medicine. 2005;33(12):2778–2785. https://doi.org/10.1097/01.CCM.0000189939.10881.60.
- Kaplan M, Blondheim O, Alon I, et al. Screening for hypoglycemia with plasma in neonatal blood of high hematocrit value. Critical Care Medicine. 1989;17(3):279–282. https://doi.org/10.1097/00003246-198903000-00016.
- Kautzky-Willer A, Bancher-Todesca D, Weitgasser R, et al. The impact of risk factors and more stringent diagnostic criteria of gestational diabetes on outcomes in central European women. Journal of Clinical Endocrinology and Metabolism. 2008;93(5):1689–1695. https://doi.org/10.1210/jc.2007-2301.
- Kerstjens JM, Bocca-Tjeertes IF, de Winter AF, et al. Neonatal Morbidities and Developmental Delay in Moderately Preterm-Born Children. Pediatrics. 2012;130(2):e265–e272. https://doi.org/10.1542/peds.2012-0079.
- Kinnala A, Rikalainen H, Lapinleimu H, et al. Cerebral Magnetic Resonance Imaging and Ultrasonography Findings After Neonatal Hypoglycemia. Pediatrics. 1999;103(4). https://doi.org/10.1542/peds.103.4.724.
- Kishnani PS, Chen YT. Defects in Metabolism of Carbohydrates 87.1 Glycogen Storage Diseases. 2015.
- Kitsommart R, Ngerncham S, Wongsiridej P, et al. Accuracy of the StatStrip versus SureStep Flexx glucose meter in neonates at risk of hypoglycemia. European Journal of Pediatrics. 2013;172(9):1181–1186. https://doi.org/10.1007/s00431-013-2019-2.
- Koh HG, Aynsley-Green A, Tarbit M, et al. Neural dysfunction during hypoglycaemia. Archives of Disease in Childhood. 1988;63:1353–1358. Retrieved from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1779138/pdf/archdisch00680-0065.pdf.
- Lilien LD, Grajwer LA, Pildes RS. Treatment of neonatal hypoglycemia with continuous intravenous glucose infusion. The Journal of Pediatrics. 1977;91(5):779–782. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/909019.
- Lilien LD, Pildes RS, Srinivasan G, et al. Treatment of neonatal hypoglycemia with minibolus and intravenous glucose infusion. The Journal of Pediatrics. 1980;97(2):295–298. https://doi.org/10.1016/S0022-3476(80)80499-9.
- Linder N, Lahat Y, Kogan A, et al. Macrosomic newborns of non-diabetic mothers: anthropometric measurements and neonatal complications. Archives of Disease in Childhood Fetal & Neonatal Edition. 2014;99(5):F353-8.
- Lockyer MG, Fu K, Edwards RM, et al. Evaluation of the Nova StatStrip glucometer in a pediatric hospital setting. Clinical Biochemistry. 2014;47(9):840–843. https://doi.org/10.1016/j.clinbiochem.2014.01.004.
- Lucas A, Morley R, Cole TJ. et al. Adverse neurodevelopmental outcome of moderate neonatal hypoglycaemia. BMJ (Clinical Research Ed.). 1988;297(6659):1304–1308. https://doi.org/10.1136/bmj.297.6659.1304.
- Lucas A, Ynsley-Green A, Bloom SR. Gut hormones and the first meals. Clin Sci.(Lond). 1981;60(4):349–353. https://doi.org/10.1042/cs0600349.
- McIntyre S, Taitz D, Keogh J, et al. A systematic review of risk factors for cerebral palsy in children born at term in developed countries. Developmental Medicine and Child Neurology. 2013;55(6):499–508. https://doi.org/10.1111/dmcn.12017.
- McKinlay CJD, Alsweiler JM, Ansell JM, et al. Neonatal Glycemia and Neurodevelopmental Outcomes at 2 Years. New England Journal of Medicine. 2015;373(16):1507–1518. https://doi.org/10.1056/NEJMoa1504909.
- Meites S, Saniel-Banrey K. Preservation, distribution, and assay of glucose in blood, with special reference to the newborn. Clinical Chemistry. 1979;25(4):531–534.
- Mejri A, Dorval VG, Nuyt AM, et al. Hypoglycemia in term newborns with a birth weight below the 10th percentile. Paediatrics and Child Health. 2010;15(5):271–275.
- Metzger BE, Persson B, Lowe LP, et al. Hyperglycemia and adverse pregnancy outcome study: neonatal glycemia. Pediatrics. 2010;126(6):e1545-52.
- Mikesh LM, Bruns DE. Stabilization of glucose in blood specimens: mechanism of delay in fluoride inhibition of glycolysis. Clinical Chemistry. 2008;54(5):930–932. https://doi.org/10.1373/clinchem.2007.102160.
- Moore E, Bergman N, Anderson G, et al. Early skin-to-skin contact for mothers and their healthy newborn infants (Review) SUMMARY OF FINDINGS FOR THE MAIN COMPARISON. Cochrane Database of Systematic Reviews. 2016;(11). https://doi.org/10.1002/14651858.CD003519.pub4.www.cochranelibrary.com.
- NCC-WCH Diabetes in pregnancy Management of diabetes and its complications from preconception to the postnatal period. (2015). Retrieved from https://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0076657/pdf/PubMedHealth_PMH0076657.pdf.
- Nederlandse Vereniging voor Obstetrie & Gynaecologie. Diabetes mellitus en zwangerschap - Versie 2.0. 2010. Retrieved from http://www.nvog-documenten.nl/index.php?pagina=/richtlijn/item/pagina.php&id=27420&richtlijn_id=863.
- Newnam KM, Bunch M. Glucose Gel as a Treatment Strategy for Transient Neonatal Hypoglycemia. Advances in Neonatal Care : Official Journal of the National Association of Neonatal Nurses. 2017;17(6):470–477. https://doi.org/10.1097/ANC.0000000000000426.
- Ngerncham S, Piriyanimit S, Kolatat T, et al. Validity of two point-of-care glucometers in the diagnosis of neonatal hypoglycemia. Indian Pediatrics. 2012;49(8):621–625. https://doi.org/10.1007/s13312-012-0133-2.
- NICE. Diabetes in pregnancy: management from preconception to the postnatal period. 2015. Retrieved from http://linkinghub.elsevier.com/retrieve/pii/S1521693415000772.
- NICE. Diabetes in pregnancy: management from preconception to the postnatal period, (February). 2015;1–67. https://doi.org/978-1-4731-0993-3.
- NICE. Postnatal care up to 8 weeks after birth | Guidance and guidelines | NICE. 2015. Retrieved April 29, 2018, from https://www.nice.org.uk/guidance/CG37.
- Nicholl R. What is the normal range of blood glucose concentrations in healthy term newborns? Archives of Disease in Childhood. 2003;88(3):238–239. https://doi.org/10.1136/adc.88.3.238.
- NVK. Werkboek kinderendocrinologie- deel 2. (C. Kneepkens, Ed.) (Vol. 2). VU Uitgeverij, Amsterdam. 2010. Retrieved from https://www.nvk.nl/Kwaliteit/Werkboeken/Kinderendocrinologie.
- Onal EE, Hirfanoglu IM, Beken S, et al. Are the neonatal outcomes similar in large-for-gestational age infants delivered by women with or without gestational diabetes mellitus? World Journal of Pediatrics. 2012;8(2):136-9.
- Perined. Perinatale Zorg in Nederland 2016. Utrecht. 2016. Retrieved from https://assets.perined.nl/docs/7935f9c6-eaac-4f59-a150-307ae04efa27.pdf.
- Persson M, Fadl H, Hanson U, et al. Disproportionate Body Composition and Neonatal Outcome in Offspring of Mothers With and Without Gestational Diabetes Mellitus. 2013;36(11):3543-8. https://doi.org/10.2337/dc13-0899.
- Raizman JE, Shea J, Daly CH, et al. Clinical impact of improved point-of-care glucose monitoring in neonatal intensive care using Nova StatStrip: Evidence for improved accuracy, better sensitivity, and reduced test utilization. Clinical Biochemistry. 2016;49(12):879–884. https://doi.org/10.1016/j.clinbiochem.2016.05.002.
- Rawat M, Chandrasekharan P, Turkovich S, et al. Oral Dextrose Gel Reduces the Need for Intravenous Dextrose Therapy in Neonatal Hypoglycemia. Biomedicine Hub. 2016;1(3):1–1. https://doi.org/10.1159/000448511.
- RIVM. Bevolkingsonderzoeken en screeningen. 2018. Retrieved from https://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen.
- RIVM. Screening: de theorie. 2012. Retrieved from https://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen/Screening_de_theorie.
- Roth-Kleiner M, Stadelmann Diaw C, Urfer J, et al. Evaluation of different POCT devices for glucose measurement in a clinical neonatal setting. European Journal of Pediatrics. 2010;169(11):1387–1395. https://doi.org/10.1007/s00431-010-1243-2.
- Rozance PJ, Hay WW. Describing hypoglycemia--definition or operational threshold? Early Human Development. 2010;86(5):275–280. https://doi.org/10.1016/j.earlhumdev.2010.05.002.
- Rozance PJ, Hay WW. New approaches to management of neonatal hypoglycemia. Maternal Health, Neonatology and Perinatology. 2016a;2(1):3. https://doi.org/10.1186/s40748-016-0031-z.
- Rozance PJ. Update on neonatal hypoglycemia. Current Opinion in Endocrinology, Diabetes and Obesity. 2014. https://doi.org/10.1097/MED.0000000000000027.
- Sacks DB, Bruns DE, Horton J, et al. Point-of-Care Blood Glucose Testing in Acute and Chronic Care Facilities; Approved Guideline—Third Edition. Clinical and Laboratory Standards Institute (Vol. 33). Wayne, PA. 2013. Retrieved from https://clsi.org/media/1497/poct12a3_sample.pdf.
- Scott MG, Bruns DE, Boyd JC, et al. Tight glucose control in the intensive care unit: Are glucose meters up to the task? 2009. Clinical Chemistry. https://doi.org/10.1373/clinchem.2008.117291.
- Screening: de theorie - RIVM. 2018. Retrieved April 22, 2018, from https://www.rivm.nl/Onderwerpen/B/Bevolkingsonderzoeken_en_screeningen/Screening_de_theorie.
- Semmekrot B. Hypoglykemie bij de pasgeborene: weet u wat u meet? - Artikel - Editie - Tijdschrift & E-learning - Praktische Pediatrie. Praktische Pediatrie. 2015;2:93–99. Retrieved from https://www.praktischepediatrie.nl/tijdschrift-elearning/editie/artikel/t/hypoglykemie-bij-de-pasgeborene-weet-u-wat-u-meet.
- Shorey S, He HG, Morelius E. Skin-to-skin contact by fathers and the impact on infant and paternal outcomes: an integrative review. Midwifery. 2016;40:207–217. https://doi.org/10.1016/j.midw.2016.07.007.
- Sidebottom RA, Williams PR, Kanarek KS. Glucose determinations in plasma and serum: Potential error related to increased hematocrit. Clinical Chemistry. 1982;28(1):190–192.
- Singhal PK, Singh M, Paul VK, et al. Prevention of hypoglycemia: a controlled evaluation of sugar fortified milk feeding in small-for-gestational age infants. Indian Pediatrics. 1992;29(11):1365–1369.
- Sperling MA, Ganguli S, Leslie N, et al. Fetal-perinatal catecholamine secretion: role in perinatal glucose homeostasis. The American Journal of Physiology. 1984;247(1 Pt 1):E69-74. https://doi.org/10.1152/ajpendo.1984.247.1.E69 [doi].
- Sperling MA. Hypoglycemia SIGNIFICANCE AND SEQUELAE. Nelson Textbook of Pediatrics, 2-Volume Set. 2016;773–788.e1. https://doi.org/10.1016/B978-1-4557-7566-8.00092-2.
- Suman RPN, Udani R, Nanavati R. Kangaroo mother care for low birth weight infants: a randomized controlled trial. Indian Pediatrics. 2008;45(1):17–23. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/18250500.
- Swenne I, Ewald U, Gustafsson J, et al. Inter-relationship between serum concentrations of glucose, glucagon and insulin during the first two days of life in healthy newborns. Acta Paediatrica, International Journal of Paediatrics. 1994;83(9):915–919. https://doi.org/10.1111/j.1651-2227.1994.tb13170.x.
- Tang Z, Du X, Louie RF, et al. Effects of pH on glucose measurements with handheld glucose meters and a portable glucose analyzer for point-of-care testing. Archives of Pathology and Laboratory Medicine. 2000;124(4):577–582. https://doi.org/10.1309/QAW1-X5XW-BVRQ-5LKQ.
- Tang Z, Lee JH, Louie RF, et al. Effects of different hematocrit levels on glucose measurements with handheld meters for point-of-care testing. Archives of Pathology and Laboratory Medicine. 2000;124(8):1135–1140. https://doi.org/10.1043/0003-9985(2000)124<1135:EODHLO>2.0.CO;2.
- Tang Z, Louie RF, Lee JH, et al. Oxygen effects on glucose meter measurements with glucose dehydrogenase- and oxidase-based test strips for point-of-care testing. Critical Care Medicine. 2001;29(5):1062–1070. https://doi.org/10.1097/00003246-200105000-00038.
- Ter M, Halibullah I, Leung L, et al. Implementation of dextrose gel in the management of neonatal hypoglycaemia. Journal of Paediatrics and Child Health. 2017;53(4):408–411. https://doi.org/10.1111/jpc.13409.
- The HAPO Study Cooperative. Hyperglycemia and Adverse Pregnancy Outcomes. New England Journal of Medicine. 2008;358(19):1991–2002. https://doi.org/10.1056/NEJMoa0707943.
- Thornton P, Stanley C, De Leon D, et al. Recommendations from the Pediatric Endocrine Society for evaluation and management of hersistent Hypoglycemia in neonates, infants and children. Journal of Pediatrics. 2015;167(2):238–245. https://doi.org/10.1016/j.jpeds.2015.03.057.
- Tozier PK. Colostrum Versus Formula Supplementation for Glucose Stabilization in Newborns of Diabetic Mothers. JOGNN - Journal of Obstetric, Gynecologic, and Neonatal Nursing. 2013;42(6):619–628. https://doi.org/10.1111/1552-6909.12260.
- Troughton K, Corrigan N, Tait R. Hypostop gel in the treatment of neonatal hypoglycaemia: a randomised controlled trial. Archives of Disease in Childhood. 2000;82(Suppl 1):A29–A32. https://doi.org/10.1136/adc.82.suppl_1.A29.
- Van Der Hagen EAE, Fokkert MJ, Kleefman AMD, et al. Technical and clinical validation of the Greiner FC-Mix glycaemia tube. Clinical Chemistry and Laboratory Medicine. 2017;55(10):1530–1536. https://doi.org/10.1515/cclm-2016-0944.
- Vannucci RC, Vannucci SJ. Glucose metabolism in the developing brain. Semin Perinatol. 2000;24(2):107–115. https://doi.org/10.1053/sp.2000.6361.
- Voeten M, Gerrits G, Voorhoeve P, et al. Behandeling van neonatale hypoglykemie: frequenter aanleggen aan de borst versus bijvoeden met flesvoeding; retrospectief statusonderzoek. Ned Tijdschr Geneeskd. 2008;152(31).
- Volpe JJ. Hypoglycemia and brain injury. Neurology of the Newborn. Volpe JJ. 2008;591–618.
- Wada Y, Nakamura T, Kaneshige M, et al. Evaluation of two glucose meters and interference corrections for screening neonatal hypoglycemia. Pediatrics International. 2015;57(4):603–607. https://doi.org/10.1111/ped.12543.
- Weissmann-Brenner A, Simchen MJ, Zilberberg E, et al. Maternal and neonatal outcomes of large for gestational age pregnancies. Acta Obstetricia et Gynecologica Scandinavica. 2012;91(7):844–849. https://doi.org/10.1111/j.1600-0412.2012.01412.x.
- Weston PJ, Harris DL, Battin M, et al. Oral dextrose gel for the treatment of hypoglycaemia in newborn infants. Cochrane Database of Systematic Reviews. 2016;(5). https://doi.org/10.1002/14651858.CD011027.pub2.
- WHO. Hypoglycemia in the newborn. 2014. https://doi.org/10.1016/S0022-3468(67)80157-X.
- Wiener K. Whole blood glucose: What are we actually measuring? Annals of Clinical Biochemistry. 1995;32(1):1–8. https://doi.org/10.1177/000456329503200101.
- Williams AF. Hypoglycaemia of the newborn: A review. Bulletin of the World Health Organization. World Health Organization. 1997. https://doi.org/10.1177/089033449801400227.
- Wilson JMG, Jungner G. Principles and Practice of Screening for Disease. Public Health Papers. 1966. https://doi.org/10.1001/archinte.1969.00300130131020.
- Woo HC, Tolosa L, El-Metwally D, et al. Glucose monitoring in neonates: Need for accurate and non-invasive methods. Archives of Disease in Childhood: Fetal and Neonatal Edition. 2014. https://doi.org/10.1136/archdischild-2013-304682.
- World Health Organization. Infant and young child feeding. 2018. Retrieved April 29, 2018, from http://www.who.int/en/news-room/fact-sheets/detail/infant-and-young-child-feeding.
- Zecca E, Costa S, Barone G, et al. Proactive Enteral Nutrition in Moderately Preterm Small for Gestational Age Infants: A Randomized Clinical Trial. The Journal of Pediatrics. 2014;165(6):1135–1139.e1. https://doi.org/10.1016/j.jpeds.2014.08.06.
Evidence tabellen
Evidence-tabel uitgangsvraag incidentie hypoglycemie bij LGA.
|
Study |
Method |
Patients |
Definition hypoglycaemia |
Results |
Results critical appraisal |
Level of evidence |
|
Araz (2006) |
Design Case-control
Frequency glucose monitoring Once. Second hour of life.
Glucose determination Via capillary blood by glucometer (Glucometer Elite, Bayer Diagnostics, Germany). |
96 patients of non-diabetic mothers. LGA (>4000 gr.)
|
<2.2 mmol/L |
16.7% (16/96) |
-Small sample size -Gestational age of the infants is unclear. -OGTT was perfomed in a small minority (5%) of the mothers only. Mothers’ diabetes status was based mainly on verbal maternal history |
Laag |
|
Brand (2005) |
Design Retrospective study
Frequency glucose monitoring Screening for hypoglycaemia was performed 1, 3, and 5 hours after birth
Glucose determination Glucose oxidase method (2300 STAT+YSI |
75 healthy term large for gestational age (LGA) infants, born to non-diabetic mothers after 37 weeks of gestation or more.
LGA was defined as birth weight exceeding the 90th centile for gestational age (adjusted for parity of the mother and gender of the infant) |
Different definitions (see results), plasma glucose: <2.2 mmol/L 1 hour after birth, or <2.5 mmol/L subsequently.
|
Zwolle <2.2 1 h after birth, <2.5 subsequently n=60 (80%)
Srinivasan et al. <2.2 during the 1st day of life, <2.5 subsequently n=34 (45%)
Cornblath et al. <2.5 at any time point n=66 (88%) <2.0 at any time point n=42 (56%) <1.4 at any time point n=14 (19%) |
-Retrospective study -Small sample size
Only three children (4%) were exclusively breast fed during the first three days of life. |
Laag |
|
Croke (2009) |
Design Chart review
Frequency glucose monitoring For LGA term newborns, an average of 4.8 (SD=2.9) BG screening tests were conducted per baby.
Initial testing times averaged 3 h 4 min for LGA babies; the average final sampling occurred at 19 h 40 min of age. Furthermore, the average frequency of blood collection was every 4 h 2 min.
Glucose determination Radiometer ABL700 analyzer (Radiometer A/S, Denmark) – a desktop device requiring a sample size of approximately 0.1 mL of heparinized capillary blood.
Aim of this study: The audit evaluates the burden of the CPS guidelines on an asymptomatic population, as well as the predictive value of a 2 h BG level in babies at risk for subsequent hypoglycemia (defined as a BG level lower than 2.6 mmol/L). The study objective was to rationalize the recommended practice of recurrent testing of at-risk babies with potentially normal BG levels. |
148 LGA infants of 37+0 to 40+6 weeks’ gestation.
LGA: weighing more than the 90th percentile. The mean birth weight for LGA term babies was 4253g (SD=1711)
Average initial testing time: 3 h 4 min for LGA babies.
IDMs were not included. |
A positive screen was defined as an initial (2h, for LGA babies mean 3h) BG level lower than 1.8 mmol/L, or a subsequent level lower than 2.6 mmol/L. |
Initial BG levels <1.8 mmol/L: 1% (n=1). <2.6 mmol/L: 14%
24 LGA babies (17%) subsequently had levels lower than 2.6 mmol/L.
The mean BG level of babies between the 90th and 95th percentiles for birthweight was significantly higher than that of babies weighing more than the 95th percentile (3.52 mmol/L, SD=0.56 versus 3.20 mmol/L, SD=0.68; P<0.01). |
Hypoglycemia was defined as <1.8 mmol/L at 2 h (other studies: <2, 2.2 or 2.6).
|
Laag |
|
Esakoff (2009)
|
Design Retrospective cohort study
Frequency glucosemonitoring Unclear
Glucose determination Unclear |
At term patients with birthweight ≥4000 gram. |
Hypoglycemia was defined as blood glucose <1.9 mmol/L or plasma glucose <2.2 mmol/L.
|
2.4% (77)
(versus 1.2% (n=269) in patients with birthweight <4000 g, p<0.001).
|
-Retrospective. -Frequency glucosemonitoring and method of glucose determination unclear. |
Laag |
|
Groenendaal (2006) |
Design Cross-sectional
Frequency glucosemonitoring Unkown. “Formal glucose measurements at any time point after birth”
Glucose determination Unclear |
LGA (>p90) (n=22893) and LGA (>97.7) (n=10101).
Term (37-42wk).
Diabetes medication mother (/insulin) Unknown
|
Plasma glucose <2.5 mmol/L
|
>p90: 13.0% (n=2966)
>p97.7: 18.8% (n=1903) |
Cross-sectional. The timing, duration, severity and recurrence of hypoglycaemia have not been recorded in the database.
Method of glucose determination unclear.
Validity of the data (PRN registry)? |
Laag |
|
Gyurkovits (2011)
|
Design Retrospective study
Frequency glucosemonitoring Blood glucose was checked at 1, 3, 6, 24 and 72 h of age, or more frequently in the event of hypoglycaemia.
Glucose determination Unclear |
367 at term patients weighing at least 4000 g.
Control group: neonates with BW 2500–3999 g. |
Blood glucose level <2.6 mmol/L. |
3.8% (n=14)
Versus 11 (26%) macrosomic neonates of diabetic mothers, p<0.001 |
-Retrospective -Method of glucose determination unclear. -Exact timing of the reported blood glucose level is unclear.
|
Laag |
|
Harris (2012) |
Design Cohort study (as part of two randomized controlled trials)
Frequency glucosemonitoring Samples were taken at 1 hour after birth regardless of feeds, then before feeds 3-4 hourly in the first 24 hours, then 3-8 hourly for the next 24 hours.
Measurements were discontinued if there were 3 normal blood glucose concentration measurements and no clinical concerns about feeding.
Glucose determination Blood glucose concentrations were measured on capillary blood samples taken by heel-prick lance and analyzed on a blood gas analyzer (ABL800 Flex; Radiometer Medical,Copenhagen, Denmark) using the glucose oxidaze method (reading range 0.0-60 mmol/L, coefficient of variation 2.1%). |
Term (37-42 weeks). (>90th percentile or >4500 gr.).
IDM and GDM were excluded.
|
<2.6 mmol/L |
n=21/54 (39%) |
More than one-quarter of babies did not have blood glucose monitoring for the full 48 hours after birth. This was because the study protocol allowed for monitoring to be discontinued after 3 normal glucose measurements and no clinical concerns, as is routine practice in the hospital. |
Laag |
|
Jonas (2014) |
Design Retrospective study
Frequency glucosemonitoring The first blood glucose was done within 90min after birth, 30min after the first feeding and had to be repeated before each feeding.
Glucose determination Glucose concentrations were |
32 term (37-42wk) patients with LGA (birth weight >90th, >4000 gr.)
IDM excluded.
|
<2.2 mmol/L |
2/32 (6.25%) (article, figure 1) |
Retrospective, small sample size. |
Laag |
|
Linder (2014) |
Design Retrospective cohort study
Frequency glucosemonitoring During the study period, it was the departmental policy to routinely measure blood glucose in all macrosomic infants (≥4000 g) at 1 h of age, followed by early feeding. Repeated measurements were performed at ages 3, 6, 8 and 24 h. In the control group, glucose was determined in every infant requiring blood test. Glucose screening is performed in non-macrosomic infants only when symptomatic hypoglycaemia is suspected
Glucose determination Unclear |
Liveborn, singleton, full term LGA patients born to non-diabetic mothers (n=1347).
These patients (study group) were matched to the next born, healthy, full term infant with a birth weight of 3000–4000 g (control group).
Exclusion criteria were multiple birth, |
<2.2 mmol/L at any period during the hospital stay, irrespective of gestational age or hour of life |
29 (2.2%) (p<0.001) |
Retrospective.
Method of glucose determination unclear. |
Laag |
|
McKinlay (2015) |
Design Prospective cohort study
Frequency glucosemonitoring up to 24 - 48 hr
Glucose determination Glucose oxidase method (ABL800 FLEX, Radiometer)
Hypoglycemia, defined as a blood glucose concentration of less than 47 mg per deciliter (2.6 mmol per liter), was treated with any combination of additional feeding, buccal dextrose-gel, and intravenous dextrose to maintain a blood glucose concentration of at least 47 mg per deciliter. Approximately one third of the infants (237) were enrolled in a randomized, placebo-controlled trial of buccal dextrose-gel (!). |
42 patients, >p90 or >4500g, gestational age >=35 wks.
Infants were enrolled before or shortly after birth in one of two parallel studies: the Babies and Blood Sugar’s Influence on EEG Study (BABIES) (102 infants) and the Sugar Babies study (514 infants),
Diabetes medication mother (/insulin) Unknown
|
<2.6 mmol/L
|
40.5% (17/42) |
Small sample size.
Term or preterm unknown.
If the LGA patients had other risk factors is unclear. |
Laag |
|
Metzger (2010) |
Design Cohort study
Frequency glucosemonitoring 1 to 2 hrs after birth.
For determination of whether neonatal plasma glucose concentrations decrease progressively in healthy newborns, rather than showing an early postdelivery plateau, 5% of
Glucose determination Capillary blood, heel prick, central determination |
1647 patients with LGA (>p90). Gestational age range: 30-44 weeks.
Diabetes medication mother (/insulin) Excluded: diagnosis of diabetes during the current pregnancy, diabetes predating the pregnancy treated with medication.
|
Biochemical Neonatal Hypoglycemia: Central laboratory–measured plasma glucose concentrations of <2.2 mmol/L, representing the 10th percentile of the 17 094 HAPO Study values, were used to define biochemical hypoglycemia. The 5th percentile was 1.9 mmol/L.
Clinical Neonatal Hypoglycemia: This was defined by ≥1 clinical criterion, that is, a notation of neonatal hypoglycemia in the medical record and symptoms or treatment with glucose infusion or laboratory-reported glucose levels of ≤1.7 mmol/L in the first 24 hours after birth or ≤2.5 mmol/L after the first 24 hours. |
Biochemical: 202/1647 (12.3%)
Clinical: 75/2219 (3.4%)
|
Meter measurements of glucose were not included in the determination of hypoglycaemia. E.g. clinical hypoglycaemia was defined by a notation in the medical record.
Mothers with diabetes were not eligible to participate, but it is unclear whether mothers developed diabetes during the study period.
Collection of heel stick samples was omitted more frequently in some cases: no collection of cord blood, caesarean delivery, preterm, preeclampsia, NICU admission. This might have led to an underestimation of the frequency of hypoglycaemia.
Preterm children may be included. |
Laag |
|
Onal (2012) |
Design Retrospective study
Frequency glucosemonitoring All LGA infants were routinely evaluated for hypoglycemia by heel-stick at the first and fourth hour.
Glucose determination Blood glucose measurement was done by a glucometer (GlucoDr®) |
LGA infants of ≥36 weeks of gestation of mothers without DM (and with DM).
Of the 700 LGA infants, 87 (12.4%) were infants of gestational diabetic mothers and 613 (87.6%) were infants of non-diabetic mothers.
Infants of mothers with preexisting diabetes, pregnancy-induced hypertension and preeclampsia, and other systemic illness or history of smoking during gestation were excluded. |
<2.6 mmol/L |
The incidence of hypoglycemia at the first hour in infants of non-diabetic mothers was 5.3% and 8.8% on the 4th hour.
|
Retrospective. |
Laag |
|
Schaefer-Graf (2002) |
Design Retrospective study
Frequency glucosemonitoring The first postnatal glucose testing was performed 30 to 60 minutes after the first feeding. Subsequent measurements of neonatal blood glucose were performed before feeding every 4 to 6 hours within the first 24 hours of life
Glucose determination Heel stick with a reflectance meter (Roche Diagnostics, Mannheim, Germany. Glucose values of ≤40 mg/dL were confirmed in laboratory measurements by the glucose oxidase method (Beckman Glucose Analyzer II, Beckman Instruments, Brea, Calif). |
887 LGA infants of non-diabetic mothers who were born during the 5-year period between 1994 and 1998.
LGA: birth weight, >90th percentile). Gestational age at delivery: 39.2 (sd 1.3) |
≤1.7 mmol/L |
N=142 (16.0%) during the first 24 hours of life.
The rate of hypoglycemia was 5.9% in infants of mothers with normal OGTT glucose levels, 12.2% in infants of mothers with 1 elevated value, and 17.7% in infants of mothers without antenatal glucose testing. |
There was an incremental risk of hypoglycemia with increasing 1-hour oral glucose tolerance test values, with hypoglycemia rates of 2.5%, 9.3%, 22.0%, and 50.0% that were associated with maternal 1-hour glucose values of <120, 120-179, 180-239, and ≥240 mg/dL, respectively (p<.05, for all comparisons). |
Laag |
|
Weissmann Brenner (2012) |
Design Retrospective analysis
Frequency glucosemonitoring Unclear
Glucose determination Unclear |
LGA (birthweight≥90th percentile) at or after 37 weeks of gestation.
LGA 90+: n=3900 LGA 95+: n=1802 LGA 99+: n=325 |
Not defined. |
LGA 90+: 4.23% LGA 95+: 9.16% LGA 99+: 9.23% |
Hypoglycemia was not defined.
Retrospective study
Frequency glucosemonitoring, method of glucose determination and definition hypoglycemia are unclear.
The rate of diabetes mellitus in the entire study population was 4.4% and increased significantly from 4% in the AGA pregnancies to 13.5% in the LGA ≥99th percentile group. |
Laag |
Evidence tabel uitgangsvraag incidentie hypoglycemie bij overige risicogroepen
|
Author |
Year |
Study design |
N (number of patients studied) |
Definition hypoglycemia |
Risk factor 1 (term) |
Risk factor 2 (weight) |
Risk factor 3 (motherly interventions/medication) |
Incidence hypoglycemia |
Level of evidence
|
||
|
Prematuriteit |
|
|
|
|
|
|
|
|
|
||
|
Hawdon |
1992 |
Retrospective cohort |
62 |
<2.6 mmol/L; mean glucose value 0-24hr: 2.5±0.3 |
preterm (25-36wk), median 31 weeks |
AGA >p10, median 1760 g |
none (IDM excluded) |
14.5% |
2b |
||
|
Harris |
2012 |
Retrospective cohort |
82 |
hypoglycemia as a blood glucose concentration |
late-preterm (35-37 weeks |
AGA |
none (IDM and GDM excluded) |
59.0% |
2b |
||
|
Dysmaturiteit |
|
|
|
|
|
|
|
|
|
||
|
Harris |
2012 |
Retrospective cohort |
71 |
hypoglycemia as a blood glucose concentration |
term (37-42 weeks) |
small (<10th percentile or <2500 g), |
none (IDM and GDM excluded) |
56.0% |
2b |
||
|
Croke |
2009 |
Retrospective cohort |
85 |
<2.6 mmol/L |
Term (37– 40+6wk) |
SGA <p10 (mean 2584 (SD 1047)) |
Unknown |
21.0% |
2b |
||
|
Mejri A |
2010 |
Retrospective cohort |
85 |
<2.6 mmol/L |
term (37-42wk) |
SGA (p5-10) |
6% |
22.0% |
2b |
||
|
102 |
<2.6 mmol/L |
term (37-42wk) |
SGA (<p5) |
4% |
28.0% |
||||||
|
Kinderen van moeders met diabetes |
|
|
|
|
|
|
|
||||
|
Harris |
2012 |
Retrospective cohort |
122 |
hypoglycemia as a blood glucose concentration |
term (37-42 weeks) |
AGA |
IDM |
49.0% |
2b |
||
|
Persson |
2012 |
Retrospective cohort |
1734 |
Hypoglycaemia was |
32-<43 weeks (44% preterm) 38 (37–39) wks |
LGA >p90 |
type 1 diabetes were identified based |
23.5% |
2b |
||
|
1783 |
32-<43 weeks (30% preterm), 38 (37–39)wks |
AGA p10-90 (3500 (3200–3789)) |
type 1 diabetes were identified based |
20.3% |
|||||||
|
1547 |
term (37-43 weeks): median: 39 (38-40) |
BW >90th percentile in relation to gestational age and seks: median 4400g (4202-4675) |
GDM (Women with a diagnosis of GDM were identified by ICD-10 code O24) |
6.4% |
|||||||
|
Kautzky-Willer |
2008 |
Prospective cohort |
672 |
<35 mg/dL |
mean 39.2 (0.1) |
mean 3366.4 (25) (9.8% >p90) |
GDM (also with insulin) |
9.1% |
1b |
||
|
794 |
mean 39.6 (0.1) |
mean 3371.5 (22.4) |
none |
2.5% |
|||||||
|
Cordero |
1998 |
Retrospective cohort |
530 |
<2.2 mmol/L |
Preterm - term |
SGA/AGA/LGA |
Diabetes gravidarum/IDM |
26.7% |
2b |
||
|
Florese-le Roux |
2012 |
Prospective cohort |
190 |
<2.5 mmol/L |
mean 39.1 (1.4) |
mean 3349 (495) g |
GDM (also with insulin) |
25.3% |
1b |
||
|
12 |
term (37-42wk) |
SGA (not defined) |
GDM (also with insulin) |
25.0% |
|||||||
|
30 |
term (37-42wk) |
LGA (not defined) |
GDM (also with insulin) |
46.7% |
|||||||
|
Hapo study group |
2008 |
Prospective cohort |
23227 |
clinical neonatal hypoglycemia |
mean 37.4 (1.7), 6.9% prematuur |
mean 3292 (529), 9.5% macrosoom |
unknown |
2.1% |
1b |
||
|
Onal |
2012 |
Retrospective cohort |
87 |
<46 mg/dL (2.6 mmol/ |
>36 weeks |
LGA >p90 |
gestational diabetes (pre-existing excluded) |
Hypoglycemia on 1st hour: 11/86 (12.8%), Hypoglycemia on 4th hour: 8/86 (9.3%) |
2b |
||
|
Agrawal |
2000 |
Case series |
21 |
<2.0 mmol/L |
term (37-42wk) |
not defined |
IDM/GDM, insulin use |
52.4% |
4 |
||
|
17 |
term (37-42wk) |
not defined |
GDM, no insulin use |
41.2% |
|||||||
|
Overig |
|
|
|
|
|
|
|
|
|
||
|
Hoseth E |
2000 |
Cross-sectional study |
223 |
<2.6 mmol/L |
term (37-42wk) |
AGA |
none (IDM excluded) |
14.0% |
3b |
||
|
Anderson S et al |
1993 |
Cross-sectional study |
Unknown |
<2.6 mmol/L |
Uncomplicated term newborns |
not defined |
na |
38.0% |
3b |
||
|
Hawdon |
1991 |
Retrospective cohort |
156 |
<2.6 mmol/L; mean glucose value at 1-12hr: 3.1±0.3 at 12-24hr: 3.7±0.2 |
term (37-42wk) |
AGA >p10 |
none (IDM excluded) |
12.0% |
2b |
||
Kwaliteit van bewijs
Systematic reviews
- Alkalay 2006 Level: 2a- (SR met meta-analyse van observationele studies)
- Nicholl 2003 Level: 2a- (SR (methodologisch matig) van cohort studies)
Originele studies uit search
- Hypo-EXIT Level: 1b (RCT)
- McKinlay 2015 Level: 1b (prospectief cohort met hoge follow up)
- Lucas 1988 Level: 1b (observationele cohort studie met >80% follow up)
- Kautzky-Willer 2008 Level: 1b (prospectief cohort met hoge follow up)
- Flores-le-Roux 2012 Level: 1b (prospectief cohort met hoge follow up)
- The HAPO study 2008 Level: 1b (prospectief cohort met hoge follow up)
- Mejjri 2010 Level: 2b (retrospectief cohort)
- Harris 2012 Level: 2b (retrospectief cohort)
- Persson 2013 Level: 2b (retrospectief cohort)
- Onal 2013 Level: 2b (retrospectief cohort)
- Brand 2004 Level: 2b (retrospectief cohort)
- Voeten 2008 Level: 2b (retrospectief cohort)
- Croke 2009 Level: 2b (retrospectief cohort)
- Hoseth 2003 Level: 3b (cross-sectional study, prone to selection bias).
- Anderson 1993 Level: 3b (cross-sectional study, prone to selection bias).
- Cordero 1998 Level: 2b (retrospectief cohort)
Individuele studies naar gerefereerd
- Guemes 2016 Level: 5 (niet-systematische review met expert opinion)
- Rozance 2016 Level: 5 (niet-systematische review met expert opinion)
- Hawdon 2012 Level: 5 (niet systematische review met expert opinion (tekstboek)
- Hawdon 2016 Level: 5 (niet-systematische review met expert opinion)
- Hawkes 2017 Level: 5 (niet systematische review met expert opinion) (tekstboek)
GRADE van het bewijs
1. Alle studies zijn observationeel en in geen enkele studie wordt er gecontroleerd voor confounding (bijvoorbeeld mate van dysmaturiteit).
2. Er werden grote verschillen in incidenten binnen subgroepen gevonden.
3. De definitie van risicofactoren voor hypoglycemie was verschillend tussen de studies (bijvoorbeeld definitie van diabetes).
4. De grootte van de studiepopulaties varieerde en was in veel studies klein.
5. Publicatiebias niet te bepalen.
Kwaliteit: Zeer laag.
GRADE tabel: Van bewijs naar aanbeveling
|
|
Beslissing |
Toelichting |
|
1. Kwaliteit van het bewijs Is de algehele kwaliteit van bewijs hoog? |
☐ Nee |
|
|
2. Balans tussen gewenste en ongewenste effecten |
|
|
|
In geval van een positieve aanbeveling: Overtreffen de gunstige effecten de ongunstige effecten aanzienlijk, en is de werkgroep hier zeker van? |
☐ Ja
☐ Nee |
Ja, screenen van prematuur geboren kinderen en kinderen van moeders met diabetes waarvoor medicamenteuze behandeling is in lijn met internationale en nationale protocollen. Ja, er is consensus over het screenen van SGA en LGA, maar discussie over de exacte afkapgrenzen van het geboortegewicht. Nee, bij kinderen van moeders met diabetes met dieet met een geboortegewicht p10 tot 90 is er onvoldoende evidence en gebrek aan consensus om deze kinderen te screenen. |
|
In geval van een negatieve aanbeveling: Overtreffen de ongunstige effecten de gunstige effecten aanzienlijk, en is de werkgroep hier zeker van? |
☐ Ja |
Ja, bij gezonde à terme AGA-pasgeborenen is er binnen de internationale en nationale protocollen consensus dat zij niet gescreend hoeven te worden. |
|
3. Patiëntenperspectief |
|
|
|
In het geval van een positieve aanbeveling: Hanteren vrijwel alle patiënten hetzelfde perspectief op de wenselijkheid van de conceptaanbeveling? |
☐ ja |
In de dagelijkse praktijk zijn de meeste ouders akkoord met het voorstel om te screenen voor hypoglycemie bij risicogroepen. |
|
4. Professioneel perspectief |
|
|
|
In het geval van een positieve aanbeveling: Hanteren vrijwel alle zorgverleners hetzelfde perspectief op de wenselijkheid van de conceptaanbeveling? |
☐ Ja, grotendeels |
In het geval van prematuriteit en maternaal insuline gebruik is er in de dagelijkse praktijk hoge mate van consensus. Er bestaat wel enige discussie over de definitie van SGA en LGA. De richtlijn zal om deze reden ook geëvalueerd worden. |
|
5. Middelenbeslag |
|
|
|
In het geval van een positieve aanbeveling: Zijn de netto-gunstige effecten de (extra) middelen waard? |
☐ Ja |
Het voorkomen van hersenschade door tijdige opsporing van hypoglycemie voorkomt kosten van kinderen met ontwikkelingsachterstand. |
|
6. Organisatie van zorg |
|
|
|
In geval van een positieve aanbeveling: Zijn voldoende condities van zorg-organisatorische of maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ Ja |
Op dit moment wordt al routinematig gescreend. Door de bestaande praktijkvariatie, zullen vrijwel alle ziekenhuizen hun protocol moeten aanpassen, waardoor het aantal kinderen en duur van screening kan veranderen, zowel in meer als minder screening. |
|
7. Maatschappelijk perspectief |
|
|
|
In geval van een positieve aanbeveling: Zijn voldoende condities van zorg-organisatorische of maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ Ja |
Zie punt 6. |
Indien meerdere factoren positief worden geëvalueerd (‘ja’) neemt de waarschijnlijkheid van een sterke aanbeveling toe.
Overzicht literatuur incidentie hypoglycemie bij LGA
|
Laag |
Van de 69 LGA-pasgeborenen (geboortegewicht >4000 gram) had 17% een hypoglycemie (bloedglucose <2,2 mmol/L twee uur na de geboorte).
Bronnen (Araz, 2006) |
|
Laag |
Glucosecontrole één, drie en vijf uur na geboorte (op indicatie langer)
Van de 75 à terme LGA-pasgeborenen (geboortegewicht >P90) had 80% een hypoglycemie (plasmaglucose <2,2 mmol/L één uur na geboorte en/of <2,5 mmol/L daarna).
Bronnen (Brand, 2005) |
|
Laag |
Bij gebruik van een andere definitie voor hypoglycemie
Van de 75 à terme LGA-pasgeborenen (geboortegewicht >P90) had 45% een hypoglycemie (plasmaglucose <2,2 mmol/L in de eerste 24 uur en/of <2,5 mmol >24 uur na geboorte).
Bronnen (Brand, 2005) |
|
Laag |
1% van de 148 à terme LGA-pasgeborenen (>P90) had een eerste glucose <1,8 mmol/L twee tot drie uur na geboorte en 14% <2,6 mmol/L.
17% had een bloedglucose <2,6 mmol/L (drie tot 24 uur na geboorte).
Bronnen (Croke, 2009) |
|
Laag |
Hypoglycemie: bloedglucose <1,9 mmol/L of plasmaglucose <2,2 mmol/L
2,4% (n=77) van de à terme LGA-pasgeborenen (geboortegewicht >4000 gram) had een bloedglucose <1,9 mmol/L.
Bronnen (Esafkoff, 2009) |
|
Laag |
13% (n=2966) van de à terme pasgeborenen opgenomen met een geboortegewicht >P90 en 19% (n=1903) van de opgenomen pasgeborenen met een geboortegewicht >P97,7 had een plasmaglucose <2,5 mmol/L op een willekeurig moment.
Bronnen (Groenendaal, 2006) |
|
Laag |
6,1% (25 van de 410) à terme LGA-pasgeborenen (>4000 gram) had een hypoglycemie (glucoseconcentratie <2,6 mmol/L, gemeten op drie, zes, 24 en 72 uur na geboorte):
Bronnen (Gyurkovits, 2011) |
|
Laag |
39% van de à terme LGA-pasgeborenen (>P90 of >4500 gram) zonder andere risicofactoren had een bloedglucose <2,6 mmol/L in de eerste 48 uur na de geboorte.
Bronnen (Harris, 2012) |
|
Laag |
6% van de à terme LGA-pasgeborenen (>P90 en >4000 gram) had een bloedglucose <2,2 mmol/L binnen 90 minuten na geboorte.
Bronnen (Jonas, 2014) |
|
Laag |
Glucose controle één, drie, zes, acht en 24 uur na geboorte
2,2% van de 1347 à terme LGA-pasgeborenen met (≥4000g) had een bloedglucose <2,3 mmol/L tijdens ziekenhuisopname.
Bronnen (Linder, 2014) |
|
Laag |
40,5% van de 42 pasgeborenen (zwangerschapsduur >35 weken) met een geboortegewicht >P90 of >4500 gram) had een bloedglucose <2,6 mmol/L in de eerst 48 uur na geboorte.
Bronnen (McKinlay, 2015) |
|
Laag |
Glucosecontrole één tot twee uur na geboorte en at random geselecteerde 5% ook nog vier uur na geboorte
12,3% van de 1647 pasgeborenen (zwangerschapsduur 30 tot 44 weken) met een geboortegewicht >P90 had een glucose <2,2 mmol/L en 3,4% voldeed aan de klinische definitie van hypoglycemie (zie evidence-tabel).
Bronnen (Metzger, 2010) |
|
Laag |
Glucosecontrole één en vier uur na geboorte
Van de 613 pasgeborenen (zwangerschapsduur ≥36 weken) met een geboortegewicht >P90 had 5,3% één uur en 8,8% vier uur na de geboorte een bloedglucose <2,6 mol/l.
Bronnen (Onal, 2012) |
|
Laag |
Glucose controles 30 tot 60 min na eerste voeding gevolgd door à vier tot zes uur
Van de 887 LGA-pasgeborenen (>P90) had 16% binnen 24 na geboorte een bloedglucose ≤1,7 mmol/L.
Bronnen (Schaefer-Graf, 2002) |
|
Laag |
Glucose controle schema en definitie hypoglycemie niet beschreven
Van de 3900 pasgeborenen met een geboortegewicht ≥P90 en 1802 pasgeborenen met een geboortegewicht van ≥P95 had respectievelijk 4,2% en 9,2% hypoglycemie.
Bronnen (Weissmann-Brenner, 2012) |
|
Algehele kwaliteit van bewijs* = zeer laag |
*De algehele kwaliteit van het bewijs wordt bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 28-11-2020
De richtlijn wordt één keer per vijf jaar gereviseerd. De geldigheid van de richtlijn komt eerder te vervallen als nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten. Zo mogelijk wordt de richtlijn, indien financiering beschikbaar is, aangevuld met extra modules.
Doel en doelgroep
Het doel van deze richtlijn is om handvatten te bieden voor de algemene kindergeneeskundige zorg voor de (bijna) à terme pasgeborenen. In deze richtlijn gaan de uitgangsvragen over het beleid rondom neonatale hypoglycemie, beleid na vacuümextractie en de indicaties voor een consult kinderarts. Het gaat hierbij om pasgeborenen die vanwege een medische indicatie in het ziekenhuis geboren of opgenomen worden en bij wie de (algemeen) kinderarts zorg levert of zou moeten leveren. Prematuren met een zwangerschapsduur <35 weken en pasgeborenen met een indicatie voor intensive care opname vallen niet onder deze richtlijn. Deze richtlijn bevat aanbevelingen voor de zorg voor pasgeborenen waarbij de focus ligt op de algemeen kinderarts. Ook andere zorgverleners binnen de integrale geboortezorg kunnen gebruik maken van de informatie uit deze richtlijn, zoals huisartsen, verloskundigen, verpleegkundigen, kraamverzorgenden en ouderverenigingen.
Samenstelling werkgroep
Voor de ontwikkeling van deze richtlijn is een richtlijnwerkgroep samengesteld. Deze werkgroep bestond uit gemandateerde vertegenwoordigers van de NVK, de Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) en de Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV). Het ouderperspectief in de werkgroep werd vertegenwoordigd door participatie van Stichting Kind en Ziekenhuis. De werkgroep werd aangevuld met een arts-onderzoeker met expertise op het gebied van neonatale hypoglycemie. De werkgroep werd bij het literatuuronderzoek ondersteund door een epidemioloog van het NVK-bureau. Een epidemioloog van PROVA was betrokken voor methodologisch en procedureel advies. De werkgroep werd secretarieel ondersteund vanuit het bureau van de NVK. De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget van de SKMS.
Werkgroep
- Mw. L.H. van der Meer-Kappelle, werkzaam in Reinier de Graaf Groep, namens NVK (voorzitter)
- Dr. R.F. Kornelisse, neonatoloog, werkzaam in Erasmus MC-Sophia, namens NVK
- Dr. R.H.T. van Beek, neonatoloog, werkzaam in Amphia Ziekenhuis, namens NVK
- Drs. C.S. Barbian, kinderarts, werkzaam in Ziekenhuis Rivierenland, namens NVK
- Dr. A.A.M.W. van Kempen, neonatoloog, werkzaam in OLVG Amsterdam, namens NVK
- Drs. N.R. van Veenendaal, arts-onderzoeker werkzaam in OLVG Amsterdam, namens NVK
- Drs. H.G. Stas, neonatoloog, werkzaam in Maasstad Ziekenhuis Rotterdam, namens NVK
- Dr. P.H Dijk, neonatoloog, werkzaam in UMCG, namens NVK
- D. Joseph, MSc, verpleegkundige, werkzaam voor Kind en Ziekenhuis
- L. Zondag, beleidsmedewerker, werkzaam als verloskundige, namens KNOV
- NVOG, commissie Kwaliteitsdocumenten
Meelezers
- Mw. Dr. C. de Boer, verpleegkundige neonatologie, werkzaam in Erasmus MC, namens V&VN
- Dr. R.M.J. Moonen, neonatoloog, werkzaam in Zuyderland Medisch Centrum Heerlen, namens NVK
- Drs. S. Mulder, hoofd afdeling neonatologie, werkzaam in Isala Zwolle, namens NVK
- Dr. J.E. Bunt, neonatoloog, werkzaam in ETZ Elisabeth, namens NVK
- Dr. F. Maingay, neonatoloog, werkzaam in Noordwest Ziekenhuisgroep Alkmaar, namens NVK
- Dr. F.A.B.A. Schuerman, neonatoloog, werkzaam in Isala Zwolle, namens NVK
- Dr. W.J.M. van Heel, neonatoloog, werkzaam in Haga Ziekenhuis, namens NVK
- Dr. H.B. Burggraaff, verloskundige huisarts, werkzaam in H.B. Burggraaff, namens NHG
Met ondersteuning van
- Mw. Drs. M. Tuut, zelfstandig epidemioloog PROVA
- Mw. Dr. L.M.A.J. Venmans, epidemioloog NVK
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of zij in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek en belangen door kennisvalorisatie. De ingevulde belangenverklaringen zijn beoordeeld door de projectleider. Hieruit is geen belemmering voor participatie in de werkgroep naar voren gekomen. De verklaringen liggen ter inzage bij de NVK.
Inbreng patiëntenperspectief
Het perspectief van patiënten en ouders is gewaarborgd doordat Stichting Kind en Ziekenhuis vertegenwoordigd was in de werkgroep. Zij hadden een belangrijke bijdrage aan de patiëntenversie van de richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De definitieve richtlijn is onder de verenigingen verspreid, en via de website van de NVK (https://www.nvk.nl/) en de Richtlijnendatabase elektronisch beschikbaar gesteld. Op wetenschappelijke bijeenkomsten van de betrokken wetenschappelijke verenigingen en regionale bijeenkomsten kunnen de aanbevelingen van de richtlijn worden gepresenteerd.
Het uitgebreide implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Knelpuntanalyse, verzamelen protocollen en vaststellen uitgangsvragen
Door de leden van de werkgroep werd een schriftelijke knelpuntenanalyse uitgevoerd om de huidige werkwijze ten aanzien van neonatale hypoglycemie, beleid na vacuümextractie en opname- en ontslagcriteria in kaart te brengen.
De inhoud van deze praktische en specifiek op de Nederlandse situatie gerichte richtlijn, is mede gebaseerd op internationale richtlijnen. De evidence was niet altijd even sterk. Daarnaast leende een deel van de uitgangsvragen zich niet voor een literatuursearch.
Daarom werden, naast literatuur, internationale en nationale richtlijnen, ook regionale en lokale protocollen omtrent neonatale hypoglycemie, vacuümextracties en indicatie voor een consult kinderarts verzameld en gebruikt. Er werden 34 protocollen toegestuurd: 4 afkomstig uit NICU’s, 9 uit post-IC/HC-centra en 21 uit algemene ziekenhuizen. In december 2016 telde Nederland 79 ziekenhuisorganisaties, inclusief 10 NICU’S. Het aantal ingestuurde protocollen werd door de werkgroep als representatief voor de Nederlandse ziekenhuizen beschouwd.
Tijdens werkgroepvergaderingen werden de definitieve knelpunten en uitgangsvragen vastgesteld. De Nederlandse kinderarts werkt zo veel mogelijk evidence-based. Wanneer er een grote praktijkvariatie is, komt dit doordat evidence ontbreekt in de literatuur. Aangezien deze richtlijn als doel heeft de praktijkvariatie te beperken, is per vraag bekeken of een evidence-based search zinvol was om antwoord te geven op de uitgangsvraag of dat de uitgangsvraag door middel van consensus, met behulp van bestaande literatuur, (inter)nationale richtlijnen en lokale protocollen, binnen de werkgroep zou worden uitgewerkt.
Zoeken (inter)nationale richtlijnen
In eerste instantie werd gezocht naar evidence-based richtlijnen. Hierbij werd gebruik gemaakt van de volgende databases: Medline, SUMSEARCH2, Clinical evidence van BMJ, Scottish Intercollegiate Guidelines Network en de TRIP DATABASE. Inclusiecriteria waren als volgt:
- het betreft een evidence-based richtlijn of practical guideline;
- de populatie betreft pasgeborenen;
- de richtlijn moet gaan over postnatale zorg voor pasgeborenen;
- publicatie tot juli 2015 (datum van de search).
De gevonden richtlijnen werden op kwaliteit beoordeeld met behulp van AGREE II (https://www.agreetrust.org/). De resultaten van deze search en de kwaliteit van de gevonden richtlijnen is beschreven bij de verschillende modules.
Zoeken artikelen
Bij de vragen waarvoor een search werd gedaan, wordt beschreven welke databases en zoektermen zijn gebruikt en welke zoekperiode is aangehouden (zie de zoekverantwoording in de verschillende modules). Er werd gezocht naar de hoogste mate van bewijs: systematische reviews en gerandomiseerd en gecontroleerd onderzoek. Zoals te verwachten bij veel praktijkvariatie, was het bewijsniveau van de literatuur en richtlijnen over het algemeen laag.
Beoordeling artikelen
De uitgangsvragen waarvoor een search werd gedaan, werden met behulp van de GRADE-methodiek (Grading Recommendations Assessment, Development and Evaluation) uitgewerkt. De literatuur werd beoordeeld middels https://www.cebm.net/2009/06/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/. Aan het begin van het richtlijntraject werden hiertoe uitkomstmaten gedefinieerd. Resultaten werden per uitkomstmaat samengevat, waarbij tevens de overall kwaliteit van de onderliggende bewijslast (evidence) werd aangegeven. Bij de beoordeling werd gebruik gemaakt van GRADEpro (https://gradepro.org/). Met behulp van dit instrument werd bij elke uitgangsvraag een tabel met bevindingen (summary of findings) en een tabel met de beoordeling van het bewijs (GRADE evidence profile) gemaakt.
GRADE kent vier niveaus: high, moderate, low en very low. Per uitkomst werd een GRADE-niveau toegekend. Wanneer een uitkomst als high geclassificeerd werd, wil dit zeggen dat het onwaarschijnlijk is dat toekomstig onderzoek de schatting van de uitkomst zal veranderen. Met andere woorden: er is veel vertrouwen in de juistheid van de schatting van de uitkomst. Een very low-classificatie wil zeggen dat er veel onzekerheid is over de juistheid van de uitkomst.
Het onderzoeksdesign is een belangrijke factor binnen GRADE. Gerandomiseerde en gecontroleerde studies krijgen daarom in beginsel de kwalificatie high. Er zijn vijf factoren die kunnen zorgen voor een lagere kwalificatie:
- beperkingen in de onderzoeksopzet;
- inconsistentie: onverklaarde heterogeniteit van de resultaten;
- indirectheid: de populatie, interventie, controle en uitkomst (PICO) waarop de evidence gebaseerd is, wijken op een of meer punten af van de PICO die men wil onderzoeken. Ook het gebruik van surrogaatmarkers valt onder indirectheid;
- imprecisie: wijde betrouwbaarheidsintervallen rond een geschat effect duiden op onzekerheid in de grootte van het effect. Er is sprake van imprecisie bij een te kleine steekproef (lage statistische power), weinig events en een betrouwbaarheidsinterval dat wel statistisch significant is, maar zowel in het gebied van klinische relevantie als in het gebied van een verwaarloosbaar effect ligt;
- publicatiebias.
Indien de resultaten niet gepoold konden worden, werd volstaan met een globale inschatting van de kwaliteit van de onderliggende bewijslast. Voor een uitgebreidere beschrijving van GRADE verwijst de werkgroep naar http://www.gradeworkinggroup.org.
Van bewijs naar aanbeveling
Nadat de evidence was samengevat en gegradeerd, werden door de werkgroep aanbevelingen geformuleerd. Naast de evidence werden hierbij overwegingen uit de praktijk meegenomen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is rekening gehouden met de organisatie van zorg; alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur), hoewel deze in de algemeen kindergeneeskundige praktijken nog al verschillend zijn. Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Commentaar- en autorisatiefase
Na vaststelling van de conceptrichtlijn door de werkgroep werd de richtlijn naar de meelezers gestuurd ter becommentariëring. Na verwerking van alle suggesties, startte de commentaarfase en werd de richtlijn voorgelegd aan de volgende partijen: NVK, Stichting Kind en Ziekenhuis, NVOG, KNOV, V&VN, IGZ, VGVK, NHG.
In de definitieve richtlijn, die ter autorisatie is aangeboden aan de NVK, NVOG, KNOV en Stichting Kind & Ziekenhuis op 28 november, is het commentaar waar mogelijk en relevant verwerkt door de werkgroep.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op evidence gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien deze aanbevelingen hoofdzakelijk gebaseerd zijn op de gemiddelde patiënt kunnen zorgverleners op basis van hun professionele autonomie zo nodig afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
