Observatieperiode na vacuümextractie (VE) bij neonatale hypoglycemie
Uitgangsvraag
Gedurende welke periode na een vacuümextractie (VE) is een observatie van pasgeborenen geïndiceerd en waar dient op gelet te worden?
Aanbeveling
De werkgroep adviseert om alle pasgeborenen na een VE ten minste zes uur te observeren op kliniek (geprikkeld zijn, pijn bij verzorging, huilen, spugen, kreunen, voedingsproblemen, kleur, activiteit/gedrag, ademhaling en hartfrequentie). Hierbij moet het hoofd regelmatig worden geïnspecteerd op locatie, aspect en een eventuele toename van de zwelling, om een SGH tijdig te onderkennen. Bij bijzonderheden tijdens deze observatieperiode moet de observatieperiode verlengd worden naar tenminste 12 uur. Bij tekenen van shock moet direct een arts gewaarschuwd worden en met behandeling gestart worden.
De werkgroep adviseert om bij de observatie van de pasgeborene na een VE de toename van de schedelomtrek niet als indicator voor een SGH te gebruiken, omdat deze het bloedverlies kan onderschatten en de toename van de schedelomtrek bij een SGH pas laat op kan treden.
Overwegingen
Er werden geen studies gevonden die antwoord gaven op onze uitgangsvraag.
De belangrijkste reden om een kind na een VE, ook na een goede start, te observeren is om de weinig frequent voorkomende complicatie SGH tijdig te onderkennen. Dit is belangrijk gezien de hoge mortaliteit, welke aanzienlijk daalt bij snelle onderkenning en behandeling.
Hoe vaak een SGH in Nederland voorkomt is niet bekend, omdat een SGH niet apart als complicatie in de groep van geboortetrauma in de perinatale registratie Nederland (Perined) werd geregistreerd. In de nieuwe versie (oktober 2018) van Perined kan een SGH wel als apart item worden geregistreerd.
De tijdsduur waarop intracraniële bloeding de eerste verschijnselen geven, werd bij de studies naar incidentie van complicaties na een VE niet vermeld.
De klinische tekenen van een bloeding (zowel intra- als extracranieel), zoals tachycardie, tachypnoe, bleekheid en sufheid zijn belangrijk. Indien deze verschijnselen optreden moet er direct een arts worden gewaarschuwd.
In de literatuur en leerboeken worden verschillende grenzen voor de normaal waarden van de fysiologische parameters van de à terme pasgeborenen (zeker in de eerste uren postpartum) op gegeven (Mortensen, 2017; Roland, 2010).
Er zijn verschillende neonatal early warning scoring-systemen. Mortensen beschrijft in zijn review vier scoringssystemen voor de à terme pasgeborene. Deze scoringssystemen zijn niet gevalideerd voor de korte observatie in de eerste uren postpartum en ook niet gevalideerd voor onze doelgroep (observatie na vacuüm extractie). Zij bekeken de parameters (retro- en prospectief) bij pasgeborenen met andere risicofactoren, zoals verhoogd risico op infectie of na een matige start. (Roland, 2010; British Association of Perinatal Medicine, 2015). Scoringssystemen zijn een goede manier om observaties proberen te objectiveren en te gebruiken om een trend te vervolgen. De sensitiviteit en specificiteit van de absolute score op een opname op de High of Intensive Care verschilden per scoringssysteem. Daarnaast is er discussie welke sensitiviteit en specificiteit acceptabel is: je wilt geen kind met een sepsis of shock missen, maar je wilt ook niet te veel onnodige opnames.
De literatuur beschrijft dat de tijdsduur waarbinnen de eerste verschijnselen van een SGH optreden varieert van één tot zes uur met een uitloop naar 33 uur. Dit is mede afhankelijk van het wel of niet actief monitoren van de kliniek en de zwelling op het hoofd.
Wanneer er tijdens de (korte) observatieperiode verschijnselen optreden, moet er snel gestart kunnen worden met behandeling (correctie hypovolemie, anemie en stollingsproblemen). Daarnaast kan, met name de eerste uren, een caput succedaneum, een cefaal hematoom en een SGH verraderlijk veel op elkaar lijken (zelfs voor de geoefende zorgverlener).
Een VE met of zonder zichtbare bloeding, is een risicofactor voor hyperbilirubinemie. Dit is reden voor extra alertheid en laagdrempelige controle van de bilirubine, maar geen reden om het kind zonder tekenen van een SGH hiervoor opgenomen te houden.
De invloed van mogelijke riscofactoren, zoals langdurige uitdrijvingsfase of het aantal tracties, de kracht waarmee getrokken moet worden en het aantal keren losschieten van de cup, is in de literatuur niet eenduidig. Daarnaast is het begrip “moeizame VE” subjectief.
Het meten van de schedelomtrek wordt niet geadviseerd, omdat een geringe toename van de schedelomtrek soms pas optreedt bij aanzienlijk bloedverlies. Met andere woorden: het meten van de schedelomtrek heeft een slechte negatief voorspellende waarde.
Een observatielijst met notitie van vitale parameters en gegevens over de zwelling op het hoofd (zie aanverwante producten) kan behulpzaam zijn om achteruitgang of veranderingen op te merken. Hieraan kan nog een pijnscore (bijvoorbeeld NIPS) en/of een van de neonatal early warning-scores worden toegevoegd. Wie van de zorgverleners wat doet en waar geobserveerd wordt, moet binnen het VSV worden afgesproken zolang een adequate observatie en een snelle aanvang van de behandeling, indien er bijzonderheden zijn, gegarandeerd zijn.
Indien zich tijdens deze observatieperiode bijzonderheden voordoen, moet de observatie geïntensiveerd en uitgebreid worden naar tenminste 12 uur.
Zorgvuldige overdracht van zorg met (eventuele) aandachtspunten is gewenst bij overdracht van zorgverlener, die de verantwoordelijkheid heeft voor de observatie van de pasgeborene. Ouders kunnen hierin mee genomen worden.
Onderbouwing
Achtergrond
Een VE wordt verricht om de vaginale bevalling te bespoedigen. Een VE kan op maternale en/of bij foetale indicatie worden verricht. In 2016 werd 7,7% van de kinderen in Nederland geboren middels een VE (Perined, 2018).
Een VE verhoogt de kans op neonatale morbiditeit in vergelijking met een ongecompliceerde vaginale partus. Hierbij moet worden gedacht aan bloedingen (cefaal hematoom, subgaleale en intracraniële bloedingen), fracturen (schedel-, clavicula- en overige fracturen), een Erbse parese en hyperbilirubinemie (Simonson, 2007; Doumouchtsis, 2008; Baskett, 2008; Ghidini, 2017).
Met deze module wil de werkgroep antwoord geven op de vraag of observeren (en zo ja, hoe lang) na een VE zinvol is om complicaties op tijd te onderkennen. Aangezien de verhoogde kans op een hyperbilirubinemie na een VE, ook zonder zichtbare bloeding, al in de NVK-richtlijn Hyperbilirubinemie wordt benoemd, wordt dit als bekend verondersteld en in deze module niet (nogmaals uitgebreid) behandeld.
Daarnaast wordt in de module ‘Standaard (oplaad) paracetamol na vacuümextractie (VE)’ antwoord gegeven op de vraag of er een indicatie is voor paracetamol na een VE.
Conclusies / Summary of Findings
|
Laag |
De incidentie van een subgaleale bloeding (SGH) en een intracraniële bloeding is verhoogd na een vacuümextractie VE ten opzichte van de incidentie na een spontane vaginale baring of sectio caesarea (SC) (Simonson 2007, Dumouchtsis 2006 en 2008, Boo 2005, Ng 1995). |
|
Laag |
Risicofactoren, zoals karakteristieken van de zwangere (nullipara versus multipara, obesitas, leeftijd), van het kind (ligging, geboortegewicht, mate van indaling) en VE (indicatie, aantal tracties, losschieten cup, plaatsing van de cup, mislukken VE, duur VE), worden wisselend als onafhankelijke risicofactor beschreven en kunnen daarom (nog) niet discrimineren welke pasgeborene met een goede start wel of geen observatie nodig heeft na een VE.
Onderstaande factoren worden wisselend als onafhankelijke risicofactor voor neonatale complicaties na een VE in de literatuur genoemd.
1 Indicatie van de kunstverlossing (foetale nood of maternale factoren zoals niet vorderende uitdrijving). 2 Ervaring van de obstetricus (Doumouchtsis, 2008). 3 Aantal tracties (Ekeus, 2018 en Simonson, 2007 wel; Ghidini 2017 niet). 4 (aantal keren) Losschieten cup (Ekeus, 2018; Krispin, 2017; Simonson, 2007 wel; Gidini, 2017 niet). 5 Duur tracties/totale duur VE (Ghidini, 2017 wel; Ekeus, 2018 niet). 4 De kracht waarmee getrokken wordt. 5 Soort cup (metalen of soft) (Ismail, 2008 wel; Boo, 2005 niet). 6 Plaatsing van de cup op het hoofd (over de pijlnaad (sutura sagittalis) of <3 cm afstand tot voorste fontanel) (Boo, 2005). 7 Mislukte VE (Ahlberg, 2016; Simonson, 2007; Boo, 2005). 8 Mate van indaling van het kind (Ducarme, 2015 niet significant). 9 Geboortegewicht (Ghidini, 2017; Ekeus, 2014). 10 Pariteit van de moeder (Cargill, 2004; Boo, 2005; Uchil, 2003, Ghidini 2017, Simonson 2007). |
|
Laag |
Een SGH presenteert zich als een progressieve (in tegenstelling tot een caput succedaneum) diffuse weke of fluctuerende massa welke (in tegenstelling tot een cefaal haematoom) over de schedelnaden heen reikt en daardoor mobiel is. Het bloed verplaatst zich of zakt uit met de positie van het hoofd. |
|
Laag |
Een SGH vereist een snelle behandeling om overlijden en schade door hypovolemie, anemie en stollingsstoornissen te voorkomen (Boo, 2005; Chadwick, 1996; Plauche, 1980; Colditz, 2015).
Actieve controle op SGH bij de pasgeborene verlaagd de mortaliteit (Boo, 2015). |
|
Laag |
Tijd tot het stellen van de diagnose SGH is één tot zes uur postpartum (Boo, 2005; Amar, 2003). |
|
Laag |
Na een VE wordt een goede observatie van kliniek (kleur, activiteit/gedrag, Hartactie, ademhaling) met aandacht voor de zwelling (zowel aspect, locatie als toename in grootte) op het hoofd, ook na een SC na een mislukte VE, geadviseerd (Boo, 2015; RANZCOG, 2015; Ahlberg, 2016). |
|
Laag |
De geadviseerde observatieperiode is in de geraadpleegde richtlijnen en literatuur wisselend (één uur RANZCOG (2015) zonder risicofactoren, vier uur Colditz (2015), tien uur Wu-Smit (2006) en 12 uur RANZCOG (2015) met risicofactoren.
In de prospectieve studie van Boo (2005) werden kinderen direct postpartum, één, zes en 24 uur postpartum onderzocht, omdat de SGH zich geleidelijk gedurende de eerste uren postpartum kan uitbreiden alvorens opgemerkt te worden. De mortaliteit was in deze studie met 2,8%, in vergelijking met de mortaliteit van 5 tot 25% in andere studies, sterk gereduceerd. |
Samenvatting literatuur
Ten aanzien van het beleid voor de pasgeborene na een VE werden geen artikelen gevonden die antwoord gaven op de uitgangsvraag.
Het bewijsniveau van de gevonden artikelen, welke slechts deels antwoord gaven op de uitgangsvraag, was in het algemeen van lage kwaliteit.
Complicaties na een VE variëren van excoriatie van de hoofdhuid tot een intracraniële of subgaleale bloeding (SGH). Ze worden ook wel ingedeeld in minor complicaties (beschadiging van de hoofdhuid, caput succedaneum, cefaal hematoom) en major complicaties (SGH, intracraniële bloedingen, schedelfracturen) (Baskett 2008, Chitine 2017), of in extra- (cefaal hematoom en SGH) en intracraniële bloedingen (Doumouchtsis 2008).
In de literatuur wordt een aantal factoren, welke een rol spelen bij het optreden van complicaties, na een VE genoemd:
- De indicatie (foetale nood of maternale factoren, zoals niet vorderende uitdrijving), de ervaring van de obstetricus, het aantal tracties en de kracht waarmee getrokken wordt, het soort cup, (afwijkende) ligging van het kind, plaatsing van de cup op het hoofd (over de pijlnaad (sutura sagittalis)) of <3 cm afstand tot voorste fontanel), mate van indaling van het kind, geboortegewicht en pariteit van de moeder (Cargill, 2004; Boo, 2005; Uchil, 2003, Ghidini 2017; RANZOG 2015, Ducarme 2015). De literatuur is niet eenduidig over welke van bovenstaande risicofactoren een onafhankelijke risicofactor is voor intra- en extracraniële bloeding bij de pasgeborenen (Ekeus 2018; Ghidini 2017; Krispin 2017; Ducarme 2015, Simonson 2007).
- Deze complicaties kunnen ook optreden na een spontane partus of na sectio caesarea door de mechanische krachten op het hoofd gedurende de partus en de moulage van de schedel (Fareeduddin, 2008; Plauche, 1980; Ahuja, 1969).
- De kans op een intra- of extracraniële bloeding na een VE is verhoogd ten opzichte van de kans hierop na een spontane vaginale baring. De kans hierop verschilt aanzienlijk tussen verschillende publicaties.
Tabel 1 Gevonden incidentie in de literatuur
|
|
Cefaal hematoom |
ICH |
SGH |
|
Spontane partus |
1 tot 2% |
0,01 tot 0,06% |
0,04 tot 0,06% |
|
VE |
5,2 tot 14,7% |
0 tot 0,9% |
0 tot 21% |
ICH intracraniële bloeding. SGH subgaleale bloeding
De gevonden incidentie van een intracraniële bloeding is mede afhankelijk of er routinematige of op indicatie beeldvorming is gedaan (O’Mahony, 2010; Ekeus, 2014; Simonson, 2007; Whitby 2004).
Klinische verschijnselen bij een intracraniële bloeding zijn mede afhankelijk van de locatie en de hoeveelheid bloedverlies, maar zijn niet exclusief voor een bepaald type bloeding of de lokalisatie ervan. Verschijnselen van shock of anemie (bijvoorbeeld bleekheid en tachycardie), convulsies, apnoe’s, onregelmatige ademhaling, sufheid, prikkelbaarheid en kreunen, kunnen wijzen op zowel een intra – als een extracraniële bloeding. Anisocorie met volle fontanel kan op een intracraniële bloeding duiden (Ou-Yang, 2010).
Een SGH ontstaat wanneer er een bloeding optreedt tussen het periost en de galea aponeurotica (een dunne peesplaat die de M Occipitalis met de M Frontalis verbindt) ten gevolge van een traumatische verscheuring van de onder de galea aponeurotica gelegen brugvenen (Vv. Emissariae) (zie figuur 1). Deze brugvenen vormen de verbinding tussen direct subcutaan gelokaliseerde schedelvenen en de durale veneuze sinus. De subgaleale ruimte strekt zich uit van de nekbasis tot de orbita en naar lateraal tot het jukbeen. De berekening die vaak geciteerd wordt, werd oorspronkelijk gepubliceerd door Eliachare in 1963 (Boo, 2005; Plauche, 1980; Eliachar, 1963; Uchil 2003). Hij berekende dat wanneer de subgaleale ruimte slechts 1 cm in dikte is toegenomen, deze al circa 260 ml bloed kan bevatten.
Een SGH presenteert zich als een progressieve (in tegenstelling tot een caput succedaneum) diffuse weke of fluctuerende massa welke, in tegenstelling tot een cefaal haematoom, over de schedelnaden heen reikt en daardoor mobiel is. Het bloed verplaatst zich of zakt uit met de positie van het hoofd. Een SGH vereist een snelle behandeling om overlijden en schade door hypovolemie, anemie en stollingsstoornissen te voorkomen (Boo, 2005; Chadwick, 1996; Plauche, 1980; Colditz, 2015).
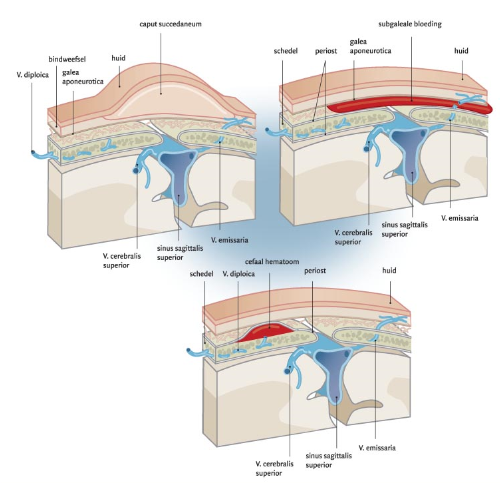
Figuur 1 Anatomische begrenzingen caput succedaneum, cefaal hematoom en subgaleale bloeding. Fuijkschot et al NTVG (2008;152:96 tot 100)
Tabel 2 Kenmerken en ernst van diverse extracerebrale vochtcollecties
|
|
Caput succedaneum |
Cefaal hematoom |
Subgaleale bloeding |
|
Locatie |
Plek van cup. |
Meestal os pariëtale; onder het periost. |
Onder de galea aponeurotica, kan zich uitstrekken tot orbitae en nek. |
|
Aspect |
Cupranden soms vaag gemarkeerd, pitting oedeem. |
Scherp begrensd door schedelnaden; voelt aanvankelijk vast aan, na 48 uur verwekend, kan calcificeren. |
Geen duidelijke begrenzing op het hoofd; kan in eerste instantie ook stevig of als oedeem aanvoelen maar later week en/of fluctuerend. Zakt uit afhankelijk van ligging van het kind. |
|
Tijdstip |
Maximale grootte bij geboorte, afname in grootte en stevigheid binnen 12 tot 18 uren postpartum en volledig herstel in dagen. |
Neemt toe in grootte eerste dag postpartum; herstel binnen twee tot drie weken (soms langer door verkalkingen). |
Progressief na geboorte, herstel binnen twee tot drie weken. |
|
Bloedvolume |
Minimaal. |
Zelden groot.
|
Varieert van 80 tot 260 ml. Cave anemie, hypovolaemie, stollingsproblemen. |
|
Ernst |
Nauwelijks ernstig. |
Tot matig ernstig. |
Tot zeer ernstig. |
De mortaliteit bij een SGH na een VE varieert van 2,8 tot 25% en is onder andere afhankelijk van hoe snel de diagnose gesteld wordt en de behandeling gestart wordt (correctie shock of hypovolaemie, anemie en stollingsproblemen). Een actieve controle op een SGH kan de mortaliteit aanzienlijk verlagen (Boo, 2005; Chadwick, 1996; Plauche, 1980; Colditz, 2015).
Een SGH kan een eerste uiting zijn van een stollingsprobleem (Plauche, 1980; Radovanovic, 2016; Talar, 2015; Wetzel, 2012; Chia, 2008).
De kans op een hyperbilirubinaemie is na een VE verhoogd waarbij een (zichtbare) bloeding niet aanwezig hoeft te zijn (Norman, 2015; NVK, 2008).
Wanneer treden klinische verschijnselen van een SGH op?
Het tijdsinterval tussen partus en kliniek van een SGH werd in twee studies en twee reviews beschreven (Boo, 2005; Colditz, 2015; Chang, 2007 en Uchill, 2013).
In de prospectieve studie van Boo werd de diagnose SGH gesteld na een mediaan van één uur (IQR 0). In de review van Colditz (2015) wordt een tijdsduur van één tot zes uur postpartum voor het stellen van de diagnose SGH genoemd. Dit is gebaseerd op het eerder genoemde artikel van Boo (2005) en een artikel van Amar (2003) waarin twee casussen beschreven worden.
In de retrospectieve studie van Chang uit 2007 naar SGH bij 42 patiënten was de mediane tijd tot de diagnose 7,8 uur postpartum (range 0 tot 33 uur). In de review van Uchil uit 2003 (53 referenties) wordt net als in de review van Plauche (1980) (zonder literatuur referenties) gesteld dat de tekenen van een subgaleale bloeding zich direct postpartum, binnen enkele uren, maar ook in de loop van enkele dagen na de geboorte kunnen ontwikkelen.
Duur observatie na een vacuümextractie
De richtlijn subgaleale bloeding van de RANZCOG (2015) geeft als aanbeveling dat de manier van observatie van de pasgeborene met een verhoogde kans op SGH, gebaseerd moet zijn op de risicofactoren op een SGH, de klinische omstandigheden en klinische verschijnselen bij de pasgeborene.
Hun advies luidt dat na een VE zonder extra risicofactoren het kind direct postpartum en na een uur moet worden beoordeeld op kleur, activiteit of gedrag, hartfrequentie en ademhalingsfrequentie. Tevens moet het hoofd gedurende het eerste uur zonder muts worden geobserveerd.
Bij extra risicofactoren, zoals moeizame VE (duur van de VE >20 minuten en/of meer >3 tracties en/of >2 cup plaatsingen) of een Apgar-score <7 na 5 minuten, of op het verzoek van de obstetricus (gevoelsmatig een moeilijke bevalling of wanneer de cup niet in de mediaan lijn geplaatst was), of wanneer er bij de observatie van de pasgeborene bijzonderheden worden waargenomen (tachycardie, tachypnoe, bleek zien, kreunen, sufheid of juist geprikkeld zijn, problemen met voeding), adviseert de RANZCOG dat de observatie moet worden uitgebreid met laboratoriumonderzoek (navelstreng pH, lactaat, Hb/Ht en trombocyten) en met het verlenging van de observatieperiode gedurende tenminste de eerste 12 uur met inspectie van de schedel op één, twee, vier, zes en acht uur postpartum. Het observeren middels monitor kan overwogen worden.
Colditz (review 2015) adviseert na een kunstverlossing, indien het kind een goede start en navelstreng pH had, het kind na één en vier uur postpartum nauwkeurig te onderzoeken (inclusief inspectie van het hoofd). Indien er geen aanwijzingen zijn voor een SGH is er geen extra zorg nodig.
In de prospectieve studie van Boo (2005) werden kinderen direct postpartum, één, zes en 24 uur postpartum onderzocht omdat de SGH zich geleidelijk gedurende de eerste uren postpartum kan uitbreiden alvorens opgemerkt te worden. De mediane leeftijd voor het stellen van de diagnose was 1 uur postpartum ([IQR] =0).
Hun advies luidt om pasgeborenen geboren na een VE structureel te beoordelen gedurende de eerste uren postpartum. Daarnaast noemden zij vijf onafhankelijke risicofactoren voor SGH na VE: nullipariteit (adjusted OR 4,0; 95% CI: 1,6 tot 10,0), Apgar ≤7 na vijf minuten (OR 5,0; 95% CI:1,7 tot 15,2), afdruk vacuümcup op de sagittaal naad (OR 4,4; 95% CI: 1,9 tot 10,2), rand van de vacuüm cup <3 cm bij de voorste fontanel (OR 6,0; 95%CI: 1,7 tot 21,0) en een mislukt VE (OR 16,4; 95%CI: 2,0 tot 135,6).
Dat een mislukte VE een extra risicofactor was voor SGH kwam ook uit de studie van Ahlberg (2016), maar kwam niet uit de studie van Ghinidi (2017).
De richtlijn van de RANZCOG (2015) schrijft dat herhaalde meting van de schedelomtrek (SO) nuttig zou kunnen zijn, ondanks dat grote hoeveelheid bloed slechts tot een geringe toename van de SO kan leiden (38ml/cm). Anderen halen dezelfde in het Frans gepubliceerde berekening van Eliachar uit 1963 aan, waarbij één cm toename van de schedelomtrek zowel bij 38 ml als bij 260 ml bloedverlies kan worden gezien (Chang, 2007; Plauche 1980; Uchil 2003).
Amar beschrijft twee casussen waarbij een van de casus in twee dagen tijd een toename van de schedelomtrek heeft van vijf cm. Hij haalt een andere referentie aan waarbij de hoeveelheid bloedverlies is berekend van ongeveer 40 ml bloed per cm toename van de SO (Robinson 1968).
Een voordeel van het meten van de SO is het regelmatig bewust zien van het hoofd (zonder muts).Een nadeel kan zijn dat een slechts geringe toename van de SO, een grote hoeveelheid bloed in de subgaleale ruimte niet uitsluit.
Enkele Nederlandse publicaties vermelden iets over het neonataal beloop en beleid na een VE.
In 2008 schreef Fuijkschot naar aanleiding van een casus van een SGH, als aanbeveling dat na een VE de pasgeborenen enkele uren grondig geobserveerd moet worden om mortaliteit en morbiditeit te reduceren.
De richtlijn Vaginale kunstverlossing van de NVOG vermeldt niets over het beleid na VE.
Smit-Wu hield in 2000 een enquête onder Nederlandse kinderartsen waaruit bleek dat 20 ziekenhuizen een schriftelijk protocol over het beleid na kunstverlossing hadden en dat in 66% van de ziekenhuizen het kind eenmalig door de kinderarts onderzocht werd, meestal tijdens een reguliere visite.
Smit-Wu publiceerde in 2006 de resultaten van een prospectief onderzoek. Deze studie is van zeer lage kwaliteit en kwam niet uit de literatuursearch. Ondanks dat deze studie een klein aantal patiënten beschrijft (n=79), er veel uitvallers waren (96 van de 175 in verband met niet beschikbaar zijn van schedelechografie) en geen controlegroep had, vermeldt de werkgroep deze studie hier, omdat het over de Nederlandse situatie gaat, een prospectieve studie betrof die naar intracraniële bloedingen keek en een uitspraak doet over observatie van de pasgeborene. Van de 79 geïncludeerde pasgeborenen geboren per VE had één pasgeborene een intracraniële bloeding. Deze pasgeborene had binnen één uur postpartum de eerste klinische verschijnselen. 14% van de geïncludeerde kinderen in het onderzoek had voedingsproblemen, met de eerste verschijnselen binnen zeven uur postpartum. 19 kinderen scoorde op de Neonatal Infant Pain Scale (NIPS) >3 (zie ook de module ‘Standaard (oplaad) paracetamol na vacuümextractie (VE)’) met de eerste verschijnselen binnen 10 uur postpartum. Eén kind kreeg fototherapie in verband met hyperbilirubinemie. Op basis van deze klinische verschijnselen na een VE, gaven zij het advies om de pasgeborene na een VE de eerste tien uur te observeren (Smit-Wu, 2006).
Plaatselijke protocollen
Wij ontvingen na een oproep aan alle vakgroepen kindergeneeskunde in Nederland 34 reacties. Slechts 11 van deze 34 vakgroepen kindergeneeskunde hadden een protocol over beleid na VE (twee NICU’s, drie post IC-HC centra en zes algemene ziekenhuizen).
De observatieduur van pasgeborenen werd in slechts vijf protocollen genoemd en varieerde van vier tot acht uur postpartum, acht uur postpartum, 12 uur postpartum of de vermelding observatieduur in overleg met kinderarts. Pijnstilling werd in alle 11 de protocollen als item benoemd (zie de module ‘Standaard (oplaad) paracetamol na vacuümextractie (VE)’).
Zoeken en selecteren
Deze module kwam tot stand op basis van consensus in de werkgroep met behulp van een literatuur search, nationale en internationale richtlijnen en lokale protocollen van Nederlandse ziekenhuizen (zie ook Algemene inleiding).
Er werd een volledige evidence-based search gedaan, welke bij het verwerken van het commentaar in de commentaarronde werd uitgebreid tot en met september 2018.
Daarnaast werd naar nationale en internationale richtlijnen gezocht (zie ook Algemene inleiding). De gevonden richtlijnen over kunstverlossingen vermeldden (net als de Cochrane reviews) niets over de observatie of zorg voor de pasgeborene (American College of Obstetricians and Gynecologists (ACOG) 2015; French College of Obstetricians and Gynecologists of Collège National des Gynécologues et Obstétriciens Français (CNGOF) Vayssiere, 2011; Society of Obstetricians and Gynaecologists of Canada (SOGC) Cargill, 2004; Royal College of Obstetricians and Gynaecologists (RCOG), Macleod, 2008; Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG), 2005) en waren op één na >5 jaar oud.
Via de literatuursearch werd een consensus-based Australische-Nieuw-Zeelandse richtlijn over preventie, detectie en behandeling van subgaleale bloeding (SGH) bij pasgeborenen gevonden (The Royal Australian and New Zealand College of Obstetricians and Gynaecologists (RANZCOG), 2015).
Aangezien de SGH een zeldzame, maar potentieel levensbedreigende complicatie is en daarmee de belangrijke reden voor observatie na een VE, werd de SGH meegenomen bij de literatuursearch van deze uitgangsvraag (Boo, 2005; Amar, 2003; Chadwick, 1996; Chang, 2007).
De lokale Nederlandse protocollen over het beleid postpartum na een VE heeft de werkgroep bij de vakgroepen kindergeneeskunde in 2015 opgevraagd (zie ook Algemene inleiding).
Referenties
- ACOG. Practice Bulletin No. 154: Operative Vaginal Delivery. Obstet Gynecol. 2015;126:e56-e65.
- Ahlberg M, Norman M, Hjelmstedt A, et al. Risk factors for failed vacuum extraction and associated complications in term newborn infants: a population-based cohort study. J Matern Fetal Neonatal Med. 2016;29:1646-51.
- Ahuja GL, Willoughby ML, Kerr MM, et al. Massive subaponeurotic haemorrhage in infants born by vacuum extraction. Br Med J. 1969;3:743-5.
- Amar AP, Aryan HE, Meltzer HS, et al. Neonatal subgaleal hematoma causing brain compression: report of two cases and review of the literature. Neurosurgery. 2003;52:1470-4.
- Bahl R, Van d V, Macleod M, et al. Maternal and neonatal morbidity in relation to the instrument used for mid-cavity rotational operative vaginal delivery: a prospective cohort study. BJOG. 2013;120:1526-32.
- Baskett TF, Fanning CA, Young DC. A prospective observational study of 1000 vacuum assisted deliveries with the OmniCup device.J Obstet Gynaecol Can. 2008 Jul;30(7):573-580.
- Boo NY, Foong KW, Mahdy ZA, et al. Risk factors associated with subaponeurotic haemorrhage in full-term infants exposed to vacuum extraction. BJOG. 2005;112:1516-21.
- Bremerich DH, Neidhart G, Heimann K, et al. Prophylactically-administered rectal acetaminophen does not reduce postoperative opioid requirements in infants and small children undergoing elective cleft palate repair. Anesth Analg. 2001;92:907-12.
- British Association of Perinatal Medicine (2015). Newborn early warning trigger and track(NEWTT). In British Association of Perinatal Medicine (ed). A framework for practice. UK: British Association of Perinatal Medicine, p 17.
- Cargill YM, MacKinnon CJ, Arsenault MY, et al. Guidelines for operative vaginal birth. J Obstet Gynaecol Can. 2004;26:747-61.
- Chadwick LM, Pemberton PJ, Kurinczuk JJ. Neonatal subgaleal haematoma: associated risk factors, complications and outcome. J Paediatr Child Health. 1996;32:228-32.
- Chang HY, Peng CC, Kao HA, et al. Neonatal subgaleal hemorrhage: clinical presentation, treatment, and predictors of poor prognosis. Pediatr Int. 2007;49:903-7.
- Chia CC, Huang SC. Neonatal coagulopathy presents as unusual and severe subgaleal hematomas after vacuum delivery. Taiwan J Obstet Gynecol. 2008;47:435-7.
- Colditz MJ, Lai MM, Cartwright DW, et al. Subgaleal haemorrhage in the newborn: A call for early diagnosis and aggressive management. J Paediatr Child Health. 2015;51:140-6.
- Doumouchtsis SK, Arulkumaran S. Head injuries after instrumental vaginal deliveries. Curr Opin Obstet Gynecol. 2006;18:129-34.
- Doumouchtsis SK, Arulkumaran S. Head trauma after instrumental births. Clin Perinatol. 2008;35:69-83, viii.
- Ducarme G, Hamel JF, Bouet PE, et al. Maternal and Neonatal Morbidity After Attempted Operative Vaginal Delivery According to Fetal Head Station. Obstet Gynecol. 2015;126:521-9.
- Ekeus C, Hogberg U, Norman M. Vacuum assisted birth and risk for cerebral complications in term newborn infants: a population-based cohort study. BMC Pregnancy Childbirth. 2014;14:36.
- Eliachar E, Bret AJ, Bardiaux M, et al. [Cranial Subcutaneous Hematoma in the Newborn]. Arch Fr Pediatr. 1963;20:1105-11.
- Fareeduddin R, Schifrin BS. Subgaleal hemorrhage after the use of a vacuum extractor during elective cesarean delivery: a case report. J Reprod Med. 2008;53:809-10.
- Fuijkschot J, Antonius T, Meijers PW, et al. [Neonatal subgaleal haemorrhage; a potential life-threatening extracranial haemorrhage]. Ned Tijdschr Geneeskd. 2008;152:96-100.
- Gebremariam A. Subgaleal haemorrhage: risk factors and neurological and developmental outcome in survivors. Ann Trop Paediatr. 1999;19:45-50.
- Ghidini A, Stewart D, Pezzullo JC, et al. Neonatal complications in vacuum-assisted vaginal delivery: are they associated with number of pulls, cup detachments, and duration of vacuum application? Arch Gynecol Obstet. 2017;295:67-73.
- Ismail NA1, Saharan WS, Zaleha MA, Jaafar R, Muhammad JA, Razi ZR. Kiwi Omnicup versus Malmstrom metal cup in vacuum assisted delivery: a randomized comparative trial. J Obstet Gynaecol Res. 2008 Jun;34(3):350-3.
- Macleod M, Murphy DJ. Operative vaginal delivery and the use of episiotomy--a survey of practice in the United Kingdom and Ireland. Eur J Obstet Gynecol Reprod Biol. 2008;136:178-83.
- Mortensen N, Augustsson JH, Ulriksen J, Hinna UT, Schmölzer GM, Solevåg AL. Early warning- and track and trigger systems for newborn infants: A review. J Child Health Care. 2017 Mar;21(1):112-120.
- Nederlandse Vereniging voor Kindergeneeskunde. Richtlijn Hyperbilirubinemie. https://www.nvk.nl/Kwaliteit/Richtlijnenoverzicht/Details/tabid/1558/articleType/ArticleView/articleId/730/Hyperbilirubinemie-preventie-diagnostiek-en-behandeling-bij-de-pasgeborene-geboren-na-een-zwangerschapsduur-van-meer-dan-35-weken.aspx. 2008. (Accessed 14-12-2017).
- Nederlandse Vereniging voor Obstetrie & Gynaecologie. Richtlijn Vaginale kunstverlossing. http://nvog-documenten.nl/index.php?pagina=/richtlijn/item/pagina.php&richtlijn_id=504. 2005. (Accessed 14-12-2017).
- Norman M, Aberg K, Holmsten K, et al. Predicting Nonhemolytic Neonatal Hyperbilirubinemia. Pediatrics. 2015;136:1087-94.
- Ohlsson A, Shah PS. Paracetamol (acetaminophen) for prevention or treatment of pain in newborns. Cochrane Database Syst Rev. 2016;10:CD011219.
- O'Mahony F, Hofmeyr GJ, Menon V. Choice of instruments for assisted vaginal delivery. Cochrane Database Syst Rev. 2010:CD005455.
- Ou-Yang MC, Huang CB, Huang HC, et al. Clinical manifestations of symptomatic intracranial hemorrhage in term neonates: 18 years of experience in a medical center. Pediatr Neonatol. 2010;51:208-13.
- Perined. Perinatale Zorg in Nederland 2016. Utrecht: Perined. 2018. https://assets.perined.nl/docs/7935f9c6-eaac-4f59-a150-307ae04efa27.pdf.
- Plauche WC. Subgaleal hematoma. A complication of instrumental delivery. JAMA. 1980;244:1597-8.
- Radovanovic T, Spasojevic S, Stojanovic V, et al. Severe neonatal subgaleal hemorrhage as the first presentation of hemophilia A. Srp Arh Celok Lek. 2016;144:204-6.
- RANZCOG. The Royal Australian and New Zealand College of Obstetricians and Gynaecologists. Prevention, detection and management of subgaleal haemorrhage in the newborn. https://www.ranzcog.edu.au/Statements-Guidelines/Obstetrics/Subgaleal-Haemorrhage-in-the-Newborn,-Prevention-D. 2015. (Accessed 3-7-2017).
- Robinson RJ, Rossiter MA. Massive subaponeurotic haemorrhage in babies of African origin. Arch Dis Child. 1968 Dec;43(232):684-7
- Roland D, Madar J, Conolly G. The Newborn early Warning (NEW) system: development of an at-risk infant intervention system. Infant 2010; 6(4): 116-20
- Simonson C, Barlow P, Dehennin N, et al. Neonatal complications of vacuum-assisted delivery. Obstet Gynecol. 2007;109:626-33.
- Smit-Wu MN, Moonen-Delarue DM, Benders MJ, et al. Onset of vacuum-related complaints in neonates. Eur J Pediatr. 2006;165:374-9.
- Suwannachat B, Lumbiganon P, Laopaiboon M. Rapid versus stepwise negative pressure application for vacuum extraction assisted vaginal delivery. Cochrane Database Syst Rev. 2012:CD006636.
- Talar T, Paczesniak U, Nowiczewski M, et al. SUBGALEAL HEMATOMA AS A PERINATAL PRESENTATION OF RARE HEMATOLOGIC PROBLEMS IN NEWBORNS. OWN EXPERIENCE. Dev Period Med. 2015;19:277-82.
- Tinner EM, Hoesli I, Jost K, et al. Rectal paracetamol in newborn infants after assisted vaginal delivery may increase pain response. J Pediatr. 2013;162:62-6.
- Uchil D, Arulkumaran S. Neonatal subgaleal hemorrhage and its relationship to delivery by vacuum extraction. Obstet Gynecol Surv. 2003;58:687-93.
- Van der Marel CD, Peters JW, Bouwmeester NJ, et al. Rectal acetaminophen does not reduce morphine consumption after major surgery in young infants. Br J Anaesth. 2007;98:372-9.
- Van Lingen RA, Quak CM, Deinum HT, et al. Effects of rectally administered paracetamol on infants delivered by vacuum extraction. Eur J Obstet Gynecol Reprod Biol. 2001;94:73-8.
- van Lingen RA, Deinum HT, Quak CM, et al. Multiple-dose pharmacokinetics of rectally administered acetaminophen in term infants. Clin Pharmacol Ther. 1999 Nov;66(5):509-15.
- Vayssiere C, Beucher G, Dupuis O, et al. Instrumental delivery: clinical practice guidelines from the French College of Gynaecologists and Obstetricians. Eur J Obstet Gynecol Reprod Biol. 2011;159:43-8.
- Veltman L. Vacuum-assisted vaginal delivery (VAVD)-basics for the risk manager. J Healthc Risk Manag. 2014;33(4):23-8.
- Wetzel EA, Kingma PS. Subgaleal hemorrhage in a neonate with factor X deficiency following a non-traumatic cesarean section. J Perinatol. 2012;32:304-5.
Evidence tabellen
Classificatie geselecteerd medische publicaties
|
C |
Ekeus et al (2018) Observationele studie; database 2013 6 centra in Zweden (5 in Stockholm Country Council) N=596 (100 VE uit 6 verschillende ziekenhuizen, 4 FE per abuis geïncludeerd) 64,4% primigravida; Zwangerschapsduur: 96,5% ≥37 weken; 3,4% 34-36 weken 441/596 Metal cup en 134/596 Omnicup of soft cup 7% mislukte VE (gevolgd door cs) 11,4% gecompliceerde VE (definitie: ≥2 x losschieten cup en/of ≥6 tracties en/of duur ≥ 15 min) Cefaalhematoom en SGH: 5,5% (ongecompliceerde VE) versus 13,2% (gecompliceerde VE) (OR 2.60) (95%CI: 1.17-5.77) Outcome pasgeborene gebaseerd op ICD-10 codes Geen gegevens over tijdsinterval geboorte en diagnose stelling |
|
C |
Ghidini et al. (2017) Retrospectieve cohort study. Vraag: Zijn de karakteristieken van de Vacuüm Extractie geassocieerd met de neonatale complicaties? Cohort van 01-01-2009 tot 01-09-2012. ( bijna 4 jaar) N=555 (515 succesvolle VE; 40 mislukte VE). Aantal drop outs: 7 ontbrekende informatie en 17 GA <37 weken Neonatale complicaties: cefaal hematoom (5,6%) 2 SGH (0,4%) en geen intracraniële bloedingen. Aantal tracties (1-9), aantal keren los schieten (0-5) en een mislukte VE waren niet geassocieerd met de neonatale complicaties. Totale duur van de tracties was wel significant verschillend 45 (30-75) zonder versus 60 (28-110) seconden in de groep met neonatale complicaties. (P˂ 0.001) |
|
C |
Krispin et al. (2017) Retrospectieve cohort studie Vraag; Relatie tussen het aantal keren losschieten van de cup en outcome? Periode: 2012-2014. Zwangerschapsduur: 37-42 weken Tertiair (academisch) ziekenhuis Israël Zowel Metal cup als Kiwi Omnicup gebruikt N= 1851 VE (8,1% van het totaal aantal bevallingen) waarvan 1779 (96%) aan inclusiecriteria voldeden. ≥1x Losschieten N= 146 (8,2%) (waarvan 16/146 (11%) ≥2x) versus niet losschieten N= 1622 (91,8%) Uitkomst: Alleen subarachnoïdale bloeding kwam significant meer voor in cup detachement groep (2,7% versus 0,1%; aOR 45.44; 95%CI: 6.42-321.62; p<0.001) en wanneer alle neonatale complicaties bij elkaar werden opgeteld (aOR 2,62; 95%CI: 1.1-6.22; p=0.03). SGH 18/1779 (1%): 1,4% versus 1% (P= 0.655) Nullipara 70,5% in cup detachement groep versus 67,4% in de niet cup detachement groep (p=0,461). Gecorrigeerd voor potentiele confounders Geen duidelijkheid over criteria rondom vaststellen diagnose (standaard observatie of criteria of onderzoeken pasgeborene) Geen gegevens over tijdbeloop VE en symptomen of vaststellen diagnose en geen gegevens over morbiditeit/mortaliteit pasgeborenen |
|
B |
Ducarme et al. (2015) Prospectieve studie Vraag: Verschillen de complicaties na kunstverlossing op basis van mate van indaling (midpelvic (H3 of +1) of low-pelvic +2 of +3 cm voorbij H3 of outlet) Dec 2008-oktober 2013 (80% vaginaal waarvan 13,6% kunstverlossing en 20% cs waarvan 1% van de cs na mislukte kunstverlossing) Een tertiair universitair ziekenhuis (Canada) met >4000 bevallingen/jaar Uitvoerder >5 jaar ervaring met kunstverlossingen Kiwi OmniCup of FE/Thierry’s Spatulas Exclusie: meerlingen, congenitale afwijkingen, dysmaturiteit (<P10), geen hoofdligging of ontbreken gegevens over mate van indaling. N= 2138 kunstverlossingen (391/2138 (18,3%) midpelvic waarvan 38/391 (9,8%) VE en 1550/2138 (72,5%) low-pelvic waarvan 525/ 1550 (33,9%) en 197/2153 (9,2%) outlet waarvan 165/197 (83,8%) VE) Uitkomst ernstige morbiditeit pasgeborene: Apgar 5 min <7, navelstreng pH <7.00, Reanimatie of intubatie pasgeborene, trauma (Clavicula fractuur, lange pijpbeenderen fractuur, Plexus letsel, cefaal hematoom), intraventriculaire bloeding >graad 2, NICU opname >24 uur, convulsie, sepsis en/of overlijden. Resultaten niet uitgesplitst naar FE of VE. Geen significant verschil tussen midpelvic en low-pelvic en outlet kunstverlossingen ten aanzien van ernstige morbiditeit (15,1-10,2-10,7%) of cefaalhematoom (0,3%-0,5%-0%) |
|
C |
Ahlberg et al. (2015) Retrospectief populatie-based nationaal cohort studie Vraag: Zijn karakteristieken van de VE en met name die van een mislukte VE geassocieerd met neonatale complicaties? Cohort 1999-2010 Zweden Zwangerschapsduur >36+6 weken, eenling zwangerschappen 8,2% VE (88418/1077532) waarvan 5,4% mislukte VE (4747/88418) Intracraniële bloedingen: 0,16% ( 0,158% bij geslaagde VE versus 0,23% bij mislukte VE; OR 1.33; 95%CI 0,68-2,62) SGH: 0,43% (0,33% geslaagde VE versus 2,1% mislukte VE; OR 7,3; 95% CI 5,51-9,66)
Database onderzoek gebaseerd op ingevulde ICD-10 code, geen standaard procedure over beeldvorming, lange onderzoeksperiode |
|
D |
Colditz et al. (2015) Review over SGH: stellen van de diagnose en behandeling. Tijd tot het stellen van de diagnose: 1-6 uur postpartum (Ref: Boo 2005 en Amar 2003) Incidentie SGH: 0,01-0,06% na spontane bevalling en 0,3-0,76% na VE (7 referenties) Incidentie SGH in prospectieve studies: 4,1-21% (Boo 2005, Boo1990, ACOG 2000) Mortaliteit: 17-25% (4 referenties 1980-1999) gedaald naar 5-14% (3 referenties 2007-2012) en bij prospectieve regelmatige controle en agressieve behandeling: 2,8% (Boo 2005) Morbiditeit: epilepsie, vertraagde ontwikkeling, gehandicapt: 17-33% (4 referenties 1996-2011)
(expert opinion op basis van review waarbij onvoldoende selectie criteria beschreven zijn van de genoemde literatuur en bias aanwezig is omdat de auteur aangeeft de review te hebben geschreven om onnodig overlijden bij een SGH te voorkomen) |
|
B |
Ekeus (2014) Retrospectief population-based nationaal cohort 1999-2010 Zweden. Vraag: Is het risico op cerebrale complicaties bij pasgeborenen verhoogd na een VE? Zwangerschapsduur >37 +0 weken, eenling zwangerschappen Vergelijking van risico op intracraniële bloeding, convulsies, encefalopathie bij pasgeborenen geboren per VE (N=87150), spoed sectio (CS) (75216) of spontane vaginale partus (N=851347).
Cerebrale neonatale complicaties:
ICH intracraniële bloeding
Database onderzoek gebaseerd op ingevulde ICD-10 code, geen standaard procedure over beeldvorming. Tevens lange onderzoeksperiode |
|
A1 |
Suwannachat et al. Cochrane Database Syst Rev. 2012. Rapid versus stepwise negative pressure application for vacuum extraction assisted vaginal delivery. Cefaal hematoom 5% SGH 2% |
|
D |
Doumouchtsis 2008 Review Cefaal hematoom 1-2% spontane vaginale partus versus 6-10% (range 1-26%) na VE (4 referenties waaronder 2 Cochrane reviews) SGH 0-21% na VE (OR 7,17; 95%CI: 5,43-10,25) (3 referenties waaronder Boo 2005 en Simonson 2007) |
|
B |
Ismail 2008 RCT Kiwi Omnicup (KO) versus Malmstrom metal cup (MM) Juni 2005-Mei 2006 Teaching hospital; 2-4e jaars assistenten getraind voor het doen van VE Totaal 6% VE (362/6031) Exclusie: meerling zwangerschap, zwangerschapsduur <36 weken en geen informed consent Totaal in studie geincludeerd N=164 (85 KO en 79 MM) SGH 1,2% KO en 10,1% MM groep (p=0.015; OR 0,11: 95%CI 0.01-0.87) |
|
C |
Baskett et al. (2008) Prospectieve observationele studie Maart 2002- Augustus 2005 1000 VE waarvan 87,1% geslaagd; Na mislukte VE: 1,1% alsnog spontaan bevallen, 9,8% met Forceps; 2% per sc. Gegevens van 651/1000 pasgeborenen na VE beschikbaar met notitie cup positie en lichamelijk onderzoek door onafhankelijk onderzoeker <48 uur postpartum volgens protocol 14,7% Cefaal hematoom (96/651); 0,4% Intracraniële bloeding (4/1000) waarvan 2 met convulsies: onduidelijk hoe vastgesteld maar geen routinematige echo of MRI. 0,01% SGH
Onduidelijk wie en waarom een echo cerebrum kreeg |
|
C |
Chang H- Y et al. (2007) Retrospectief database studie van SGH in cohort: 1995-2004 Vraag: Wat is de kliniek van een SGH en welke factoren bepalen de prognose? N=42 SGH (incidentie 0.6/1000 partussen en 4.6/1000 VE) 88% à terme zwangerschappen, 2 post-term en 3 prematuur, Diagnose gesteld gemiddeld 7,8 uur (0-33) uur na geboorte Mortaliteit:12% SGH (5/42) Morbiditeit: 4 epilepsie; 3 doof of slechthorend; 2 cerebral palsy en 1 trombose V Renalis 85% van de 13 kinderen met een slechte prognose (overleden of bovenbeschreven morbiditeit) waren elders geboren en naar getransporteerd. |
|
C |
Chang X et al. (2007) Prospectieve observationele studie van Aug 2004- Januari 2005 Vraag: Maternale en neonatale uitkomst na VE Exclusie BW >4500 gram of het niet aanwezig zijn van een van de onderzoekers. N=105 VE van de totaal 5460 partussen (1,9%) waarvan 5 drop outs in verband met geen toestemming voor onderzoek. 3% mislukte VE (3x afschieten cup) Geen neonatale complicaties (geen fracturen, plexuslaesie, asfyxie cefaalhematoom of SGH) direct postpartum en 4 weken postpartum Bias: nieuwe aangeleerde methode (VE) promoten om aantal CS te reduceren. |
|
C |
Simonson et al. (2007) Prospectief Vraag: Neonatale complication na VE Jan 2000-Dec 2004 Systematische screening met echo cerebrum en X-schedel 9,8% VE (1123/11405 partussen) Dropouts (apart geanalyseerd): - 150 (13,4%) geen echo en/of X-schedel volgens protocol (door te vroeg ontslag of geen toestemming); - 24 (2,1%) prematuren; - 36 (3,2%) mislukte VE.
ICH intracraniële bloeding
Cefaal hematoom: 10,85% (95%CI 8,79-12,9) Intracraniële (subdurale) bloedingen n=8 waarvan 7 zonder kliniek: 0,87% (95%CI 0,26-1,49) alleen gediagnosticeerd door echo cerebrum te maken SGH 0% Schedelfractuur (allen lineair) in groep geslaagde VE N=46: geen behandeling nodig Geen Follow-Up gegevens. |
|
C |
Kilani et al. (2006) Retrospectief database onderzoek over obstetrische factoren bij kinderen met diagnose SGH waarvoor opname op NICU noodzakelijk was. 1991-2003 N=34 SGH met NICU opname (inborn 8 è 0,17% van alle bevallingen in dat centrum) Zwangerschapsduur: 34-37 weken N=7 (20,6%) en ≥37 weken N=27 (79,4%) Nullipara 73,5% (echter geen controle groep) 29/34 hadden een VE ondergaan (85,3%) (21 alleen VE, 3 VE+FE en 5 VE+SC) 4/34 overleden (11,8%) Lange periode, selectie bias door SGH met NICU opname, geen tijdsinterval tussen geboorte en diagnose vermeld. |
|
C |
Boo et al. (2005) Prospectieve observationele studie 29-02-2000 en 27-03-2002 Alle pasgeborenen geboren middels VE of na mislukte VE werden door kinderarts direct postpartum, 1 uur, 6 uur en 24 uur postpartum. beoordeeld. Indien verdenking SGH volgde een tweede onderzoek door neonatoloog. 3,3% VE (338/10066) 21% SGH (71/338) Mediaan tijd vaststellen diagnose 1 uur postpartum Relatie met nullipara (OR 4,0;95% CI 1,6-10,0; P=0,003), mislukte VE (OR 16,4%; 95% CI 2,0-135,6; P=0,01) plaatsing cup over sagittaalnaad (OR 4,4; 95%CI 1,9-10,2; P<0,0001), plaatsing cup <3 cm voorste fontanel (OR 6,0; 95%CI 1,7-21,0; P=0,005); Apgar <8 na 5 min (OR 5,0; 95%CI 1,7-15,2; P=0,004) |
|
C |
Ng et al. (1995) Prospectieve studie VE middels metalen Malmstrom cup Jan 1991-Dec 1993 Vraag: Hoe vaak komt SGH voor? 11% VE (2500/22489 partussen) Incidentie SGH overall: 0,08% (18/22489) Incidentie SGH na VE: 0,64% (16/2500). Mortaliteit: 3/18 (17%) Afgewaardeerd in verband met Metalen cup, en jaartal <2000. |
|
Studie |
Design, follow-up, setting |
Patiënten |
Methode |
Outcome |
Resultaten |
Resultaten Beoordeling |
Quality of evidence (GRADE) |
|
Ekeus (2018) |
database
observationele studie in zes centra |
596 waarvan 64,4% primigravida
Zwangerschapsduur: 96,5% ≥37 weken; 3,4% 34 tot 36 weken |
Retrospectieve indeling in ongecompliceerde of gecompliceerde VE (definitie: ≥2 x losschieten cup en/of ≥6 tracties en/of duur ≥ 15 min) |
Complicatiess: Cefaalhematoom en SGH gebaseerd op ICD-10 codes |
Cefaal hematoom en SGH: 5,5% (ongecompliceerde VE) versus 13,2% (gecompliceerde VE) (OR 2.60) (95%CI: 1,17 tot 5,77) |
Retrospectief Database |
Low |
|
Ghidini (2017) |
Retrospectieve cohort studie
01-01-2009 tot 01-09-2012. (bijna vier jaar) |
N=555waarvan 40 mislukte VE en zeven drop-outs. |
Retrospectieve) |
Neonatale complicaties: cefaal hematoom (5,6%) twee SGH (0,4%) en geen intracraniele bloedingen. |
Aantal tracties (1 tot 9), aantal keren los schieten (0 tot 5) en een mislukte VE waren niet geassocieerd met de neonatale complicaties. Totale duur van de tracties was wel significant verschillend 45 (30 tot 75) zonder versus 60 (28 tot 110) seconden in de groep met neonatale complicaties. (P˂ 0.001) |
Retrospectief cohort |
Low |
|
Krispin (2017)
|
Retrospectieve cohort studie
Periode: 2012-2014
Tertiair (academisch) ziekenhuis Israël |
1851 VE (8,1% van het totaal aantal bevallingen) waarvan 1779 (96%) aan inclusiecriteria voldeden
Zwangerschapsduur: 37 tot 42 weken.
|
Retrospectief cohort |
Relatie tussen het aantal keren losschieten van de cup en outcome? |
Alleen significant verschil in Subarachnoïdale bloeding: cup detachement groep 2,7% versus 0,1% ( aOR 45.44; 95%CI: 6.42 tot 321.62; p<0.001) en wanneer alle neonatale complicaties bij elkaar werden opgeteld (aOR 2.62; 95%CI: 1.1 tot 6.22; p=0.03). Geen verschil: SGH 18/1779 (1%): 1,4% versus 1% (P= 0.655) |
Gecorrigeerd voor potentiele confounders
Geen duidelijkheid over criteria rondom vaststellen diagnose (standaard observatie of criteria of onderzoeken pasgeborene) |
Low |
|
Ducarme (2015)
|
Prospectieve studie
Tertiair universitair ziekenhuis (Canada) met >4000 bevallingen/jaar
Uitvoerder >5 jaar ervaring met kunstverlossingen
Periode 2008-2013 |
2138 kunstverlossingen (VE Omni Cup/FE)
18,3% midpelvic (9,8% VE)
72,5% low-pelvic ((33,9% VE)
9,2% outlet (83,8% VE)
Exclusie BW <P10, cong afw, stuit of ontbreken gegevens mate van indaling
1,8% mislukte kunstverlossingen |
Prospectief |
Ernstige morbiditeit moeder en kind.
pasgeborene: - Apgar 5 min <7, - Navelstreng pH <7.00, - Reanimatie of intubatie pasgeborene, - Trauma (Clavicula fractuur, lange pijpbeendereen fractuur, Plexus letsel, cefaal hematoom, - Intraventriculaire bloeding >graad 2, - NICU opname >24 uur, - convulsie, - sepsis - overlijden. |
Ernstige neonatale morbiditeit; 11,1% (n=217)
Geen significant verschil tussen midpelvic, low-pelvic en outlet kunstverlossingen ten aanzien van ernstige morbiditeit (15,1 tot 10,2 tot 10,7%) of ten aanzien van cefaal hematoom (0,3% tot 0,5% tot 0%) |
Resultaten niet uitgesplitst naar FE of VE.
Statistische bewerking beschreven
Gecorrigeerd voor confounders in de multivariate analyse |
Moderate |
|
Ahlberg (2015) |
Retrospectief populatie-based nationaal cohort studie
Cohort 1999-2010 Zweden |
1077532 Zwangerschapsduur >36+6 weken, eenling zwangerschappen
88418 VE ( 8,2%) waarvan 5,4% mislukte VE (4747/88418) |
Retrospectief database cohort |
Zijn karakteristieken van de VE en met name die van een mislukte VE geassocieerd met neonatale complicaties? |
Intracraniële bloedingen: 0,16% ( 0,158% bij geslaagde VE versus 0,23% bij mislukte VE; OR 1.33; 95%CI 0,68-2,62)
SGH: 0,43% (0,33% geslaagde VE versus 2,1% mislukte VE; OR 7,3; 95% CI 5,51-9,66) |
Database onderzoek gebaseerd op ingevulde ICD-10 code
Groot aantal patiënten
geen standaard procedure over beeldvorming
Lange onderzoeksperiode |
Low |
|
Ekeus (2014) |
Retrospectief population-based nationaal cohort
1999-2010 Zweden. |
N= 1013713 Zwangerschapsduur >37 +0 weken, eenling in hoofdligging
VE (N=87150 waarvan 3484 mislukt), Secundaire sectio (CS) (75216), Spontane vaginale partus (N=851347). |
Retrospectief population-based cohort |
Risico op cerebrale complicaties (intracraniele bloeding, convulsies (klinisch en/of EEG) , encephalopathie) |
|
Database onderzoek gebaseerd op ingevulde ICD-10 code
Groot aantal patiënten
geen standaard procedure beeldvorming (echo/MRI/CT) op basis van kliniek
Lange onderzoeksperiode |
Low |
|
Baskett (2008) |
Prospectieve observationele studie
2002- 2005
Canada, teaching hospital met 5000 bevallingen/jaar |
1000 bevallingen middels VE met Omnicup
GA >35 weken
651 gedetailleerde gegevens van de VE, positie cup op het hoofd en lichamelijk onderzoek kind <48 uur postpartum beschikbaar
87,1% van de 1000 geslaagde VE |
Pospectief observationeel |
Incidentie cefaalhematoom, plexus laesie, fracturen, convulsies, intracraniele bloeding, IVH, SGH |
Incidentie 0,01% SGH
14,7% Cefaal hematoom (96/651)
0,4% Intracraniële bloeding (4/1000) |
Niet beschreven waarom beeldvorming gedaan werd/hoe intracraniële bloeding werden vastgesteld (geen routinematige echo of MRI).
|
Low |
|
Ismail 2008 |
RCT
Juni 2005-mei 2006
Teaching hospital, Maleisië
2-4e jaars assistenten getraind voor het doen van VE |
164 geïncludeerd van de 362 VE van de 6031 partussen (6%):
85 Kiwi Omnicup en 79 Malstrom metal cup
Exclusie: meerling zwangerschap, zwangerschapsduur <36 weken en geen informed consent
|
Gerandomiseerd Na informed consent Kiwi Omnicup (KO) versus Malmstrom metal cup (MM)
|
Maternale complicaties
Neonatale complicaties; Opname NICU SGH |
SGH: 1,2% KO en 10,1% MM groep (p=0.015; OR 0,11: 95%CI 0.01-0.87) |
Statistische methode beschreven
Mogelijke bias door <50% van de ouders bij een VE informed consent heeft gegeven |
Moderate |
|
Chang H- Y et al (2007) |
Retrospectief status onderzoek op basis van geregistreerde diagnose SGH
1995-2004
Single centre (Taipei) |
N=42 SGH
SGH incidentie 0.6/1000 partussen en 4.6/1000 VE) |
Retrospectief status onderzoek |
Kliniek SGH
Welke factoren bepalen de prognose
Slechte prognose: mortaliteit of morbiditeit (neurologische complicaties: epilepsie, doof of slechthorend, cerebral palsy en nierfunctiestoornissen) |
Kliniek: Toename SO, resp. distress, tachypnoe, weinig reactief, bleekheid en convulsies
Latere symptomen: icterus, ecchymosis/hematomen
Slechte outcome bij (31%/) gedefinieerd als): Convulsies Hypotensie Anemie Metabole acidose Coagulopathie Nierfunctiestoornissen Opname NICU Bloedtransfusie Medicatie voor hypotensie Outborn
Incidentie SGH 0.6/1000 partussen en 4.6/1000 VE
Diagnose gesteld gemiddeld 7,8 uur (0-33) uur na geboorte
Mortaliteit:12% SGH (5/42) |
Klein aantal in lange periode
Retrospectieve status studie
Criteria morbiditeit niet vooraf gedefinieerd |
Low |
|
Chang X (2007) |
Prospectieve observationele studie
Aug 2004- januari 2005 |
|
|
|
Geen neonatale complicaties (geen fracturen, plexuslaesie, asfyxie cefaalhematoom of SGH) direct postpartum en 4 weken postpartum |
Bias: nieuwe aangeleerde methode (VE) promoten om aantal CS te reduceren. |
Low |
|
Simonson et al. (2007)
|
Prospectief
Jan 2000-Dec 2004 |
VE 1123/11405 (9,8%) waarvan 913 (81%) geslaagd
Drop-outs (apart geanalyseerd): - 150 (13,4%) in verband met geen echo en/of X-schedel volgens protocol (door te vroeg ontslag of geen toestemming); - 24 (2,1%) prematuren <37 weken - 36 (3,2%) mislukte VE. |
Cohort Protocol met echo en X-schedel beoordeeld door een radioloog Lichamelijk onderzoek door kinderarts |
Neonatale complication: Caput succedaneum Cefaal hematoom SGH Schedel fractuur Intracraniele bloeding Opname NICU Plexus laesie Lage Apgarscore 5 min Navelstreg pH <7,20 |
Incidentie: - Cefaal hematoom 10,84% - Geen SGH - Intracraniële bloeding: - Geslaagde VE: 0,87% (95%CI 0.26-1.49) - Losschieten cup: 0% - Mislukte VE gevolgd door SC: 2,78% |
Systematische screening met echo cerebrum en X-schedel niet aanwezig bij 150 van de 913
Statistiek beschreven |
Low |
|
Kilani et al 2006 |
Retrospectief database studie
1991-2003 |
N=34 SGH met NICU opname (inborn 8 0,17% van alle bevallingen in dat centrum)
Zwangerschapsduur: 34-37 weken N=7 (20,6%) en ≥37 weken N=27 (79,4%) |
|
obstetrische factoren bij kinderen met diagnose SGH waarvoor opname op NICU noodzakelijk was |
Nullipara 73,5% (echter geen controle groep)
29/34 hadden een VE ondergaan (85,3%)
Mortaliteit 4/34 (11,8%)
|
Criteria voor selectie en definities of complicaties duidelijk beschreven
Lange periode.
Selectie bias door SGH met NICU opname |
Low |
|
Boo et al (2005) |
Prospectieve observationele studie
Tertiair teaching hospital Maleisië
29-02-2000 en 27-03-2002 |
VE 338/10066 (3,3% )
Drop-outs 55 van de 267 kinderen zonder SGH in verband met ontbreken gegevens |
Alle pasgeborenen geboren middels VE of na mislukte VE werden door kinderarts direct postpartum, 1 uur, 6 uur en 24 uur postpartum. Indien verdenking SGH tweede onderzoek door neonatoloog
Vergelijking risicofactoren tussen SGH en controles (geen SGH) |
Incidentie SGH
Risicofactoren voor SGH |
21% SGH (71/338) waarvan 81,7% complicaties ten gevolge van bloeding ontwikkelde waarvoor behandeling noodzakelijk (anemie waarvoor transfusie, stollingsproblemen waarvoor FFP, shock waarvoor vulling en/of inotropie)
Mortaliteit 2,8%
Mediaan tijd vaststellen diagnose 1 uur postpartum
Risicofactoren: - Nullipara (OR 4,0; 95% CI 1,6-10,0; P=0,003), - Mislukte VE (OR 16,4: 95% CI 2,0-135,6; P=0,01) - Plaatsing cup over sagittaalnaad (OR 4,4; 95%CI 1,9-10,2; P<0,0001) - Plaatsing cup <3 cm voorste fontanel (OR 6,0; 95%CI 1,7-21,0; P=0,005); - Apgar <8 na 5 min (OR 5,0; 95%CI 1,7-15,2; P=0,004) |
Prospectief
Groot aantal patiënten met SGH
Multivariate analysis |
moderate |
|
Ng. (1995) |
Prospectieve studie
Tertiair centrum Hong Kong
Jan 1991-Dec 1993 |
18 SGH waarvan 16 na VE
VE 11% van het aantal partussen 922489) |
Analyse gegevens van de 18 SGH patienten |
Incidentie SGH na VE middels metalen Malmstrom cup
. |
Incidentie SGH overall: 0,08% (18/22489) Incidentie SGH na VE: 0,64% (16/2500). Mortaliteit SGH: 3/18 (17%) |
Afgewaardeerd in verband met Metalen cup, en jaartal <2000
Alle SGH patiënten werden via vast protocol met opname op NICU gemonitord
Klein aantal patiënten |
Low |
GRADE Working Group grades of evidence
High quality: Further research is very unlikely to change our confidence in the estimate of effect.
Moderate quality: Further research is likely to have an important impact on our confidence in the estimate of effect and may change the estimate.
Low quality: Further research is very likely to have an important impact on our confidence in the estimate of effect and is likely to change the estimate.
Very low quality: We are very uncertain about the estimate
GRADE-tabel: Van bewijs naar aanbeveling
|
|
Beslissing |
Toelichting |
|
1. Kwaliteit van het bewijs Is de algehele kwaliteit van bewijs hoog? |
☐ Nee |
|
|
2. Balans tussen gewenste en ongewenste effecten |
|
|
|
Overtreffen de gunstige effecten de ongunstige effecten aanzienlijk, en is de werkgroep hier zeker van? |
☐ Ja |
Ja, in de literatuur wordt beschreven dat de mortaliteit bij een SGH door actieve observatie van 25 naar 2,8% verlaagd kan worden. De incidentie van een SGH in Nederland ontbreekt. |
|
3. Patiëntenperspectief |
|
|
|
In het geval van een positieve aanbeveling: Hanteren vrijwel alle patiënten hetzelfde perspectief op de wenselijkheid van de conceptaanbeveling? |
Niet van toepassing |
|
|
4. Professioneel perspectief |
|
|
|
Hanteren vrijwel alle zorgverleners hetzelfde perspectief op de wenselijkheid van de conceptaanbeveling? |
☐ Nee |
De praktijk variatie over het beleid na een VE en de in de literatuur gevonden incidentie van een SGH is zeer groot. Over eventuele extra risicofactoren (naast een VE) op een SGH is bij de zorgverleners en in de literatuur geen overeenstemming. |
|
5. Middelenbeslag |
|
|
|
Zijn de netto-gunstige effecten de (extra) middelen waard? |
☐ Ja |
Overlijden aan een SGH door hypovolemie en of door stollingsproblemen, is fors te reduceren door vroege signalering van een SGH en het daarop starten van de behandeling. Daarom is een korte observatieperiode van 6 uur te verantwoorden. |
|
6. Organisatie van zorg |
|
|
|
Zijn voldoende condities van zorg-organisatorische of maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ Ja |
Die zorgverleners die de observatie gaan uitvoeren moeten goed geïnstrueerd worden over waaruit de observatie bestaat en hoe te handelen bij bijzondere bevindingen. De overdracht binnen de keten moet zorgvuldig gebeuren zodat de observatie goed kan worden uitgevoerd. |
|
7. Maatschappelijk perspectief |
|
|
|
Zijn voldoende condities van zorg-organisatorische of maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ Twijfel |
De druk op de capaciteit van de intramurale verloskundige zorg is enorm hoog. Indien de observatie extramuraal gaat plaatsvinden, is een goed gestroomlijnd zorgpad vereist waarbij een snelle start van de behandeling bij bijzonderheden tijdens de observatie, gegarandeerd moet zijn. |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 28-11-2020
De richtlijn wordt één keer per vijf jaar gereviseerd. De geldigheid van de richtlijn komt eerder te vervallen als nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten. Zo mogelijk wordt de richtlijn, indien financiering beschikbaar is, aangevuld met extra modules.
Doel en doelgroep
Het doel van deze richtlijn is om handvatten te bieden voor de algemene kindergeneeskundige zorg voor de (bijna) à terme pasgeborenen. In deze richtlijn gaan de uitgangsvragen over het beleid rondom neonatale hypoglycemie, beleid na vacuümextractie en de indicaties voor een consult kinderarts. Het gaat hierbij om pasgeborenen die vanwege een medische indicatie in het ziekenhuis geboren of opgenomen worden en bij wie de (algemeen) kinderarts zorg levert of zou moeten leveren. Prematuren met een zwangerschapsduur <35 weken en pasgeborenen met een indicatie voor intensive care opname vallen niet onder deze richtlijn. Deze richtlijn bevat aanbevelingen voor de zorg voor pasgeborenen waarbij de focus ligt op de algemeen kinderarts. Ook andere zorgverleners binnen de integrale geboortezorg kunnen gebruik maken van de informatie uit deze richtlijn, zoals huisartsen, verloskundigen, verpleegkundigen, kraamverzorgenden en ouderverenigingen.
Samenstelling werkgroep
Voor de ontwikkeling van deze richtlijn is een richtlijnwerkgroep samengesteld. Deze werkgroep bestond uit gemandateerde vertegenwoordigers van de NVK, de Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) en de Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV). Het ouderperspectief in de werkgroep werd vertegenwoordigd door participatie van Stichting Kind en Ziekenhuis. De werkgroep werd aangevuld met een arts-onderzoeker met expertise op het gebied van neonatale hypoglycemie. De werkgroep werd bij het literatuuronderzoek ondersteund door een epidemioloog van het NVK-bureau. Een epidemioloog van PROVA was betrokken voor methodologisch en procedureel advies. De werkgroep werd secretarieel ondersteund vanuit het bureau van de NVK. De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget van de SKMS.
Werkgroep
- Mw. L.H. van der Meer-Kappelle, werkzaam in Reinier de Graaf Groep, namens NVK (voorzitter)
- Dr. R.F. Kornelisse, neonatoloog, werkzaam in Erasmus MC-Sophia, namens NVK
- Dr. R.H.T. van Beek, neonatoloog, werkzaam in Amphia Ziekenhuis, namens NVK
- Drs. C.S. Barbian, kinderarts, werkzaam in Ziekenhuis Rivierenland, namens NVK
- Dr. A.A.M.W. van Kempen, neonatoloog, werkzaam in OLVG Amsterdam, namens NVK
- Drs. N.R. van Veenendaal, arts-onderzoeker werkzaam in OLVG Amsterdam, namens NVK
- Drs. H.G. Stas, neonatoloog, werkzaam in Maasstad Ziekenhuis Rotterdam, namens NVK
- Dr. P.H Dijk, neonatoloog, werkzaam in UMCG, namens NVK
- D. Joseph, MSc, verpleegkundige, werkzaam voor Kind en Ziekenhuis
- L. Zondag, beleidsmedewerker, werkzaam als verloskundige, namens KNOV
- NVOG, commissie Kwaliteitsdocumenten
Meelezers
- Mw. Dr. C. de Boer, verpleegkundige neonatologie, werkzaam in Erasmus MC, namens V&VN
- Dr. R.M.J. Moonen, neonatoloog, werkzaam in Zuyderland Medisch Centrum Heerlen, namens NVK
- Drs. S. Mulder, hoofd afdeling neonatologie, werkzaam in Isala Zwolle, namens NVK
- Dr. J.E. Bunt, neonatoloog, werkzaam in ETZ Elisabeth, namens NVK
- Dr. F. Maingay, neonatoloog, werkzaam in Noordwest Ziekenhuisgroep Alkmaar, namens NVK
- Dr. F.A.B.A. Schuerman, neonatoloog, werkzaam in Isala Zwolle, namens NVK
- Dr. W.J.M. van Heel, neonatoloog, werkzaam in Haga Ziekenhuis, namens NVK
- Dr. H.B. Burggraaff, verloskundige huisarts, werkzaam in H.B. Burggraaff, namens NHG
Met ondersteuning van
- Mw. Drs. M. Tuut, zelfstandig epidemioloog PROVA
- Mw. Dr. L.M.A.J. Venmans, epidemioloog NVK
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of zij in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek en belangen door kennisvalorisatie. De ingevulde belangenverklaringen zijn beoordeeld door de projectleider. Hieruit is geen belemmering voor participatie in de werkgroep naar voren gekomen. De verklaringen liggen ter inzage bij de NVK.
Inbreng patiëntenperspectief
Het perspectief van patiënten en ouders is gewaarborgd doordat Stichting Kind en Ziekenhuis vertegenwoordigd was in de werkgroep. Zij hadden een belangrijke bijdrage aan de patiëntenversie van de richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De definitieve richtlijn is onder de verenigingen verspreid, en via de website van de NVK (https://www.nvk.nl/) en de Richtlijnendatabase elektronisch beschikbaar gesteld. Op wetenschappelijke bijeenkomsten van de betrokken wetenschappelijke verenigingen en regionale bijeenkomsten kunnen de aanbevelingen van de richtlijn worden gepresenteerd.
Het uitgebreide implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Knelpuntanalyse, verzamelen protocollen en vaststellen uitgangsvragen
Door de leden van de werkgroep werd een schriftelijke knelpuntenanalyse uitgevoerd om de huidige werkwijze ten aanzien van neonatale hypoglycemie, beleid na vacuümextractie en opname- en ontslagcriteria in kaart te brengen.
De inhoud van deze praktische en specifiek op de Nederlandse situatie gerichte richtlijn, is mede gebaseerd op internationale richtlijnen. De evidence was niet altijd even sterk. Daarnaast leende een deel van de uitgangsvragen zich niet voor een literatuursearch.
Daarom werden, naast literatuur, internationale en nationale richtlijnen, ook regionale en lokale protocollen omtrent neonatale hypoglycemie, vacuümextracties en indicatie voor een consult kinderarts verzameld en gebruikt. Er werden 34 protocollen toegestuurd: 4 afkomstig uit NICU’s, 9 uit post-IC/HC-centra en 21 uit algemene ziekenhuizen. In december 2016 telde Nederland 79 ziekenhuisorganisaties, inclusief 10 NICU’S. Het aantal ingestuurde protocollen werd door de werkgroep als representatief voor de Nederlandse ziekenhuizen beschouwd.
Tijdens werkgroepvergaderingen werden de definitieve knelpunten en uitgangsvragen vastgesteld. De Nederlandse kinderarts werkt zo veel mogelijk evidence-based. Wanneer er een grote praktijkvariatie is, komt dit doordat evidence ontbreekt in de literatuur. Aangezien deze richtlijn als doel heeft de praktijkvariatie te beperken, is per vraag bekeken of een evidence-based search zinvol was om antwoord te geven op de uitgangsvraag of dat de uitgangsvraag door middel van consensus, met behulp van bestaande literatuur, (inter)nationale richtlijnen en lokale protocollen, binnen de werkgroep zou worden uitgewerkt.
Zoeken (inter)nationale richtlijnen
In eerste instantie werd gezocht naar evidence-based richtlijnen. Hierbij werd gebruik gemaakt van de volgende databases: Medline, SUMSEARCH2, Clinical evidence van BMJ, Scottish Intercollegiate Guidelines Network en de TRIP DATABASE. Inclusiecriteria waren als volgt:
- het betreft een evidence-based richtlijn of practical guideline;
- de populatie betreft pasgeborenen;
- de richtlijn moet gaan over postnatale zorg voor pasgeborenen;
- publicatie tot juli 2015 (datum van de search).
De gevonden richtlijnen werden op kwaliteit beoordeeld met behulp van AGREE II (https://www.agreetrust.org/). De resultaten van deze search en de kwaliteit van de gevonden richtlijnen is beschreven bij de verschillende modules.
Zoeken artikelen
Bij de vragen waarvoor een search werd gedaan, wordt beschreven welke databases en zoektermen zijn gebruikt en welke zoekperiode is aangehouden (zie de zoekverantwoording in de verschillende modules). Er werd gezocht naar de hoogste mate van bewijs: systematische reviews en gerandomiseerd en gecontroleerd onderzoek. Zoals te verwachten bij veel praktijkvariatie, was het bewijsniveau van de literatuur en richtlijnen over het algemeen laag.
Beoordeling artikelen
De uitgangsvragen waarvoor een search werd gedaan, werden met behulp van de GRADE-methodiek (Grading Recommendations Assessment, Development and Evaluation) uitgewerkt. De literatuur werd beoordeeld middels https://www.cebm.net/2009/06/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/. Aan het begin van het richtlijntraject werden hiertoe uitkomstmaten gedefinieerd. Resultaten werden per uitkomstmaat samengevat, waarbij tevens de overall kwaliteit van de onderliggende bewijslast (evidence) werd aangegeven. Bij de beoordeling werd gebruik gemaakt van GRADEpro (https://gradepro.org/). Met behulp van dit instrument werd bij elke uitgangsvraag een tabel met bevindingen (summary of findings) en een tabel met de beoordeling van het bewijs (GRADE evidence profile) gemaakt.
GRADE kent vier niveaus: high, moderate, low en very low. Per uitkomst werd een GRADE-niveau toegekend. Wanneer een uitkomst als high geclassificeerd werd, wil dit zeggen dat het onwaarschijnlijk is dat toekomstig onderzoek de schatting van de uitkomst zal veranderen. Met andere woorden: er is veel vertrouwen in de juistheid van de schatting van de uitkomst. Een very low-classificatie wil zeggen dat er veel onzekerheid is over de juistheid van de uitkomst.
Het onderzoeksdesign is een belangrijke factor binnen GRADE. Gerandomiseerde en gecontroleerde studies krijgen daarom in beginsel de kwalificatie high. Er zijn vijf factoren die kunnen zorgen voor een lagere kwalificatie:
- beperkingen in de onderzoeksopzet;
- inconsistentie: onverklaarde heterogeniteit van de resultaten;
- indirectheid: de populatie, interventie, controle en uitkomst (PICO) waarop de evidence gebaseerd is, wijken op een of meer punten af van de PICO die men wil onderzoeken. Ook het gebruik van surrogaatmarkers valt onder indirectheid;
- imprecisie: wijde betrouwbaarheidsintervallen rond een geschat effect duiden op onzekerheid in de grootte van het effect. Er is sprake van imprecisie bij een te kleine steekproef (lage statistische power), weinig events en een betrouwbaarheidsinterval dat wel statistisch significant is, maar zowel in het gebied van klinische relevantie als in het gebied van een verwaarloosbaar effect ligt;
- publicatiebias.
Indien de resultaten niet gepoold konden worden, werd volstaan met een globale inschatting van de kwaliteit van de onderliggende bewijslast. Voor een uitgebreidere beschrijving van GRADE verwijst de werkgroep naar http://www.gradeworkinggroup.org.
Van bewijs naar aanbeveling
Nadat de evidence was samengevat en gegradeerd, werden door de werkgroep aanbevelingen geformuleerd. Naast de evidence werden hierbij overwegingen uit de praktijk meegenomen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is rekening gehouden met de organisatie van zorg; alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur), hoewel deze in de algemeen kindergeneeskundige praktijken nog al verschillend zijn. Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Commentaar- en autorisatiefase
Na vaststelling van de conceptrichtlijn door de werkgroep werd de richtlijn naar de meelezers gestuurd ter becommentariëring. Na verwerking van alle suggesties, startte de commentaarfase en werd de richtlijn voorgelegd aan de volgende partijen: NVK, Stichting Kind en Ziekenhuis, NVOG, KNOV, V&VN, IGZ, VGVK, NHG.
In de definitieve richtlijn, die ter autorisatie is aangeboden aan de NVK, NVOG, KNOV en Stichting Kind & Ziekenhuis op 28 november, is het commentaar waar mogelijk en relevant verwerkt door de werkgroep.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op evidence gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien deze aanbevelingen hoofdzakelijk gebaseerd zijn op de gemiddelde patiënt kunnen zorgverleners op basis van hun professionele autonomie zo nodig afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
