Instrumenten als hulpmiddel bij minderen en stoppen van medicatie
Uitgangsvraag
Welke stappen zijn nodig bij het stoppen van geneesmiddelen en welke instrumenten kunnen hiervoor gebruikt worden?
Aanbeveling
Zie het overzicht van de aanbevelingen.
Overwegingen
Alle impliciete instrumenten hebben gemeen dat zij uitgaan van een cyclisch proces van anamnese, analyse, plan maken met patiënt en evaluatie. De STRIP-methodiek is hiervoor in Nederland al goed geïmplementeerd. Het 6-step behandelplan kan daarbij worden gebruikt om systematisch na te gaan of medicatie nog is geïndiceerd bij een actueel klinisch probleem.
Hoewel expliciete instrumenten het identificeren van geneesmiddelen die mogelijk in aanmerking komen om te stoppen kunnen vergemakkelijken, bevelen wij geen specifiek expliciet instrument voor het gehele zorgspectrum aan. Redenen hiervoor zijn onder andere dat de toepasbaarheid zeer afhankelijk is van de patiëntengroep, de setting, de eigen ervaring en de inpasbaarheid in het eigen (digitale) werkproces. De toepasbaarheid/implementatie van minderen en stoppen van medicatie in de dagelijkse praktijk kan bevorderd kunnen worden door een dergelijk instrument als digitale beslissingsondersteunende module te integreren in of te koppelen aan het EPD, zoals het geval is bij NHGDoc [Monteiro 2019].
Wat passende medicatie is en welk instrument gebruikt kan worden bij de analyse van het medicatiegebruik is naast de wensen van de patiënt mede afhankelijk van de levensverwachting en klinische conditie van de patiënt. Op basis van de beschikbare instrumenten zou een categorisatie gemaakt kunnen worden:
- patiënten met een geringe geschatte resterende levensverwachting;
- patiënten met een geschatte resterende levensverwachting ≤ 1 jaar;
- kwetsbare ouderen (hiervoor worden verschillende definities gehanteerd, de resterende levensverwachting wordt geschat op maximaal 2 tot 5 jaar);
- vitale ouderen (met een geschatte resterende levensverwachting ≥ 5 jaar).
Bij patiënt met een levensverwachting van bijvoorbeeld enkele maanden tot 1 jaar in bijvoorbeeld het verpleeghuis zullen andere keuzes worden gemaakt (bijvoorbeeld met behulp van STOPPFrail) dan bij ouderen met een aanzienlijk langere levensverwachting in de eerste lijn (bijvoorbeeld met behulp van STOPP-START).
In de kennisdocumenten die naar aanleiding van deze module mede op basis van Australische, Tasmaanse en Canadese deprescribing-tools worden ontwikkeld (zie Implementatieplan) is deze categorisatie ook aangehouden en zijn voor geneesmiddelen uit enkele veelgebruikte geneesmiddelengroepen concrete overwegingen en aanbevelingen gegeven voor het stoppen of minderen.
Het betrekken van de patiënt is een absolute voorwaarde voor het succes van minderen en stoppen van medicatie. Hierbij kan gebruik worden gemaakt van de OPT en de GAS.
Conclusies
- De toepasbaarheid/implementatie van minderen en stoppen van medicatie in de dagelijkse praktijk kan bevorderd worden door een van de beschikbare instrumenten als digitale beslissingsondersteunende module te integreren of te koppelen aan het EPD.
- Het bewust stoppen en minderen van een geneesmiddel omvat veel meer dan het stoppen of veranderen van een medicatievoorschrift. Het is een proces waarbij de STRIP en het algemene 6-steps behandelplan de WHO gevolgd kunnen worden, toegesneden op de individuele patiënt.
- Er zijn veel instrumenten voor het identificeren van geneesmiddelen die gestopt of geminderd kunnen worden, en hoe dat te doen. Hun toepasbaarheid is erg afhankelijk van de patiëntengroep, de eigen ervaring en de inpasbaarheid in het (digitale) werkproces. De werkgroep beveelt daarom geen specifiek instrument aan.
- Het is essentieel de patiënt te betrekken in de besluitvorming over het stoppen of minderen van medicatie. Ook hiervoor zijn enkele instrumenten beschikbaar.
Onderbouwing
Achtergrond
Minderen en stoppen van medicatie is geen enkelvoudige actie, maar onderdeel van een proces. Het voorschrijven van geneesmiddelen is meer dan het schrijven van een recept door de arts en het beschikbaar stellen van het geneesmiddel door de apotheker. Evenzo is het stoppen van een geneesmiddel meer dan het niet meer schrijven van een recept.
Aangezien de individueel te behandelen patiënt nooit exact overeenkomt met de evidence afkomstig van de patiënten geïncludeerd in klinisch geneesmiddelonderzoek is de uitkomst van het starten, maar ook het stoppen van een geneesmiddel bij de individuele patiënt omgeven met behoorlijke onzekerheid.
Samenvatting literatuur
Instrumenten die helpen identificeren welke geneesmiddelen te stoppen of te minderen
Er zijn impliciete en expliciete instrumenten of screeningsmethoden te onderscheiden. Impliciete screeningsmethoden berusten op een structurele analyse van de medicatie en de aandoeningen van een patiënt en vereisen interpretatie van medische kennis naast informatie van de patiënt. Expliciete screeningsmethoden zijn in het algemeen gebaseerd op de vigerende richtlijnen en zijn doorgaans eenvoudig toe te passen als checklist bij een medicatiebeoordeling. Ze kunnen ook ingebouwd worden in zorginformatiesystemen, als geautomatiseerde beslissingsondersteuning. Expliciete instrumenten zijn aanvullend op impliciete instrumenten.
Impliciete screeningsinstrumenten
Een belangrijk impliciet instrument, gericht op het voorschrijven van geneesmiddelen, is het 6-step behandelplan van de WHO [De Vries 1994]. Het is een cyclisch proces in zes stappen dat op geleide van de pathofysiologie, het beschikbare bewijs, de expertise en ervaring van de behandelaar, de wensen, verwachtingen en kenmerken van de individuele patiënt richting geeft aan het starten, monitoren, evalueren en zo nodig bijstellen van een therapie met een of meer geneesmiddelen. Centraal hierbij staat het klinische probleem van de patiënt. De zes stappen bij het voorschrijven kunnen echter ook goed worden gebruikt bij het stoppen of minderen van geneesmiddelen.
In de praktijk wordt bij de analyse van het gehele medicatiegebruik al gebruik gemaakt van impliciete hulplijsten zoals de Systematic Tool to Reduce Inappropriate Medication (STRIP), die beschreven wordt in de Module Medicatiebeoordeling (2019). De STRIP geeft handvatten voor de afstemming van de zorgverlener met de patiënt (farmacotherapeutische anamnese), de analyse van de medicatie op mogelijke farmacotherapeutische problemen (FTP’s) zoals onderbehandeling, niet-effectieve behandeling, (potentiële) bijwerking, klinisch relevante contra-indicatie en interactie, onjuiste dosering en problemen bij gebruik en de follow-up.
Expliciete screeningsinstrumenten
In de literatuur zijn daarnaast veel expliciete instrumenten beschreven die behulpzaam kunnen zijn om geneesmiddelen te identificeren die mogelijk gestopt kunnen worden (zie voor een recente systematische review [Thompson 2019, Le Bosquet 2019]). De meeste van deze instrumenten zijn ontwikkeld in het kader van optimalisatie van de farmacotherapie bij (oudere) patiënten met polyfarmacie en een al dan niet korte levensverwachting. Enkele bekende voorbeelden zijn STOPP-START [Knol 2015], STOPPFrail [Lavan 2017], FORTA [Wehling 2016] en LESS-CHRON [Rodríguez-Pérez 2017]. De meeste beschikbare instrumenten zijn bedoeld om de zorgverlener te helpen bij het identificeren van geneesmiddelen die mogelijk gestopt kunnen worden.
De meeste instrumenten hebben op populatieniveau voorspellende waarde voor ongewenste uitkomsten van farmacotherapie (bijvoorbeeld ziekenhuisopnames of verminderde kwaliteit van leven). Ook hebben diverse onderzoeken laten zien dat het gebruik van dergelijke instrumenten leidt tot frequenter stoppen van geneesmiddelen. De evidence voor betere patiëntgebonden uitkomsten na het stoppen van geneesmiddelen op basis van deze instrumenten is echter heel beperkt en bovendien zijn de betreffende onderzoeken van suboptimale kwaliteit.
Instrumenten voor het stoppen van specifieke geneesmiddelengroepen
Er zijn ook instrumenten voor het stoppen van specifieke geneesmiddelengroepen, zoals bloedglucoseverlagende middelen en middelen bij dementie. Deze deprescribing tools beschrijven vooral methoden om te stoppen met de genoemde geneesmiddelen. Praktische informatie is onder andere te vinden op de volgende websites:
- Australië: www.nswtag.org.au/deprescribing-tools;
- Canada: www.deprescribingnetwork.ca/algorithms;
- Tasmanië: www.primaryhealthtas.com.au/resources/deprescribing-resources.
Beslissingsondersteunende systemen
Voor het analyseren van de (inname)complexiteit van het geneesmiddelregime is de Medication Regimen Complexity Index ontwikkeld [George 2004, Wimmer 2015].
Idealiter wordt gebruik gemaakt van elektronische beslissingsondersteunende systemen die gegevens uit het EPD kunnen halen en beoordelen op basis van bijvoorbeeld de genoemde impliciete en expliciete instrumenten [Monteiro 2019].
Er is een aantal onderzoeken gedaan naar de effecten van het gebruik van zulke systemen, zoals de Nederlandse STRIP-assistant [Meulendijk 2015] en PRIMA-eDS [Rieckert 2020]. Deze onderzoeken laten veelal zien dat deze systemen behulpzaam kunnen zijn bij het optimaliseren van polyfarmacie en ook kunnen helpen bij minderen of stoppen van medicatie. De systemen zijn echter nog niet standaard beschikbaar voor koppeling aan de verschillende EPD’s.
Instrumenten om patiënt te betrekken bij besluitvorming
Onderzoeken onder oudere mensen die chronisch geneesmiddelen gebruiken, laten zien dat 80 tot 85% van hen betrokken wil worden bij besluiten over hun medicatie [Kalogianis 2016, Crutzen 2020]. Het is dus belangrijk om samen met de patiënt tot een besluit te komen om medicatie te minderen of te stoppen. Daarbij kunnen keuzehulpen van waarde zijn om de behandelopties en uitkomsten op een rijtje te zetten en persoonlijke doelen helder te krijgen.
In Canada zijn enkele keuzehulpen en patiëntinformatiefolders ontwikkeld om patiënten te informeren over de vooren nadelen van het stoppen met bijvoorbeeld protonpompremmers of glucoseverlagende middelen (deprescribing.org). De keuzehulp voor protonpompremmers is bedoeld om tijdens het consult te gebruiken en is in een voor-naonderzoek bij 12 patiënten getest [Thompson 2018]. Daaruit kwam naar voren dat kennis en realistische verwachtingen toenamen door gebruik te maken van de keuzehulp. Het onderzoek was te beperkt om veranderingen in de besluitvorming vast te kunnen stellen.
In Nederland is enige ervaring opgedaan met een instrument dat bedoeld is om de algemene doelen van een patiënt te bepalen in het kader van een MBO [Fried 2011, Schuling 2013, Van Summeren 2016, Van Summeren 2017]. Deze Outcome Prioritization Tool (OPT) bestaat uit 4 visueel-analoge schalen die elk een algemene gezondheidsuitkomst vertegenwoordigen: levensverlenging, onafhankelijkheid bewaren, pijn verminderen, andere klachten verminderen (figuur 1). Het gebruik wordt kort uitgelegd in een recente review [Stegmann 2019]. Het is online te gebruiken op www.OPTool.nl, alwaar ook een video en instructies zijn te vinden. Uit een onderzoek bij 58 ouderen in Nederland bleek dat de meesten de tool begrijpelijk vonden [Van Summeren 2016]. Uit hetzelfde onderzoek bleek dat de tool zorgverleners hielp beter inzicht te krijgen in de doelen van patiënten. Met name preventieve medicatie werd gestopt [Van Summeren 2017].
Figuur 1 Outcome Prioritization Tool
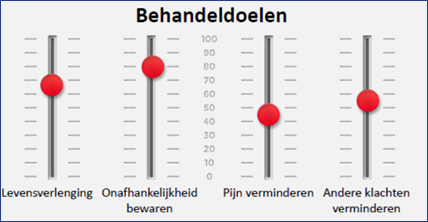
Bron: Stegmann 2019
Verder is in Nederland ervaring opgedaan met zogeheten Goal Attainment Scaling (GAS) bij medicatiebeoordelingen [Verdoorn 2018, Verdoorn 2019]. In dit onderzoek hebben openbaar apothekers en patiënten samen geprobeerd om persoonlijke doelen te stellen als onderdeel van de medicatiebeoordeling. Doelen als verminderen van pijn, verbeteren van mobiliteit en verminderen van het aantal pillen werden door zo’n 10 tot 15% van de mensen gesteld [Verdoorn 2018]. Deze aanpak bleek te leiden tot enige verbetering in kwaliteit van leven en een afname in ervaren gezondheidsklachten met impact op het dagelijks leven, maar niet op het totale aantal gezondheidsklachten [Verdoorn 2019]. Deze aanpak kan helpen bij het prioriteren van de belangrijkste problemen vanuit patiënt perspectief.
Referenties
- Abou J, et al. Barriers and enablers of health care professionals to deprescribing cardiometabolic medication in older patients: a qualitative focus group study. 2021;
- Ailabouni NJ, Nishtala PS, Mangin D, Tordoff JM. Challenges and enablers of deprescribing: a general practitioner perspective. PLoS One. 2016;11:e0151066.
- Ailabouni NJ, Nishtala PS, Mangin D, Tordoff JM. General practitioners’ insight into deprescribing for the multimorbid older individual: a qualitative study. Int J Clin Pract. 2016;70:261-76.
- AlRasheed MM, Alhawassi TM, Alanazi A, Aloudah N, Khurshid F, Alsultan M. Knowledge and willingness of physicians about deprescribing among older patients: a qualitative study. Clin Interv Aging. 2018;13:1401-8.
- Anderson K, Foster M, Freeman C, Luetsch K, Scott I. Negotiating ‘unmeasurable harm and benefit’: perspectives of general practitioners and consultant pharmacists on deprescribing in the primary care setting. Qual Health Res. 2017;27:1936-47.
- Anderson K, Stowasser D, Freeman C, Scott I. Prescriber barriers and enablers to minimising potentially inappropriate medications in adults: a systematic review and thematic synthesis. BMJ Open. 2014;4:e006544.
- Barnett N, Kelly O. Deprescribing: is the law on your side? Eur J Hosp Pharm. 2017;24:21-25.
- Barnett N, Kelly O. Legal implications of deprescribing: a case scenario. Prescriber. 2017;28(3);49-52.
- Bolmsjö BB, Palagyi A, Keay L, Potter J, Lindley RI. Factors influencing deprescribing for residents in advanced care facilities: insights from general practitioners in Australia and Sweden. BMC Fam Pract. 2016;17:152.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al.; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182:e839-42.
- Campins L, Serra-Prat M, Gózalo I, López D, Palomera E, Agustí C, Cabré M; REMEI Group. Randomized controlled trial of an intervention to improve drug appropriateness in community-dwelling polymedicated elderly people. Fam Pract. 2017;34:36-42.
- Campins L, Serra-Prat M, Palomera E, Bolibar I, Martínez MÀ, Gallo P. Reduction of pharmaceutical expenditure by a drug appropriateness intervention in polymedicated elderly subjects in Catalonia (Spain). Gac Sanit. 2019;33:106-11.
- Cane J, Richardson M, Johnston M, Ladha R, Michie S. From lists of behaviour change techniques (BCTs) to structured hierarchies: comparison of two methods of developing a hierarchy of BCTs. Br J Health Psychol. 2015;20:130-50.
- Crutzen S, et al. Older people’s attitudes towards deprescribing cardiometabolic medication. 2021;
- Crutzen S, Baas G, Abou J, Van den Born-Bondt T, Hugtenburg JG, Bouvy ML, et al. Barriers and enablers of older patients to deprescribing of cardiometabolic medication: a focus group study. Front Pharmacol. 2020;11: 1268.
- De Vries TP, Henning RH, Hogerzeil HV, Fresle DA. Guide to good prescribing: a practical manual. Geneva: World Health Organization Action Programme on Essential Drugs. 1994;
- Dills H, Shah K, Messinger-Rapport B, Bradford K, Syed Q. Deprescribing medications for chronic diseases management in primary care settings: a systematic review of randomized controlled trials. J Am Med Dir Assoc. 2018;19:923-35.e2.
- Djatche L, Lee S, Singer D, Hegarty SE, Lombardi M, Maio V. How confident are physicians in deprescribing for the elderly and what barriers prevent deprescribing? J Clin Pharm Ther. 2018;43:550-55.
- Fried TR, Tinetti M, Agostini J, Iannone L, Towle V. Health outcome prioritization to elicit preferences of older persons with multiple health conditions. Patient Educ Couns. 2011;83:278-82.
- Galazzi A, Lusignani M, Chiarelli MT, Mannucci PM, Franchi C, Tettamanti M, Reeve E, Nobili A. Attitudes towards polypharmacy and medication withdrawal among older inpatients in Italy. Int J Clin Pharm. 2016;38:454-61.
- Geijteman EC, Huisman BA, Dees MK, Perez RS, Van der Rijt CC, Van Zuylen L, et al. Medication discontinuation at the end of life: a questionnaire study on physicians’ experiences and opinions. J Palliat Med. 2018;21:1166-70.
- George J, Phun YT, Bailey MJ, Kong DC, Stewart K. Development and validation of the medication regimen complexity index. Ann Pharmacother. 2004;38:1369-76.
- Gillespie RJ, Harrison L, Mullan J. Deprescribing medications for older adults in the primary care context: A mixed studies review. Health Sci Rep. 2018;1:e45.
- Holmes HM, Todd A. The role of patient preferences in deprescribing. Clin Geriatr Med. 2017;33:165-75.
- Iyer S, Naganathan V, McLachlan AJ, Le Couteur DG. Medication withdrawal trials in people aged 65 years and older: a systematic review. Drugs Aging. 2008;25:1021-31.
- Kalogianis MJ, Wimmer BC, Turner JP, Tan EC, Emery T, Robson L, et al. Are residents of aged care facilities willing to have their medications deprescribed? Res Social Adm Pharm. 2016;12:784-8.
- Kalogianis MJ, Wimmer BC, Turner JP, Tan EC, Emery T, Robson L, Reeve E, Hilmer SN, Bell JS. Are residents of aged care facilities willing to have their medications deprescribed? Res Social Adm Pharm. 2016;12:784-8.
- Keijsers, CP. Education in appropriate pharmacotherapy in older patients (thesis). Utrecht: Utrecht University. 2015;
- Kennisinstituut van Medisch Specialisten (KiMS), Medisch Specialistische Richtlijnen 2.0. 2012;
- Kennisinstituut van Medisch Specialisten (KiMS), Leidraad opstellen richtlijnen. 2011;
- KNM, V&VN, KNOV, KNGF, KNMP, NIP, NVZ, NFU, GGZ Nederland, NPCF. Handreiking Verantwoor- delijkheidsverdeling bij samenwerking in de zorg. 2010;
- Knol W, Verduijn MM, Lelie-van der Zande AC, Van Marum RJ, Brouwers JR, Van der Cammen TJ, et al. Onjuist geneesmiddelengebruik bij ouderen opsporen: De herziene STOPP/START criteria. Ned Tijdschr Geneeskd. 2015;159:A8904.
- Kua CH, Mak VSL, Huey Lee SW. Health outcomes of deprescribing interventions among older residents in nursing homes: a systematic review and meta-analysis. J Am Med Dir Assoc. 2019;20:362-72.e11.
- Lavan AH, Gallagher P, Parsons C, O’Mahony D. STOPPFrail (Screening Tool of Older Persons Prescriptions in Frail adults with limited life expectancy): consensus validation. Age Ageing. 2017;46:600-7.
- Le Bosquet K, Barnett N, Minshull J. Deprescribing: practical ways to support person-centred, evidence-based deprescribing. Pharmacy (Basel). 2019;7:129.
- Luymes CH, Van der Kleij RM, Poortvliet RK, De Ruijter W, Reis R, Numans ME. Deprescribing potentially inappropriate preventive cardiovascular medication: barriers and enablers for patients and general practitioners. Ann Pharmacother. 2016;50:446-54.
- Lyu H, Xu T, Brotman D, Mayer-Blackwell B, Cooper M, Daniel M, et al. Overtreatment in the United States. PLoS One. 2017;12:e0181970.
- Mantelli S, Jungo KT, Rozsnyai Z, Reeve E, Luymes CH, Poortvliet RKE, et al. How general practitioners would deprescribe in frail oldest-old with polypharmacy the LESS study. BMC Fam Pract. 2018;19:169.
- Meulendijk MC, Spruit MR, Drenth-van Maanen AC, Numans ME, Brinkkemper S, Jansen PA, et al. Computerized decision support improves medication review effectiveness: an experiment evaluating the STRIP assistant’s usability. Drugs Aging. 2015;32:495-503.
- Michie S, Johnston M, Abraham C, Lawton R, Parker D, Walker A; ‘Psychological Theory’ Group. Making psychological theory useful for implementing evidence basedpractice: a consensus approach. Qual Saf Health Care. 2005;14:26-33.
- Monteiro L, Maricoto T, Solha I, Ribeiro-Vaz I, Martins C, Monteiro-Soares M. Reducing potentially inappropriate prescriptions for older patients using computerized decision support tools: systematic review. J Med Internet Res. 2019;21:e15385.
- NHG, NIV, NVVC. Multidisciplinaire richtlijn Cardiovasculair Risicomanagement. 2019;
- NHG, NVKG. Multidisciplinaire richtlijn Polyfarmacie bij ouderen. 2019;
- NHG, Ephor, KNMP. STOP-START-NL. 0000;
- NHG, V&VN, KNMP. LESA Organisatie van zorg bij chronische medicatie. 2020;
- NHG, Module Medicatiebeoordeling. 2019;
- Nixon MS, Vendelø MT. General practitioners’ decisions about discontinuation of medication: an explorative study. J Health Organ Manag. 2016;30:565-80.
- NVKG, Addendum Polyfarmacie bij ouderen 2e lijn. 2018;
- Page AT, Clifford RM, Potter K, Schwartz D, Etherton-Beer CD. The feasibility and effect of deprescribing in older adults on mortality and health: a systematic review and meta-analysis. Br J Clin Pharmacol. 2016;82:583-623.
- Palagyi A, Keay L, Harper J, Potter J, Lindley RI. Barricades and brickwalls--a qualitative study exploring perceptions of medication use and deprescribing in long-term care. BMC Geriatr. 2016;16:15.
- Parekh N, Schenker Y, Good CB, Neilson L, Shrank WH. Deprescribing in advanced illness: aligning patient, clinician, and health plan goals. J Gen Intern Med. 2019;34:631-3.
- Potter K, Flicker L, Page A, Etherton-Beer C. Deprescribing in frail older people: a randomised controlled trial. PLoS One. 2016;11:e0149984.
- Reeve E, Bell JS, Hilmer SN. Barriers to optimising prescribing and deprescribing in older adults with dementia: a narrative review. Curr Clin Pharmacol. 2015;10:168-77.
- Reeve E, Denig P, Hilmer SN, Ter Meulen R. The ethics of deprescribing in older adults. J Bioeth Inq. 2016;13:581-90.
- Reeve E, Low LF, Hilmer SN. Beliefs and attitudes of older adults and carers about deprescribing of medications: a qualitative focus group study. Br J Gen Pract. 2016;66:e552-60.
- Reeve E, To J, Hendrix I, Shakib S, Roberts MS, Wiese MD. Patient barriers to and enablers of deprescribing: a systematic review. Drugs Aging. 2013;30:793-807.
- Reeve E, Wolff JL, Skehan M, Bayliss EA, Hilmer SN, Boyd CM. Assessment of attitudes toward deprescribing in older medicare beneficiaries in the United States. JAMA Intern Med. 2018;178:1673-80.
- Rieckert A, Reeves D, Altiner A, Drewelow E, Esmail A, Flamm M, et al. Use of an electronic decision support tool to reduce polypharmacy in elderly people with chronic diseases: cluster randomised controlled trial. BMJ. 2020;369:m1822.
- Rodríguez-Pérez A, Alfaro-Lara ER, Albiñana-Perez S, Nieto-Martín MD, Díez-Manglano J, PérezGuerrero C, et al. Novel tool for deprescribing in chronic patients with multimorbidity: List of EvidenceBased Deprescribing for Chronic Patients criteria. Geriatr Gerontol Int. 2017;17:2200-7.
- Schiøtz ML, Frølich A, Jensen AK, Reuther L, Perrild H, Petersen TS, et al. Polypharmacy and medication deprescribing: A survey among multimorbid older adults in Denmark. Pharmacol Res Perspect. 2018;6:e00431.
- Schuling J, Gebben H, Veehof LJ, Haaijer-Ruskamp FM. Deprescribing medication in very elderly patients with multimorbidity, the view of Dutch GPs: A qualitative study. BMC Fam Pract. 2012;13:56.
- Schuling J, Sytema R, Berendsen AJ. Aanpassen medicatie: voorkeur oudere patiënt telt mee. Ned Tijdschr Geneeskd. 2013;157:A6491.
- Scott IA, Anderson K, Freeman CR, Stowasser DA. First do no harm: a real need to deprescribe in older patients. Med J Aust. 2014;201:390-2.
- Scott IA, Hilmer SN, Reeve E, Potter K, Le Couteur D, Rigby D, et al. Reducing inappropriatepolypharmacy: the process of deprescribing. JAMA Intern Med. 2015;175:827-34.
- Sirois C, Ouellet N, Reeve E. Community-dwelling older people’s attitudes towards deprescribing in Canada. Res Social Adm Pharm. 2017;13:864-70.
- Stegmann ME, Festen S, Brandenbarg D, Schuling J, Van Leeuwen B, De Graeff P, et al. Using the Outcome Prioritization Tool (OPT) to assess the preferences of older patients in clinical decision-making: A review. Maturitas. 2019;128:49-52.
- Thillainadesan J, Gnjidic D, Green S, Hilmer SN. Impact of deprescribing interventions in older hospitalised patients on prescribing and clinical outcomes: a systematic review of randomised trials. Drugs Aging. 2018;35:303-19.
- Thio SL, Nam J, Van Driel ML, Dirven T, Blom JW. Effects of discontinuation of chronic medication in primary care: a systematic review of deprescribing trials. Br J Gen Pract. 2018;68:e663-72.
- Thompson W, Farrell B, Welch V, Tugwell P, Way C, Richardson L, et al. Continuation or deprescribing of proton pump inhibitors: A consult patient decision aid. Can Pharm J (Ott). 2018;152:18-22.
- Thompson W, Lundby C, Graabaek T, Nielsen DS, Ryg J, Søndergaard J, et al. Tools for deprescribing in frail older persons and those with limited life expectancy: a systematic review. J Am Geriatr Soc. 2019;67:172-80.
- Tjia J, Givens J. Ethical framework for medication discontinuation in nursing home residents with limited life expectancy. Clin Geriatr Med. 2012;28:255-72.
- Turner JP, Edwards S, Stanners M, Shakib S, Bell JS. What factors are important for deprescribing in Australian long-term care facilities? Perspectives of residents and health professionals. BMJ Open. 2016;6:e009781.
- Ulley J, Harrop D, Ali A, Alton S, Fowler Davis S. Deprescribing interventions and their impact on medication adherence in community-dwelling older adults with polypharmacy: a systematic review. BMC Geriatr. 2019;19:15.
- Van der Linden L, Decoutere L, Walgraeve K, Milisen K, Flamaing J, Spriet I, et al. Combined use of the Rationalization of home medication by an Adjusted STOPP in older Patients (RASP) list and a pharmacist-led medication review in very old inpatients: impact on quality of prescribing and clinical outcome. Drugs Aging. 2017;34:123-33.
- Van Middelaar T, Ivens SD, Van Peet PG, Poortvliet RK, Richard E, Pols AJ, et al. Prescribing and deprescribing antihypertensive medication in older people by Dutch general practitioners: a qualitative study. BMJ Open. 2018;8:e020871.
- Van Summeren JJ, Haaijer-Ruskamp FM, Schuling J. Eliciting preferences of multimorbid elderly adults in family practice using an outcome prioritization tool. J Am Geriatr Soc. 2016;64:e143-8.
- Van Summeren JJ, Schuling J, Haaijer-Ruskamp FM, Denig P. Outcome prioritisation tool for medication review in older patients with multimorbidity: a pilot study in general practice. Br J Gen Pract. 2017;67:e501-6.
- Verdoorn S, Blom J, Vogelzang T, Kwint HF, Gussekloo J, Bouvy ML. The use of goal attainment scaling during clinical medication review in older persons with polypharmacy. Res Social Adm Pharm. 2019;15:1259-65.
- Verdoorn S, Kwint HF, Blom J, Gussekloo J, Bouvy ML. DREAMeR: Drug use Reconsidered in the Elderly using goal Attainment scales during Medication Review; study protocol of a randomised controlled trial. BMC Geriatr. 2018;18:190.
- Wallis KA, Andrews A, Henderson M. Swimming against the tide: primary care physicians’ views on deprescribing in everyday practice. Ann Fam Med. 2017;15:341-6.
- Wehling M, Burkhardt H, Kuhn-Thiel A, Pazan F, Throm C, Weiss C, et al. VALFORTA: a randomised trial to validate the FORTA (Fit fOR The Aged) classification. Age Ageing. 2016;45:262-7.
- Weir K, Nickel B, Naganathan V, Bonner C, McCaffery K, Carter SM, et al. Decision-making preferences and deprescribing: perspectives of older adults and companions about their medicines. J Gerontol B Psychol Sci Soc Sci. 2018;73:e98-107.
- Wimmer BC, Cross AJ, Jokanovic N, Wiese MD, George J, Johnell K, et al. Clinical outcomes associated with medication regimen complexity in older people: a systematic review. J Am Geriatr Soc. 2017;65:747-53.
- Wouters H, Scheper J, Koning H, Brouwer C, Twisk JW, Van der Meer H, et al. Discontinuing inappropriate medication use in nursing home residents: a cluster randomized controlled trial. Ann Intern Med. 2017;167:609-17.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 03-12-2020
Voor het beoordelen van de actualiteit van deze richtlijnmodule is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepalen het Nederlands Huisartsen Genootschap (NHG) en de Nederlandse Vereniging voor Klinische Geriatrie (NVKG) of de module nog actueel is. Er is een onderhoudsplan beschreven waarin de werkgroep een inschatting heeft gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening of update. De geldigheid van de module komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVKG en het NHG zijn regiehouder en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze module deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Module Minderen en stoppen medicatie |
NHG&NVKG |
2020 |
2025 |
5 jaar |
NHG&NVKG |
Niet van toepassing |
- Naam van de module.
- Regiehouder van de module (deze kan verschillen per module en er kunnen meerdere regiehouders zijn).
- Na maximaal 5 jaar.
- Eens per 6 maanden, eens per jaar, eens per 2 jaar of eens per 5 jaar.
- Regievoerende vereniging(en) of (multidisciplinaire) werkgroep die in stand blijft.
- Lopend onderzoek, wijzigingen in vergoeding of organisatie, beschikbaarheid van nieuwe middelen.
Algemene gegevens
De richtlijn is ontwikkeld in samenwerking met:
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KMNP)
- Nederlandse Internisten Vereniging (NIV)
- Nederlandse Vereniging voor Cardiologie (NVVC)
- Nederlandse Vereniging voor Psychiatrie (NVvP)
- Nederlandse Vereniging van Ziekenhuis Apothekers (NVZA)
- Vereniging van Specialisten Ouderengeneeskunde (Verenso).
- Patiëntenfederatie Nederland (PFNL)
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (KiMS) en gefinancierd uit een subsidie van het Ministerie van Volksgezondheid, Welzijn en Sport, een bijdrage van het NHG en een subsidie van de Stichting Kwaliteitsgelden Medisch Specialisten.
Doel en doelgroep
Doel
Het primaire doel van minderen en stoppen van medicatie is het optimaliseren van de medicamenteuze behandeling en daarmee het verbeteren van de kwaliteit van leven, gezondheid en welzijn van de patiënt. Deze module biedt handvatten aan voorschrijvers, apothekers en patiënten om het minderen en stoppen van geneesmiddelen in de dagelijkse praktijk vorm te geven.
Doelgroep
Deze module richt zich primair op de brede populatie van ouderen met polyfarmacie, ongeacht de situatie waarin zij verblijven. De MDR Polyfarmacie bij ouderen hanteert sinds 2019 een leeftijdsgrens van 70 jaar om ‘de oudere patiënt’ te definiëren. Deze leeftijdsgrens is niet absoluut, maar is met name gebruikt om richting te geven aan ondersteunend literatuuronderzoek en inbreng vanuit focusgroepen. Dit laat onverlet dat de principes zoals besproken in deze module ook toepasbaar kunnen zijn bij andere doelgroepen dan ouderen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten waarvoor minderen en stoppen van medicatie relevant is.
De werkgroepsleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijnmodule.
Werkgroep
- dhr. prof. dr. R.J. van Marum, klinisch geriater en klinisch farmacoloog, & bijzonder hoogleraar farmacotherapie bij ouderen, werkzaam in het Jeroen Bosch Ziekenhuis, ‘s-Hertogenbosch en werkzaam
- in het Amsterdam UMC, locatie VUms, Amsterdam. Nederlandse Vereniging voor Klinische Geriatrie (voorzitter).
- dhr. prof. dr. M.A. van Agtmael, internist-infectioloog en klinisch farmacoloog, & hoogleraar farmacotherapieonderwijs, werkzaam in het Amsterdam UMC, locatie VUmc, Amsterdam. Namens Nederlandse Internisten Vereniging (NIV).
- dhr. J. Benedictus, patiëntvertegenwoordiger, werkzaam bij Patiëntenfederatie Nederland, Utrecht. Namens Patiëntenfederatie Nederland (PFNL).
- mw. dr. F. Boersma, specialist ouderengeneeskunde & senior onderzoeker, werkzaam in het UMCG, Groningen. Namens Vereniging van Specialisten Ouderengeneeskunde (Verenso).
- dhr. drs. Th.L.A. Burm, ouderenpsychiater, werkzaam bij GGNet locatie RGC Apeldoorn. Namens Nederlandse Vereniging voor Psychiatrie (NVvP).
- mw. prof. dr. P. Denig, hoogleraar kwaliteit van geneesmiddelgebruik, werkzaam in het UMCG, Groningen.
- dhr. prof. dr. A.C.G. Egberts, ziekenhuisapotheker & hoogleraar klinische farmacie, werkzaam in het UMCU, Utrecht. Namens Nederlandse Vereniging van Ziekenhuis Apothekers (NVZA).
- mw. dr. P.J.M. Elders, huisarts & hoofdonderzoeker afdeling Huisartsgeneeskunde en Ouderengeneeskunde, werkzaam in het Amsterdam UMC, locatie VUmc, Amsterdam. Namens Nederlands Huisartsen Genootschap (NHG).
- dhr. dr. E.C.T. Geijteman, aios interne geneeskunde en klinisch farmacoloog, werkzaam in het Erasmus MC, Rotterdam. Namens Nederlandse Internisten Vereniging (NIV).
- dhr. dr. H.F. Kwint, openbaar apotheker, werkzaam bij Apotheek Stevenshof, Leiden, & onderzoeker SIR Institute for Pharmacy Practice and Policy, Leiden. Namens Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP).
- mw. prof. dr. M. Muller, internist ouderengeneeskunde & hoogleraar cardiovasculaire veroudering, werkzaam in het Amsterdam UMC, locatie VUmc, Amsterdam. Namens Nederlandse Internisten Vereniging (NIV).
- mw. drs. S.E. van Putten-de Wit, huisarts & wetenschappelijk medewerker, werkzaam bij het NHG, Utrecht. Namens Nederlands Huisartsen Genootschap (NHG) (tot april 2019).
- mw. dr. M.A. Verdoorn MSc., openbaar apotheker, werkzaam bij Apotheek Hoogland, Sliedrecht, & onderzoeker SIR Institute for Pharmacy Practice and Policy, Leiden. Namens Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP).
- dhr. drs. R.W. Vingerhoets, klinisch geriater, werkzaam in het Elisabeth-TweeSteden Ziekenhuis, Tilburg. Namens Nederlandse Vereniging voor Klinische Geriatrie (NVKG).
- mw. drs. C.J.H. de Vries, huisarts & wetenschappelijk medewerker, werkzaam bij het NHG, Utrecht. Namens Nederlands Huisartsen Genootschap (NHG) (vanaf april 2019 tot februari 2020).
- mw. A.S.G. van Walraven MSc., openbaar apotheker & wetenschappelijk medewerker, werkzaam bij het NHG, Utrecht. Namens Nederlands Huisartsen Genootschap (NHG) (vanaf februari 2020).
- dhr. dr. J. van Wijngaarden, cardioloog, werkzaam in het Deventer Ziekenhuis, Deventer, Namens Nederlandse Vereniging voor Cardiologie (NVVC).
Met ondersteuning van
- dhr. ir. T.A. van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht.
- A.A. Lamberts MSc., senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht.
- mw. L.H.M. Niesink-Boerboom MSc., literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten.
- mw. drs. M.M. Verduijn, apotheker & senior wetenschappelijk medewerker, Nederlands Huisartsen Genootschap.
Belangenverklaringen
De ‘KNAW-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling‘ (2017) is gevolgd. Alle werkgroepsleden hebben schriftelijk verklaard of ze in de laatste 3 jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Benedictus |
Programmamanager Patiëntenfederatie Nederland (1,0 fte) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
1-9-2018 |
Geen actie |
|
Boersma |
Specialist ouderengeneeskunde, senior onderzoeker UMC Groningen (0,30 fte) Lentis/Team 290: (0,64 fte) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
1-10-2018 |
Geen actie |
|
Burm |
Ouderenpsychiater bij GGnet, Polikliniek Ouderenpsychiatrie, RGC, locatie Apeldoorn (1,0 fte) |
Bestuurslid Afdeling Ouderenpsychiatrie NVvP (onbetaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
4-7-2018 |
Geen actie |
|
De Vries |
Huisarts n.p., wetenschappelijk medewerker, Afdeling Richtlijnontwikkeling en Wetenschap, NHG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
20-8-2019 |
Geen actie |
|
Denig |
Hoogleraar kwaliteit van geneesmiddelgebruik, Afdeling Klinische Farmacie en Farmacologie, Universitair Medisch Centrum Groningen (0,8 fte) |
Geen |
Geen |
Geen |
Ik neem deel aan onderzoek dat gefinancierd wordt door ZonMW, KNMP en EU fondsen. De KNMP is als partij ook betrokken bij de ontwikkeling van de module Deprescribing. (Projecten: DISCARDt; financiering via KNMP) |
Als persoon heb ik geen baat bij bepaalde uitkomsten van het advies. Ik voer onderzoek uit naar mogelijkheden voor, ervaringen met en hulpmiddelen bij Deprescribing, van waaruit ik als extern expert mijn input zal geven. |
Geen |
22-5-2018 |
Geen actie |
|
Egberts |
Ziekenhuisapotheker, UMC Utrecht (0,9 fte) Hoogleraar klinische farmacie, bètafaculteit Universiteit Utrecht (0,1 fte) |
Lid internationale wetenschappelijke adviesraad Zentrum fur psychische Gesundheit, Universität Wurzburg (onbetaald) Bestuurslid SIR Institute for Pharmacy Practice & Policy (onbetaald) Lid kernteam Expertisecentrum Pharmacotherapie bij Ouderen (EPHOR) (onbetaald). Voorzitter stichting KNMP-fondsen (onbetaald). Lid Editorial Board Drug Safety (onbetaald) Plv lid CCMO (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
23-8-2018 |
Geen actie |
|
Elders |
Universitair hoofddocent onderzoekslijn Diabetes, overgewicht, leefstijl en osteoporose, Afdeling Huisartsgeneeskunde en Ouderenzorg, UMC Amsterdam, locatie VUmc (0,64 fte) Waarnemend huisarts (0,25 fte) |
Lid vaste commissie bevolkingsonderzoek van de Gezondheid (betaald) Cursussen osteoporose of diabetes voor verschillende organisaties (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
30-8-2018 |
Geen actie |
|
Geijteman |
Aios interne geneeskunde, Reinier de Graaf gasthuis, Delft tot 1-7-2018 Aios interne geneeskunde, Erasmus MC, Rotterdam vanaf 1-7-2018 (1,0 fte) |
Arts onderzoeker Erasmus MC afdelingen maatschappelijke gezondheidszorg en klinische farmacologie en apotheek interne oncologie |
Geen |
Geen |
ZonMW Medicatiemanagement in de laatste levensfase periode 2013-2016 |
Geen |
Geen |
14-6-2018 |
Geen actie |
|
Kwint |
Directeur/openbaar apotheker, Apotheek Stevenshof, Leiden (0,8 fte) Senior-onderzoeker, SIR Institute for Pharmacy Practice and Policy (0,2 fte) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
13-7-2018 |
Geen actie |
|
Lamberts |
Senior adviseur, Kennisinstituut FMS (0,8 fte) Beleidsmedewerker Kwaliteit, NVKG (0,2 fte) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
2018 |
Geen actie |
|
Muller |
Hoofd Sectie Interne Ouderengeneeskunde, Afdeling Interne Geneeskunde, Hoofd Onderzoeksgroep Cardiovascular Aging, Amsterdam UMC, locatie VUmc (1,0 fte) Visiting professor National lnstitute on Aging |
Lid richtlijncommissie CVRM addendum kwetsbare ouderen (betaald) Presentaties voor NWC over relatie hart-brein, CVRM ouderen (betaald) Werkgroep Diabetes and costs Merck (betaald) Presentatie over diabetes en ouderen, Landelijk Diabetescongres (betaald) Presentatie NVIVG CVRM bij ouderen (bvetaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
29-6-2018 |
Geen actie |
|
Werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Van Agtmael |
Internist-klinisch farmacoloog (0,7 fte), hoogleraar farmacotherapie (0,3 fte), Amsterdam UMC, locatie VUmc |
Voorzitter EACPT education working group Voorzitter Stichting Informatiemanagement infectieziekten Bestuurder Stichting Pscribe) Bestuurder NVKF&B, commissie onderwijszaken (onbetaald) co-opted member EACPT executive committee) Alle functies zijn onbetaald en hebben geen relatie met de farmaceuti- sche industrie |
Geen |
Geen |
Geen |
De uitwerking van het concept deprescribing door deze commissie maakt het uitrollen van deze methode in het VUmc mogelijk makkelijker |
Geen |
4-6-2018 |
Geen actie |
|
Van Marum* |
Klinisch geriater, klinisch farmacoloog, Afdeling Geriatrie, Jeroen Bosch Ziekenhuis, Den Bosch (0,7fte), bijzonder hoogleraar farmacotherapie bij ouderen, Afdeling Huisartsgeneeskunde en Ouderengeneeskunde, Amsterdam UMC, locatie VUmc |
Lid College ter beoordeling Geneesmiddelen (betaald, 0, 16 fte) Lid wetenschappelijke adviesraad BENU Apotheken (vacatie) Lid raad van toezicht zorginstelling Careyn (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
16-7-2018 |
Geen actie |
|
Van Putten |
Wetenschappelijk medewerker, Afdeling Richtlijnontwikkeling en Wetenschap, NHG (0,4 fte) Huisarts (0,2 fte) |
Medisch inhoudelijke nascholing aan verpleegkundig specialisten van een woonzorginstelling voor verstandelijk beperkte mensen (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
16-6-2018 |
Geen actie |
|
Van Walraven |
Apotheker, Wetenschappelijk medewerker Afdeling Richtlijnontwikkeling en Wetenschap, NHG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
9-3-20 |
Geen actie |
|
Van Wijngaarden |
Cardioloog, Deventer ziekenhuis, Deventer (1,0 fte) |
Opleider cardiologie, Werkgroep Opleidingszaken (onbetaald) Concilium Ccardiologicum (onbetaald) Lid/ambassadeur projectgroep medisch specialist 2025 FMS (onbetaald) Lid kamer medisch specialisten capiciteitsorgaan KNMG (onbetaald) |
Geen |
Geen |
Geen |
Ambassadeur Medisch Specialist 2025 |
Geen |
25-7-2018 |
Geen actie |
|
Verdoorn |
Openbaar apotheker, Thorbecke apotheek Sliedrecht (0,4 fte) Onderzoeker/promovendus, SIR Institute for Pharmacy Practice and Policy, Leiden (0,6 fte) |
Geen |
Geen |
Geen |
Mijn werkgever SIR heeft een subsidie ontvangen voor mijn promotieonderzoek over het onderwerp medicatiebeoordelingen van de KNMP en Service Apotheek in de vorm van een unconditional grant. De richtlijn deprescribing heeft qua onderwerp wel te maken met mijn promotieonderzoek. De financierders hebben geen direct belang bij de uitkomsten van de richtlijn. Zij vinden het alleen belangrijk dat deze richtlijn er komt om de apothekers te ondersteunen bij dit onderwerp |
Geen |
Geen |
27-6-2018 |
Geen actie |
|
Verduijn |
Apotheker, senior wetenschappelijk medewerker Afdeling Richtlijnontwikkeling en Wetenschap, NHG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
9-3-20 |
Geen actie |
|
Vingerhoets |
Klinisch geriater, klinisch farmacoloog en medisch manager, Zorgeenheid Geriatrie, Elisabeth-TweeSteden ziekenhuis, Tilburg (1,0 fte) |
Jaarlijks onderwijs voor psychologen in opleiding, Universiteit Tilburg, en voor Nurse practitioners in opleiding, Fontys Hogeschool Tilburg (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
8-6-2018 |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland zitting te laten nemen in de werkgroep. Ook is er een focusgroep met patiënten gehouden. De resultaten van deze focusgroep zijn beschreven in de submodule ‘Belemmerende en bevorderende factoren’. De Patiëntenfederatie Nederland en de seniorenorganisatie KBO-PCOB zijn uitgenodigd voor deelname aan de invitational conference die is georganiseerd in het kader van de knelpunteninventarisatie. Een verslag van deze bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijnmodules. Een verslag van deze bijeenkomst is opgenomen in bijlage 2. De conceptrichtlijnmodules zijn tevens voor commentaar voorgelegd aan KBO-PCOB en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijnmodules in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
De richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport ‘Medisch Specialistische Richtlijnen 2.0‘ van de Orde van Medisch Specialisten (2012). Dit rapport is gebaseerd op het internationaal breed geaccepteerde instrument Appraisal of Guidelines for Research & Evaluation II (AGREE II) [Brouwers 2010]. Voor een stap-voor-stap beschrijving hoe een evidencebased richtlijn tot stand komt, wordt verwezen naar genoemd rapport.
Knelpunteninventarisatie
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Een verslag hiervan is opgenomen in de aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling worden naast (de kwaliteit van) het wetenschappelijke bewijs ook andere belangrijke aspecten meegewogen, zoals de expertise van de werkgroepsleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. Het wetenschappelijke bewijs en het gewicht dat de werkgroep toekent aan de overwegingen bepalen samen de sterkte van de aanbeveling. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg, zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur. Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste submodule.
Commentaar- en autorisatiefase
De richtlijnmodules werden in concept ter commentaar voorgelegd aan de betrokken (wetenschappelijke) verenigingen en (patiënten)organisaties. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werden de richtlijnmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodules zijn aan de deelnemende (wetenschappelijke) verenigingen en (patiënten)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
