Meetinstrumenten comfort
Uitgangsvraag
Welke meetinstrumenten kunnen het best gebruikt worden voor de beoordeling van de mate van comfort bij pre verbale kinderen/neonaten, kinderen, adolescenten en kinderen met neurobiologische ontwikkelingsstoornissen?
Aanbeveling
Wees altijd alert op het comfort van het kind. Zorg voor een holistische benadering van pijn/discomfort. Naast pijn spelen angst/stress en mogelijk nog meer factoren een rol.
Communiceer in principe rechtstreeks met het kind op een zorgzame, duidelijke en behulpzame manier. Gebruik positief taalgebruik en vermijd negatieve suggesties, omdat negatieve woorden zoals pijn en prik tot meer pijn en angst kunnen leiden.
Voor kinderen die een procedure ondergaan: zie richtlijn PSA bij kinderen.
Overweeg de COMFORT-B schaal als meetinstrument om comfort bij verbale kinderen te meten.
Overweeg de bovenstaande aanbevelingen op basis van expert opinion te gebruiken voor de groep pre verbale/neonaten en kinderen met neurobiologische ontwikkelingsstoornissen, bij gebrek aan valide instrumenten.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematische literatuur analyse uitgevoerd naar welke meetinstrumenten het beste gebruikt kunnen worden voor de beoordeling van de mate comfort bij pre verbale kinderen/neonaten, kinderen, adolescenten en kinderen met neurobiologische ontwikkelingsstoornissen (Maaskant, 2016). Er werd literatuur gevonden voor de subgroepen pre verbale kinderen/neonaten, verbale kinderen en kinderen met neurobiologische ontwikkelingsstoornissen.
Pre verbale kinderen/neonaten
In de systematische literatuuranalyse van Maaskant werd de validiteit en betrouwbaarheid van de COMFORT-neo schaal voor het meten van comfort onderzocht voor pre verbale kinderen/neonaten. De bewijskracht werd beoordeeld als zeer laag vanwege de redelijke kwaliteit en indirectheid. Er kunnen dus geen conclusies getrokken worden over de validiteit en betrouwbaarheid van de COMFORT-neo schaal voor het meten van comfort in pre verbale kinderen/neonaten.
Verbale kinderen
In de systematische literatuuranalyse van Maaskant werd de validiteit en betrouwbaarheid van de originele COMFORT schaal en de COMFORT-B schaal voor het meten van comfort onderzocht voor verbale kinderen.
De bewijskracht van de originele COMFORT schaal was laag (voor internal consistency, interrater reliability) tot zeer laag (voor construct validity) vanwege redelijke tot slechte kwaliteit. Dit leidt tot een zeer lage overall bewijskracht voor de validiteit en een lage overall bewijskracht voor de betrouwbaarheid. Dit betekent dat de COMFORT schaal mogelijk een betrouwbaar meetinstrument kan zijn voor het meten van comfort in verbale kinderen.
De bewijskracht van de COMFORT-B schaal was redelijk voor de betrouwbaarheid (interrater reliability) vanwege imprecisie. Dit betekent dat de COMFORT-B schaal mogelijk een betrouwbaar meetinstrument is voor het meten van comfort in verbale kinderen. Over de validiteit van de COMFORT-B schaal kunnen geen conclusies getrokken worden.
Kinderen met neurobiologische ontwikkelingsstoornissen
In de systematische literatuuranalyse van Maaskant werd de validiteit en betrouwbaarheid van de COMFORT-B schaal voor het meten van comfort onderzocht voor kinderen met neurobiologische ontwikkelingsstoornissen. De bewijskracht voor de validiteit en betrouwbaarheid was laag (voor internal consistency) tot zeer laag (voor construct validity and interrater reliability) vanwege de redelijke kwaliteit en indirectheid. De overall bewijskracht voor de validiteit en betrouwbaarheid komt daarmee uit op zeer laag. Er kunnen dus geen conclusies getrokken worden over de validiteit en betrouwbaarheid van de COMFORT-B schaal voor het meten van comfort in kinderen met neurobiologische ontwikkelingsstoornissen.
Ondanks de lage bewijskracht is het meten/vastleggen in welke vorm dan ook essentieel voor goede zorg. De pijnmetingen en pijnbehandeling zou meer moeten aansluiten bij de beleving van het kind en eventueel de ouders. Hiervoor is een veel bredere benadering nodig; voor het kind is namelijk het comfort van belang, waarbij zowel pijn als angst en stress een rol spelen. Omdat het begrip ‘comfort’ vager en abstracter is dan pijn en ook groter is dan pijn, moet het woord pijn niet vervangen worden door comfort, maar als onderdeel gezien worden van een “comfort-benadering”. Dit is een combinatie waarbij pijn, emoties (angst en stress) en omgevingsfactoren een rol spelen. Onderdeel van deze benadering van pijn is om de oorzaak en aangrijpingspunten voor behandeling van de pijnbeleving van het individuele kind goed in kaart te brengen en ook vast te leggen, om op deze manier monitoring en behandeling goed in te kunnen stellen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De belangrijkste doelen voor patiënt en ouders is dat men pijn- en angstvrij is met aandacht voor meerdere stresserende factoren dan alleen pijn en angst.
De voordelen van meten en vastleggen voor de patiënt zijn dat men op basis van valide scores de behandeling/ begeleiding wellicht kan bijsturen. Door met een meetinstrument te werken geef je kinderen ook meer ruimte voor hun eigen stem en controle tijdens de behandeling en daarmee voor samen beslissen. Hoe meer de behandeling is afgestemd op het kind, hoe beter de behandeling verloopt. Mogelijk kan een gedragsdeskundige of pedagogisch medewerker hierbij ondersteuning bieden. Helpend taalgebruik, therapeutische communicatie of focustaal kan ingezet worden om het kind vertrouwen te geven in de behandeling en om het kind zicht prettiger te laten voelen tijdens een procedure, zoals tijdens het inbrengen van een infuus, bloedafname of vaccinatie (Aarts, 2023). Door positief taalgebruik tijdens een ingreep en door afleiding ervaart het kind minder angst, pijn en stress. Door het kind zich te laten focussen op iets anders dan de ingreep kan je ze daar in laten opgaan zodat hun directe omgeving niet meer opmerken. Kinderen zijn daar van nature goed in. Hiervoor kan bijvoorbeeld de folder ‘Hoe kun je je kind helpen tijdens een ingreep’ gebruikt worden van Stichting Kind en Ziekenhuis.
Er zijn in het algemeen geen nadelen te benoemen van het meten van comfort (door middel van een meetinstrument).
Kosten (middelenbeslag)
Het gebruiken van een meetinstrument zal zeer waarschijnlijk geen extra kosten met zich meebrengen. Het kan zelfs kosten besparen als het gebruik leidt tot beter afgestemde zorg op maat. Dit kan op zijn beurt weer preventieve werking hebben op het ontwikkelen van angst(stoornissen) en/of ontwijken van zorg in de toekomst.
Aanvaardbaarheid, haalbaarheid en implementatie
Er wordt op dit moment bij kinderen met pijn niet routinematig gebruik gemaakt van een meetinstrument anders dan alleen voor het meten van pijn. Er zijn weinig tot geen tegenargumenten te geven om een breder meetinstrument niet in te zetten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op dit moment wordt er niet routinematig gebruik gemaakt van een meetinstrument bij pijnlijke interventies. Het gebruiken van een bestaand meetinstrument kent weinig tot geen nadelen. Het kan wel leiden tot optimalisatie van de geboden zorg en maakt ook interventies beter vergelijkbaar met elkaar.
Verbale kinderen
Voor de groep verbale kinderen was de bewijskracht redelijk. Dit betekent dat de COMFORT-B schaal mogelijk een betrouwbaar meetinstrument is voor het meten van comfort in verbale kinderen.
Pre verbale kinderen, neonaten en kinderen met neurobiologische ontwikkelingsstoornissen
Er is geen goed valide meetinstrument gevonden voor comfortmeting bij pediatrische patiënten in alle groepen. Voor het meten van comfort in pre verbale kinderen/neonaten is gekeken naar de COMFORT Neo schaal en bij de groep kinderen met neurobiologische ontwikkelingsstoornissen naar de COMFORT-B schaal. Voor beide kunnen er geen conclusies getrokken worden over de validiteit en betrouwbaarheid. Desalniettemin is het op basis van expert opinion aan te bevelen om Comfort scores af te nemen voor alle groepen.
Onderbouwing
Achtergrond
In de praktijk wordt op dit moment meestal alleen pijn gemeten. Nadeel hiervan is dat pijn eigenlijk een onderdeel is van het bredere begrip discomfort. Daarnaast kan het vragen naar pijn juist leiden tot meer pijn; het zogenaamde nocebo effect (Chooi, 2013).
Het is bekend dat angst de pijnbeleving verergert en dat meer pijn weer kan leiden tot meer angst, zowel bij acute als chronische pijn (Benore, 2015; Cimpean, 2019; McMurtry, 2015). Naast angst kunnen andere factoren de pijnbeleving beïnvloeden; onder andere karakter, stemming, eerdere ervaringen en verwachtingen van de patiënt, maar ook omgevingsfactoren zoals de ruimte in het ziekenhuis, wachttijd of de kenmerken van de zorgverlener (communicatiestijl, kleding) (Biasi, 2001; Kocks, 2010; Linton, 2011)
Recent onderzoek heeft laten zien dat de manier waarop zorgverleners met patiënten communiceren angst en pijn kan beïnvloeden, zowel positief als negatief (Dutt-Gupta, 2007; Lang, 2005; Peerdeman, 2016; Varelmann, 2020). Patiënten geven meer angst en pijn aan, als vooraf een negatieve suggestie wordt gegeven, dit wordt het nocebo effect genoemd. De studie van Varelman beschrijft bijvoorbeeld dat er lagere pijnscores worden gegeven wanneer neutrale woorden worden gebruikt tijdens lokale verdoving ‘’we gaan je een lokale verdoving geven, waardoor het gebied verdoofd wordt en je comfortabel zult zijn tijdens de behandeling’’ dan wanneer je een negatieve suggestie geeft ‘’het voelt als een wespensteek, dit is het ergste deel van de procedure.’’ Deze nocebo effecten worden gemedieerd door verhoogde neuronale activiteit in de anterior cingulate cortex en de hippocampus en zijn ook zichtbaar op functionele MRI (Arrow, 2022).
In de definitie van de International Association for the Study of Pain (IASP) wordt pijn gedefinieerd als een onplezierige, sensorische en emotionele ervaring die geassocieerd is met actuele of potentiële weefselschade, of beschreven wordt in termen van zulke schade (Raja, 2020). Volgens deze definitie kan het woord pijn zelf ook als een negatieve suggestie of nocebo effect gezien worden en onbewust het gevoel of de stemming van het kind of de ouder beïnvloeden. Anders gezegd, door te vragen naar pijn en naar een score voor de pijn zorg je ervoor dat de patiënt (en/of de ouder) gaat focussen op de pijn en dit kan de ervaring en het herstel weer negatief beïnvloeden (Chooi, 2011&2013; Evers, 2018).
Het woord comfort is een complex en breed begrip, en wordt gedefinieerd als een staat van welzijn, zonder onaangenaamheden (fysiek, functioneel en psychologisch) (Kolcaba, 2015). Door het comfort van de patiënt te meten wordt een breder beeld gekregen van het welzijn van de patiënt en wordt daarnaast het nocebo effect van het vragen naar pijn vermeden.
Uiteraard is dan wel een goed gevalideerd instrument nodig het comfort bij kinderen te meten.
Een instrument zou behulpzaam kunnen zijn om te beoordelen of de gekozen benadering de beste is en het kan dienen als tool om verder te kunnen verbeteren of te vergelijken met andere behandelmodaliteiten. Wanneer de patiënt aangeeft niet comfortabel te zijn of zich niet goed te voelen is het uiteraard wel belangrijk om de pijnscore te meten. Deze module richt zich op de vraag welk meetinstrument het best gebruikt kan worden voor de beoordeling van de mate van comfort.
Conclusies / Summary of Findings
1. Preverbal children/neonates (<1 month)
COMFORT-neo
|
Very low GRADE |
It is unclear whether the COMFORT-neo could be a valid and reliable measurement tool (sufficient construct validity, sufficient internal consistency, sufficient interrater reliability) for the assessment of comfort in preverbal children/neonates.
Source: Maaskant, 2016 |
|
No GRADE |
No evidence was found regarding the content validity, criterion validity and measurement error of the COMFORT-neo for the assessment of comfort in preverbal children/neonates. |
2. Verbal children
Original COMFORT scale
|
Very low GRADE |
It is unclear whether the COMFORT scale could be a valid measurement tool (sufficient construct validity) for the assessment of comfort in verbal children.
Source: Maaskant, 2016 |
|
Low GRADE |
The COMFORT scale could possibly be a reliable measurement tool (sufficient internal consistency, sufficient interrater reliability) for the assessment of comfort in verbal children.
Source: Maaskant, 2016 |
|
No GRADE |
No evidence was found regarding the content validity, criterion validity and measurement error of the COMFORT scale for the assessment of comfort in verbal children. |
COMFORT-B
|
Moderate GRADE |
The COMFORT-B scale is probably a reliable measurement tool (sufficient interrater reliability) for the assessment of comfort in verbal children.
Source: Maaskant, 2016 |
|
No GRADE |
No evidence was found regarding the content validity, construct validity, criterion validity, internal consistency and measurement error of the COMFORT-B scale for the assessment of comfort in verbal children. |
3. Children with neurobiological developmental disorders
COMFORT-B
|
Very low GRADE |
It is unclear whether the COMFORT-B could be a valid (insufficient construct validity) and reliable measurement tool (sufficient interrater reliability) for the assessment of comfort in children with neurobiological developmental disorders.
Source: Maaskant, 2016 |
|
Low GRADE |
The COMFORT-B could possibly be a reliable measurement tool (insufficient internal consistency) for the assessment of comfort in children with neurobiological developmental disorders.
Source: Maaskant, 2016 |
|
No GRADE |
No evidence was found regarding the content validity, criterion validity and measurement error of the COMFORT-B scale for the assessment of comfort in children with neurobiological developmental disorders. |
Samenvatting literatuur
Description of studies
Maaskant (2016) performed a systematic review to study the clinimetric properties of the (modified) COMFORT scale in children up to 18 years. Central, CINAHL, Embase, Medline, PsycInfo and Web of Science were searched until 1 December 2014. No language or publication date restrictions were imposed. Studies published as original articles that evaluated one or more clinimetric properties of the original COMFORT scale or any of the modified versions as a tool to measure distress, sedation or pain in children from birth until 18 years of age including premature neonates were included. Studies were excluded if only abstracts were available or if it concerned reviews, guidelines, descriptive studies, editorials or poster publications. In total, 30 studies were included in the review. The COMFORT scale was applied to measure distress in six studies (Ambuel, 1992; Boerlage, 2014; Carnevale and Razack, 2002; Gjerstad, 2008; Van Dijk, 2009; Wielenga, 2004). The population consisted of preverbal children/neonates and verbal children with an age ranging from <1 month to 11 years of age. In addition, one study included children with neurobiological developmental disorders. COnsensus based Standards for the selection of health Measurement INstruments (COSMIN) was used to assess the methodological quality of the included studies. Each item was assessed with poor, fair, good or excellent quality.
Results
1. Preverbal children/neonates (<1 month)
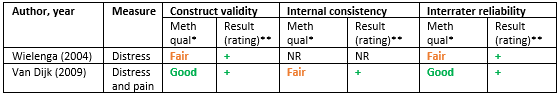
Maaskant (2016) included two studies that applied the COMFORT-neo scale to measure either distress or distress and prolonged pain (respectively Wielenga, 2004; Van Dijk, 2009) (table 2).
1.1. Validity (critical outcome)
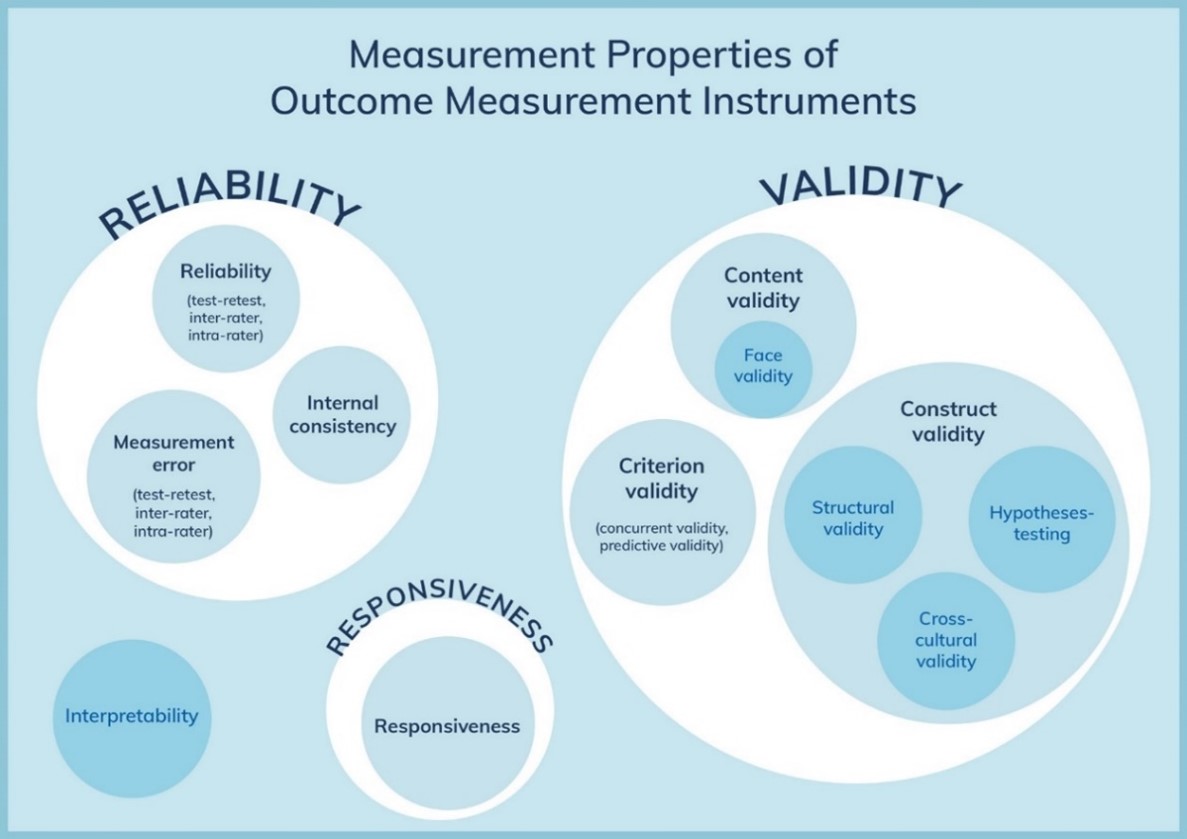
The domain validity refers to the degree to which an outcome measure measures the construct it purports to measure and contains the measurement properties content validity (including face validity), construct validity (including structural validity, hypotheses testing, and cross-cultural validity/measurement invariance) and criterion validity.
1.1.1. Content validity
Not reported.
1.1.2. Construct validity
Wielenga (2004) compared the COMFORT-neo scale with expert opinion for distress. A correlation coefficient of 0.84 was found and at a cut-off point of 20, the sensitivity was 1.00 and the specificity 0.77. The construct validity was assessed as sufficient.
Van Dijk (2009) compared the COMFORT-neo scale with the numeric rating scale observer (NRS-obs) for distress and prolonged pain. A correlation coefficient of 0.83 was found and at the cut-off point of 14, the sensitivity was 0.81 and the specificity 0.90. The construct validity was assessed as sufficient.
Overall, the construct validity was assessed as sufficient.
1.1.3. Criterion validity
Not reported.
1.2. Reliability (important outcome)
The domain reliability refers to the degree to which the measurement is free from measurement error, and it contains the measurement properties internal consistency, reliability, and measurement error.
1.2.1. Internal consistency
Van Dijk (2009) reported a Cronbach’s alpha of 0.88 and 0.84 for not ventilated patients and ventilated patients, respectively, when using the COMFORT-neo for determining distress and pain. The internal consistency was assessed as sufficient.
1.2.2. Reliability
A weighted kappa median of 0.84 was reported by Wielenga (2004) when using the COMFORT-neo for determining distress. The interrater reliability was assessed as sufficient.
Van Dijk (2009) reported a weighted kappa median of 0.79 and the interrater reliability was assessed as sufficient when using the COMFORT-neo for determining distress and pain.
Overall, the interrater reliability was assessed as sufficient.
1.2.3. Measurement error
Not reported.
Table 1. Validity and reliability of the COMFORT-neo
*Risk of bias assessment based on COSMIN risk of bias tool
**Measurement properties of each study could be rated as: sufficient (+), insufficient (–), or indeterminate (?)
2. Verbal children
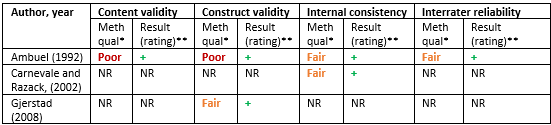
Maaskant (2016) included three studies that applied the original COMFORT scale to assess distress (Ambuel, 1992; Carnevale and Razack, 2002; Gjerstad 2008) (table 3).
2.1. Validity (critical outcome)
2.1.1. Content validity
Not reported.
2.1.2. Construct validity
Ambuel (1992) compared the COMFORT scale with the visual analogue scale observer (VAS-obs). A correlation coefficient of 0.75 was found. Gjerstad (2008) compared it with skin conductance. A correlation coefficient of 0.78 was demonstrated before and during suctioning and a correlation coefficient of 0.68 for during and after suctioning. The overall construct validity was assessed as sufficient.
2.1.3. Criterion validity
Not reported.
2.2. Reliability (important outcome)
2.2.1. Internal consistency
Ambuel (1992) reported a Cronbach’s alpha of 0.90 and Carnevale and Razack (2002) reported an explained variance of in total 99%. The overall internal consistency was assessed as sufficient.
2.2.2. Reliability
Ambuel (1992) reported a correlation coefficient of 0.84 and the interrater reliability was assessed as sufficient.
2.2.3. Measurement error
Not reported.
Table 2. Validity and reliability of the original COMFORT
*Risk of bias assessment based on COSMIN risk of bias tool
**Measurement properties of each study could be rated as: sufficient (+), insufficient (–), or indeterminate (?)
Besides, Maaskant (2016) reported one study that applied the COMFORT-B scale to measure distress (Boerlage 2014) (table 4). Only the interrater reliability was assessed. An Intra Class Correlation of 0.96 was found with a weighted kappa between 0.72 and 0.86. The interrater reliability was assessed as sufficient.
3. Children with neurobiological developmental disorders
Maaskant (2016) included one study that applied the COMFORT-B scale to measure procedural pain in children with Down Syndrome (Valkenburg, 2011).
3.1. Validity (critical outcome)
3.1.1. Content validity
Not reported.
3.1.2. Construct validity
Valkenburg (2011) compared the COMFORT-B scale with the numeric rating scale observer (NRS-obs). A correlation coefficient of 0.45 was found and at the cut-off point of 17, the sensitivity was 0.82 and the specificity 0.92. The construct validity was assessed as insufficient.
3.1.3. Criterion validity
Not reported.
3.2. Reliability (important outcome)
3.2.1. Internal consistency
Valkenburg (2011) reported a Cronbach’s alpha per item of 0.54 to 0.72 and the internal consistency was assessed as insufficient.
3.2.2. Reliability
A median kappa of 0.81 was reported by Valkenburg (2011) and the interrater reliability was assessed as sufficient.
3.2.3. Measurement error
Not reported.
Level of evidence of the literature
The level of evidence for all outcome measures of chronic pain measurements starts at a high GRADE.
1. Preverbal children/neonates (<1 month)
COMFORT-neo
The level of evidence regarding the outcome construct validity was downgraded by three levels because of risk of bias (2 levels, because of fair quality) and indirectness (1 level, because the COMFORT-neo was not only used to measure distress in one study) to VERY LOW.
The level of evidence regarding the outcome internal consistency was downgraded by three levels because of risk of bias (2 levels, because of fair quality) and indirectness (1 level, because the COMFORT-neo was not only used to measure distress in one study) to VERY LOW.
The level of evidence regarding the outcome interrater reliability was downgraded by three levels because of risk of bias (2 levels, because of fair quality) and indirectness (1 level, because the COMFORT-neo was not only used to measure distress in one study) to VERY LOW.
The level of evidence regarding the outcomes content validity, criterion validity and measurement error were not assessed because no studies were included investigating these outcomes.
2. Verbal children
Original COMFORT scale
The level of evidence regarding the outcome construct validity was downgraded by three levels because of risk of bias (3 levels, because of poor quality) to VERY LOW.
The level of evidence regarding the outcome internal consistency was downgraded by two levels because of risk of bias (2 levels, because of fair quality) to LOW.
The level of evidence regarding the outcome interrater reliability was downgraded by two levels because of risk of bias (2 levels, because of fair quality) to LOW.
The level of evidence regarding the outcomes content validity, criterion validity and measurement error were not assessed because no studies were included investigating these outcomes.
COMFORT-B
The level of evidence regarding the outcome interrater reliability was downgraded by one level because of imprecision (1 levels, because there is only one study) to MODERATE.
The level of evidence regarding the outcomes content validity, construct validity, criterion validity, internal consistency, and measurement error were not assessed because no studies were included investigating these outcomes.
3. Children with neurobiological developmental disorders
COMFORT-B
The level of evidence regarding the outcome construct validity was downgraded by four levels because of risk of bias (2 levels, because of fair quality), indirectness (1 level, because the COMFORT-B was used to measure procedural pain) and imprecision (1 level, because there is only one study) to VERY LOW.
The level of evidence regarding the outcome internal consistency was downgraded by two levels because of indirectness (1 level, because the COMFORT-B was used to measure procedural pain) and imprecision (1 level, because there is only one study) to LOW.
The level of evidence regarding the outcome interrater reliability was downgraded by four levels because of risk of bias (2 levels, because of fair quality), indirectness (1 level, because the COMFORT-B was used to measure procedural pain) and imprecision (1 level, because there is only one study) to VERY LOW.
The level of evidence regarding the outcomes content validity, criterion validity and measurement error were not assessed because no studies were included investigating these outcomes.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the validity and reliability of measures for the assessment of comfort in preverbal children/neonates, verbal children, adolescents and children with neurodevelopmental disorders?
| P: |
P1. preverbal children/neonates (<1 month) P2. verbal children P3. adolescents (up to 18 years) P4. children with neurodevelopmental disorders |
| I: | Measures for the assessment of comfort: FLACC, VAS, TROOPS score, COMFORT scale, COMFORT-B, NRS, NISS. OPS, Ramset, POCIS: such as COMFORT neo |
| C: | Other measures for the assessment of comfort |
| O: | Validity, reliability |
Relevant outcome measures
The guideline development group considered validity as a critical outcome measure for decision making; and reliability as an important outcome measure for decision making.
The measurement properties were defined following the taxonomy of the Consensus-based Standards for the selection of health Measurement INstruments (COSMIN) (Mokkink, 2010).
The working group defined the discriminate validity of the screening tools as follows:
AUC < 0.7: poor; 0.7 ≤ AUC < 0.8: acceptable; 0.8 ≤ AUC < 0.9: excellent; AUC ≥ 0.9: outstanding. The working group defined the reliability of the screening tools as follows: ICC < 0.5: poor; 0.5 ≤ ICC < 0.75: moderate; 0.75 ≥ ICC < 0.9: good; ICC≥ 0.9: excellent.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2007 until 6 October 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 648 hits. Studies were selected based on the following criteria:
- Being a systematic review or meta-analysis or observational study (cohort study or case control study)
- Reporting the validity and/or reliability of measures for the assessment of comfort in preverbal children/neonates, verbal children, adolescents and children with neurodevelopmental disorders
Eight studies were initially selected based on title and abstract screening. After reading the full text, six studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One study was included in the analysis of the literature (Maaskant, 2021). The study concerns subgroups 1 (preverbal children/neonates), 2 (verbal children) and 4 (children with neurobiological developmental disorders). No studies were included for subgroup 3 (adolescents). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias table. The COSMIN Risk of Bias tool was used to assess the quality of single studies for each measurement property.
Referenties
- 1 - Aarts LAM, van Geffen GJ, Smedema EAL, Smits RM. Therapeutic communication improves patient comfort during venipuncture in children: a single-blinded intervention study. Eur J Pediatr. 2023 Sep;182(9):3871-3881. doi: 10.1007/s00431-023-05036-7. Epub 2023 Jun 17. PMID: 37330438; PMCID: PMC10570224.
- 2 - Arrow K, Burgoyne LL, Cyna AM. Implications of nocebo in anaesthesia care. Anaesthesia. 2022 Jan;77 Suppl 1:11-20. doi: 10.1111/anae.15601. PMID: 35001386.
- 3 - Benore E, D'Auria A, Banez GA, Worley S, Tang A. The influence of anxiety reduction on clinical response to pediatric chronic pain rehabilitation. Clin J Pain. 2015 May;31(5):375-83. doi: 10.1097/AJP.0000000000000127. PMID: 24977393.
- 4 - Di Blasi Z, Harkness E, Ernst E, Georgiou A, Kleijnen J. Influence of context effects on health outcomes: a systematic review. Lancet. 2001 Mar 10;357(9258):757-62. doi: 10.1016/s0140-6736(00)04169-6. PMID: 11253970.
- 5 - Cimpean A, David D. The mechanisms of pain tolerance and pain-related anxiety in acute pain. Health Psychol Open. 2019 Nov 29;6(2):2055102919865161. doi: 10.1177/2055102919865161. PMID: 31827877; PMCID: PMC6886278.
- 6 - Chooi CS, Nerlekar R, Raju A, Cyna AM. The effects of positive or negative words when assessing postoperative pain. Anaesth Intensive Care. 2011 Jan;39(1):101-6. doi: 10.1177/0310057X1103900117. PMID: 21375099.
- 7 - Chooi CS, White AM, Tan SG, Dowling K, Cyna AM. Pain vs comfort scores after Caesarean section: a randomized trial. Br J Anaesth. 2013 May;110(5):780-7. doi: 10.1093/bja/aes517. Epub 2013 Feb 5. PMID: 23384734.
- 8 - Dutt-Gupta J, Bown T, Cyna AM. Effect of communication on pain during intravenous cannulation: a randomized controlled trial. Br J Anaesth. 2007 Dec;99(6):871-5. doi: 10.1093/bja/aem308. Epub 2007 Oct 30. PMID: 17977860.
- 9 - Evers AWM, Colloca L, Blease C, Annoni M, Atlas LY, Benedetti F, Bingel U, Büchel C, Carvalho C, Colagiuri B, Crum AJ, Enck P, Gaab J, Geers AL, Howick J, Jensen KB, Kirsch I, Meissner K, Napadow V, Peerdeman KJ, Raz A, Rief W, Vase L, Wager TD, Wampold BE, Weimer K, Wiech K, Kaptchuk TJ, Klinger R, Kelley JM. Implications of Placebo and Nocebo Effects for Clinical Practice: Expert Consensus. Psychother Psychosom. 2018;87(4):204-210. doi: 10.1159/000490354. Epub 2018 Jun 12. PMID: 29895014; PMCID: PMC6191882.
- 10 - Kocks JW, Lisman-van Leeuwen Y, Berkelmans PG. De kleren maken de dokter--meer vertrouwen in netter geklede huisarts [Clothing make the doctor--patients have more confidence in a smartly dressed GP]. Ned Tijdschr Geneeskd. 2010;154(51-52):A2898. Dutch. PMID: 21211081.
- 11 - Kolcaba K. Katharine Kolcabas comfort theory. Nursing theories and nursing practice. 2015; 381-392.
- 12 - Lang EV, Hatsiopoulou O, Koch T, Berbaum K, Lutgendorf S, Kettenmann E, Logan H, Kaptchuk TJ. Can words hurt? Patient-provider interactions during invasive procedures. Pain. 2005 Mar;114(1-2):303-9. doi: 10.1016/j.pain.2004.12.028. Epub 2005 Jan 26. PMID: 15733657.
- 13 - Linton SJ, Shaw WS. Impact of psychological factors in the experience of pain. Phys Ther. 2011 May;91(5):700-11. doi: 10.2522/ptj.20100330. Epub 2011 Mar 30. PMID: 21451097.
- 14 - Maaskant J, Raymakers-Janssen P, Veldhoen E, Ista E, Lucas C, Vermeulen H. The clinimetric properties of the COMFORT scale: A systematic review. Eur J Pain. 2016 Nov;20(10):1587-1611. doi: 10.1002/ejp.880. Epub 2016 May 10. PMID: 27161119.
- 15 - McMurtry CM, Pillai Riddell R, Taddio A, Racine N, Asmundson GJ, Noel M, Chambers CT, Shah V; HELPinKids&Adults Team. Far From "Just a Poke": Common Painful Needle Procedures and the Development of Needle Fear. Clin J Pain. 2015 Oct;31(10 Suppl):S3-11. doi: 10.1097/AJP.0000000000000272. PMID: 26352920; PMCID: PMC4900413.
- 16 - Peerdeman KJ, van Laarhoven AIM, Keij SM, Vase L, Rovers MM, Peters ML, Evers AWM. Relieving patients' pain with expectation interventions: a meta-analysis. Pain. 2016 Jun;157(6):1179-1191. doi: 10.1097/j.pain.0000000000000540. PMID: 26945235.
- 17 - Varelmann D, Pancaro C, Cappiello EC, Camann WR. Nocebo-induced hyperalgesia during local anesthetic injection. Anesth Analg. 2010 Mar 1;110(3):868-70. doi: 10.1213/ANE.0b013e3181cc5727. Epub 2009 Dec 30. PMID: 20042440.
- 18 - Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, Keefe FJ, Mogil JS, Ringkamp M, Sluka KA, Song XJ, Stevens B, Sullivan MD, Tutelman PR, Ushida T, Vader K. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain. 2020 Sep 1;161(9):1976-1982. doi: 10.1097/j.pain.0000000000001939. PMID: 32694387; PMCID: PMC7680716.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Maaskant, 2016
[individual study characteristics deduced from [Maaskant, 2016]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
Systematic review
Literature search up to December 2014
A: Ambuel, 1992 B: Boerlage, 2014 C: Carnevale and Razack, 2002 D: Gjerstad, 2008 E: Van Dijk, 2009 F: Wielenga, 2004 G: Valkenburg, 2011
Study design: Not reported
Setting and Country: Not reported
Source of funding and conflicts of interest: Funding sources and conflict of interest not declared, but not reported for individual studies. |
Inclusion criteria SR: - Study aimed to evaluate one or more clinimetric properties of the original COMFORT scale or any of the modified versions, as a tool to measure distress, sedation or pain - The study population consisted of children from birth until 18 years, including premature neonates - The studies were published as original articles
Exclusion criteria SR: Publications were excluded if only abstracts were available, or if it concerned reviews, guidelines, descriptive studies, editorials or poster publications.
30 studies included in systematic review, but seven studies used for literature analysis
Important patient characteristics at baseline: N, mean age A: 37, mean 37.1 months (SD ± 52.7) B: 180, 0.4 years (IQR 0.1–2.0) C: 18, range <1 month – 7 years D: 20, 1 day–11 years E: 174, gestational age range 24–43 weeks F: 19, median gestational age 30 weeks (range 26–36) G: 76 Down syndrome versus 466 control, Down syndrome: median 81 days (range 42–273) Controls: median 119 days (range 22–355) |
Measures for assessment of comfort:
COMFORT scale (or modified scales like COMFORT-Behaviour, COMFORT-neo) |
For construct validity, comparisons were made with either of the following:
|
Endpoint of follow-up: NA
For how many participants were no complete outcome data available? In 21 studies the number of missing items was not mentioned or not explained further.
|
Construct validity A: sufficient B: NR C: NR D: sufficient E: sufficient F: sufficient G: insufficient
Internal consistency A: sufficient B: NR C: sufficient D: NR E: sufficient F: NR G: insufficient
Interrater reliability A: sufficient B: sufficient C: NR D: NR E: sufficient F: sufficient G: sufficient
|
Personal remarks: Only methodological quality presented, no rating with sufficient, insufficient or indeterminate. Concerns about blinding, missing items and sample size.
Construct validity A: poor B: NR C: NR D: fair E: fair F: fair G: fair Internal consistency A: fair B: NR C: fair D: NR E: fair F: NR G: good Interrater reliability A: fair B: good C: NR D: NR E: good F: fair G: fair |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Beltramini A, Galinski M, Chabernaud JL, Ruiz Almenar R, Tsapis M, Goddet NS, Kessous K, Falissard B, Fournier-Charrière E. Pain Assessment in Children Younger Than 8 Years in Out-of-Hospital Emergency Medicine: Reliability and Validity of EVENDOL Score. Pediatr Emerg Care. 2019 Feb;35(2):125-131. doi: 10.1097/PEC.0000000000000953. PMID: 28030517. |
Wrong intervention: pain scale |
|
Boerlage AA, Ista E, Duivenvoorden HJ, de Wildt SN, Tibboel D, van Dijk M. The COMFORT behaviour scale detects clinically meaningful effects of analgesic and sedative treatment. Eur J Pain. 2015 Apr;19(4):473-9. doi: 10.1002/ejp.569. Epub 2014 Jul 29. PMID: 25070754. |
Wrong outcome: sensitivity of change by multilevel regression analysis, responsiveness |
|
van Dijk M, Roofthooft DW, Anand KJ, Guldemond F, de Graaf J, Simons S, de Jager Y, van Goudoever JB, Tibboel D. Taking up the challenge of measuring prolonged pain in (premature) neonates: the COMFORTneo scale seems promising. Clin J Pain. 2009 Sep;25(7):607-16. doi: 10.1097/AJP.0b013e3181a5b52a. PMID: 19692803. |
Included in SR Maaskant (2016) |
|
Boerlage AA, Ista E, de Jong M, Tibboel D, van Dijk M. The COMFORT behavior scale: is a shorter observation period feasible? Pediatr Crit Care Med. 2012 Mar;13(2):e124-5. doi: 10.1097/PCC.0b013e3182192d92. PMID: 21499179. |
Wrong outcome: sensitivity and specificity calculated for COMFORT-B 30-sec and NRS with COMFORT-B 2 min as gold standard, no confidence intervals reported. No AUC (criterion validity) can be calculated |
|
Bosch-Alcaraz A, Falcó-Pegueroles A, Jordan I. A literature review of comfort in the paediatric critical care patient. J Clin Nurs. 2018 Jul;27(13-14):2546-2557. doi: 10.1111/jocn.14345. Epub 2018 Apr 19. PMID: 29516623. |
Wrong study design: overview article |
|
Johansson M, Kokinsky E. The COMFORT behavioural scale and the modified FLACC scale in paediatric intensive care. Nurs Crit Care. 2009 May-Jun;14(3):122-30. doi: 10.1111/j.1478-5153.2009.00323.x. PMID: 19366409. |
Included in SR Maaskant (2016) |
|
Valkenburg AJ, Boerlage AA, Ista E, Duivenvoorden HJ, Tibboel D, van Dijk M. The COMFORT-behavior scale is useful to assess pain and distress in 0- to 3-year-old children with Down syndrome. Pain. 2011 Sep;152(9):2059-2064. doi: 10.1016/j.pain.2011.05.001. Epub 2011 Jun 2. PMID: 21640484. |
Included in SR Maaskant (2016) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-04-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met pijn.
Kernwerkgroep
- Drs. M.A. (Maarten) Mensink, kinderanesthesioloog en pijnarts, werkzaam in het Prinses Máxima Centrum voor Kinderoncologie te Utrecht, NVA, voorzitter
- Drs. J.F. (Joanne) Goorhuis, algemeen kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Dr. F (Felix) Kreier, algemeen kinderarts, werkzaam in het OLVG te Amsterdam, NVK
- Drs. M.S. (Sukru) Genco, algemeen kinderarts, werkzaam in het OLVG te Amsterdam, NVK
- Dr. S.H. (Steven) Renes, anesthesioloog-pijnspecialist, werkzaam in het Radboud UMC te Nijmegen, NVA
- Dr. P. (Petra) Honig-Mazer, psychotherapeut, werkzaam in het Erasmus MC Sophia te Rotterdam, NIP/LVMP
- Drs. M. (Marjorie) de Neef, kinder-IC verpleegkundige, werkzaam in het Amsterdam UMC, V&VN
- R. (Rowy) Uitzinger, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis, tot 1 juni 2022
- E.C. (Esen) Doganer, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis, vanaf 1 juni 2022
Werkgroep
- Drs. L.A.M. (Lonneke) Aarts, algemeen kinderarts, werkzaam in het RadboudUMC Amalia kinderziekenhuis te Nijmegen, NVK
- Prof. dr. W.J.E. (Wim) Tissing, kinderoncoloog, werkzaam in het UMCG te Groningen en Prinses Máxima Centrum te Utrecht, NVK
- Prof. dr. S.N. (Saskia) de Wildt, kinderintensivist, werkzaam in het RadboudUMC te Nijmegen, NVK (tot 9-9-2022)
- Prof. dr. N.M. (Nico) Wulffraat, kinderreumatoloog, werkzaam in het UMC Utrecht te Utrecht, NVK (tot 1-11-2022)
- Drs. P. (Petra) Hissink-Muller, kinderreumatoloog, werkzaam in het Erasmus MC Sophia te Rotterdam (vanaf 1-11-2022)
- Drs. A.M. (Arine) Vlieger, algemeen kinderarts, werkzaam in het St. Antonius Ziekenhuis te Utrecht, NVK
- Dr. S.H.P. (Sinno) Simons, kinderarts-neonatoloog, werkzaam in het Erasmus MC Sophia te Rotterdam, NVK
- Drs. K. (Karina) Elangovan, kinderanesthesioloog, werkzaam in het Erasmus MC Sophia te Rotterdam, NVA
- Dr. C.M.G. (Claudia) Keyzer – Dekker, kinderchirurg, werkzaam in het Erasmus MC Sophia te Rotterdam, NVvH
- A.P. (Annette) van der Kaa, kinderfysiotherapeut, werkzaam in het Erasumc MC Sophia te Rotterdam, NVFK en KNGF
- Drs. A. H. (Agnes) Dommerholt, klinisch psycholoog, werkzaam in het OLVG te Amsterdam, NIP/LVMP (vanaf 1-1-2023)
Klankbordgroep
- Drs. J. (Judig) Blaauw, kinderrevalidatiearts, VRA
- Dr. H. (Hanneke) Bruijnzeel, AIOS, werkzaam in het UMC Utrecht te Utrecht, NVKNO
- Dr. A.M.J.W. (Anne-Marie) Scheepers, ziekenhuisapotheker, werkzaam in het MUMC te Maastricht, NVZA
- Dr. S.A. (Sylvia) Obermann-Borst, ervaringsdeskundige ouder & huisarts-epidemioloog, Care4Neo (voorheen Vereniging van Ouders van Couveusekinderen - VOC)
- Dr. I.H. (Ilse) Zaal-Schuller, arts voor verstandelijk gehandicapten/kaderarts palliatieve zorg i.o., werkzaam bij Prinsenstichting Purmerend/ AmsterdamUMC locatie AMC, NVAVG
- M. (Miep) van der Doelen, CliniClowns Nederland (tot 1-9-2023)
- Dr. E. (Eva) Schaffrath, anesthesioloog, werkzaam in het Maastricht UMC te Maastricht, PROSA Kenniscentrum
- M. (Mirjam) Jansen op de Haar, HME-MO Vereniging Nederland
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst – Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. C. (Cécile) Overman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. D.A.M. (Danique) Middelhuis, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Liza) van Mun, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van (kern)werkgroepleden en klankbordgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Betrokkenen |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Werkgroep |
||||
|
Aarts |
Algemeen kinderarts in het Amalia kinderziekenhuissinds november 2017 |
Interne functies onbetaald: 1. voorzitter Pijn werkgroep Amalia kinderziekenhuis. 2. Verbonden aan werkgroep procedurele sedatie bij kinderen. 3. Implementatie VR in Amalia. |
Onderzoek naar effect comfort talk technieken; maar eenmalige subsidie gekregen voor uitvoer. Geen extern belang qua uitkomst. |
Geen actie |
|
Dommerholt |
Klinisch psycholoog KJ, vakgroep kindergeneeskunde OLVG |
Praktijk Dommerholt, praktijk voor kinder- en jeugdpsychotherapie, supervisie en doceren. (momenteel inactief). Lid vakgroep en medische staf, uitvoeren van psychologische diagnostiek en behandeling van kinderen en hun systeem, opleider. |
Geen |
Geen actie |
|
Elangovan |
Universitair medisch specialist Anesthesioloog-pijnspecialist; ErasmusMC |
Geen |
Geen |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam |
- Eigenaar Genco Med. Beheer B.V. |
Directe belangen bij eigen B.V. maar geen relatie met de bezigheden van de werkgroep. Bijvangst van het project kan zijn: nieuwe kennis en ervaring om binnen onze organisatie te delen. |
Geen actie |
|
Goorhuis |
Algemeen kinderarts - acute kindergeneeskunde |
Geen |
Geen |
Geen actie |
|
Hissink-Muller |
Kinderreumatoloog, Erasmus MC Sophia |
|
|
|
|
Kaa, van der |
Kinderfysiotherapeut |
-Docent Master Kinderfysiotherapie bij Breederode Hogeschool - Universitair docent -Kinderfysiotherapeut 1e lijn (Fysio van der Linden) |
Geen |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg Sophia Kinderziekenhuis ErasmusMC te Rotterdam |
APLS instructeur SSHK Riel, dagvergoeding |
Geen |
Geen actie |
|
Kreier |
Kinderarts OLVG Amsterdam |
Medeauteur en -oprichter “De hamster in je brein” |
Geen |
Geen actie |
|
Mensink* |
kinderanesthesioloog - pijnarts - Prinses Máxima Centrum voor kinderoncologie |
Bestuurslid sectie Pijn&palliatieve geneeskunde NVA - onbetaalde functie |
Geen |
Geen actie |
|
Neef, de |
Verpleegkundig onderzoeker, Kinder IC, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Petra Honig-Mazer |
Erasmus MC - Sophia Kinderziekenhuis Afdeling Kinder- en Jeugdpsychiatrie/psychologie Unit Psychosociale Zorg Psychotherapeut BIG |
Kleine eigen praktijk: Praktijk voor Psychotherapie Honig-Mazer, betaald |
Geen |
Geen actie |
|
Renes |
Anesthesioloog-pijnspecialist Radboudumc |
Kwaliteitsvisitaties Nederlandse Vereniging Anesthesiologie, vacatiegeld |
Geen |
Geen actie |
|
Simons |
Kinderarts - neonatoloog - klinisch farmacoloog (Universitair Medische Specialist) |
Lid geneesmiddelencommissie Erasmus MC (onbetaald) |
Geen |
Geen actie |
|
Tissing |
Kinderoncoloog, Hoogleraar supportive care in de kinderoncologie. 0.6 fte Prinses Maxima Centrum, 0,4 fte UMCG |
PI van onderzoek naar app over invloed van laagdrempelig contact op pijn bij patiënten met kanker. |
Geen |
Geen actie |
|
Uitzinger |
Junior Project manager en beleidsmedewerker Stichting kind en ziekenhuis |
Geen |
Geen |
Geen actie |
|
Vlieger |
1. Kinderarts St Antonius ziekenhuis Nieuwegein |
1. Les geven via Cure en Care en via het Prinses MAxima Centrum op het gebiedvan hypnose bij kinderen. Dit is betaald. |
Aangezien ik les geef op het gebied van non-farmacologische methoden om pijn en angst te voorkomen cq te behandelen kan ik daar theoretisch voordeel van ondervinden als nog meer afdelingen hun personeel geschoold wilt hebben in non-farmacologische technieken. in de richtlijn komen uiteraard geen namen van bedrijven te staan, dus ik verwacht geen evident voordeel. Mijn mede eigenaars van het skills4comfort bedrijf. Overigens loopt dit al heel goed. Iedereen is gelukkig al overtuigd van het belang van het aanleren van positief taalgebruik, afleiden, echt contact maken en een vertrouwensband opbouwen. |
Uitsluiten van besluitvorming voor modules over non-farmacologische pijnbestrijding. Mag wel meelezen. |
|
Wildt, de |
Kinderarts-intensivist, hoogleraar klinische farmacologie, Radboudumc |
Directeur stichting Nederlands Kenniscentrum Farmacotherapie Kinderen (detachering |
Patent: Gebruik van PENK voor nierfunctiebepaling bij kinderen (aangevraagd). Bill and Melinda Gates Foundation: model-informed dosing for pediatric dosing |
Geen actie |
|
Wulffraat |
Hoogleraar kinderimmunologie/reumatologie. UMCU |
Voorzitter (coordinator) ERN-RITA (european reference network (onbetaald). |
Onze vakgroep heeft zeer veel extern gefinancierd onderzoek. Er is geen direct belang van de financier bij deze richtlijn. Onderzoekslijn chronische pijn bij jeugdreuma is puur academisch. Mensink (aangesteld in PMC) is hier de promovendus. Ik ben de promotor. |
Geen actie |
|
Klankbordgroep |
||||
|
Bruijnzeel |
Arts-assistent Keel-, Neus- en Oorheelkunde, UMC Utrecht |
Kerngroep Pediatrie (KNO vereniging) - onbetaald |
Geen |
Geen actie |
|
Scheepers |
ziekenhuisapotheker, Maastricht UMC+ |
Geen |
Geen |
Geen actie |
|
Obermann-Borst |
Coördinator Wetenschap bij Care4Neo 10 u per week |
Coördinator Wetenschap bij Care4Neo 75% betaald/25% vrijwillig verzorgen van bijdrage vanuit patientenperspectief aan wetenschap, richtlijnen en kwaliteit van zorg namens de patientenvereniging voor ouders van en voor kinderen die te vroeg, te klein en/of ziek geboren zijn. |
Geen |
Geen actie |
|
Zaal Schuller |
Arts voor verstandelijk gehandicapten |
Arts voor verstandelijk gehandicapten, betaald. |
Geen |
Geen actie |
|
Schaffrath |
Kinderanesthesioloog MUMC |
Faculty member PROSA (tegen dagvergoeding) |
Geen |
Geen actie |
|
Blaauw |
Kinderrevalidatiearts |
Geen |
Geen |
Geen actie |
|
Bruijn, de (interim) |
Kinderrevalidatiearts bij Revalidatie Friesland |
Lid kwaliteitscommissie VRA (deels betaald, vacatiegeld) |
Geen |
Geen actie |
|
Doelen |
CliniClown bij stichting CliniClowns 28 uur per week |
Bestuurslid theaterproducties Natuurtheater de Kersouwe in Heeswijk Dinther (onbetaald) |
Hoofddoel van mijn bijdrage aan de werkgroep is de kennis en ervaring van CliniClowns in te zetten bij het geven van feedback op de gemaakte stukken. |
Geen actie |
|
Haar, van der |
Freelance consultant Moonshot |
Bestuurslid HME-MO Vereniging Nederland |
Geen |
Geen actie |
* Voorzitter
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Stichting Kind en Ziekenhuis in de kernwerkgroep en Care4Neo, CliniClowns Nederland en HME-MO Vereniging Nederland in de klankbordgroep. Op verschillende momenten is input gevraagd tijdens een invitational conference en bij het opstellen van het raamwerk. Het verslag van de invitational conference [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Meetinstrumenten comfort
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Voorafgaand aan de voorbereidende fase is een invitational conference georganiseerd over herkenning en behandeling van pijn binnen de kindzorg. Een verslag hiervan is opgenomen onder aanverwante producten. Daarnaast werd tijdens de voorbereidende fase van de richtlijn een schriftelijke knelpunteninventarisatie gehouden. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
COSMIN
The COSMIN Risk of Bias tool was used to assess the quality of single studies for each measurement property. Thereby, the worst-score-counts method was used to determine the risk of bias, this means that the lowest rating given in a box determines the final rating, i.e. the quality of the study. The result of each study on a measurement property were rated against the updated criteria for good measurement properties (Table 1). Each result was rated as either sufficient (+), insufficient (–), or indeterminate (?).
Table 1. Criteria for good measurement properties (Mokkink, 2018)
|
Measurement property |
Rating[1] |
Criteria |
|
Structural validity |
+ |
CTT: CFA: CFI or TLI or comparable measure >0.95 OR RMSEA <0.06 OR SRMR <0.08[2] IRT/Rasch: No violation of unidimensionality[3]: CFI or TLI or comparable measure >0.95 OR RMSEA <0.06 OR SRMR <0.08 AND no violation of local independence: residual correlations among the items after controlling for the dominant factor < 0.20 OR Q3's < 0.37 AND no violation of monotonicity: adequate looking graphs OR item scalability >0.30 AND adequate model fit: IRT: χ2 >0.01 Rasch: infit and outfit mean squares ≥ 0.5 and ≤ 1.5 OR Z-standardized values > ‐2 and <2 |
|
? |
CTT: Not all information for ‘+’ reported IRT/Rasch: Model fit not reported |
|
|
- |
Criteria for ‘+’ not met |
|
|
Internal consistency |
+ |
At least low evidence[4] for sufficient structural validity[5] AND Cronbach's alpha(s) ≥ 0.70 for each unidimensional scale or Subscale.[6] |
|
? |
Criteria for “At least low evidence for sufficient structural validity” not met |
|
|
- |
At least low evidence4 for sufficient structural validity5 AND Cronbach’s alpha(s) < 0.70 for each unidimensional scale or Subscale.6 |
|
|
Reliability |
+ |
ICC or weighted Kappa ≥ 0.70 |
|
? |
ICC or weighted Kappa not reported |
|
|
- |
ICC or weighted Kappa < 0.70 |
|
|
Measurement error |
+ |
SDC or LoA < MIC |
|
? |
MIC not defined |
|
|
- |
SDC or LoA > MIC |
|
|
Hypotheses testing for construct validity |
+ |
The result is in accordance with the hypothesis[7] |
|
? |
No hypothesis defined (by the review team) |
|
|
- |
The result is not in accordance with the hypothesis |
|
|
Cross‐cultural validity\measurement invariance |
+ |
No important differences found between group factors (such as age, gender, language) in multiple group factor analysis OR no important DIF for group factors (McFadden's R2 < 0.02) |
|
? |
No multiple group factor analysis OR DIF analysis performed |
|
|
- |
Important differences between group factors OR DIF was found |
|
|
Criterion validity |
+ |
Correlation with gold standard ≥ 0.70 OR AUC ≥ 0.70 |
|
? |
Not all information for ‘+’ reported |
|
|
- |
Correlation with gold standard < 0.70 OR AUC < 0.70 |
|
|
Responsiveness |
+ |
The result is in accordance with the hypothesis OR AUC ≥ 0.70 |
|
? |
No hypothesis defined (by the review team) |
|
|
- |
The result is not in accordance with the hypothesis OR AUC < 0.70 |
|
|
AUC: area under the curve, CFA: confirmatory factor analysis, CFI: comparative fit index, CTT: classical test theory, DIF: differential item functioning, ICC: intraclass correlation coefficient, IRT: item response theory, LoA: limits of agreement, MIC: minimal important change, RMSEA: Root Mean Square Error of Approximation, SEM: Standard Error of Measurement, SDC: smallest detectable change, SRMR: Standardized Root Mean Residuals, TLI = Tucker‐Lewis Index |
||
[1] “+” = sufficient, ” –“ = insufficient, “?” = indeterminate
[2] To rate the quality of the summary score, the factor structures should be equal across studies
[3] unidimensionality refers to a factor analysis per subscale, while structural validity refers to a factor analysis of a (multidimensional) patient‐reported outcome measure
[4] As defined by grading the evidence according to the GRADE approach
[5] This evidence may come from different studies
[6] The criteria ‘Cronbach alpha < 0.95’ was deleted, as this is relevant in the development phase of a PROM and not when evaluating an existing PROM.
[7] The results of all studies should be taken together and it should then be decided if 75% of the results are in accordance with the hypotheses
The level of evidence of the literature was evaluated as described in the COSMIN user manual for systematic reviews of patient-reported outcome measures (Mokkink, 2018). The following four factors were taken into account: (1) risk of bias (i.e. the methodological quality of the studies), (2) inconsistency (i.e. unexplained inconsistency of results across studies), (3) imprecision (i.e. total sample size of the available studies), and (4) indirectness (i.e. evidence from different populations than the population of interest in the review). The quality of evidence could be downgraded with one level (e.g. from high to moderate evidence) if there is serious risk of bias, with two levels (e.g. from high to low) if there is very serious risk of bias, or with three levels (i.e. from high to very low) if there is extremely risk of bias. The quality of the evidence could be downgraded with one or two levels for inconsistency, imprecision (-1 if total N=50-100; -2 if total N<50) and indirectness.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J [corrected to Schünemann, Holger J]. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.