Farmacologische pijnbestrijding bij somatische/ nociceptieve pijn
Uitgangsvraag
Wat is de meest effectieve farmacologische pijnbestrijding bij kinderen met somatische/ nociceptieve pijn?
Aanbeveling
Aanbeveling-1
Gebruik multimodale analgesie (volgens de WHO pijnladder) zo snel mogelijk bij nociceptieve pijn bij kinderen en gebruik daarbij helpend taalgebruik om het effect van de behandeling te optimaliseren.
Aanbeveling -2
Schrijf opioïden slechts voor enkele dagen voor alleen bij kinderen met ernstige nociceptieve pijn en licht ouders(s)/verzorger(s) en kinderen goed in over effecten en bijwerkingen van opiaten. Breng de huisarts op de hoogte van dit voorschrift.
Aanbeveling-3
Informeer ouder(s)/verzorger(s) en kinderenover de verschillende pijnstillers om oligoanalgesie en chronische pijn bij kinderen te vermijden.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek gedaan naar het effect van multimodale vs unimodale farmacologische pijnbehandeling bij somatisch nociceptieve pijn bij kinderen. Hieruit kwamen vijf studies die relevante uitkomstmaten over verandering in pijn rapporteerden. De studies gebruikten verschillende medicaties en combinaties van medicatie. Over de uitkomstmaten functioneren, kwaliteit van leven, stress/distress en angst is geen literatuur gevonden.
Vier van de vijf studies rapporteerden de verandering in pijn binnen twee uur na toediening van medicatie; de laatste studies rapporteerde verandering in pijn over drie dagen na bezoek aan de eerste hulp. Maar één studie liet maar op één moment een verschil zien tussen de interventie en de controlegroepen die hier bestonden uit ibuprofen en orale morfine versus alleen ibuprofen. De auteurs gaven echter aan dat deze uitkomst voorzichtig moet worden geïnterpreteerd vanwege de hoge uitval van meer dan 50%. Het is dus op dit moment niet mogelijk om op basis van de literatuur te zeggen dat een bepaald medicament of een combinatie van medicamenten de voorkeur geniet bij het behandelen van somatisch nociceptieve pijn bij kinderen.
Ondanks dit gebrek aan bewijs raden wij aan om multimodale analgesie te gebruiken bij nociceptieve pijn vanwege de opioïde besparende werking hiervan (Palmer, 2016). Dit kan op farmacologische basis maar ook op non farmacologische basis.
Hier focussen we ons op de farmacologische analgesie bij kinderen. In de perioperatieve setting bij kinderen en volwassenen wordt multimodale analgesie aangeraden door de verschillende anesthesiologische verenigingen op basis van uitgebreide literatuur (o.a. Wong, 2013).
Zoals hierboven beschreven wordt de WHO pijnladder gebruikt voor acute nociceptieve pijn. In de eerste stap wordt geadviseerd om paracetamol en/of NSAIDs voor te schrijven zoals in bovenstaande artikelen. Paracetamol geeft nagenoeg geen bijwerkingen maar er is dosis aanpassing nodig bij leverfalen. De biologische beschikbaarheid van paracetamol is beter in orale en intraveneuze toediening dan via zetpillen (60%).
In eerdere onderzoeken is al naar voren gekomen dat NSAIDS goed effect heeft op musculoskeletale schade. De bijwerkingen van NSAIDS zijn voornamelijk gastro-intestinale en renale van aard en moet men voorzichtig zijn bij nierfalen en nieraandoeningen. Aangeraden wordt om een maagbeschermer voor te schrijven bij langdurige gebruik van NSAID’s.
Bij onvoldoende pijnstilling zijn de stappen 2 en 3 van de WHO pijnladder een logische keuze. Hierin wordt aangeraden naast de paracetamol en NSAID’s te starten met de zwakopiaten (codeïne, tramadol) of bij ernstige pijn stap 3 te starten met de sterke opiaten. De toevoeging van codeïne aan ibuprofen laat geen verbetering op de pijnscore zien en zelfs oxycodon als orale preparaat lijkt geen meerwaarde te hebben boven ibuprofen alleen (Koller, 2007; Poonai 2014), Hierbij moet wel bedacht zijn dat de kwaliteit van het onderzoeken matig waren en met kleine groepen. Ook Lemay (2018) laat onvoldoende pijnstilling zien in de combinatie morfine - ibuprofen in de OUCHtrail. Er werden weinig bijwerkingen gezien bij oxycodon gebruik. Ondanks het tekort aan bewijsvoering bij kinderen voor de juiste behandeling voor deze patiëntengroep heeft de voorkeur om volgens het WHO pijnladder te behandelen.
Bij tramadol en codeïne is pharmacogenetica van belang. Tramadol en codeïne behoren tot de groep medicamenten die afgebroken worden door het gen CYP2D6P. Door verschil in genexpressie heeft het gen CYP2D6P verschillende werkingen bij patiënten.
Bij sommigen (5-10%) is het gen inactief waardoor tramadol en codeïne niet worden afgebroken tot het actieve metabolieten waardoor er verminderd pijnstilling optreedt (=poor metabolizers). Bij 90-95% van het Kaukasisch ras worden tramadol en codeïne normaal afgebroken tot actieve metabolieten (extensive metabolizers) en bij de ultra extensive metabolizers (2-3%) worden deze zo snel afgebroken dat er intoxicatie kan optreden door de hoge hoeveelheid actieve metabolieten.
Naar aanleiding van enkele fatale casuïstiek door respiratoire depressie bij codeïne gebruik wordt codeïne afgeraden voor kinderen onder de 12 jaar bij acute pijn en na adenotonsillectomie. Codeïne wordt alleen nog aangeraden met de laagste dosering bij paracetamol en NSAIDS intolerantie onder strikte bewaking. Tramadol is een goed alternatief als pijnstiller.
Bij ernstige nociceptieve pijn met weinig effect van paracetamol, NSAID’s en zwak opiaten kan gestart worden met de sterkere opiaat morfine. Dit kan voor een enkele dagen voorgeschreven worden waarna de ernstige pijn meestal verminderd is en er gestopt kan worden met deze opiaat en verder gegaan kan worden met paracetamol en de NSAID’s. Morfine heeft een uitgebreid bijwerkingsprofiel met onder andere bij jonge kinderen respiratoire depressie, urineretentie en vertraagde darmmotiliteit waar elke voorschrijver rekening mee moet houden. Elk ziekenhuis heeft al protocollen voor bewaking van kinderen met morfine gebruik.
De laatste 10 jaar is er veel onderzoek gedaan naar intranasale toediening van pijnstillers zoals fentanyl en esketamine bij kinderen bij acute ernstige nociceptieve pijn in de prehospitale, klinische setting en bij korte pijnlijke procedures. Hoewel het niet binnen de scope van de onderzoeksvraag valt, is het wel relevant dit hier te benoemen. Het middel wordt direct opgenomen door de nasale mucosa en wordt door het omzeilen van het first pass effect niet meteen afgebroken (Prescott, 2023). Het voordeel van deze toedieningsvorm is dat kinderen geen intraveneuze of intramusculaire toegang nodig hebben en binnen enkele minuten pijnstilling ervaren in tegenstelling tot orale of rectale toediening. Ook wordt deze toediening niet als vervelend ervaren door de kinderen zelf in tegenstelling tot de intramusculaire en intraveneuze toediening. Mogelijke nadelen zijn: beperkt in de hoeveelheid die je kan toedienen via de neus en verslavingsgevoeligheid. De doseringen zijn geformuleerd in het kinderformularium.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het belangrijkste doel is om de pijn te verminderen tot milde acceptabele pijn. Dit geldt zowel voor volwassenen als voor kinderen. Uit diverse onderzoeken komt naar voren dat kleine kinderen (en kinderen met een verstandelijke beperking) te weinig pijnstilling krijgen en ondergedoseerd worden (Noble, 2020; Karreman, 2016; Alexander, 2003). Dit kan verschillende oorzaken hebben. Het gebruik van verschillende pijnscores voor de verschillende leeftijden kan een drempel zijn zodat pijnscores minder vaak worden afgenomen. Een andere oorzaak kan zijn dan ouders terughoudend zijn in het geven van pijnstilling aan hun kinderen door onvoldoende kennis. Door oligoanalgesie (onderbehandeling van pijn) kunnen kinderen met ernstige acute nociceptieve pijn chronisch pijn ontwikkelen (McGreevy, 2011; Sinatra, 2010). Bij kinderen boven de 13 jaar ziet men dat kinderen vaker zelf om pijnstillers vragen ondanks terughoudendheid van hun ouders (Gagliani, 2018).
Kosten (middelenbeslag)
De kosten voor de diverse middelen van de WHO pijnladder zijn laag doordat deze middelen al langer bestaan en bij opiaten wordt dit maar kort gebruikt. De gezondheidskosten worden aanzienlijk als de acute ernstige nociceptieve pijn niet goed wordt behandeld en patiënten chronische pijn ontwikkelen.
Aanvaardbaarheid, haalbaarheid en implementatie
De bovengenoemde middelen zijn zeer veelvuldig gebruikte middelen die geen aanvaardbaarheid of haalbaarheid of implementatie meer behoeven in de preklinische als klinische setting.
Rationale van aanbeveling-1: weging van argumenten voor en tegen de interventies
Zoals hierboven beschreven wordt aanbevolen om de WHO pijn ladder te gebruiken bij nociceptieve pijn met als eerste stap paracetamol en/of NSAID’s. Bij onvoldoende werking van deze middelen en te hoge pijnscores wordt aanbevolen om in de tweede stap tramadol voor te schrijven. Bij ernstige pijn wordt aanbevolen om morfine te starten in de klinische setting ondanks gebrek aan bewijsvoering. Geadviseerd wordt om zo snel mogelijk pijnstilling te starten bij acute nociceptieve pijn om oligoanalgesie en chronische pijn te vermijden. Gebruik daarbij helpend taalgebruik om het effect van de behandeling te optimaliseren (zie ook module Non-farmacologische pijnbestrijding).
Rationale van aanbeveling-2: weging van argumenten voor en tegen de interventies
Bij het voorschrijven van opiaten voor kinderen is van belang dat dit slechts voor enkele dagen wordt voorgeschreven. Ernstige nociceptieve pijn houdt vaak maar een paar dagen aan waardoor er geen de noodzaak is om opiaten langer voor te schrijven en breng de huisarts op de hoogte van het genomen pijnbeleid.
Rationale van aanbeveling-3: weging van argumenten voor en tegen de interventies
Kleine kinderen en mentaal geretardeerde kinderen worden tot nu toe vaak onderbehandeld voor hun nociceptieve pijn (Noble, 2020; Karreman, 2016; Alexander, 2003). Dit kan verschillende oorzaken hebben waarvan het atypisch uiten van pijn, diagnostic overshadowing en terughoudendheid van de ouders in het geven van pijnstillers voor hun kinderen oorzaken kunnen zijn. Door onder andere ouders goed te informeren over de verschillende pijnstillers is een slag te slaan in het adequate behandelen van pijn bij kinderen.
Onderbouwing
Achtergrond
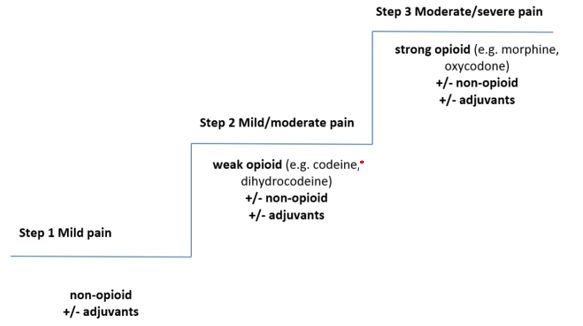
The most common type of acute pain is nociceptive pain. Examples of nociceptive pain are postoperative pain, pain due to trauma and pain during invasive interventions. The WHO pain ladder clearly indicates what to do in case of mild pain using paracetamol and NSAIDS (see figure 1). Therefore, for monotherapy no literature search was performed (good practice statement). Mild nociceptive pain is pain that is acceptable with an NRS 1-3. Moderate pain is unacceptable and limiting pain with NRS 4-7 and severe pain is NRS 8-10, which requires immediate action to relieve the pain. In these last two groups, multimodal pharmacological pain control is applied, which includes paracetamol together with NSAIDs (except in the case of contraindications), if needed in combination with opioids. The goal of this multimodal pain management is to obtain adequate analgesia by administering analgesics with different mechanisms of action. This results in improved effectiveness, fewer side effects and less opiate use. The question is which combination of pain relief is most effective for moderate and severe nociceptive pain. For dosages we refer to the Kinderformularium.
Figure 1. WHO pain ladder (source: https://www.medicineslearningportal.org/2016/01/palliative-care-who-pain-ladder.html). * Codeine is strongly adviced against for children by the Food and Drug Administration (FDA)
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of multimodal pain management (ibuprofen+oxycodone/codeine/morphine, or paracetamol+codeine) on pain when compared with unimodal pain management (ibuprofen) in children with somatic nociceptive pain.
Source: Koller, 2007; Drendel, 2009; Friday, 2009; Le May, 2013; Le May, 2017 |
|
No GRADE |
No evidence was found regarding the effect of multimodal pain management on functioning when compared with unimodal pain management in children with somatic nociceptive pain.
Source: - |
|
No GRADE |
No evidence was found regarding the effect of multimodal pain management on quality of life when compared with unimodal pain management in children with somatic nociceptive pain.
Source: - |
|
No GRADE |
No evidence was found regarding the effect of multimodal pain management on stress/distress when compared with unimodal pain management in children with somatic nociceptive pain.
Source: - |
|
No GRADE |
No evidence was found regarding the effect of multimodal pain management on anxiety when compared with unimodal pain management in children with somatic nociceptive pain.
Source: - |
Samenvatting literatuur
Description of studies
This literature analysis is based on the systematic review of Parri (2020) and expanded on with additional studies not included in the systematic review of Parri.
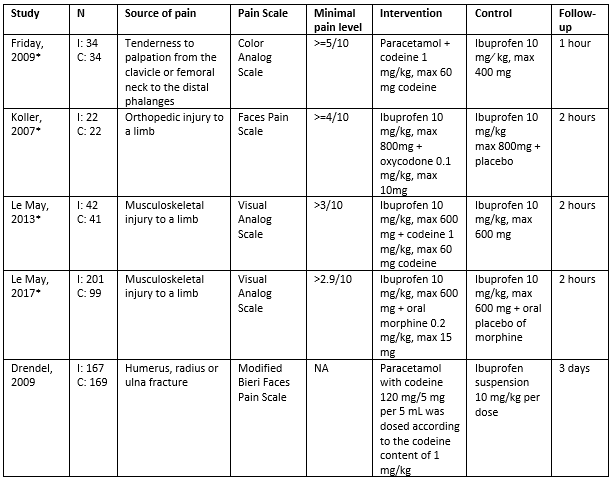
Parri (2020) performed a systematic review that aimed to evaluate the efficacy of ibuprofen in relieving musculoskeletal post-traumatic pain in children in the emergency department (ED). Randomized controlled trials (RCTs) on pharmacological interventions in children and adolescents under 19 years of age with musculoskeletal injuries were included. Studies related to fracture reduction or other interventions were excluded, as were studies related to musculoskeletal injuries associated with inflammatory diseases or other systemic conditions. Four out of the six studies included in this systematic review were relevant for this literature analysis and only these will be used for this literature analysis (Friday, 2009; Koller, 2007; Le May, 2013; Le May, 2017). Two of the studies included by Parri were investigating another comparison then defined in the PICO, and therefore not included in our literature analysis. The main study characteristics of the included studies are listed in Table 1.
Drendel (2009) performed a RCT that evaluated the effect of acetaminophen with codeine (1 mg/kg/dose) versus ibuprofen (10 mg/kg) on 336 children between four and eighteen years old who presented with acute arm fracture pain at the ED. Children in the intervention group were on average 8.2 years old (range 4.2 to 14.9) and 49.1% male, whereas children in the control group were on average 7.4 years old (range 4.0 to 17.9) and 53.9% male. The main outcomes were a reduction in pain in the first three days after discharge from the ED.
Table 1. Study Characteristics
* Data was collected from Parri (2020) where possible and supplemented with data from the original paper when needed
Results
Friday (2009) reported the pain measured by the Color Analog Scale (CAS) at baseline and at 20, 40, and 60 minutes after administration. A difference in mean pain change relative to the intervention was reported as the main outcome. Twenty minutes after administration, a mean pain change between the intervention and control group of -0.6 (95% CI: -1.5 to 0.3) was reported. After 40 minutes, a change of -0.4 (95% CI: -1.4 to 0.6) was reported. Lastly, after 60 minutes, a change of 0.2 (95% CI: -0.8 to 1.2) was reported. None of the mean pain changes were statistically significant.
Koller (2007) reported the pain measured by the Faces Pain Scale at baseline and after 30, 60, 90 and 120 minutes. The data was only reported in a graph from where it was impossible to extract numerical data. The only result that was reported was that all groups their scores drop over time, with a mean change of 4.2 over the two-hour study period.
Le May (2013) reported pain measured by the Visual Analog Scale at baseline and at 60, 90, and 120 minutes after administration. A difference in mean pain change relative to the intervention was reported as the main outcome. After 60 minutes, a mean change of 0.2 (95% CI: -0.8 to 1.2) was reported. After 90 minutes, a mean change of -0.1 (95% CI: -1.3 to 1.0) was reported. Lastly, after 120 minutes, a mean change of -0.3 (95% CI: -1.7 to 1.1) was reported. No changes between the intervention and control groups were reported.
Le May (2017) reported the pain measured by the Visual Analog Scale at baseline and at 30, 60, 90 and 120 minutes after administration. The difference between baseline and each timepoint per group was reported. After 30 minutes, the intervention group reported a mean change of -12.8 (95% CI: -15.4 to -10.2) whereas the control group reported a mean change of -12.9 (-16.5 to -9.2). After 60 minutes, the intervention group reported a mean change of -18.7 (-21.9 to -16.6), compared to the control group reported a mean change of -18.6 (-22.9 to -14.2). After 90 minutes, the intervention reported a mean change of -23.6 (95% CI: -27.5 to -19.7), whereas the control group reported a mean change of -23.1 (95% CI: -28.3 to -18.0). Lastly, after 120 minutes, the intervention group reported a mean change of -20.9 (95% CI: -25.7 to -16.0) compared to the control group which reported a mean change of -27.1 (95% CI: -33.1 to -21.1), which was shown to be a statistically significant difference. We calculated mean differences for both 60 minutes and 120 minutes to compare with the other studies. For 60 minutes, a mean difference of 0.1 (95% CI: -0.4 to 0.6) was calculated. For 120 minutes a mean difference of -6.2 (95% CI: -7.1 to 5.3) was calculated.
Drendel (2009) reported the pain measured by the Modified Biere Faces Pain Scale measured at waking, at bedtime, and 1 hour before and after taking the medication for a total of three days. Daily and total median score, maximum score, and minimum score were analysed. The total mean pain scores for day 0 to day 3 was 1.6 in the intervention group and 1.6 in the control group, revealing no clinical or statistical difference in the total mean pain scores between the two groups. Overall daily maximum pain scores and overall minimum pain scores also showed no differences between the two groups, nor did comparing pain scores at each daily recorded time. Finally, the median reduction in pain score after use of ibuprofen was 2.0 compared with a median reduction of pain score of 1.5 after acetaminophen with codeine, which was not clinically or statistically significant different between the two groups.
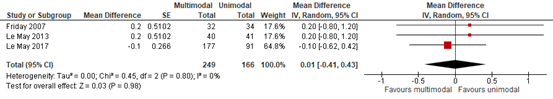
Three studies reported data at a time period of 60 minutes post administration, whereby a forest plot could be made (figure 2). No difference was found between the multimodal and unimodal treatment, with a mean difference of 0.01 (95% CI -0.41 to 0.43).
Figure 2. Forest plot of mean difference in pain reduction for multimodal vs unimodal pain management
Level of evidence of the literature
The level of evidence regarding the outcome measure pain was downgraded by three levels because of study limitations (risk of bias, -1); and low number of included patients (imprecision, -2).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of multimodal pharmacological pain management (compared to placebo and other pain medication) in children with moderate or severe somatic/nociceptive pain?
| P: | Children (until the age of 18 years old) with moderate or severe somatic/nociceptive pain (as per the WHO pain ladder) |
| I: | Multimodal pharmacological pain management: NSAID and/or paracetamol + additional pain medication (e.g. opioids, clodinine, esketamine) |
| C: |
NSAID and/or paracetamol (or a different type of pharmacological pain management) |
| O: | pain, functioning, quality of life, stress/distress, anxiety |
Relevant outcome measures
The guideline development group considered pain as a critical outcome measure for decision making; and functioning, quality of life, stress/distress, and anxiety as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined one point difference on the VAS scale (Voepel-Lewis, 2011) or 10% difference on a pain scale as a minimal clinically (patient) important difference for pain prevention and reduction.
For other continuous outcome measures, the working group defined a difference of 0.5 standard deviation (SD) as clinically relevant.
For dichotomic outcome measures, the working group used the GRADE default limits as limits for clinical decision making, which are defined as a risk ratio (RR) of >1.25 and <0.8 as clinically relevant.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until November 15th, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 598 hits. Studies were selected based on the following criteria: systematic review or meta-analysis, RCT or other comparative research (such as case-control or cohort studies). Seventeen studies were initially selected based on title and abstract screening. After reading the full text, thirteen studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included.
Results
Four studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The individual studies that were included from Parri are described in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- 1 - Alexander J, Manno M. Underuse of analgesia in very young pediatric patients with isolated painful injuries. Ann Emerg Med. 2003 May;41(5):617-22. doi: 10.1067/mem.2003.138. PMID: 12712027.
- 2 - Drendel AL, Gorelick MH, Weisman SJ, Lyon R, Brousseau DC, Kim MK. A randomized clinical trial of ibuprofen versus acetaminophen with codeine for acute pediatric arm fracture pain. Ann Emerg Med. 2009 Oct;54(4):553-60. doi: 10.1016/j.annemergmed.2009.06.005. Epub 2009 Aug 19. PMID: 19692147.
- 3 - Friday JH, Kanegaye JT, McCaslin I, Zheng A, Harley JR. Ibuprofen provides analgesia equivalent to acetaminophen-codeine in the treatment of acute pain in children with extremity injuries: a randomized clinical trial. Acad Emerg Med. 2009 Aug;16(8):711-6. doi: 10.1111/j.1553-2712.2009.00471.x. Epub 2009 Jul 14. PMID: 19624576.
- 4 - Gaglani A, Gross T. Pediatric Pain Management. Emergency medicine clinics of North America. 2018, 36(2), 323-334. https://doi.org/10.1016/j.emc.2017.12.002
- 5 - Karreman E, Krause CS, Smith S. Children receive less analgesia in general ERs than adults: A retrospective study. Journal of Emergency Medicine, Trauma and Acute Care. 2016(1), 1.
- 6 - Koller DM, Myers AB, Lorenz D, Godambe SA. Effectiveness of oxycodone, ibuprofen, or the combination in the initial management of orthopedic injury-related pain in children. Pediatr Emerg Care. 2007 Sep;23(9):627-33. doi: 10.1097/PEC.0b013e31814a6a39. PMID: 17876251.
- 7 - Le May S, Gouin S, Fortin C, Messier A, Robert MA, Julien M. Efficacy of an ibuprofen/codeine combination for pain management in children presenting to the emergency department with a limb injury: a pilot study. J Emerg Med. 2013 Feb;44(2):536-42. doi: 10.1016/j.jemermed.2012.06.027. Epub 2012 Dec 8. PMID: 23232154.
- 8 - Le May S, Ali S, Plint AC, Mâsse B, Neto G, Auclair MC, Drendel AL, Ballard A, Khadra C, Villeneuve E, Parent S, McGrath PJ, Leclair G, Gouin S; Pediatric Emergency Research Canada (PERC). Oral Analgesics Utilization for Children With Musculoskeletal Injury (OUCH Trial): An RCT. Pediatrics. 2017 Nov;140(5):e20170186. doi: 10.1542/peds.2017-0186. Epub 2017 Oct 11. PMID: 29021235.
- 9 - McGreevy K, Bottros MM, Raja SN. Preventing Chronic Pain following Acute Pain: Risk Factors, Preventive Strategies, and their Efficacy. Eur J Pain Suppl. 2011 Nov 11;5(2):365-372. doi: 10.1016/j.eujps.2011.08.013. PMID: 22102847; PMCID: PMC3217302.
- 10 - Nikula, A., Lundeberg, S., Ryd Rinder, M., Lääperi, M., Sandholm, K., Castrén, M., & Kurland, L. (2024). A randomized double-blind trial of intranasal dexmedetomidine versus intranasal esketamine for procedural sedation and analgesia in young children. Scandinavian journal of trauma, resuscitation and emergency medicine, 32(1), 16. https://doi.org/10.1186/s13049-024-01190-5
- 11 - Palmer G. M. (2016). Pain management in the acute care setting: Update and debates. Journal of paediatrics and child health, 52(2), 213220. https://doi.org/10.1111/jpc.13134
- 12 - Parri N, Lazzeri S. Efficacy of ibuprofen in musculoskeletal post-traumatic pain in children: A systematic review. PLoS One. 2020 Dec 3;15(12):e0243314. doi: 10.1371/journal.pone.0243314. PMID: 33270748; PMCID: PMC7714211.
- 13 - Poonai, N., Bhullar, G., Lin, K., Papini, A., Mainprize, D., Howard, J., Teefy, J., Bale, M., Langford, C., Lim, R., Stitt, L., Rieder, M. J., & Ali, S. (2014). Oral administration of morphine versus ibuprofen to manage postfracture pain in children: a randomized trial. CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne, 186(18), 1358-1363. https://doi.org/10.1503/cmaj.140907
- 14 - Prescott, M. G., Iakovleva, E., Simpson, M. R., Pedersen, S. A., Munblit, D., Vallersnes, O. M., & Austad, B. (2023). Intranasal analgesia for acute moderate to severe pain in children - a systematic review and meta-analysis. BMC pediatrics, 23(1), 405. https://doi.org/10.1186/s12887-023-04203-x
- 15 - Sinatra R. Causes and consequences of inadequate management of acute pain. Pain Med. 2010 Dec;11(12):1859-71. doi: 10.1111/j.1526-4637.2010.00983.x. Epub 2010 Oct 28. PMID: 21040438.
- 16 - Wong, I., St John-Green, C., & Walker, S. M. (2013). Opioid-sparing effects of perioperative paracetamol and nonsteroidal anti-inflammatory drugs (NSAIDs) in children. Paediatric anaesthesia, 23(6), 475495. https://doi.org/10.1111/pan.12163.
Evidence tabellen
No Evidence tables.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Adams AJ, Buczek MJ, Flynn JM, Shah AS. Perioperative Ketorolac for Supracondylar Humerus Fracture in Children Decreases Postoperative Pain, Opioid Usage, Hospitalization Cost, and Length-of-Stay. J Pediatr Orthop. 2019 Jul;39(6):e447-e451. doi: 10.1097/BPO.0000000000001345. PMID: 30720556. |
Wrong design: no trial |
|
Cukiernik VA, Lim R, Warren D, Seabrook JA, Matsui D, Rieder MJ. Naproxen versus acetaminophen for therapy of soft tissue injuries to the ankle in children. Ann Pharmacother. 2007 Sep;41(9):1368-74. doi: 10.1345/aph.1H596. Epub 2007 Jul 17. PMID: 17636113. |
Wrong intervention: no multimodal approach |
|
Friday JH, Kanegaye JT, McCaslin I, Zheng A, Harley JR. Ibuprofen provides analgesia equivalent to acetaminophen-codeine in the treatment of acute pain in children with extremity injuries: a randomized clinical trial. Acad Emerg Med. 2009 Aug;16(8):711-6. doi: 10.1111/j.1553-2712.2009.00471.x. Epub 2009 Jul 14. PMID: 19624576. |
Included in Parri 2020 |
|
Furyk JS, Grabowski WJ, Black LH. Nebulized fentanyl versus intravenous morphine in children with suspected limb fractures in the emergency department: a randomized controlled trial. Emerg Med Australas. 2009 Jun;21(3):203-9. doi: 10.1111/j.1742-6723.2009.01183.x. PMID: 19527280. |
Wrong intervention: no multimodal approach |
|
Ghirardo S, Trevisan M, Ronfani L, Zanon D, Maestro A, Barbieri F, De Nardi L, Amaddeo A, Barbi E, Cozzi G. Oral ibuprofen versus oral ketorolac for children with moderate and severe acute traumatic pain: a randomized comparative study. Eur J Pediatr. 2023 Feb;182(2):929-935. doi: 10.1007/s00431-022-04759-3. Epub 2022 Dec 17. PMID: 36526794; PMCID: PMC9758024. |
Wrong intervention: no multimodal approach |
|
Koller DM, Myers AB, Lorenz D, Godambe SA. Effectiveness of oxycodone, ibuprofen, or the combination in the initial management of orthopedic injury-related pain in children. Pediatr Emerg Care. 2007 Sep;23(9):627-33. doi: 10.1097/PEC.0b013e31814a6a39. PMID: 17876251. |
Included in Parri 2020 |
|
Le May S, Ali S, Khadra C, Drendel AL, Trottier ED, Gouin S, Poonai N. Pain Management of Pediatric Musculoskeletal Injury in the Emergency Department: A Systematic Review. Pain Res Manag. 2016;2016:4809394. doi: 10.1155/2016/4809394. Epub 2016 Apr 11. PMID: 27445614; PMCID: PMC4904632. |
A more recent SR was found |
|
Le May S, Gouin S, Fortin C, Messier A, Robert MA, Julien M. Efficacy of an ibuprofen/codeine combination for pain management in children presenting to the emergency department with a limb injury: a pilot study. J Emerg Med. 2013 Feb;44(2):536-42. doi: 10.1016/j.jemermed.2012.06.027. Epub 2012 Dec 8. PMID: 23232154. |
Included in Parri 2020 |
|
Ledoux A-, Tang K, Freedman SB, Gravel J, Boutis K, Yeates KO, Mannix RC, Richer LR, Bell MJ, Zemek RL; Pediatric Emergency Research Canada 5P Study Group. Early analgesic administration and headache presence 7 days post-concussion in children. CJEM. 2022 Dec;24(8):876-884. doi: 10.1007/s43678-022-00367-0. Epub 2022 Sep 15. PMID: 36107402. |
Wrong intervention: no multimodal approach |
|
Mak WY, Yuen V, Irwin M, Hui T. Pharmacotherapy for acute pain in children: current practice and recent advances. Expert Opin Pharmacother. 2011 Apr;12(6):865-81. doi: 10.1517/14656566.2011.542751. Epub 2011 Jan 22. PMID: 21254863. |
Wrong design: no trial |
|
Simons SH, Anand KJ. Pain control: opioid dosing, population kinetics and side-effects. Semin Fetal Neonatal Med. 2006 Aug;11(4):260-7. doi: 10.1016/j.siny.2006.02.008. Epub 2006 Apr 18. PMID: 16621750. |
Wrong design: no trial |
|
Sola R Jr, Desai AA, Gonzalez KW, Doyle NM, Weaver KL, Poola AS, Fraser JD, St Peter SD, Millspaugh DL. Does Intravenous Acetaminophen Improve Postoperative Pain Control after Laparoscopic Appendectomy for Perforated Appendicitis? A Prospective Randomized Trial. Eur J Pediatr Surg. 2019 Apr;29(2):159-165. doi: 10.1055/s-0037-1615276. Epub 2018 Jan 2. PMID: 29294507. |
Wrong comparison: intravenous acetaminophen vs oral pain medication |
|
Stanhope B. Paracetamol/codeine probably had equivalent analgesia to ibuprofen in children with extremity injuries. Arch Dis Child Educ Pract Ed. 2010 Oct;95(5):167. doi: 10.1136/adc.2010.192435. Epub 2010 Jun 28. PMID: 20585054. |
Wrong design: commentary |
|
Wiffen PJ, Cooper TE, Anderson AK, Gray AL, Grégoire MC, Ljungman G, Zernikow B. Opioids for cancer-related pain in children and adolescents. Cochrane Database Syst Rev. 2017 Jul 19;7(7):CD012564. doi: 10.1002/14651858.CD012564.pub2. PMID: 28722116; PMCID: PMC6484393. |
Wrong intervention: no paracetamol or NSAID |
|
Xie D, Liu F, Zuo Y. Effectiveness of Sufentanil-Based Patient-Controlled Analgesia Regimen in Children and Incidence of Adverse Events Following Major Congenital Structure Repairs. J Clin Pharmacol. 2023 Jun;63(6):715-720. doi: 10.1002/jcph.2211. Epub 2023 Feb 28. PMID: 36762722. |
Wrong intervention: no paracetamol or NSAID |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-03-2025
Beoordeeld op geldigheid : 21-02-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met pijn.
Kernwerkgroep
- Drs. M.A. (Maarten) Mensink, kinderanesthesioloog en pijnarts, werkzaam in het Prinses Máxima Centrum voor Kinderoncologie te Utrecht, NVA, voorzitter
- Drs. J.F. (Joanne) Goorhuis, algemeen kinderarts, werkzaam in het Medisch Spectrum Twente, NVK
- Dr. T. (Tessa) Sieswerda, kinderarts, werkzaam in het Amsterdam UMC te Amsterdam, NVK
- Drs. M.S. (Sukru) Genco, algemeen kinderarts, werkzaam in het OLVG te Amsterdam, NVK
- Dr. S.H. (Steven) Renes, anesthesioloog-pijnspecialist, werkzaam in het Radboud UMC te Nijmegen, NVA
- Dr. P. (Petra) Honig-Mazer, psychotherapeut, werkzaam in het Erasmus MC Sophia te Rotterdam, PAZ/LVMP
- Drs. M. (Marjorie) de Neef, kinder-IC verpleegkundige, werkzaam in het Amsterdam UMC, V&VN
- E.C. (Esen) Doganer, junior projectmanager en beleidsmedewerker, Stichting Kind en Ziekenhuis
Werkgroep
- Drs. L.A.M. (Lonneke) Aarts, algemeen kinderarts, werkzaam in het RadboudUMC Amalia kinderziekenhuis te Nijmegen, NVK
- Prof. dr. W.J.E. (Wim) Tissing, kinderoncoloog, werkzaam in het UMCG te Groningen en Prinses Máxima Centrum te Utrecht, NVK
- Drs. P. (Petra) Hissink-Muller, kinderreumatoloog, werkzaam in het Erasmus MC Sophia te Rotterdam
- Dr. A.M. (Arine) Vlieger, algemeen kinderarts, werkzaam in het St. Antonius Ziekenhuis te Utrecht, NVK
- Dr. G.E. (Gerbrich) van den Bosch, kinderarts-neonatoloog, werkzaam in het Erasmus MC Sophia te Rotterdam, NVK
- Drs. K. (Karina) Elangovan, kinderanesthesioloog, werkzaam in het Erasmus MC Sophia te Rotterdam, NVA
- Dr. C.M.G. (Claudia) Keyzer – Dekker, kinderchirurg, werkzaam in het Erasmus MC Sophia te Rotterdam, NVvH
- A.P. (Annette) van der Kaa, kinderfysiotherapeut, werkzaam in het Erasumc MC Sophia te Rotterdam, NVFK en KNGF
- Drs. A. H. (Agnes) Dommerholt, klinisch psycholoog, werkzaam in het OLVG te Amsterdam, NIP/LVMP (vanaf 1-1-2023)
Klankbordgroep
- Drs. J. (Judig) Blaauw, kinderrevalidatiearts, VRA
- Dr. H. (Hanneke) Bruijnzeel, AIOS, werkzaam in het UMC Utrecht te Utrecht, NVKNO
- Dr. A.M.J.W. (Anne-Marie) Scheepers, ziekenhuisapotheker, werkzaam in het MUMC te Maastricht, NVZA
- Dr. S.A. (Sylvia) Obermann-Borst, ervaringsdeskundige ouder & huisarts-epidemioloog, Care4Neo (voorheen Vereniging van Ouders van Couveusekinderen - VOC)
- Dr. I.H. (Ilse) Zaal-Schuller, arts voor verstandelijk gehandicapten/kaderarts palliatieve zorg i.o., werkzaam bij Prinsenstichting Purmerend/ AmsterdamUMC locatie AMC, NVAVG
- Dr. E. (Eva) Schaffrath, anesthesioloog, werkzaam in het Maastricht UMC te Maastricht, PROSA Kenniscentrum
- M. (Mirjam) Jansen op de Haar, HME-MO Vereniging Nederland
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst – Schilp, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. C. (Cécile) Overman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. D.A.M. (Danique) Middelhuis, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. M. (Mark) van Eck, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Liza) van Mun, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van (kern)werkgroepleden en klankbordgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Betrokkenen |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Werkgroep |
||||
|
Aarts |
Algemeen kinderarts in het Amalia kinderziekenhuissinds november 2017 |
Interne functies onbetaald: 1. voorzitter Pijn werkgroep Amalia kinderziekenhuis. 2. Verbonden aan werkgroep procedurele sedatie bij kinderen. 3. Implementatie VR in Amalia. |
Onderzoek naar effect comfort talk technieken; maar eenmalige subsidie gekregen voor uitvoer. Geen extern belang qua uitkomst. |
Geen actie |
|
Bosch van den |
Kinderarts-neonatoloog |
NALS (Newborn Advanced Life Support) instructeur SSHK te Riel (reanimatietraining, alleen onkostenvergoeding). Wetenschapelijk onderzoeker Erasmus MC-Sophia (onbetaald, betaald voor klinische werkzaamheden als neonatoloog). O.a. begeleider 3 PhD studenten m.b.t. neonatale pin en stress |
Vriendenloterij en De Stichting Vrienden van het Sophia - HIPPO studie - Landelijke studie naar de hoeveelheid en impact van neonatale en ouderlijke stress op de NICU, projectleider. De Stichting Vrienden van het Sophia – Pijn bij NEC project (lange termijn follow up van patienten met NEC o.a. testen van pijngevoeligheid, projectleider. Horizon 2020 - ALBINO study (RCT naar Allopurinol bij neonaten met asfyxie, Europese multicenter studie waarbij Rotterdam meedoet als 1 van deze centra) – Nee geen projectleider, alleen lokale pi van Rotterdam (maar niet inhoudelijk betrokken bij de opzet en dergelijke van de studie) |
Geen actie
|
|
Dommerholt |
Klinisch psycholoog KJ, vakgroep kindergeneeskunde OLVG |
Praktijk Dommerholt, praktijk voor kinder- en jeugdpsychotherapie, supervisie en doceren. (momenteel inactief). Lid vakgroep en medische staf, uitvoeren van psychologische diagnostiek en behandeling van kinderen en hun systeem, opleider. |
Geen |
Geen actie |
|
Elangovan |
Universitair medisch specialist Anesthesioloog-pijnspecialist; ErasmusMC |
Geen |
Geen |
Geen actie |
|
Genco |
Kinderarts, OLVG, Amsterdam |
- Eigenaar Genco Med. Beheer B.V. |
Directe belangen bij eigen B.V. maar geen relatie met de bezigheden van de werkgroep. Bijvangst van het project kan zijn: nieuwe kennis en ervaring om binnen onze organisatie te delen. |
Geen actie |
|
Goorhuis |
Algemeen kinderarts - acute kindergeneeskunde |
Geen |
Geen |
Geen actie |
|
Hissink-Muller |
Kinderreumatoloog, Erasmus MC Sophia |
Geen |
Ja, CHAMP studie en UCAN CAN DU. 1. NWO, Goed Geneesmiddelen Gebruik. UCAN CAN DU, CIHR, ZONMW, ReumaNederland. 2. CHAMP studie, mono of polytherapie bij non systemic JIA patienten. Personalised medicine bij JIA. |
Geen actie |
|
Kaa, van der |
Kinderfysiotherapeut |
-Docent Master Kinderfysiotherapie bij Breederode Hogeschool - Universitair docent -Kinderfysiotherapeut 1e lijn (Fysio van der Linden) |
Geen |
Geen actie |
|
Keyzer-Dekker |
Kinderchirurg Sophia Kinderziekenhuis ErasmusMC te Rotterdam |
APLS instructeur SSHK Riel, dagvergoeding |
Geen |
Geen actie |
|
Mensink* |
kinderanesthesioloog - pijnarts - Prinses Máxima Centrum voor kinderoncologie |
Bestuurslid sectie Pijn&palliatieve geneeskunde NVA - onbetaalde functie |
Geen |
Geen actie |
|
Neef, de |
Verpleegkundig onderzoeker, Kinder IC, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Honig-Mazer |
Erasmus MC - Sophia Kinderziekenhuis Afdeling Kinder- en Jeugdpsychiatrie/psychologie Unit Psychosociale Zorg Psychotherapeut BIG |
Kleine eigen praktijk: Praktijk voor Psychotherapie Honig-Mazer, betaald |
Geen |
Geen actie |
|
Renes |
Anesthesioloog-pijnspecialist Radboudumc |
Kwaliteitsvisitaties Nederlandse Vereniging Anesthesiologie, vacatiegeld |
Geen |
Geen actie |
|
Sieswerda |
Kinderarts sociale pediatrie Amsterdam UMC locatie AMC |
Werkgroeplid NVK commissie richtlijnen |
2023 - heden. Initiatiefnemeer gekoelde vs niet-gekoelde sondes, met funding vanuit Janivo stichting. 2021 – heden. Initiatiefnemer studie ‘Focus on comfort - the effect of language on pain perception in pediatric patients.’ met funding vanuit ESPR. Publicatie verwacht Q4 2023 2021 – heden. Initiatiefnemer studie ‘The ARCADE study, Anxiety Reduction in Children Analyzing Data from EEG.’ met funding vanuit WAR. Publicatie verwacht Q2 2024 |
Geen actie |
|
Simons |
Kinderarts - neonatoloog - klinisch farmacoloog (Universitair Medische Specialist) |
Lid geneesmiddelencommissie Erasmus MC (onbetaald) |
Geen |
Geen actie |
|
Tissing |
Kinderoncoloog, Hoogleraar supportive care in de kinderoncologie. 0.6 fte Prinses Maxima Centrum, 0,4 fte UMCG |
PI van onderzoek naar app over invloed van laagdrempelig contact op pijn bij patiënten met kanker. |
Geen |
Geen actie |
|
Uitzinger |
Junior Project manager en beleidsmedewerker Stichting kind en ziekenhuis |
Geen |
Geen |
Geen actie |
|
Vlieger |
Kinderarts St Antonius ziekenhuis Nieuwegein |
1. Betaald les geven via Cure en Care op het gebied van hypnose bij kinderen. 2. Mede-eigenaar van Skills4Comfort, een onderwijsbedrijf, dat tegen betaling trainingen verzorgt in ziekenhuizen op het gebied van non-farmacologische technieken om het comfort van patienten te verbeteren, mn tijdens pijnlijke procedures. 3. Voorzitter Stichting Hypnose bij Kinderen. Onbetaald. 4. Tot 2021: bestuurslid en mede-oprichter van de stichting Procedureel comfort bij Kinderen (Prosa). |
Enig financieel belang door mede-eigenaarschap van Skills4comfort dat onderwijs verzorgt op hte gebied van non-farmacologische pijn bestrijding. |
Uitsluiten van besluitvorming voor modules over non-farmacologische pijnbestrijding. Mag wel meelezen. |
*Voorzitter
|
Klankbordgroep |
||||
|
Blaauw |
Kinderrevalidatiearts |
Geen |
Geen |
Geen actie |
|
Bruijnzeel |
Arts-assistent Keel-, Neus- en Oorheelkunde, UMC Utrecht |
Kerngroep Pediatrie (KNO vereniging) - onbetaald |
Geen |
Geen actie |
|
Haar, van der |
Freelance consultant Moonshot |
Bestuurslid HME-MO Vereniging Nederland |
Geen |
Geen actie |
|
Scheepers |
ziekenhuisapotheker, Maastricht UMC+ |
Geen |
Geen |
Geen actie |
|
Obermann-Borst |
Coördinator Wetenschap bij Care4Neo 10 u per week |
Coördinator Wetenschap bij Care4Neo 75% betaald/25% vrijwillig verzorgen van bijdrage vanuit patientenperspectief aan wetenschap, richtlijnen en kwaliteit van zorg namens de patientenvereniging voor ouders van en voor kinderen die te vroeg, te klein en/of ziek geboren zijn. |
Geen |
Geen actie |
|
Zaal Schuller |
Arts voor verstandelijk gehandicapten |
Arts voor verstandelijk gehandicapten, betaald. |
Geen |
Geen actie |
|
Schaffrath |
Kinderanesthesioloog MUMC |
Faculty member PROSA (tegen dagvergoeding) |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Stichting Kind en Ziekenhuis in de kernwerkgroep en Care4Neo en HME-MO Vereniging Nederland in de klankbordgroep. Op verschillende momenten is input gevraagd tijdens een invitational conference en bij het opstellen van het raamwerk. Het verslag van de invitational conference [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Voorafgaand aan de voorbereidende fase is een invitational conference georganiseerd over herkenning en behandeling van pijn binnen de kindzorg. Een verslag hiervan is opgenomen onder aanverwante producten. Daarnaast werd tijdens de voorbereidende fase van de richtlijn een schriftelijke knelpunteninventarisatie gehouden. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Embase.com 15-11-2023
|
No. |
Query |
Results |
|
#1 |
'nociceptive pain'/exp OR (('injury'/de OR 'abrasion'/exp OR 'accidental injury'/exp OR 'avulsion injury'/exp OR 'battle injury'/exp OR 'bites and stings'/exp OR 'crush trauma'/exp OR 'head and neck injury'/exp OR 'limb injury'/exp OR 'membrane damage'/exp OR 'multiple trauma'/exp OR 'microtrauma'/exp OR 'musculoskeletal injury'/exp OR 'pelvis injury'/exp OR 'perforation'/exp OR 'rupture'/exp OR 'seatbelt injury'/exp OR 'skin injury'/exp OR 'soft tissue injury'/exp OR 'sport injury'/exp OR 'strangulation'/exp OR 'surgical injury'/exp OR 'thermal injury'/exp OR 'tissue injury'/exp OR 'tooth injury'/exp OR 'traumatic shock'/exp OR 'traumatic amputation'/exp OR 'traumatic hematoma'/exp OR 'trench foot'/exp OR 'wound'/exp) AND 'pain'/exp/mj) OR 'nociceptive pain':ti,ab,kw OR 'somatic pain':ti,ab,kw OR 'tissue pain':ti,ab,kw |
43211 |
|
#2 |
'paracetamol'/exp OR paracetamol:ti,ab,kw OR acetaminophen*:ti,ab,kw OR 'nonsteroid antiinflammatory agent'/exp OR nsaid*:ti,ab,kw OR ((('non steroid*' OR nonsteroid*) NEAR/2 ('anti inflam*' OR 'anti rheumat*' OR antirheumat*) NEAR/2 (agent* OR drug*)):ti,ab,kw) OR aceclofenac:ti,ab,kw OR dexketoprofen:ti,ab,kw OR diclofenac:ti,ab,kw OR fenylbutazon:ti,ab,kw OR flurbiprofen:ti,ab,kw OR ibuprofen:ti,ab,kw OR indometacine:ti,ab,kw OR ketoprofen:ti,ab,kw OR meloxicam:ti,ab,kw OR metamizol:ti,ab,kw OR nabumeton:ti,ab,kw OR naproxen:ti,ab,kw OR piroxicam:ti,ab,kw OR celecoxib:ti,ab,kw OR etoricoxib:ti,ab,kw OR parecoxib:ti,ab,kw OR 'anticonvulsive agent'/exp OR gabapentin:ti,ab,kw OR pregabalin*:ti,ab,kw OR carbamezapin*:ti,ab,kw OR oxcarbazepin*:ti,ab,kw OR anticonvuls*:ti,ab,kw OR 'antidepressant agent'/exp OR 'antidepress*':ti,ab,kw OR amitriptylin*:ti,ab,kw OR nortriptylin*:ti,ab,kw OR 'serotonin noradrenalin reuptake inhibitor'/exp OR duloxetin*:ti,ab,kw OR venlafaxin*:ti,ab,kw OR 'serotonin noradrenalin reuptake inhibitor*':ti,ab,kw OR snri*:ti,ab,kw OR 'opiate agonist'/exp OR morphin*:ti,ab,kw OR buprenorphin*:ti,ab,kw OR codein*:ti,ab,kw OR methadon*:ti,ab,kw OR nalbuphin*:ti,ab,kw OR oxycodon*:ti,ab,kw OR pethidin*:ti,ab,kw OR hydromorphon*:ti,ab,kw OR fentanyl*:ti,ab,kw OR tramadol:ti,ab,kw OR tapentadol:ti,ab,kw OR 'benzodiazepine derivative'/exp OR benzodiazepin*:ti,ab,kw OR 'ketamine'/exp OR ketamin*:ti,ab,kw OR esketamin*:ti,ab,kw OR 'serotonin uptake inhibitor'/exp OR ssri*:ti,ab,kw OR 'serotonin uptake inhibitor*':ti,ab,kw OR 'spasmolytic agent'/exp OR spasmolytic*:ti,ab,kw OR 'clonidine'/exp OR 'loperamide'/exp OR loperamide:ti,ab,kw OR clonidin*:ti,ab,kw OR 'scopolamine butyl bromide'/exp OR buscopan:ti,ab,kw OR 'scopolamine butyl bromide':ti,ab,kw |
3261555 |
|
#3 |
#1 AND #2 |
12464 |
|
#4 |
'adolescent'/exp OR 'baby'/exp OR 'boy'/exp OR 'child'/exp OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR 'childhood disease'/exp OR infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab |
5855719 |
|
#5 |
#3 AND #4 |
1602 |
|
#6 |
#5 AND [2005-2024]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
893 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
977891 |
|
#8 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3914834 |
|
#9 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7931054 |
|
#10 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14578839 |
|
#11 |
#6 AND #7 – SR’s |
73 |
|
#12 |
#6 AND #8 NOT #11 – RCT’s |
213 |
|
#13 |
#6 AND (#9 OR #10) NOT #11 NOT #12 – Observationeel |
252 |
|
#14 |
#11 OR #12 OR #13 |
538 |
Ovid/Medline 15-11-2023
|
# |
Searches |
Results |
|
1 |
Nociceptive Pain/ or (("Wounds and Injuries"/ or Accidental Injuries/ or Amputation, Traumatic/ or Arm Injuries/ or Athletic Injuries/ or Back Injuries/ or "Bites and Stings"/ or Burns/ or Cold Injury/ or Crush Injuries/ or Joint Dislocations/ or Drowning/ or Fractures, Bone/ or Fractures, Cartilage/ or Frostbite/ or Hand Injuries/ or Hip Injuries/ or Lacerations/ or Leg Injuries/ or Microtrauma, Physical/ or Multiple Trauma/ or Nasal Septal Perforation/ or Neck Injuries/ or Rupture/ or Shock, Traumatic/ or Shoulder Injuries/ or Soft Tissue Injuries/ or Spinal Cord Injuries/ or "Sprains and Strains"/ or Surgical Wound/ or Tendon Injuries/ or Tooth Injuries/ or War-Related Injuries/ or Wounds, Nonpenetrating/ or Wounds, Penetrating/) and Pain/) or nociceptive pain*.ti,ab,kf. or somatic pain*.ti,ab,kf. or tissue pain.ti,ab,kf. |
9443 |
|
2 |
exp Acetaminophen/ or acetaminophen.ti,ab,kf. or paracetamol.ti,ab,kf. or exp Anti-Inflammatory Agents, Non-Steroidal/ or nsaid*.ti,ab,kf. or (("non steroid* " or nonsteroid*) adj2 ("anti inflam*" or "anti rheumat*" or antirheumat*) adj2 (agent* or drug*)).ti,ab,kf. or aceclofenac.ti,ab,kf. or dexketoprofen.ti,ab,kf. or diclofenac.ti,ab,kf. or fenylbutazon.ti,ab,kf. or flurbiprofen.ti,ab,kf. or ibuprofen.ti,ab,kf. or indometacine.ti,ab,kf. or ketoprofen.ti,ab,kf. or meloxicam.ti,ab,kf. or metamizol.ti,ab,kf. or nabumeton.ti,ab,kf. or naproxen.ti,ab,kf. or piroxicam.ti,ab,kf. or celecoxib.ti,ab,kf. or etoricoxib.ti,ab,kf. or parecoxib.ti,ab,kf. or exp Anticonvulsants/ or gabapentin.ti,ab,kf. or pregabalin*.ti,ab,kf. or carbamezapin*.ti,ab,kf. or oxcarbazepin*.ti,ab,kf. or anticonvuls*.ti,ab,kf. or exp Antidepressive Agents/ or antidepress*.ti,ab,kf. or amitriptylin*.ti,ab,kf. or nortriptylin*.ti,ab,kf. or "Serotonin and Noradrenaline Reuptake Inhibitors"/ or exp Selective Serotonin Reuptake Inhibitors/ or duloxetin*.ti,ab,kf. or venlafaxin*.ti,ab,kf. or serotonin noradrenalin reuptake inhibitor*.ti,ab,kf. or snri*.ti,ab,kf. or ssri.ti,ab,kf. or exp Analgesics, Opioid/ or morphin*.ti,ab,kf. or buprenorphin*.ti,ab,kf. or codein*.ti,ab,kf. or methadon*.ti,ab,kf. or nalbuphin*.ti,ab,kf. or oxycodon*.ti,ab,kf. or pethidin*.ti,ab,kf. or hydromorphon*.ti,ab,kf. or fentanyl*.ti,ab,kf. or tramadol.ti,ab,kf. or tapentadol.ti,ab,kf. or exp Benzodiazepines/ or benzodiazepin*.ti,ab,kf. or exp Ketamine/ or ketamin*.ti,ab,kf. or esketamin*.ti,ab,kf. or exp Selective Serotonin Reuptake Inhibitors/ or ssri*.ti,ab,kf. or serotonin uptake inhibitor*.ti,ab,kf. or exp Parasympatholytics/ or spasmolytic*.ti,ab,kf. or exp Clonidine/ or exp Loperamide/ or loperamide.ti,ab,kf. or clonidin*.ti,ab,kf. or exp Butylscopolammonium Bromide/ or buscopan.ti,ab,kf. or scopolamine butyl bromide.ti,ab,kf. |
893075 |
|
3 |
1 and 2 |
1610 |
|
4 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2961125 |
|
5 |
3 and 4 |
176 |
|
6 |
limit 5 to yr=2005-2024 |
127 |
|
7 |
6 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) |
116 |
|
8 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
707078 |
|
9 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2656363 |
|
10 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4580828 |
|
11 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5556246 |
|
12 |
7 and 8 – SR’s |
9 |
|
13 |
(7 and 9) not 12 – RCT’s |
32 |
|
14 |
(7 and (10 or 11)) not (12 or 13) – Observationeel |
46 |
|
15 |
12 or 13 or 14 |
87 |