Trommelvliesbuisjes bij pOME
Uitgangsvraag
Wat is de effectiviteit van trommelvliesbuisjes bij kinderen met persisterende otitis media met effusie (pOME)?
Aanbeveling
Stel in de behandeling van persisterende otitis media met effusie (pOME) het gehoorverlies en de spraak- taalontwikkeling centraal.
Weeg samen met de patiënt en ouders/verzorgers de voor- en nadelen van het plaatsen van buisjes af tegen een afwachtend beleid. Gebruik hierbij eventueel de keuzekaart trommelvliesbuisjes of de keuzehulp.
Bij de wens tot plaatsen trommelvliesbuisjes:
Kinderen < 4 jaar
Overweeg het plaatsen van buisjes alleen bij kinderen met pOME die:
- in hun spraak- taalontwikkeling worden bedreigd; of
- om andere reden ernstige hinder ondervinden van het gehoorverlies.
Breng bij deze groep kinderen de spraak- taalontwikkeling in kaart middels de SNEL- of ELS-test. Wanneer er geen uitval is op de SNEL- of ELS-test en er desondanks de wens is voor plaatsen van buisjes, laat dan een gehooronderzoek uitvoeren (evt. een 3-punts audiogram, zie Kinderen ≥ 4 jaar). Verwijs hiervoor zo nodig naar een audiologisch centrum.
Kinderen ≥ 4 jaar
Overweeg het plaatsen van buisjes alleen bij kinderen met pOME die ernstige hinder ondervinden van het gehoorverlies én minimaal een gehoorverlies hebben van meer dan 20 dB.
Breng bij deze groep kinderen het gehoorverlies bij voorkeur in kaart met standaard audiometrie (audiogram met lucht- en beengeleidingsdrempels). Wanneer dit niet haalbaar is, verricht dan minimaal een 3-punts audiogram (luchtgeleidingsdrempels bij 500, 1000 en 2000 Hz).
Verricht audiometrie als het gehoor en/of taal- spraakproblematiek na het plaatsen van buisjes niet subjectief verbetert, om een onderliggend (enkelzijdig) perceptief gehoorverlies uit te sluiten, dan wel aan te tonen. Verwijs hiervoor zo nodig naar een audiologisch centrum.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek gedaan naar de effecten van trommelvliesbuisjes vergeleken met een afwachtend beleid bij de behandeling van persisterende otitis media met effusie (pOME) bij kinderen. Als cruciale uitkomstmaat werd gehoorverlies gedefinieerd. Resolutie van OME, duur van OME, bijwerkingen en kwaliteit van leven werden gedefinieerd als belangrijke uitkomstmaten.
De gevonden literatuur heeft beperkingen in de studieopzet, waaronder gebrek aan blindering. Dit verlaagt de bewijskracht van het gevonden bewijs. Opmerkelijk is dat er geen recente studies zijn gedaan naar het effect van trommelvliesbuisjes. De geïncludeerde studies dateren uit het jaar 2000 of daarvoor. Een recenter consensus paper uit 2017 trekt dezelfde conclusie en benoemt dat er na 2011 (het review van Browning) geen nieuwe trials meer zijn gepubliceerd (Schilder, 2017). Wel zijn er na de publicatiedatum van dit review nieuwere reviews gepubliceerd, deze waren echter van lagere kwaliteit dan het review van Browning (2010) en zijn daarom niet geselecteerd voor deze richtlijn.
Het gevonden bewijs suggereert op korte termijn (3-6 maanden) een mogelijk positief effect van trommelvliesbuisjes op het gehoor van kinderen. De gevonden effecten variëren van een verbetering van gemiddeld 5 decibel (dB; Black, 1990; Dempster, 1993) tot gemiddeld 11 dB (MRC-target 2001) en gemiddeld 19 dB (Maw, 1976-86). Op de langere termijn (6-9 maanden, 12 maanden) lijkt dit effect echter nagenoeg verdwenen.
Ook werd er een mogelijk positief effect gevonden van trommelvliesbuisjes op de duur van OME, waarbij kinderen met trommelvliesbuisjes minder lang last hadden van effusie dan kinderen die een afwachtend beleid of paracentese ondergingen (gemiddeld 17% minder in eerste en/of tweede jaar). De grootte van het daadwerkelijke effect is mogelijk nog groter dan de studies laten zien, doordat een deel van de kinderen in de controle groep paracentese heeft ondergaan. Echter, de bewijskracht voor dit gevonden effect is laag, mede door beperkingen in de studieopzet.
Het gevonden bewijs suggereert dat trommelvliesbuisjes mogelijk bijwerkingen met zich meebrengen. Ondanks dat de literatuur slechts bewijs met een lage bewijskracht laat zien, wordt het risico op bijwerkingen in de praktijk wel degelijk ervaren. Een loopoor komt bij kinderen met trommelviesbuisjes geregeld voor. Dit kan zich ontwikkelen tot een chronisch loopoor, wat weer kan leiden tot frequent gebruik van (lokale) antibiotica. In enkele gevallen is het actief verwijderen van een buisje geïndiceerd, waarvoor opnieuw een ingreep onder narcose nodig is. Bij een deel van de kinderen ontstaan tympanosclerose of blijvende trommelvlies perforaties, wat kan leiden tot blijvend, licht gehoorverlies van 5 tot 10 dB (Beer, 2004). Wat niet in de literatuur wordt meegenomen, maar wel een nadeel is van het plaatsen van trommelvliesbuisjes, is dat kinderen in het ziekenhuis een operatie onder narcose moeten ondergaan.
Ondanks dat de gevonden literatuur geen sterk bewijs laat zien ten faveure van trommelvliesbuisjes, is er vanuit de praktijk de ervaring dat het plaatsen van buisjes op individuele basis, vanwege het gunstige effect op het gehoor op korte termijn, wel degelijk zinvol kan zijn. De literatuur laat een afname van effect zien naarmate de follow-up periode langer wordt. Daarnaast richt de literatuur zich alleen op metingen vanaf 3 maanden. Mogelijk is er op een (nog kortere) termijn van 2-3 maanden een groter effect zichtbaar. Wanneer een kind bezig is met de taal- en spraakontwikkeling en leert lezen en schrijven, kan een aanhoudend gehoorverlies van een aantal weken al een grote impact hebben. In principe is de mate van gehoorverlies leidend voor het plaatsen van buisjes. Over het algemeen heeft een kind geen of slechts beperkte hinder van geringe gehoorverliezen (20 dB nHL of lager)Daarom wordt het plaatsen van buisjes over het algemeen pas zinvol geacht bij een gehoorverlies vanaf 20 dB.
In de praktijk wordt door ouders een toename in kwaliteit van leven na plaatsen van buisjes regelmatig gemeld. Deze conclusie wordt niet getrokken uit het aanwezige bewijs.
Behalve het feit dat maar 1 studie uit onze search kwaliteit van leven beschrijft (Rovers et al 2000) zijn er ook twijfels bij het gebruikte instrument (TAIQOL). Brouwer (2005 en 2007) stelt in 2 studies mede uitgevoerd door Rovers zelf, dat de TAIQOL, een generieke health-related quality of life vragenlijst, een zeer beperkte onderscheidende waarde heeft en dat de gevoeligheid voor verandering in kwaliteit van leven bij kinderen met otitis media met deze vragenlijst onvoldoende is.
Diagnostiek
Bepaling van het gehoorverlies is belangrijk voor de beslissing om wel of geen buisjes te plaatsen, maar bij kinderen <4 jaar is audiometrie lastig uit te voeren in de algemene KNO-praktijk. Voor kinderen ≥ 4 jaar is bepaling van gehoorverlies d.m.v. standaard audiometrie over het algemeen wel mogelijk. Maar de capaciteit voor audiometrie voor deze groep kinderen is soms beperkt.
Naast audiometrie kunnen ook het otoscopisch beeld en impedantiemetrie (type B of C2 tympanogram volgens Jerger) bijdragen aan de indicatiestelling. Daarbij moet in aanmerking worden genomen dat onderzoek een momentopname is en otitis media met effusie heel wisselend in de tijd aanwezig kan zijn.
Pre-operatief bij kinderen < 4 jaar
Jonge kinderen met pOME worden vaak doorverwezen vanwege vermoeden van gehoorverlies en twijfels over de spraak- taalontwikkeling. Deze groep jonge kinderen is vaak nog moeilijk instrueerbaar en de uitvoer van gehooronderzoek is daardoor in de algemene KNO-praktijk moeilijk of onmogelijk. Verwijzing naar een audiologisch centrum is daarvoor gewenst, maar de toegangstijd aldaar kan lang zijn.
Of kinderen in hun spraak- taalontwikkeling worden bedreigd kan worden gescreend met behulp van een gestandaardiseerde spraak- taalontwikkelingstest (SNEL- of ELS-test; zie module: Effecten van otitis media op taal- en spraakontwikkeling, gedrag en kwaliteit van leven). Bij uitval op deze test en daarbij een duidelijk beeld van OME (otoscopisch beeld, impedantiemetrie) zouden buisjes kunnen worden geplaats zonder audiometrie vooraf. Dit om langdurig gehoorverlies, wat een negatief effect kan hebben op de spraak-taalontwikkeling, te voorkomen.
Pre-operatief bij kinderen ≥ 4 jaar
Kinderen vanaf4 jaar zijn over het algemeen in staat om reguliere toondrempelaudiometrie, evt. in de vorm van spelaudiometrie, uit te voeren. Uitvoer van een regulier toondrempelaudiogram (4 tot 6 frequentiepunten per oor met lucht- en beengeleidingsdempels) kost veel tijd en de aandachtsspanne van jonge kinderen is hiervoor vaak te laag. Mogelijk biedt een 3-punts audiogram een oplossing. Daarbij worden alleen luchtgeleidingsdrempels bepaald bij 500, 1000 en 2000 Hz. De uitvoer van dit audiogram duurt korter en is mede daardoor gemakkelijker uit te voeren, met name bij kinderen met een beperkte aandachtsspanne. Door het achterwege laten van beengeleidingsdrempels kan een eventueel aanwezig perceptief gehoorverlies niet worden opgemerkt. Echter, bij het overgrote deel van de kinderen is dit niet aan de orde. De uitslag van de neonatale gehoorscreening dient dan ook altijd meegenomen te worden in de overwegingen.
Postoperatieve diagnostiek
Indien het gehoor en de spraak-taalontwikkeling evident verbeterd zijn, kan een controle audiogram achterwege gelaten worden.
Bij uitblijven van een verbetering van het gehoor of de spraak-taalontwikkeling na plaatsing van trommelvliesbuisjes wordt bij kinderen jonger dan 4 jaar een verwijzing naar het audiologisch centrum geadviseerd. Bij kinderen ouder dan 4 jaar wordt audiometrie (lucht- en beengeleiding) geadviseerd om na te gaan of er sprake is van een niet aan OME-gerelateerd gehoorverlies.
Waarden en voorkeuren van patiënten (en hun verzorgers)
Kinderen die door de huisarts zijn doorgestuurd naar de KNO-arts vanwege pOME hebben al langere tijd aan OME gerelateerde klachten. Over het algemeen worden kinderen pas doorverwezen naar de KNO-arts wanneer de klachten dusdanig ernstig zijn dat ouders en kinderen graag van de klachten af geholpen worden door middel van plaatsing van trommelvliesbuisjes (zie NHG-standaard Otitis media met effusie bij kinderen uit 2014). Het invullen van de keuzekaart trommelvliesbuisjes helpt huisartsen of de JGZ bij het maken van de beslissing om naar de KNO-arts doorverwezen te worden, omdat hierin duidelijk de voor- en nadelen van het plaatsen van buisjes en de beperkte winst op lange termijn worden beschreven.
Ondanks dat ouders en kinderen meestal met de wens tot het plaatsen van trommelvliesbuisjes binnenkomen bij de KNO-arts, blijft het van belang om opnieuw de (beperkte) meerwaarde en de nadelen van trommelvliesbuisjes met ouders en kinderen te bespreken.
Kosten (middelenbeslag)
Het plaatsen van tv-buisjes is significant duurder dan het volgen van een afwachtend beleid. Daarbij worden buisjes relatief veel geplaatst, waardoor er in totaal hoge kosten aan verbonden zijn.
Uitvoer van audiometrie kost tijd en geld. Wanneer er een 3-punts audiogram wordt uitgevoerd in plaats van volledige audiometrie kunnen er naar verwachting meer kinderen gemeten worden tegen een mogelijk lagere kostprijs
Aanvaardbaarheid, haalbaarheid en implementatie
Om advies te kunnen geven over het nut van plaatsen van trommelvliesbuisjes is het van belang om de mate van het gehoorverlies en daarmee de te verwachten meerwaarde van de trommelvliesbuisjes te kennen. Probleem hierbij is dat audiometrie bij jonge kinderen (kinderen die nog geen spelaudiometrie kunnen uitvoeren; leeftijd < 3 à 4 jaar) een verwijzing naar een audiologisch centrum nodig is. Dit levert onacceptabele vertraging op () bij kinderen die vanwege gehoorverlies in hun spraak-taalontwikkeling worden bedreigd. In het geval van jonge kinderen (< 4 jaar) zou daarom tot het plaatsen van trommelvliesbuisjes overgegaan kunnen worden zonder audiometrie vooraf, wanneer er sprake is van een duidelijk beeld van pOME (bij voorkeur geverifieerd met behulp van oto(micro)scopie en tympanometrie) bij een achterblijvende spraak- taalontwikkeling, blijkend uit een afwijkende screening (uitval op SNEL- of ELS-test).
Ook bij oudere kinderen (≥ 4 jaar) is uitgebreide audiometrie in de KNO-praktijk soms niet haalbaar (). Mogelijk kan 3-punts audiometrie (luchtgeleidingsdrempel bij 500, 1000 en 2000 Hz) hier uitkomst bieden. Zo kunnen meer kinderen in dezelfde tijd bemeten worden en is de beperkte aandachtsspanne van jonge kinderen minder problematisch.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Bij pOME worden buisjes geplaatst om conductief gehoorverlies ten gevolge van OME op te heffen. Buisjes blijken echter gemiddeld gezien slechts een beperkte gehoorverbetering op te leveren op de korte termijn, en geen positief effect te hebben op de lange termijn. Vanwege dit beperkte positieve effect van buisjes op het gehoor en het gunstige verloop van spontaan herstel bij pOME past een terughoudend beleid t.a.v. het plaatsen van trommelvliesbuisjes bij pOME.
Hier staat tegenover dat de hinder die kinderen en hun omgeving kunnen ondervinden van matig conductief gehoorverlies ten gevolge van pOME aanzienlijk kan zijn. Het kan leiden tot een tijdelijk achterblijvende spraak- taalontwikkeling of onvoldoende spraakverstaan, waardoor b.v. op school problemen ontstaan (zowel cognitief als sociaal).
Bovenstaande maakt dat, wanneer kinderen met pOME naar de KNO-arts worden verwezen, geadviseerd wordt om bij jonge kinderen (<4 jaar) met evidente spraaktaalachterstand (bevestigd met ELS- of SNEL test) en een OME bij otoscopisch beeld en/of een vlak tympanogram, een gehoormeting achterwege te laten. Bij oudere kinderen (> 4jaar) kunnnen met een (3 punts) audiogram als basis, de voor- en nadelen van trommelvliesbuisjes met ouders en kinderen besproken worden. Bij lichte gehoorverliezen zijn trommelvliesbuisjes niet geïndiceerd en wordt alsnog een afwachtend beleid geadviseerd.
Wanneer er na het plaatsen van trommelvliesbuisjes twijfel blijft bestaan over het gehoor of de spraak-taalontwikkeling is uitgebreid gehooronderzoek (been- en luchtgeleidingsdrempels) geïndiceerd om na te gaan of er sprake is van niet aan OME gerelateerd gehoorverlies.
Onderbouwing
Achtergrond
Om gehoorklachten bij kinderen ten gevolge van pOME te verbeteren, worden bij kinderen vaak trommelvliesbuisjes geplaatst. Er is echter onvoldoende bewijs dat de buisjes meerwaarde hebben, met name bij kinderen met lichte gehoorverliezen.
Advies in de voorgaande richtlijn (2012) is om voorafgaand aan plaatsen van trommelvliesbuisjes audiometrie te verrichten om na te gaan of er sprake is van een gehoorverlies van minimaal 25 dB. De richtlijn geeft aan dat het doen van gehooronderzoek minder bepalend is voor het te voeren beleid bij kinderen die:
- forse hinder hebben van het gehoorverlies
- middenoorbeluchtingsproblemen hebben (zoals kinderen met schisis of Down)
- in hun (spraak- taal) ontwikkeling worden bedreigd
In veel KNO-praktijken is er geen mogelijkheid om audiometrie te verrichten bij jonge kinderen (kinderen die nog geen spelaudiometrie kunnen uitvoeren). Kinderen zouden voor dergelijk gehooronderzoek verwezen moeten worden naar een audiologisch centrum. De wachttijd voor gehooronderzoek is vaak aanzienlijk. Daarom worden buisjes vaak geplaatst zonder gehooronderzoek vooraf. Dit ondanks het feit dat bij pOME de buisjes als doel hebben om het gehoor te verbeteren en het plaatsen van buisjes onvoldoende meerwaarde lijkt te hebben bij lichte gehoorverliezen.
De vraag is, of het verantwoord is om bij pOME trommelvliesbuisjes te plaatsen zonder gehooronderzoek vooraf. Wat zijn in dat geval de minimale voorwaarden waaraan moet worden voldaan? Bijvoorbeeld. anamnestisch onacceptabele beperkingen in functioneren, otomicroscopie, type B tympanongram, uitval op de SNEL- of ELS-test. Kan als alternatieve behandeling vaker een afwachtend beleid worden overwogen?
Conclusies / Summary of Findings
Hearing level (3-6 months follow-up)
|
Low GRADE |
Ventilation tubes reduce the level of hearing loss when compared with watchful waiting or myringotomy in children with pOME.
Source: From Browning (2010): Black (1990), Dempster (1993), Maw (1976-86), MRC-target (2001), |
Hearing level (6-12 months follow-up)
|
Low GRADE |
Ventilation tubes may result in little to no difference in hearing loss when compared with watchful waiting or myringotomy in children with pOME.
Source: From Browning (2010): Black (1990), Dempster (1993), Maw (1976-86), MRC-target (2001), Rovers (2000) |
Resolution of OME
|
No GRADE |
No evidence was found regarding the effect of ventilation tubes on resolution of OME compared with watchful waiting or myringotomy in children with pOME.
Source: - |
Duration of otitis media (time with effusion)
|
Very low GRADE |
Ventilation tubes may result in a reduction in time with effusion during the first (two) year(s) when compared with watchful waiting or myringotomy in children with pOME.
Source: From Browning (2010): Gates (1987), Mandel (1992), Paradise (2001) Rovers (2000) |
Adverse events
|
Low GRADE |
Ventilation tubes may result in an increase in adverse events when compared with watchful waiting or myringotomy in children with pOME.
Source: From Browning (2010): Dempster (1993), Gates (1987), Rovers (2000), MRC-Target (2001) |
Quality of life
|
Very low GRADE |
The evidence is very uncertain about the effect of ventilation tubes compared to watchful waiting or myringotomy on quality of life in children with pOME.
Source: From Browning (2010): Rovers (2000) |
Samenvatting literatuur
Description of studies
Browning (2010) performed a Cochrane review to assess the effectiveness of ventilation tube insertion compared with non-surgical treatment or myringotomy in children with otitis media with effusion (OME). The databases the Cochrane Ear, Nose and Throat Disorders Group Trials Register; the Cochrane Central Register of Controlled Trials (CENTRAL, The Cochrane Library Issue 3, 2010); PubMed; EMBASE; CINAHL; LILACS; KoreaMed; IndMed; PakMediNet; CAB Abstracts; Web of Science; BIOSIS Previews; CNKI; ISRCTN; ClinicalTrials.gov; ICTRP and Google were searched for relevant trials published until the 22nd of March 2010. Inclusion criteria were: children aged 0-12 years with unilateral or bilateral otitis media with effusion, treatment with unilateral or bilateral ventilation tube insertion in the tympanic membrane compared to respectively no surgery or unilateral myringotomy in the other ear, or a control group with no surgery or myringotomy alone. Studies in which children had received short courses of analgesics or antibiotics for acute infection, or children used decongestants, were included. In studies where patients received adenoidectomy as study intervention, the adenoidectomy arm was excluded from the analysis. In total, ten studies were included in the systematic review, of which nine were considered relevant for the purpose of this guideline (Black 1990; Dempster 1993; Maw 1979-86; Gates 1987; Mandel 1992; Maw 1999; MRC Target 2001; Rovers 2000; Paradise 2001). Data of follow-up publications of the studies by Maw (1978-86), Maw (1999), MRC: Target (2001), Paradise (2001) and Rovers (2000) was also included in the review. The study that was not considered relevant was excluded because it did not report one of the predefined outcome measures (Rach 1991). Baseline characteristics of the relevant studies are presented in Table 1. Outcomes included mean hearing levels, time with effusion, quality of life and adverse events.
Table 1: baseline characteristics of the individual studies included in the review from Browning (2010)
OME = otitis media with effusion; dB = decibel; HL = hearing loss; Hz = Hertz
|
|
Inclusion criteria |
Intervention |
Control |
|
Black, 1990 |
Children with bilateral OME |
Shepard ventilation tube (in one ear) |
myringotomy (other ear) |
|
Dempster, 1993 |
Children referred for hearing loss; bilateral OME for 3 months or more |
Shepard ventilation tube (in one ear) |
no surgery (other ear) |
|
Gates, 1987 |
Children referred with at least 2 months unilateral or bilateral OME |
Ventilation tubes |
myringotomy |
|
Mandel, 1992 |
Children referred with unilateral or bilateral OME for 2 months or more; mean hearing level in worst ear 24 dB |
Bilateral armstrong ventilation tubes |
bilateral myringtomy/no surgery |
|
Maw, 1979-86 |
Children referred with long-standing bilateral OME (mean duration 18 months) with symmetrical hearing loss in excess of 25 dB HL |
Unilateral Shepard tube |
no intervention |
|
Maw, 1999 |
Children with bilateral OME, disruption in speech, language or behaviour, and hearing loss (25 dB or poorer at 4000 Hz only) for at least 3 months, referred to hospital |
Bilateral Shepard or Shah ventilation tubes |
watchful waiting/active monitoring |
|
MRC Target, 2001 |
Children qualified on 2 occasions, 3 months apart, with better ear hearing level > 20 dB HL with tympanometrically confirmed bilateral OME |
Bilateral Shepard ventilation tubes |
watchful waiting/active monitoring |
|
Paradise, 2001 |
Children with bilateral or unilateral effusion |
Teflon bi-flanged ventilation tubes |
no intervention |
|
Rovers, 2000 |
children who had failed 3 successive hearing screening tests with persistent (4 to 6 months) bilateral OME confirmed by tympanometry and otoscopy were randomised |
bilateral Bevel Bobbins ventilation tubes |
watchful waiting/active monitoring |
Results
Hearing levels
Hearing level at 3-6 months follow-up
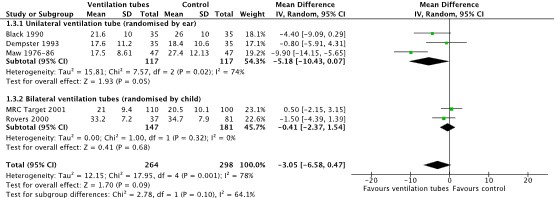
Four studies reported the outcome measure hearing levels at a follow-up duration from 3 to 6 months (from Browning 2010: Maw 1976 – 1986; Dempster, 1993; Black, 1990, MRC-Target, 2001). In Black (1990), Dempster (1993) and Maw (1976-1986), children received unilateral ventilation tubes and randomization was by ear. In MRC-Target (2001) children received bilateral ventilation tubes and randomization was by child. The results of these studies were pooled in a meta-analysis. The pooled Mean Difference (MD) in hearing level between children treated with ventilation tubes (n = 224) and children receiving watchful waiting or myringotomy (n = 221) was -10.63 dB (95% CI -16.04 to -5.22; Figure 1). This indicates children with pOME who were treated with ventilation tubes on average had a 10 dB better hearing level at 3-6 months follow-up than children undergoing watchful waiting or myringotomy. The results were considered clinically relevant.
Figure 1: Forest plot showing the comparison between ventilation tubes and watchful waiting/myringotomy (control) for the outcome hearing level at 3-6 months follow-up (FU). Pooled Mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; SD: standard deviation; I2; statistical heterogeneity; CI: confidence interval.
Hearing level at 6-9 months follow-up
Three studies reported the outcomes measure hearing levels at a follow-up duration from 6 to 9 months (from Browning 2010: Rovers, 2000; MRC-target, 2001; Maw 1999). In these studies children received bilateral ventilation tubes and randomization was by child. The results of these studies were pooled in a meta-analysis. The pooled MD in hearing level between children treated with ventilation tubes (n = 271) and children undergoing watchful waiting or myringotomy (n = 252) was -4.20 dB (95% CI: -6.00 to -2.39, Figure 2). This indicates children with pOME who were treated with ventilation tubes on average had a 4 dB better hearing level at 6-9 months follow-up than children undergoing watchful waiting or myringotomy. The results were not considered clinically relevant.
Figure 2: Forest plot showing the comparison between ventilation tubes and watchful waiting/myringotomy (control) for the outcome hearing level at 6-9 months follow-up (FU). Pooled Mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; SD: standard deviation; I2; statistical heterogeneity; CI: confidence interval.
Hearing level at 12 months follow-up
Five studies reported hearing levels at 12 months follow-up (from Browning 2010: Black, 1990; Dempster, 1993; Maw, 1976-86; MRC-target, 2001; Rovers, 2000). In the studies by Black (1990), Dempster (1993) and Maw (1976-1986) children received unilateral ventilation tubes and randomization was by ear. In MRC-Target (2001) and Rovers (2000) children received bilateral ventilation tubes and randomization was by child. The results of these studies were pooled in a meta-analysis. The pooled MD in hearing level between children treated with ventilation tubes (n = 264) and children undergoing watchful waiting or myringotomy (n = 298) was -3.05 dB (95% CI: -6.58 to 0.47, Figure 3). This indicates children with pOME who were treated with ventilation tubes on average had a 3 dB better hearing level at 12 months follow-up than children undergoing watchful waiting or myringotomy. The results were not considered clinically relevant.
Figure 3: Forest plot showing the comparison between ventilation tubes and watchful waiting/myringotomy (control) for the outcome hearing level at 12 months follow-up (FU). Pooled Mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; SD: standard deviation; I2; statistical heterogeneity; CI: confidence interval.
Resolution of otitis media
None of the included studies reported the outcome resolution of otitis media for the comparison ventilation tubes versus no ventilation tubes.
Duration of otitis media
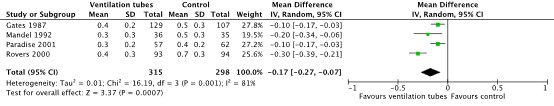
Four studies reported the outcome time with effusion during the first (two) year(s) (from Browning, 2010: Gates, 1987; Mandel, 1992; Paradise, 2001; Rovers, 2000). The results of these studies were pooled in a meta-analysis. The pooled MD in time with effusion between children treated with ventilation tubes (n = 315) and children undergoing watchful waiting or myringotomy (n = 298) was -0.17 (95% CI -0.27 to -0.07). This indicates patients with ventilation tubes on average spent 17% less time with effusion during the first (two) year(s), as compared to those in the watchful waiting or myringotomy group. This was considered clinically relevant (Figure 4).
Figure 4: Forest plot showing the comparison between ventilation tubes and watchful waiting/myringotomy (control) for the outcome time with effusion. Pooled Mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; SD: standard deviation; I2; statistical heterogeneity; CI: confidence interval.
Adverse events
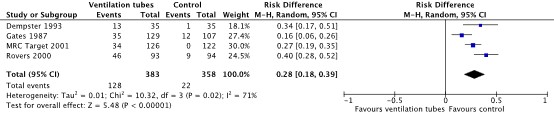
Four studies reported the outcome complications (from Browning 2010: Dempster, 1993; Gates, 1987; Rovers, 2000; MRC-Target 2001). All studies reported higher complication rates in the children treated with ventilation tubes, compared to the children in the control group. Events were calculated from the percentages presented in Browning (2010). The pooled Risk Difference (RD) was 0.28 (95% CI 0.18 to 0.39). This was considered clinically relevant (Figure 5). Adverse events that were reported included perforation and otorrhea (Gates, 1987; Rovers, 2000) and tympanosclerosis (Dempster 1993).
Figure 5: Forest plot showing the comparison between ventilation tubes and watchful waiting/myringotomy (control) for the outcome adverse events. Pooled Mean difference, random effects model. Z: p-value of overall effect; df: degrees of freedom; SD: standard deviation; I2; statistical heterogeneity; CI: confidence interval.
Quality of life
One study reported the outcome quality of life (from Browning, 2010: Rovers 2000). Data on quality of life outcomes was not presented, however it was reported that Rovers (2000) “did not find a significant quality of life improvement using the TAIQOL scale at either 6- or 12-months post-randomization between groups” (n = 386).
Level of evidence of the literature
Hearing level (3-6 months follow-up)
The level of evidence regarding the outcome measure hearing level was downgraded retrieved from RCTs and therefore started high. The level of evidence was downgraded by two levels because of study limitations including high loss to follow-up rates and risk of (-1 risk of bias); and the 95% confidence interval crossing the boundaries of clinical decision making (-1 imprecision). The final level of evidence was graded low.
Hearing level (6-12 months follow-up)
The level of evidence regarding the outcome measure hearing level was downgraded retrieved from RCTs and therefore started high. The level of evidence was downgraded by two levels because of study limitations including high loss to follow-up rates and risk of (-1 risk of bias); and the 95% confidence interval crossing the boundaries of clinical decision making (-1 imprecision). The final level of evidence was graded low.
Resolution of OME
The level of evidence for the outcome resolution of OME could not be graded as it was not reported in the included studies.
Duration of otitis media (time with effusion)
The level of evidence regarding the outcome measure time with effusion was downgraded retrieved from RCTs and therefore started high. The level of evidence was downgraded by two levels because of study limitations including high loss to follow-up rates and risk of (-1 risk of bias) and the 95% confidence interval crossing the boundaries of clinical decision making (-1 imprecision). The final level of evidence was graded low.
Adverse events
The level of evidence regarding the outcome measure adverse events was downgraded retrieved from RCTs and therefore started high. The level of evidence was downgraded by two levels because of study limitations including high loss to follow-up rates and risk of (-1 risk of bias) and low number of included patients (-1 imprecision). The final level of evidence was graded low.
Quality of life
The level of evidence regarding the outcome measure quality of life was downgraded retrieved from RCTs and therefore started high. The level of evidence was downgraded by three levels because of study limitations including high loss to follow-up rates and risk of (-1 risk of bias); and low number of included patients (-2 imprecision). The final level of evidence was graded very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the favorable and unfavorable effects of ventilation tubes compared with watchful waiting or myringotomy in children (0-18 years) with (persistent) otitis media with effusion?
P: children with (persistent) otitis media with effusion (0-18 years)
I: ventilation tubes
C: watchful waiting or myringotomy
O: hearing level, complications, resolution of otitis media, duration of otitis media, quality of life
Relevant outcome measures
The guideline development group considered hearing loss as a critical outcome measure for decision-making; and complications, resolution of otitis media, duration of otitis media and quality of life as important outcome measures for decision making.
A priori, the guideline development group did not define the outcome measures listed above but used the definitions used in the studies.
The guideline development group defined a threshold of 25% as a minimal clinically (patient) important difference; RR < 0.80 and RR > 1.25 for dichotomous outcome and a 10% difference for continuous outcomes. For the outcome measure hearing level, a minimal clinically (patient) important difference of 10 dB was considered clinically relevant.
The effects on the outcome hearing level were interpreted with consideration of the thresholds for hearing loss; in which thresholds up to 20 dB nHL are considered as normal, or good enough for normal functioning.
Search and select (Methods)
On the 28th of April 2023, a systematic search was performed in the databases Embase.com and Ovid/Medline for systematic reviews, RCTs (and observational studies) on tympanic tubes in otitis media with effusion in children. The detailed search strategy is depicted under the tab Methods. The search resulted in 236 unique hits. Studies were selected based on the following criteria: systematic reviews or randomized controlled trials comparing ventilation tubes with no ventilation tubes or myringotomy in children aged 0 – 18 with (persistent) otitis media with effusion. Twenty-three studies were initially selected based on title and abstract screening. After reading the full text, twenty-two studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One systematic review was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Beer, de BA, Schilder AGM, Ingels K, Snik AF, Zielhuis GA, Graamans K (2004) Hearing loss in young adults who had ventilation tube insertion in childhood. Ann. Otol. Rhinol. Larnygol. 113, 438-444.
- Brouwer CN, Maillé AR, Rovers MM, Grobbee DE, Sanders EA, Schilder AG. Health-related quality of life in children with otitis media. Int J Pediatr Otorhinolaryngol. 2005 Aug;69(8):1031-41. doi: 10.1016/j.ijporl.2005.03.013. Epub 2005 Apr 20.PMID: 16005345
- Brouwer et al. Reliability and validity of functional health status and health-related quality of life questionnaires in children with recurrent acute otitis media. Qual Life Res. 2007 Oct;16(8):1357-73. doi: 10.1007/s11136-007-9242-0. Epub 2007 Aug 1.PMID: 17668290
- Browning GG, Rovers MM, Williamson I, Lous J, Burton MJ. Grommets (ventilation tubes) for hearing loss associated with otitis media with effusion in children. Cochrane Database Syst Rev. 2010 Oct 6;(10):CD001801. doi: 10.1002/14651858.CD001801.pub3. PMID: 20927726.
- Schilder AG, Marom T, Bhutta MF, Casselbrant ML, Coates H, Gisselsson-Solén M, Hall AJ, Marchisio P, Ruohola A, Venekamp RP, Mandel EM. Panel 7: Otitis Media: Treatment and Complications. Otolaryngol Head Neck Surg. 2017 Apr;156(4_suppl):S88-S105. doi: 10.1177/0194599816633697. PMID: 28372534.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Browning 2010
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to March 22, 2010
A: Black, 1990 B: Dempster, 1993 C: Gates, 1987 D: Mandel, 1992 E: Maw, 1979-86 F: Maw, 1999 G: MRC Target, 2001 H: Paradise, 2001 I: Rovers, 2000
Study design: only RCT included
Setting and Country: no information
Source of funding and conflicts of interest: No information
|
Inclusion criteria SR: - children aged 0-12 years - unilateral or bilateral OME - treatment with uni- or bilateral grommet insertion in the tympanic membrane - compared to respectively no surgery or unilateral myringotomy in the other ear; or a control group with no surgery or myringotomy alone.
Exclusion criteria SR: In studies where patients received adenoidectomy as study intervention, the adenoidectomy arm was excluded from the analysis
10 studies included (of which 9 were considered relevant)
Important patient characteristics at baseline:
N, mean age A: 149; 4-9 years B: 78; 3-12 years C: 491; 4-8 years D: 111; 7 months - 12 years E: 150; 2-9 years F: 182; mean: 8,9 years G: 376; 3.5-7 years H: 588; 0-3 years I: 386; 16-24 months
Duration of OME A: Bilateral OME B: Bilateral OME for minimal 3 months C: At least 2 months uni- or bilateral OME, treated with antibiotic and decongestant D: uni- or bilateral OME for minimal 2 months, treated with antibiotics for 2 weeks E: long-standing bilateral OME, with symmetrical hearing loss in excess of 25 dB F: bilateral OME and hearing loss (25 dB or poorer) for minimal 3 months G: bilateral OME, difference in hearing level > 20 dB H: bilateral or unilateral effusion for minimal 90 days, or intermittent effusion for specified longer periods I: 4 to 6 months with OME
Groups comparable at baseline? Probably yes |
Describe intervention:
A: Shepard ventilation tube (in one ear) B: Shepard Grommet (in one ear) C: Grommets D: Bilateral armstrong ventilation tubes E: Unilateral Shepard tube F: Bilateral Shepard or Shah ventilation tubes G: Bilateral shepard Grommets H: Teflon bi-flanged ventilation tubes I: bilateral Bevel Bobbins Grommets |
Describe control:
A: myringotomy (in the other ear) B: no surgery (in the other ear) C: myringotomy only D: bilateral myringtomy/no surgery E: no intervention F: watchful wating/active monitoring G: watchful waiting/active monitoring H: no intervention I: watchful waiting/active monitoring |
End-point of follow-up:
A:7 weeks, 6, 12 and 24 months B: 6 and 12 months C t/m F: no information G:3, 6, 12, 18 and 24 months H, I: no information.
For how many participants were no complete outcome data available? (intervention/control) A: 81% seen at fu B: 92% complete data C: 40% seen at fu D: 87% seen at fu (high cross-over) E: 75% seen at fu F: 88% completed the trial G: 80% seen at FU, imputation of missing data H: 94% seen at fu I: 6% LTFU |
Outcome hearing level 3-6 months FU MD (95% CI) B: -5.30 [-10.46, -0.14] E: -19.00 [-23.50, -14.50] G: - 11.90 [-14.20, - 9.60]
9 months FU F: -3.80 [-7.79, 0.19] G: -5.60 [-8.08, -3.12] I: -2.80 [-5.48, -0.12]
12 months FU A: -4.40 [-9.09, 0.29] B: -0.80 [-5.91, 4.31] E: -9.90 [-14.15, -5.65] G: -5.60 [-8.08, -3.12] I: -2.80 [-5.48, -0.12]
Outcome time (proportion) with effusion C: -0.10 [-0.17, -0.03] D: -0.20 [-0.34, -0.06] H: -0.10 [-0.17, -0.03] I: -0.30 [-0.39, -0.21]
Pooled MD: -0.17 [-0.27, -0.07]
Outcome quality of life I: “no significant improvement”
Outcome adverse events
Tympanosclerosis present B: I: 38% vs C: 1%
Perforation and Otorrhoea C: i: 27% / c: 11% G: à not presented per management strategy I: i: 49% (95% CI 39% to 60%) / c: 10% (95% CI 4% to 16%) Long-term hearing loss |
Facultative: The authors concluded that: “In children with OME the effect of ventilation tubes on hearing, as measured by standard tests, appears small and diminishes after six to nine months by which time natural resolution also leads to improved hearing in the non-surgically treated children”
Sensitivity analyses - (sub)analysis for patients with unilateral tubes (randomization by ear) - (sub)analysis for patients with bilateral tubes (randomization by child)
Risk of Bias: A: low B: low C: some concerns D: some concerns E: low G: some concerns H: low I: low
Excluded for purpose of guideline: - Rach 1991: did not report one of the predefined outcomes |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Browning 2010 |
Yes
Reason: PICO is clearly defined |
Yes
Reason: databases and search period are described |
Yes
Reason: exclusion table with reasons is included |
Yes
Reason: overview of the baseline characteristics of the included studies is included |
Not applicable |
Yes
Reason: Cochrane RoB tool was used |
Yes
Reason: I2 was calculated |
Unclear |
No
Reason: not reported for the individual studies. |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention, and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g., Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Ahmad, J. A. W. A. D., Hussain, B. I. L. A. L., & Iftikhar, M. (2016). Comparison of Outcome of Myringotomy with and without ventilation tube in glue ear. Pak J Med Health Sci, 10(2), 467-471. |
Children in both groups received additional adenoidectomy |
|
Banigo A, Hunt A, Rourke T, Whiteside O, Aldren C. Does the EarPopper(®) device improve hearing outcomes in children with persistent otitis media with effusion? A randomised single-blinded controlled trial. Clin Otolaryngol. 2016 Feb;41(1):59-65. doi: 10.1111/coa.12480. PMID: 26095773. |
wrong intervention: auto-inflatie |
|
Bidarian-Moniri A, Ramos MJ, Ejnell H. Autoinflation for treatment of persistent otitis media with effusion in children: a cross-over study with a 12-month follow-up. Int J Pediatr Otorhinolaryngol. 2014 Aug;78(8):1298-305. doi: 10.1016/j.ijporl.2014.05.015. Epub 2014 May 23. PMID: 24882460. |
wrong intervention: auto-inflatie |
|
Diacova S, McDonald TJ, Ababii I. Clinical, functional, and surgical findings in chronic bilateral otitis media with effusion in childhood. Ear Nose Throat J. 2016 Aug;95(8):E31-7. PMID: 27551851. |
wrong study design: observational study |
|
Hellström S, Groth A, Jörgensen F, Pettersson A, Ryding M, Uhlén I, Boström KB. Ventilation tube treatment: a systematic review of the literature. Otolaryngol Head Neck Surg. 2011 Sep;145(3):383-95. doi: 10.1177/0194599811409862. Epub 2011 Jun 1. PMID: 21632976. |
SRs of higher quality available (Browning, 2010 – same studies included) |
|
MacKeith, S., Mulvaney, C. A., Galbraith, K., Marom, T., Daniel, M., Venekamp, R. P., ... & Schilder, A. G. (2022). Ventilation tubes (ventilation tubes) for otitis media with effusion (OME) in children. The Cochrane Database of Systematic Reviews, 2022(3). |
wrong design: study protocol |
|
Marchisio P, Chonmaitree T, Leibovitz E, Lieberthal A, Lous J, Mandel E, McCormick D, Morris P, Ruohola A. Panel 7: Treatment and comparative effectiveness research. Otolaryngol Head Neck Surg. 2013 Apr;148(4 Suppl):E102-21. doi: 10.1177/0194599812465397. PMID: 23536528. |
wrong design: consensus panel/review |
|
Perera R, Glasziou PP, Heneghan CJ, McLellan J, Williamson I. Autoinflation for hearing loss associated with otitis media with effusion. Cochrane Database Syst Rev. 2013 May 31;(5):CD006285. doi: 10.1002/14651858.CD006285.pub2. PMID: 23728660. |
wrong intervention: auto-inflatie |
|
Popova D, Varbanova S, Popov TM. Comparison between myringotomy and tympanostomy tubes in combination with adenoidectomy in 3-7-year-old children with otitis media with effusion. Int J Pediatr Otorhinolaryngol. 2010 Jul;74(7):777-80. doi: 10.1016/j.ijporl.2010.03.054. PMID: 20399511. |
wrong comparator: adenoidectomy |
|
Sanyaolu LN, Cannings-John R, Butler CC, Francis NA. The effect of ventilation tube insertion on quality of life in children with persistent otitis media with effusion. Clin Otolaryngol. 2020 Mar;45(2):239-247. doi: 10.1111/coa.13502. Epub 2020 Jan 6. PMID: 31869494. |
wrong design: children were randomised to steroids or no steroids; tube placement not randomised |
|
Schilder AG, Marom T, Bhutta MF, Casselbrant ML, Coates H, Gisselsson-Solén M, Hall AJ, Marchisio P, Ruohola A, Venekamp RP, Mandel EM. Panel 7: Otitis Media: Treatment and Complications. Otolaryngol Head Neck Surg. 2017 Apr;156(4_suppl):S88-S105. doi: 10.1177/0194599816633697. PMID: 28372534. |
wrong design: consensus panel/review |
|
Steele DW, Adam GP, Di M, Halladay CH, Balk EM, Trikalinos TA. Effectiveness of Tympanostomy Tubes for Otitis Media: A Meta-analysis. Pediatrics. 2017 Jun;139(6):e20170125. doi: 10.1542/peds.2017-0125. Epub 2017 May 16. PMID: 28562283. |
Low quality SR (same studies included as Browning 2010) |
|
Steele, D., Adam, G. P., Di, M., Halladay, C., Pan, I., Coppersmith, N., ... & Trikalinos, T. A. (2017). Tympanostomy tubes in children with otitis media. |
Network meta-analysis on all treatment options for OME |
|
To, K., Harrison, L., & Daniel, M. (2013). Management of otitis media with effusion and recurrent acute otitis media. The Otorhinolaryngologist. |
wrong intervention: therapeutic options for otitis media |
|
Venekamp RP, Mick P, Schilder AG, Nunez DA. Grommets (ventilation tubes) for recurrent acute otitis media in children. Cochrane Database Syst Rev. 2018 May 9;5(5):CD012017. doi: 10.1002/14651858.CD012017.pub2. PMID: 29741289; PMCID: PMC6494623. |
wrong population: children with acute OM |
|
Vlastos IM, Houlakis M, Kandiloros D, Manolopoulos L, Ferekidis E, Yiotakis I. Adenoidectomy plus tympanostomy tube insertion versus adenoidectomy plus myringotomy in children with obstructive sleep apnoea syndrome. J Laryngol Otol. 2011 Mar;125(3):274-8. doi: 10.1017/S0022215110002549. Epub 2010 Dec 16. PMID: 21205368. |
wrong comparator: adenoidectomy |
|
Wallace IF, Berkman ND, Lohr KN, Harrison MF, Kimple AJ, Steiner MJ. Surgical treatments for otitis media with effusion: a systematic review. Pediatrics. 2014 Feb;133(2):296-311. doi: 10.1542/peds.2013-3228. Epub 2014 Jan 6. PMID: 24394689. |
wrong intervention: any surgical treatment for OME (including adenoidectomy)
|
|
Yegin Y, Çelik M, Olgun B, Koçak HE, Kayhan FT. Is ventilation tube insertion necessary in children with otitis media with effusion? Otolaryngol Pol. 2015;69(6):39-44. doi: 10.5604/00306657.1184542. PMID: 26860606. |
wrong design: retrospective chart review |
|
Yousaf M, Inayatullah, Khan F. Medical versus surgical management of otitis media with effusion in children. J Ayub Med Coll Abbottabad. 2012 Jan-Mar;24(1):83-5. PMID: 23855103. |
wrong design: observational study |
|
Yousaf M, Malik SA, Haroon T. Laser Myringotomy Versus Ventilation Tubes In Otitis Media With Effusion. J Ayub Med Coll Abbottabad. 2016 Oct-Dec;28(4):773-775. PMID: 28586587.
|
Children already received 3 conservative treatments before starting treatment with tubes |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 29-04-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met Otitis Media (in de tweede lijn).
Werkgroep
- Dhr. dr. H.J. (Jeroen) Rosingh (voorzitter), KNO-arts, Isala Zwolle; NVKNO
- Mevr. dr. E.H. (Jet) van den Akker, KNO-arts, Meander MC Amersfoort; NVKNO
- Dhr. dr. M.P. (Marc) van der Schroeff, KNO-arts, Erasmus MC Rotterdam; NVKNO
- Mevr. dr. S.A.C. (Sophie) Kraaijenga, KNO-arts, Rijnstate Arnhem; NVKNO
- Mevr. dr. J.E.C. (Esther) Wiersinga-Post, Klinisch Fysicus - audioloog, UMC Groningen; NVKF
- Mevr. H.F. (Francien) Miedema MSc, logopedist/klinisch gezondheidswetenschapper, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch; NVLF
- Dhr. dr. R.P. (Roderick) Venekamp, huisarts, UMC Utrecht; NHG
- Mevr. H. (Hester) Rippen, patiëntvertegenwoordiger; Stichting Kind en Ziekenhuis
Met ondersteuning van
- Mevr. dr. A. (Anja) van der Hout, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2022)
- Mevr. D.G. (Dian) Ossendrijver, MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dhr. M. (Mitchel) Griekspoor, MSc, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. dr. I. (Iris) Duif, adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot september 2022)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Rosingh |
- KNO-arts in lsala, Zwolle (werkend in MSB verband, dus niet in dienst van het ziekenhuis) - Plaatsvervangend opleider - KNO-arts in Ziekenhuis in Suriname, MMC Nickerie (september 2022 en november 2023) |
- Voorzitter Commissie Richtlijnen NVKNO - Opleider KNO en lid van consilium - Voorzitter ad interim commissie Kwaliteit & Veiligheid van (jan. 2023 – sep 2023) |
Geen |
Geen restricties |
|
Van der Schroeff |
KNO-arts, ErasmusMC |
Geen |
Geen |
Geen restricties |
|
Rippen |
- Directeur Stichting Kind en Ziekenhuis - Eigenaar Fiduz management (strategie, advies en projectmanagement) |
- Lid Raad van Toezicht MEEr-groep - Lid Adviesraad Medgezel - Coördinator European Association for Children in Hospital (EACH) - Bestuurslid College Perinatale zorg (CPZ) - AQUA De methodologische Advies- en expertgroep Leidraad voor Kwaliteitsstandaarden (AQUA) - Penningmeester Ervaringskenniscentrum Schouders - Voorzitter Landelijke Borstvoedingsraad - Voorzitter MKS Landelijke coördinatieteam Integrale Kindzorg - Voorzitter Expertiseraad Kenniscentrum kinderpalliatieve zorg - Lid Algemene Ledenvergadering VZVZ - Lid beoordelingscommissie KIDZ |
Geen |
Geen restricties |
|
Kraaijenga |
KNO-arts, Rijnstate ziekenhuis te Arnhem. |
Geen |
Geen |
Geen restricties |
|
Wiersinga-Post |
Klinisch fysicus – audioloog, UMC Groningen |
Geen |
Geen |
Geen restricties |
|
Miedema |
Logopedist, klinisch gezondheidswetenschapper Jeroen Bosch ziekenhuis, ‘s-Hertogenbosch |
Geen |
Geen |
Geen restricties |
|
Van den Akker |
KNO-arts, Meander Medisch Centrum Amersfoort |
-Lid Kerngroep kinder kno van de Nederlandse KNO vereniging, (betaald) - Voorzitter peersupport team meander medische centrum (onbetaald) |
Geen |
Geen restricties |
|
Venekamp |
- Praktiserend huisarts, Huisartsenpraktijk Verwielstraat te Waalwijk - Associate professor, Julius Centrum, UMC Utrecht |
NHG Autorisatiecommissie (vacatiegelden) |
Onze onderzoeksgroep van de afdeling Huisartsgeneeskunde van het Julius Centrum, UMC Utrecht, verricht onderzoek naar alledaagse infectieziekten dat wordt gefinancierd door (semi)overheid, met name ZonMw, en fondsen. |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Kind en Ziekenhuis in de richtlijnwerkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Kind en Ziekenhuis en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Trommelvliesbuisjes bij pOME |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de geldigheid van de modules binnen de richtlijn Otitis media bij kinderen in de tweede lijn (need-for-update). Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in 2020. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij de richtlijn.
Op basis van de uitkomsten van deze inventarisatie zijn door de werkgroep geprioriteerd en daarbij zijn de uitgangsvragen opgesteld en definitief vastgesteld tijdens een vergadering.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nul effect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen van de verschillende modules.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. Doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. Doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. Doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. Doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. Doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. Doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html .
Zoekverantwoording
Zoekverantwoording bij module trommelvliesbuisjes pOME
Algemene informatie
|
Cluster/richtlijn: Otitis Media (MO van KNO pediatrische richtlijnen) |
|
|
Uitgangsvraag/modules: UV5 Wat is de plaats van trommelvliesbuisjes bij kinderen met otitis media met effusie (pOME)? |
|
|
Database(s): Embase.com, Ovid/Medline |
Datum: 28 april 2023 |
|
Periode: vanaf 2010 |
Talen: geen restrictie |
|
Literatuurspecialist: Alies van der Wal |
Rayyan review: https://rayyan.ai/reviews/654107 |
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
Het sleutelartikel wordt gevonden met deze search |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR |
68 |
54 |
74 |
|
RCT |
152 |
80 |
162 |
|
Observationele studies |
376 |
331 |
434 |
|
Totaal |
220 |
134 |
236* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#13 |
#6 AND (#9 OR #10) NOT (#11 OR #12) = observationeel |
376 |
|
#12 |
#6 AND #8 NOT #11 = RCT |
152 |
|
#11 |
#6 AND #7 = SR |
68 |
|
#10 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14030821 |
|
#9 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7608295 |
|
#8 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3775851 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
921642 |
|
#6 |
#5 AND [2010-2023]/py |
772 |
|
#5 |
#4 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1958 |
|
#4 |
#1 AND #2 AND #3 |
2181 |
|
#3 |
'adolescent'/exp OR 'baby'/exp OR 'boy'/exp OR 'child'/exp OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab |
5670910 |
|
#2 |
'tympanostomy tube'/exp OR 'middle ear ventilation'/exp OR 'tympanostomy'/exp OR 'tympanostomy tube placement'/exp OR 'middle ear ventilat*':ti,ab,kw OR tubulat*:ti,ab,kw OR grommet*:ti,ab,kw OR tympanostom*:ti,ab,kw OR 'armstrong':ti,ab,kw OR 't tube':ti,ab,kw OR 'paparella':ti,ab,kw OR (((tympanic OR ventilat* OR insert* OR 'middle ear*') NEAR/3 tube*):ti,ab,kw) |
24367 |
|
#1 |
'secretory otitis media'/exp OR 'glue ear*':ti,ab,kw OR ome:ti,ab,kw OR pome:ti,ab,kw OR som:ti,ab,kw OR ((('otitis media' OR 'middle ear') NEAR/3 (effusion OR exudative OR exsudative OR otorrhea OR otorrhoea OR secretory OR fluid OR mucoid* OR serous OR serosa OR adhesive)):ti,ab,kw) |
24890 |
Ovid/Medline
|
# |
Searches |
Results |
|
13 |
(6 and (9 or 10)) not (11 or 12) = observationeel |
331 |
|
12 |
(6 and 8) not 11 = RCT |
80 |
|
11 |
6 and 7 = SR |
54 |
|
10 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5409788 |
|
9 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4423127 |
|
8 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2581106 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
664166 |
|
6 |
limit 5 to yr="2010 -Current" |
607 |
|
5 |
4 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) |
1524 |
|
4 |
1 and 2 and 3 |
1574 |
|
3 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2883512 |
|
2 |
exp Middle Ear Ventilation/ or 'middle ear ventilat*'.ti,ab,kf. or tubulat*.ti,ab,kf. or grommet*.ti,ab,kf. or tympanostom*.ti,ab,kf. or 'armstrong'.ti,ab,kf. or 't tube'.ti,ab,kf. or 'paparella'.ti,ab,kf. or ((tympanic or ventilat* or insert* or 'middle ear*') adj3 tube*).ti,ab,kf. |
17002 |
|
1 |
exp Otitis Media with Effusion/ or 'glue ear*'.ti,ab,kf. or ome.ti,ab,kf. or pome.ti,ab,kf. or som.ti,ab,kf. or (('otitis media' or 'middle ear') adj3 (effusion or exudative or exsudative or otorrhea or otorrhoea or secretory or fluid or mucoid* or serous or serosa or adhesive)).ti,ab,kf. |
20906 |