Fysiotherapie en oefentherapie
Uitgangsvraag
Wat is de plaats van oefen- en fysiotherapie in de behandeling van patiënten van 50 jaar of ouder met een symptomatische stabiele wervelfractuur?
Aanbeveling
Er is op dit moment onvoldoende bewijs om beweeginterventies aan te raden bij patiënten van 50 jaar of ouder met een symptomatische stabiele wervelfractuur om pijn te verminderen en kwaliteit van leven te verbeteren.
Adviseer patiënten van 50 jaar of ouder met een symptomatische stabiele wervelfractuur en osteopenie of osteoporose, zowel in de eerste als tweede lijn, dat fysieke belasting en lichaamsbeweging volgens de landelijke beweegrichtlijn zinvol en veilig zijn om vallen en botbreuken te voorkomen en de botmineraaldichtheid te verbeteren (zie ook module Beweegadviezen bij verhoogd fractuurrisico).
Verwijs zowel in de eerste als tweede lijn naar een paramedisch bewegingsspecialist zoals een fysio- of -oefentherapeut indien:
- zelfmanagement tekort schiet;
- onduidelijk is welke oefeningen passend zijn bij de persoonlijke problematiek;
- er sprake is van meer complexe problematiek zoals comorbiditeiten of kwetsbaarheid of verhoogd valrisico (zie ook module Beweegadviezen bij verhoogd fractuurrisico).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de gunstige en ongunstige effecten van oefentherapie en/of fysiotherapie ten opzichte van standaardzorg bij patiënten van 50 jaar of ouder met een stabiele wervelfractuur (i.e. een wervelfractuur waarvoor geen operatieve stabilisatie middels osteosynthese is geïndiceerd). Op basis van een meta-analyse van twaalf gerandomiseerde studies die overeenkwamen met de onderzochte vergelijking, werd voor de cruciale uitkomstmaten pijn en kwaliteit van leven, en voor de belangrijke uitkomstmaten activiteit en complicaties een zeer lage bewijskracht gevonden, vanwege variatie in de interventies, conflicterende resultaten en overschrijding van de grenzen van klinische besluitvorming. De totale bewijskracht is daarmee zeer laag. De belangrijke uitkomstmaten participatie, spierkracht, nieuwe fracturen, vallen en valangst werden in de geïncludeerde meta-analyse niet beschreven. Hiermee kon de literatuur geen richting geven aan de besluitvorming.
In de module Beweegadviezen bij verhoogd fractuurrisico is een literatuuranalyse verricht naar het effect van bewegen op vallen, fracturen en verbetering van de botmineraaldichtheid. In de betreffende module wordt aanbevolen om een actieve leefstijl te bespreken met de patient en zo nodig een bewegingsspecialist te consulteren, indien de patient zelf niet in staat is om de beweegnorm te halen of bij complexe problematiek. Ook de KNGF-richtlijn Osteoporose, de UK consensus statement (Brooke-Wavell, 2022) en de EULAR “points to consider” (Adams, 2021) onderschrijven het belang van bewegen ter verbetering van pijn, welbevinden, fractuur- en valrisico en verbetering van de botmineraaldichtheid. Adams (2021) benadrukt daarbij het belang van samen beslissen.
De werkgroep deelt unaniem de aanbevelingen van de Osteoporose en Fractuurpreventie richtlijn, de KNGF richtlijn, de EULAR “points to consider” en de UK consensus statement om de patiënt te stimuleren tot een actieve leefstijl en zo nodig te verwijzen naar een fysiotherapeut of oefentherapeut om pijn te verminderen, kwaliteit van leven te verbeteren, fractuur- en valrisico te verlagen en botmineraaldichtheid te verbeteren.
Bij behandeling van patiënten die met osteoporose samenhangende klachten ervaren, begeleidt de fysiotherapeut of oefentherapeut de patiënt om te komen tot opheffing of vermindering van de immobiliteit, vermindering van het valrisico, het behouden of herwinnen van de zelfstandigheid na een fractuur, het bevorderen van een gezondheidsbevorderende leefstijl en stimuleren van daarmee samenhangende botbelastende activiteiten.
Toekomstig onderzoek dient een betere onderbouwing te geven van de voor- en nadelen van fysio- en oefentherapie en de verschillende vormen ervan. Een review van Gibbs over fysio-/oefentherapie na een osteoporotische wervelfractuur (2019) geeft aan dat toekomstig onderzoek specifiek zou moeten aangeven of de interventie gericht is op spierkracht, uithoudingsvermogen of beide, en de verandering in de uitkomstmaten voor zowel kracht als uithoudingsvermogen beoordelen. Verder kan het verstandig zijn om te onderzoeken of kracht of uithoudingsvermogen verandering in andere uitkomstmaten zoals houding en pijn verklaart, en deze effecten op wervelfracturen te kwantificeren. Met als doelstelling de incidentie van fracturen en vallen te verminderen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Van belang is dat een patiënt met osteoporose en een wervelfractuur vanaf de eerste dag optimaal begeleid wordt. Educatie om te bewegen staat bij het behandelen van de patiënt voorop om valangst, immobiliteit en verlies van zelfstandigheid en zelfredzaamheid te voorkomen. Hiermee kan een effectieve gecombineerde medicamenteuze en beweeginterventie aangeboden worden en neemt functioneren en participatie toe. De (beweeg)interventie, bij voorkeur begeleid door een gespecialiseerde fysiotherapeut of oefentherapeut, richt zich op het reduceren van (val)angst en pijn, het verbeteren van mobiliteit en functies met als doel het vergroten van de zelfstandigheid en zelfredzaamheid.
Kosten (middelenbeslag)
De kosten van een (beweeg)interventie, bij voorkeur begeleid door een gespecialiseerde fysiotherapeut, variëren per bezoek tussen de €25 en €45. Afhankelijk of er sprake is van wel of geen gecontracteerde zorg en of de patiënt al dan niet aanvullend verzekerd is, worden de kosten hiervan vergoed. Ook het aantal interventies dat voor vergoeding in aanmerking komt, is afhankelijk van de door de patiënt gekozen verzekeringsopties.
Deze paramedische interventies brengen maatschappelijke kosten met zich mee. Dit geldt ook voor de valrisicobeoordeling-en valanalyse, valpreventie groeps programma’s of maatwerkprogramma’s. Echter door nieuwe fracturen (waar mogelijk) te voorkomen, kan dit kosteneffectitief zijn voor de maatschappij (Zinnige Zorg - Verbetersignalement Osteoporose, 2020).
Aanvaardbaarheid, haalbaarheid en implementatie
Uit het overzicht van de regionale verbeterinitiatieven voor osteoporose blijkt dat de fysiotherapeut en oefentherapeut vaak geen deel uitmaakt van het betrokken zorgteam. Het in kaart brengen van evidentie voor oefentherapie en/of fysiotherapie kan bijdragen aan het inzichtelijk maken van de meerwaarde en richting geven aan implementatie strategieën.
Doordat (beweeg)interventies niet zijn ondergebracht in de basisverzekering, is deze zorg niet voor iedereen toegankelijk. Het betekent ook dat als passende zorg niet voor handen is dit kan leiden tot hogere zorgkosten en een nog groter verlies van arbeidscapaciteit.
Vanaf 2024 zullen valpreventieve programma’s ondergebracht worden in de basisverzekering. Deze valpreventieve programma’s zijn ontwikkeld voor vallen in het algemeen en niet voor osteoporose in het bijzonder.
In Nederland zijn er verschillende kwaliteitsnetwerken zoals bijvoorbeeld het Rug-netwerk en Chronisch Zorgnet, waar fysio- en oefentherapeuten bij zijn aangesloten met een specialisatie voor osteoporose. Deze fysio- en oefentherapeuten richten zich op de best evidence based practice behandeling zoals meer en veilig bewegen, een betere balans, een grotere botbelasting, valpreventie en leefstijlbegeleiding (zie KNGF-richtlijn Osteoporose).
De werkgroep adviseert om bij ontoereikend zelfmanagement, verminderde gezondheidsvaardigheden of complexe problematiek, bij voorkeur een fysio-en oefentherapeut te consulteren voor een beweegadvies op maat, rekening houdend met de belemmerende individuele kenmerken en wensen van de patiënt.
Daarnaast hebben patiënten met een laag valrisico baat bij een algemeen preventief beweegadvies (zie module Beweegadviezen bij verhoogd fractuurrisico).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Jaarlijks melden ongeveer 13.000 50-plussers zich op de spoedeisende hulp met een fractuur door een val. Na onderzoek blijkt de helft een verlaagde botdichtheid te hebben. Dit vergroot de kans op een nieuwe fractuur bij een volgende val.
Om een nieuwe breuk te voorkomen zijn het uitvoeren van samengestelde botbelastende interventies, gericht op spieruithoudingsvermogen, spierkracht en balans, effectief, naast valpreventieve programma’s. Daarnaast hebben patiënten baat bij algemeen preventief beweegadvies.
Onderbouwing
Achtergrond
Jaarlijks melden ongeveer 13.000 50-plussers zich op de spoedeisende hulp met een pijnlijke wervelfractuur door een val. Na onderzoek blijkt de helft een verlaagde botdichtheid te hebben. Dit vergroot de kans op een nieuwe wervelfractuur bij een volgende val. Voor zowel vermindering van pijn als ter voorkoming van vallen en ter verbetering van de botdichtheid kan oefentherapie een belangrijke behandeling zijn, maar op dit moment worden niet alle patienten verwezen voor oefentherapie.
Conclusies / Summary of Findings
Critical outcomes
|
Very low GRADE |
The evidence is very uncertain about the effect of exercise therapy on pain when compared with no exercise in patients age ≥50 with a stable vertebral fracture.
Source: Bolton, 2022. |
|
Very low GRADE |
The evidence is very uncertain about the effect of exercise therapy on disease-specific quality of life when compared with no exercise in patients age ≥50 with a stable vertebral fracture.
Source: Bolton, 2022. |
Important outcomes
|
Very low GRADE |
The evidence is very uncertain about the effect of exercise/physical therapy on activities/limitations of daily living when compared with no exercise in patients age ≥50 with a stable vertebral fracture.
Source: Bolton, 2022. |
|
Very low GRADE |
The evidence is very uncertain about the effect of exercise/physical therapy on adverse events when compared with no exercise in patients age ≥50 with a stable vertebral fracture.
Source: Bolton, 2022. |
|
No GRADE |
No data was found regarding the effect of exercise/physical therapy on participation, muscle strength, secondary fractures, falls and fear of falling when compared with no exercise in patients age ≥50 with a stable vertebral fracture. |
Samenvatting literatuur
Description of studies
Bolton (2022) performed a systematic review and meta-analysis of benefits and harms of non-surgical and nonpharmacological management of people with osteoporotic vertebral fractures compared with standard care and compared with an alternative non-pharmacological, non-invasive intervention. In this Brazilian review, trials were eligible if they were: randomized controlled trials; included participants with a diagnosis of primary osteoporosis and a vertebral fracture demonstrated on radiographs (not further specified); the experimental group received non-pharmacological or non-surgical management of more than one session (e.g., strengthening, balance, or motor control exercise interventions, bracing, taping, electrotherapy) and the comparison group received standard care or an alternative intervention (e.g., soft brace compared to rigid brace); and if at least one outcome was reported at the conclusion of the intervention. Twenty randomized controlled trials were included with 2083 participants with osteoporotic vertebral fractures. Exercise, bracing, multimodal therapy, electrotherapy, and taping were investigated interventions. The current analysis includes the 12 studies comparing exercise and/or physical therapy with usual care, the characteristics of which are outlined in table 1. Bolton assessed risk of bias of the included trials to be low, but considered the certainty of the evidence low due to inconsistency and imprecision. There was a large variation in the type, intensity and duration of the exercise interventions.
Table 1. Study characteristics
|
Study |
Comparison |
Setting |
Intervention dose and duration |
Population (intervention) |
Population (control) |
|
Barker, 2019 |
manual outpatient physiotherapy or exercise outpatient physiotherapy compared with a 1-hour single session of physiotherapy |
Clinic and home Program, UK |
Strength training intensity set at RPE level 3-4 45min session/week, 3-5/week. 6 sessions over 12 weeks. Home program for 12 months. |
N = 216 72.2 ± 8.4 y Female 85.6% |
N = 196 72.2 ± 8.4 y Female 88.7% |
|
Bennel, 2010 |
Exercise vs. no exercise |
Clinic and home program, Australia |
Individual sessions with an experienced clinician once a week for 10 weeks and performed daily home exercises; 45-minute session standardised treatment, with individualized dosage; 11 weeks. |
N = 11 66.2 ± 8.0 y Female, 63.6% |
N = 9 66.3 ± 11.8 y Female 88.7% |
|
Bergland, 2011 |
Exercise vs. no exercise |
Clinic, Norway |
Biweekly 3- month program.
|
N = 47 70.8 ± 5.9 y Female 100% |
N = 47 70.8 ± 5.9 y Female 100% |
|
Berstrom, 2001 |
Exercise -strengthening; postural advice vs. control (not specified) |
Clinic, Sweden |
Back muscle extensor strengthening program for 1 h, twice a week for 4 months |
N = 20 73.2 ± 8.9 y Female 100% |
N = 16 74.1 ± 6.0 y Female 100% |
|
Cergerl, 2019 |
Supervised exercise vs. home exercise vs. control (not specified) |
Clinic or home Program, Turkey |
Exercise program including strengthening exercise for the back extensor muscles, three times per week for 6 weeks. |
N = 20; 20 58.9 ± 4.7; 60.2 ± 7.6 y Female 100% |
N = 20 59.7 ± 6.5 y Female 100% |
|
Evstigneeva, 2016 |
Exercise vs. no exercise |
Clinic, Canada |
40-minute program twice weekly, 12 months |
N = 40 70.7 ± 8.1 y Female 100% |
N = 38 67.6 ± 7.0 y Female 100% |
|
Giangregorio, 2018 |
Exercise vs. no exercise |
Home, Australia and Canada |
Home exercise program supported by 6 home visits by physical therapist; 5-8 exercises 2 sets of 8-10 reps or isometric holds of 3-5 seconds; 12 months |
N = 71 76 ± 6.4 y Female 100% |
N = 70 77 ± 7.3 y Female 100% |
|
Gold, 2004 |
Exercise vs. health education |
Clinic, USA |
Exercise 3x week for 6 months; Coping class x2 week for 6 months |
N = 94 80.2 ± 4.8 y Female 100% |
N = 91 82.0 ± 6.2 y Female 100% |
|
Karaksidou, 2013 |
Exercise vs. no exercise |
Clinic, Greece |
3x week 1-hour one-on-one sessions with physical therapist; 13-week program |
N = 10 67.6 ± 6.41 y Female 100% |
N = 10 69.3 ± 4.4 y Female 100% |
|
Malmros, 1998 |
Exercise vs. no exercise |
Clinic and home exercise program, Denmark |
60-minute twice weekly physical therapy-led sessions; 10-week program |
N = 27 65 y (25:75 percentile 62:70) |
N = 25 68 y (25:75 percentile 64:71) |
|
Papaioannou, 2002 |
Exercise vs. no exercise |
Home program, Canada |
60-minutes 3x per week; 12 months |
N = 37 71.6 ± 7.3 y Female 100% |
N = 37 72.2 ± 7.98 y Female 100% |
|
Stranghelle, 2019 |
Exercise vs. no exercise |
Clinic, Norway |
One session, twice weekly, physical therapist led sessions; 12 weeks |
N = 76 74.6 ± 6.1 y Female 100% |
N = 73 73.7 ± 5.6 y Female 100% |
Results
Pain
Bolton (2022) reported pain as the primary outcome, transformed to a scale of 0-10 (higher score indicates more pain). Based on six trials with in total 561 participants, the pooled mean difference was -1.18 in favour of exercise, with a 95% confidence interval (CI) of -2.26 to -0.10, as depicted in figure 1. The difference was not considered clinically relevant.
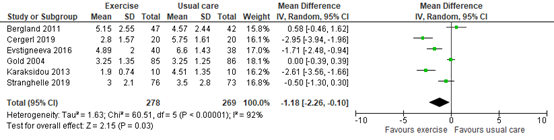
Figure 1. Pain after exercise therapy versus usual care
Post-intervention means and standard deviation. Pain outcomes for individual trials were transformed to a common scale (0 to 10, higher indicates more pain). Random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect.
Quality of life
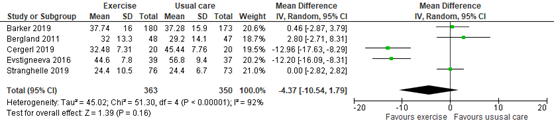
The outcome quality of life by QUALEFFO was reported in 5 trials, as depicted in figure 2. Based on 713 participants, the mean difference was -4.37 in favour of exercise, with a 95% CI of -10.54 to 1.79. The difference was not considered clinically relevant.
Figure 2. Quality of life after exercise therapy versus usual care
Post-intervention QUALEFFO, means and standard deviation. Random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect.
Activities/limitations of daily living
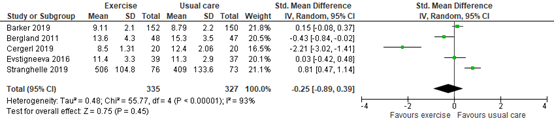
Bolton reported activity, but did not specify how it was assessed. Based on five trials with in total 662 participants, the standardized mean difference was -0.25 in favor of exercise, with a 95% CI of -0.89 to 0.39. The difference was not considered clinically relevant.
Figure 3. Activity after exercise therapy versus usual care
Post-intervention means and standard deviation. Random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect.
Secondary fractures and other adverse events
Bolton did not report new fractures separately, but included fractures in serious adverse events.
The two studies that reported serious adverse events found conflicting results. The study by Evistigneeva found 4/40 patients (10%) with serious adverse events in the exercise group versus 7/38 (18%) in the usual care group, resulting in a risk ratio (RR) of 1.84 (95% CI 0.59 to 5.79) in favour of exercise. Giangregorio however, reported events in 18/71 patients (25%) in the exercise group versus 12/70 (17%) in the control group, resulting in a RR of 0.68 (95% CI 0.35 to 1.30) in favour of no exercise.
One study reported non-serious adverse events. Bergstrom found events in 1/20 patients (5.0%) in the exercise group versus 1/16 (6.3%) in the usual care group, resulting in a risk ratio (RR) of 1.25 (95% CI 0.08 to 18.46) in favour of exercise.
Participation (including work)
The outcome participation was not reported by Bolton (2022).
Muscle strength
The outcome muscle strength was not reported by Bolton (2022).
Falls and fear of falling
The outcomes falls and fear of falling were not reported by Bolton (2022).
Level of evidence of the literature
The level of evidence regarding all outcome measures was based on randomized controlled studies and therefore started at high.
For the outcome measures pain, QOL and activities/limitations in daily living, the level of evidence was downgraded by three levels to VERY LOW due to conflicting results (inconsistency, -1), because the pooled CI overlapped with the limit of clinical decision-making (imprecision, -1) and due to clinical heterogeneity in the interventions (large variation in type, frequency, intensity and duration of interventions, -1).
For the outcome measure adverse events, the level of evidence was downgraded by three levels to VERY LOW due to conflicting results (inconsistency, -1), the limited population size (imprecision, -1) and due to clinical heterogeneity in the interventions (variation in type, frequency, intensity and duration of interventions, -1).
For the outcome measures participation, secondary fractures, muscle strength, falls and fear of falling, the level of evidence could not be determined due to a lack of data.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the benefits and harms of exercise therapy and/or physical therapy in patients aged 50 years or older with a stable vertebral fracture, compared with usual care?
P: patients aged 50 years or older with a stable vertebral fracture;
I: exercise and/or physical therapy;
C: usual care;
O: pain, quality of life, activities/limitations of daily living, secondary fractures, (other) adverse events, participation (including work), muscle strength, number of falls, fear of falling.
The benefits and harms of exercise therapy to decrease fracture and fall risk and improve bone strength have been reported in the section Beweegadviezen bij verhoogd fractuurrisico.
Relevant outcome measures
The guideline development group considered pain and QOL as critical outcome measures for decision making; and activities of daily living, secondary fractures, adverse events, participation (including work), muscle strength, number of falls, fear of falling as important outcome measures for decision making. Exercise therapy was defined as a combination of flexibility, extension, core stability and aerobe exercises.
The guideline development group defined the outcome measure pain as VAS score, NRS score, and/or use of pain medication. For quality of life, the osteoporosis-specific QUALEFFO was preferred over EQ-5D. The working group did not define the other outcome measures a priori, but followed the definitions used in the studies.
The working group defined 20% of the maximum score as a minimal clinically (patient) important difference for pain (NRS or VAS) and QOL, 30% for RMDQ (based on on MCID for low back pain in Jordan, 2006), 13 points for ODI (based on on MCID for low back pain), 25% for risk ratios (RR) and 0.5 for standardized mean differences.
Search and select (Methods)
The databases Embase and Ovid/Medline were searched with relevant search terms from 2017 until August 15, 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 114 unique hits. Studies were selected based on the following criteria: (1) randomized controlled trials or a meta-analysis thereof; (2) comparison between exercise/physical therapy and usual care; (3) patients with a stable vertebral fracture. Based on title and abstract screening, sixteen studies were initially selected. After reading the full text, fifteen studies were excluded (see the table with reasons for exclusion under the tab Methods), and one meta-analysis was included.
Results
One meta-analysis was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Adams J, Wilson N, Hurkmans E, Bakkers M, Baláová P, Baxter M, Blavnsfeldt AB, Briot K, Chiari C, Cooper C, Dragoi RG, Gäbler G, Lems W, Mosor E, Pais S, Simon C, Studenic P, Tilley S, de la Torre-Aboki J, Stamm TA. 2019 EULAR points to consider for non-physician health professionals to prevent and manage fragility fractures in adults 50 years or older. Ann Rheum Dis. 2021 Jan;80(1):57-64. doi: 10.1136/annrheumdis-2020-216931. Epub 2020 Apr 24. PMID: 32332077; PMCID: PMC7788058.
- Bolton K, Wallis JA, Taylor NF. Benefits and harms of non-surgical and non-pharmacological management of osteoporotic vertebral fractures: A systematic review and meta-analysis. Braz J Phys Ther. 2022 Jan-Feb;26(1):100383. doi: 10.1016/j.bjpt.2021.100383. Epub 2022 Jan 10. PMID: 35063701; PMCID: PMC8784306.
- Brooke-Wavell K, Skelton DA, Barker KL, Clark EM, De Biase S, Arnold S, Paskins Z, Robinson KR, Lewis RM, Tobias JH, Ward KA, Whitney J, Leyland S. Strong, steady and straight: UK consensus statement on physical activity and exercise for osteoporosis. Br J Sports Med. 2022 May 16;56(15):83746. doi: 10.1136/bjsports-2021-104634. Epub ahead of print. PMID: 35577538; PMCID: PMC9304091.
- de Kam D, Smulders E, Weerdesteyn V, Smits-Engelsman BC. Exercise interventions to reduce fall-related fractures and their risk factors in individuals with low bone density: a systematic review of randomized controlled trials. Osteoporos Int. 2009 Dec;20(12):2111-25. doi: 10.1007/s00198-009-0938-6. Epub 2009 May 7. PMID: 19421702.
- Gibbs JC, MacIntyre NJ, Ponzano M, Templeton JA, Thabane L, Papaioannou A, Giangregorio LM. Exercise for improving outcomes after osteoporotic vertebral fracture. Cochrane Database Syst Rev. 2019 Jul 5;7(7):CD008618. doi: 10.1002/14651858.CD008618.pub3. PMID: 31273764; PMCID: PMC6609547.
- Johnsen LG, Hellum C, Nygaard OP, Storheim K, Brox JI, Rossvoll I, Leivseth G, Grotle M. Comparison of the SF6D, the EQ5D, and the oswestry disability index in patients with chronic low back pain and degenerative disc disease. BMC Musculoskelet Disord. 2013 Apr 26;14:148. doi: 10.1186/1471-2474-14-148. PMID: 23622053; PMCID: PMC3648434.
- Jordan K, Dunn KM, Lewis M, Croft P. A minimal clinically important difference was derived for the Roland-Morris Disability Questionnaire for low back pain. J Clin Epidemiol. 2006 Jan;59(1):45-52. doi: 10.1016/j.jclinepi.2005.03.018. Epub 2005 Nov 4. PMID: 16360560.
- Zorginstituut Nederland, Verbetersignalement Osteoporose. Zinnige Zorg, ICD-10- hoofdstuk XIII, M80-85. 11 augustus 2020. https://www.zorginstituutnederland.nl/publicaties/rapport/2020/08/11/zinnige-zorg-verbetersignalement-osteoporose
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What are the benefits and harms of exercise therapy and/or physical therapy in patients aged 50 years or older with a vertebral fracture, compared with usual care?
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Bolton, 2022 |
Yes |
Yes |
No Excluded studies were not.described. |
Yes |
N/A |
Yes |
Yes |
Yes |
Unclear Not specified for included studies |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Spiegl U, Bork H, Grüninger S, Maus U, Osterhoff G, Scheyerer MJ, Pieroh P, Schnoor J, Heyde CE, Schnake KJ. Osteoporotic Fractures of the Thoracic and Lumbar Vertebrae: Diagnosis and Conservative Treatment. Dtsch Arztebl Int. 2021 Oct 8;118(40):670-677. doi: 10.3238/arztebl.m2021.0295. PMID: 34342263; PMCID: PMC8727857. |
More recent systematic review used |
|
Gibbs JC, MacIntyre NJ, Ponzano M, Templeton JA, Thabane L, Papaioannou A, Giangregorio LM. Exercise for improving outcomes after osteoporotic vertebral fracture. Cochrane Database Syst Rev. 2019 Jul 5;7(7):CD008618. doi: 10.1002/14651858.CD008618.pub3. PMID: 31273764; PMCID: PMC6609547. |
More recent systematic review used |
|
Stanghelle B, Bentzen H, Giangregorio L, Pripp AH, Skelton DA, Bergland A. Effects of a resistance and balance exercise programme on physical fitness, health-related quality of life and fear of falling in older women with osteoporosis and vertebral fracture: a randomized controlled trial. Osteoporos Int. 2020 Jun;31(6):1069-1078. doi: 10.1007/s00198-019-05256-4. Epub 2020 Jan 10. Erratum in: Osteoporos Int. 2020 Apr 27;: PMID: 31925473. |
Included in systematic review |
|
Stanghelle B, Bentzen H, Giangregorio L, Pripp AH, Skelton DA, Bergland A. Physical fitness in older women with osteoporosis and vertebral fracture after a resistance and balance exercise programme: 3-month post-intervention follow-up of a randomised controlled trial. BMC Musculoskelet Disord. 2020 Jul 18;21(1):471. doi: 10.1186/s12891-020-03495-9. PMID: 32682416; PMCID: PMC7368978. |
Included in systematic review |
|
Gibbs JC, McArthur C, Wark JD, Thabane L, Scherer SC, Prasad S, Papaioannou A, Mittmann N, Laprade J, Kim S, Khan A, Kendler DL, Hill KD, Cheung AM, Bleakney R, Ashe MC, Adachi JD, Giangregorio LM. The Effects of Home Exercise in Older Women With Vertebral Fractures: A Pilot Randomized Controlled Trial. Phys Ther. 2020 Apr 17;100(4):662-676. doi: 10.1093/ptj/pzz188. PMID: 31899499; PMCID: PMC7439228. |
Included in systematic review |
|
Barker KL, Newman M, Stallard N, Leal J, Lowe CM, Javaid MK, Noufaily A, Hughes T, Smith D, Gandhi V, Cooper C, Lamb SE; PROVE trial group. Physiotherapy rehabilitation for osteoporotic vertebral fracture-a randomised controlled trial and economic evaluation (PROVE trial). Osteoporos Int. 2020 Feb;31(2):277-289. doi: 10.1007/s00198-019-05133-0. Epub 2019 Nov 12. PMID: 31720722. |
Included in systematic review |
|
Çergel Y, Topuz O, Alkan H, Sarsan A, Sabir Akkoyunlu N. The effects of short-term back extensor strength training in postmenopausal osteoporotic women with vertebral fractures: comparison of supervised and home exercise program. Arch Osteoporos. 2019 Jul 27;14(1):82. doi: 10.1007/s11657-019-0632-z. PMID: 31352573. |
Included in systematic review |
|
Evstigneeva L, Lesnyak O, Bultink IE, Lems WF, Kozhemyakina E, Negodaeva E, Guselnikova G, Belkin A. Effect of twelve-month physical exercise program on patients with osteoporotic vertebral fractures: a randomized, controlled trial. Osteoporos Int. 2016 Aug;27(8):2515-24. doi: 10.1007/s00198-016-3560-4. Epub 2016 Mar 16. PMID: 26984569. |
Included in systematic review |
|
Al-Sari UA, Tobias JH, Clark EM. Self-reported everyday physical activities in older people with osteoporotic vertebral fractures: a systematic review and meta-analysis. Osteoporos Int. 2018 Jan;29(1):19-29. doi: 10.1007/s00198-017-4287-6. Epub 2017 Nov 3. PMID: 29098348. |
More recent systematic review used |
|
Tsuda T. Epidemiology of fragility fractures and fall prevention in the elderly: a systematic review of the literature. Curr Orthop Pract. 2017 Nov;28(6):580-585. doi: 10.1097/BCO.0000000000000563. Epub 2017 Oct 27. PMID: 29177024; PMCID: PMC5671779. |
More recent systematic review used |
|
Hassan S, Seung SJ, Clark RE, Gibbs JC, McArthur C, Mittmann N, Thabane L, Kendler D, Papaioannou A, Wark JD, Ashe MC, Adachi JD, Templeton JA, Giangregorio LM. Describing the resource utilisation and costs associated withvertebral fractures: the Build Better Bones with Exercise (B3E) Pilot Trial. Osteoporos Int. 2020 Jun;31(6):1115-1123. doi: 10.1007/s00198-020-05387-z. Epub 2020 Mar 26. PMID: 32219499. |
Predefined outcomes not reported |
|
Gregson CL, Armstrong DJ, Bowden J, Cooper C, Edwards J, Gittoes NJL, Harvey N, Kanis J, Leyland S, Low R, McCloskey E, Moss K, Parker J, Paskins Z, Poole K, Reid DM, Stone M, Thomson J, Vine N, Compston J. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022 Apr 5;17(1):58. doi: 10.1007/s11657-022-01061-5. Erratum in: Arch Osteoporos. 2022 May 19;17(1):80. PMID: 35378630; PMCID: PMC8979902. |
No data for meta-analysis |
|
Brooke-Wavell K, Skelton DA, Barker KL, Clark EM, De Biase S, Arnold S, Paskins Z, Robinson KR, Lewis RM, Tobias JH, Ward KA, Whitney J, Leyland S. Strong, steady and straight: UK consensus statement on physical activity and exercise for osteoporosis. Br J Sports Med. 2022 May 16;56(15):837–46. doi: 10.1136/bjsports-2021-104634. Epub ahead of print. PMID: 35577538; PMCID: PMC9304091. |
No data for meta-analysis |
|
Barker KL, Newman M, Stallard N, Leal J, Minns Lowe C, Javaid MK, Noufaily A, Adhikari A, Hughes T, Smith DJ, Gandhi V, Cooper C, Lamb SE. Exercise or manual physiotherapy compared with a single session of physiotherapy for osteoporotic vertebral fracture: three-arm PROVE RCT. Health Technol Assess. 2019 Aug;23(44):1-318. doi: 10.3310/hta23440. PMID: 31456562; PMCID: PMC6732718. |
Included in systematic review |
|
Giangregorio LM, Gibbs JC, Templeton JA, Adachi JD, Ashe MC, Bleakney RR, Cheung AM, Hill KD, Kendler DL, Khan AA, Kim S, McArthur C, Mittmann N, Papaioannou A, Prasad S, Scherer SC, Thabane L, Wark JD. Build better bones with exercise (B3E pilot trial): results of a feasibility study of a multicenter randomized controlled trial of 12 months of home exercise in older women with vertebral fracture. Osteoporos Int. 2018 Nov;29(11):2545-2556. doi: 10.1007/s00198-018-4652-0. Epub 2018 Aug 8. PMID: 30091064. |
Included in systematic review |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 18-04-2024
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met symptomatishce stabiele wervelfracturen.
Werkgroep
- prof. dr. P.C. (Paul) Willems, orthopedisch chirurg, Maastricht UMC+, Maastricht, NOV (voorzitter)
- dr. M.J. (Marc) Nieuwenhuijse, orthopedisch chirurg, Amphia Ziekenhuis, Breda, NOV
- dr. H.C.A. (Harm) Graat, orthopedisch chirurg, Noordwest Ziekenhuisgroep, NOV
- dr. E. (Eva) Jacobs, orthopedisch chirurg, Maastricht UMC+, Maastricht, NOV
- dr. A.G. (Annegreet) Vlug, internist-endocrinoloog Jan van Goyen Medisch Centrum en Onze Lieve Vrouwen Gasthuis in Amsterdam, NIV
- dr. C.A.H (Caroline) Klazen, Radioloog, Medisch spectrum Twente, Enschede, NVvR
- prof. dr. W.F. (Willem) Lems, reumatoloog, Amsterdam UMC, Amsterdam, NVR
- dr. H. (Hanna) Willems, Klinisch geriater, Amsterdam UMC, Amsterdam, NVKG
- drs. J. (Joost) Hoekstra, Traumachirurg UMCG, Groningen, NVvH
- drs. E.L.S. (Annelies) Kievit, anesthesioloog-pijnspecialist, Medisch Centrum Leeuwarden, NVA
- drs. C.F.M.G. (Christianne) Bessems, geriatriefysiotherapeut, Bronzwaer Fysiotherapie, Maastricht, KNGF
- H.J.G. (Harry) van den Broek, patiëntvertegenwoordiger Osteoporose Vereniging, Den Haag, Osteoporose Vereniging
Klankbordgroep
- E.E. (Erna) Hiddink, Oefentherapeut Mensendieck, Opella, VvOCM
- H.A.A. (Riekie) van Beers, verpleegkundig specialist, Amphia ziekenhuis, Breda, V&VN
- Dr. I. (Iris) Ketel, wetenschappelijk medewerker NHG, Nederlands Huisartsen Genootschap, Utrecht, NHG
- Dr. M.C. (Marloes) Minnaard, wetenschappelijk medewerker NHG, Nederlands Huisartsen Genootschap, Utrecht, NHG
Met ondersteuning van
Dr. M.S. (Matthijs) Ruiter, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bessems |
Geriatriefysiotherapeut MSc. Eerstelijnszorg Bronzwaer Fysiotherapie en Valkfysio |
Docent en examinator Avans+ opleiding master geriatriefysiotherapie |
Geen |
Geen restricties |
|
Hoeks |
Traumachirurg UMCG |
Docent UMCG/RUG |
Geen financiële belangen anders dan als traumachirurg betrokken bij de behandeling van patiënten met wervelfracturen |
Geen restricties |
|
Jacobs |
Orthopedisch chirurg MUMC+ Maastricht |
Geen |
Extern gefinancierd onderzoek. ZonMw: Cost-effectiveness of dynamic bracing versus standard care alone in patients suffering from osteoporotic vertebral fractures - a multicenter RCT. Geen projectleider. |
Geen restricties |
|
Graat |
Orthopedisch chirurg (Noordwest Ziekenhuisgroep) |
Geen |
Geen |
Geen restricties |
|
Klazen |
Radioloog, Medisch spectrum Twente |
Geen |
Geen |
Geen restricties |
|
Kievit |
anesthesioloog-pijnspecialist medisch centrum leeuwarden (betaald) |
Geen |
Geen |
Geen restricties |
|
Lems |
hoogleraar reumatologie in amsterdam umc (o,8 FTE), ook werkzaam in Reade (o,2 fTE) |
Hoofdredacteur Ned Tijdschrift reumatologie (betaald), Secretaris IWO (betaald), Steering Committee Capture the Fracture (onderdeel IOF, onbetaald), Board of Directors ECTS (onbetaald). |
Geen |
Geen restricties, adviesraden buiten afbakening richtlijn |
|
Nieuwenhuijse |
Orthopedisch chirurg Amphia Ziekenhuis Breda |
Geen |
Geen |
Geen restricties |
|
Van den Broek |
Voorzitter Osteoporose Vereniging (vrijwilliger, onbezoldigd) |
DGA Consultec BV (Eigen holding, houder pensioenrechten) deels betaald. Bestuurslid Energiek Heusden (energiecoöperatie, onbezoldigd) |
De osteoporose vereniging heeft geen extern gefinancierd onderzoek, dus niet van toepassing. Zij ontvangt subsidie, sponsoring en donatie voor het organiseren van verenigingsactiviteiten van VWS, ReumaNederland, contributie en bedrijven (waaronder Farma). |
Geen restricties |
|
Vlug |
Internist-endocrinoloog Jan van Goyen Medisch Centrum en Onze Lieve Vrouwen Gasthuis in Amsterdam Onderzoeker Centrum voor Botkwaliteit Leids Universitair Medisch Centrum |
Board Member of the European Calcified Tissue Society Chair of the Academy of the European Calcified Tissue Society Scientific Board Member of the International Bone Marrow Adiposity Society Dutch Ambassador of the American Society for Bone and Mineral Research Lid van de stuurgroep Women's Health van de Nederlandse Vereniging voor Obstetrie en Gynaecologie Educational activities for Amgen and UCB: develop and present webinars on osteoporosis to educate health care professionals Educational activities for Abbott: develop and present webinars on flash glucose monitoring for diabetes to educate health care professionals |
In afgelopen drie jaar twee keer deelgenomen aan adviesraad, een keer voor Abbott over flash glucose monitoring voor diabetes en een keer voor UCB over het gebruik van Romosozumab. Op dit moment ben ik niet actief betrokken bij een adviesraad. |
Geen restricties |
|
P. Willems |
Orthopedisch chirurg, Maastricht UMC; Hoogleraar lntegrated Spinal Care, Universiteit Maastricht |
geen |
Extern gefinancierd onderzoek. Zorginstituut NL: Samen beslissen o.b.v. uitkomstinformatie in een multidisciplinaire context: setting Stadspoli Rug, Maastricht. Geen projectleider.
ZonMw: Cost-effectiveness of dynamic bracing versus standard care alone in patients suffering from osteoporotic vertebral fractures - a multicenter RCT. Projectleider. |
Geen restricties |
|
H. Willems |
Klinisch geriater en internist, Amsterdam UMC, |
Bestuurder stichting zorgevaluatie en voorzitter werkgroep Leading the change, 0,1 FTE, betaald. |
speakersfee, advisoryboard AMGEN en UCB, gelden worden gedoneerd aan onderzoek van de afdeling ouderengeneeskunde. |
Geen restricties |
|
Ruiter |
Adviseur Kennisinstituut |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van een afgevaardigde van de Osteoporose Vereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan deze vereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module fysio-/oefentherapie |
geen substantiële financiële gevolgen |
Het betreft geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening. Veel patiënten ontvangen nu ook al fysio-/oefentherapie, alleen niet specifiek gericht op wervelfracturen bij osteoporose. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module braces |
geen substantiële financiële gevolgen |
Het betreft geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening. Er worden daarom substantiële financiële gevolgen verwacht. |
|
Module cementaugmentatie |
geen substantiële financiële gevolgen |
Op dit moment wordt cement augmentatie niet vergoed door de zorgverzekeraars. Wanneer dit wel vergoed wordt, dan zou dit een beperkte stijging van de zorgkosten met zich meebrengen. |
|
Module multidisciplinaire afstemming |
geen substantiële financiële gevolgen |
Dit betreft een betere afstemming tussen de disciplines, waardoor patiënten mogelijk sneller en adequater geholpen kunnen worden, met een positief effect op de zorgkosten. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
De Nederlandse Orthopaedische Vereniging signaleerde bij de herziening van de richtlijn Osteoporose en fracttuurpreventie het ontbreken van modules over conservatieve en invasieve behandelopties voor osteoporotische wervelfacturen. In overleg met de Nederlandse Internisten Vereniging en richtlijnwerkgroep zijn de aanvullende knelpunten vastgesteld. Er is een nieuwe werkgroep gevormd voor de aanvullende modules en deze heeft vervolgens de uitgangsvragen geprioriteerd en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie GRADE working group). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.