Klinische tests bij diagnose OSA
Uitgangsvraag
Welke klinische testen dienen te worden ingezet voor de diagnose van OSA?
Aanbeveling
Doe voorafgaand aan een slaaponderzoek altijd een somnologische anamnese (zie bijlage Slaapanamnese).
Verricht initieel een type 3 slaaponderzoek bij patiënten met een hoge verdenking op OSA(S) (indien bij klinische beoordeling tenminste 2 van de 3 kenmerken aanwezig (snurken, geobserveerde ademstops, verhoogde slaperigheid (bijvoorbeeld ESS ≥10)), zonder verdenking op een andere slaapstoornis (op basis van de anamnese) en/of onderstaande subgroepen.
Verricht een type 1 (video-geobserveerd) of type 2 meting bij:
- tongzenuwstimulatiezorg of irreversibele OSA-chirurgie;
- second opinion;
- discrepantie tussen klachten en uitslag van de test; of
- patiënten bij wie naast OSA aan méér/andere slaapstoornis gedacht wordt
(bijvoorbeeld insomnie, parasomnie, centrale hypersomnie/narcolepsie, nachtelijke epilepsie, RBD, PLMD).
Overweeg laagdrempelig een PSG uit te voeren bij:
- verdenking centraal slaapapneu of bijkomende hypoventilatie;
- ernstig COPD, hartfalen en chronisch atriumfibrilleren, neuromusculaire aandoening, ernstige restrictieve longaandoening;
- bij verdenking OSA met lage pre-test waarschijnlijkheid , zoals premenopauzale vrouwen en ouderen; of
- andere patiëntgebonden omstandigheden, zoals woonomstandigheden, voorkeur van de patiënt (bijvoorbeeld bij angst), verstandelijke of fysieke beperking.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit de literatuuranalyse van de klinische nutstudies komt naar voren dat een slaaponderzoek met type 3 monitor waarschijnlijk niet inferieur is aan een PSG met betrekking tot effecten op kwaliteit van leven en slaperigheid bij patiënten die voldeden aan de inclusiecriteria van de studies (snurken, slaperigheid overdag en/of verdenking op OSA door partner). Ook werden er geen duidelijke verschillen gevonden op de andere klinische uitkomstmaten (lage tot redelijke bewijskracht). Op basis van de diagnostische testaccuratesse lijken met een type 3 monitor weinig patiënten te worden gemist met de diagnose OSA. Een relevant deel van de patiënten zonder OSA krijgt waarschijnlijk wel ten onrechte de diagnose OSA. Dit kan leiden tot onterechte, intensieve behandelingen.
Er werden geen studies gevonden waarin het klinisch nut van een type 2 monitor (ambulante PSG) werd vergeleken met een standaard PSG (type 1 monitor) of type 3 monitor. Type 2 en 3 zijn voor OSA de twee meest gebruikte diagnostische testen in Nederland. Op basis van de diagnostische testaccuratesse (3 onderzoeken) lijken er geen grote verschillen te zijn tussen type 1 en 2. De auteurs van de Cochrane rapport (Heus, 2018) schrijven dat gegeven de overeenkomsten en de aard van onderzoeken met een type 2 monitor (een uitbreiding van metingen van onderzoek met type 3 monitoren) het aannemelijk is dat het klinisch nut op zijn minst vergelijkbaar is met dat van type 3.
Uit Tabel 2 komt naar voren dat het aantal fout-positieven en fout-negatieven sterk afhangt van de prevalentie van OSA in de onderzochte populatie. Bij gelijkblijvende sensitiviteit zal het aantal gemiste diagnosen per 1000 geteste personen (fout-negatieven) stijgen, als de OSA-prevalentie toeneemt. Het omgekeerde geldt voor het aantal fout-positieven: bij gelijkblijvende specificiteit zal het aantal ten onrechte gestelde diagnosen (fout-positieven) per 1000 geteste personen juist dalen, als de OSA-prevalentie toeneemt. Het is dan ook belangrijk om een goede anamnese en lichamelijk onderzoek af te nemen en alleen diagnostiek te verrichten bij patiënten waarbij OSA op basis van symptomen waarschijnlijk is.
Als kanttekening bij de klinische nut onderzoeken kan worden opgemerkt dat deze zijn gedaan in grotendeels mannelijke populaties, gemiddeld gezien met (ernstig) overgewicht, zonder ernstige comorbiditeit, van middelbare leeftijd, dus een vrij algemene OSA-populatie. Wanneer de studies in andere populaties waren uitgevoerd, zou dit hebben kunnen leiden tot andere conclusies. Zo presenteren vrouwen zich op een andere manier dan mannen (Bosignore, 2019); met name premenopauzale vrouwen hebben een andere klachtenpresentatie. Er zijn aanwijzingen dat ze relatief veel klachten hebben bij een lagere AHI en ook REM-slaap gerelateerd OSA komt vaker voor dan bij mannen. Ook kunnen de resultaten niet zonder meer geëxtrapoleerd worden naar specifieke patiëntgroepen en ouderen, omdat dat niet goed is onderzocht.
Een type 3 slaaponderzoek is minder belastend, meer beschikbaar en goedkoper dan een PSG. Er kunnen echter geen slaap, slaapstadia en arousals worden vastgesteld indien een PG-onderzoek als type 3 onderzoek wordt ingezet. Een PG-onderzoek meet de AHI op basis van aantal uren in bed, terwijl een PSG de meting baseert op de slaapduur. Gevolg is dat berekende indexen in een PG-onderzoek, zoals de AHI, gebaseerd zijn op tijd in bed, in plaats van totale slaaptijd, wat een onderschatting kan geven van de werkelijke ernst van de OSA. Indien een PAT-onderzoek wordt ingezet, wordt met behulp van actigrafie wel een waarschijnlijk nauwkeuriger schatting gemaakt van de AHI in vergelijking met een type 3 slaaponderzoek zonder actigrafie. Met een PSG kunnen de respiratoire gebeurtenissen nauwkeurig worden vastgesteld in relatie tot de slaapstadia en arousals in het EEG. Fysiologische effecten van de ademhalingsgebeurtenissen op onder andere slaapcontinuïteit, zuurstofsaturatie, beenbewegingen en hartfrequentie zijn met deze techniek aantoonbaar en kwantificeerbaar. Hierdoor kunnen met een PSG ook andere slaapstoornissen worden gediagnosticeerd, die apart van of samen met OSA kunnen voorkomen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten is het belangrijk dat ze vooral tijdig de beste diagnostiek krijgen om de juiste behandeling te krijgen. En bij verdenking op een fout-negatieve uitslag verder onderzoek te krijgen. Men hecht over het algemeen meer waarde aan een goede anamnese, de juiste diagnose en een goede nabehandeling, dan aan het type slaaponderzoek.
Het verschil in belasting voor de patiënt van PG of een PSG-meting thuis is niet heel groot. Een PSG kost de patiënt iets meer tijd door het plaatsen van de elektrodes.
Kosten (middelenbeslag)
Toegankelijkheid en lage kostprijs, althans wanneer de technische inzet en beoordeling van het resultaat correct worden toegepast, zijn vooralsnog voordelen van type 3 slaaponderzoek. De technische ontwikkelingen van zowel apparatuur als van de software zijn dusdanig, dat de kostprijs van een ambulante PSG aanzienlijk lager zijn geworden in de afgelopen jaren. Rekening houdend met de inherente beperkingen en in het perspectief van de huidige technologische (r)evolutie is het mogelijk dat PG in de toekomst aan belang zal afnemen ten voordele van PSG. De mogelijkheden om de complexiteit van PSG te reduceren, en daardoor goedkoper en toegankelijker te maken voor ambulant gebruik, liggen voor de hand (Pevernagie, 2015). De kosten van een ambulant PSG (type 2) zijn lager dan voor een klinisch PSG (type 1) (geen opname, geen tijd kwijt aan video beoordeling). Type 3 en type 2 verschillen ook in prijs, maar het verschil in kostprijs wordt steeds kleiner.
Aanvaardbaarheid, haalbaarheid en implementatie
Er dient altijd een uitgebreide anamnese gedaan te worden voorafgaand aan een slaaponderzoek. Voor een doelmatige inzet van zowel type 3 onderzoek als PSG is het van belang dat de, BIG-geregistreerde, behandelaar voldoende kennis en expertise heeft in het aandachtsgebied slaapgeneeskunde (bevoegd en bekwaam, dit kan in een verlengde armconstructie). Deze kwalificaties zijn vereist om zowel pre-testwaarschijnlijkheid te kunnen inschatten als post-test resultaten genuanceerd te kunnen interpreteren. Voor artsen is bij de keuze voor type 3 of PSG, naast de inhoudelijke opbrengst, de beschikbaarheid van het aanvullend onderzoek van belang. Dit verschilt per afdeling. Voor klinieken die alleen type 3 onderzoeken aanbieden, zou het betekenen dat bij patiënten die na de intake een indicatie voor PSG hebben, ze PSG moeten implementeren of een samenwerkingsverband met een andere partij moeten aangaan die wel PSG kan uitvoeren. Dit kan leiden tot het volgen van scholings- en aanschaftraject.
Een belangrijke aanpassing voor instellingen kan zijn dat het stappenplan/ zorgpad veranderd moet worden, zodat er eerst altijd een goede somnologische anamnese gedaan wordt, waaruit voortvloeit of, en welk slaaponderzoek het meest geschikt is.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Als referentiemethode voor het diagnosticeren van OSA wordt wereldwijd (video-)PSG gehanteerd. Hiermee kunnen, door de mogelijkheid respiratoire gebeurtenissen vast te stellen in relatie met slaapstadia en andere factoren, ook andere slaapstoornissen worden gediagnosticeerd, die apart van of samen met OSA kunnen voorkomen. Op basis van de literatuuranalyse en bovengenoemde overwegingen, kunnen we wel concluderen dat een type 3 slaaponderzoek klinisch even nuttig lijkt als een PSG, een aanvaardbare diagnostische testaccuratesse heeft, over het algemeen iets minder belastend is voor de patiënt, goedkoper en toegankelijker dan een PSG. De klinisch nut onderzoeken zijn echter bij een vrij standaard, overwegend mannelijke, OSA-patiëntenpopulatie uitgevoerd, waardoor de resultaten moeilijk te extrapoleren zijn naar andere patiëntgroepen, vrouwen en ouderen. Bij de beoordeling van de resultaten moet daarnaast rekening gehouden worden met de mogelijkheid op fout-positieve uitslagen om onnodige behandeling te voorkomen. Bij twijfel zou laagdrempelig de diagnose moeten worden heroverwogen en eventueel opgevolgd moeten worden met een PSG. Om dubbel-diagnostiek te vermijden, wordt bij twijfel over de pre-testwaarschijnlijkheid op OSA een PSG geadviseerd.
Er dient altijd een somnologische anamnese uitgevoerd door een BIG-geregistreerd zorgverlener met voldoende kennis van slaapgeneeskunde (bevoegd en bekwaam) te worden om te bepalen of en welk slaaponderzoek nodig is. De diagnostiek wordt in principe handmatig uitgelezen en geïnterpreteerd. Een beschrijving van de technisch correcte uitvoering en interpretatie van PG en PSG valt buiten het bestek van deze module. Hiervoor wordt verwezen naar de AASM manual for the scoring of sleep and associated events (AASM, 2020).
De ontwikkeling van PAT technologie (zoals de watchPAT en NightOwl) in de diagnostiek van OSA is veelbelovend; gezien de goede overeenkomst in scoring van slaapduur en AHI lijkt het vergelijkbaar met een PG (Yalamanchali, 2013; Zhang, 2020). Er ontbreken echter nog klinische nutstudies om te kunnen aantonen wat het effect is op klinisch relevante uitkomstmaten. Diagnostische accuratesse studies zijn wel beschikbaar en in AASM-richtlijn (2017) is de PAT dan ook goedgekeurd. In de klinische praktijk is ook al ervaring opgedaan met deze vorm van diagnostiek. Op basis van deze ervaring ziet de werkgroep PAT als een bruikbaar diagnosticum, mits er wordt voldaan aan de volgende criteria volgens de AASM: meting met ten minste oximetrie en actigrafie. De toevoeging van een betrouwbaarder geschatte slaaptijd met behulp van actigrafie is een pluspunt ten opzichte van de PG. De ademhalingspatronen worden daarentegen minder betrouwbaar gemeten.
Onbewaakte ambulante toepassing van type 3 PM wordt op basis van bovenstaande adequaat geacht voor de diagnose van OSA (ten opzichte van PSG als referentiemethode) onder de volgende voorwaarden:
- uitgebreide anamnese door een zorgverlener met expertise op het gebied van slaapgeneeskunde;
- enkel in geval van hoge pre-test waarschijnlijkheid voor OSA (indien bij klinische beoordeling tenminste 2 van de 3 kenmerken aanwezig (snurken, geobserveerde ademstops, verhoogde slaperigheid (bijvoorbeeld ESS ≥10)), zonder aanwijzingen voor relevante andere slaapstoornissen en/of onderstaande subgroepen.
- Mits er rekening wordt gehouden met patiëntkenmerken die mogelijk minder geschikt zijn voor onderzoek met PAT-technologie:
- Atriumfibilleren (AF): het is de mening van de werkgroep dat bij bekend AF de voorkeur uitgaat naar een ander type onderzoek. Door de al bestaande variabiliteit in de hartslag zijn de arousals minder goed herkenbaar en dus is manuele correctie lastiger. Sommige aanbieders van PAT technologie hebben wel registratie voor het onderzoek bij ritmestoornissen.;
- Bij gebruik van alfablokkers: perifere sympaticusactiviteit wordt onderdrukt, daarmee zijn deze mensen ongeschikt voor PAT;
- Verdenking op centrale slaapapneu: minder geschikt omdat de ademhalingsactiviteit minder goed in beeld komt.
Een PSG is geïndiceerd bij de volgende subgroepen:
- Patiënten die geanalyseerd worden voor een operatieve (irreversibele) OSA-behandeling, zij zouden, gezien de irreversibele ingreep, altijd PSG voorafgaand aan de ingreep moeten krijgen, ter voorkoming van een fout-positieve diagnose. Voor tongzenuwstimulatie is een PSG een voorwaarde voor de commissie die beoordeelt of de ingreep geïndiceerd is.
- Patiënten die voor een second opinion komen, vooral na falen therapie. Er is een hogere pre-test waarschijnlijkheid dat de patiënt geen OSA heeft (andere oorzaak voor de klachten of een bijkomende aandoening dan wel slaapstoornis).
- Onduidelijke testuitslag type 3 onderzoek, discrepantie tussen klachten en uitslag type 3 onderzoek.
- Patiënten bij wie naast OSA aan méér/andere slaapstoornis gedacht wordt
(bijvoorbeeld insomnie, primaire hypersomnie, nachtelijke epilepsie, (non)REM-parasomnie, PLMD). (Bij circadiaan ritmeprobleem en verdenking OSA kan type 3 meting wel, alleen timing aanpassen)
De werkgroep is van mening dat er subgroepen zijn waar PSG laagdrempelig ingezet kan worden, zoals:
- Bij verdenking OSA met lage pre-test waarschijnlijkheid. Dit komt onder andere vaak voor bij ouderen en (premenopauzale) vrouwen. Oudere patiënten en vrouwen zijn ondervertegenwoordigd in de wetenschappelijke studies. Daarnaast hebben met name premenopauzale vrouwen een andere klachtenpresentatie. Zo zijn er aanwijzingen dat ze relatief veel klachten hebben bij een lagere AHI en komt ook REM-slaap gerelateerd OSA vaker voor dan bij mannen (Bonsignore, 2019). Oudere mensen hebben ook vaak een atypische presentatie van OSA (Netzer, 2016). Ook verandert slaap met het ouder worden en komen slaapademhalingsstoornissen vaker voor. Bovendien hebben ouderen over het algemeen meer bijkomende ziektes en functionele klachten gerelateerd aan het ouder worden (zie ook de richtlijnmodule Behandeling van OSA bij ouderen).
- Verdenking centraal apneusyndroom (CSA) of bijkomende hypoventilatie. Deze groepen zijn geëxcludeerd bij de vergelijkende studies tussen type 1 en type 3 monitor en zijn beter te diagnosticeren met een PSG.
- Ernstig COPD, hartfalen en chronisch atriumfibrilleren, neuromusculaire aandoening, ernstige restrictieve longaandoening. Er is te weinig onderzoek gedaan naar het gebruik van PG in deze populaties omdat patiënten met deze aandoeningen vaak geëxcludeerd waren voor de studies. Daarnaast is bekend dat in deze patiëntengroepen (o.a. hartfalen of atriumfibrilleren) andere (bijkomende) slaapstoornissen meer voorkomen, waaronder CSA en hypoventilatiesyndromen. Ernstig COPD en of ernstig overgewicht geeft vaker een bijkomende hypoventilatie (McNicholas, 2019, Mokhlesi, 2019).
- Patiëntgebonden omstandigheden, zoals woonomstandigheden van de patiënt, afstand tot de kliniek, voorkeur van de patiënt (bijvoorbeeld angstig om thuis een onderzoek te ondergaan), verstandelijke of fysieke beperking, hetgeen een onderzoek thuis lastig of onmogelijk maakt.
Onderbouwing
Achtergrond
Omdat OSA een slaapgerelateerde aandoening betreft, hebben klinische tests voor OSA betrekking op het registreren van respiratoire gebeurtenissen tijdens de nachtelijke slaap. Het kwantificeren van zowel de ademhalingsstoornissen als de slaap zelf kan van belang zijn. Er zijn echter aanwijzingen in de literatuur dat bij een groep patiënten met een hoge verdenking op OSA en een lage verdenking op bijkomende andere slaapstoornissen als insomnia, parasomnie, periodic limb movement disorder (plmd), primaire hypersomnie, centraal slaapapneu (CSA), nachtelijke epilepsie en hypoventilatiesyndroom volstaan kan worden met een nachtelijke meting van de ademhaling, hartslag en zuurstofsaturatie (Heus, 2018).
Bij conventie wordt polysomnografie (PSG) uitgevoerd in een slaaplaboratorium (type 1) beschouwd als de referentiemethode. PSG is een uitgebreide onderzoeksmethode die de gelijktijdige registratie van diverse biologische signalen behelst, met inbegrip van hersenactiviteit (EEG), oogbewegingen (EOG), spieractiviteit (EMG), ademhaling (flow afgeleid van nasale druk, temperatuur van in- en uitgeademde lucht en respiratoire plethysmografie), zuurstofsaturatie (SpO2-pulsoximetrie), lichaamspositie en hartslag (ECG) en beenbewegingen. Synchrone video-opname wordt gebruikt voor onderzoek van bewegings- en gedragsstoornissen in de slaap. Technologische ontwikkelingen in de laatste jaren hebben ervoor gezorgd dat de PSG meting (zonder video) ook in de thuissituatie kan voor bepaalde indicaties waar geen video registratie voor nodig is. Beoordeling van het PSG zal de komende jaren gemiddeld minder arbeidsintensief worden gezien de ontwikkeling van automatische scoringsalgoritmen die de manuele beoordeling een stuk sneller kunnen maken.
Tests die niet de volledige montage van PSG omvatten worden aangeduid met de verzamelnaam type 3 slaaponderzoek, vaak een polygrafie (PG). Het PG-onderzoek betreft een beperkte combinatie van bij PSG gebruikte signalen en sensoren, met weglating van EEG, EOG en EMG. Dit betekent dat slaap, slaapstadia, arousals en beenbewegingen niet kunnen worden vastgesteld. Dit is een belangrijke inherente beperking van deze onderzoeksmethode.
De American Association of Sleep Medicine (AASM) onderscheidt drie niveaus van portable monitoring (PM) apparaten, ook wel genoemd: home sleep apnea testing (HSAT) (Chesson, 2003). Tabel 1 geeft een overzicht van deze drie methoden van slaapregistratie. In Nederland wordt type 3 het meest gebruikt voor diagnostiek en monitoring van OSA. Type 4, dat slechts één of twee kanalen telt, wordt in Nederland niet geschikt geacht als solitair diagnosticum omdat het te weinig informatie genereert. Het is daarom niet meegenomen in de literatuuranalyse. HSAT gebaseerd op perifere arteriële tonometrie (PAT; tonometrie=veranderingen in de vaatweerstand) in combinatie met oximetrie en actigrafie (bewegingsregistratie om onderscheid te maken tussen waak en slaap) wordt door de AASM beschouwd als equivalent van type 3 slaapregistratie. In de rest van deze module spreken we zoveel mogelijk over type 1, 2, 3 modaliteiten. Met een type 3 onderzoek bedoelt de werkgroep zowel PG als PAT waarbij ook ademhalingsactiviteit geregistreerd wordt.
Tabel 1 (Portable) monitoring apparaten volgens de AASM
|
Type (portable) monitoring apparaat |
Gemeten parameters |
|
Type 1 Conventionele PSG, uitgevoerd in slaaplaboratorium |
PSG: Minimum 7 kanalen, met name EEG, EOG, kin EMG, ECG of hartfrequentie, luchtstroom, respiratoire beweging, SpO2 |
|
Type 2 Uitgebreid draagbaar (ambulante PSG) |
PSG: Minimum 7 kanalen, met name EEG, EOG, kin EMG, ECG of hartfrequentie, luchtstroom, respiratoire beweging, SpO2 |
|
Type 3 Aangepaste draagbare slaapapneutest |
Minimum 4 kanalen, met name ventilatie of luchtstroom (ten minste 2 kanalen met respiratoire beweging of respiratoire beweging met luchtstroom), ECG of hartfrequentie, SpO2. Of meting van PAT met oximetrie en actigrafie |
|
Type 4 Continue enkelvoudige of tweevoudige bioparameters |
1 of 2 kanalen, typisch met inbegrip van SpO2 of luchtstroom |
Conclusies / Summary of Findings
Klinisch nut van diagnostiek d.m.v. PG (type 3) versus PSG
|
Redelijk GRADE |
Een PG is waarschijnlijk niet slechter dan een PSG met betrekking tot kwaliteit van leven bij patiënten met hoge verdenking op OSA en bij afwezigheid van de in de studies als exclusiecriteria genoemde co-morbide aandoeningen*. Bronnen: Corrall, 2017; Chai-Coetzer, 2017 |
|
Redelijk GRADE |
Een PG is waarschijnlijk niet slechter dan een PSG met betrekking op slaperigheid overdag bij patiënten met hoge verdenking op OSA en bij afwezigheid van de in de studies als exclusiecriteria genoemde co-morbide aandoeningen*.
Bronnen: Corrall, 2017; Chai-Coetzer, 2017 |
|
Redelijk GRADE |
Een PG resulteert waarschijnlijk niet of nauwelijks in een verschil op vermindering van cardiovasculaire eindpunten vergeleken met een PSG bij patiënten met hoge verdenking op OSA en bij afwezigheid van de in de studies als exclusiecriteria genoemde co-morbide aandoeningen*.
Bronnen: Corrall, 2017 |
|
Laag GRADE |
Een PG resulteert mogelijk niet of nauwelijks in een verschil op de AHI vergeleken met een PSG bij patiënten met hoge verdenking op OSA en bij afwezigheid van de in de studies als exclusiecriteria genoemde co-morbide aandoeningen*.
Bronnen: Corrall, 2017; Chai-Coetzer, 2017 |
|
Redelijk GRADE |
Een PG resulteert waarschijnlijk niet of nauwelijks in een verschil op de ODI vergeleken met een PSG bij patiënten met hoge verdenking op OSA en bij afwezigheid van de in de studies als exclusiecriteria genoemde co-morbide aandoeningen*.
Bronnen: Corrall, 2017 |
|
Laag GRADE |
Een PG resulteert mogelijk niet of nauwelijks in een verschil op CPAP-compliance vergeleken met een PSG bij patiënten met hoge verdenking op OSA en bij afwezigheid van de in de studies als exclusiecriteria genoemde co-morbide aandoeningen*.
Bronnen: Corrall, 2017; Chai-Coetzer, 2017 |
|
- GRADE |
Gerandomiseerde onderzoeken die de uitkomst mortaliteit bestudeerden, werden niet geïdentificeerd. |
*Neuromusculaire ziekte, ernstig(e)restrictieve longziekte of COPD, instabiele cardiovasculaire ziekte, hartfalen en andere slaapstoornissen
Conclusies (uit Cochrane review)
Type 2 monitoren
|
Laag / Zeer laag GRADE |
Bij patiënten met slaperigheidsklachten en een verdenking op OSA zal, wanneer AHI/RDI ≥5 als definitie voor OSA aangehouden wordt, bij het gebruik van een type 2 monitor in de thuissituatie mogelijk 4-12% van de patiënten met OSA ten onrechte niet gediagnosticeerd worden (GRADE: laag) en zal mogelijk 29-50% van de patiënten zonder OSA ten onrechte geclassificeerd worden als hebbende OSA (GRADE: zeer laag).
Bronnen: Jonas, 2017 |
|
Laag GRADE |
Bij patiënten met slaperigheidsklachten en een verdenking op OSA zal, wanneer AHI/RDI ≥5 als definitie voor OSA aangehouden wordt, bij het gebruik van een type 2 monitor in een slaapcentrum mogelijk 9% van de patiënten met OSA ten onrechte niet gediagnosticeerd worden en zal mogelijk 16% van de patiënten zonder OSA ten onrechte geclassificeerd worden als hebbende OSA.
Bronnen: Jonas, 2017 |
Type 3 monitor (polygrafie)
|
Hoog / Redelijk GRADE |
Bij patiënten met slaperigheidsklachten en een verdenking op OSA zal, wanneer AHI/RDI ≥5 als definitie voor OSA aangehouden wordt, bij het gebruik van een type 3 monitor in de thuissituatie 7% van de patiënten met OSA ten onrechte niet gediagnosticeerd worden (GRADE: hoog) en zal waarschijnlijk 40% van de patiënten zonder OSA ten onrechte geclassificeerd worden als hebbende OSA (GRADE: redelijk). Bronnen: Jonas, 2017 |
|
Redelijk / Laag GRADE |
Bij patiënten met slaperigheidsklachten en een verdenking op OSA zal, wanneer AHI/RDI ≥5 als definitie voor OSA aangehouden wordt, bij het gebruik van een type 3 monitor in een slaapcentrum waarschijnlijk 4% van de patiënten met OSA ten onrechte niet gediagnosticeerd worden (GRADE: redelijk) en zal mogelijk 24% van de patiënten zonder OSA ten onrechte geclassificeerd worden als hebbende OSA (GRADE: laag). Bronnen: Jonas, 2017 |
Samenvatting literatuur
Beschrijving studies – klinisch nut type 3 monitor (PG) versus PSG
Twee multicenter non-inferioriteit RCT’s werden meegenomen om het klinisch nut te onderzoeken.
- Patiënten in de studie van Chai-Coetzer (2017) kwamen in aanmerking voor deelname bij een verwijzing naar een slaapcentrum met vermoeden op OSA, met ten minste twee van de volgende symptomen: snurken, geconstateerde apneus of excessieve slaperigheid overdag. Exclusiecriteria waren: neuromusculaire ziekte, ernstige chronische obstructieve of restrictieve longziekte en/of gebruik van zuurstoftoediening, instabiele cardiovasculaire ziekte, ernstig cardiaal falen in de afgelopen drie maanden, of psychiatrische of cognitieve ziekte. Bij alle patiënten werd een PSG afgenomen (in het ziekenhuis), en via randomisatie werd bepaald welke informatiekanalen werden gebruikt (volledige PSG, type 3 of type 4 kanalen). Wij nemen in onze resultaten alleen de resultaten van PG (type 3) versus PSG mee. De follow-up was 4 maanden en primaire uitkomstmaten waren slaperigheid overdag (ESS, non-inferioriteitsgrens van 2 punten) en kwaliteit van leven (FOSQ, non-inferioriteitsgrens van -1 punt). In totaal werden 406 patiënten geïncludeerd, zie tabel 2 voor de baseline karakteristieken.
- Corral (2017) vergeleek PG (type 3 monitor, bestaande uit luchtstroom, thoracoabdominale banden en zuurstofsaturatie) gemeten in de thuissituatie met een PSG (in het ziekenhuis). Patiënten met verdenking op OSA (snurken of door de partner geconstateerde apneu, een ESS-score van 10 of hoger, en de afwezigheid van klinische verdenking op andere slaappathologie die slaperigheid overdag zou kunnen veroorzaken (zoals narcolepsie)) werden geïncludeerd. Exclusiecriteria waren: ongecontroleerde coronaire cardiopathie, Cheyne-Stokes syndroom, patiënten met uvulopalatofaryngoplastiek, ernstige nasale obstructie. In totaal werden 430 patiënten geïncludeerd (zie tabel 2 voor de baseline karakteristieken) De follow-up was 6 maanden en de primaire uitkomstmaat was slaperigheid (ESS, non-inferioriteitsgrens van 2 punten).
Tabel 2. Baseline karakteristieken (gemiddelde (SD) of n (%)
|
|
Chai-Coetzer, 2017 |
|
Corral, 2017 |
|
|
|
|
Type 1 |
Type 3 |
|
Type 1 |
Type 3 |
|
N |
135 |
136 |
|
212 |
218 |
|
Leeftijd, jaren |
48,1 (12,1) |
48,3 (13,0) |
|
51 (15,3) |
50 (18) |
|
Geslacht, n(%)man |
89 (66%) |
97 (71%) |
|
70% |
71% |
|
Body Mass Index, kg/m2 |
34,8 (9,9) |
34,1 (7,8) |
|
30,1 (7,7) |
31,1 (7,2) |
|
AHI, apneus/u gemeten met PSG |
31,5 (32,4) |
29,5 (28,3) |
|
28,5 (43,3) |
20,9 (33,4) |
|
AHI 0-15/ 15-30, ≥30 (%) |
|
|
|
25,0/ 25,9 / 49,1 |
41,2 / 23,9/ 34,9 |
|
Medische comorbiteiten, n (%) |
|
|
|
|
|
|
Hypertensie |
40 (30%) |
39 (29%) |
|
31,2% |
29,2% |
|
Diabetes Mellitus type 2 |
14 (11%) |
12 (9%) |
|
10,6% |
8% |
|
Coronaire hartziekten |
6 (4%) |
4 (3%) |
|
5% |
2,8% |
|
Cerebrovasculaire ziekten / beroerte |
4 (3%) |
2 (1%) |
|
1,4% |
2,4% |
|
Atriumfibrilleren / arrythmia |
1(1%) |
2 (1%) |
|
3,2% |
0,9% |
|
COPD |
2 (1%) |
4 (3%) |
|
Niet gerapporteerd |
Niet gerapporteerd |
|
Depressie/ angststoornis |
26 (19%) |
27 (20%) |
|
11,7% |
9,9% |
Resultaten
Slaapneiging (ESS)
De resultaten van beide studies konden worden gepooled in een meta-analyse. Uit de analyse blijkt dat in de PSG-groep de gemiddelde ESS-score 0,43 punten meer daalde dan in de polygrafie-groep (95%BI -0,22 tot 1,07). Dit indiceert dat polygrafie in deze studies niet inferieur is aan PSG als het slaperigheid betreft bij patiënten met een sterke klinische verdenking op OSA en zonder de in de studies als exclusiecriteria genoemde co-morbide aandoeningen (neuromusculaire ziekte, ernstig(e)restrictieve longziekte of COPD, instabiele cardiovasculaire ziekte, hartfalen en andere slaapstoornissen).
Chai-Coetzer nam ook de SASQ mee en vond geen significant verschil op slaperigheid tussen de groepen (gemiddelde afname 1,9, 95% CI –4,3 tot 8,1).
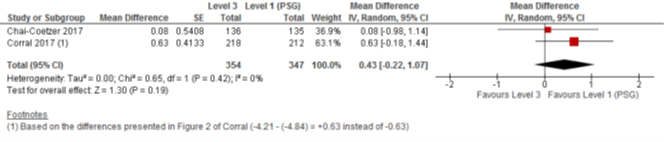
Figuur 1 Forest plot van het gemiddelde verschil van de daling van de ESS t.o.v. baseline van PG (type 3) versus PSG (type 1).
Vermoeidheid
De geïncludeerde studies beschreven geen vermoeidheid als uitkomstmaat.
Kwaliteit van leven
Kwaliteit van leven (gemeten met de FOSQ) was na follow-up nagenoeg hetzelfde voor de PSG als de PG. Chai-Coetzer (2017) vond een verschil tussen de groepen van 0,01 (–0,47 tot 0,49). Corral (2017) zag op de uitgebreidere versie van de FOSQ een verbetering van 6,5 (18,1) in de PSG-groep en 6,7 (SD 16,7) in de PG-groep; het verschil was niet significant tussen de groepen (p=0,92).
Andere kwaliteit van leven vragenlijsten lieten de volgende resultaten zien:
- De gemiddelde verandering op de AQoL-8D was op de drie domeinen (psychosociaal, fysiek en globaal) niet statistisch significant verschillend tussen de groepen (Chai-Coetzer, 2017).
- Visual analogical well-being scale: gemiddelde verandering tussen de groepen: -4,7 (p=0,04, range 0-100)) in het voordeel van PSG (Corral, 2017).
- De gemiddelde veranderingen op de EuroQol 5D en de twee subschalen van de SF-36 waren niet statistisch significant verschillend tussen de groepen (Corral, 2017).
AHI
Onder de patiënten die met CPAP behandeld werden (PG: 70/136 (51%) versus PSG: 63/135 (74%)) was er geen verschil in de apnoe/hypopneu index (AHI) (data niet gerapporteerd) (Chai-Coetzer, 2017). Ook Corrall (2017) zag geen significant verschil in AHI (gemiddeld verschil 1,4/uur, p = 0,286).
Oxygen desaturation index (ODI)
Corrall (2017) vond geen significant verschil op de desaturation index na een PG of PSG (gemiddeld verschil 1,4/uur, p = 0,197).
(Cardiovasculaire) sterfte en cardiovasculaire eindpunten
Corrall (2017) vond geen statistisch significante verschillen op cardiovasculaire eindpunten (hypertensie, angina pectoris, myocardinfarct, aritmie, hartfalen, TIA, beroerte of cardiovasculaire sterfte) (rate ratio 0,88, p = 0,767).
Gebruik CPAP
In de studie van Chai-Coetzer (2017) was de CPAP-compliance gemiddeld 0,1 uur lager (95%BI -0,93 tot 0,73) in de PG-groep dan de PSG-groep (PG gemiddeld 5,2 uur/nacht vs. PSG gemiddeld 5,3 uur/nacht). Ook Corral (2017) vond onder CPAP-gebruikers geen verschil in CPAP-compliance (gemiddeld verschil -0,2 uur/dag, 95%-BI -0,63 tot 0,23, p = 0,41).
Bewijskracht
De bewijskracht voor kwaliteit van leven en slaperigheid overdag is met 1 niveau verlaagd gezien indirectheid (Chai-Coetzer gebruikte niet de standaard PG (indextest), maar gebruikte een deel van de kanalen van een klinisch PSG).
Voor de overige uitkomstmaten is daarnaast nog afgewaardeerd voor imprecisie, waardoor ze op laag uitkomen.
De onderzoeken waarop onderstaande conclusies zijn gebaseerd, bestonden voornamelijk uit mannen met een overgewicht en een matig-ernstig OSA.
Beschrijving studies – Diagnostische testaccuratesse type 2, 3 en 4 monitoren
Jonas (2017) voerde een systematisch review uit naar de diagnostische accuratesse van type 2, 3 en 4 monitoren (in de thuissituatie of een slaapcentrum), in vergelijking met PSG in een slaapcentrum als referentietest. Studies waren uitgevoerd bij patiënten met verdenking op OSA die waren verwezen voor slaaponderzoek. Drie onderzoeken werden geïncludeerd die type 2 monitoren onderzochten, in twee onderzoeken werd de monitor thuis gebruikt, 1 studie werd in een slaapcentrum uitgevoerd.
Voor type 3 monitoren werden een systematisch review (El Shayeb, 2014) en twee primaire onderzoeken geïncludeerd. El Shayeb (2014) includeerde 59 studies, waarvan er 19 meegenomen konden worden in een meta-analyse.
Resultaten Diagnostische testaccuratesse - Type 2 en 3 monitoren
In Tabel 3 staan de diagnostische accuratessematen samengevat. Voor de positief en negatief voorspellende waarden is uitgegaan van een OSA-prevalentie van 55% en 87% (op basis van AHI ≥ 5). Deze waarden komen uit de AASM-richtlijn (Kapur, 2017) en representeren de prevalentie van OSA in een laag- en hoog-risico slaapkliniek.
Tabel 3. Overzicht resultaten betreffende de accuratesse van verschillende diagnostische instrumenten voor het aantonen van OSA (AHI ≥ 5, gemeten met polysomnografie) bij patiënten met verdenking op OSA bij een voorafkans op OSA (prevalentie) van 55% (laag-risico slaapkliniek) en 87% (hoog-risico slaapkliniek, AASM, 2019), overgenomen uit rapport van Cochrane Nederland (Heus, 2018)
|
|
# onderzoeken, # patiënten |
Sensitiviteit |
Specificiteit |
Fout-positief/ 1000 |
Fout-negatief/ 1000 |
Fout-positief/ 1000 |
Fout-negatief/ 1000 |
|
AHI ≥ 5 |
|
|
|
55% |
55% |
87% |
87% |
|
Type 2 - Thuissituatie |
2 (92) |
0,88-0,96 |
0,50-0,71 |
131 - 225 |
22 - 66 |
38 – 65 |
35 – 104 |
|
Type 2 - Slaapcentrum |
1 (68) |
0,91 |
0,84 |
72 |
49 |
21 |
78 |
|
Type 3 monitor (PG) – thuis (El Shayeb) |
8 (674) |
0,93 (95%BI 0,90 tot 0,95) |
0,60 (95%BI 0,51 tot 0,68) |
180 (95% BI: 144 tot 221) |
38 (95%BI: 27 tot 55) |
52 (95%BI: 42 tot 64) |
61 (95% BI: 43 tot 87) |
|
|
0,87 |
0,67 |
|
|
|
|
|
|
0,97 |
0,67 |
|
|
|
|
|
Type 3 monitor (PG) – slaapcentrum (review El Shayeb) |
7 (505) |
0,96 (95% BI 0,90 tot 0,98) |
0,76 (95% BI 0,63 tot 0,85). |
108 (95%BI: 68 tot 166) |
22 (95%BI: 11 tot 55) |
31 (95%BI: 19 tot 48) |
35 (95%BI: 17 tot 87) |
Bewijskracht
Type 2 monitor in thuissituatie: De bewijskracht voor sensitiviteit werd met 2 niveaus afgewaardeerd voor imprecisie, de bewijskracht voor specificiteit werd afgewaardeerd met 3 niveaus voor imprecisie en heterogeniteit.
Type 2 monitor in slaapcentrum: De bewijskracht voor sensitiviteit en specificiteit werd met 2 niveaus afgewaardeerd voor imprecisie (zeer kleine steekproef) (zeer laag GRADE).
Type 3 monitor in thuissituatie: De bewijskracht voor sensitiviteit bleef gelijk op Hoog. Voor specificiteit werd afgewaardeerd met 1 niveau vanwege imprecisie (redelijk GRADE).
Type 3 monitor in slaapcentrum: De bewijskracht voor sensitiviteit werd met 1 niveau afgewaardeerd vanwege heterogeniteit (redelijke GRADE). Voor specificiteit werd afgewaardeerd met 2 niveaus vanwege heterogeniteit en imprecisie (laag GRADE).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er gebruik gemaakt van de systematische literatuuranalyse die Cochrane Nederland heeft uitgevoerd (Heus, 2018). Hierbij is de volgende zoekvraag gehanteerd:
Wat is het klinisch nut van diagnostiek met type 1-4 monitoren bij volwassen patiënten met slaperigheidsklachten en verdenking op slaapapneu (OSA)?
P: Volwassen patiënten met OSA-gerelateerde klachten en verdenking op OSA
I: Onderzoeken die een diagnostische test vergelijken met een andere diagnostische test (of niet-testen) gevolgd door een behandeling. Te onderzoeken testen:
- Volledig door een laborant of video geobserveerde, in een slaaplaboratorium uitgevoerde PSG (slaapstadiëring (middels EEG, EOG, kin-EMG), beenbewegingen, ECG of hartfrequentie en respiratoire metingen met airflow, ademhalingsbewegingen en oximetrie - gouden standaard; type 1 monitor)
- Onbewaakte portable polysomnografie (type 2 monitor)
- Portable registratieapparaat waarmee op meerdere kanalen ademhalingsbewegingen (borst- én buikwandbewegingen) en airflow met daarnaast hartfrequentie of ECG én de zuurstofsaturatie worden vastgelegd (polygrafie; type 3 monitor)
C: Andersoortige diagnostische test zoals hierboven genoemd.
O: Uitkomsten:
- Slaapneiging/slaperigheid ) (kritieke uitkomstmaat)
- Vermoeidheid (kritieke uitkomstmaat)
- Kwaliteit van leven (kritieke uitkomstmaat)
- AHI (belangrijke uitkomstmaat)
- (cardiovasculaire) sterfte en cardiovasculaire eindpunten (belangrijke uitkomstmaat)
- Oxygen desaturation index (ODI) (belangrijke uitkomstmaat)
- Bijwerkingen (m.n. het niet verdragen van de interventie), therapie-compliance (belangrijke uitkomstmaat)
- Diagnostische testaccuratesse (sensitiviteit, specificiteit, positief voorspellende waarde, negatief voorspellende waarde)
Relevante uitkomstmaten
De werkgroep achtte de mate van slaperigheid en kwaliteit van leven voor de besluitvorming kritieke uitkomstmaten; en de overige uitkomstmaten voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten en/of klinische relevantiegrenzen als volgt:
- Slaperigheid overdag, gemeten met de Epworth Sleepiness Scale of een andere vergelijkbare vragenlijst; de werkgroep stelde een verschil van 2 punten op de ESS als een klinisch (patiënt) relevant verschil (Chai-Coetzer, 2017).
- Kwaliteit van leven, gemeten met de Functional outcomes of Sleep Questionnaire (FOSQ) of een andere vergelijkbare vragenlijst; de werkgroep stelde een verschil van 1 punt op de FOSQ als een klinisch (patiënt) relevant verschil (Chai-Coetzer, 2017).
- Vermoeidheid, gemeten met de Fatigue Severity Scale (FSS) of een andere vergelijkbare vragenlijst.
- Vermindering van AHI naar een index <5 events/uur als klinisch relevant verschil
- (Cardiovasculaire) sterfte en cardiovasculaire eindpunten
- Bijwerkingen (met name het (niet) verdragen van de interventie)
Voor de onderzoeken naar de diagnostische testaccuratesse is de werkgroep overeengekomen dat er meer waarde wordt gehecht aan zo min mogelijk fout-positieve uitslagen (belang bij een hoog positief voorspellende waarde), dan aan fout-negatieve uitslagen. Een fout-positieve uitslag kan leiden tot een onterecht behandeltraject. Bij vermoeden van een fout-negatieve uitslag vanwege een discrepantie tussen voor OSA verdachte anamnese en resultaat van slaaponderzoek is het wel noodzakelijk dat bij blijvende klinische verdenking een PSG wordt uitgevoerd.
Zoeken en selecteren (Methode)
Er werd gebruik gemaakt van de systematische literatuuranalyse die Cochrane Nederland heeft uitgevoerd (Heus, 2018). In de databases Medline (via OVID), Embase, The Cochrane Library (Cochrane Database of Systematic Reviews) en de HTA database van het Center for Reviews and Dissemination (University of York) is op 4 oktober 2017 met relevante zoektermen gezocht naar systematische reviews van RCT’s en diagnostische accuratessestudies. De literatuurzoekactie leverde na ontdubbeling 324 treffers op. Op basis van titel en abstract werden in eerste instantie 70 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 59 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 11 systematische reviews definitief geselecteerd (o.a. type 2 monitoren: n=3; Type 3 monitoren: n=5). De meest recente review werd nader bestudeerd (Jonas, 2017). Daarnaast werd op 5 december 2017 een nieuwe zoekactie uitgevoerd naar RCT’s betreffende het klinisch nut van diagnostische testen bij verdenking op OSA. Twee RCT’s werden geïncludeerd (Chai-Coetzer, 2017; Corral, 2017). Op 5 juli 2021 is een update van de literatuursearches uitgevoerd. Hierbij kwamen geen nieuwe artikelen naar voren.
Resultaten
Een systematische review (Jonas, 2017) en twee RCT’s over het klinisch nut van type 3 en 4 monitoren zijn opgenomen in de literatuuranalyse. We bespreken eerst de effecten van de verschillende monitoren op de klinische uitkomstmaten, vervolgens komt de diagnostische testaccuratesse aan bod.
Referenties
- American Academy of Sleep Medicine (AASM). Treatment of Adult Obstructive Sleep Apnea with Positive Airway Pressure: An American Academy of Sleep Medicine Clinical Practice Guideline. 2019
- American Academy of Sleep Medicine (AASM). The AASM Manual for the Scoring of Sleep and Associated Events (2020). https://aasm.org/clinical-resources/scoring-manual/
- Berry RB, Brooks R, Gamaldo CE, et al.; for the American Academy of Sleep Medicine. The AASM Manual for the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specifications. Version 2.3. Darien, IL: American Academy of Sleep Medicine; 2016.
- Bonsignore MR, Saaresranta T, Riha RL. Sex differences in obstructive sleep apnoea. Eur Respir Rev. 2019 Nov 6;28(154):190030. doi: 10.1183/16000617.0030-2019. PMID: 31694839.
- Chai-Coetzer CL, Antic NA, Hamilton GS, et al. Physician Decision Making and Clinical Outcomes With Laboratory Polysomnography or Limited-Channel Sleep Studies for Obstructive Sleep Apnea: A Randomized Trial. Ann Intern Med. 2017 Mar 7;166(5):332-340. doi: 10.7326/M16-1301. Epub 2017 Jan 10. PMID: 28114683.
- Chesson AL, Berry RB, Pack A, et al. Practice parameters for the use of portable monitoring devices in the investigation of suspected obstructive sleep apnea in adults. Sleep. 2003;26(7):907-13.
- Corral J, Sánchez-Quiroga MÁ, Carmona-Bernal C, et al; for the Spanish Sleep Network. Conventional Polysomnography Is Not Necessary for the Management of Most Patients with Suspected Obstructive Sleep Apnea. Noninferiority, Randomized Controlled Trial. Am J Respir Crit Care Med. 2017 Nov 1;196(9):1181-1190. doi: 10.1164/rccm.201612-2497OC. PMID: 28636405.
- Heus P, Van Doorn S, Damen A, et al. (Cochrane Netherlands). Diagnostiek bij patienten met slaperigheidsklachten en verdenking op slaapapneu (OSA) Deel 2. Systematische reviews. 2018
- Jonas DE, Amick HR, Feltner C, et al. Screening for Obstructive Sleep Apnea in Adults: Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2017 Jan 24;317(4):415-433. doi: 10.1001/jama.2016.19635. Erratum in: JAMA. 2017 Mar 28;317(12 ):1278. PMID: 28118460.
- Kapur VK, Auckley DH, Chowdhuri S, et al. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med. 2017 Mar 15;13(3):479-504. doi: 10.5664/jcsm.6506. PMID: 28162150; PMCID: PMC5337595.
- McNicholas WT, Hansson D, Schiza S, Grote L. Sleep in chronic respiratory disease: COPD and hypoventilation disorders. Eur Respir Rev. 2019 Sep 25;28(153):190064. doi: 10.1183/16000617.0064-2019. PMID: 31554703.
- Mokhlesi B, Masa JF, Brozek JL, et al. Evaluation and Management of Obesity Hypoventilation Syndrome. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med. 2019 Aug 1;200(3):e6-e24. doi: 10.1164/rccm.201905-1071ST. Erratum in: Am J Respir Crit Care Med. 2019 Nov 15;200(10):1326.
- Netzer NC, Ancoli-Israel S, Bliwise DL, Fulda S, et al. Principles of practice parameters for the treatment of sleep disordered breathing in the elderly and frail elderly: the consensus of the International Geriatric Sleep Medicine Task Force. Eur Respir J. 2016 Oct;48(4):992-1018. doi: 10.1183/13993003.01975-2015. Epub 2016 Jul 28. PMID: 27471200.
- Pevernagie DA, Verbraecken JA. East, West: is home best? Sleep Med. 2015;16(11):1432-3.
- Yalamanchali S, Farajian V, Hamilton C, Pott TR, Samuelson CG, Friedman M. Diagnosis of obstructive sleep apnea by peripheral arterial tonometry: meta-analysis. JAMA Otolaryngol Head Neck Surg. 2013 Dec;139(12):1343-50. doi: 10.1001/jamaoto.2013.5338. PMID: 24158564.
- Zhang Z, Sowho M, Otvos T, Sperandio LS, East J, Sgambati F, Schwartz A, Schneider H. A comparison of automated and manual sleep staging and respiratory event recognition in a portable sleep diagnostic device with in-lab sleep study. J Clin Sleep Med. 2020 Apr 15;16(4):563-573. doi: 10.5664/jcsm.8278. PMID: 32022670; PMCID: PMC7161441.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-08-2022
Beoordeeld op geldigheid : 20-07-2022
Algemene gegevens
In samenwerking met:
- ApneuVereniging
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
- Nederlandse Vereniging van Orthodontisten
- V&VN Longverpleegkundigen
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
In deze richtlijn worden aanbevelingen gedaan over de diagnostiek, chirurgische en niet-chirurgische behandelingen en de begeleiding van patiënten met OSA. Hiermee wordt meer uniformiteit verkregen met betrekking tot de zorg van patiënten met OSA. Voor de patiënt kan deze richtlijn leiden tot een betere en doelgerichtere behandeling/ betere op de patiënt afgestemde zorg.
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met OSA. De gebruikers van de richtlijn betreffen dan ook naast de longartsen, KNO-artsen, neurologen en kaakchirurgen veel andere medische beroepsgroepen zoals geriaters, orthodontisten, anesthesiologen, cardiologen, huisartsen, psychiaters, physician assistants, verpleegkundig specialisten, verpleegkundigen, OSA-consulenten, verzekeringsartsen en bedrijfsartsen.
Samenstelling werkgroep
- Dr. J.P. van Maanen, KNO-arts, Onze Lieve Vrouwe Gasthuis, (voorzitter), NVKNO
- Dr. J. (Jerryll) Asin, Longarts, Amphia ziekenhuis Breda, NVALT, NSVL
- Dr. J.A. (Hans) Hardeman, longarts, Antoniusziekenhuis Nieuwegein, NVALT
- Dr. L.L. (Laurien) Teunissen, neuroloog, Antoniusziekenhuis Nieuwegein, NVN
- Drs. P.H.J.M. van Mechelen, ApneuVereniging
Met ondersteuning van
- Dr. Ir. N.L. van der Zwaluw, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Met dank aan
- Dr. R.J.B. (Raphael) Hemler, KNO-arts, Gelre Ziekenhuizen
- De Slaapgeneeskunde Vereniging Nederland (SVNL) voor het bieden van een overlegplatform
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep-lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
JP van Maanen |
KNO-arts somnoloog, OLVG, voorzitter slaapcentrum
|
- bestuurslid Slaapgeneeskunde Vereniging Nederland - bestuurslid Stichting Slaapcongres Nederland - Voorzitter kerngroep slaapgeneeskunde, NVKNO |
- |
- |
|
J Asin |
Longarts-somnoloog, werkzaam in Amphia, Breda |
Lid NVALT, sectie Ademhalingsstoornissen tijdens de slaap (SAS) (onbetaald) Bestuurslid SNVL (onbetaald) |
- Advisory board Bioproject (vergoeding per bijeenkomst) - SLEMRA studie PRESMO-studie -COMISA-studie -JAZZ-studie |
- |
|
JA Hardeman |
Longarts, st. Antonius ziekenhuis Nieuwegein |
Secretaris sectie ademhalingsstoornissen in de slaap (SAS) onbetaald |
- |
- |
|
LL Teunissen |
Neuroloog, st Antonius ziekenhuis Nieuwegein |
Werkgroep ontwikkeling post-HBO opleiding SVNL ism LOI (tot op heden geen financiële tegemoetkoming, mogelijk in toekomst wel) |
- lid projectgroep namens de NVN voor studie: Z69118163 Een Value Based Healthcare verbetercyclus voor Obstructief Slaapapneu, SKMS subsidie. |
- |
|
PHJM van Mechelen |
Beleidsadviseur ApneuVereniging (onbetaald) |
- |
- |
- |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van een patiëntenvereniging, de ProstaatKankerStichting, in de werkgroep te laten participeren.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie ook het implementatieplan).
De richtlijn is opgenomen in de richtlijnendatabase waarmee hij toegankelijk is voor alle relevante beroepsgroepen en patiënten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreetrust.org), dat een internationaal breed geaccepteerd instrument is voor de beoordeling van de kwaliteit van richtlijnen. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur mogelijke knelpunten. Tevens werden betrokken partijen uitgenodigd op de Invitational conference om knelpunten aan te dragen. Een verslag hiervan is opgenomen onder aanverwante producten. Tenslotte zijn de modules van de richtlijn uit 2010 beoordeeld of een update nodig was.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter, de vicevoorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn vervolgens verder uitgewerkt door de leden van de werkgroep en tijdens de werkgroepvergadering vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Voor iedere uitgangsvraag werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading of Recommendations Assessment, Development and Evaluation (zie www.gradeworkinggroup.org).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek.
Bij interventievragen verwijst de conclusie niet naar een of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op voor elke interventie. Bij het opmaken van de balans werden door de werkgroep de gunstige en ongunstige effecten voor de patiënt afgewogen. Wanneer er voor een uitgangsvraag geen systematisch literatuuronderzoek werd verricht, is de literatuur niet beoordeeld op kwaliteit en is de kracht van het bewijs niet bepaald.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. Bij het formuleren en graderen van de aanbeveling worden minimaal de volgende vier factoren in ogenschouw genomen: algehele kwaliteit van het wetenschappelijke bewijs; balans tussen voor- en nadelen van de interventie; waarden en voorkeuren van professional en patiënten; en beschikbare middelen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
De werkgroep heeft een procesindicator opgesteld om te bepalen welk percentage patiënten dat start met CPAP-behandeling binnen zes weken een vervolgafspraak heeft in het ziekenhuis (zie indicatoren). Dit zou de begeleiding en uiteindelijk de therapietrouw ten goede moeten komen.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html. 2012.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
