Nacontrole na definitieve chemoradiatie
Uitgangsvraag
Wat is de optimale nacontrole voor patiënten met oesofaguscarcinoom na definitieve chemoradiatie?
Aanbeveling
Verricht geen standaard follow-up met beeldvorming of endoscopie bij patiënten met definitieve chemoradiatie. Overweeg screening alleen bij patiënten voor wie een salvage behandeling haalbaar en wenselijk is, en alleen in de eerste drie jaar na behandeling.
Overweeg daarbij het volgende schema:
Screeningsschema na einde chemoradiatie
Endoscopische follow-up na 3 tot 6m-9m-12m-18m-24m-36m
CT thorax/abdomen na 3 tot 6m-12m-24m
Wanneer een recidief wordt gedetecteerd en een salvage behandeling wordt overwogen, verricht dan tevoren eerst een PET-CT.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor de drie cruciale uitkomstmaten (algehele overleving, her-interventies en kwaliteit van leven) zijn geen uitkomsten gerapporteerd.
Er is één systematic review (Du, 2017) en een aanvullende observationele studie (Sudo, 2018) die uitkomsten rapporteren voor recurrence rate en tijd tot recurrence. De systematic review van Du (2017) heeft verschillende studie designs geïncludeerd waarbij patiënten verschillende typen chemotherapie ontvingen evenals verschillende doses radiotherapie gecombineerd met electieve lymfeklier bestraling. Echter wordt in de studie niet duidelijk of dit gerapporteerde uitkomsten op 1, 2 of 3 jaar betreft. Daardoor geeft deze studie geen verheldering van de situatie van dCRT patiënten. Bovendien wordt er een pooled local-regional recurrence rate en distant metastasis rate genoemd, waarbij niet duidelijk is op hoeveel jaar dit is.
De observationele studie van Sudo (2018) keek naar recurrences en tijd tot recurrences bij patiënten na definitieve chemoradiotherapy. Patiënten in deze studie werden elke 3 tot 6 maanden middels CT-scan en gastroduodenoscopie onderzocht voor een minimum van vijf jaar.
Vanwege het observationele studie design van de meeste geïncludeerde studies, is er sprake van zeer lage bewijskracht.
Het recidiefpatroon na definitieve chemoradiatie is wezenlijk anders dan na neoadjuvante chemoradiatie gevolgd door een resectie (Versteijne, 2015; Hulshof, 2021; Oppedijk, 2014).
Patiënten hebben na definitieve chemoradiatie een recidiefkans van 45-54% (Versteijne, 2015; Hulshof, 2021; Pape, 2022). Van alle eerste recidieven is 34-55% alleen locoregionaal, 27-41% alleen op afstand en 20-32% zowel locoregionaal als op afstand (Versteijne, 2015; Hulshof, 2021; Pape, 2022).
Verreweg de meeste recidieven treden op binnen 2-3 jaar. De kans op een eerste locoregionaal recidief >3 jaar na behandeling is <2% (Versteijne, 2015). Onderscheid dient te worden gemaakt tussen verschillende groepen patiënten, die allen een andere behandeling vereisen (salvage dCRT, salvage chirurgie of palliatieve systeemtherapie). Voor eventuele salvage behandelingen dient altijd een complete herstadiëring te worden verricht (inclusief tenminste 18F FDG/PET-CT), alvorens zo mogelijk tot in-opzet curatieve therapie over te gaan.
1. Locoregionale recidief binnen het bestralingsgebied. Hiervoor is de enige curatieve optie een salvage resectie. Veelal is in de primaire setting al bewust gekozen voor definitieve chemoradiatie. Slechts bij patiënten waarbij een ingrijpende resectie alsnog haalbaar kan zijn na definitieve chemoradiatie heeft intensievere follow-up therapeutische consequenties. Bij een lokaal recidief in de slokdarm (86% van alle locoregionale recidieven) (Versteijne, 2015), al dan niet in combinatie met recidief in regionale klieren, zullen patiënten zich snel presenteren met dysfagieklachten. Bij een recidief in alleen regionale klieren (14% van alle locoregionale recidieven) (Versteijne, 2015) zullen minder snel symptomen ontstaan. Of screening op een locoregionaal recidief invloed heeft op de overleving is twijfelachtig en onbekend. Hoewel zelden toegepast, is een salvage slokdarmresectie een haalbare therapeutische optie voor zorgvuldig geselecteerde patiënten met een beperkt locoregionaal recidief na dCRT (Borghesi S, 2008; Gardner-Thorpe, 2007; Farinella, 2016). Salvage resectie na dCRT kent een hogere morbiditeit in vergelijking met oesofagusresectie na neo-adjuvante CRT (Nishimura, 2007; Swisher 2002; D’Journo XB, 2008; Miyata, 2009). De beste manier om patiënten voor deze benadering te selecteren is niet vastgesteld. Zeker is dat er alleen een poging tot resectie dient te worden gedaan indien een R0-resectie technisch haalbaar is en afstandsmetastasen zijn uitgesloten (Booka, 2020). In het geval van alleen een klein lokaal residu of recidief dat zich niet dieper dan de (sub)mucosa lijkt uit te breiden kan in zeer geselecteerde gevallen een endoscopische resectie worden overwogen (Al-Kaabi, 2021)Teneinde patiënten voor wie een salvage resectie mogelijk is, tijdig te identificeren en te vervolgen, adviseren we om bij indicatiestelling voor definitieve chemoradiatie, direct in het MDO te bepalen of patiënt potentieel in aanmerking komt voor salvage resectie (chirurgische resectabiliteit). De minimale voorwaarden voor het potentieel mogelijk zijn van een salvage resectie zijn:
- Chirurgisch resectabel recidief of residu
- WHO performance status ≤ 1 en medisch operabele patiënt (o.a. bepaald middels spirometrie)
- Behandelwens bij patiënt, zowel voorafgaand aan als na afronding van definitieve chemoradiatie. Bij een proximaal recidief met betrokkenheid of nabijheid van de bovenste slokdarmsfincter is een larynx-farynx extirpatie nodig; het is belangrijk dat patiënt hier uitgebreid over gecounseld wordt.
De operabiliteit van patiënt dient na dCRT en tijdens follow-up steeds heroverwogen te worden, en indien patiënt niet langer operabel is, de follow-up daarop aangepast.
2. Locoregionaal recidief buiten het bestralingsgebied. Dit betreffen meestal regionale klierrecidieven zonder recidief in de slokdarm. Van de circa 50% van alle patiënten die een recidief krijgt, krijgt ongeveer 40% (20% van totaal) alleen een locoregionaal recidief. Bij diegenen met een locoregionaal recidief is in 14% (circa 2-3% van totaal) sprake van een geïsoleerd regionaal klierrecidief, waarvan de meesten zich buiten het eerdere bestralingsveld bevinden (Versteijne, 2015). Voor deze patiënten kan definitieve chemoradiatie een goede salvage behandeling zijn (Jeene, 2017), maar gezien de lage incidentie lijkt het niet aan te bevelen hier actief op te screenen.
3. Oligometastatische recidiefziekte. Internationaal neemt de neiging toe om oligometastatische ziekte radicaal te behandelen, ook voor het slokdarmcarcinoom, bijvoorbeeld door naast palliatieve systeemtherapie ook op metastase(n) gerichte chirurgie, ablatie of stereotactische radiotherapie te overwegen.(Kroese, 2022; Kroese, 2023). Een voltooide gerandomiseerde fase II trial bij patiënten met een oligogemetastaseerd plaveiselcelcarcinoom van de oesofagus (waarvan een kleine meerderheid een metachroon oligorecidief had en status na definitieve chemoradiatie), observeerde een verbeterde progressie-vrije overleving na additie van metastase-gerichte radicale behandeling bovenop systeemtherapie alleen (Liu, 2024). Aanvullend fase III onderzoek en dergelijke studies bij adenocarcinoom zijn nodig om deze bevindingen te ondersteunen of weerleggen. Het is onduidelijk of screening ter vroege identificatie van (oligo)gemetastaseerde ziekte een overlevingsvoordeel biedt en screening met dat doel kan derhalve heden niet worden aanbevolen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Samenvattend is er geen onderzoek van goede kwaliteit dat het ziektebeloop of de overleving wordt beïnvloed door screening. Gezien het recidiefpatroon waarbij de meeste recidieven optreden binnen 2 tot 3 jaar na behandeling, dient eventuele screening zich tot 3 jaar te beperken.
Studies naar de waarde van diagnostische modaliteiten voor screening in de follow-up periode na definitieve chemoradiatie zijn zeer beperkt. De werkgroep is van mening dat het intensiveren van de frequentie van endoscopische evaluatie (met biopten alleen indien zichtbare afwijkingen) meer kans geeft om een geschikte patiënt voor salvage behandeling op te sporen dan het intensiveren van de frequentie van beeldvorming.
Onderbouwing
Achtergrond
Definitive chemoradiation is a curative treatment modality that should be considered for patients with irresectable esophageal tumors or patients that are medically inoperable. However, recurrences after definitive chemoradiation are frequent. Selected patients may benefit from aggressive, curative-intent treatment in case of relapse after definitive chemoradiation. Currently, varying follow-up schedules are used and do or do not include imaging or endoscopy. This leads to insufficient national real-world data on the efficacy of definitive chemoradiation and may lead to too many or, in case of curative options, too little diagnostic procedures.
Conclusies / Summary of Findings
|
No Grade |
No evidence was found regarding the effect of follow-up overall survival, number of re-interventions, quality of life and distant metastasis when compared with no follow-up in patients with esophageal- or gastro-esophageal cancer after definitive chemoradiotherapy. |
|
Very low GRADE |
The evidence is very uncertain about the (locoregional) recurrence of patients with esophageal cancer treated with definitive chemoradiotherapy.
Source: Du, 2017; Sudo, 2018 |
|
Very low GRADE |
The evidence is very uncertain about the time to recurrence of patients with esophageal cancer treated with definitive chemoradiotherapy.
Source: Sudo, 2018 |
Samenvatting literatuur
Description of studies
Du (2017) performed a systematic review including studies reporting response rate, survival, failure pattern and toxicity on the definitive concurrent chemoradiotherapy with elective node irradiation (ENI) in patients with esophageal cancer between 1990 and 2015. Studies were excluded if neoadjuvant or adjuvant chemoradiotherapy was combined with surgery, if there was palliative chemoradiotherapy, if radiotherapy was delivered by Co-60 or by unconventional fractions, if it was a phase I study if results of ENI and conventional radiotherapy were mixed or if there were other sites of cancer included.
In total, 22 studies were included. Regarding the scope of this summary and the outcomes, only data regarding patterns of failure was reported. Fifteen studies in the systematic review of Du (2017) reported patterns of failure (Cooper, 1999; Nishimura, 2009; Yamashita, 2011; Onozawa, 2009; Ishikura, 2003; Kato, 2013; Poplin, 1996; Roca, 1996; Jefford, 2002; Ishida, 1996; Liu, 2014; Morota, 2009; Ohtsu, 1999; Kodaira, 2006; Hironaka, 2003) with a total of 1163 patients.
Follow-up period in which patterns of failure should occur, were not reported by Du (2017).
Sudo (2018) performed a retrospective cohort study including patients with stage II or III esophageal squamous cell carcinoma who received definitive chemoradiotherapy.
Patients with a complete therapy response (CRT) (defined as the disappearance of all lesions as well as secondary changes associated with the tumors according to the Japanese classification of esophageal cancer, 10th edition), were under evaluation by CT and esophagogastroduoscopy. These examinations were repeated every three to six months for at least five years after achieving CRT, until relapse or death.
In total, 204 patients received CRT with a median age of 65 years (range 42-81) and 83% was male. Of the included patients, 184 (90%) received 5-FU and cisplatin as chemotherapy during radiation treatment, 9 patients (4%) received 5-FU and nedaplatin, 9 patients (4%) received S-1 and cisplatin and two patients (1%) received docetaxel. Regarding radiation dose, 57 patients (28%) received 50.4 Gy and 147 patients (72%) received 60.0 Gy.
The median follow-up time was 75.7 months. Sudo (2018) reported locoregional relapses and annual odds of luminal relapse, regional relapse and new cancer found with esophagogastroduodenoscopy.
Results
Overall survival
None of the included studies reported overall survival.
Number of re-interventions
None of the included studies reported number of re-interventions.
Quality of life
None of the included studies reported quality of life.
(Locoregional) recurrence
The systematic review of Du (2017) reported local-regional recurrence and distant failure rate. The local-regional recurrence rates of individual studies in the review of Du (2017) are presented in table 1. The pooled local-regional recurrence rate is 21% (95%CI 16-26).
Table 1. Local-regional recurrence rates (Du, 2017)
|
Study |
Local-regional recurrence rate (95%CI) |
|
Cooper (1999) – Randomized group |
13% (5-22) |
|
Cooper (1999) – Non-randomized group |
20% (11-30) |
|
Nishimura (2009) – Arm B |
13% (3-23) |
|
Yamashita (2011) |
16% (9-22) |
|
Onozawa (2009) |
11% (5-17) |
|
Ishikura (2003) |
11% (6-16) |
|
Kato (2013) |
27% (15-40) |
|
Poplin (1996) |
6% (-2-15) |
|
Jefford (2002) |
22% (5-39) |
|
Roca (1996) |
38% (25-51) |
|
Ishida (1996) |
18% (7-30) |
|
Liu (2014) |
37% (29-44) |
|
Morota (2009) |
17% (8-26) |
|
Ohtsu (1999) |
35% (22-48) |
|
Kodaira (2006) |
24% (7-41) |
|
Hironaka (2003) |
36% (23-49) |
The distant failure rates of individual studies from the review of Du (2017) are presented in table 2. The pooled distant failure rate is 11% (95%CI 9-14).
Table 2. Distant failure rates (Du, 2017)
|
Study |
Distant failure rate (95%CI) |
|
Cooper (1999) – Randomized group |
8% (1-15) |
|
Cooper (1999) – Non-randomized group |
16% (7-25) |
|
Yamashita (2011) |
10% (4-15) |
|
Onozawa (2009) |
9% (3-14) |
|
Ishikura (2003) |
9% (5-14) |
|
Kato (2013) |
16% (6-26) |
|
Poplin (1996) |
6% (-2-15) |
|
Jefford (2002) |
13% (-1-27) |
|
Roca (1996) |
16% (7-26) |
|
Ishida (1996) |
36% (22-51) |
|
Liu (2014) |
9% (5-13) |
|
Morota (2009) |
7% (1-13) |
|
Ohtsu (1999) |
17% (7-27) |
|
Kodaira (2006) |
24% (7-41) |
|
Hironaka (2003) |
8% (0-15) |
The pooled distant failure rate and both local-regional recurrence plus distant failure rate is 7% (95%CI 4-11%).
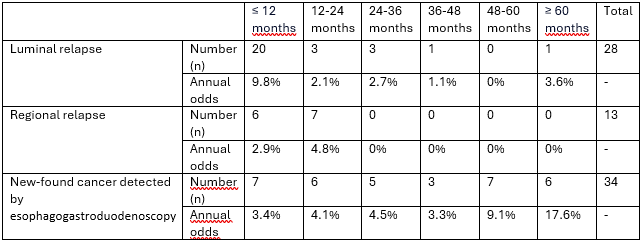
Sudo (2018) reported luminal relapse, regional relapse and distant metastasis in the follow-up period with a median follow-up time of 75.7 months. Sudo (2018) reported luminal relapse in 28 patients (13.7%), regional relapse in 13 patients (6.4%) and distant metastases in 39 patients (19.1%). In 34 patients (7.8%) a new-found cancer was detected by the esophagogastroduodenoscopy.
Distant metastasis
None of the included studies reported distant metastasis.
Time to recurrence
Sudo (2018) reported the annual odds for developing luminal relapse, regional relapse and new-found cancer detected by the esophagogastroduodenoscopy, see table 3.
Table 3. Timing of relaps patterns and new-found cancer (Sudo, 2018)
Level of evidence of the literature
The level of evidence of observational cohort studies is considered low according to the GRADE methodology. Therefore, the level of evidence of these cohort studies starts at low GRADE.
The level of evidence regarding the outcome measure (locoregional) recurrence was downgraded to very low because of study limitations (-1; risk of bias).
The level of evidence regarding the outcome measure time to recurrence was downgraded by to very low because of study limitations (-1; risk of bias) and number of included patients (-1; imprecision because of small sample size).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
1. What is the effect of (5-year) follow-up on overall survival, number of re-interventions, quality of life, locoregional recurrence and distant metastasis compared with no follow-up in patients with esophageal- or gastro-esophageal cancer after definitive chemoradiotherapy?
| P: | Patients with esophageal- or gastro-esophageal cancer after definitive chemoradiotherapy |
| I: | (5-year) follow-up with endoscopy, (FDG/PET) CT or MRI |
| C: | No follow-up |
| O: | Overall survival, number of re-interventions, quality of life, (locoregional) recurrence, distant metastasis |
2. What are the recurrence rates or time to recurrences in patients with esophageal- or gastro-esophageal cancer after definitive chemoradiotherapy?
| P: | Patients with esophageal- or gastro-esophageal cancer after definitive chemoradiotherapy |
| I: |
(Locoregional) recurrence, time to recurrence |
Relevant outcome measures
The guideline development group considered overall survival, re-interventions and quality of life, as a critical outcome measure for decision making and locoregional recurrence, distant metastasis, recurrence rate and time to recurrence as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences (per outcome measure) as minimal clinically (patient) important difference:
- Overall survival:
- Number of re-interventions: >5% absolute difference
- Quality of life: ³ 10 points on the EORTC QLQ-C30 or a difference of a similar magnitude on other quality of life instruments
- (Locoregional) recurrence: >5% absolute difference
- Distant metastasis: >5% absolute difference
- Time to recurrence: >5% absolute difference
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 27-05-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 81 systematic reviews, 180 RCT’s and 110 recurrence rate studies hits. Studies were selected based on the following criteria:
- The study population had to meet the criteria as defined in the PICO;
- The intervention and comparison had to be as defined in the PICO or reported at least one of the outcomes as defined in the PICO;
- Full text available;
- Articles written in English or Dutch.
47 studies were initially selected based on title and abstract screening. After reading the full text, 45 studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included.
Results
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- 1 - Al-Kaabi A, Schoon EJ, Deprez PH, Seewald S, Groth S, Giovannini M, Braden B, Berr F, Lemmers A, Hoare J, Bhandari P, van der Post RS, Verhoeven RHA, Siersema PD. Salvage endoscopic resection after definitive chemoradiotherapy for esophageal cancer: a Western experience. Gastrointest Endosc. 2021 Apr;93(4):888-898.e1. doi: 10.1016/j.gie.2020.07.062. Epub 2020 Aug 4. PMID: 32763242.
- 2 - Booka E, Haneda R, Ishii K, Kawakami T, Tsushima T, Yasui H, Onoe T, Ogawa H, Tsubosa Y. Appropriate Candidates for Salvage Esophagectomy of Initially Unresectable Locally Advanced T4 Esophageal Squamous Cell Carcinoma. Ann Surg Oncol. 2020 Sep;27(9):3163-3170. doi: 10.1245/s10434-020-08440-7. Epub 2020 Apr 20. PMID: 32314159.
- 3 - Borghesi S, Hawkins MA, Tait D. Oesophagectomy after definitive chemoradiation in patients with locally advanced oesophageal cancer. Clin Oncol (R Coll Radiol). 2008 Apr;20(3):221-6. doi: 10.1016/j.clon.2007.12.001. Epub 2008 Jan 14. PMID: 18248970.
- 4 - Cooper JS, Guo MD, Herskovic A, Macdonald JS, Martenson JA Jr, Al-Sarraf M, Byhardt R, Russell AH, Beitler JJ, Spencer S, Asbell SO, Graham MV, Leichman LL. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA. 1999 May 5;281(17):1623-7. doi: 10.1001/jama.281.17.1623. PMID: 10235156.
- 5 - D'Journo XB, Michelet P, Dahan L, Doddoli C, Seitz JF, Giudicelli R, Fuentes PA, Thomas PA. Indications and outcome of salvage surgery for oesophageal cancer. Eur J Cardiothorac Surg. 2008 Jun;33(6):1117-23. doi: 10.1016/j.ejcts.2008.01.056. Epub 2008 Mar 14. PMID: 18342532.
- 6 - Du D, Song T, Liang X, Fang M, Wu S. Concurrent chemoradiotherapy with elective lymph node irradiation for esophageal cancer: a systemic review and pooled analysis of the literature. Dis Esophagus. 2017 Feb 1;30(2):1-9. doi: 10.1111/dote.12471. PMID: 26918886.
- 7 - Farinella E, Safar A, Nasser HA, Bouazza F, Liberale G, Paesmans M, Marechal R, Van Laethem JL, Hendlisz A, VanHoutte P, El Nakadi I. Salvage esophagectomy after failure of definitive radiochemotherapy for esophageal cancer. J Surg Oncol. 2016 Dec;114(7):833-837. doi: 10.1002/jso.24429. Epub 2016 Oct 25. PMID: 27778349.
- 8 - Gardner-Thorpe J, Hardwick RH, Dwerryhouse SJ. Salvage oesophagectomy after local failure of definitive chemoradiotherapy. Br J Surg. 2007 Sep;94(9):1059-66. doi: 10.1002/bjs.5865. PMID: 17657720.
- 9 - Hironaka S, Ohtsu A, Boku N, Muto M, Nagashima F, Saito H, Yoshida S, Nishimura M, Haruno M, Ishikura S, Ogino T, Yamamoto S, Ochiai A. Nonrandomized comparison between definitive chemoradiotherapy and radical surgery in patients with T(2-3)N(any) M(0) squamous cell carcinoma of the esophagus. Int J Radiat Oncol Biol Phys. 2003 Oct 1;57(2):425-33. doi: 10.1016/s0360-3016(03)00585-6. PMID: 12957254.
- 10 - Hulshof MCCM, Geijsen ED, Rozema T, Oppedijk V, Buijsen J, Neelis KJ, Nuyttens JJME, van der Sangen MJC, Jeene PM, Reinders JG, van Berge Henegouwen MI, Thano A, van Hooft JE, van Laarhoven HWM, van der Gaast A. Randomized Study on Dose Escalation in Definitive Chemoradiation for Patients With Locally Advanced Esophageal Cancer (ARTDECO Study). J Clin Oncol. 2021 Sep 1;39(25):2816-2824. doi: 10.1200/JCO.20.03697. Epub 2021 Jun 8. PMID: 34101496.
- 11 - Ishida K, Iizuka T, Ando N, Ide H. Phase II study of chemoradiotherapy for advanced squamous cell carcinoma of the thoracic esophagus: nine Japanese institutions trial. Jpn J Clin Oncol. 1996 Oct;26(5):310-5. doi: 10.1093/oxfordjournals.jjco.a023238. PMID: 8895670.
- 12 - Ishikura S, Nihei K, Ohtsu A, Boku N, Hironaka S, Mera K, Muto M, Ogino T, Yoshida S. Long-term toxicity after definitive chemoradiotherapy for squamous cell carcinoma of the thoracic esophagus. J Clin Oncol. 2003 Jul 15;21(14):2697-702. doi: 10.1200/JCO.2003.03.055. PMID: 12860946.
- 13 - Jeene PM, Versteijne E, van Berge Henegouwen MI, Bergmann JJ, Geijsen ED, Muller K, van Laarhoven HW, Hulshof MC. Definitive chemoradiation for locoregional recurrences of esophageal cancer after primary curative treatment. Dis Esophagus. 2017 Feb 1;30(2):1-5. doi: 10.1111/dote.12539. PMID: 27766725.
- 14 - Jefford M, Toner GC, Smith JG, Ngan SY, Rischin D, Guiney MJ. Phase II trial of continuous infusion carboplatin, 5-fluorouracil, and radiotherapy for localized cancer of the esophagus. Am J Clin Oncol. 2002 Jun;25(3):277-82. doi: 10.1097/00000421-200206000-00015. PMID: 12040288.
- 15 - Kato K, Nakajima TE, Ito Y, Katada C, Ishiyama H, Tokunaga SY, Tanaka M, Hironaka S, Hashimoto T, Ura T, Kodaira T, Yoshimura K. Phase II study of concurrent chemoradiotherapy at the dose of 50.4 Gy with elective nodal irradiation for Stage II-III esophageal carcinoma. Jpn J Clin Oncol. 2013 Jun;43(6):608-15. doi: 10.1093/jjco/hyt048. Epub 2013 Apr 12. PMID: 23585687.
- 16 - Kodaira T, Fuwa N, Kamata M, Furutani K, Tachibana H, Yamazaki T. Single-institute phase I/II trial of alternating chemoradiotherapy with 5-FU and nedaplatin for esophageal carcinoma. Anticancer Res. 2006 Jan-Feb;26(1B):471-8. PMID: 16739307.
- 17 - Kroese TE, van Laarhoven HWM, Nilsson M, Lordick F, Guckenberger M, Ruurda JP, D'Ugo D, Haustermans K, van Cutsem E, van Hillegersberg R, van Rossum PSN. Definition of oligometastatic esophagogastric cancer and impact of local oligometastasis-directed treatment: A systematic review and meta-analysis. Eur J Cancer. 2022 May;166:254-269. doi: 10.1016/j.ejca.2022.02.018. Epub 2022 Mar 24. PMID: 35339868.
- 18 - Kroese TE, van Laarhoven HWM, Schoppman SF, Deseyne PRAJ, van Cutsem E, Haustermans K, Nafteux P, Thomas M, Obermannova R, Mortensen HR, Nordsmark M, Pfeiffer P, Elme A, Adenis A, Piessen G, Bruns CJ, Lordick F, Gockel I, Moehler M, Gani C, Liakakos T, Reynolds J, Morganti AG, Rosati R, Castoro C, Cellini F, D'Ugo D, Roviello F, Bencivenga M, de Manzoni G, van Berge Henegouwen MI, Hulshof MCCM, van Dieren J, Vollebergh M, van Sandick JW, Jeene P, Muijs CT, Slingerland M, Voncken FEM, Hartgrink H, Creemers GJ, van der Sangen MJC, Nieuwenhuijzen G, Berbee M, Verheij M, Wijnhoven B, Beerepoot LV, Mohammad NH, Mook S, Ruurda JP, Kolodziejczyk P, Polkowski WP, Wyrwicz L, Alsina M, Pera M, Kanonnikoff TF, Cervantes A, Nilsson M, Monig S, Wagner AD, Guckenberger M, Griffiths EA, Smyth E, Hanna GB, Markar S, Chaudry MA, Hawkins MA, Cheong E, van Hillegersberg R, van Rossum PSN; OMEC collaborators. Definition, diagnosis and treatment of oligometastatic oesophagogastric cancer: A Delphi consensus study in Europe. Eur J Cancer. 2023 May;185:28-39. doi: 10.1016/j.ejca.2023.02.015. Epub 2023 Feb 24. PMID: 36947929.
- 19 - Liu M, Zhao K, Chen Y, Jiang GL. Evaluation of the value of ENI in radiotherapy for cervical and upper thoracic esophageal cancer: a retrospective analysis. Radiat Oncol. 2014 Oct 25;9:232. doi: 10.1186/s13014-014-0232-4. PMID: 25344056; PMCID: PMC4224691.
- 20 - Liu Q, Chen J, Lin Y, Ye J, Shen W, Luo H, Li B, Huang W, Wei S, Song J, Wang Y, Yang H, Lai S, Zhu H, Ai D, Chen Y, Deng J, Hao S, Zhao K. Systemic therapy with or without local intervention for oligometastatic oesophageal squamous cell carcinoma (ESO-Shanghai 13): an open-label, randomised, phase 2 trial. Lancet Gastroenterol Hepatol. 2024 Jan;9(1):45-55. doi: 10.1016/S2468-1253(23)00316-3. Epub 2023 Nov 18. PMID: 37980921.
- 21 - Miyata H, Yamasaki M, Takiguchi S, Nakajima K, Fujiwara Y, Nishida T, Mori M, Doki Y. Salvage esophagectomy after definitive chemoradiotherapy for thoracic esophageal cancer. J Surg Oncol. 2009 Nov 1;100(6):442-6. doi: 10.1002/jso.21353. PMID: 19653262.
- 22 - Morota M, Gomi K, Kozuka T, Chin K, Matsuura M, Oguchi M, Ito H, Yamashita T. Late toxicity after definitive concurrent chemoradiotherapy for thoracic esophageal carcinoma. Int J Radiat Oncol Biol Phys. 2009 Sep 1;75(1):122-8. doi: 10.1016/j.ijrobp.2008.10.075. Epub 2009 Mar 26. PMID: 19327900.
- 23 - Nishimura Y, Mitsumori M, Hiraoka M, Koike R, Nakamatsu K, Kawamura M, Negoro Y, Fujiwara K, Sakurai H, Mitsuhashi N. A randomized phase II study of cisplatin/5-FU concurrent chemoradiotherapy for esophageal cancer: Short-term infusion versus protracted infusion chemotherapy (KROSG0101/JROSG021). Radiother Oncol. 2009 Aug;92(2):260-5. doi: 10.1016/j.radonc.2008.12.012. Epub 2009 Jan 21. PMID: 19167122.
- 24 - Nishimura M, Daiko H, Yoshida J, Nagai K. Salvage esophagectomy following definitive chemoradiotherapy. Gen Thorac Cardiovasc Surg. 2007 Nov;55(11):461-4; discussion 464-5. doi: 10.1007/s11748-007-0157-z. PMID: 18049854.
- 25 - Ohtsu A, Boku N, Muro K, Chin K, Muto M, Yoshida S, Satake M, Ishikura S, Ogino T, Miyata Y, Seki S, Kaneko K, Nakamura A. Definitive chemoradiotherapy for T4 and/or M1 lymph node squamous cell carcinoma of the esophagus. J Clin Oncol. 1999 Sep;17(9):2915-21. doi: 10.1200/JCO.1999.17.9.2915. PMID: 10561371.
- 26 - Onozawa M, Nihei K, Ishikura S, Minashi K, Yano T, Muto M, Ohtsu A, Ogino T. Elective nodal irradiation (ENI) in definitive chemoradiotherapy (CRT) for squamous cell carcinoma of the thoracic esophagus. Radiother Oncol. 2009 Aug;92(2):266-9. doi: 10.1016/j.radonc.2008.09.025. Epub 2008 Oct 24. PMID: 18952308.
- 27 - Oppedijk V, van der Gaast A, van Lanschot JJ, van Hagen P, van Os R, van Rij CM, van der Sangen MJ, Beukema JC, Rütten H, Spruit PH, Reinders JG, Richel DJ, van Berge Henegouwen MI, Hulshof MC. Patterns of recurrence after surgery alone versus preoperative chemoradiotherapy and surgery in the CROSS trials. J Clin Oncol. 2014 Feb 10;32(5):385-91. doi: 10.1200/JCO.2013.51.2186. Epub 2014 Jan 13. PMID: 24419108.
- 28 - Pape M, Vissers PAJ, Bertwistle D, McDonald L, Beerepoot LV, van Berge Henegouwen MI, Lagarde SM, Mook S, Mohammad NH, Jeene PM, van Laarhoven HWM, Verhoeven RHA. Population-based study of treatment and outcome of recurrent oesophageal or junctional cancer. Br J Surg. 2022 Nov 22;109(12):1264-1273. doi: 10.1093/bjs/znac290. PMID: 35998093; PMCID: PMC10364682.
- 29 - Poplin EA, Jacobson J, Herskovic A, Panella TJ, Valdivieso M, Hutchins LF, Macdonald JS. Evaluation of multimodality treatment of locoregional esophageal carcinoma by Southwest Oncology Group 9060. Cancer. 1996 Nov 1;78(9):1851-6. PMID: 8909302.
- 30 - Roca E, Pennella E, Sardi M, Carraro S, Barugel M, Milano C, Fiorini A, Giglio R, Gonzalez G, Kneitschel R, Aman E, Jarentchuk A, Blajman C, Nadal J, Santarelli MT, Navigante A. Combined intensive chemoradiotherapy for organ preservation in patients with resectable and non-resectable oesophageal cancer. Eur J Cancer. 1996 Mar;32A(3):429-32. doi: 10.1016/0959-8049(95)00524-2. PMID: 8814686.
- 31 - Sudo K, Kato K, Kuwabara H, Sasaki Y, Takahashi N, Shoji H, Iwasa S, Honma Y, Okita NT, Takashima A, Hamaguchi T, Yamada Y, Ito Y, Itami J, Fukuda T, Tobinai K, Boku N. Patterns of Relapse after Definitive Chemoradiotherapy in Stage II/III (Non-T4) Esophageal Squamous Cell Carcinoma. Oncology. 2018;94(1):47-54. doi: 10.1159/000480515. Epub 2017 Oct 28. PMID: 29080886.
- 32 - Swisher SG, Wynn P, Putnam JB, Mosheim MB, Correa AM, Komaki RR, Ajani JA, Smythe WR, Vaporciyan AA, Roth JA, Walsh GL. Salvage esophagectomy for recurrent tumors after definitive chemotherapy and radiotherapy. J Thorac Cardiovasc Surg. 2002 Jan;123(1):175-83. doi: 10.1067/mtc.2002.119070. PMID: 11782772.
- 33 - Versteijne E, van Laarhoven HW, van Hooft JE, van Os RM, Geijsen ED, van Berge Henegouwen MI, Hulshof MC. Definitive chemoradiation for patients with inoperable and/or unresectable esophageal cancer: locoregional recurrence pattern. Dis Esophagus. 2015 Jul;28(5):453-9. doi: 10.1111/dote.12215. Epub 2014 Apr 11. PMID: 24725186.
- 34 - Yamashita H, Okuma K, Wakui R, Kobayashi-Shibata S, Ohtomo K, Nakagawa K. Details of recurrence sites after elective nodal irradiation (ENI) using 3D-conformal radiotherapy (3D-CRT) combined with chemotherapy for thoracic esophageal squamous cell carcinoma--a retrospective analysis. Radiother Oncol. 2011 Feb;98(2):255-60. doi: 10.1016/j.radonc.2010.10.021. Epub 2010 Nov 11. PMID: 21074880.
Evidence tabellen
Research question: What are the recurrence rates or time to recurrences in patients with esophageal- or gastro-esophageal cancer after definitive chemoradiotherapy?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Du, 2017
PS. Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs and cohort studies
Literature search up to February 2015
A: Cooper, 1999 B: Nishimura, 2009 C: Yamashita, 2011 D: Onozawa, 2009 E: Ishikura, 2003 F: Kato, 2013 G: Poplin, 1996 H: Roca, 1996 I: Jefford, 2002 J: Ishida, 1996 K: Liu, 2014 L: Morota, 2009 M: Ohtsu, 1999 N: Kodaira, 2006 O: Hironaka, 2003
Study design: A: RCT + prospective cohort B: RCT C: Retrospective cohort D: Retrospective cohort E: Retrospective cohort F: Prospective cohort G: Prospective cohort H: Prospective cohort I: Prospective cohort J: Prospective cohort K: Retrospective cohort L: Retrospective cohort M: Prospective cohort N: Prospective cohort O: Retrospective cohort
Setting and Country: A: USA B: Japan C: Japan D: Japan E: Japan F: Japan G: USA H: Argentina I: Australia J: Japan K: China L: Japan M: Japan N: Japan O: Japan
Source of funding and conflicts of interest: The authors indicated no potential conflicts of interest
|
Inclusion criteria SR: - Studies containing original data on definitive chemoradiotherapy with elective node irradiation (ENI) in patients with esophageal carcinoma - Report of outcome failure pattern
Exclusion criteria SR: - Neoadjuvant or adjuvant chemoradiotherapy combined with surgery - Palliative chemoradiotherapy - Radiotherapy delivered by Co-60 or by unconventional fractions - Not published in full-text - Phase I study - Results mixed with ENI and conventional RT filed - Results not reported exactly - Other sites of cancer - Reviews and meta analyses
22 studies included (regarding the scope and outcome of interest of this review, only data from 15 studies is reported)
Important patient characteristics at baseline:
N, % male A: 134, not reported B: 91, 90% C: 126, 88% D: 102, 83% E: 139, 87% F: 76, 89% G: 32, 81% H: 55, 69% I: 23, 65% J: 45, 96% K: 169, 76% L: 69, 87% M: 54, 96% N: 25, 88% O: 53, 85%
TNM/Stage A: T1-3N0-1M0 B: II-IVa C: I-IV D: I-IVb E: I-IVa F: II-III G: I-III H: I-III I: Not reported J: T4Nx-1M0-1 K: I-IV L: I-IVb M: T4NxM0-1 N: T1b-4N0-1M0-1 O: IIa-III
Studies are not comparable at baseline |
Describe intervention:
Chemotherapy A: Cisplatin + 5-Fu B: Cisplatin + 5-Fu C: Nedaplatin + 5-Fu D: Cisplatin + 5-Fu E: Cisplatin + 5-Fu F: Cisplatin + 5-Fu G: Cisplatin + 5-Fu H: Cisplatin + 5-Fu + leucovorin + bleomycin + mitomycin C I: Carboplatin + 5-Fu J: Cisplatin + 5-Fu K: PF/TP/TPF L: Cisplatin + 5-Fu M: Cisplatin + 5-Fu N: Nedaplatin + 5-Fu O: Cisplatin + 5-Fu
Radiation dose (Gy) A: 50 B: 60 C: 50-50.4 D: 60 E: 60 F: 60 G: 50 H: 60 I: 50 J: 60 K: 60-68.4 L: 60 M: 60 N: 63 O: 60
|
Describe control:
Not applicable
|
End-point of follow-up: Not reported
For how many participants were no complete outcome data available? Not reported
|
Outcome measure-1 Defined as patterns of failure
See table 1 in summary of literature
|
Risk of bias (high, some concerns or low): No individual risk of bias assessment by authors of systematic review
Authors conclusion: The comparison of failure patterns suffered from bias since they were performed during different time periods or based on different evaluation criteria. These biases might have influenced the pooled results and interpretation of the findings. |
|
Sudo, 2018 |
Type of study: Retrospective cohort study
Setting and country: Japan
Funding and conflicts of interest: Study was supported by a National Cancer Center Research and Development Fund. Authors have no conflicts of interest to disclose |
Inclusion criteria: - Patients who were diagnosed with stage II-III esophageal squamous cell carcinoma; - Between 2000 and 2011 - Patients who received definitive chemoradiotherapy (dCRT) - Patients with complete respons after dCRT
Exclusion criteria: - Patients with T4 esophageal squamous cell carcinoma - Patients with double cancer - Received chemoradiotherapy as a salvage treatment for recurrent disease after surgery
N total at baseline: 204
Important prognostic factors2: Median age: 65 (range 42-81)
Sex: 83% male
Baseline stage: Stage II: N=134 (66%) Stage III: N=70 (34%) |
Describe intervention
Chemotherapy: 5-Fu and cisplatin: N=184 (90%) 5-Fu and nedaplatin: N=9 (4%) S-1 and cisplatin: N=9 (4%) Docetaxel: N=2 (1%)
Total radiation dose: 50.4Gy: N=57 (28%) 60.0Gy: N=147 (72%) |
Describe control
Not applicable |
Length of follow-up: Median follow-up time: 75.7 months (IQR 53.1-104.7)
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measures:
See results and table 2 in summary of literature
|
Authors conclusion: Intensive surveillance with esophagogastroduodenoscopy may be important in the first 3 years after dCRT to detect luminal relapse, and esophagogastroduodenoscopy might be needed to detect new-found cancer beyond 3 years from dCRT. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Du, 2017 |
Yes |
No |
No, no description of excluded studies |
No |
No, no multivariate analysis |
No |
No, RCT’s and observational studies were combined |
Yes |
Yes |
Risk of bias table for observational studies
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables?
|
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Sudo, 2018 |
Definitely yes
Reason: Participants were selected from a hospital registry
|
Unclear
Reason: Therapy response was assessed by CT-scan and esophagogastroduodenoscopy. Possible cases of exposure were missed
|
Unclear
Reason: Outcome of interest at start of study was assessed by CT-scan and esophagogastroduodenoscopy
|
Probably no
Reason: Limited characteristic and confounding factors were reported
|
Definitely no
Reason: No multivariate analysis
|
Unclear
Reason: Outcome was assessed by CT-scan and esophagogastroduodenoscopy. Possible cases of exposure were missed
|
Probably yes
Reason: Follow-up time was adequate. No reported of imputing missing data
|
No information
Reason: Not clear if there were any co-interventions
|
High |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Kumagai K, Mariosa D, Tsai JA, Nilsson M, Ye W, Lundell L, Rouvelas I. Systematic review and meta-analysis on the significance of salvage esophagectomy for persistent or recurrent esophageal squamous cell carcinoma after definitive chemoradiotherapy. Dis Esophagus. 2016 Oct;29(7):734-739. doi: 10.1111/dote.12399. Epub 2015 Aug 28. PMID: 26316181. |
Wrong comparison: Salvage surgery versus chemoradiotherapy |
|
Chen M, Liu P, Chen Y, Chen Z, Shen M, Liu X, Li X, Lin Y, Yang R, Ni W, Zhou X, Zhang L, Tian Y, Chen J. Primary tumor regression patterns in esophageal squamous cell cancer treated with definitive chemoradiotherapy and implications for surveillance schemes. Cancer Manag Res. 2019 Apr 17;11:3361-3369. doi: 10.2147/CMAR.S198524. PMID: 31114372; PMCID: PMC6489665. |
Wrong comparison: comparison of recurrence patterns |
|
Sudo K, Xiao L, Wadhwa R, Shiozaki H, Elimova E, Taketa T, Blum MA, Lee JH, Bhutani MS, Weston B, Ross WA, Komaki R, Rice DC, Swisher SG, Hofstetter WL, Maru DM, Skinner HD, Ajani JA. Importance of surveillance and success of salvage strategies after definitive chemoradiation in patients with esophageal cancer. J Clin Oncol. 2014 Oct 20;32(30):3400-5. doi: 10.1200/JCO.2014.56.7156. Epub 2014 Sep 15. PMID: 25225435; PMCID: PMC4195852. |
Wrong population: Patients who underwent surgery or salvage surgery |
|
Dong D, Zhao D, Li S, Liu W, Du F, Xu X, Xiao S, Zheng B, Sun Y, Wang W. Nomogram to predict overall survival for patients with non-metastatic cervical esophageal cancer: a SEER-based population study. Ann Transl Med. 2020 Dec;8(23):1588. doi: 10.21037/atm-20-2505. PMID: 33437787; PMCID: PMC7791199. |
No outcomes of interest reported
|
|
Doosti-Irani A, Mansournia MA, Rahimi-Foroushani A, Haddad P, Holakouie-Naieni K. Local recurrence of esophageal squamous cell carcinoma after treatment: Comparison of frequentist and Bayesian network meta-analysis. Clinical Epidemiology and Global Health 2019 7(2), 145-152, doi: https://doi.org/10.1016/j.cegh.2018.02.009. |
Wrong comparisons: Surgery + chemotherapie vs. Surgery
|
|
Hipp J, Nagavci B, Schmoor C, Meerpohl J, Hoeppner J, Schmucker C. Post-Neoadjuvant Surveillance and Surgery as Needed Compared with Post-Neoadjuvant Surgery on Principle in Multimodal Treatment for Esophageal Cancer: A Scoping Review. Cancers (Basel). 2021 Jan 23;13(3):429. doi: 10.3390/cancers13030429. PMID: 33561090; PMCID: PMC7865772. |
Wrong design: Scoping review
|
|
Mikhail S, Wei L, Salem ME, Bekaii-Saab T. Outcomes of definitive chemoradiation in patients with esophageal cancer. Dis Esophagus. 2017 Feb 1;30(2):1-7. doi: 10.1111/dote.12506. PMID: 27868290. |
Narrative review |
|
Mummudi N, Jiwnani S, Niyogi D, Srinivasan S, Ghosh-Laskar S, Tibdewal A, Rane P, Karimundackal G, Pramesh CS, Agarwal JP. Salvage radiotherapy for postoperative locoregional failure in esophageal cancer: a systematic review and meta-analysis. Dis Esophagus. 2022 Mar 12;35(3):doab020. doi: 10.1093/dote/doab020. PMID: 33912933. |
Wrong population: Patients who underwent salvage radiotherapie (after developing locoregional recurrence)
|
|
Salcedo J, Suen SC, Bian SX. Cost-effectiveness of chemoradiation followed by esophagectomy versus chemoradiation alone in squamous cell carcinoma of the esophagus. Cancer Med. 2020 Jan;9(2):440-446. doi: 10.1002/cam4.2721. Epub 2019 Nov 20. PMID: 31749330; PMCID: PMC6970052. |
Wrong comparison: Chemoradiation and surgery verus chemoradiation alone |
|
van den Boorn HG, Engelhardt EG, van Kleef J, Sprangers MAG, van Oijen MGH, Abu-Hanna A, Zwinderman AH, Coupé VMH, van Laarhoven HWM. Prediction models for patients with esophageal or gastric cancer: A systematic review and meta-analysis. PLoS One. 2018 Feb 8;13(2):e0192310. doi: 10.1371/journal.pone.0192310. PMID: 29420636; PMCID: PMC5805284. |
Wrong population: Patients who underwent resection; Wrong outcome: Survival |
|
Chang X, Liu J, Zhao Y, Shi A, Yu H, Yu R, Wang W. Neoadjuvant chemoradiotherapy followed by oesophagectomy may be the optimal treatment option for lower thoracic oesophageal cancer with supraclavicular lymph node metastasis: An inverse probability of treatment-weighted analysis of SEER database. J Med Imaging Radiat Oncol. 2023 Sep;67(6):676-683. doi: 10.1111/1754-9485.13561. Epub 2023 Jul 14. PMID: 37452459. |
Wrong population: Patients with locoregional disease, metastasis or distant metastasis
|
|
Grou-Boileau F, Tankel J, Nevo Y, Najmeh S, Spicer J, Cools-Lartigue J, Mueller C, Ferri L. Locoregional Recurrence of Esophageal Cancer Treated with Curative Intent Local Salvage Therapy: A Single Center Experience. J Gastrointest Cancer. 2023 Dec;54(4):1292-1299. doi: 10.1007/s12029-023-00929-0. Epub 2023 Mar 29. PMID: 36988820. |
Wrong intervention: en bloc esophagectomy |
|
Chen D, Zha X, Ye D, Kang M, Zhu L, Yang M, Chen Y, Zhu K, Xia W, Wang Z, Wang Y. Patterns of care and prognostic evaluation for stage I-III upper esophageal squamous cell carcinoma: a population-based study. Ann Transl Med. 2022 Nov;10(22):1222. doi: 10.21037/atm-22-4577. PMID: 36544690; PMCID: PMC9761128. |
Wrong design: Prognostic models for optimal treatment pattern (chemoradiotherapy, chemoradiotherapy and/or surgery) |
|
Yang Y, Chen M, Xie J, Ji Y, Sheng L, Qiu G, Du X, Wei Q. Treatment Patterns and Outcomes of Elderly Patients With Potentially Curable Esophageal Cancer. Front Oncol. 2022 Feb 14;12:778898. doi: 10.3389/fonc.2022.778898. PMID: 35237508; PMCID: PMC8882918. |
Wrong intervention: Optimal treatment patterns (resection, chemoradiotherapy, radiotherapy, etc) in elderly patients |
|
Gaber CE, Shaheen NJ, Edwards JK, Sandler RS, Nichols HB, Sanoff HK, Lund JL. Trimodality Therapy vs Definitive Chemoradiation in Older Adults With Locally Advanced Esophageal Cancer. JNCI Cancer Spectr. 2022 Nov 1;6(6):pkac069. doi: 10.1093/jncics/pkac069. PMID: 36205723; PMCID: PMC9623425. |
Wrong comparison: Trimodal therapy versus chemoradiation; Wrong outomes: No report of (time to) recurrence |
|
Bakhos CT, Acevedo E Jr, Petrov RV, Abbas AE. Surveillance Following Treatment of Esophageal Cancer. Surg Clin North Am. 2021 Jun;101(3):499-509. doi: 10.1016/j.suc.2021.03.011. PMID: 34048769. |
Narrative review |
|
Mori K, Sugawara K, Aikou S, Yamashita H, Yamashita K, Ogura M, Chin K, Watanabe M, Matsubara H, Toh Y, Kakeji Y, Seto Y. Esophageal cancer patients' survival after complete response to definitive chemoradiotherapy: a retrospective analysis. Esophagus. 2021 Jul;18(3):629-637. doi: 10.1007/s10388-021-00817-1. Epub 2021 Feb 24. PMID: 33625649. |
Wrong population: Also included patients with neoadjuvant chemotherapy
|
|
van der Wilk BJ, Noordman BJ, Neijenhuis LKA, Nieboer D, Nieuwenhuijzen GAP, Sosef MN, van Berge Henegouwen MI, Lagarde SM, Spaander MCW, Valkema R, Biermann K, Wijnhoven BPL, van der Gaast A, van Lanschot JJB, Doukas M, Nikkessen S, Luyer M, Schoon EJ, Roef MJ, van Lijnschoten I, Oostenbrug LE, Riedl RG, Gisbertz SS, Krishnadath KK, Bennink RJ, Meijer SL; Collaborators:. Active Surveillance Versus Immediate Surgery in Clinically Complete Responders After Neoadjuvant Chemoradiotherapy for Esophageal Cancer: A Multicenter Propensity Matched Study. Ann Surg. 2021 Dec 1;274(6):1009-1016. doi: 10.1097/SLA.0000000000003636. PMID: 31592898. |
Wrong comparison: Immediate surgery versus active surveillance |
|
Wang J, Qin J, Jing S, Liu Q, Cheng Y, Wang Y, Cao F. Clinical complete response after chemoradiotherapy for carcinoma of thoracic esophagus: Is esophagectomy always necessary? A systematic review and meta-analysis. Thorac Cancer. 2018 Dec;9(12):1638-1647. doi: 10.1111/1759-7714.12874. Epub 2018 Oct 1. PMID: 30277016; PMCID: PMC6275815. |
Wrong comparison: Surgical versus non-surgical treatment |
|
Schlottmann F, Strassle PD, Gaber C, Patti MG. Stage III esophageal adenocarcinoma: definitive chemoradiation vs. chemoradiation plus surgery. Updates Surg. 2018 Dec;70(4):423-426. doi: 10.1007/s13304-018-0541-5. Epub 2018 Jun 20. PMID: 29926306. |
Wrong comparison: Def. Chemoradiation versus chemoradiation + surgery |
|
Khangura SK, Greenwald BD. Endoscopic management of esophageal cancer after definitive chemoradiotherapy. Dig Dis Sci. 2013 Jun;58(6):1477-85. doi: 10.1007/s10620-012-2554-0. Epub 2013 Jan 17. PMID: 23325163. |
Wrong intervention: Salvage endoscopic therapies
|
|
Taketa T, Correa AM, Suzuki A, Blum MA, Chien P, Lee JH, Welsh J, Lin SH, Maru DM, Erasmus JJ, Bhutani MS, Weston B, Rice DC, Vaporciyan AA, Hofstetter WL, Swisher SG, Ajani JA. Outcome of trimodality-eligible esophagogastric cancer patients who declined surgery after preoperative chemoradiation. Oncology. 2012;83(5):300-4. doi: 10.1159/000341353. Epub 2012 Sep 4. PMID: 22964903; PMCID: PMC3832345. |
Wrong study population: Patients who declined surgery were included |
|
Smith GL, Smith BD, Buchholz TA, Liao Z, Jeter M, Swisher SG, Hofstetter WL, Ajani JA, McAleer MF, Komaki R, Cox JD. Patterns of care and locoregional treatment outcomes in older esophageal cancer patients: The SEER-Medicare Cohort. Int J Radiat Oncol Biol Phys. 2009 Jun 1;74(2):482-9. doi: 10.1016/j.ijrobp.2008.08.046. Epub 2009 Mar 14. PMID: 19289262. |
Wrong comparisons: Different treatments (surgery, radiotherapy, chemotherapy, chemotherapy + surgery) |
|
Aurello P, Berardi G, Moschetta G, Cinquepalmi M, Antolino L, Nigri G, D'Angelo F, Valabrega S, Ramacciato G. Recurrence Following Anastomotic Leakage After Surgery for Carcinoma of the Distal Esophagus and Gastroesophageal Junction: A Systematic Review. Anticancer Res. 2019 Apr;39(4):1651-1660. doi: 10.21873/anticanres.13270. PMID: 30952703. |
Wrong intervention: Surgery; Wrong outcome: Anastomotic leakage |
|
Li F, Ding N, Zhao Y, Yuan L, Mao Y. The current optimal multimodality treatments for oesophageal squamous-cell carcinoma: A systematic review and meta-analysis. Int J Surg. 2018 Dec;60:88-100. doi: 10.1016/j.ijsu.2018.10.037. Epub 2018 Oct 31. PMID: 30389537. |
Wrong comparisons; nCRT + surgery versus dCRT |
|
Mei LX, Mo JX, Chen Y, Dai L, Wang YY, Chen MW. Esophagectomy versus definitive chemoradiotherapy as initial treatment for clinical stage I esophageal cancer: a systematic review and meta-analysis. Dis Esophagus. 2022 Mar 12;35(3):doab049. doi: 10.1093/dote/doab049. PMID: 34318324. |
No outcome data for recurrence rates regarding dCRT |
|
Sun Z, Zheng J, Xu X, Zhao X, Ma X, Ye Q. Comparison of clinical outcomes of conservative treatment and surgery for esophageal cancer patients who achieve a clinical complete response following neoadjuvant chemoradiotherapy: a systematic review and meta-analysis. Ann Transl Med. 2022 Dec;10(24):1378. doi: 10.21037/atm-22-6186. PMID: 36660656; PMCID: PMC9843363. |
No outcome data for recurrence rates regarding CRT only, data comparing CRT + conservative treatment versus CRT + surgery |
|
Vellayappan BA, Soon YY, Ku GY, Leong CN, Lu JJ, Tey JC. Chemoradiotherapy versus chemoradiotherapy plus surgery for esophageal cancer. Cochrane Database Syst Rev. 2017 Aug 22;8(8):CD010511. doi: 10.1002/14651858.CD010511.pub2. PMID: 28829911; PMCID: PMC6483706. |
Wrong outcomes: No recurrence rates |
|
Wang J, Xiao L, Wang S, Pang Q, Wang J. Addition of Induction or Consolidation Chemotherapy in Definitive Concurrent Chemoradiotherapy Versus Concurrent Chemoradiotherapy Alone for Patients With Unresectable Esophageal Cancer: A Systematic Review and Meta-Analysis. Front Oncol. 2021 Sep 13;11:665231. doi: 10.3389/fonc.2021.665231. PMID: 34589418; PMCID: PMC8473880. |
Wrong comparison: Induction chemotherapy versus consolidation chemotherapy; Wrong population: Patients with unresectable esophageal cancer |
|
Mitani S, Kato K, Daiko H, Ito Y, Nozaki I, Kojima T, Yano M, Nakagawa S, Ueno M, Watanabe M, Tsunoda S, Abe T, Kadowaki S, Kadota T, Sasaki K, Machida R, Kitagawa Y. Second primary malignancies in patients with clinical T1bN0 esophageal squamous cell carcinoma after definitive therapies: supplementary analysis of the JCOG trial: JCOG0502. J Gastroenterol. 2022 Jul;57(7):455-463. doi: 10.1007/s00535-022-01870-y. Epub 2022 May 11. PMID: 35546373; PMCID: PMC9232445. |
Wrong outcome: Combined cumulative incidence for second primary malignancies for different treatment types (surgery, chemoradiation)
|
|
van der Bogt RD, van der Wilk BJ, Nikkessen S, Krishnadath KK, Schoon EJ, Oostenbrug LE, Siersema PD, Vleggaar FP, Doukas M, van Lanschot JJB, Spaander MCW. Predictive value of endoscopic esophageal findings for residual esophageal cancer after neoadjuvant chemoradiotherapy. Endoscopy. 2021 Nov;53(11):1098-1104. doi: 10.1055/a-1362-9375. Epub 2021 Mar 2. PMID: 33652496. |
Wrong outcome: Predictive value of endoscopy
|
|
Eyck BM, Onstenk BD, Noordman BJ, Nieboer D, Spaander MCW, Valkema R, Lagarde SM, Wijnhoven BPL, van Lanschot JJB. Accuracy of Detecting Residual Disease After Neoadjuvant Chemoradiotherapy for Esophageal Cancer: A Systematic Review and Meta-analysis. Ann Surg. 2020 Feb;271(2):245-256. doi: 10.1097/SLA.0000000000003397. PMID: 31188203. |
Wrong outcome: Diagnostic accuracy of various modalities for detecting residual disease
|
|
Lim JT, Truong PT, Berthelet E, Pai H, Joe H, Wai E, Larsson S, Kader HA, Weinerman B, Wilson K, Olivotto IA. Endoscopic response predicts for survival and organ preservation after primary chemoradiotherapy for esophageal cancer. Int J Radiat Oncol Biol Phys. 2003 Dec 1;57(5):1328-35. doi: 10.1016/s0360-3016(03)00751-x. PMID: 14630270. |
Wrong comparisons
|
|
Khangura SK, Greenwald BD. Endoscopic management of esophageal cancer after definitive chemoradiotherapy. Dig Dis Sci. 2013 Jun;58(6):1477-85. doi: 10.1007/s10620-012-2554-0. Epub 2013 Jan 17. PMID: 23325163. |
FU strategy after chemoradiation |
|
Shridhar R, Imani-Shikhabadi R, Davis B, Streeter OA, Thomas CR Jr. Curative treatment of esophageal cancer; an evidenced based review. J Gastrointest Cancer. 2013 Dec;44(4):375-84. doi: 10.1007/s12029-013-9511-9. PMID: 23824628. |
Narrative review |
|
Weidenbaum C, Gibson MK. Approach to Localized Squamous Cell Cancer of the Esophagus. Curr Treat Options Oncol. 2022 Oct;23(10):1370-1387. doi: 10.1007/s11864-022-01003-w. Epub 2022 Aug 31. PMID: 36042147; PMCID: PMC9526684. |
Wrong scope: No follow-up or recurrence rates
|
|
Wong R, Malthaner R. Esophageal cancer: a systematic review. Curr Probl Cancer. 2000 Nov-Dec;24(6):297-373. doi: 10.1016/s0147-0272(00)80002-1. PMID: 11198836. |
Narrative review |
|
Zhu W, Xing L, Yue J, Sun X, Sun X, Zhao H, Yu J. Prognostic significance of SUV on PET/CT in patients with localised oesophagogastric junction cancer receiving neoadjuvant chemotherapy/chemoradiation:a systematic review and meta-analysis. Br J Radiol. 2012 Sep;85(1017):e694-701. doi: 10.1259/bjr/29946900. Epub 2012 Feb 14. PMID: 22337686; PMCID: PMC3487087. |
No comparison: Only outcomes regarding FDG-PET |
|
al-Sarraf M, Martz K, Herskovic A, Leichman L, Brindle JS, Vaitkevicius VK, Cooper J, Byhardt R, Davis L, Emami B. Progress report of combined chemoradiotherapy versus radiotherapy alone in patients with esophageal cancer: an intergroup study. J Clin Oncol. 1997 Jan;15(1):277-84. doi: 10.1200/JCO.1997.15.1.277. Erratum in: J Clin Oncol 1997 Feb;15(2):866. PMID: 8996153. |
Wrong comparison: Chemoradiotherapy versus radiotherapy |
|
Burmeister BH, Walpole ET, D'Arcy N, Burmeister EA, Cox S, Thomson DB, Harvey JA, Smithers BM. A phase II trial of chemoradiation therapy with weekly oxaliplatin and protracted infusion of 5-fluorouracil for esophageal cancer. Invest New Drugs. 2009 Jun;27(3):275-9. doi: 10.1007/s10637-008-9178-4. Epub 2008 Oct 8. PMID: 18841327. |
Wrong comparison |
|
Chang H, Shin SK, Cho BC, Lee CG, Kim CB, Kim DJ, Lee JG, Hur J, Lee CY, Bae MK, Kim HR, Lee SK, Park JC, Lee H, Kim HI, Chung H, Cha J, Lee YC, Kim JH. A prospective phase II trial of S-1 and cisplatin-based chemoradiotherapy for locoregionally advanced esophageal cancer. Cancer Chemother Pharmacol. 2014 Apr;73(4):665-71. doi: 10.1007/s00280-013-2371-y. Epub 2014 Feb 22. PMID: 24562525. |
Wrong comparison |
|
Cui J, Zhang D, Gao Y, Duan J, Wang L, Li L, Yuan S. CT-based radiomics combined with hematologic parameters for survival prediction in locally advanced esophageal cancer patients receiving definitive chemoradiotherapy. Insights Imaging. 2024 Mar 25;15(1):87. doi: 10.1186/s13244-024-01647-2. PMID: 38523188; PMCID: PMC10961297. |
Wrong scope: Radiomic and genomics model CT |
|
Cui Y, Li Z, Xiang M, Han D, Yin Y, Ma C. Machine learning models predict overall survival and progression free survival of non-surgical esophageal cancer patients with chemoradiotherapy based on CT image radiomics signatures. Radiat Oncol. 2022 Dec 27;17(1):212. doi: 10.1186/s13014-022-02186-0. PMID: 36575480; PMCID: PMC9795769. |
Wrong scope: Prediction CT image radiomics model |
|
Glasgow RE, Ilson DH, Hayman JA, Gerdes H, Mulcahy MF, Ajani JA. Modern approaches to localized cancer of the esophagus. J Natl Compr Canc Netw. 2011 Aug 1;9(8):902-11. doi: 10.6004/jnccn.2011.0074. PMID: 21900220. |
Narrative review |
|
Teoh AY, Yan Chiu PW, Wong TC, Liu SY, Hung Wong SK, Ng EK. Functional performance and quality of life in patients with squamous esophageal carcinoma receiving surgery or chemoradiation: results from a randomized trial. Ann Surg. 2011 Jan;253(1):1-5. doi: 10.1097/SLA.0b013e3181fcd991. PMID: 21233603. |
Wrong comparison |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-12-2024
Beoordeeld op geldigheid : 01-09-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van het cluster) die betrokken zijn bij de zorg voor patiënten met oesofagus- en maagcarcinoom.
Het cluster oesofagus- en maagcarcinoom bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. Het cluster oesofagus- en maagcarcinoom bestaat uit de volgende personen:
Clusterstuurgroep
- Dhr. Prof. Dr. P.D. (Peter) Siersema (voorzitter), maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
- Mevr. Dr. R.E. (Roos) Pouw, maag-darm-leverarts, Amsterdam UMC, Amsterdam; NVMDL
- Mevr. Dr. A. (Annemarieke) Bartels – Rutten, radioloog, NKI-AVL, Amsterdam; NVvR
- Dhr. Prof. Dr. M.I. (Mark) van Berge Henegouwen, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Dhr. Prof. Dr. R. (Richard) van Hillegersberg, chirurg, UMC Utrecht, Utrecht; NVvH
- Dhr. M.C.C.M. (Maarten) Hulshof MD PhD, Radiotherapeut, Amsterdam UMC, Amsterdam; NVRO (neemt geen deel meer)
- Mevr. Dr. H.W.M. (Hanneke) van Laarhoven, internist, Amsterdam UMC, Amsterdam; NIV
- Mevr. Dr. E.M. (Liesbeth) Timmermans, bestuurslid Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal; SPKS (tot 1 december 2023)
- Dhr. Dr. E. (Erik) Vegt, nucleair geneeskundige, Erasmus MC, Rotterdam; NVNG
Clusterexpertisegroep
- Dhr. Drs. W.W. (Weibel) Braunius, keel-neus-oorarts, UMC Utrecht, Utrecht; NVKNO
- Mevr. Dr. M.J. (Marc) van Det, chirurg, Ziekenhuisgroep Twente; NVvH
- Mevr. Dr. S.S. (Suzanne) Gisbertz, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Mevr. Dr. N.C.T. (Nicole) van Grieken, patholoog, Amsterdam UMC, Amsterdam; NVVP
- Dhr. R. (Ronald) Hoekstra, internist, Ziekenhuisgroep Twente; NIV
- Dhr. R. (Remco) Huiszoon MBA, ervaringsdeskundige en bestuurslid Stichting voor Patiënten met kanker aan het Spijsverteringskanaal excl. darmkanker; SPKS
- Dhr. P.M. (Paul) Jeene MD, radiotherapeut, Radiotherapiegroep; NVRO
- Dhr. Dr. S.M. (Sjoerd) Lagarde, chirurg, Erasmus MC, Rotterdam; NVvH
- Dhr. Dr. R.W.F. (Roelof) van Leeuwen, ziekenhuisapotheker, Erasmus MC, Rotterdam; NVZA
- Dhr. Dr. S.L. (Sybren) Meijer, patholoog, Amsterdam UMC, Amsterdam; NVVP
- Mevr. B. (Bianca) Mostert, internist, Erasmus MC, Rotterdam; NIV
- Mevr. C.T. (Kristel) Muijs MD PhD, radiotherapeut, UMCG, Groningen; NVRO
- Mevr. L. (Luidmila) Peppelenbosch – Kodach, patholoog, NKI-AVL, Amsterdam; NVVP
- Mevr. Drs. H. (Heidi) Rütten, radiotherapeut, Radboud UMC, Nijmegen; NVRO
- Mevr. M. (Marije) Slingerland, internist, LUMC, Leiden; NIV
- Mevr. Prof. Dr. V.M.C.W. (Manon) Spaander, maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
- Mevr. M.E. (Manon) Dik, verpleegkundig specialist, Ziekenhuisgroep Twente; V&VN
- Dhr. C.C.G. (Carlo) Schippers, verpleegkundig specialist, UMC Utrecht, Utrecht; V&VN
Met ondersteuning van:
- Mevr. S.N. (Sarah) van Duijn MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. M. (Miriam) te Lintel Hekkert MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. Dr. C.M.W. (Charlotte) Gaasterland, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Siersema (Voorzitter) |
MDL-arts en Hoofd Endoscopisch Centrum, Radboud University Medical Center
|
Editor in Chief, Endoscopy |
Research funding/advisory board zonder invloed op deze richtlijn |
Geen restrictie |
|
Pouw (tijdelijke voorzitter) |
MDL-arts Amsterdam UMC |
Bestuurslid DUCG - onbetaald. Bestuurslid young ISDE - onbetaald. Bestuurslid Barrett Expertise Centra - onbetaald. Lid beoordelingscommissie ontwikkeling en implementatie KWF - onbetaald. Nationaal afgevaardigde NVMDL voor UEG - onbetaald. Projectleider KWF (PREFER studie). Studie protocol (inclusief inclusie criteria) PREFER studie staat vast. Publicatie resultaten worden pas over vijf jaar verwacht, ruim na datum publicatie richtlijnmodule endoscopische behandeling vroegcarcinoom maag. |
Betaalde deelname aan onderwijscursus georganiseerd door Medtronic Betaald adviseurschap voor Medtronic BV. (scholing en webminar endoscopische behandeling vroege afwijking in slokdarm, geen belang bij gebruik producten) Betaald adviseurschap voor MicroTech Europe (webminar, symposium, m.n. behandeling van lekkages na slokdarmoperaties) |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module;
|
|
Timmermans |
- Bestuurslid SPKS (Stichting voor Patiënten met kanker aan het Spijsverteringskanaal) 5 uur per week - Gedragswetenschappelijk docent huisartsenopleiding Eerstelijnsgeneeskunde Radboudumc |
Onbetaald vrijwilligerswerk Bestuurslid SPKS (15 uur per week) |
Geen |
Neemt geen deel meer aan cluster - Geen restrictie
|
|
Van Laarhoven |
Hoofd afdeling medische oncologie, Amsterdam UMC |
- Wetenschappelijke raad KWF (onbetaald) - Voorzitter ESMO upper GI faculty (onbetaald) - Lid ESMO Leadership Generation programme (onbetaald) - Lid EORTC upper GI strategy commiittee (onbetaald) |
- Consultant or advisory role: Amphera, AstraZeneca, Beigene, BMS, Daiichy-Sankyo, Dragonfly, Eli Lilly, MSD, Nordic Pharma, Servier - Research funding and/or medication supply: Bayer, BMS, Celgene, Janssen, Incyte, Eli Lilly, MSD, Nordic Pharma, Philips, Roche, Servier - Speaker role: Astellas, Benecke, Daiichy-Sankyo, JAAP, Medtalks, Novartis, Travel Congress Management B.V Employment and leadership: Amsterdam UMC, the Netherlands (head of the department of medical oncology) Honorary: ESMO (chair upper GI faculty) |
Geen restrictie |
|
Bartels |
Radioloog, Antoni van Leeuwenhoek |
Geen |
Geen |
Geen restrictie |
|
Van Berge Henegouwen |
Chirurg slokdarm en maagchirurgie Amsterdam UMC Hoogleraar slokdarm en maagchirurgie Universiteit van Amsterdam |
- bestuur DUCA, DICA en voorzitter werkgroep Upper GI (allen onbetaald). |
- Olympus financiering studie (researcher initiated grant) Stryker financiering studie (researcher initiated grant) uitkomsten richtlijn geen invloed op deze bedrijven of studies - Consultancy voor meerdere bedrijven (B. Braun en Viatris) (uitbetaling aan Amsterdam UMC), niet gerelateerd aan richtlijn. |
Geen restrictie |
|
Hulshof |
Radiotherapeut oncoloog Amsterdam UMC |
Geen |
Geen |
Neemt geen deel meer aan cluster - Geen restrictie |
|
Van Hillegersberg |
Chirurg, UMC Utrecht |
Proctor Intuitive Surgical Consultant Medtronic |
- Bestuur DUCA, DICA |
Geen restrictie |
|
Vegt |
Nucleair geneeskundige, Afdeling Radiologie en Nucleaire Geneeskunde, Erasmus MC, Rotterdam |
Geen |
- ZonMW-subsidie voor de PLASTIC-studie, programma doelmatigheid van zorg, naar de kosten-effectiviteit van FDG-PET/CT en laparoscopie bij maagcarcinoom. |
Geen restrictie |
|
Van Rossum |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Huiszoon |
ING Bank N.V. Agile coach expert, full-time |
Buddy voor slokdarmkanker patiënten bij het SPKS, onbetaald. Vanuit persoonlijke ervaring 'klankbord' zijn voor patiënten die nu dezelfde ziekte hebben als ik in 2017 heb gehad |
Neemt deel namens SPKS en hoopt vanuit dat perspectief als ervaringsdeskundige bij te kunnen dragen. Geen boegbeeldfunctie of ander belang |
Geen restrictie |
|
Braunius |
Oncologisch Hoofd-Halschirurg UMC Utrecht Cancer Center |
Geen |
Geen |
Geen restrictie |
|
Van Leeuwen |
Ziekenhuisapotheker - Erasmus MC Afdelingen Apotheek (80%) en Interne Oncologie (20%) |
SIG Oncologie NVZA - onbetaald Werkgroep Geneesmiddel Interacties NVZA/KNMP (betaald "onkosten") Onderwijs PAO Farmacie (betaald "onkosten") |
Industrie: Geneesmiddelen onderzoek i.s.m. Roche, Astellas, BMS, Servier, Boehringer (unrestricted research grants) Fondsen: Stichting Coolsingel, Stichting de Merel, Stichting Mitialto Geen conflict of interest |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; b) Werkgroeplid werkt tenminste samen met een ander werkgroeplid met vergelijkbare expertise in alle fasen (studieselectie, data-extractie, evidence synthese, evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces; c) In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken; d) Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen) |
|
Jeene |
Radiotherapeut - Oncoloog bij Radiotherapiegroep PhD candidate - AmsterdamUMC ( 0 uren aanstelling) |
Bestuurslid DUCG - onbetaald |
Studie coördinator en eerste auteur POLDER trail (effectiviteit kortdurende uitwendige radiotherapie, geen externe financiering). PICO is anders dan studie |
Geen restrictie |
|
Gisbertz |
Slokdarmkanker en maagkanker chirurg - Amsterdam UMC |
Bestuur ESDE, NVGIC, ISDE, research commitee EAES, de Groene OK: allen onbetaald |
Extern gefinancierd onderzoek: KWF: SQA n observational studies (projectleider) CCA: USPIO enhanced MRI in esophageal cancer (projectleider) |
Geen restrictie |
|
Lagarde |
Chirug, Erasmus MC, Rotterdam |
- lid wetenschappelijke commissie DKCA - bestuurslid werkgroep Upper Gi beiden onbetaald |
Geen |
Geen restrictie |
|
Hoekstra |
Internist-oncoloog, Ziekenhuisgroep Twente (ZGT) |
Lid Concillium Medicinae Internae (onbetaald) |
- Als internist-oncoloog betrokken bij inclusie van patiënten in klinische studies bij oesofagus- en maagcarcinoom. Op dit moment Critics-2 studie en Lyrics studie |
Geen restrictie |
|
Van Det |
Gastro-intestinaal chirurg Ziekenhuis groep Twente (ZGT) |
- Proctor/Instructor voor Intuitive Surgical betreffende Robot-Assisted operaties in de upper-GI zoals: - Slokdarm resecties - Maagresecties - Hernia diafragmatica. |
Geen |
Geen restrictie |
|
Rütten |
Radiotherapeut, Radboud UMC |
Geen |
Geen |
Geen restrictie |
|
Van Grieken |
Patholoog, Amsterdam UMC (locatie Vumc), Amsterdam |
Detachering Expertisepanel poliepen BVO-DK, Screeningsorganisatie BVO darmkanker (3 uur/week) |
- KWF - Identificatie van markers voor response op immunotherapie - projectleider - KWF - CRITICS-II klinische trial voor resectabel maagcarcinoom - ZonMW - Effect van chemotherapie bij patienten met microsatelliet instabiel resectabel maagcarcinoom. – projectleider - advisory boards van BMS, MSD |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Mostert |
Internist-oncoloog, Erasmus MC |
Consultancy voor: BMS, Lilly, Servier |
- BMS: fase 2 studie: nivolumab tijdens actieve surveillance slokdarmcarcinoom Sanofi: cabazitaxel bij AR-v7 positieve prostaatcarcinoom patiënten Pfizer: DLA bij mammacarcinoompatiënten behandeld met CDK4/6 De f1/2 studie betreft research support`; investigator initiated studie waarvoor BMS de medicatie “schenkt” Astra zeneca betreft advisory board. |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Slingerland |
Internist-oncoloog LUMC |
Geen |
- Advisory board Lilly, Astra Zeneca en BMS |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Spaander |
MDL-arts 1.0 Fte in Erasmus Universiteit MC (betaald) Voor 6 uur per week gedetacheerd aan de screeningorganisatie voor het BVO darmkanker (betaald) |
Voorzitter NVMDL en NVGE oncologie commissie (onbetaald) |
ZonMW: Gender differencees in Barrett Surveillance, projectleidersrol. Capsulomics: Biomarkers in Barrett slokdarm, projectleidersrol. Lucid: Non-ionvasive tool for Barrett surveillance. Microtech: New Esophageal stent. CELTIC: Blood test bij FIT +patiënten
|
Geen restrictie |
|
Meijer |
Patholoog, Amsterdam UMC |
Geen |
Geen |
Geen restrictie |
|
Peppelenbosch - Kodach |
Patholoog, NKI/AVL |
Geen |
Deelname studie inter-observer variabiliteit voor PD-L1 CPS in maagcarcinomen, gefinancierd door BMS, fee naar de werkgever AVL/NKI |
Geen restrictie |
|
Muijs |
Radiotherapeut-Oncoloog Universitaire Medisch Centrum Groningen |
Lid wetenschapscommissie DUCA (Gemandateerde NVRO) Lid werkgroep indicatie protocol protonen radiotherapie (NVRO) |
Project Leider Models Project (KWf funded): ontwikkelen en valideren predictiemodellen voor complicaties na CRT en resectie Principle investigator CLARIFY studie (KWF funded): Observationeel onderzoek naar pulmonale hupertensie als complicatie na thoracale RT Participatie in PROTECT studie (EU funded): RCT fase 3: fotonen vs protonen bij nCRT voor oesofaguscarcinoom Voortrekker protonen RT bij het oesofaguscarcinoom |
Geen restrictie |
|
Dik |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
|
Schippers |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van de Stichting voor Patiënten met kanker aan het Spijsverteringskanaal (SPKS). De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan SPKS en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
‘Nacontrole na definitieve chemoradiatie’ (oesofaguscarcinoom) |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in juni 2021.
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze module is geprioriteerd door het cluster.
Voor de geprioriteerde modules zijn door het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Het cluster definieerde klinisch (patiënt) relevante verschillen, tenminste voor de cruciale uitkomstmaten.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen.
De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID).
Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Uitgangsvraag 1.1: Wat is de optimale nacontrole voor patiënten met oesofaguscarcinoom na definitieve chemoradiatie? |
|
|
Database(s): Medline, Embase |
Datum: 14 + 27-5-2023 |
|
Periode: >2019 |
|
Zoekverantwoording
|
Database |
Aantallen treffers |
Aantallen treffers na ontdubbelen |
Database aanvulling |
Aantallen treffers |
Aantallen treffers na ontdubbelen |
|
Medline 13 mei 2023 |
820 |
819 |
Medline 27 mei 2023 |
383 |
165 |
|
Embase 14 mei 2023 |
1079 |
423 |
Embase 27 mei 2023 |
486 |
195 |
|
Totaal |
820 |
550 |
|
869 |
360 |
- Aantal SRs: 52; aantal RCT’s: 144, aantal observationele studies: 936, aantal SR’s recurrence rate: 110.
- Aanvulling 27 mei: aantal SRs: 29; aantal RCT’s: 36, aantal observationele studies: 295.
OVID/Medline 13 mei 2023
Ovid MEDLINE(R) ALL <1946 to May 11, 2023>
|
1 |
exp Esophageal Neoplasms/ or ((carcinoma* or neoplas* or adenoma* or adenocarcinoma* or tumor* or tumour* or cancer* or oncolog* or malignan* or carcinogen* or oncogen* or anticarcinogen* or squamous*) adj3 (oesophag* or esophag* or gastroesophag* or gastrooesophag* or oesogastr* or esogastr*)).ti,ab,kf. |
78886 |
|
2 |
exp Chemoradiotherapy/ or (chemoradio* or radiochemo* or chemo-radio* or radio-chemo* or chemoradiati*).mp. [mp=title, book title, abstract, original title, name of substance word, subject heading word, floating sub-heading word, keyword heading word, organism supplementary concept word, protocol supplementary concept word, rare disease supplementary concept word, unique identifier, synonyms, population supplementary concept word, anatomy supplementary concept word] |
51331 |
|
3 |
Survival Rate/ or exp Survival Analysis/ or Survivors/ or Reoperation/ or ((surviv* adj3 (rate or mean or analys* or disease-free or progression-free or event-free or overall)) or survivor* or (surg* adj3 (revis* or repeat*))).ti,ab,kf. |
955206 |
|
4 |
Endoscopy/ or exp Laryngoscopy/ or exp Endoscopy, Gastrointestinal/ or (endoscop* or gastroscop* or laryngoscop* or esophagoscop* or oesophagoscop*).ti,ab,kf. |
334931 |
|
5 |
exp Tomography, X-Ray Computed/ or (computed-tomograph* or ct or cts or cat-scan* or computer-assisted-tomograph* or computerized-tomograph* or computerised-tomograph* or computed-x-ray-tomograph* or computed-xray-tomograph*).ti,ab,kf. |
838842 |
|
6 |
exp Tomography, Emission-Computed/ or (spect or petscan* or pet-scan* or pet or (emission adj3 tomogra*) or radionuclid*).ti,ab,kf. |
239779 |
|
7 |
exp Magnetic Resonance Imaging/ or ((magnetic-resonance adj3 imag*) or mri or mris or nmr or mra or mras or zeugmatograph* or mr-tomograph* or proton-spin or ((magneti* or chemical-shift) adj3 imag*) or fmri or fmris).ti,ab,kf. |
930203 |
|
8 |
4 or 5 or 6 or 7 |
2028680 |
|
9 |
1 and 2 and 3 and 8 |
837 |
|
10 |
9 not ((Adolescent/ or Child/ or Infant/) not Adult/) |
837 |
|
11 |
10 not ((exp animals/ or exp models, animal/) not humans/) |
837 |
|
12 |
11 not (comment/ or editorial/ or letter/ or Case Reports/) |
821 |
|
13 |
(systematic-review.pt. or (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.)) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
633188 |
|
14 |
12 and 13 |
36 |
|
15 |
exp randomized controlled trial/ or random*.ti,ab,kf. or ((pragmatic or practical) adj clinical trial*).ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1551076 |
|
16 |
(12 and 15) not 14 |
91 |
|
17 |
exp Epidemiologic Studies/ or (cohort or (case adj5 (control or controll* or comparison or referent)) or risk or causation or causal or odds-ratio or etiol* or aetiol* or natural-history or predict* or prognos* or outcome or course or retrospect* or followup or follow-up).ti,ab,kf. |
8448338 |
|
18 |
(12 and 17) not (14 or 16) |
640 |
|
19 |
14 or 16 |
127 |
|
20 |
Recurrence/ or (recurrenc* or recrudescenc* or relaps*).ti,ab,kf. |
697437 |
|
21 |
1 and 2 and 13 and 20 |
66 |
|
22 |
21 not (14 or 16 or 18) |
53 |
Embase.com 14 mei 2023
|
No. |
Query |
Results |
|
#27 |
#26 NOT (#15 OR #17 OR #23) |
104 |
|
#26 |
#1 AND #2 AND #14 AND #25 |
125 |
|
#25 |
'tumor recurrence'/exp OR 'cancer recurrence'/de OR 'recurrent disease'/exp OR recurrenc*:ti,ab,kw OR recrudescenc*:ti,ab,kw OR relaps*:ti,ab,kw |
1152822 |
|
#24 |
#23 NOT (#15 OR #17) |
778 |
|
#23 |
#13 AND #22 |
915 |
|
#22 |
'epidemiology'/de OR 'prospective study'/exp OR 'cohort analysis'/exp OR cohort:ti,ab,kw OR ((case NEAR/5 (control OR controll* OR comparison OR referent)):ti,ab,kw) OR risk:ti,ab,kw OR causation:ti,ab,kw OR causal:ti,ab,kw OR 'odds ratio':ti,ab,kw OR etiol*:ti,ab,kw OR aetiol*:ti,ab,kw OR 'natural history':ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw OR outcome:ti,ab,kw OR course:ti,ab,kw OR retrospect*:ti,ab,kw OR 'case control':ti,ab,kw OR 'multivariate':ti,ab,kw OR followup:ti,ab,kw OR 'follow up':ti,ab,kw |
11119520 |
|
#18 |
#17 NOT #15 |
118 |
|
#17 |
#13 AND #16 |
150 |
|
#16 |
'randomized controlled trial'/exp OR random*:ti,ab,kw OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab,kw) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab,kw) |
2045803 |
|
#15 |
#13 AND #14 |
58 |
|
#14 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
705870 |
|
#13 |
#12 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) AND [1999-2023]/py |
1033 |
|
#12 |
#11 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) |
1052 |
|
#11 |
#10 NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1728 |
|
#10 |
#9 NOT (('adolescent'/exp OR 'child'/exp) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp)) |
1731 |
|
#9 |
#1 AND #2 AND #3 AND #8 |
1735 |
|
#8 |
#4 OR #5 OR #6 OR #7 |
2935052 |
|
#7 |
'nuclear magnetic resonance imaging'/exp OR (('magnetic resonance' NEAR/3 imag*):ti,ab,kw) OR mri:ti,ab,kw OR mris:ti,ab,kw OR nmr:ti,ab,kw OR mra:ti,ab,kw OR mras:ti,ab,kw OR zeugmatograph*:ti,ab,kw OR 'mr tomograph*':ti,ab,kw OR 'proton spin':ti,ab,kw OR (((magneti* OR 'chemical shift') NEAR/3 imag*):ti,ab,kw) OR fmri:ti,ab,kw OR fmris:ti,ab,kw |
1519472 |
|
#6 |
'computer assisted emission tomography'/exp OR 'gated single photon emission computed tomography'/exp OR 'single photon emission computer tomography'/exp OR spect:ti,ab,kw OR petscan*:ti,ab,kw OR 'pet scan*':ti,ab,kw OR ((emission NEAR/3 tomograph*):ti,ab,kw) OR radionuclid*:ti,ab,kw |
373318 |
|
#5 |
'x-ray tomography'/exp OR 'computed tomograph*':ti,ab,kw OR ct:ti,ab,kw OR cts:ti,ab,kw OR 'cat scan*':ti,ab,kw OR 'computer assisted tomograph*':ti,ab,kw OR 'computerized tomograph*':ti,ab,kw OR 'computerised tomograph*':ti,ab,kw OR 'computed x ray tomograph*':ti,ab,kw OR 'computed xray tomograph*':ti,ab,kw |
1026673 |
|
#4 |
'endoscopy'/de OR 'digestive tract endoscopy'/de OR 'esophagogastroduodenoscopy'/de OR 'gastrointestinal endoscopy'/de OR 'pharyngoscopy'/de OR 'laryngoscopy'/exp OR endoscop*:ti,ab,kw OR gastroscop*:ti,ab,kw OR laryngoscop*:ti,ab,kw OR esophagoscop*:ti,ab,kw OR oesophagoscop*:ti,ab,kw |
504563 |
|
#3 |
'survival rate'/exp OR 'survival analysis'/exp OR 'survivor'/de OR 'cancer survivor'/de OR 'reoperation'/de OR ((surviv* NEAR/3 (rate OR mean OR analys* OR 'disease free' OR 'progression free' OR 'event free' OR overall)):ti,ab,kw) OR survivor*:ti,ab,kw OR (surg*:ti,ab,kw AND adj3:ti,ab,kw AND (revis*:ti,ab,kw OR repeat*:ti,ab,kw)) |
1148912 |
|
#2 |
'chemoradiotherapy'/de OR chemoradio*:ti,ab,kw OR radiochemo*:ti,ab,kw OR 'chemo radio*':ti,ab,kw OR 'radio chemo*':ti,ab,kw OR chemoradiati*:ti,ab,kw |
102465 |
|
#1 |
'esophagus tumor'/exp OR (((oesophag* OR esophag* OR gastroesophag* OR gastrooesophag* OR oesogastr* OR esogastr*) NEAR/3 (carcinoma* OR neoplas* OR tumour* OR adenoma* OR adenocarcinoma* OR tumor* OR cancer* OR oncolog* OR malignan* OR carcinogen* OR oncogen* OR anticarcinogen* OR squamous*)):ti,ab,kw) |
125442 |
Aanvulling 27 mei met de uitkomsten ‘metastases’ en ‘kwaliteit van leven’
Ovid/Medline 27 mei 2023
Ovid MEDLINE(R) ALL <1946 to May 25, 2023>
|
1 |
exp Esophageal Neoplasms/ or ((carcinoma* or neoplas* or adenoma* or adenocarcinoma* or tumor* or tumour* or cancer* or oncolog* or malignan* or carcinogen* or oncogen* or anticarcinogen* or squamous*) adj3 (oesophag* or esophag* or gastroesophag* or gastrooesophag* or oesogastr* or esogastr*)).ti,ab,kf. |
79060 |
|
2 |
exp Chemoradiotherapy/ or (chemoradio* or radiochemo* or chemo-radio* or radio-chemo* or chemoradiati*).mp. [mp=title, book title, abstract, original title, name of substance word, subject heading word, floating sub-heading word, keyword heading word, organism supplementary concept word, protocol supplementary concept word, rare disease supplementary concept word, unique identifier, synonyms, population supplementary concept word, anatomy supplementary concept word] |
51440 |
|
3 |
exp Neoplasm Metastasis/ or (metasta* or seeding* or micrometasta*).ti,ab,kf. |
716194 |
|
4 |
exp "Quality of Life"/ or (quality-of-life or qoli or qol or qolis or hrqol* or hr-qol* or life-qual*).ti,ab,kf. |
434799 |
|
5 |
3 or 4 |
1135104 |
|
6 |
Endoscopy/ or exp Laryngoscopy/ or exp Endoscopy, Gastrointestinal/ or (endoscop* or gastroscop* or laryngoscop* or esophagoscop* or oesophagoscop*).ti,ab,kf. |
335712 |
|
7 |
exp Tomography, X-Ray Computed/ or (computed-tomograph* or ct or cts or cat-scan* or computer-assisted-tomograph* or computerized-tomograph* or computerised-tomograph* or computed-x-ray-tomograph* or computed-xray-tomograph*).ti,ab,kf. |
840604 |
|
8 |
exp Tomography, Emission-Computed/ or (spect or petscan* or pet-scan* or pet or (emission adj3 tomogra*) or radionuclid*).ti,ab,kf. |
240281 |
|
9 |
exp Magnetic Resonance Imaging/ or ((magnetic-resonance adj3 imag*) or mri or mris or nmr or mra or mras or zeugmatograph* or mr-tomograph* or proton-spin or ((magneti* or chemical-shift) adj3 imag*) or fmri or fmris).ti,ab,kf. |
932004 |
|
10 |
6 or 7 or 8 or 9 |
2032856 |
|
11 |
1 and 2 and 5 and 10 |
688 |
|
12 |
11 not ((Adolescent/ or Child/ or Infant/) not Adult/) |
688 |
|
13 |
12 not ((exp animals/ or exp models, animal/) not humans/) |
688 |
|
14 |
13 not (comment/ or editorial/ or letter/ or Case Reports/) |
507 |
|
15 |
limit 14 to yr="1999 -Current" |
488 |
|
16 |
(systematic-review.pt. or (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.)) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
635721 |
|
17 |
15 and 16 |
23 |
|
18 |
exp randomized controlled trial/ or random*.ti,ab,kf. or ((pragmatic or practical) adj clinical trial*).ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1554523 |
|
19 |
(15 and 18) not 17 |
44 |
|
20 |
exp Epidemiologic Studies/ or (cohort or (case adj5 (control or controll* or comparison or referent)) or risk or causation or causal or odds-ratio or etiol* or aetiol* or natural-history or predict* or prognos* or outcome or course or retrospect* or followup or follow-up).ti,ab,kf. |
8469031 |
|
21 |
(15 and 20) not (17 or 19) |
356 |
Embase.com 27 mei 2023
|
No. |
Query |
Results |
|
#21 |
#15 AND #20 NOT (#17 OR #19) |
636 |
|
#20 |
'epidemiology'/de OR 'prospective study'/exp OR 'cohort analysis'/exp OR cohort:ti,ab,kw OR ((case NEAR/5 (control OR controll* OR comparison OR referent)):ti,ab,kw) OR risk:ti,ab,kw OR causation:ti,ab,kw OR causal:ti,ab,kw OR 'odds ratio':ti,ab,kw OR etiol*:ti,ab,kw OR aetiol*:ti,ab,kw OR 'natural history':ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw OR outcome:ti,ab,kw OR course:ti,ab,kw OR retrospect*:ti,ab,kw OR 'case control':ti,ab,kw OR 'multivariate':ti,ab,kw OR followup:ti,ab,kw OR 'follow up':ti,ab,kw |
11156975 |
|
#19 |
#15 AND #18 NOT #17 |
96 |
|
#18 |
'randomized controlled trial'/exp OR random*:ti,ab,kw OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab,kw) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab,kw) |
2051905 |
|
#17 |
#15 AND #16 |
61 |
|
#16 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
709516 |
|
#15 |
#13 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) AND [1999-2023]/py |
931 |
|
#14 |
#13 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) |
956 |
|
#13 |
#12 NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1960 |
|
#12 |
#11 NOT (('adolescent'/exp OR 'child'/exp) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp)) |
1966 |
|
#11 |
#1 AND #2 AND #5 AND #10 |
1967 |
|
#10 |
#6 OR #7 OR #8 OR #9 |
2946237 |
|
#9 |
'nuclear magnetic resonance imaging'/exp OR (('magnetic resonance' NEAR/3 imag*):ti,ab,kw) OR mri:ti,ab,kw OR mris:ti,ab,kw OR nmr:ti,ab,kw OR mra:ti,ab,kw OR mras:ti,ab,kw OR zeugmatograph*:ti,ab,kw OR 'mr tomograph*':ti,ab,kw OR 'proton spin':ti,ab,kw OR (((magneti* OR 'chemical shift') NEAR/3 imag*):ti,ab,kw) OR fmri:ti,ab,kw OR fmris:ti,ab,kw |
1524676 |
|
#8 |
'computer assisted emission tomography'/exp OR 'gated single photon emission computed tomography'/exp OR 'single photon emission computer tomography'/exp OR spect:ti,ab,kw OR petscan*:ti,ab,kw OR 'pet scan*':ti,ab,kw OR ((emission NEAR/3 tomograph*):ti,ab,kw) OR radionuclid*:ti,ab,kw |
374555 |
|
#7 |
'x-ray tomography'/exp OR 'computed tomograph*':ti,ab,kw OR ct:ti,ab,kw OR cts:ti,ab,kw OR 'cat scan*':ti,ab,kw OR 'computer assisted tomograph*':ti,ab,kw OR 'computerized tomograph*':ti,ab,kw OR 'computerised tomograph*':ti,ab,kw OR 'computed x ray tomograph*':ti,ab,kw OR 'computed xray tomograph*':ti,ab,kw |
1030961 |
|
#6 |
'endoscopy'/de OR 'digestive tract endoscopy'/de OR 'esophagogastroduodenoscopy'/de OR 'gastrointestinal endoscopy'/de OR 'pharyngoscopy'/de OR 'laryngoscopy'/exp OR endoscop*:ti,ab,kw OR gastroscop*:ti,ab,kw OR laryngoscop*:ti,ab,kw OR esophagoscop*:ti,ab,kw OR oesophagoscop*:ti,ab,kw |
507790 |
|
#5 |
#3 OR #4 |
1878971 |
|
#4 |
'quality of life'/exp OR 'quality of life':ti,ab,kw OR qoli:ti,ab,kw OR qol:ti,ab,kw OR qolis:ti,ab,kw OR hrqol*:ti,ab,kw OR 'hr qol*':ti,ab,kw OR 'life qual*':ti,ab,kw |
781281 |
|
#3 |
'metastasis'/exp OR metasta*:ti,ab,kw OR seeding*:ti,ab,kw OR micrometasta*:ti,ab,kw |
1136733 |
|
#2 |
'chemoradiotherapy'/de OR chemoradio*:ti,ab,kw OR radiochemo*:ti,ab,kw OR 'chemo radio*':ti,ab,kw OR 'radio chemo*':ti,ab,kw OR chemoradiati*:ti,ab,kw |
102849 |
|
#1 |
'esophagus tumor'/exp OR (((oesophag* OR esophag* OR gastroesophag* OR gastrooesophag* OR oesogastr* OR esogastr*) NEAR/3 (carcinoma* OR neoplas* OR tumour* OR adenoma* OR adenocarcinoma* OR tumor* OR cancer* OR oncolog* OR malignan* OR carcinogen* OR oncogen* OR anticarcinogen* OR squamous*)):ti,ab,kw) |
125890 |