Hoe worden anti-CD20 monoklonale antilichamen doelmatig voorgeschreven? Hoe wordt orale medicatie doelmatig voorgeschreven?
Uitgangsvraag
Hoe worden anti-CD20 monoklonale antilichamen en orale medicatie doelmatig voorgeschreven?
Aanbeveling
Weeg de volgende criteria bij het maken van een doelmatige en passende keuze bij de behandeling van RRMS:
- Effectiviteit
- Veiligheid
- Patiëntkarakteristieken
- Belasting en voorkeuren patiënt
- Kosten
Anti-CD20 monoklonale antilichamen
Bij het voorschrijven van een anti-CD20 monoklonaal middel is er op basis van doelmatigheid geen groot verschil tussen ofatumumab en ocrelizumab bij RRMS patiënten.
Orale middelen
Overweeg bij voorschrijven van een S1P modulator te kiezen voor ponesimod als meest doelmatig middel vanuit maatschappelijk perspectief bij RRMS patiënten.
Overweeg bij voorschrijven van een orale middelen als eerste lijn te kiezen voor ponesimod als meest doelmatige therapie, en als tweede lijn voor cladribine als meest doelmatige middelen vanuit maatschappelijk perspectief bij RRMS patiënten.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Deze module evalueert de doelmatigheid van ‘anti-CD20 monoklonale antilichamen’ en ‘orale medicatie’ op basis van het ErasmusMC/iMTA MS model. Kosten-effectiviteitsmodellen zijn een middel om de economische consequenties van MS behandelkeuzes te wegen. Het ErasmusMC/iMTA model stelt de werkgroep in staat de kosten-effectiviteit van verschillende behandelstrategieën te modelleren en hiermee tot meer doelmatige keuzes te komen. Zoals ieder model, is dit een kunstmatige weergave van de werkelijkheid. Toekomstige validatie van de bevindingen van het model met observaties uit de klinische praktijk blijft noodzakelijk.
Voor deze deelvraag is geen PICO geformuleerd, geen literatuursearch is uitgevoerd en daarom ook geen GRADE beoordeling uitgevoerd. Omtrent anti-CD20 monoklonale antilichamen in de eerste en tweede lijn, is er geen duidelijk doelmatigheidsverschil gezien tussen ofatumumab en ocrelizumab bij RRMS patiënten vanuit maatschappelijk perspectief. Omtrent S1P modulatoren in de eerste en tweede lijn, is ponesimod het meest doelmatige middel bij RRMS patiënten vanuit maatschappelijk perspectief. In de tweede lijn is cladribine de meest doelmatige orale therapie.
De insteek van de werkgroep is dat deze analyse bijdraagt aan de bewustwording dat iedere therapie die voorgeschreven wordt een klein effect heeft op de totale zorguitgaven binnen Nederland. Met de stijgende zorguitgaven zal een kritische beschouwing van zorguitgaven een essentiële rol gaan spelen om de zorg voor mensen met MS toekomstbestendig, betaalbaar en toegankelijk te houden. Hierbij kunnen er conflicten ontstaan tussen doelmatigheid vanuit ziekenhuis perspectief en vanuit maatschappelijk perspectief. Het is belangrijk om zich bewust te zijn van deze verschillende perspectieven voor voorschrijvers, apothekers, en inkopers.
Beschikbaarheid nieuwe middelen
Met het beschikbaar komen van nieuwe middelen (e.g. generieke middelen, biosimilars, Follow-on non-Biological Complex Drugs; NBCDs) voor de behandeling van MS en het clusteren van preparaten binnen het geneesmiddelenvergoedingssysteem (GVS), heersen er vragen omtrent de inwisselbaarheid van het innovator geneesmiddel en generieke middel, middelen met dezelfde stofnaam, biosimilars of follow-on NBCDs. In lijn met de visie van Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP) en het College ter Beoordeling van Geneesmiddelen (CBG) heeft de werkgroep hieronder zijn standpunt geformuleerd.
Als het patent van de oorspronkelijke specialité verloopt komen er vaak meerdere fabrikanten op de markt die een biosimilar, NBCD of generieke variant van de werkzame stof aanbieden. Door de marktwerking ontstaan er prijsschommelingen waardoor de prijzen kunnen dalen (NOS, 2018; NRC, 2022). In het geval van meerdere aanbieders kan er een keuze worden gemaakt binnen het behandelcentrum (of inkoopgroep) om een bepaalde fabrikant als voorkeursmiddel aan te merken. De werkgroep adviseert om naar de volgende criteria te kijken (dit geldt zowel voor oraal als parenteraal toegediende medicatie):
- Effectiviteit
- Veiligheid
- Patiëntkarakteristieken
- Kosten
- Belasting en voorkeuren patiënt
De voorwaarden die het Europees Medicijn Agentschap (EMA) hanteert voor toelating van een biosimilar op de Europese markt is dat de effectiviteit, veiligheid en kwaliteit van het geneesmiddel gelijk is aan de originator (CBG, 2022). Een biosimilar voldoet daardoor per definitie aan de twee factoren ‘effectiviteit’ en ‘veiligheid’. Om een definitieve keuze te maken voor een switch kan vervolgens gekeken worden naar de kosten en de belasting voor de patiënt.
Gebruik en switchen tussen geneesmiddelen
Switchen naar een generieke variant binnen de klassieke geneesmiddelen wordt algemeen toegepast in de klinische praktijk. De Federatie Medisch Specialisten heeft een standpunt naar buiten gebracht rondom het gebruik en switchen tussen biologische geneesmiddelen (Federatie, 2017). De Federatie hanteert een aantal extra voorwaarden:
- Patiënten die starten met een voor hem/haar nieuw geneesmiddel kunnen zonder meer met een biosimilar worden behandeld.
- Eenmalige wisseling tussen biologische geneesmiddelen is mogelijk, mits de patiënt hierover goed geïnformeerd is en/of er monitoring plaatsvindt.
- Ongecontroleerde en herhaaldelijke uitwisseling tussen biologische geneesmiddelen moet worden vermeden.
Uit een systematische review is gebleken dat een transitie van een originator naar een biosimilar veilig kan worden uitgevoerd (Barbier, 2020). Voorwaarden voor een dergelijke transitie zijn dat de patiënt goed geïnformeerd wordt en dat herhaaldelijke transities kort achter elkaar moeten worden voorkomen om bijvoorbeeld het nocebo-effect te voorkomen (NVZA, 2017).
Ook bij de orale MS-middelen wordt het switchen naar een generieke variant toegepast. De MS-middelen vallen niet onder de handleiding substitutie van de KNMP waar middelen worden genoemd die om verschillende redenen niet gesubstitueerd mogen worden naar een ander merk (KNMP, 2018). Het advies van de werkgroep is: generiek waar het kan.
Bij orale medicatie gaat het veelal om geneesmiddelen die vallen binnen het Geneesmiddelvergoedingssysteem (GVS). De overheid en verzekeraars kunnen in dit geval veel meer eisen stellen aan de vergoeding van het product. Een verzekeraar kan zelf een voorkeursmiddel (merk) aanwijzen indien er een generieke variant op de markt komt. De leverende apotheek moet dit merk dan ook afleveren aan de patiënt. De overheid bepaalt welke geneesmiddelen in aanmerking komen voor vergoeding. Het kan dat er voorwaarden worden gesteld aan een vergoeding. Bijvoorbeeld dat eerst geneesmiddel A moet worden geprobeerd voordat geneesmiddel B mag worden ingezet.
Binnen dezelfde geneesmiddelklasse als dimethylfumaraat is sinds een aantal jaar diroximelfumaraat beschikbaar. Als voordeel zou diroximelfumaraat hebben dat het minder maagdarmklachten geeft. Ervaring van de werkgroep is dat dit niet altijd het geval is. Sinds 2022 zijn er generieke varianten beschikbaar van dimethylfumaraat. Indien het prijsverschil tussen beide middelen significant is, heeft de werkgroep in het kader van doelmatigheid de voorkeur voor dimethylfumaraat. In het geval van bijwerkingen kan daarna gekozen worden voor diroximelfumaraat.
Het introduceren van een andere toedieningsroute bij dezelfde werkzame stof, bijvoorbeeld van intraveneus naar subcutaan, staat niet per definitie gelijk aan dezelfde effectiviteit. Uit onderzoek blijkt bijvoorbeeld dat de therapeutische spiegels bij het subcutaan toedienen van natalizumab lager kunnen uitvallen ten opzichte van de intraveneuze toediening (Toorop, 2023).
Switchen van een intraveneuze toediening naar een subcutane toediening kan impact hebben op processen in het ziekenhuis. Indien de subcutane variant door de patiënt zelf thuis kan worden toegediend heeft dit impact op bijvoorbeeld de bezetting van de dagbehandeling. Indien in overleg met de patiënt wel wordt gekozen voor een switch in toedieningsvorm dient er extra monitoring plaats te vinden op effect en veiligheid.
Een andere mogelijkheid om doelmatig geneesmiddelen in te zetten is het voorkeursmiddel maken van een bepaalde werkzame stof binnen een therapeutische groep van geneesmiddelen (bijvoorbeeld de S1P-modulatoren of anti-CD20 monoklonale antilichamen). Indien de werkzaamheid en veiligheid binnen een dergelijke groep gelijk is kan het kiezen van een voorkeursmiddel bijdragen aan doelmatig geneesmiddelgebruik.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Er is grote variatie in voorkeuren van patiënten betreffende ziektemodulerende middelen. Shared-decision making is dan ook aangewezen. In 2018 is onderzocht welke aspecten belangrijk zijn in de keuze van ziektemodulerende middelen (Kremer, 2018). Hieruit bleek dat het effect op ziekteprogressie, het effect op kwaliteit van leven en het effect op relapse leidend waren in de keuze.
Kosten (middelenbeslag)
Het Erasmus MC/iMTA MS model laat de verschillende opties zien. Op basis van kosten zijn er geen grote verschillen gezien voor de anti-CD20 monoklonale antilichamen.
Factoren die meespelen bij de totale kosten van het inkopen en in gebruik nemen van een geneesmiddel zijn:
- Directe medicijnkosten (direct inkopen bij fabrikant, groothandel of parallelimport)
- Toediening thuis versus toediening in ziekenhuis (kosten BV Nederland vs kosten ziekenhuis)
- Kosten subcutaan toediening versus vs kosten intraveneuze toediening
- Vergoeding vanuit de verzekeraar
In het geval van een GVS-geneesmiddel kan de verzekeraar zelf een voorkeursmiddel aanwijzen voor de patiënt en moet die geleverd worden door de verstrekkende apotheek. Voor add-on geneesmiddelen is dit, op het moment van het verschijnen van de richtlijn, niet het geval. Het staat behandelcentra vrij om eigen afwegingen te maken. De hierboven genoemde factoren zijn te gebruiken als handvat, waarbij het streven wel moet zijn naar het doelmatig inzetten van geneesmiddelen.
Aanvaardbaarheid, haalbaarheid en implementatie
Volgens de werkgroep zijn de aanbevelingen haalbaar en aanvaardbaar voor betrokkenen omdat zij grotendeels aansluiten bij de huidige klinische praktijk. De werkgroep is zich ervan bewust dat deze module grotendeels gebaseerd is op een kosten-effectiviteitsmodel, waarbij aannames noodzakelijk zijn. Mogelijk zullen zorgverleners kunnen twisten over deze aannames en onzekerheden, wat de aanvaardbaarheid kan beperken.
Fingolimod wordt niet vergoed als deze direct als eerste middel bij zeer actieve ziekte worden ingezet. Fingolimod wordt alleen vergoed als eerst een ander middel niet effectief is gebleken. Er zijn andere S1P modulatoren (ozanimod, ponesimod) welke wel direct als eerstelijns therapie ingezet kunnen worden. De werkgroep is van mening dat alle eerste- en tweedelijns middelen direct inzetbaar moeten kunnen zijn bij patiënten met zeer actieve MS.
Bij de plaatsbepaling van ziektemodulerende therapieën met het oog op vergoeding, is ervoor gekozen om S1P modulatoren en anti-CD20 monoklonale antilichamen in verschillende lijnen van therapie in te schalen. Hierbij worden ozanimod en ponesimod als eerstelijns vergoed, en fingolimod als tweedelijns. Ocrelizumab wordt als eerstelijns vergoed als add-on, ofatumumab als tweedelijns via GVS. Gezien de overlappende werkingsmechanismen en veiligheidsprofielen, is de werkgroep van mening dat deze middelen allemaal in dezelfde lijn geplaatst kunnen worden.
Op basis van verzamelde gegevens kan de vraag opkomen waarom er tot nu toe minder bewust op een doelmatige wijze MS ziektemodulerende middelen worden voorgeschreven. De werkgroep denkt dat dit mogelijk komt omdat er tot nu toe niet voldoende een discussie over gevoerd is met hierbij toenemende bewustwording. Tevens spelen waarschijnlijk persoonlijke voorkeuren en ervaring een rol.
Het is van belang om te realiseren dat maatschappelijke belangen niet altijd overeen met de belangen van een ziekenhuis of zorgverlener. De keuze voor de maatschappelijk meest doelmatige optie hoeft niet noodzakelijkerwijs voor het ziekenhuis de meeste doelmatige (onderhandelde) keuze te zijn.
Het meewegen van kosten in beslissingen is een groeiend perspectief in medicamenteuze behandeling. In een Nederlandse studie onder reumatologen werd de keuze voor immuun-suppressieve behandeling bepaald door effectiviteit (44%), gevolgd door kosten (24%) en patiëntvoorkeuren (17%) (Hifinger, 2017). Bij de werkgroep is geen onderzoek bekend naar de invloed van kosten op voorschrijfgedrag van MS behandelaars.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Deze module evalueert de doelmatigheid van ‘anti-CD20 monoklonale antilichamen’ en ‘orale medicatie’ op basis van het ErasmusMC/iMTA MS model. De werkgroep heeft de bevindingen van het model aangevuld met overwegingen.
Onderbouwing
Achtergrond
De afgelopen jaren zijn er steeds meer ziektemodulerende behandelingen voor MS beschikbaar gekomen. Jaarlijks wordt er in Nederland meer dan 200 miljoen euro uitgegeven aan MS medicatie. Uit een Canadese studie blijkt dat medicatiekosten de grootste kostenpost in de behandeling van MS zijn (Khakban, 2022). Zonder maatregelen van de Rijksoverheid zouden de prijzen van medicijnen elk jaar stijgen (Rijksoverheid, 2022). Interventies om te komen tot een meer kosteneffectieve inzet van MS medicatie zijn daarom belangrijk om MS zorg betaalbaar en toekomstbestendig te houden. Deze module richt zich op de doelmatigheid van anti-CD20 monoklonale antilichamen en orale medicatie.
Samenvatting literatuur
Deze samenvatting bestaat uit 3.1 ‘Beschrijving model’, 3.2 ‘Resultaten model: Doelmatigheid van anti-CD20 monoklonale antilichamen’ en 3.3 ‘Resultaten model: Doelmatigheid van orale medicatie’.
3.1 Beschrijving model
3.1.1 Model structuur
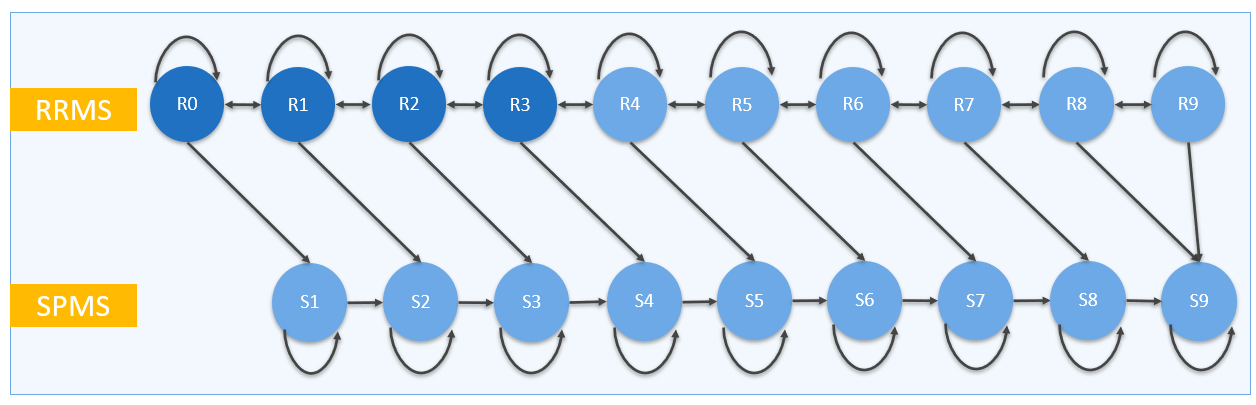
Het ErasmusMC/iMTA MS model simuleert de hele levensduur van een relapsing MS patiënt vanaf het moment van diagnose tot overlijden. Patiënten worden ingedeeld op basis van hun Expanded Disability Status Scale score (EDSS score) en het type MS (RRMS of SPMS) in een zogeheten ‘gezondheidstoestand’. Een gezondheidstoestand vertegenwoordigt een fase van de ziekte met een relatief homogeen klinisch beeld. In iedere gezondheidstoestand heeft de patiënt risico op een relapse, ernstige bijwerking, progressie van de ziekte (EDSS score) of overlijden. In Figuur 1 zijn de verschillende gezondheidstoestanden over de levensduur weergegeven.
De kans op ziekteprogressie is gebaseerd op ‘natural history’ data van de British Columbia MS (BCMS) database (Palace, 2014). De kans op een relapse is gebaseerd op de placebo armen in randomised controlled trials (RCTs) gepubliceerd na 2005 (Huygens, 2021; Corsten, 2023). Deze risico’s kunnen kleiner worden door de effectiviteit van de ziektemodulerende therapieën op basis van gegevens uit een netwerk meta-analyse (NMA) (Corsten, 2023).
3.1.2 Perspectief
De analyses met het ErasmusMC/iMTA MS model die in deze module worden besproken zijn uitgevoerd vanuit een maatschappelijk perspectief. Dit betekent dat eventuele besparingen voor individuele ziekenhuizen door onderhandelde prijzen die lager zijn dan de publieke lijstprijzen (zoals vermeld op Farmacotherapeutisch Kompas) niet meegenomen zijn in het model, omdat deze besparingen niet noodzakelijkerwijs doorvloeien naar de premiebetaler en dus de samenleving. Dit betekent dat er verschillen kunnen zijn tussen een ‘business case’ voor een ziekenhuis en wat het meest doelmatig is voor de gehele samenleving. In sectie 2.1.8 is een nadere toelichting te vinden over de verschillen in financiële vergoedingen tussen intramurale en extramurale ziektemodulerende behandelingen en de invloed die dat heeft op de uitkomsten van het model.
3.1.3 Klinische beslisregels voor switchen in het model
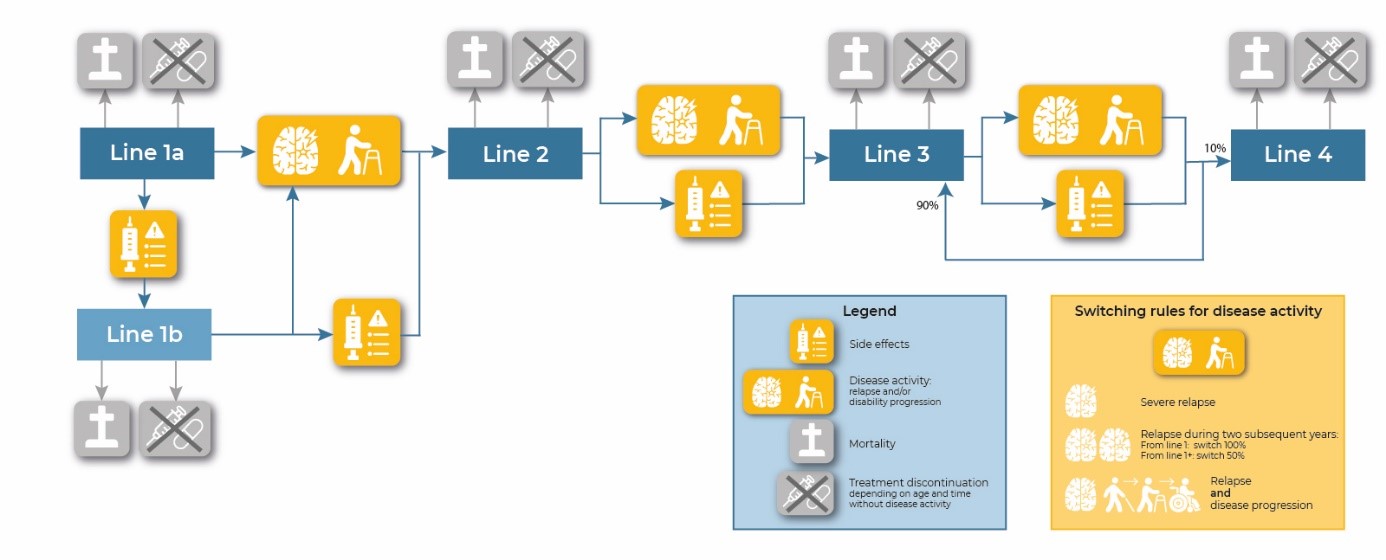
Gebaseerd op de MS richtlijn van de Nederlandse Vereniging voor Neurologie (NVN) uit 2021 zijn klinische beslisregels opgesteld die het switchen tussen ziektemodulerende therapieën in de klinische praktijk zo goed mogelijk weerspiegelen (NVN, 2021). In het model kunnen patiënten switchen wanneer zij bijwerkingen of ziekteactiviteit ervaren. Ziekteactiviteit is hierbij gedefinieerd als: een ernstige relapse (18.7% van de relapses; Nickerson, 2015), zowel een relapse als ziekteprogressie binnen één jaar, een relapse gedurende twee achtereenvolgende jaren op eerstelijnstherapieën en 50% van de patiënten met een relapse gedurende twee achtereenvolgende jaren op tweedelijnstherapieën. In het geval van bijwerkingen op een eerstelijnstherapie (lijn 1a) switchen patiënten eerst naar een andere eerstelijnstherapie (lijn 1b). In geval van ziekteactiviteit switchen patiënten meteen naar een tweedelijnstherapie (lijn 2). Vervolgens kunnen patiënten naar een volgende tweedelijnstherapie (lijn 3) switchen bij bijwerkingen of ziekteactiviteit. Voor patiënten die op lijn 3 bijwerkingen of ziekteactiviteit krijgen is alleen alemtuzumab beschikbaar als ‘last-resort’ behandeling. Echter, wegens de algemene terughoudendheid in het veld om alemtuzumab voor te schrijven is de assumptie gedaan dat slechts 10% van de patiënten die op lijn 3 bijwerkingen of ziekteactiviteit heeft zal switchen naar alemtuzumab (lijn 4). Deze regels zijn schematisch weergeven in Figuur 2.
3.1.4 Geïncludeerde ziektemodulerende therapieën
De volgende ziektemodulerende therapieën waren op het moment van de analyses beschikbaar in Nederland en daarom geïncludeerd in het model: interferon-ß (IFNB), dimethylfumaraat 240 mg (DMF), teriflunomide 14 mg (TER), glatirameeracetaat 20 mg (GLA), ponesimod 20 mg (PON), ozanimod 1 mg (OZA), fingolimod 0.5 mg (FIN), natalizumab 300 mg (NAT), cladribine 3.5 mg/kg (CLA), ocrelizumab 600 mg (OCR), ofatumumab 20 mg (OFA), en alemtuzumab 12 mg (ALE). Glatirameeracetaat 40 mg is niet meegenomen omdat de RCT alleen 12-weken ‘confirmed disease progression’ rapporteerde (Khan, 2013). Daarnaast is siponimod niet meegenomen omdat het niet geregistreerd is voor RRMS. Het doelmatigheidsmodel kan geen uitspraak doen over de verschillen tussen dimethylfumuraat en diroximelfumuraat. Dit is het gevolg van afwezigheid van data. De indeling in lijnen is weergegeven in Tabel 1.
Figuur 1. Schematische weergave van de gezondheidstoestanden.
Figuur 2. Schematische weergave van switchen tussen ziektemodulerende therapieën.
Tabel 1. Indeling ziektemodulerende therapieën in lijnen in het ErasmusMC/iMTA MS model
|
Lijn 1a en b |
Lijn 2 en 3 |
Lijn 4 |
|
interferon-ß (IFNB) |
natalizumab 300 mg (NAT) |
alemtuzumab 12 mg (ALE) |
|
dimethylfumaraat 240 mg (DMF) |
cladribine 3.5 mg/kg (CLA |
|
|
teriflunomide 14 mg (TER) |
ocrelizumab 600 mg (OCR) |
|
|
glatirameeracetaat 20 mg (GLA) |
ofatumumab 20 mg (OFA) |
|
|
ponesimod 20 mg (PON) |
|
|
|
ozanimod 1 mg (OZA) |
|
|
|
fingolimod 0.5 mg (FIN) |
|
|
3.1.5 Kosten
De kosten van de ziektemodulerende therapieën in het ErasmusMC/iMTA MS model zijn gebaseerd op lijstprijzen (1 april 2022): de publieke prijzen zoals bekend op Farmacotherapeutisch Kompas waarin lokale prijsonderhandelingen niet zijn meegenomen (Corsten, 2023). De laagst geprijsde optie is gebruikt (ongeacht of deze generiek of originator is) voor alle ziektemodulerende therapieën.
Naast de kosten van ziektemodulerende therapieën worden ook andere kosten binnen de gezondheidszorg meegenomen, namelijk kosten van: toediening en/of monitoring van ziektemodulerende therapieën, overig zorggebruik gerelateerd aan de EDSS score (inclusief policontroles, diagnostiek, ziekenhuisopnames, overige medicatie, hulpmiddelen en maatschappelijke dienstverlening, zie Tabel 2) (Uitdehaag, 2017), behandeling van een relapse (€1,886) (Uitdehaag, 2017), behandeling van ernstige bijwerkingen (progressieve multifocale leuko-encefalopathie: €36,889 en schildklierproblemen: jaar 1 €811, jaar 2+ €68) en kosten die gepaard gaan met het switchen van een behandeling (extra MRI en polibezoeken, €578) (Corsten, 2023; Huygens, 2021). In Tabel 3 staan de kosten per geneesmiddel, inclusief de gemiddelde toedienings- en monitoringskosten. Naast gezondheidszorg gerelateerde kosten worden ook maatschappelijke kosten buiten de gezondheidszorg (mantelzorg en productiviteitsverliezen) geïncludeerd in het model (Uitdehaag, 2017). De kosten van mantelzorg staan in Tabel 2. De maatschappelijke kosten van productiviteitsverliezen zijn €988 voor tijdelijke afwezigheid door een relapse en €13,977 wanneer een patiënt stopt met werken (Huygens, 2021).
Tabel 2. Maandelijkse kosten van overig zorggebruik en informele zorg voor MS patiënten in Nederland (in €)
|
EDSS score klasse |
Kosten van zorggebruik |
Kosten van informele zorg |
|
EDSS 0-3 |
€4,094 |
€1,009 |
|
EDSS 4-6 |
€8,033 |
€4,580 |
|
EDSS 7-9 |
€10,146 |
€10,349 |
Tabel 3. Jaarlijkse kosten van ziektemodulerende therapieën (inclusief toediening en/of monitoring) voor MS patiënten in Nederland (2022, in €)
|
Ziektemodulerende therapie |
Jaar 1 |
Jaar 2+ |
Ziektemodulerende therapie |
Jaar 1 |
Jaar 2+ |
|
ALE* |
37,204 |
22,322 |
TER |
11,435 |
11,435 |
|
CLA* |
25,890 |
25,890 |
IFNa30 |
8,476 |
8,728 |
|
DMF |
14,026 |
14,162 |
IFNa44 |
9,887 |
10,408 |
|
FIN |
21,086 |
20,591 |
IFNb250 |
7,231 |
7,413 |
|
GLA |
8,784 |
8,784 |
OFA |
23,434 |
20,086 |
|
NAT |
22,386 |
22,386 |
OZA |
14,936 |
15,144 |
|
OCR |
23,922 |
23,427 |
PON |
12,050 |
12,384 |
|
PEG |
11,715 |
11,826 |
RIT |
3,802 |
2,535 |
*Geen geneesmiddelkosten na jaar 2 voor alemtuzumab en cladribine.
3.1.6 Klinische uitkomstmaten en kwaliteit van leven
De effectiviteit van behandelsequenties voor MS patiënten wordt gemeten in het aantal relapses gedurende de levensduur van de patiënt, de tijd tot EDSS score 6 en het aantal voor kwaliteit-gecorrigeerde levensjaren (ofwel quality-adjusted life years, QALYs). De kwaliteit van leven is afhankelijk van de EDSS score (Uitdehaag, 2017) en kan tijdelijk afnemen vanwege een relapse of ernstige bijwerking (PML en schildklierproblemen).
3.1.7 Doelmatigheid
Doelmatigheid van een interventie wordt meestal uitgedrukt in de additionele kosten per gewonnen QALY ten opzichte van een andere interventie (ook wel de incrementele kosten-effectiviteitsratio, IKER, genoemd). Deze uitkomstmaat is echter minder geschikt voor het vergelijken van meer dan twee gezondheidszorginterventies. Daarom worden de doelmatigheidsresultaten van dit model weergegeven in de ‘net health benefit’ (NHB). Deze NHB gebruikt dezelfde gegevens als de IKER, namelijk de totale kosten en QALYs van gezondheidszorginterventies. De formule van de NHB is: totale QALYs – (totale kosten/referentiewaarde). Hierbij worden de totale kosten uitgedrukt in het aantal QALYs dat hiermee tenminste behaald zou moeten worden volgens de referentiewaarde voor kosten per QALY. Deze referentiewaarde is €50,000 per QALY voor MS in Nederland (Huygens, 2021). Hoe hoger de NHB, ‘hoe meer waar voor het geld’ of hoe doelmatiger de behandeling.
3.1.8 Aannames en beperkingen
Zoals iedere modelmatige versimpeling van de werkelijkheid heeft het ErasmusMC/iMTA MS model een aantal beperkingen. Ten eerste zijn de kansen op ziekteprogressie (in termen van verandering in EDSS score) gebaseerd op een verouderde database. De BCMS bestaat uit 7,335 onbehandelde Canadese patiënten (1980-1995) met een mediane follow-up van 6.4 jaar (Palace, 2014). Dit is echter de enige beschikbare databron van voldoende omvang met onbehandelde patiënten, waarin voldoende transities tussen EDSS scores zijn geobserveerd om het verloop van de ziekte zonder behandeling goed in kaart te kunnen brengen. Deze databron wordt in de meeste MS modellen gebruikt (Zimmermann, 2018; Piena, 2021). Epidemiologisch data suggereren de ontwikkeling van MS naar een milder beloop door de tijd, waardoor de toepasbaarheid van deze historische data op actuele patiënten onzeker is (Sorensen, 2020). Mogelijk heeft dit invloed op de absolute resultaten van het model, maar omdat deze data voor alle ziektemodulerende therapieën gebruikt wordt heeft het geen invloed op de relatieve verschillen, en daarmee de rangschikking, tussen medicijnen in het model.
Ten tweede wordt aangenomen dat de relatieve effectiviteit van de ziektemodulerende therapieën (gebaseerd op Corsten, 2023) gelijk is ongeacht in welke lijn ze gegeven worden. RCTs maken namelijk doorgaans geen onderscheid tussen de lijnen. Ook zijn er verschillen tussen designs en de inclusiecriteria van trials waarvan het niet altijd duidelijk is hoe ze invloed hebben op de primaire eindpunten van de studies (Sormani, 2017). Dit maakt de resultaten van de NMA onzeker, maar de onzekerheden zijn niet groot genoeg om geen NMA uit te voeren. Een afname van het effect van eerstelijns therapieën in cohorten met een oudere leeftijd is gerapporteerd (Weideman, 2017). De data hiervoor is echter onzeker en kent methodologische zwakten waardoor er niet goed voor valt te corrigeren.
Ten derde worden de resultaten van relatief kortlopende RCTs geëxtrapoleerd naar een langere behandelduur. We trachten dit te ondervangen door bij de NMA voor ziekteprogressie altijd de 24 i.p.v. 12 weken EDSS progressie meting te gebruiken, maar evengoed wordt in het model de effectiviteit verder doorgetrokken dan 6 maanden op basis van de assumptie van blijvende effectiviteit. Bij relapses blijft de relatieve effectiviteit gelijk na extrapolatie, maar neemt de achtergrondkans op een relapse af met de leeftijd, waardoor ook de absolute kans op een relapse daalt over tijd.
Ten vierde zijn de kosten van ziektemodulerende behandelingen gebaseerd op lijstprijzen. Deze prijzen kunnen veranderen na afloop van patent of door andere omstandigheden zoals prijsonderhandelingen. De lagere prijzen na prijsonderhandelingen zijn niet publiek bekend en daarom niet meegenomen in het model. De gevolgen van prijsonderhandelingen zijn verschillend voor extramurale geneesmiddelen in het geneesmiddelen vergoedingssysteem (GVS, zoals fingolimod) en intramurale geneesmiddelen (add-ons, zoals natalizumab). Voor extramurale geneesmiddelen is het mogelijk dat een individueel ziekenhuis een lagere prijs dan de lijstprijs onderhandelt met een farmaceut. Echter, wanneer het verschil tussen de onderhandelde prijs en de lijstprijs niet ten gunste komt van de premiebetaler, is er vanuit een maatschappelijke doelmatigheidsanalyse geen daadwerkelijk voordeel behaald voor de samenleving. De kosten van de lijstprijs worden dan nog steeds opgebracht door de premiebetaler en het verschil tussen de lijstprijs en de onderhandelde prijs gaan naar een andere partij in de zorg (in dit voorbeeld het ziekenhuis). Daarom is het in het geval van extramurale geneesmiddelen geen beperking dat de lagere onderhandelde prijzen niet meegenomen worden in het doelmatigheidsmodel. Ook voor intramurale geneesmiddelen (add-ons) kan een individueel ziekenhuis een lagere prijs onderhandelen met een farmaceut. De kosten van add-ons worden door de zorgverzekeraar aan het ziekenhuis vergoed. Als de zorgverzekeraar het vermoeden heeft van succesvolle onderhandelingen in het ziekenhuis kunnen zij er voor kiezen om een lager tarief te vergoeden aan het ziekenhuis dan het add-on tarief (= de lijstprijs). In dat geval zijn er mogelijk wel maatschappelijke besparingen die ten gunste komen van de premiebetaler, omdat de lagere kosten van de zorgverzekeraar zich waarschijnlijk wel vertalen in een lagere zorgverzekeringspremie. Helaas is het gezien het geheime karakter van dit soort prijsonderhandelingen niet mogelijk dit mee te nemen in het doelmatigheidsmodel. In het algemeen kan gesteld worden dat de bevindingen uit een doelmatigheidsmodel een momentopname zijn op basis van de publiek bekende lijstprijzen en ziektemodulerende therapieën die op het moment van analyse gelden.
Ten slotte houdt het model geen rekening met patiënt-specifieke factoren (zoals kinderwens, comorbiditeit of toedieningsvorm). Deze zullen in klinische besluitvorming altijd meegewogen worden. Hierbij gaat het model uit van een ‘gemiddelde’ patiënt met aanvalsgewijze MS en actieve ziekte zoals deze in de klinische trials geïncludeerd is, en zullen prognostische factoren die samenhangen met meer/ minder actieve ziekte niet in het model meegewogen worden (Rotstein, 2019).
3.2 Resultaten model: Doelmatigheid van anti-CD20 monoklonale antilichamen
3.2.1 Ofatumumab vs ocrelizumab
Voor de behandeling van RRMS zijn er twee geregistreerde anti-CD20 monoklonale antilichamen (ocrelizumab en ofatumumab). Rituximab wordt ‘off-label’ gebruikt en de registratie van ublituximab wordt verwacht. Hieronder beschrijven we de doelmatigheid van ocrelizumab en ofatumumab.
Uit de NMA blijkt dat de puntschatting van de effectiviteit voor het reduceren van relapses van ofatumumab vs placebo (RR 0.30, 95%CI 0.22 tot 0.42) gunstiger is dan die van ocrelizumab vs placebo (RR 0.4, 95%CI 0.30 tot 0.52) (Corsten, 2023; Smets, 2023). Echter, het relatief risico op ziekteprogressie is gunstiger voor ocrelizumab vs placebo (RR 0.45, 95%CI 0.31 tot 0.61) dan ofatumumab vs placebo (RR 0.55, 95%CI 0.34 tot 0.88) (Corsten, 2023; Smets, 2023).
Relapses hebben door hun beperkte duur en beperkte aantal over de levensduur minder invloed op het totaal aantal voor kwaliteit gecorrigeerde levensjaren (QALYs) dan ziekteprogressie. De puntschatting van het doelmatigheidsmodel toont dat ocrelizumab meer QALYs oplevert dan ofatumumab (Smets, 2023). De totale kosten zijn hoger voor ocrelizumab dan voor ofatumumab en deze patronen herhalen zich voor toediening in de tweede lijn (Tabel 4) (Smets, 2023). Het aantal relapses over de levensduur zal met ocrelizumab als eerstelijnsbehandeling hoger liggen dan met ofatumumab (3.9 vs. 3.5), maar daarentegen is de tijd tot EDSS6 met ocrelizumab langer dan met ofatumumab (26.6 vs. 24.7 jaar) (Smets, 2023). Deze patronen herhalen zich bij voorschrijven in de tweede lijn (Smets, 2023).
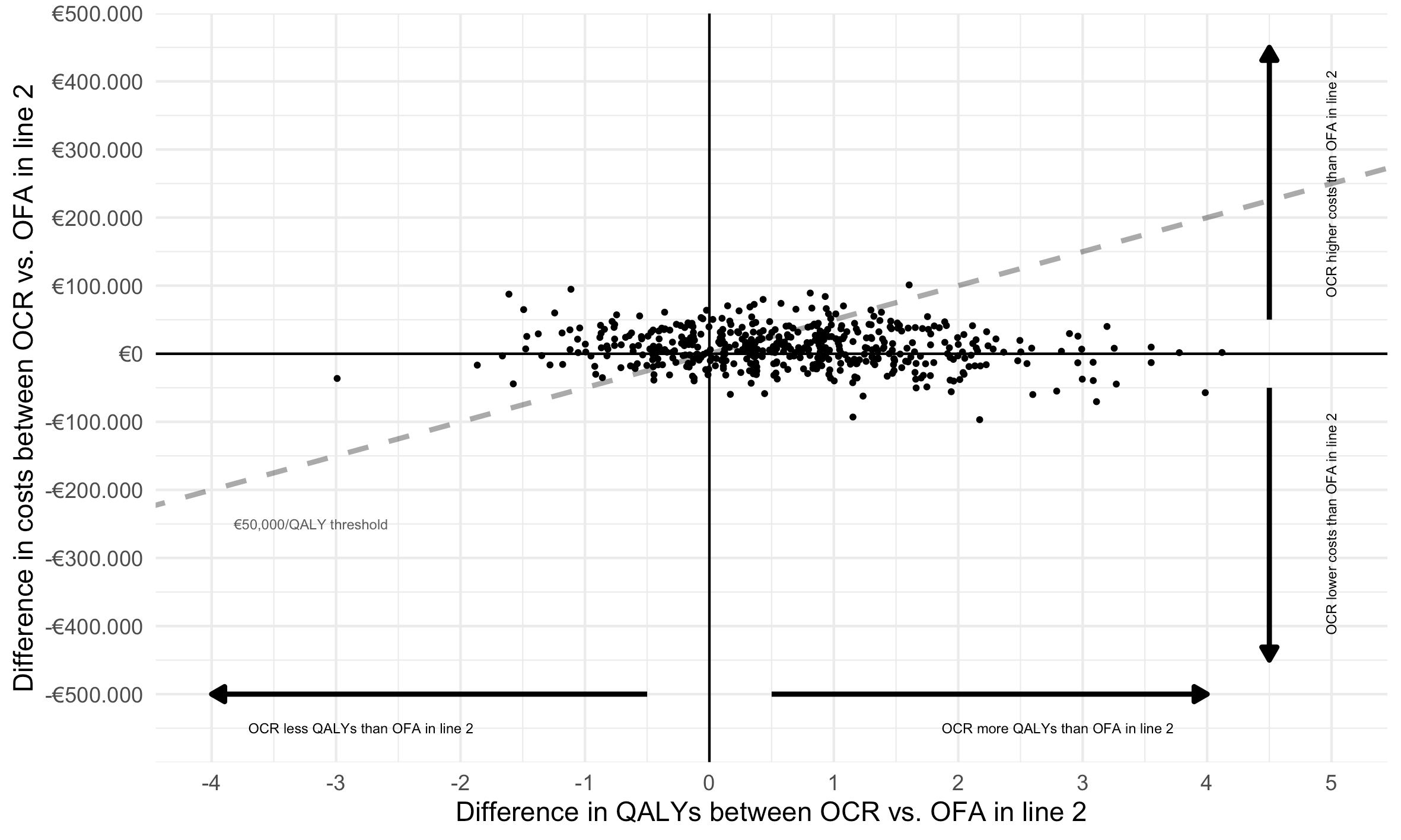
De onzekerheidsanalyse toont aan dat voor gebruik in de eerste en tweede lijn en bij een doelmatigheidsdrempel van €50,000 per QALY, ocrelizumab in respectievelijk 65% en 64% de meest doelmatige keuze is (Smets, 2023). Dat kan worden geïnterpreteerd als een uiterst onzeker voordeel voor ocrelizumab vs ofatumumab in de eerste lijn waar geen sterke conclusies aan verbonden kunnen worden. Figuur 3 toont onzekerheidsanalyse van de tweede lijn, met daarin duidelijk zichtbaar dat de analyses zowel boven (niet doelmatig) als onder (wel doelmatig) de referentielijn vallen.
Tabel 4. Kosten en QALYs door voorschrijven ocrelizumab of ofatumumab in de eerste of tweede lijn.
|
Gecombineerd per DMT |
OCR-CLA-NAT-ALE* |
OFA-CLA-NAT-ALE* |
INFB-GLA-OCR-CLA-ALE* |
INFB-GLA-OFA-CLA-ALE* |
|
Totale kosten (in €) |
494,703 |
482,249 |
454,605 |
445,776 |
|
DMT kosten (in €) |
290,094 |
269,390 |
233,185 |
218,584 |
|
Overige zorgkosten (in €) |
127,820 |
130,581 |
134,985 |
136,814 |
|
Maatschappelijke kosten (in €) |
76,789 |
82,279 |
86,435 |
90,379 |
|
Totale QALYs |
20.4 |
19.7 |
19.3 |
18.7 |
|
NHB |
10.5 |
10.0 |
10.3 |
9.8 |
|
Aantal relapses |
3.9 |
3.5 |
4.7 |
4.3 |
|
Tijd tot EDSS score 6 (in jaren) |
26.6 |
24.7 |
24.1 |
22.6 |
|
Tijd in lijn 1 (in jaren) |
9.9 |
11.1 |
5.5 |
5.5 |
* Behandelsequentie is meeste doelmatige behandelsequentie uit de deterministische analyse. OCR = ocrelizumab, CLA = cladribine, NAT = natalizumab, ALE = alemtuzumab, OFA = ofatumumab, GLA = glatirameracetaat, INFB = interferon-ß.
Figuur 3. Resultaten van onzekerheidsanalyse voor behandelsequenties met ocrelizumab of ofatumumab in de tweede lijn.
De vergeleken sequenties zijn hier interferon-ß (lijn 1)-glatirameeracetaat (lijn 1b)-ocrelizumab/ofatumumab (lijn 2)-cladribine (lijn3) -alemtuzumab (lijn 4). The onderbroken lijn weerspiegelt de kosten per QALY referentiewaarde van €50,000/QALY.
Afkortingen: OCR = ocrelizumab, OFA = ofatumumab, QALY = quality adjusted life year.
3.2.2 Rituximab
Er zijn geen goede gerandomiseerde studies naar de effectiviteit van rituximab op ziekteprogressie bij MS. In de RIFUND-MS trial werd in 3/98 patiënten met rituximab en in 16/97 patiënten in de dimethylfumaraat groep een exacerbatie gezien (Svenningsson, 2022). Er was een achteruitgang in EDSS score in 10/98 patiënten met rituximab en in 5/97 patiënten met dimethylfumaraat. Dit is in contrast met de indirecte vergelijking tussen dimethylfumaraat en ocrelizumab zoals gedaan in de NMA, waarbij de puntschatter voor effect op EDSS progressie superieur is voor ocrelizumab. Hierbij dient opgemerkt te worden dat de OPERA-studie een grotere steekproefgrootte (ocrelizumab n=827, Interferon-ß n=829) en daarmee meer power had om een effect van behandeling op EDSS progressie ten opzichte van interferon-ß aan te tonen (Hauser, 2017), in vergelijking met de RIFUND-MS trial (Svenningsson, 2022). Hetzelfde geldt voor de ASCLEPIOS studies, waarbij het effect op EDSS progressie tussen ofatumumab (n=946) versus teriflunomide (n=936) onderzocht werd (Hauser, 2020). Aangezien effect op EDSS progressie een grote invloed heeft op uiteindelijke kosteneffectiviteit, is het niet mogelijk een doelmatigheidsanalyse uit te voeren voor rituximab met de data van de RIFUND-MS trial. Het model kan echter wel gebruikt worden om te onderzoeken hoe effectief rituximab zou moeten zijn om een even doelmatige (off-label) keuze te zijn als de meest doelmatige sequentie met ocrelizumab in de eerste lijn (ocrelizumab-cladribine-natalizumab-alemtuzumab). Omdat rituximab lager geprijsd is dan ocrelizumab zou rituximab maar een relatief risico vs. placebo op ziekteprogressie van 0.8 hoeven hebben. Beperkte observationele data suggereren in kleine groepen een vergelijkbaar effect van beide middelen op ziekteprogressie in PPMS. Alcalá (2022) rapporteerde na gemiddeld 18 maanden follow-up progressie in 15/49 deelnemers behandeld met rituximab en 11/46 deelnemers behandeld met ocrelizumab.
3.3 Resultaten model: Doelmatigheid van orale medicatie
3.3.1 Doelmatigheid van S1P modulatoren
Voor de behandeling van relapsing remitting MS zijn er drie geregistreerde S1P modulatoren: fingolimod, ozanimod en ponesimod. Uit de NMA blijkt dat de puntschatting van de effectiviteit voor het reduceren van relapses voor fingolimod het meest gunstig is in vergelijking met ozanimod en ponesimod (zie Tabel 5).
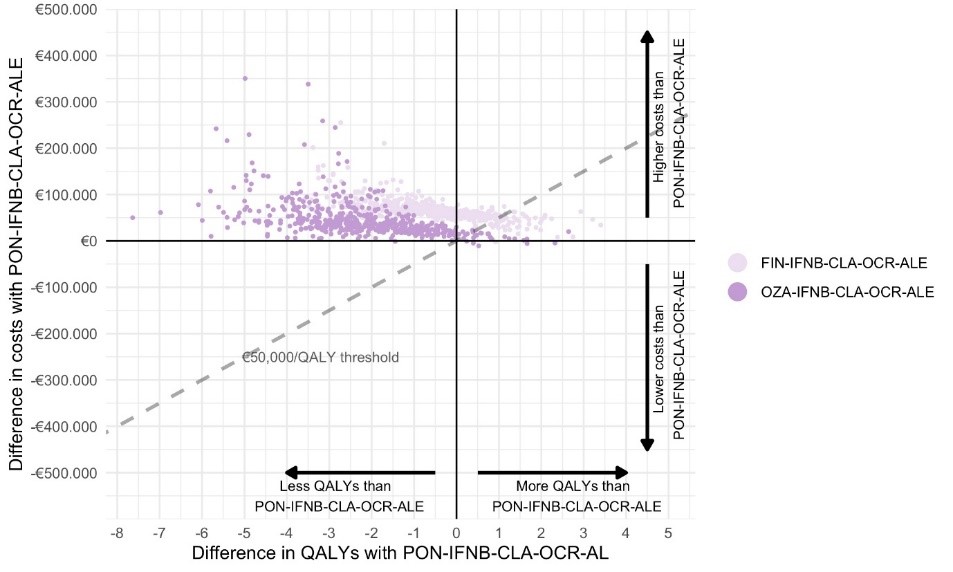
Uit het doelmatigheidsmodel blijkt dat relapses door hun beperkte duur en beperkte aantal over de levensduur minder invloed hebben op het totaal aantal QALYs dan ziekteprogressie. De puntschatting van het doelmatigheidsmodel laat zien dat in zowel de eerste als tweede lijn ponesimod de meeste QALYs oplevert en de laagste kosten heeft ten opzichte van behandelsequenties met ozanimod of fingolimod (zie Tabel 6). Het voorschrijven van ponesimod in de eerste lijn (gemiddelde behandelduur 8.9 jaar) bespaart gemiddeld respectievelijk €62,354 en €43,850 ten opzichte van fingolimod en ozanimod gedurende de levensduur van de patiënt, met in achtneming van zowel geneesmiddelkosten, zorgkosten als maatschappelijke kosten. Deze kostenbesparing wordt vooral verklaard door het vertragen van ziekteprogressie en daarmee gepaard gaande kosten. In de tweede lijn bespaart het voorschrijven van ponesimod respectievelijk €55,798 en €17,472 ten opzichte van fingolimod en ozanimod. In Figuur 4 wordt de onzekerheid rondom de resultaten weergeven. Ondanks de onzekerheid is ponesimod de meest doelmatige S1P modulator in de eerste lijn, omdat meer dan 90% van de puntschattingen onder de referentiewaarde van €50,000 per QALY liggen.
De resultaten van de RCTs voor de S1P-modulatoren over ziekteprogressie zijn onzeker omdat de RCTs hier niet op gepowered zijn, maar op de annualized relapse rate. Om rekening te houden met deze onzekerheid is een sensitiviteitsanalyse gedaan waarbij voor EDSS progressie het gemiddelde van de effectiviteit op ziekteprogressie van fingolimod, ponesimod en ozanimod is toegepast voor alle drie de S1P-modulatoren (met andere woorden, we gaan er van uit dat de S1P modulatoren gelijke effectiviteit hebben wat betreft het afremmen van ziekteprogressie) (Corsten, 2023). De resultaten van deze gevoeligheidsanalyse bevestigen de resultaten uit de oorspronkelijke analyse: ponesimod is nog steeds de meest doelmatige eerste en tweedelijnstherapie in ons model (Corsten, 2023). In tegenstelling tot de eerdere analyse was ozanimod in deze gevoeligheidsanalyse doelmatiger dan fingolimod (Corsten, 2023).
Tabel 5. Resultaten van de netwerk meta-analyse voor S1P-modulatoren (Corsten, 2023)
|
Uitkomstmaat |
Relatief risico (95%BI) |
|
Relapses |
|
|
fingolimod vs. placebo |
0.45 (0.36 tot 0.54) |
|
ozanimod vs. placebo |
0.53 (0.41 tot 0.69) |
|
ponesimod vs. placebo |
0.48 (0.33 tot 0.69) |
|
Ziekteprogressie |
|
|
fingolimod vs. placebo |
0.71 (0.56 tot 0.90) |
|
ozanimod vs. placebo |
0.85 (0.53 tot 1.36) |
|
ponesimod vs. placebo |
0.64 (0.38 tot 1.08) |
Tabel 6. Resultaten van de doelmatigheidsanalyse waarbij behandelsequenties gecombineerd zijn op basis van de S1P modulator in de eerste of tweede lijn gedeeld door het totaal aantal sequenties.
|
|
Eerste lijn |
Tweede lijn |
||||
|
Gecombineerd per DMT |
FIN |
PON |
OZA |
FIN |
PON |
OZA |
|
Totale kosten (in €) |
545,142 |
482,789 |
526,639 |
531,737 |
472,339 |
504,509 |
|
DMT kosten (in €) |
319,199 |
262,862 |
277,424 |
295,403 |
240,347 |
254,283 |
|
Overige zorgkosten (in €) |
136,040 |
133,875 |
144,799 |
140,313 |
138,897 |
145,193 |
|
Maatschappelijke kosten (in €) |
89,904 |
86,051 |
104,416 |
96,020 |
93,096 |
105,034 |
|
Totale QALYs |
18.7 |
19.3 |
16.9 |
18.7 |
19.3 |
16.9 |
|
NHB |
7.8 |
9.6 |
6.4 |
7.2 |
8.9 |
6.3 |
|
Aantal relapses |
3.9 |
4.1 |
3.8 |
3.9 |
4.1 |
3.8 |
|
Tijd tot EDSS score 6 (in jaren) |
22.8 |
24.0 |
19.0 |
22.8 |
24.0 |
19.0 |
|
Tijd in lijn 1 (in jaren) |
10.0 |
8.9 |
8.8 |
NA |
NA |
NA |
Afkortingen: DMT: disease modifying treatment, FIN: fingolimod, PON: ponesimod, OZA: ozanimod, QALY: quality-adjusted life year, NHB: net health benefit, EDSS: Expanded Disability Status Scale, NA: not applicable
Figuur 4. Resultaten van onzekerheidsanalyse voor behandelsequenties die beginnen met fingolimod (FIN-IFNB-CLA-OCR-ALE, lichtpaars) of ozanimod (OZA-IFNB-CLA-OCR-ALE, donker paars) in vergelijking met ponesimod (PON-IFNB-CLA-OCR-ALE). The onderbroken lijn weerspiegelt de kosten per QALY referentiewaarde van €50,000/QALY. (Afkortingen: PON: ponesimod, FIN: fingolimod, OZA: ozanimod, IFNB: interferon-ß, CLA: cladribine, OCR: ocrelizumab, ALE: alemtuzumab)
3.3.2 Doelmatigheid van orale ziektemodulerende therapieën
Orale therapieën kunnen in eerste en latere lijnen worden voorgeschreven, uitgaande van een escalatie strategie. Tot de eerstelijns orale therapieën behoren dimethylfumuraat, teriflunomide, ozanimod, ponesimod en fingolimod. Tot de tweede lijn behoren ozanimod, ponesimod, fingolimod en cladribine. De meest doelmatige eerstelijns orale therapie is ponesimod (Tabel 7). De meest doelmatige tweedelijns orale therapie is cladribine (Tabel 8).
3.3.3 Fumuraat-esters
Het doelmatigheidsmodel kan geen uitspraak doen over de verschillen tussen dimethylfumuraat en diroximelfumuraat. Dit is het gevolg van afwezigheid van data.
Tabel 7. Resultaten van de doelmatigheidsanalyse waarbij behandelsequenties gecombineerd zijn op basis van de orale DMT in de eerste lijn gedeeld door het totaal aantal sequenties.
|
|
Eerste lijn |
||||
|
Gecombineerd per DMT |
FIN |
PON |
OZA |
TER |
DMF |
|
Totale kosten (in €) |
545,142 |
482,789 |
526,639 |
500,174 |
505,079 |
|
DMT kosten (in €) |
319,199 |
262,862 |
277,424 |
267,274 |
277,210 |
|
Overige zorgkosten (in €) |
136,040 |
133,875 |
144,799 |
139,191 |
136,968 |
|
Maatschappelijke kosten (in €) |
89,904 |
86,051 |
104,416 |
93,708 |
90,900 |
|
Totale QALYs |
18.7 |
19.3 |
16.9 |
18.3 |
18.6 |
|
NHB |
7.8 |
9.6 |
6.4 |
8.3 |
8.5 |
|
Aantal relapses |
3.9 |
4.1 |
3.8 |
4.4 |
4.2 |
|
Tijd tot EDSS score 6 (in jaren) |
22.8 |
24.0 |
19.0 |
21.9 |
22.5 |
|
Tijd in lijn 1 (in jaren) |
10.0 |
8.9 |
8.8 |
6.7 |
8.3 |
Afkortingen: DMT: disease modifying treatment, FIN: fingolimod, PON: ponesimod, OZA: ozanimod, TER: teriflunomide, DMF: dimethylfumaraat, QALY: quality-adjusted life year, NHB: net health benefit, EDSS: Expanded Disability Status Scale, NA: not applicable
Tabel 8. Resultaten van de doelmatigheidsanalyse waarbij behandelsequenties gecombineerd zijn op basis van de orale DMT in de tweede lijn gedeeld door het totaal aantal sequenties
|
|
Tweede lijn |
|||
|
Gecombineerd per DMT |
FIN |
PON |
OZA |
CLA |
|
Totale kosten (in €) |
531,737 |
472,339 |
504,509 |
443,292 |
|
DMT kosten (in €) |
295,403 |
240,347 |
254,283 |
212,916 |
|
Overige zorgkosten (in €) |
140,313 |
138,897 |
145,193 |
138,073 |
|
Maatschappelijke kosten (in €) |
96,020 |
93,096 |
105,034 |
92,302 |
|
Totale QALYs |
17.9 |
18.4 |
16.4 |
18.5 |
|
NHB |
7.2 |
8.9 |
6.3 |
9.6 |
|
Aantal relapses |
4.5 |
4.6 |
4.3 |
4.3 |
|
Tijd tot EDSS score 6 (in jaren) |
20.8 |
22.0 |
18.1 |
22.3 |
Afkortingen: DMT: disease modifying treatment, FIN: fingolimod, PON: ponesimod, OZA: ozanimod, CLA: cladribine, QALY: quality-adjusted life year, NHB: net health benefit, EDSS: Expanded Disability Status Scale, NA: not applicable
4. Bewijskracht van de literatuur
Voor deze deelvraag is geen PICO geformuleerd en is geen literatuursearch is uitgevoerd. Daarom is geen GRADE beoordeling uitgevoerd.
5. Conclusies model
Doelmatigheid anti-CD20 monoklonale antilichamen
Eerste in sequentie kosten-effectiviteitsmodel
Er is geen duidelijk doelmatigheidsverschil tussen ofatumumab en ocrelizumab bij RRMS patiënten vanuit maatschappelijk perspectief.
Tweede in sequentie kosten-effectiviteitsmodel
Er is geen duidelijk doelmatigheidsverschil tussen ofatumumab en ocrelizumab bij RRMS patiënten vanuit maatschappelijk perspectief.
Rituximab
Indien uit wetenschappelijke studies blijkt dat rituximab niet inferieur is aan andere ziektemodulerende therapieën wat betreft de risicoreductie op ziekteprogressie is dit het meest doelmatige anti-CD20 monoklonale antilichaam.
Doelmatigheid S1P modulatoren
Eerste lijn
Ponesimod is de meest doelmatige S1P modulator in de eerste lijn bij RRMS patiënten vanuit maatschappelijk perspectief.
Tweede lijn
Ponesimod is de meest doelmatige S1P modulator in de tweede lijn bij RRMS patiënten vanuit maatschappelijk perspectief.
Doelmatigheid orale therapieën
Eerste lijn
Ponesimod is de meest doelmatige orale therapie in de eerste lijn bij RRMS patiënten vanuit maatschappelijk perspectief.
Tweede lijn
Cladribine is de meest doelmatige orale therapie in de tweede lijn bij RRMS patiënten vanuit maatschappelijk perspectief.
Zoeken en selecteren
Bij het beantwoorden van deze deelvraag heeft de werkgroep voornamelijk gebruikt gemaakt van het ErasmusMC/iMTA MS model (Huygens, 2021; Versteegh, 2021; Corsten, 2023). Daarnaast is de uitgangsvraag beantwoord met behulp van 1) eerder geformuleerde standpunten vanuit o.a. de Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP), College ter Beoordeling van Geneesmiddelen (CBG), de Federatie Medisch Specialisten, 2) consensus artikelen, 3) de expertise van de werkgroep die uit verschillende disciplines bestaat, en 4) bestaande lokale afspraken met betrekking tot doelmatigheid.
ErasmusMC/iMTA MS model
In 2020 is door het Institute of Medical Technology Assessment (iMTA) met MS centrum ErasMS van het Erasmus MC het Erasmus MC/iMTA MS model ontwikkeld. Dit is een rekenkundig model dat de doelmatigheid (ofwel kosteneffectiviteit) van sequenties van ziektemodulerende therapieën voor MS in Nederland kan berekenen. Van dit model zijn verschillende wetenschappelijke publicaties verschenen (Huygens, 2021; Versteegh, 2021; Corsten, 2023, Smets, 2023). Dit model is opgesteld conform de nationale richtlijnen voor economische evaluaties (Zorginsitituut, 2016). Hieronder volgt een korte beschrijving van het model. Daarna zullen resultaten van doelmatigheidsberekeningen beschreven worden die kunnen helpen bij het maken van keuzes tussen S1P modulatoren, tussen anti-CD20 monoklonale antilichamen en tussen verschillende orale ziektemodulerende therapieën.
Referenties
- Aalbers, R. & Roos, A.-F. Rapport: Zorguitgaven, ons een zorg? Centraal Planbureau, Den Haag, Oktober 2022. Link: https://www.cpb.nl/sites/default/files/omnidownload/CPB-Publicatie-Zorguitgaven-ons-een-zorg.pdf.
- Alcalá C, Quintanilla-Bordás C, Gascón F, Sempere ÁP, Navarro L, Carcelén-Gadea M, Landete L, Mallada J, Cañizares E, Belenguer A, Carratalá S, Domínguez JA, Pérez-Miralles FC, Gil-Perotín S, Gasqué R, Cubas L, Castillo J, Casanova B. Effectiveness of rituximab vs. ocrelizumab for the treatment of primary progressive multiple sclerosis: a real-world observational study. J Neurol. 2022 Jul;269(7):3676-3681. Doi: 10.1007/s00415-022-10989-0. Epub 2022 Feb 2. PMID: 35107597.
- Barbier L, Ebbers HC, Declerck P, Simoens S, Vulto AG, Huys I. The Efficacy, Safety, and Immunogenicity of Switching Between Reference Biopharmaceuticals and Biosimilars: A Systematic Review. Clin Pharmacol Ther. 2020 Oct;108(4):734-755. Doi: 10.1002/cpt.1836. Epub 2020 Apr 30. PMID: 32236956; PMCID: PMC7540323.
- Biogen Inc, 2021. News: Biogen Provides Regulatory Update on the Supplemental Biologic License Application (sBLA) for Subcutaneous Administration of TYSABRI® (natalizumab). Date: 28 April 2021. Link: https://www.globenewswire.com/news-release/2021/04/28/2219162/0/en/Biogen-Provides-Regulatory-Update-on-the-Supplemental-Biologic-License-Application-sBLA-for-Subcutaneous-Administration-of-TYSABRI-natalizumab.html
- CBG, 2022. College ter Beoordeling van Geneesmiddelen. Biosimilar geneesmiddel. Toegang: 03-11-2022. Link: https://www.cbg-meb.nl/onderwerpen/hv-biosimilar-geneesmiddel
- Corsten CEA, Huygens SA, Versteegh MM, Wokke BHA, Smets I, Smolders J. Benefits of sphingosine-1-phosphate receptor modulators in relapsing MS estimated with a treatment sequence model. Multiple Sclerosis and Related Disorders 2023;80:105100.FMS, 2017. Federatie Medisch Specialisten. Standpunt Biosimilars Federatie Medisch Specialisten. Toegang: 03-11-2022. Link: https://demedischspecialist.nl/sites/default/files/Standpunt%20Biosimilars%20Federatie%20Medisch%20Specialisten.PDF
- Hauser SL, Bar-Or A, Comi G, Giovannoni G, Hartung HP, Hemmer B, Lublin F, Montalban X, Rammohan KW, Selmaj K, Traboulsee A, Wolinsky JS, Arnold DL, Klingelschmitt G, Masterman D, Fontoura P, Belachew S, Chin P, Mairon N, Garren H, Kappos L; OPERA I and OPERA II Clinical Investigators. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. N Engl J Med. 2017 Jan 19;376(3):221-234. Doi: 10.1056/NEJMoa1601277. Epub 2016 Dec 21. PMID: 28002679.
- Hauser SL, Bar-Or A, Cohen JA, Comi G, Correale J, Coyle PK, Cross AH, de Seze J, Leppert D, Montalban X, Selmaj K, Wiendl H, Kerloeguen C, Willi R, Li B, Kakarieka A, Tomic D, Goodyear A, Pingili R, Häring DA, Ramanathan K, Merschhemke M, Kappos L; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. Doi: 10.1056/NEJMoa1917246. PMID: 32757523.
- Hifinger M, Hiligsmann M, Ramiro S, Severens JL, Fautrel B, Watson V, Boonen A. Patients preferences and economic considerations play an important role in treatment decisions: a discrete choice experiment among rheumatologists. Rheumatology (Oxford). 2017 Jan;56(1):68-76. Doi: 10.1093/rheumatology/kew328. Epub 2016 Oct 22. PMID: 28028156.
- Huygens S, Versteegh M. Modeling the Cost-Utility of Treatment Sequences for Multiple Sclerosis. Value Health. 2021 Nov;24(11):1612-1619. Doi: 10.1016/j.jval.2021.05.020. Epub 2021 Aug 11. PMID: 34711361.
- Khakban A, Rodriguez Llorian E, Michaux KD, Patten SB, Traboulsee A, Oh J, Lynd LD; CanProCo Study Group. Direct Health Care Costs Associated With Multiple Sclerosis: A Population-Based Cohort Study in British Columbia, Canada, 2001-2020. Neurology. 2023 Feb 28;100(9):e899-e910. Doi: 10.1212/WNL.0000000000201645. Epub 2022 Nov 30. PMID: 36450607; PMCID: PMC9990437.
- Khan O, Rieckmann P, Boyko A, Selmaj K, Zivadinov R; GALA Study Group. Three times weekly glatiramer acetate in relapsing-remitting multiple sclerosis. Ann Neurol. 2013 Jun;73(6):705-13. Doi: 10.1002/ana.23938. Epub 2013 Jun 28. PMID: 23686821.
- KNMP, 2018. KNMP: Handleiding Geneesmiddelsubstitutie. September 2018. Link: https://www.knmp.nl/sites/default/files/2022-02/Handleiding%20substitutie%202018.pdf
- Kremer IEH, Evers SMAA, Jongen PJ, Hiligsmann M. Comparison of preferences of healthcare professionals and MS patients for attributes of disease-modifying drugs: A best-worst scaling. Health Expect. 2018 Feb;21(1):171-180. Doi: 10.1111/hex.12599. Epub 2017 Jul 21. PMID: 28734004; PMCID: PMC5750752.
- Nickerson M, Cofield SS, Tyry T, Salter AR, Cutter GR, Marrie RA. Impact of multiple sclerosis relapse: The NARCOMS participant perspective. Mult Scler Relat Disord. 2015 May;4(3):234-40. Doi: 10.1016/j.msard.2015.03.005. Epub 2015 Mar 27. PMID: 26008940.
- NRC, 2022. NRS Nieuwsbericht: Nu het octrooi is verlopen, is dit kankermedicijn plots 99 procent goedkoper. 24 maart 2022. Link: https://www.nrc.nl/nieuws/2022/03/24/nu-het-octrooi-is-verlopen-is-dit-kankermedicijn-plots-99-procent-goedkoper-a4104863
- NOS, 2018. NOS Nieuwsbericht: Duur medicijn ineens fors goedkoper: 'goed nieuws' maar ook zorgen. 5 december 2018. Link: https://nos.nl/artikel/2262135-duur-medicijn-ineens-fors-goedkoper-goed-nieuws-maar-ook-zorgen
- NVN, 2021. Nederlandse Vereniging voor Neurologie (NVN) Richtlijn Multiple Sclerose (MS). Beoordeeld: 08-07-2021. Link: https://richtlijnendatabase.nl/richtlijn/multiple_sclerose_ms/startpagina_-_multiple_sclerose_ms.html
- NVZA, 2017. NVZA Toolbox Biosimilars - Een praktische handleiding voor succesvolle implementatie van biosimilars in de medisch specialistische zorg. April 2017. Link: https://www.biosimilars-nederland.nl/wp-content/uploads/2017/04/NVZA-Toolbox-biosimilars_7-april-2017.pdf
- Palace J, Bregenzer T, Tremlett H, Oger J, Zhu F, Boggild M, Duddy M, Dobson C. UK multiple sclerosis risk-sharing scheme: a new natural history dataset and an improved Markov model. BMJ Open. 2014 Jan 17;4(1):e004073. Doi: 10.1136/bmjopen-2013-004073. Erratum in: BMJ Open. 2014;4(1):e004073corr1. Zhu, Fheng [corrected to Zhu, Feng]. PMID: 24441054; PMCID: PMC3902459.
- Piena MA, Kroep S, Simons C, Fenwick E, Harty GT, Wong SL, van Hout BA. An Innovative Approach to Modelling the Optimal Treatment Sequence for Patients with Relapsing-Remitting Multiple Sclerosis: Implementation, Validation, and Impact of the Decision-Making Approach. Adv Ther. 2022 Feb;39(2):892-908. Doi: 10.1007/s12325-021-01975-5. Epub 2021 Nov 18. Erratum in: Adv Ther. 2022 Jan 8;: PMID: 34796464; PMCID: PMC8866358.
- Rijksoverheid, 2022. Medicijnen: Betaalbaar houden van medicijnen. Link: https://www.rijksoverheid.nl/onderwerpen/geneesmiddelen/betaalbaar-houden-van-geneesmiddelen. Geraadpleegd op: 9 december 2022.
- Rotstein, D. & Montalban, X. Reaching an evidence-based prognosis for personalized treatment of multiple sclerosis. Nat. Rev. Neurol. 15, 287-300 (201
- Smets, I., Versteegh, M., Huygens, S., Corsten, C., Wokke, B., & Smolders, J. (2023). Health-economic benefits of anti-CD20 treatments in relapsing multiple sclerosis estimated using a treatment-sequence model. Multiple sclerosis journal - experimental, translational and clinical, 9(3), 20552173231189398. https://doi.org/10.1177/20552173231189398.
- Smolders, J. F. M., Beer, J. J. A., & Frequin, S. T. F. M. (2021). Ziektemodulerende behandeling van mutiple sclerose bij volwassenen: addendum bij de richtlijn multiple sclerose. Tijdschr Neurol Neurochir, 122(1), 17-21.
- Sorensen PS, Sellebjerg F, Hartung HP, Montalban X, Comi G, Tintoré M. The apparently milder course of multiple sclerosis: changes in the diagnostic criteria, therapy and natural history. Brain. 2020 Sep 1;143(9):2637-2652. Doi: 10.1093/brain/awaa145. PMID: 32710096.
- Sormani MP. Indirect comparisons of treatment effects: Network meta-analyses. Mult Scler. 2017 Apr;23(4):510-512. Doi: 10.1177/1352458517690272. Epub 2017 Feb 17. PMID: 28273772.
- Svenningsson A, Frisell T, Burman J, Salzer J, Fink K, Hallberg S, Hambraeus J, Axelsson M, Nimer FA, Sundström P, Gunnarsson M, Johansson R, Mellergård J, Rosenstein I, Ayad A, Sjöblom I, Risedal A, de Flon P, Gilland E, Lindeberg J, Shawket F, Piehl F, Lycke J. Safety and efficacy of rituximab versus dimethyl fumarate in patients with relapsing-remitting multiple sclerosis or clinically isolated syndrome in Sweden: a rater-blinded, phase 3, randomised controlled trial. Lancet Neurol. 2022 Aug;21(8):693-703. Doi: 10.1016/S1474-4422(22)00209-5. PMID: 35841908.
- Toorop AA, van Kempen ZLE, Steenhuis M, Nielsen J, Sinnige LGF, van Dijk G, Roosendaal CM, Arnoldus EPJ, Hoitsma E, Lissenberg-Witte BI, de Jong BA, Oosten BWV, Strijbis EMM, Uitdehaag BMJ, Rispens T, Killestein J; NEXT-MS study group. Decrease of natalizumab drug levels after switching from intravenous to subcutaneous administration in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2023 Jan 13:jnnp-2022-330467. Doi: 10.1136/jnnp-2022-330467. Epub ahead of print. PMID: 36639226.
- Weideman AM, Tapia-Maltos MA, Johnson K, Greenwood M, Bielekova B. Meta-analysis of the Age-Dependent Efficacy of Multiple Sclerosis Treatments. Front Neurol. 2017 Nov 10;8:577. Doi: 10.3389/fneur.2017.00577. PMID: 29176956; PMCID: PMC5686062.
- Uitdehaag B, Kobelt G, Berg J, Capsa D, Dalén J; European Multiple Sclerosis Platform. New insights into the burden and costs of multiple sclerosis in Europe: Results for the Netherlands. Mult Scler. 2017 Aug;23(2_suppl):117-129. Doi: 10.1177/1352458517708663. PMID: 28643595.
- Versteegh MM, Huygens SA, Wokke BWH, Smolders J. Effectiveness and Cost-Effectiveness of 360 Disease-Modifying Treatment Escalation Sequences in Multiple Sclerosis. Value Health. 2022 Jun;25(6):984-991. Doi: 10.1016/j.jval.2021.11.1363. Epub 2021 Dec 15. PMID: 35667786.
- Zimmermann M, Brouwer E, Tice JA, Seidner M, Loos AM, Liu S, Chapman RH, Kumar V, Carlson JJ. Disease-Modifying Therapies for Relapsing-Remitting and Primary Progressive Multiple Sclerosis: A Cost-Utility Analysis. CNS Drugs. 2018 Dec;32(12):1145-1157. Doi: 10.1007/s40263-018-0566-9. PMID: 30141001.
- Zorginstituut Nederland, 2016. Richtlijn voor het uitvoeren van economische evaluaties in de gezondheidszorg. Februari, 2016.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-12-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de modules voor het addendum is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de indicatiestelling en monitoring van ziektemodulerende therapie bij mensen met MS (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Mevr. dr. B.A. de Jong, neuroloog, NVN (voorzitter)
- Mevr. B. Bakker, patiëntvertegenwoordiger, MS-patiënten Vereniging Nederland
- Dhr. drs. R. Haenen, revalidatiearts, VRA
- Mevr. K. Harrison, verpleegkundig specialist, V&VN
- Dhr. drs. B.J.A. van Hoeve, neuroloog, NVN
- Mevr. dr. E. Hoitsma, neuroloog, NVN
- Dhr. prof. dr. J. Killestein, neuroloog, NVN
- Dhr. drs. J.B. Masselink, ziekenhuisapotheker, NVZA
- Dhr. dr. B. Moraal, radioloog, NVVR
- Dhr. dr. J. Mostert, neuroloog, NVN
- Dhr. dr. J. Murk, arts-microbioloog, NVMM
- Mevr. M. Pippel, patiëntvertegenwoordiger, MS-patiënten Vereniging Nederland
- Dhr. dr. J. Smolders, neuroloog, NVN
- Dhr. dr. M.T. Wijburg, AIOS neurologie, NVN
- Mevr. Dr. A. Coumans, Gynaecoloog, NVOG
Met dank aan:
- Dhr. Dr. Ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog
- Mevr. dr. S. Huygens, gezondheidseconoom, Huygensandversteegh.com
- Dhr. dr. M. Versteegh, gezondheidseconoom, Huygensandversteegh.com
Met ondersteuning van:
- Mevr. dr. C.T.J. Michels, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Gemelde belangen |
BelandenCie |
|
Bakker |
MS Patiënt vertegenwoordiger MSVN |
Functionel tester software Thunderbyte AI |
geen |
Geen restrictie |
|
Coumans |
Gynaecoloog |
Geen |
geen |
Geen restrictie |
|
De Jong (voorzitter) |
Functie: neuroloog |
Voorzitter commissie Addendum MS richtlijn van NVN (onbetaald). Voorzitter commissie MS registratie van NVN (onbetaald). Lid van wetenschappelijk adviesraad van Prinses Beatrixfonds (onbetaald) Lid van het PROMS initiative, onderdeel van Global MSIF Movement (onbetaald) |
MS Centrum Amsterdam, Amsterdam UMC, locatie VUmc ontvangt financiële ondersteuning van: Bayer AG, Biogen, Roche, GlaxoSmithKline, Merck, Celgene BMS, Sanofi Genzyme, Novartis, TEVA, Stichting MS Research, NWO, ZonMw, Hersenstichting, Nationaal MS Fonds, Zorgverzekeraars Nederland (ZN) en Health~Holland (TKI*).
*TKI: Dit is een studie gesponsord door Sanofi, het gaat om een Bruton’s tyrosine kinase inhibitor: tolebrutinib (komt niet voor in richtlijn).
Dit zijn deels wel en niet persoonsgebonden subsidies (= deels contractonderzoek). Subsidies van instanties zoals MS research, ZonMw, hersenstichting zijn allemaal persoonsgebonden maar hierbij ik ben hierbij geen PI. Ik ben wel PI bij: - subsidie van ZN om onderzoek te doen met de landelijke MS registratie. - fase IV studie waarbij observationeel de kwaliteit en veiligheid van alemtuzumab (Sanofi Genzyme) gemonitord wordt (zit niet in adviesraad, krijg er geen geld voor). Studie gaat over post-surveillance en houdt geen relatie met indicatiestelling. - fase III studie naar tyrosine kinase inhibitors bij MS (dit middel staat niet in de richtlijn en komt naar verwachting niet op korte termijn op de markt).
Ontvangen onderzoekssubsidie van MS Vereniging Nederland in 2022: “Prevalentie van MS in Nederland” met een bedrag €60.167 Ontvangen onderzoekssubsidie van Stichting MS Research in 2016: "Improving cognitieve functioning among patients with multiple sclerosis by cognitive rehabilitation therapy or mindfulness based cognitive therapy: a dual-center, investigator-blinded, parallel group randomized controlled trial" met een bedrag van € 250.000.
|
Restrictie als TKIs ter sprake komt in een module. |
|
Haenen |
Functie: revalidatiearts |
Geen |
Geen |
Geen restrictie. |
|
Harrisson |
Functie: Verpleegkundig Specialist Werkgever: Tergooi ziekenhuis |
Richtlijn Revalidatie bij MS, vergoeding van gemaakte uren. |
Geen |
Geen restrictie. |
|
Hoitsma |
Functie: neuroloog |
Voorzitter landelijke MS werkgroep (onbetaald). |
Lokale onderzoeker bij (geen PI over gehele studies):
Betreft bij allen betaling onderzoeksactiviteiten. |
Geen restrictie. |
|
Killestein |
Functie: neuroloog (hoogleraar MS) |
Adviseur Springer Healthcare - Mednet Neurologie (betaald). Hoofdredacteur Tijdschrift voor Neurologie en Neurochirurgie (TNN), tot februari 2021, (betaald).
Voorzitter Horizonscan geneesmiddelen Zorginstituut Nederland. Werkgroep Neurologische aandoeningen inclusief gedrag (onbetaald). Lid Wetenschappelijke Adviesraad Stichting MS Research (onbetaald). Lid editorial board Neurology (onbetaald). Lid editorial board MS Journal (onbetaald).
|
MS Centrum Amsterdam, Amsterdam UMC, locatie VUmc ontvangt financiële ondersteuning van: Bayer AG, Biogen, Roche, GlaxoSmithKline, Merck, Celgene BMS, Sanofi Genzyme, Novartis, TEVA, Immunic Therapeutics, Stichting MS Research, NWO, ZonMw, Hersenstichting, Nationaal MS Fonds, Zorgverzekeraars Nederland (ZN) en Health~Holland (TKI)
1. Principle investigator NEXT-MS -natalizumab extended dosing bij MS -NCT04225312. Sponsor: Hersenstichting en Stichting MS Research. 2. Principle investigator DOT-MS - discontinuation of therapy in MS, NCT04260711- Sponsor: ZonMW en Stichting MS research 3. Principle investigator BLOOMS trial: efficacy, safety and cost-effectiveness of B cell tailored ocrelizumab versus standard ocrelizumab in RRMS - Sponsor: ZonMW en Treatmeds, moet nog starten. 4. Principle investigator Apps-MS studie - Sponsor: Stichting MS-Research en Health~Holland TKI. 5. Principle investigator Blood platelet-based liquid biopsies for optimization of diagnosis and treatment of patients with multiple sclerosis - Sponsor Merck. à Merck maakt medicatie die gebruikt wordt bij MS, Rebif en Mavencla. Betrfet onderzoek m.b.t. diagnostische biomarker (wel/geen MS). Geen enkele bemoeienis van Merck met de inhoud. 6. Deelname RELAMS - onderzoek naar relapses en pseudorelapses bij MS. 7. Deelname RAM-MS trial: Randomized Autologous heMatopoietic stem cell transplantation versus alemtuzumab, cladribine or ocrelizumab for patients with RRMS. EudraCT Number: 2017-001362-25 Sponsor: Stichting MS Research en Nationaal MS fonds. 8. Lid Steering Committee Ensemble trial Roche, vergoeding naar VUmc. 9. Lid Steering Committee Liberto trial Roche, vergoeding naar VUmc. 10. Lid Steering Committee NOVA trial Biogen, vergoeding naar VUmc. 11. Lid Adjudication Committee Immunic Calliper Phase II trial, vergoeding naar VUmc |
Geen restrictie. |
|
Masselink |
Functie: ziekenhuisapotheker Werkgever: Medisch Spectrum Twente |
Lid werkgroep neurologische aandoeningen (incl. gedrag) Horizonscan Geneesmiddelen, |
Geen |
Geen restrictie. |
|
Mostert |
Functie: neuroloog |
Lid hoofdredactieraad Tijdschrift voor Neurologie en Neurochirurgie (onbetaald).
Tot mei 2021: 1.5 jaar voorzitter en daarvoor 2 jaar secretaris van de landelijke MS werkgroep (onbetaald). |
Lokale onderzoeker bij (geen PI over gehele studies):
De financiering op contractbasis (per verrichting vergoeding). |
Bij wijzigingen, graag contact opnemen met belangencie (n.a.v. non-inferiority study) |
|
Murk |
Functie: arts-microbioloog Werkgever: Elisabeth-Tweesteden ziekenhuis Tilburg |
Redactielid tijdschrift infectieziekten (onbetaald)
Sectielid infectieziektenserologie SKML, coördinator rondzending H. pylori serologie (Nederlandse organisatie die externe kwaliteitsrondzendingen voor laboratoria organiseert) (onbetaald)
|
Ik werk als arts-microbioloog in vrije vestiging. Het verrichten van laboratoriumdiagnostiek is een onderdeel van de werkzaamheden waardoor een vrijgevestigde arts-microbioloog gefinancierd wordt. |
Geen restrictie. |
|
Pippel |
Functie: Gemeentesecretaris Werkgever: Gemeente Zandvoort |
Lid Adviesplatform MS vereniging |
Geen |
Geen restrictie. |
|
Smolders |
Neuroloog, 0.8 FTE afdeling Neurologie, Erasmus Medisch Centrum Rotterdam |
Bestuurslid MS werkgroep (onbetaald).
Kosteneffectiviteitsonderzoek MS in samenwerking met het bedrijf Huygens & Versteegh |
Onderzoek wordt gefinancierd door de MS research stichting (Voorschoten), het Nationaal MS fonds (Rotterdam) en de Erasmus Foundation (Rotterdam) Van de collectebusfondsen-studies ben ik PI. De bedrijven betreft onderzoeksprojecten met het centrum, waarbij ik niet als PI fungeer. Onderzoeksprojecten binnen MS centrum ErasMS worden gefinancierd door Merck (BTK inhibitor), Idorsia (preklinisch onderzoek compound), GSK (preklinisch onderzoek compound) en Roche (federated learning project).
In verleden:
|
Geen restrictie. |
|
Van Hoeve |
Functie: neuroloog Werkgever: ZorgSaam Zeeuws-Vlaanderen, Terneuzen |
Lid van MS zorg Zuid Zuid West, regionaal samenwerkingsverband tussen neurologen uit verschillende ziekenhuis, met MS als aandachtsgebied (onbetaald). |
April 2023: Binnenkort deelnemend centrum aan SPIN-P studie (gericht op o.a. etiologische/ prognostische factoren m.b.t. primair progressieve MS). Deelname Ectrims congres (oktober 2023) op uitnodiging Merck |
Geen restrictie. |
|
Wijburg |
Functie: AIOS Neurologie, Werkgever: Amsterdam UMC |
Geen |
Geen |
Geen restrictie.
|
|
Huygens (extern adviseur) |
Eigenaar Huygens & Versteegh B.V. |
Tijdelijk senior adviseur ziektemodellen Zorginstituut Nederland (betaald) |
Het ErasmuMC/iMTA MS model is ontwikkeld door Simone Huygens & Matthijs Versteegh met een onderzoeksgrant van ErasmusMC tijdens hun dienstverband bij iMTA Erasmus Universiteit Rotterdam. In hun Huygens & Versteegh B.V. maken zij melding van vergoedingen door IQVIA (niet MS gerelateerd), Beigene (niet MS gerelateerd), Optimax (niet MS gerelateerd), ErasmusMC (niet MS gerelateerd), ICER-US (MS gerelateerd, onafhankelijk expert advies of ICER-US rapport kosteneffectiviteit MS geneesmiddelen), EuroQoL (niet MS gerelateerd), iMTA (niet MS gerelateerd), Takeda (niet MS gerelateerd), Chiesi (niet MS gerelateerd) en Merck KGgA (MS gerelateerd, niet gerelateerd aan geneesmiddelen opgenomen in de richtlijn of het model (nieuwe moleculaire entiteit)). De werkzaamheden voor de richtlijn met het ErasmusMC/iMTA model zijn onbezoldigd uitgevoerd. |
Geen restrictie.
|
|
Versteegh (extern adviseur) |
Eigenaar Huygens & Versteegh B.V. |
Tijdelijk senior adviseur ziektemodellen Zorginstituut Nederland (betaald) Editorial board member Medical Decision Making (onbetaald) Lid EuroQoL research foundation (onbetaald maar met vergoeding reiskosten en congresbezoek) Columnist NTvG (onbetaald) |
Het ErasmuMC/iMTA MS model is ontwikkeld door Simone Huygens & Matthijs Versteegh met een onderzoeksgrant van ErasmusMC tijdens hun dienstverband bij iMTA Erasmus Universiteit Rotterdam. In hun Huygens & Versteegh B.V. maken zij melding van vergoedingen door IQVIA (niet MS gerelateerd), Beigene (niet MS gerelateerd), Optimax (niet MS gerelateerd), ErasmusMC (niet MS gerelateerd), ICER-US (MS gerelateerd, onafhankelijk expert advies of ICER-US rapport kosteneffectiviteit MS geneesmiddelen), EuroQoL (niet MS gerelateerd), iMTA (niet MS gerelateerd), Takeda (niet MS gerelateerd), Chiesi (niet MS gerelateerd) en Merck KGgA (MS gerelateerd, niet gerelateerd aan geneesmiddelen opgenomen in de richtlijn of het model (nieuwe moleculaire entiteit)). De werkzaamheden voor de richtlijn met het ErasmusMC/iMTA model zijn onbezoldigd uitgevoerd. |
Geen restrictie.
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de MS-patiënten Vereniging Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Patiënten werden tevens in de werkgroep vertegenwoordigd door twee afgevaardigden van de MS-patiënten Vereniging Nederland. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en MS-patiënten Vereniging Nederland. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met MS. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (NVN, 2012; NVN, 2020) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen via een schriftelijke knelpunteninventarisatie. Een rapportage hiervan kan worden aangevraagd via de Richtlijnendatabase. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.