Atypische melanocytaire laesies (MELTUMPS/STUMPS)
Uitgangsvraag
Wat zijn de adviezen ten aanzien van de diagnostische procedure bij een klinisch en/of histologisch atypische melanocytaire laesie?
Wat zijn de adviezen ten aanzien van het klinisch beleid bij een atypische melanocytaire laesie?
Aanbeveling
- Een verdachte klinisch atypische melanocytaire laesie dient verwijderd te worden middels een diagnostische excisie met 2 mm klinische marge.
- Er wordt geadviseerd om een tweede beoordeling van een meer ervaren collega patholoog van de eigen praktijk te vragen bij twijfel over een histologisch atypische melanocytaire laesie.
- Er wordt geadviseerd om een extern consult aan te vragen of de casus in te brengen in een melanoompanel indien binnen de eigen praktijk geen consensus wordt bereikt dan wel de diagnose onzeker blijft.
- Aanvullend immunohistochemisch onderzoek eventueel gevolgd door moleculaire diagnostiek is geïndiceerd indien middels histologisch onderzoek een melanoom niet kan worden uitgesloten.
- Gebruik voor de classificatie van melanocytaire tumoren de meest recente WHO-classificatie (WHO Classification of Tumours Online, 2025).
- De maligne potentie van atypische melanocytaire laesies is onbekend en evidence-based richtlijnen voor de meest geëigende resectiemarges en follow-up ontbreken op dit moment.
- Bij laaggradige melanocytomen en bij dysplastische naevi met hooggradige dysplasie adviseert de werkgroep een radicale excisie (> 1 mm histologische marge).Bij een incomplete of twijfelachtige excisie wordt een re-excisie met een marge van 2 mm aanbevolen.
- Bij hooggradige laesies en atypische niet zeker te classificeren melanocytaire laesies (SAMPUS, MELTUMP, STUMP) adviseert de werkgroep een klinische marge van 5 mm. Bij re-excisie is het advies deze marge in de diepte ook te bereiken, tenzij er een andere anatomische grens is zoals de spierfascie.
- Bij hooggradige en diep in de huid uitbreidend atypische melanocytaire laesies, met hoge verdenking op een melanoom, kan overwogen worden om klinische follow-up zoals voor melanoom gebruikelijk is aan te houden.
- Bij een histologisch atypische melanocytaire laesie waarbij de diagnose van melanoom niet zeker kan worden gesteld wordt geadviseerd om af te zien van een schildwachtklierprocedure.
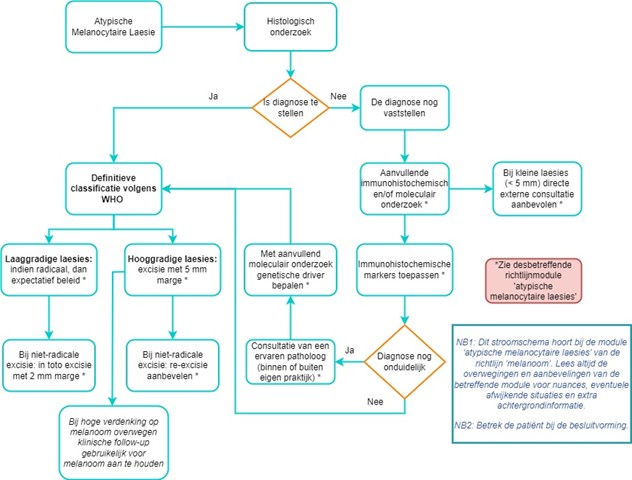
- Zie ook het stroomdiagram van diagnostiek naar behandeling.
Overwegingen
Kwaliteit van het bewijs
Voor deze vraag is niet naar wetenschappelijke literatuur gezocht.
Binnen de GRADE-methodiek is het systematisch literatuuronderzoek gebaseerd op
vergelijkend onderzoek, veelal gerandomiseerd onderzoek. Het is niet aannemelijk dat onze
uitgangsvraag met dit type onderzoek beantwoord kan worden, of dat dergelijk onderzoek in
dit kader is verricht.
Balans van gewenste en ongewenste effecten
De diagnostiek van atypische melanocytaire laesies vereist een balans tussen het juist diagnosticeren en behandelen van een mogelijke maligniteit en het vermijden van overdiagnostiek en -behandeling van een benigne of intermediaire laesie. Het beleid moet daarom zorgvuldig worden afgestemd op de individuele patiënt, met het oog op zowel het vermijden van onderdiagnose en onderbehandeling als het minimaliseren van onnodige behandelingen.
Professioneel perspectief
Diagnostiek
In geval van een atypische melanocytaire laesie waarbij het onderscheid tussen een eenduidig benigne of maligne laesie niet kan worden gemaakt op basis van enkel histologisch onderzoek dient aanvullend immunohistochemisch en eventueel moleculair onderzoek te worden verricht.
Bij kleine laesies (<5mm) dient men voorzichtig om te gaan met het beperkte weefsel en wordt het maken van vele doorsnijdingen of opsnijden voor radicaliteit ontraden om weefselverlies voor eventueel later benodigde aanvullende diagnostische technieken te voorkomen. Het advies is in deze gevallen in elk geval linten te bewaren of voldoende blanco coupes op te plakken.
Als leidraad voor aanvullende immuunhistochemie bij atypische melanocytaire tumoren kunnen de volgende markers gebruikt worden (WHO 2023, de la Fouchardière 2021, Garbe 2022):
I. Voor het bepalen van de genetische signatuur:
- Bij gepigmenteerde laesies: HMB45 (blauwe laesies, PKC-gefuseerde laesies, PEM: geen uitdoving richting de basis), PRKAR1A (verlies van expressie in een PEM), b-catenine (aberrante kernexpressie in WNT-geactiveerd melanocytoom)
- Bij heldercellige laesies: MITF, actine en desmine voor diagnose van een MITF-subtype geactiveerd melanocytoom
- Bij epithelioide/spoelcel laesies: BRAFV600E, ALK, ROS1, NTRK en BAP1. De ALK, ROS1 en NTRK immunohistochemische kleuringen kunnen echter negatief of moeilijk te interpreteren zijn, terwijl er wel een fusie is. Tevens zijn er diverse fusies, met name in de Spitz tumoren (o.a. in MAP3K8 en BRAF), waarvoor geen immunohistochemische marker beschikbaar is. Indien er toch verdenking blijft op een Spitz laesie dient in dergelijke gevallen een meer sensitieve en specifieke moleculaire test te worden ingezet om de Spitz signatuur met meer zekerheid te bepalen (Ebbelaar, 2024).
II. Voor het bepalen van digniteit:
- MelanA (architectuur en symmetrie), HMB45 (behouden dermaal in een deel van de melanomen), Sox10/S100 (altijd includeren bij verdenking desmoplastisch/lentigo maligna melanoom), p16 (geheel of partieel verlies kan aanwezig zijn in niet benigne laesies, schaakbordexpressie in benigne laesies), PRAME (positief in circa 80% van de melanomen, overwegend negatief in benigne/intermediaire laesies, Ki67 (veelal proliferatiefractie <5% in benigne laesies), p53 (vaak positief in lentigo maligna melanoom), BAP1 (in maligne blauwe melanocytaire laesies verlies van kernexpressie).
Indien na histologisch en immunohistochemisch onderzoek én interne consultatie van iemand met meer dan gemiddelde expertise op het gebied van de dermatopathologie de diagnose onduidelijk blijft, is consultatie van een ervaren patholoog op dit gebied, binnen en/of buiten de eigen praktijk, geïndiceerd.
Deze kan aanvullende moleculaire technieken inzetten om de genetische driver te bepalen die de genetische signatuur/WHO subtype van de laesie aangeeft (BRAF, NRAS en second hit mutaties in genen zoals CTNNB1, BAP1, PRKAR1A), en eventuele aanvullende pathogene mutaties (TERT promoter, TP53, CDKN2A) en copy number variaties (CNVs) kunnen detecteren die de digniteit van de laesie mede bepalen (de la Fouchardière 2021, Ebbelaar 2021).
Als technieken voor mutatie detectie heeft NGS de voorkeur, voor fusie detectie kan een Archer panel of RNA sequencing techniek gebruikt worden en voor CNV detectie een array techniek (CGH, SNP array) of (shallow) NGS: deze laatste is minder sensitief (de la Fouchardière, 2021).
De laesie dient finaal geclassificeerd te worden volgens de geldende WHO classificatie (WHO Classification of Tumours Online, 2025). Dit is een gelaagde classificatie waarin kliniek (locatie van de laesie, rol van zon-expositie en klinische context), histologie en eventuele genetische bevindingen (of overtuigende hiervan afgeleide immuunhistochemie) zijn geïntegreerd.
Wanneer de twijfel door consultatie niet kan worden weggenomen en de laesie niet zeker te classificeren blijft, dient een individuele therapiekeuze gemaakt te worden. De mate van histologische verdenking, hoewel subjectief, wordt hierbij meegewogen. Specifieke casussen kunnen in een multidisciplinair overleg (zoals pathologiebespreking of melanoompanel) besproken worden. De dermatoloog kan, in overleg met de patholoog, de onzekerheid over de diagnose en mate van histologische verdenking met de patiënt bespreken. Vervolgens kan de dermatoloog samen met de patiënt opties voor een uitgebreidere behandeling afwegen tegen een terughoudender beleid, met aandacht voor de consequenties en risico's van zowel over- als onderbehandeling (Scolyer, 2010).
Klinisch beleid
Een verdachte klinisch atypische melanocytaire laesie dient verwijderd te worden middels een diagnostische excisie met 2 mm marge. In uitzonderingsgevallen, bijvoorbeeld op een bijzondere locatie, kan het nemen van een diagnostisch stansbiopt worden overwogen.
Bij laaggradige melanocytomen is het Europese advies om bij re-excisie een vrije klinische marge van 2 mm aan te houden en bij hooggradige laesies een marge van 5-10 mm (de la Fouchardière, 2021).
Deze marge bij hooggradige laesies wordt verklaard doordat dit toch vaak dikke en diep dermaal uitbreidende laesies zijn in tegenstelling tot een melanoma in situ.
De maligne potentie van atypische melanocytaire laesies is echter onbekend en evidence-based richtlijnen voor de meest geëigende resectie marges en follow-up ontbreken op dit moment.
Voor oppervlakkige en laaggradige atypische melanocytaire laesies lijkt radicale excisie afdoende in verband met een laag risico op lokaal recidief, progressie of afstand metastasen na volledige excisie (Ensslin et al. 2017, Vermariën-Wang et al. 2022).
De werkgroep adviseert daarom een radicale excisie bij laaggradige melanocytomen (laaggradig BAP1-geïnactiveerd melanocytoom, WNT-geactiveerd melanocytoom, laaggradig Spitz melanocytoom, celrijke blauwe naevus, proliferatieve nodus in een congenitale naevus, laaggradig melanocytomen nos) en dysplastische naevi met hooggradige dysplasie. Bij een incomplete excisie of twijfel over radicaliteit van de excisie (onscherpe begrenzing van de laesie en histologische marge < 1 mm) adviseert de werkgroep om een re-excisie met 2 mm te verrichten. Aanvullende klinische follow-up is voor deze laesies niet geïndiceerd.
Voor diep in de huid uitbreidende atypische melanocytaire laesies en hooggradige laesies waarbij melanoom niet 100% zeker kan worden uitgesloten, is er wel een klein risico op regionale en afstandsmetastasen en overlijden (0,7-2.4%) (Ensslin et al. 2017, Vermariën-Wang et al. 2022).
Dit geldt ook voor de pediatrische populatie (Marshall et al. 2023, Ruijter et al. 2020).
Het risico op progressie is echter lager dan bij een conventioneel melanoom van vergelijkbare dikte.
De werkgroep adviseert derhalve een klinische marge van 5 mm bij hooggradige laesies (hooggradig BAP1-geïnactiveerd melanocytoom, hooggradig WNT-geactiveerd melanocytoom, hooggradig Spitz melanocytoom, gepigmenteerd epithelioid melanocytoom, atypische celrijke blauwe naevus, atypische proliferatieve nodus in een congenitale naevus, en hooggradig melanocytoom nos) en bij atypische niet zeker te classificeren melanocytaire laesies (SAMPUS, MELTUMP, STUMP).
Bij re-excisie is het advies deze marge in de diepte ook te bereiken, tenzij er een andere anatomische grens is zoals de spierfascie. Dit ook in verband met de diepere uitbreiding die frequent gezien wordt bij diverse melanocytomen.
Momenteel volgt de werkgroep de internationale praktijk om bij hooggradige atypische melanocytaire laesies en laaggradige melanocytomen re-excisie te adviseren ter voorkoming van recidieven en voor diagnostische zekerheid. De aanbeveling wordt herzien zodra nieuwe evidence beschikbaar is.
Het onderscheid tussen een hooggradig atypische melanocytaire laesie en een melanoom is niet altijd mogelijk, ook niet na uitgebreid histopathologisch en moleculair onderzoek. Bij hoge verdenking op melanoom kan overwogen worden om klinische follow-up corresponderend met de follow-up zoals gebruikelijk voor melanoom aan te houden.
Door gebrek aan evidence-based richtlijnen dient het beleid deels op basis van case-by-case management middels interdisciplinair overleg en in samenspraak met de patiënt gemaakt te worden.
Indien het onderscheid hooggradig melanocytoom of melanoom onzeker blijft dient de therapiekeuze (excisie marge, wel of geen schildwachtklierprocedure) middels interdisciplinair overleg en in samenspraak met de patiënt gemaakt te worden.
Stroomdiagram van diagnostiek naar behandeling Atypische Melanocytaire Laesies:
Waarden en voorkeuren van patiënten
Bij de diagnostiek en het klinische beleid van atypische melanocytaire laesies spelen de waarden en voorkeuren van de patiënt een rol. Tijdens de diagnostische excisie evenals de eventuele re-excisie dient de behandelaar duidelijk richting te geven wat betreft de (re-) excisie marge, echter deze is vastgesteld op basis van gebrekkig bewijs. Afwijken van dit beleid, indien patiënt daartoe redenen zou hebben, zou besproken moeten worden.
Aanvaardbaarheid en haalbaarheid
Voor de haalbaarheid is het essentieel dat er pathologen aanwezig zijn met specifieke expertise in de beoordeling van deze complexe laesies. Daarnaast is de mogelijkheid om deskundige pathologen te consulteren van groot belang voor het bevestigen van de diagnose en het bepalen van het juiste beleid. Tevens moeten diagnostische faciliteiten beschikken over aanvullende technieken, zoals immunohistochemische en moleculaire diagnostiek.
Onderbouwing
Achtergrond
Het onderscheid tussen benigne en maligne melanocytaire tumoren kan grote gevolgen hebben voor de patiënt. In de meeste gevallen kan de patholoog een duidelijke diagnose stellen. Echter, soms is de diagnose niet eenduidig en zijn melanocytaire tumoren moeilijk te classificeren als goedaardig of kwaadaardig.
In de World Health Organization (WHO) classificatie van 2023 is er erkenning van het bestaan van een tussengroep van intermediaire melanocytaire laesies, melanocytoom genaamd (WHO 2023, Broeke 2023).
In deze WHO classificatie wordt een melanocytaire laesie op basis van lokalisatie, klinische context, cumulatieve zonneschade en moleculaire diagnostiek ingedeeld in een specifieke pathogenetische route ook wel ‘pathway’ genoemd. Er worden nu negen subtypen onderscheiden met in elk subtype diverse progressiestappen, van een benigne afwijking via laag- en hooggradige intermediaire afwijkingen (melanocytomen) naar het melanoom als eindpunt. Deze progressie is echter niet altijd lineair en een melanoom kan ook ontstaan zonder een pre-existente naevus.
Melanocytomen hebben genetische en histopathologische kenmerken die niet meer passen bij een benigne afwijking, maar op zichzelf niet de diagnose ‘melanoom’ rechtvaardigen. Een correcte classificatie heeft echter belangrijke implicaties voor zowel de behandeling als de prognose.
Melanocytomen hebben overwegend een laag risico op progressie en indien dit optreedt blijft dit veelal beperkt tot locoregionale uitbreiding met zelden afstandsmetastasering. Melanocytomen zijn relatief zeldzaam en leiden zowel klinisch als histologisch nogal eens tot een misdiagnose van melanoom.
Enkele voorbeelden zijn het WNT-geactiveerd melanocytoom, BAP1-geïnactiveerd melanocytoom, gepigmenteerd epithelioid melanocytoom (PEM), en het Spitz melanocytoom.
Laaggradige melanocytomen zijn tegenwoordig met aanvullende immunohistochemische technieken en moleculaire diagnostiek veelal goed te diagnosticeren.
Het graderen van melanocytomen is echter niet altijd mogelijk en het onderscheid met melanoom kan zeer lastig of niet goed mogelijk zijn in de hooggradige groep van melanocytomen.
Objectieve histopathologische en moleculaire criteria voor het graderen van melanocytomen, differentiatie van melanoom en consensus over criteria ontbreken op dit moment nog.
Indien zekere differentiatie van een atypische melanocytaire laesie met melanoom niet goed mogelijk is kan een differentiaal diagnose van hooggradig melanocytoom dan wel melanoom worden opgesteld (waarbij het subtype gespecificeerd dient te worden indien bekend) (de la Fouchardière, 2021). Indien geen passende classificatie kan worden afgegeven volgens de WHO is er nog beperkte ruimte voor gebruik van de term SAMPUS (superficial atypical melanocytic proliferation of uncertain significance) in oppervlakkige atypische melanocytaire laesies of MELTUMP/STUMP (melanocytic tumor of uncertain malignant potential/ Spitz tumor of uncertain malignant potential) in dikkere melanocytaire laesies.
Gezien het belang van een accurate diagnose bij atypische melanocytaire laesies is zorgvuldige diagnostiek vereist. Hierom wordt het raadplegen van een collega patholoog geadviseerd en bij onzekerheid over de precieze aard van de laesie aanvullend gespecialiseerd onderzoek met immunohistochemische kleuringen en moleculair onderzoek om de diagnostische onzekerheid tot een minimum te beperken. Vervolgens kan dan de meest geëigende behandeling worden ingesteld.
Zoeken en selecteren
Voor deze vraag is geen systematische literatuuranalyse verricht. Overwegingen en aanbevelingen zijn gebaseerd op basis van expert opinion (de la Fouchardière 2021, Barnhill 2023) en de WHO classificatie van melanocytaire tumoren uit 2023 (WHO, 2023).
Binnen de GRADE-methodiek is het systematisch literatuuronderzoek gebaseerd op
vergelijkend onderzoek, veelal gerandomiseerd onderzoek. Het is niet aannemelijk dat onze
uitgangsvraag met dit type onderzoek beantwoord kan worden, of dat dergelijk onderzoek in
dit kader is verricht.
Referenties
- 1 - WHO Classification of Tumours Editorial Board. Skin tumours [Internet; beta version ahead of print]. Lyon (France): International Agency for Research on Cancer; 2023 [cited 2024-10-10]. (WHO classification of tumours series, 5th ed.; vol. 12). Available from: https://tumourclassification.iarc.who.int/chapters/64.
- 2 - Broeke, L. R. van den, Ebbelaar, C. F., Hayes, D. P., Bousema, M. T., & Blokx, W. A. M. (2023). Melanocytoom, intermediair tussen naevus en melanoom: implicaties van de WHO indeling van melanocytaire huidtumoren. Nederlands Tijdschrift Voor Geneeskunde, 16
- 3 - de la Fouchardière, A., Blokx, W., van Kempen, L.C. et al. ESP, EORTC, and EURACAN Expert Opinion: practical recommendations for the pathological diagnosis and clinical management of intermediate melanocytic tumors and rare related melanoma variants. Virchows Arch 479, 3–11 (2021). https://doi.org/10.1007/s00428-020-03005-1
- 4 - Garbe, C., Amaral, T., Peris, K., Hauschild, A., Arenberger, P., Basset-Seguin, N., Bastholt, L., Bataille, V., Del Marmol, V., Dréno, B., Fargnoli, M. C., Forsea, A. M., Grob, J. J., Höller, C., Kaufmann, R., Kelleners-Smeets, N., Lallas, A., Lebbé, C., Lytvynenko, B., Malvehy, J., European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO), and the European Organization for Research and Treatment of Cancer (EORTC) (2022). European consensus-based interdisciplinary guideline for melanoma. Part 1: Diagnostics: Update 2022. European journal of cancer (Oxford, England : 1990), 170, 236–255. https://doi.org/10.1016/j.ejca.2022.03.008
- 5 - Ebbelaar CF, van Dijk M, Breimer GE, Meijers RWJ, Klein LBC, Petronilia MM, de Leng WWJ, Blokx WAM, Jansen AML; Molecular Evaluation of Melanocytic Ambiguous Tumors (MOLEMAT) investigators. Comparative Performance Analysis of Idylla and Archer in the Detection of Gene Fusions in Spitzoid Melanocytic Tumors. Mod Pathol. 2024 Aug;37(8):100538. doi: 10.1016/j.modpat.2024.100538. Epub 2024 Jun 14. PMID: 38880351.
- 6 - Barnhill RL, Elder DE, Piepkorn MW, Knezevich SR, Reisch LM, Eguchi MM, Bastian BC, Blokx W, Bosenberg M, Busam KJ, Carr R, Cochran A, Cook MG, Duncan LM, Elenitsas R, de la Fouchardière A, Gerami P, Johansson I, Ko J, Landman G, Lazar AJ, Lowe L, Massi D, Messina J, Mihic-Probst D, Parker DC, Schmidt B, Shea CR, Scolyer RA, Tetzlaff M, Xu X, Yeh I, Zembowicz A, Elmore JG. Revision of the Melanocytic Pathology Assessment Tool and Hierarchy for Diagnosis Classification Schema for Melanocytic Lesions: A Consensus Statement. JAMA Netw Open. 2023 Jan 3;6(1):e2250613. doi: 10.1001/jamanetworkopen.2022.50613. PMID: 36630138; PMCID: PMC10375511.
- 7 - Ebbelaar CF, Jansen AML, Bloem LT, Blokx WAM. Genome-wide copy number variations as molecular diagnostic tool for cutaneous intermediate melanocytic lesions: a systematic review and individual patient data meta-analysis. Virchows Arch. 2021 Oct;479(4):773-783. doi: 10.1007/s00428-021-03095-5. Epub 2021 Apr 13. PMID: 33851238; PMCID: PMC8516778.
- 8 - Scolyer RA, Murali R, McCarthy SW, Thompson JF: Histologically ambiguous ("borderline") primary cutaneous melanocytic tumors: approaches to patient management including the roles of molecular testing and sentinel lymph node biopsy, Arch Pathol Lab Med. 2010;134:1770-7.
- 9 - Swetter, S. M., Tsao, H., Bichakjian, C. K., Curiel-Lewandrowski, C., Elder, D. E., Gershenwald, J. E., Guild, V., Grant-Kels, J. M., Halpern, A. C., Johnson, T. M., Sober, A. J., Thompson, J. A., Wisco, O. J., Wyatt, S., Hu, S., & Lamina, T. (2019). Guidelines of care for the management of primary cutaneous melanoma. Journal of the American Academy of Dermatology, 80(1), 208–250. https://doi.org/10.1016/j.jaad.2018.08.055
- 10 - Ensslin, C. J., Hibler, B. P., Lee, E. H., Nehal, K. S., Busam, K. J., & Rossi, A. M. (2017). Atypical Melanocytic Proliferations: A Review of the Literature. Dermatologic Surgery, 44(2), 159–174. https://doi.org/10.1097/dss.0000000000001367
- 11 - Vermariën-Wang, J., Doeleman, T., Van Doorn, R., Mooyaart, A. L., Blokx, W. A., & Schrader, A. M. (2022). Ambiguous melanocytic lesions: A retrospective cohort study of incidence and outcome of melanocytic tumor of uncertain malignant potential (MELTUMP) and superficial atypical melanocytic proliferation of uncertain significance (SAMPUS) in the Netherlands. Journal Of The American Academy Of Dermatology, 88(3), 602–608. https://doi.org/10.1016/j.jaad.2022.11.019
- 12 - Marshall, E. H., Alvarez, G., Wang, B., Crimmins, J., Schneider, M. M., Selim, M. A., & Al-Rohil, R. N. (2023). Pediatric Atypical Melanocytic Proliferations: Single-Site Retrospective Cohort Assessment of Treatment and Long-Term Follow-Up. Cancers, 15(24), 5804. https://doi.org/10.3390/cancers15245804
- 13 - Ruijter, C., Ouwerkerk, W., Jaspars, E., Doorn, R., Luiten, R., Bekkenk, M., & Tio, D. (2020). Incidence and outcome of Spitzoid tumour of unknown malignant potential (STUMP): an analysis of cases in the Netherlands from 1999 to 2014. British Journal Of Dermatology, 183(6), 1121–1123. https://doi.org/10.1111/bjd.19383
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 27-01-2026
Beoordeeld op geldigheid : 27-01-2026
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Samenstelling van het cluster
Voor het ontwikkelen van de richtlijnmodule is in 2024 een multidisciplinaire cluster ingesteld. Dit cluster bestaat uit vertegenwoordigers van alle relevante organisaties die betrekking hebben op de zorg voor patiënten met cutane maligniteiten.
Het cluster Cutane Maligniteiten bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. Het cluster Cutane Maligniteiten bestaat uit de volgende personen:
Clusterstuurgroep
|
Clusterstuurgroepleden – 2024-2025 |
Vereniging |
|
Wetenschappelijke verenigingen; |
|
|
E. I. Plasmeijer |
NVDV |
|
K. Mosterd |
NVDV |
|
N. C. Naus |
NOG |
|
D. J. Grünhagen |
NVvH |
|
J. J. Bonenkamp |
NVvH |
|
A. B. Francken |
NVvH |
|
A. J. M. van den Eertwegh |
NIV |
|
K. Hendriks / J. Collette (huidig) |
HUKAS |
Clusterexpertisegroep
|
Expertisegroepleden – 2024-2025 |
Vereniging |
|
Wetenschappelijke verenigingen; |
|
|
E. I. Plasmeijer |
NVDV |
|
K. Mosterd |
NVDV |
|
E. Rácz |
NVDV |
|
Y. S. Elshot |
NVDV |
|
R. van Doorn |
NVDV |
|
N. C. Naus |
NOG |
|
D. J. Grünhagen |
NVvH |
|
J. J. Bonenkamp |
NVvH |
|
A. B. Francken |
NVvH |
|
S. Wilgenhof |
NIV |
|
A. Joosse |
NIV |
|
K. F. Bol |
NIV |
|
E. J. Blok |
NIV |
|
A. J. M. van den Eertwegh |
NIV |
|
M. Jalving |
NIV |
|
W. A. M. Blokx |
NVVP |
|
R. O. B. de Keizer |
NOG |
|
A. Bruining |
NVvR |
|
P. de Graaf |
NVvR |
|
Patiëntenverenigingen; |
|
|
K. Hendriks / J. Collette (huidig) |
HUKAS |
Met ondersteuning van
- Nederlandse Vereniging voor Dermatologie en Venereologie, NVDV
- Drs. T. A. Teunissen, arts-onderzoeker richtlijnontwikkeling (vanaf oktober 2024)
- Dr. W. A. van Enst, directeur NVDV en epidemioloog
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterstuurgroepleden en actief betrokken expertisegroepsleden (fungerend als schrijver en/of meelezer bij tenminste één van de geprioriteerde richtlijnmodules) hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een richtlijnmodule worden wijzigingen in belangen aan de projectleider doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase. Een overzicht van de belangen van de clusterleden en betrokken expertisegroepsleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Tabel 1. Gemelde (neven)functies en belangen stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
E.I. Plasmeijer (NVDV) |
Dermatoloog, Antoni van Leeuwenhoek |
Detachering als dermatoloog LUMC vanuit AVL 1 dag per week, onbetaald Lid richtlijn melanoom, SCC en PeIN, onbetaald Lid bestuur Win-O, onbetaald Lid bestuur SCOPE Europe, onbetaald |
Geen. |
Geen. |
|
K. Mosterd (NVDV) |
Dermatoloog, hoofd afdeling dermatologie MUMC+, hoogleraar onco-dermatologie |
Consultancy Allmiral en Pierre Fabre (betaald] Lid commissie nascholing (onbetaald) Lid stuurgroep huidkanker (onbetaald) Voorzitter en docent landelijke AIOS nascholing COCOM (betaald) Verschillende presentaties voor congressen (dermatologendagen, MKA nascholing, EADO): deels betaald |
Geen. Wel extern gefinancierd onderzoek (Diverse ZonMW gesubsidieerde studies verricht op het gebied van huidkanker. Registry hedgehog inhibitors registratie, gefinancieerd doeo Sun Pharma). |
Geen. |
|
N.C. Naus (NOG) |
Oogarts, afdelingshoofd Erasmus MC |
Voorzitter richtlijnencomissie NOG (vacatiegelden) |
Geen. |
Geen. |
|
D.J. Grünhagen (NVvH) |
Chirurg, Erasmus MC |
Bestuurslid NVCO Bestuurslid DMSCG Bestuurslid DSG (sarcomen) VZ richtlijn weke delen tumoren (opgeleverd) Lid richtlijncie melanomen |
Geen. Wel extern gefinancierd onderzoek (Projectleider OMIT-trial, gefinancierd door SGS). Niet relevant voor deze richtlijn. PI van 2 recent gepubliceerde studies naar de meerwaarde van resp re-excisie en SN bij dunne melanomen (EJC 2025). |
Geen |
|
J. J. Bonenkamp (NVvH) |
Chirurg, Radboud UMC |
Bestuurslid bij DMTR Bestuurslid bij TFG Raad van Advies van Stichting Melanoom |
Geen. |
Geen. |
|
A.B. Francken (NVvH) |
Chirurg, Isala Zwolle |
Lid richtlijncomissie, FMS Bestuur Nederlandse Werkgroep voor Endocriene Chirurgie Voorzitter werkgroep Audit NVvH Voorzitter weke delen werkgroep Isala Docent module anatomie mamma/axilla (voor)opleiding Heelkunde Lid tumorfocusgroep melanoom, IKNL Lid werkgroep mammacarcinoom, NVCO, sectie kwaliteit Redactieraad Nederlands Tijdschrift voor Heelkunde Reviewer van verschillende wetenschappelijke tijdschriften |
Geen. |
Geen. |
|
A. J. M. van den Eertwegh (NIV) |
Medisch oncoloog, Amsterdam UMC |
Voorzitter DMTR (Dutch Melanoma Treatment registry)(vacatiegeld aan Amsterdam UMC) Deelname aan adviesraad (betaald aan Amsterdam UMC): Bristol-Myers Squibb, MSD Oncology, Ipsen, Pierre Fabre, Janssen Cilag BV |
Geen. Wel extern gefinancierd onderzoek (Projectleider INTRIM melanoom studie van IDERA. Projectleider REPOSIT melanoom studie van ROCHE en deelnemer aan DMTR van Novartis, Pierre Fabre, MSD, BMS en ziektekosten) |
Geen. |
|
J. Collette (HUKAS) |
Patiëntvertegenwoordiger De Huidkanker Stichting. |
|
|
|
Clusterexpertisegroep
Tabel 2. Gemelde (neven)functies en belangen expertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Y.S. Elshot (NVDV) |
Dermatoloog 1) Amsterdam UMC (0,4 FTE), betaald 2) Antoni van Leeuwenhoek ziekenhuis (0,4 FTE), betaald |
Geen |
Geen |
Geen |
|
K.F. Bol (NVDV) |
participeren in de herziening/ontwikkeling van de Cluster Maligniteiten van de huid - vergoeding van vacatiegelden |
Geen |
Geen |
Geen |
|
R. Van Doorn (NVDV) |
Dermatoloog, Leids Universitair Medisch Centrum en Antoni van Leeuwenhoek ziekenhuis |
Onbetaald lid van het bestuur van de European Society for Dermatological Research en de Nederlandse Vereniging voor Experimentele Dermatologie en de Stichting Opsporing Erfelijke Tumoren. |
Geen. Wel extern gefinancierd onderzoek verricht (therapie voor naevus en melanoom precursurs, gefinancierd door Stichting Dioraphte. Screens voor nieuwe melanoom precursor therapieën, gefinancierd door Stichting Josephine Nefkens. DNA methylatie biomarkers voor melanoom, gefinancierd door PPS/Health Holland. Preventie en therapie van melanoom bij FAMM syndroom, gefinancierd door Zeldzame Zieken Fonds). |
Geen |
|
W.A.M. Blokx (NVVP) |
Patholoog, UMC Utrecht |
Geen |
Geen. Wel extern gefinancierd onderzoek, niet van invloed op richtlijn (projectleider; onderzoek naar toepassing van kunstmatige intelligentie bij diagnosticeren van melanocytaire tumoren. Gefinancierd door Hanarth fonds). |
Geen |
|
E.I. Plasmeijer (NVDV) |
Dermatoloog, Antoni van Leeuwenhoek |
Detachering als dermatoloog LUMC vanuit AVL 1 dag per week, onbetaald Lid richtlijn melanoom, SCC en PeIN, onbetaald Lid bestuur Win-O, onbetaald Lid bestuur SCOPE Europe, onbetaald |
Geen. |
Geen. |
|
K. Mosterd (NVDV) |
Dermatoloog, hoofd afdeling dermatologie MUMC+, hoogleraar onco-dermatologie |
Consultancy Allmiral en Pierre Fabre (betaald] Lid commissie nascholing (onbetaald) Lid stuurgroep huidkanker (onbetaald) Voorzitter en docent landelijke AIOS nascholing COCOM (betaald) Verschillende presentaties voor congressen (dermatologendagen, MKA nascholing, EADO): deels betaald |
Geen. Wel extern gefinancierd onderzoek (Diverse ZonMW gesubsidieerde studies verricht op het gebied van huidkanker. Registry hedgehog inhibitors registratie, gefinancieerd doeo Sun Pharma). |
Geen |
|
E. Rácz (NVDV) |
Dermatoloog, Universitair Medisch Centrum Groningen |
Geen |
Geen. Wel extern gefinancierd odnerzoek (Deelname aan studie naar de behandeling van cutaan plaveiselcelcarcinoom met intralesionale immunotherapie; sponsor Regeneron, 1 pt geincludeerd; looptijd maart-december 2025). |
Geen |
|
S. Wilgenhof (NIV) |
Internist-oncoloog in het Antoni van Leeuwenhoek ziekenhuis. Principal investigator: CA224020 studie (ClinicalTrials.gov number, NCT01968109) R3767-ONC-2011 studie (NCT05352672) E2139 (NCT05270044) vorinostat studie (NCT02836548) Subinvestigator: TIL studie (ClinicalTrials.gov number, NCT02278887) NADINA studie (ClinicalTrials.gov number, NCT04949113) safe stop studie safe stop ipi-nivo (NCT05652673) E1325 (NCT02362594) NIVEC studie (NCT04330430) NKTR-214 + nivolumab (NCT03635983) EBIN (NCT03235245) DONIMI (NCT04133948) MASTERKEY-115 (NCT04068181) IOB-013 (NCT05155254) |
Adviesraden: Eisai, Bristol-Myers Squibb, Pierre Fabre, Novartis, Pfizer en Ipsen (betaald aan instituut (AVL)); educatief symposium: MSD en Bristol-Myers Squibb (betaald aan insituut (AVL)) |
Geen. Wel extern gefinancierd onderzoek, niet van invloed op richtlijn (EU Horizon 2020 (No 875052): CAPABLE: Pilot study of the eHealth application Cancer Patients Better Life Experience EU (101104801): CARE-1: Optimizing Treatments for Metastatic Renal Carcinoma) |
Geen |
|
K. F. Bol (NIV) |
Participeren in de herziening/ontwikkeling van de Cluster Maligniteiten van de huid - vergoeding van vacatiegelden |
Geen |
Geen. Wel extern gefinancierd onderzoek, niet van invloed op richtlijn |
Geen |
|
M. Jalving (NIV) |
Internist-oncoloog, UMCG |
ESMO climate change task force, onbetaald Richtlijn Melanoom, alleen SKMS vergoeding Richtlijn Endometriumcarcinoom, allen SKMS vergoeding Voorzitter Adviesraad Junior Scientific Masterclass UMCG, onbetaald Deelname adviesraden Pierre Fabre en Regeneron (geld naar UMCG) |
Geen |
Geen |
|
E. J. Blok (NIV) |
Internist-oncoloog, LUMC |
Geen |
Geen |
Geen |
|
R. O. B. de Keizer (NOG) |
Oogarts, oogziekenhuis Rotterdam |
Oogarts, Erasmus MC. |
Geen |
Geen |
|
A. Bruining (NVvR) |
NKI AVL |
Richtlijn revisie commissie |
Geen |
Geen |
|
J. Collette (HUKAS) |
Patiëntvertegenwoordiger De Huidkanker Stichting. |
|
|
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van relevante patiëntenorganisaties aan de need-for-update en/of prioritering. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijnmodule is tevens ter commentaar voorgelegd aan alle relevante patiëntenorganisaties in de stuur- en expertisegroep (zie ‘Samenstelling cluster’ onder ‘Verantwoording’) en aan alle patiëntenorganisaties die niet deelnemen aan de stuur- en expertisegroep, maar wel hebben deelgenomen aan de need-for-update (zie ‘Need-for-update’ onder ‘Verantwoording’). De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module MELTUMPS/STUMPS |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase (december, 2023) inventariseerde het cluster de geldigheid van de richtlijnmodules binnen het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd. Per richtlijnmodule is aangegeven of deze geldig is, herzien moet worden, kan vervallen of moet worden samengevoegd. Ook was er de mogelijkheid om nieuwe onderwerpen aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De richtlijnmodules waarbij door één of meerdere partijen werd aangegeven herzien te worden, werden doorgezet naar de prioriteringsronde. Ook suggesties voor nieuwe richtlijnmodules werden doorgezet naar de prioriteringsronde. Afgevaardigden vanuit de partijen in de stuur- en expertisegroep werden gevraagd om te prioriteren (zie ‘Samenstelling cluster’ onder ‘Verantwoording’). Hiervoor werd de RE-weighted Priority-Setting (REPS) – tool gebruikt. De uitkomsten (ranklijst) werd gebruikt als uitgangspunt voor de discussie. Voor de geprioriteerde richtlijnmodules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. [Review Manager 5.4] werd indien mogelijk gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
Tabel 3. Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in een richtlijnmodule volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Tabel 4. Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de richtlijnmodule Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd voorgelegd aan alle partijen die benaderd zijn voor de need-for-update fase. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd ter autorisatie of goedkeuring voorgelegd aan de partijen die beschreven staan bij ‘Initiatief en autorisatie’ onder ‘Verantwoording’.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.