Preoperatieve beeldvorming
Uitgangsvraag
Wat is de plaats van preoperatief beeldvormend onderzoek bij patiënten onder de 50 jaar met een indicatie voor een mammareductie?
Subvraag: Hoelang is een voorgaand preoperatief mammogram geldig bij patiënten die een mammareductie zullen ondergaan?
Aanbeveling
Preoperatieve beeldvorming:
- Boven de 40 jaar: standaard mammografie is geïndiceerd.
- Tussen 30 en 40 jaar:
- Indicatie voor mammografie of verwijzing naar mammapoli bij alle vormen van bestraling in mamma/thoraxgebied in de voorgeschiedenis.
- Indicatie voor mammografie of verwijzing naar mammapoli bij belaste familie anamnese.*
- Overweeg mammografie bij een positieve familieanamnese.**
- Onder de 30 jaar:
- Standaard beeldvorming is niet geïndiceerd.
- Indicatie voor echografie indien er sprake is van:
- palpabele afwijking;
- nieuwe huidintrekking;
- bloederige tepeluitvloed.
Een alternatief voor direct beeldvorming verrichten via plastisch chirurg, is verwijzing voor preoperatieve beeldvorming via huisarts naar radioloog, mammapoli of oncologisch chirurg, afhankelijk van de ernst van de verdenking.
Geldigheid mammogram
- De geldigheid van een preoperatief mammogram is standaard twaalf maanden.
- De geldigheid van een preoperatief mammogram is zes maanden bij patiënten met een verhoogd risico op mammacarcinoom.
* Ga na of er sprake is van een belaste familieanamnese:
- Indien een eerstegraads familielid < 40 jaar en/of meerdere tweedegraads familieleden < 50 jaar borstkanker hebben (gehad).
- Overweeg eventueel verwijzing ten aanzien van genetische consultatie en daaruit volgende adviezen ten aanzien van screening buiten het bevolkingsonderzoek. Voor verdere informatie zie flowchart 1 Borstkanker - Screening buiten het bevolkingsonderzoek.
** Positieve familieanamnese is gedefinieerd als borstkanker in de familie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er zijn geen vergelijkende studies gevonden die het effect van het uitvoeren van een preoperatieve screening en een pathologisch onderzoek vergelijken met enkel een pathologisch onderzoek bij vrouwen met een indicatie voor een mammareductie onder de 50 jaar. In de literatuuranalyse is een beschrijving gemaakt van de bevindingen van preoperatieve screening en pathologisch onderzoek, opgesplitst per leeftijdsgroep bij mammareductiepatiënten. Uit deze resultaten kunnen geen GRADE conclusies worden opgesteld.
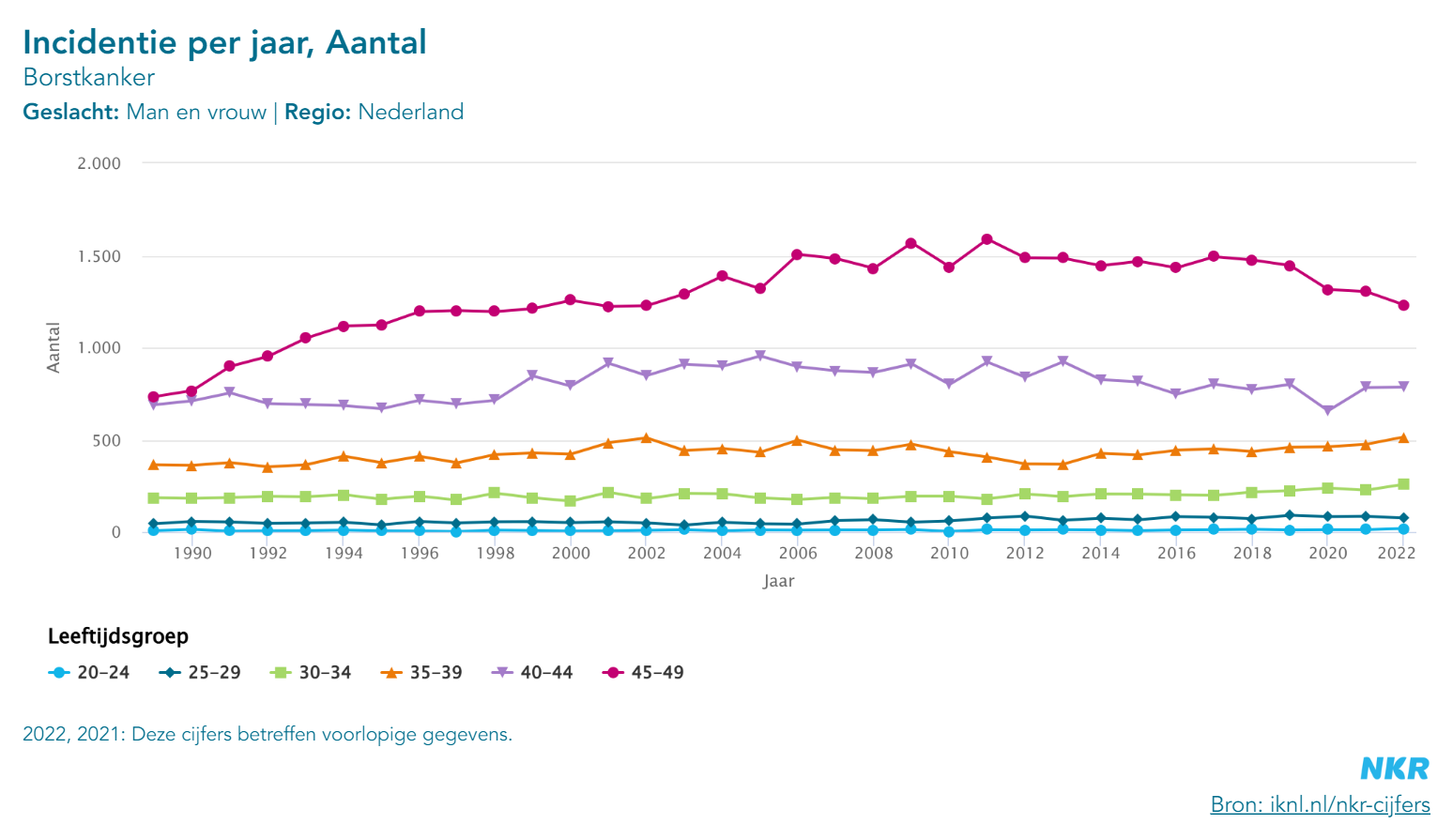
De incidentie op het krijgen van een mammacarcinoom is in Nederland het hoogst in de leeftijdsgroep boven de 90 jaar en tussen een leeftijd van 60-70 jaar met een incidentie van respectievelijk 3,7 en 3,6 per 100 vrouwen. De incidentie voor vrouwen tussen de leeftijd van 50-59 bedraagt 2,9 per 100, tussen de 40 en 49 jaar bedraagt dit 1,9 per 100 vrouwen en bij vrouwen met een leeftijd tussen 30-39 jaar 0,6 per 100. Dit verdedigt een mammogram preoperatief vanaf 40 jaar en vergt een meer pragmatische aanpak tussen 30-39 jaar. (NKR/IKNL data)
De vals-positieve ratio ten opzichte van het ontdekken van een maligniteit in deze groep ondersteunt het niet verrichten van preoperatieve beeldvorming onder de 40 jaar zeker (Ambaye, 2007; Blansfield, 2004; Klement, 2019; Merkkola-von Schantz, 2017) gezien het veelvuldig initiëren voor aanvullende controles, en het verkrijgen van pathologie (Klement, 2019). Zonder een voorgeschiedenis die screening buiten het bevolkingsonderzoek met mammografie of MRI aanbeveelt, is een mammografie het onderzoek van keuze (zie hiervoor ook de richtlijn mammacarcinoom). Een screenende preoperatieve echo heeft hierin geen plaats.
Figuur 1. Bron: NKR cijfers/IKNL
Deze grafiek (figuur 1) uitgesplitst op de indicentie van borstkanker per leeftijdgroep (van 20 t/m 49 jaar) in Nederland ondersteunt dat er – gezien de zeer lage incidentie onder de 30 geen indicatie is voor preoperatieve beeldvorming in die groep. In Nederland is de sterfte door borstkanker in deze groepen ook erg laag.
De incidentie in de groep tussen 30-34 jaar is wat hoger, echter uit de literatuur is er geen evidence dat beeldvorming bijdraagt in het opsporen van borstkanker. Ook in de leeftijdsgroep van 35-40 jaar is er geen bewijs dat beeldvorming geïndiceerd is, echter gezien een hogere incidentie in deze groep kan beeldvorming worden overwogen, zeker als er sprake is van een positieve familieanamnese. Daarbij wordt de postoperatieve PA in de groep tussen de 35-40 jaar standaard onderzocht, in de groep 30-35 ter overweging.
Waarden en voorkeuren van patiënten
Indien patiënten (onder de 40 jaar) een voorkeur hebben voor beeldvorming dient er besproken te worden dat er geen indicatie is voor beeldvorming bij patiënten zonder klachten, palpabele afwijkingen of een belaste familieanamnese. Bespreek eveneens het risico op hoge fout-positieve bevindingen in deze leeftijdsgroep.
Kosten (middelenbeslag)
Het structureel screenen van vrouwen onder de 40 jaar zal voornamelijk vals positieve uitslagen geven. Deze gaan gepaard met onnodige zorgen bij de patiënt, onnodige follow–up of invasieve procedures om PA te verkrijgen. Daarnaast kosten al deze onderzoeken veel geld, en dragen ze in negatieve zin bij aan de wachttijden voor de overige zorg. Deze fout- positieven zijn dus zowel nadelig voor patiënt als de samenleving.
Aanvaardbaarheid, haalbaarheid en implementatie
Geen bijzonderheden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De toegevoegde waarde van een preoperatief mammogram is er volgens de literatuur alleen boven de leeftijd van 40 jaar. Dit komt door een stijgende incidentie van borstkanker met de leeftijd, evenals een betere beoordeelbaarheid van het mammogram bij een lagere mammadensiteit (ACR BI-RADS® Atlas).
Vrouwen boven de 50 jaar die langer dan 12 maanden geleden een mammografie hebben gehad komen eveneens in aanmerking voor een preoperatief mammogram.
Bij jonge vrouwen, onder de 30 is de incidentie van het mammacarcinoom zo laag dat screenende beeldvorming niet geïndiceerd is. Jonge vrouwen hebben gemiddeld densere mammae, hierdoor zijn mammacarcinomen vaak occult op een mammogram, dus fout-negatieven komen vaker voor. Dit wordt ondersteund door de aanwezige literatuur: geen van de gevonden maligniteiten bij patiënten jonger dan 40 jaar waren zichtbaar op het mammogram. Er worden echter vaker fout-positieve afwijkingen gevonden, met als gevolg onrust bij de patiënt en veel onnodige ingrepen en hogere kosten.
In de literatuur is er geen indicatie voor standaard preoperatieve screening in de groep tussen de 30 en 40 jaar. Indien er sprake is van een verhoogd risico op mammacarcinoom valt een mammografie te overwegen.
Patiënten met een palpabele afwijking, nieuwe huidintrekking en/of bloederige tepelvloed komen in aanmerking voor beeldvorming, waarbij bij vrouwen onder de 30 gekozen wordt voor echografie.
Wanneer de screeningsindicatie onduidelijk is, kan worden verwezen naar de mammapoli. Niet bij iedereen is preoperatieve screening zinvol. De mammapoli kan beoordelen of er op dat moment een reden is voor screening en eventuele verdere stappen in gang zetten.
Omdat plastisch chirurgen zowel mammareducties uitvoeren in een ziekenhuis als in een ZBC zijn er verschillende routes voor de aanvraag van preoperatieve beeldvorming mogelijk.
De werkgroep is van mening dat de geldigheid van een preoperatief mammogram standaard twaalf maanden zou moeten zijn. Echter, bij patiënten met een verhoogd risico op mammacarcinoom dient deze duur te worden verkort naar zes maanden vanwege de impact van de chirurgische interventie.
Onderbouwing
Achtergrond
In de huidige situatie blijkt er praktijkvariatie te zijn wanneer preoperatief beeldvormend onderzoek (mammografie) wordt aangevraagd als work-up voorafgaande aan een mammareductie. De belangrijkste vraag voor deze module is vanaf welke leeftijd preoperatieve beeldvorming nodig is bij asymptomatische patiënten die een mammareductie ondergaan of dat postoperatief pathologisch onderzoek voldoende is. Patiënten met een sterk verhoogd risico op mammacarcinoom worden meestal gescreend volgens de richtlijn screening buiten het bevolkingsonderzoek. Deze patiënten zullen een mammografie of een MRI ondergaan. De preoperatieve work-up voor een preventieve ablatie valt buiten deze richtlijn.
De termijn voor hoelang een preoperatief mammogram geldig is, staat ook ter discussie.
Samenvatting literatuur
Description of studies
None of the studies were comparative studies that complied with the PICO.
A description of the four relevant studies that described pathology assessment and pre-operative screening (mammograms) results in mammoplasty patients in shown in table 1. Only studies that showed results per age category were included.
Table 1. Description of pathology assessment and pre-operative screening results, per age category of mammaplasty patient
|
Author, year |
Cases (N) |
Results pathology assessment and pre-operative screening |
Results per age category |
|||||||||||||||||||||
|
Ambaye, 2007 |
Prospective reduction mammaplasty specimens N=202 |
Significant pathologic findings (carcinoma and atypical hyperplasia): 25 (12.4%). None were found on prior mammogram screening 22/25 had a mammogram within 12 months 15/25 had a mammogram within 6 months |
Significant pathologic findings
*resp. 38 and 39 years, one had a mammogram within 12 months and 1 had no prior mammogram. |
|||||||||||||||||||||
|
Blansfield, 2004 |
Retrospective charts review of reduction mammaplasty (1 surgeon) N=182 |
Proliferative changes: 19 (10.4%)
75 (41%) had preoperative mammography
|
Proliferative changes <30 year: 1 (2%) proliferation without atypia 30-39 yr: 8 (15%) 40-49 yr: 6 (15%) 50-59 yr: 3 (15%) ≥60 yr: 1 (8%) Pre-operative mammography : <30 yr: 0% 30-39 yr: 41.5% 40-49 yr: 65% ≥50 yr: 84% All but 2 mammograms were reported as normal; slightly suspicious increased density. |
|||||||||||||||||||||
|
Klement, 2019 |
Retrospective chart review of reduction mammaplasty (macromastia, congenital breast asymmetry, symmetry procedure after any breast cancer treatment) N=638 |
Pathology reports of reduction mammoplasty specimens were available for 579 (90.6%) of patients. Proliferative lesion: 38 (6.6%) High‐risk lesion: 8 (1.4%) Malignancy: 2 (0.3%)
Mammography was discussed with 43.3% of patients, completed in 41.5% of patients, of which reports were available in 60%.
Of the mammograms with available reports, 80% were BIRADS 1 or 2, indicating negative or benign findings. Only four of the 10 patients with high‐risk lesions or malignancy had preoperative mammograms which were read as BIRADS 0 (n = 1), 2 (n = 2), and 3 (n = 1). |
<40 yr, mammography was discussed in 19.4% of the patients
<40 yr: 10.0% were BIRADS 0, 80% were BIRADS 1 or 2, 10.0% were BIRADS 3 and no patients were BIRADS 4, 5, or 6 mammograms. <40 yr: 8 women had mammograms that were not a negative or benign examination (BIRADS 1 or 2). All the women under the age of 40 with abnormal mammograms had no abnormal pathology. |
|||||||||||||||||||||
|
Merkkola-von Schantz, 2017 |
Retrospective review of reduction mammaplasty (symptomatic macromastia and asymmetry of the Breasts) N=918 |
Histopathological evaluation: Abnormal histopathological findings: 88 (10.4%), of which 81% had normal preoperative imaging (revealing two high-risk and two cancer findings (both in the above 40 group) high-risk lesions: 5.5%. Breast cancer: 1.2%
Preoperative screening (ultrasound or mammograms) was conducted in 89% of the patients. In patients with abnormal histopathology, preoperative imaging was normal in 81% and suspicious of malignancy in 19% of the patients. Preoperatively two of 10 patients with cancer findings and two of 47 patients with high-risk lesions were detected. |
Histopathological evaluation in <40 y group: Abnormal histopathological findings: 4.9% Low-risk lesion: 3.8% high-risk lesions: 1.7%. Breast cancer: 0%
|
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the effects and side-effects of conducting a pre-operative mammography AND a pathology assessment compared to only a pathology assessment in patients with an indication for a mamma reduction below the age of 50?
P (Patients) Patients with an indication for a mamma reduction below
the age of 50
I (Intervention) Radiological imaging (focus pre-operative mammography)
AND pathology assessment
C (Comparison) Pathology assessment
O (Outcomes) Subsequent tests; invasive procedures, anxiety patients,
false positives
Relevant outcome measures
The guideline development group considered false positives as a critical outcome measure for decision making; and subsequent tests; invasive procedures, anxiety patients as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 08-12-2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 395 hits. Studies were selected based on the criteria according to the PICO. Twenty-nine studies were initially selected based on title and abstract screening. After reading the full text, 25 studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included.
Results
Four studies were included in the descriptive analysis of the literature.
Referenties
- Ambaye, A. B., MacLennan, S. E., Goodwin, A. J., Suppan, T., Naud, S., & Weaver, D. L. (2009). Carcinoma and atypical hyperplasia in reduction mammaplasty: increased sampling leads to increased detection. A prospective study. Plastic and reconstructive surgery, 124(5), 13861392.
- Blansfield, J. A., Kukora, J. S., Goldhahn, R. T., Jr, & Buinewicz, B. R. (2004). Suspicious findings in reduction mammaplasty specimens: review of 182 consecutive patients. Annals of plastic surgery, 52(2), 126130. https://doi.org/10.1097/01.sap.0000100894.79413.74
- Dorsi CJ, Sickles EA, Mendelson EB, Morris EA. ACR BI-RADS Atlas Breast Imaging and reporting data system (2013). Reston, VA: American College of Radiology.
- Klement, K. A., Hijjawi, J. B., Neuner, J., Kelley, K., & Kong, A. L. (2019). Discussion of preoperative mammography in women undergoing reduction mammaplasty. The breast journal, 25(3), 439443. https://doi.org/10.1111/tbj.13237
- Merkkola-von Schantz, P. A., Kauhanen, S., Jahkola, T. A., Krogerus, L. A., & Hukkinen, K. S. (2017). Breast Cancer Detection by Preoperative Imaging in Reduction Mammaplasty Patients: A Single Center Study of 918 Patients. World journal of surgery, 41(8), 20132019. https://doi.org/10.1007/s00268-017-3920-z
- Sickles EA, DOrsi CJ, Bassett LW et al. ACR BI-RADS® Mammography in: ACR BI-RADS® Atlas, Breast Imaging Reporting and Data System. Reston, VA, American College of Radiology; 2013.
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Carlson, 2016 |
narrative review/background article |
|
Salah, 2013 |
no fulltext available |
|
Kyriopoulos, 2012 |
geen mammograpghy |
|
Lowes, 2018 |
background article |
|
Ortiz-Pomales, 2016 |
geen vergelijkend onderzoek |
|
Ambaye, 2017 |
alleen pa |
|
Kuehlmann, 2020 |
alleen pa, wrong outcome |
|
özmen, 2001 |
background article |
|
Clark, 2009 |
alleen pa |
|
Kakagia, 2005 |
alleen pa |
|
Slezak, 2011 |
geen vergelijkend onderzoek |
|
Dotto, 2008 |
geen mammograpghy |
|
Freedman, 2012 |
geen mammograpghy |
|
Goyal, 2011 |
Alleen PA |
|
Vande Walle, 2019 |
Onduidelijke PA data |
|
Merkkola-von Schantz, 2017 |
Geen resultaten per leeftijdscategorie |
|
Hage, 2006 |
Alleen survey resultaten |
|
Celik, 2013 |
Geen resultaten per leeftijdsgroep |
|
Huysmans, 2017 |
Geen resultaten per leeftijdsgroep: |
|
Colwell, 2004 |
Geen resultaten per leeftijdsgroep |
|
Campbell, 2010 |
Geen resultaten per leeftijdsgroep |
|
Waldner, 2018 |
Geen resultaten per leeftijdsgroep |
|
Demirdover, 2019 |
Geen resultaten per leeftijdsgroep |
|
Muir, 2010 |
Geen resultaten per leeftijdsgroep |
|
Sofianos, 2015 |
Geen resultaten per leeftijdsgroep |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-10-2023
Beoordeeld op geldigheid : 01-10-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die een mammareductie ondergaan.
Werkgroep
Drs. E.M.J. (Esther) Mesters, (voorzitter), plastisch chirurg, NVPC
Drs. M.F. (Mirjam) Hoefkens, plastisch chirurg, NVPC
Dr. C. (Corinne) Schouten, plastisch chirurg, NVPC
Dr. C.P.H. (Celien) Vreuls, patholoog, NVVP
Drs. K.M. (Katya) Duvivier, radioloog, NVvR
Drs. L.J. (Laura) Schijf, radioloog, NVvR
Drs. K. (Klaartje) Spijkers, senior adviseur patiëntbelang, Patiëntenfederatie Nederland
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
* Voorzitter |
Plastisch Chirurg
Mesters kliniek te Oisterwijk 01-12-2022 en Eyevolve-clinic te Schilde 01-12-2022 |
Geen |
Geen |
Geen actie |
|
Hoefkens |
Plastisch Chirurg - Alexander Monro Ziekenhuis (0,74 fte) |
Geen |
Geen |
Geen actie |
|
Schouten |
Plastisch chirurg in het Rijnstate Ziekenhuis in Arnhem. |
Geen |
Geen |
Geen actie |
|
Duvivier |
Radioloog AmsterdamUMC 0,8FTE |
Geen |
Geen |
Geen actie |
|
Schijf |
Radioloog AmsterdamUMC 0,7 FTE |
Geen |
Geen |
Geen actie |
|
Vreuls |
Patholoog (UMCU 0,8 FTE) |
voorzitter expert commissie mamma van de NVVP (onbetaald) |
Geen |
Geen actie |
|
Spijkers |
Senior adviseur bij MSZ Patiëntfederatie Nederland |
Geen |
Geen |
Geen actie |
|
Willeboordse |
Senior adviseur, Kennisinstituut Federatie Medisch specialisten |
Geen |
Geen |
Geen actie |
|
Van Dijk |
Junior adviseur, Kennisinstituut Federatie Medisch specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland voor de schriftelijke knelpunteninventarisatie en afvaardiging in de werkgroep. Het verslag van de knelpunteninventarisatie (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Preoperatieve beeldvorming |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Tepelsteeltechniek |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Drainbeleid |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Tranexaminezuur |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Postoperatief pathologisch onderzoek |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Organisatie van zorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die een mammareductie ondergaan. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 (((mammoplast* or mammaplast*or mastoplast*) adj3 (reduction or reductive)) or ((breast or mamma) adj1 reduction*)).ti,ab,kf. or 'breast hypertroph*'.ti,ab,kf. or (macromast* or gigantomast*).ti,ab,kf. (2957) 2 exp Mammography/ or exp Magnetic Resonance Imaging/ or exp Ultrasonography/ or (mammograph* or mamilloscop* or mammilloscop* or 'mammo graph*' or mammogram* or mastograph* or 'magnetic resonance imaging' or mri or echograph* or ultrasonograph*).ti,ab,kf. or (breast adj3 imaging).ti,ab,kf. (1161524) 3 1 and 2 (178) 4 limit 3 to ((english or dutch) and yr="2000-Current") (131) 5 4 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (121) 6 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (534633) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2197230) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3888655) 9 5 and 6 (0) – SRs 10 (5 and 7) not 9 (6) - RCTs 11 (5 and 8) not (9 or 10) (38) - observationeel 12 9 or 10 or 11 (44) 13 5 not 12 (77) – overige studiedesigns
|