Chirurgische resectie na endoscopische behandeling vroegcarcinoom maag
Uitgangsvraag
Welke patiënten komen in aanmerking voor chirurgische resectie na endoscopische behandeling voor vroegcarcinoom van de maag?
Aanbeveling
Overweeg het expanded indications model toe te passen om de keuze te maken welke patiënten wel en niet voor deze interventie in aanmerking komen. Overweeg een aanvullende resectie te verrichten indien het risico op lymfekliermetastase groter is dan het risico op chirurgische morbiditeit/mortaliteit.
De indicators voor een aanvullende resectie zijn:
- Intramucosaal carcinoom, gedifferentieerd type, </=3 cm groot, UL (þ)
- Intramucosaal carcinoom, gedifferentieerd type, >2 cm groot, UL (-)
- Intramucosaal carcinoom, ongedifferentieerd type, </=2 cm groot, UL (-)
- SM1-carcinoom (<500 mm invasie), gedifferentieerd type, </=3 cm groot
Bespreek met de patiënten die een indicatie hebben voor aanvullende chirurgische resectie de voor- en nadelen van het inzetten van chirurgische resectie na endoscopische behandeling.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een literatuuronderzoek verricht naar predictiemodellen of -factoren die voorspellen bij elke patiënten het risico groter is op lymph node metastase en tumorinvasie na endoscopische behandeling van de maagcarcinoom. Er werd een meta-analyse gevonden van 12 cohortstudies waarin factoren werden gevonden die deze twee uitkomsten voorspellen. Vanwege de opzet van de studie kon geen GRADE-analyse gedaan worden. Daarnaast werd een meta-analyse gevonden waarbij twee modellen met elkaar werden vergeleken met als uitkomstmaat incidentie van LNM. Deze studieopzet was een goede opzet voor het evalueren van dergelijke modellen. Vanwege het observationele design van de studies en gezien het feit dat de populatie Aziatisch was, kan met een zeer lage bewijskracht lastig uitspraak worden gedaan over de prestatie van deze modellen. De werkgroep concludeert dan ook dat er een kennislacune bestaat omtrent het bestaan van beslissingsmodellen voor de Nederlandse populatie welke op basis van risicofactoren voorspellen welke patiënten na endoscopische behandeling van vroegcarcinoom van de maag in aanmerking moeten komen voor chirurgische resectie.
Onderbouwing
Achtergrond
There is no clarity on which patients with early gastric carcinoma should be considered for surgical resection of the stomach to prevent lymph node metastasis in the future. There is a Japanese guideline that addresses several factors such as tumor size, tumor differentiation, and lymphovascular invasion. The question is whether these factors also apply to the patient population in the Western setting.
Conclusies / Summary of Findings
LNM incidence: The level of evidence regarding the outcome LNM incidence started at low (due to the observational nature of the included studies) and was downgraded to very low due to indirectness (the study population was Asian).
|
Very low GRADE |
The evidence is very uncertain about the performance of the expanded indicators model proposed by Abdelfatah, 2018, where
are indicators that predict LNM in EGC patients after gastrectomy.
Sources: Abdelfatah, 2018 |
Samenvatting literatuur
Description of studies
Jiang, 2020: In this systematic review and meta-analysis, a total of 12 cohort studies investigating the risk factors of lymph node metastasis (LNM) and tumor invasion were included, with in total 3015 patients. The study took place in China, and the included studies were all performed in either Japan or South-Korea. All included studies were graded as high quality
With a score of 7 to 9 on the Newcastle-Ottawa Quality Assessment Scales (NOS). No prediction value of the factors or predictive model was calculated.
Abdelfatah, 2018: in this meta-analysis a total of 12 studies (11 retrospectives and 1 prospective) were included that compared the incidence of LNM in EGC patients after gastrectomy and lymph node dissection. The total number of included patients was 9798. All of the included studies were executed in Japan, Korea or China.
Results
Preferably describe the results per outcome measure.
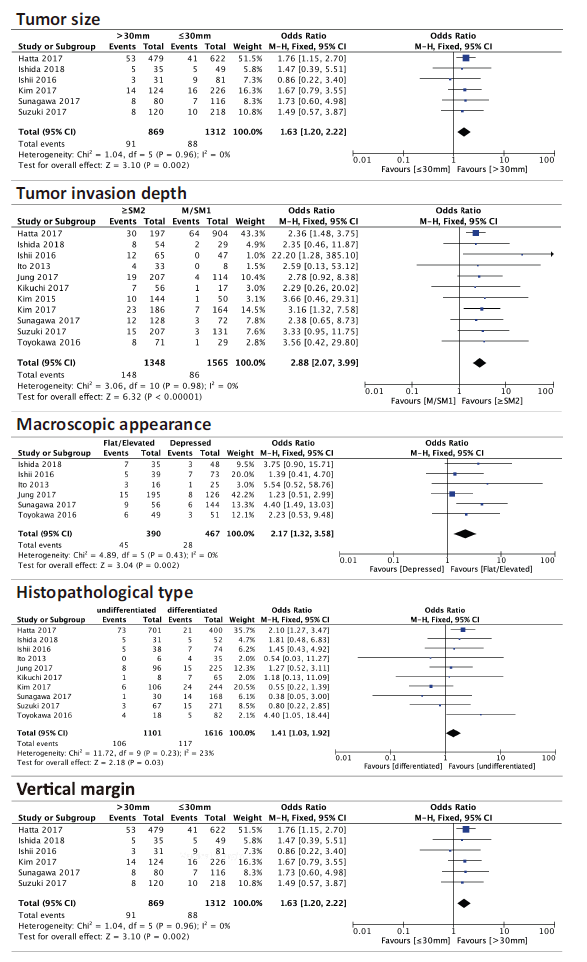
LNM: For this outcome, in Jiang, 2020 six predictive factors were found: Tumor size (the risk of LNM was significantly higher in patients with tumor size >30 mm than that of ⩽30 mm (pooled OR = 1.63, 95% CI = 1.20–2.22, p = 0.002)), tumor invasion depth (patients with tumor invasion depth ⩾ SM2 (⩾500 μm from the muscularis mucosae) had significantly higher prevalence of LNM than patients with tumor invasion depth < SM2 (pooled OR = 2.88, 95% CI = 2.07–3.99, p < 0.00001)), macroscopic appearance (patients with flat or elevated tumor macroscopic appearance had significantly higher risk of LNM than patients with depressed tumor macroscopic appearance (pooled OR = 2.17, 95% CI = 1.32–3.58, p = 0.002), histopathological type (prevalence of LNM was significantly higher in patients with histologically undifferentiated type than that of differentiated type (pooled OR = 1.41,
95% CI = 1.03–1.92, p = 0.03)), vertical margin (the prevalence of LNM was significantly
higher in patients with positive vertical margin than in patients with negative vertical
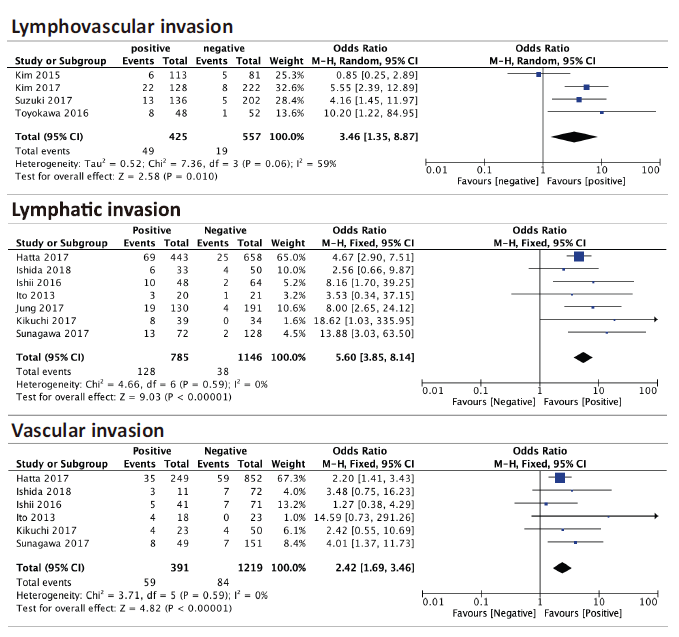
margin (pooled OR = 2.02, 95% CI = 1.50–2.73, p < 0.00001)), and lymphovasculair invasion (patients with tumor lymphovascular invasion had significantly higher risk of LNM than patients without tumor lymphovascular invasion (pooled OR = 3.46, 95% CI = 1.35–8.87, p = 0.01)). See figure 1 for the forest plots.
Figure 1: Forest plots for the relationship between LNM and tumor size, tumor invasion depth, macroscopic appearance, histopathological type and vertical margin
In Abdelfatah, 2018, In patients who underwent gastrectomy with LND, those who met the expanded criteria had a higher incidence of being diagnosed with LNM than patients who met the absolute criteria (68/9798 [0.7%] vs 6/3025 [0.2%]). The relative risk reduction when the absolute indicators were applied instead of the expanded indicators was 2.54 (1.29, 5.01) (P = .007). The expanded indicators were:
- Intramucosal cancer, differentiated type, </=3 cm in size, UL (þ) [Ex-1]
- Intramucosal cancer, differentiated type, >2 cm in size, UL (-) [Ex-2]
- Intramucosal cancer, undifferentiated type, </=2 cm in size, UL (-) [Ex-3]
- SM1 cancer (<500 mm invasion), differentiated type, </=3 cm in size [Ex-SM].
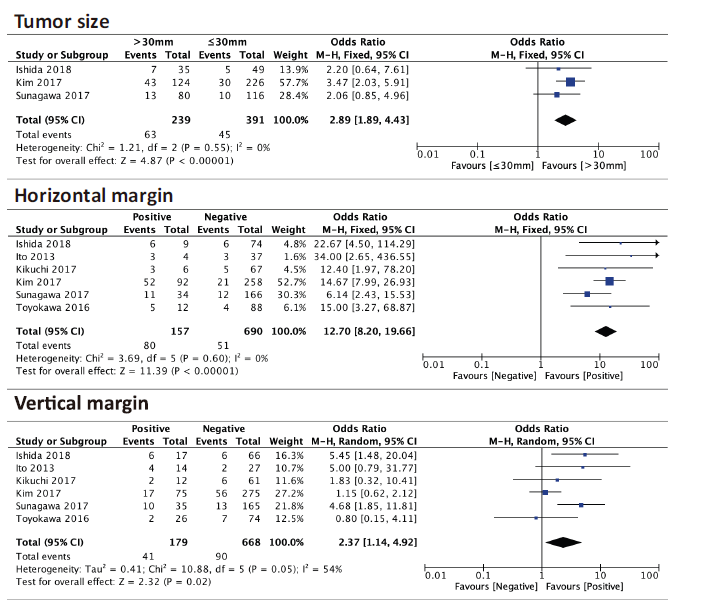
Tumor invasion: For this outcome, three predictive factors were found: Tumor size (the risk of residual tumor was significantly higher in patients with tumor size ⩾30 mm than in patients with tumor size <30 mm (pooled OR = 2.89, 95% CI = 1.89–4.43, p < 0.00001)), horizontal margin (there was a significant difference for the prevalence of residual tumor between patients with positive horizontal margin and patients with negative horizontal margin (pooled OR = 12.70, 95% CI = 8.20–19.66, p < 0.00001)), and vertical margin (the prevalence of residual tumor was significantly higher in patients with positive vertical margin than in patients with negative vertical margin (pooled OR = 2.37, 95% CI = 1.14–4.92, p = 0.02)). See figure 2 for the forest plots.
Figure 2: Forest plot for the relationship between residual tumor and tumor size, horizontal margin, and vertical margin
Overall survival: No results for this outcome was found.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: Which prognostic factors have been established for surgery after endoscopic treatment of patients with early gastric cancer (stage T1)?
Vul hier onder de belangrijkste concepten (PICO) van de zoekvraag in.
| P (Patients) | Patients with early gastric cancer (stage T1) who have been treated endoscopically |
| I (Intervention) | Prognostic factors that predict for which patients surgery is necessary in terms of residual tumor, lymph node metastasis and overall survival |
| C (Comparison) | a different model/care as usual |
| O (Outcomes) | predictive value of the factors |
| T (Timing) | after endoscopic treatment |
| S (Setting) | specialized care |
Relevant outcome measures
The guideline development group considered lymph node metastasis, residual tumor and overall survival as critical outcomes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 26-6-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 146 hits. Studies were selected based on the following criteria:
- Being a systematic review or observational study (cohort study).
- Reporting prediction factors with outcome as dependent variable and independent variables (patient characteristics) determined before the start of the procedure.
Eight studies were initially selected based on title and abstract screening. After reading the full text, 6 studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included.
Results
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- 1 - Jiang B, Zhou L, Lu J, Wang Y, Guo J. Predictors of lymph node metastasis and residual tumor in early gastric cancer patients after noncurative endoscopic resection: a systematic review and meta-analysis. Therap Adv Gastroenterol. 2020 Jun 23;13:1756284820935033. doi: 10.1177/1756284820935033. PMID: 32636929; PMCID: PMC7313346.
- 2 - Abdelfatah MM, Barakat M, Lee H, Kim JJ, Uedo N, Grimm I, Othman MO. The incidence of lymph node metastasis in early gastric cancer according to the expanded criteria in comparison with the absolute criteria of the Japanese Gastric Cancer Association: a systematic review of the literature and meta-analysis. Gastrointest Endosc. 2018 Feb;87(2):338-347. doi: 10.1016/j.gie.2017.09.025. Epub 2017 Sep 28. PMID: 28966062.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Prognostic factor(s) |
Follow-up
|
Estimates of prognostic effect |
Comments |
|
Jiang, 2020 |
Type of study: Meta-analysis of cohort studies
Setting and country: Department of General Surgery, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Bejing, China
Funding and conflicts of interest: The study was supported by the National Natural Science Foundation of China (grant number 81972324), the China Academy of Medical Sciences Innovation Fund for Medical Sciences (grant number 2016-I2M-3-019).
The authors have declared no conflicts of interest. |
Inclusion criteria: (1) study design (randomized controlled trial, cohort, or case–control); (2) articles published in English; (3) patients underwent noncurative ER for EGC, with noncurative resection defined by the Japanese gastric cancer treatment guidelines 2010 (version 3);9 (4) patients underwent additional gastrectomy after noncurative ER; (5) adequate information about risk factor for LNM and residual tumor, with available data for extraction to calculate the pooled odds ratio (OR) or mean difference (MD).
Exclusion criteria: Abstracts, case reports, reviews, letters to editor, editorials, expert opinions, conference abstracts, or meeting proceedings were excluded.
N= 3015
Potential confounders or effect modifiers: None mentioned.
|
Describe prognostic factor(s) and method of measurement:
Risk factors for LNM:
Risk factors for residual tumor:
|
Duration or endpoint of follow-up: Not reported
For how many participants were no complete outcome data available? Not reported
Reasons for incomplete outcome data described? Not reported |
(Adjusted) Factor-outcome associations (include SEs or 95%CI and p-value if available): See table 1 and 2
Incremental predictive value1: None reported
|
|
|
Abdelfatah, 2018 |
Type of study: Meta-analysis
Setting and country: Division of Gastroenterology, Department of Internal Medicine, East Carolina University, Greenville, North Carolina
Funding and conflicts of interest: Last author is a consultant for Olympus and Boston Scientific. All other authors disclosed no financial relationships relevant to this publication.
|
Inclusion criteria: (1) Patients included in the study were diagnosed with EGC by histopathology, and they underwent gastrectomy with LND. (2) Sufficient data were presented on the lesion, including depth of invasion, size, ulceration, and differentiation, in order to categorize the patients into expanded criteria versus absolute criteria. (3) Adequate details were provided on the total number of patients and percentage of patients involved.
Exclusion criteria: (1) Publications including meeting abstracts, case reports, review articles, letters to the editor, comments, and editorials. (2) Patients without EGC but with other lesions, such as a precancerous lesion, adenoma, or metastatic gastric cancer and studies referring to patients with recurrent EGCs. (3) Insufficient data provided in the article regarding the details of the lesions to categorize them into expanded criteria versus absolute criteria. (4) Articles that did not report on the frequencies of LNM.
N=9798
Potential confounders or effect modifiers: None mentioned. |
Describe prognostic factor(s) and method of measurement:
Two models were compared:
type, >2 cm in size, UL (-) [Ex-2] Intramucosal cancer, undifferentiated type, </=2 cm in size, UL (-) [Ex-3] SM1 cancer (<500 mm invasion), differentiated type, </=3 cm in size [Ex-SM] |
Duration or endpoint of follow-up: Not reported
For how many participants were no complete outcome data available? Not reported
Reasons for incomplete outcome data described? Not reported |
(Adjusted) Factor-outcome associations (include SEs or 95%CI and p-value if available): In patients who underwent gastrectomy with LND, those who met the expanded criteria had a higher incidence of being diagnosed with LNM than patients who met the absolute criteria (68/9798 [0.7%] vs 6/3025 [0.2%]). The relative risk reduction when the absolute criteria were applied instead of the expanded criteria was 2.54 (1.29, 5.01) (P = .007)
Incremental predictive value1: None reported
|
|
Risk of bias table
|
Study reference
(first author, year of publication) |
Study participation1
Study sample represents the population of interest on key characteristics?
(high/moderate/low risk of selection bias) |
Study Attrition2
Loss to follow-up not associated with key characteristics (i.e., the study data adequately represent the sample)?
(high/moderate/low risk of attrition bias) |
Prognostic factor measurement3
Was the PF of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to PF) |
Outcome measurement3
Was the outcome of interest defined and adequately measured?
(high/moderate/low risk of measurement bias related to outcome) |
Study confounding4
Important potential confounders are appropriately accounted for?
(high/moderate/low risk of bias due to confounding) |
Statistical Analysis and Reporting5
Statistical analysis appropriate for the design of the study?
(high/moderate/low risk of bias due to statistical analysis) |
|
Jiang, 2020 |
Low risk of bias |
Unclear |
Low risk of bias |
Low risk of bias |
Unclear |
Low risk of bias |
|
Abdelfatah, 2018 |
Low risk of bias |
Unclear |
Low risk of bias |
Low risk of bias |
Unclear |
Low risk of bias |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Chang, 2018 |
Wrong outcome (invasion depth) |
|
Dai, 2015 |
Wrong outcome (endoscopic treatment) |
|
Hasuike, 2018 |
Wrong study design (no prognostic models) |
|
Liu, 2021 |
Wrong outcome (serosial invasion) |
|
Tsolakis, 2019 |
Wrong population (gastric neuroendocrine neoplasms type 1) |
|
Yang, 2022 |
Wrong study design (no prognostic models) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-12-2024
Beoordeeld op geldigheid : 01-09-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van het cluster) die betrokken zijn bij de zorg voor patiënten met oesofagus- en maagcarcinoom.
Het cluster oesofagus- en maagcarcinoom bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. Het cluster oesofagus- en maagcarcinoom bestaat uit de volgende personen:
Clusterstuurgroep
- Dhr. Prof. Dr. P.D. (Peter) Siersema (voorzitter), maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
- Mevr. Dr. R.E. (Roos) Pouw, maag-darm-leverarts, Amsterdam UMC, Amsterdam; NVMDL
- Mevr. Dr. A. (Annemarieke) Bartels – Rutten, radioloog, NKI-AVL, Amsterdam; NVvR
- Dhr. Prof. Dr. M.I. (Mark) van Berge Henegouwen, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Dhr. Prof. Dr. R. (Richard) van Hillegersberg, chirurg, UMC Utrecht, Utrecht; NVvH
- Dhr. M.C.C.M. (Maarten) Hulshof MD PhD, Radiotherapeut, Amsterdam UMC, Amsterdam; NVRO (neemt geen deel meer)
- Mevr. Dr. H.W.M. (Hanneke) van Laarhoven, internist, Amsterdam UMC, Amsterdam; NIV
- Mevr. Dr. E.M. (Liesbeth) Timmermans, bestuurslid Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal; SPKS (tot 1 december 2023)
- Dhr. Dr. E. (Erik) Vegt, nucleair geneeskundige, Erasmus MC, Rotterdam; NVNG
Clusterexpertisegroep
- Dhr. Drs. W.W. (Weibel) Braunius, keel-neus-oorarts, UMC Utrecht, Utrecht; NVKNO
- Mevr. Dr. M.J. (Marc) van Det, chirurg, Ziekenhuisgroep Twente; NVvH
- Mevr. Dr. S.S. (Suzanne) Gisbertz, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Mevr. Dr. N.C.T. (Nicole) van Grieken, patholoog, Amsterdam UMC, Amsterdam; NVVP
- Dhr. R. (Ronald) Hoekstra, internist, Ziekenhuisgroep Twente; NIV
- Dhr. R. (Remco) Huiszoon MBA, ervaringsdeskundige en bestuurslid Stichting voor Patiënten met kanker aan het Spijsverteringskanaal excl. darmkanker; SPKS
- Dhr. P.M. (Paul) Jeene MD, radiotherapeut, Radiotherapiegroep; NVRO
- Dhr. Dr. S.M. (Sjoerd) Lagarde, chirurg, Erasmus MC, Rotterdam; NVvH
- Dhr. Dr. R.W.F. (Roelof) van Leeuwen, ziekenhuisapotheker, Erasmus MC, Rotterdam; NVZA
- Dhr. Dr. S.L. (Sybren) Meijer, patholoog, Amsterdam UMC, Amsterdam; NVVP
- Mevr. B. (Bianca) Mostert, internist, Erasmus MC, Rotterdam; NIV
- Mevr. C.T. (Kristel) Muijs MD PhD, radiotherapeut, UMCG, Groningen; NVRO
- Mevr. L. (Luidmila) Peppelenbosch – Kodach, patholoog, NKI-AVL, Amsterdam; NVVP
- Mevr. Drs. H. (Heidi) Rütten, radiotherapeut, Radboud UMC, Nijmegen; NVRO
- Mevr. M. (Marije) Slingerland, internist, LUMC, Leiden; NIV
- Mevr. Prof. Dr. V.M.C.W. (Manon) Spaander, maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
- Mevr. M.E. (Manon) Dik, verpleegkundig specialist, Ziekenhuisgroep Twente; V&VN
- Dhr. C.C.G. (Carlo) Schippers, verpleegkundig specialist, UMC Utrecht, Utrecht; V&VN
Met ondersteuning van:
- Mevr. S.N. (Sarah) van Duijn MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. M. (Miriam) te Lintel Hekkert MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. Dr. C.M.W. (Charlotte) Gaasterland, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Siersema (Voorzitter) |
MDL-arts en Hoofd Endoscopisch Centrum, Radboud University Medical Center
|
Editor in Chief, Endoscopy |
Research funding/advisory board zonder invloed op deze richtlijn |
Geen restrictie |
|
Pouw (tijdelijke voorzitter) |
MDL-arts Amsterdam UMC |
Bestuurslid DUCG - onbetaald. Bestuurslid young ISDE - onbetaald. Bestuurslid Barrett Expertise Centra - onbetaald. Lid beoordelingscommissie ontwikkeling en implementatie KWF - onbetaald. Nationaal afgevaardigde NVMDL voor UEG - onbetaald. Projectleider KWF (PREFER studie). Studie protocol (inclusief inclusie criteria) PREFER studie staat vast. Publicatie resultaten worden pas over vijf jaar verwacht, ruim na datum publicatie richtlijnmodule endoscopische behandeling vroegcarcinoom maag. |
Betaalde deelname aan onderwijscursus georganiseerd door Medtronic Betaald adviseurschap voor Medtronic BV. (scholing en webminar endoscopische behandeling vroege afwijking in slokdarm, geen belang bij gebruik producten) Betaald adviseurschap voor MicroTech Europe (webminar, symposium, m.n. behandeling van lekkages na slokdarmoperaties) |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module;
|
|
Timmermans |
- Bestuurslid SPKS (Stichting voor Patiënten met kanker aan het Spijsverteringskanaal) 5 uur per week - Gedragswetenschappelijk docent huisartsenopleiding Eerstelijnsgeneeskunde Radboudumc |
Onbetaald vrijwilligerswerk Bestuurslid SPKS (15 uur per week) |
Geen |
Neemt geen deel meer aan cluster - Geen restrictie
|
|
Van Laarhoven |
Hoofd afdeling medische oncologie, Amsterdam UMC |
- Wetenschappelijke raad KWF (onbetaald) - Voorzitter ESMO upper GI faculty (onbetaald) - Lid ESMO Leadership Generation programme (onbetaald) - Lid EORTC upper GI strategy commiittee (onbetaald) |
- Consultant or advisory role: Amphera, AstraZeneca, Beigene, BMS, Daiichy-Sankyo, Dragonfly, Eli Lilly, MSD, Nordic Pharma, Servier - Research funding and/or medication supply: Bayer, BMS, Celgene, Janssen, Incyte, Eli Lilly, MSD, Nordic Pharma, Philips, Roche, Servier - Speaker role: Astellas, Benecke, Daiichy-Sankyo, JAAP, Medtalks, Novartis, Travel Congress Management B.V Employment and leadership: Amsterdam UMC, the Netherlands (head of the department of medical oncology) Honorary: ESMO (chair upper GI faculty) |
Geen restrictie |
|
Bartels |
Radioloog, Antoni van Leeuwenhoek |
Geen |
Geen |
Geen restrictie |
|
Van Berge Henegouwen |
Chirurg slokdarm en maagchirurgie Amsterdam UMC Hoogleraar slokdarm en maagchirurgie Universiteit van Amsterdam |
- bestuur DUCA, DICA en voorzitter werkgroep Upper GI (allen onbetaald). |
- Olympus financiering studie (researcher initiated grant) Stryker financiering studie (researcher initiated grant) uitkomsten richtlijn geen invloed op deze bedrijven of studies - Consultancy voor meerdere bedrijven (B. Braun en Viatris) (uitbetaling aan Amsterdam UMC), niet gerelateerd aan richtlijn. |
Geen restrictie |
|
Hulshof |
Radiotherapeut oncoloog Amsterdam UMC |
Geen |
Geen |
Neemt geen deel meer aan cluster - Geen restrictie |
|
Van Hillegersberg |
Chirurg, UMC Utrecht |
Proctor Intuitive Surgical Consultant Medtronic |
- Bestuur DUCA, DICA |
Geen restrictie |
|
Vegt |
Nucleair geneeskundige, Afdeling Radiologie en Nucleaire Geneeskunde, Erasmus MC, Rotterdam |
Geen |
- ZonMW-subsidie voor de PLASTIC-studie, programma doelmatigheid van zorg, naar de kosten-effectiviteit van FDG-PET/CT en laparoscopie bij maagcarcinoom. |
Geen restrictie |
|
Van Rossum |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
Clusterexpertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Huiszoon |
ING Bank N.V. Agile coach expert, full-time |
Buddy voor slokdarmkanker patiënten bij het SPKS, onbetaald. Vanuit persoonlijke ervaring 'klankbord' zijn voor patiënten die nu dezelfde ziekte hebben als ik in 2017 heb gehad |
Neemt deel namens SPKS en hoopt vanuit dat perspectief als ervaringsdeskundige bij te kunnen dragen. Geen boegbeeldfunctie of ander belang |
Geen restrictie |
|
Braunius |
Oncologisch Hoofd-Halschirurg UMC Utrecht Cancer Center |
Geen |
Geen |
Geen restrictie |
|
Van Leeuwen |
Ziekenhuisapotheker - Erasmus MC Afdelingen Apotheek (80%) en Interne Oncologie (20%) |
SIG Oncologie NVZA - onbetaald Werkgroep Geneesmiddel Interacties NVZA/KNMP (betaald "onkosten") Onderwijs PAO Farmacie (betaald "onkosten") |
Industrie: Geneesmiddelen onderzoek i.s.m. Roche, Astellas, BMS, Servier, Boehringer (unrestricted research grants) Fondsen: Stichting Coolsingel, Stichting de Merel, Stichting Mitialto Geen conflict of interest |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; b) Werkgroeplid werkt tenminste samen met een ander werkgroeplid met vergelijkbare expertise in alle fasen (studieselectie, data-extractie, evidence synthese, evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces; c) In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken; d) Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen) |
|
Jeene |
Radiotherapeut - Oncoloog bij Radiotherapiegroep PhD candidate - AmsterdamUMC ( 0 uren aanstelling) |
Bestuurslid DUCG - onbetaald |
Studie coördinator en eerste auteur POLDER trail (effectiviteit kortdurende uitwendige radiotherapie, geen externe financiering). PICO is anders dan studie |
Geen restrictie |
|
Gisbertz |
Slokdarmkanker en maagkanker chirurg - Amsterdam UMC |
Bestuur ESDE, NVGIC, ISDE, research commitee EAES, de Groene OK: allen onbetaald |
Extern gefinancierd onderzoek: KWF: SQA n observational studies (projectleider) CCA: USPIO enhanced MRI in esophageal cancer (projectleider) |
Geen restrictie |
|
Lagarde |
Chirug, Erasmus MC, Rotterdam |
- lid wetenschappelijke commissie DKCA - bestuurslid werkgroep Upper Gi beiden onbetaald |
Geen |
Geen restrictie |
|
Hoekstra |
Internist-oncoloog, Ziekenhuisgroep Twente (ZGT) |
Lid Concillium Medicinae Internae (onbetaald) |
- Als internist-oncoloog betrokken bij inclusie van patiënten in klinische studies bij oesofagus- en maagcarcinoom. Op dit moment Critics-2 studie en Lyrics studie |
Geen restrictie |
|
Van Det |
Gastro-intestinaal chirurg Ziekenhuis groep Twente (ZGT) |
- Proctor/Instructor voor Intuitive Surgical betreffende Robot-Assisted operaties in de upper-GI zoals: - Slokdarm resecties - Maagresecties - Hernia diafragmatica. |
Geen |
Geen restrictie |
|
Rütten |
Radiotherapeut, Radboud UMC |
Geen |
Geen |
Geen restrictie |
|
Van Grieken |
Patholoog, Amsterdam UMC (locatie Vumc), Amsterdam |
Detachering Expertisepanel poliepen BVO-DK, Screeningsorganisatie BVO darmkanker (3 uur/week) |
- KWF - Identificatie van markers voor response op immunotherapie - projectleider - KWF - CRITICS-II klinische trial voor resectabel maagcarcinoom - ZonMW - Effect van chemotherapie bij patienten met microsatelliet instabiel resectabel maagcarcinoom. – projectleider - advisory boards van BMS, MSD |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Mostert |
Internist-oncoloog, Erasmus MC |
Consultancy voor: BMS, Lilly, Servier |
- BMS: fase 2 studie: nivolumab tijdens actieve surveillance slokdarmcarcinoom Sanofi: cabazitaxel bij AR-v7 positieve prostaatcarcinoom patiënten Pfizer: DLA bij mammacarcinoompatiënten behandeld met CDK4/6 De f1/2 studie betreft research support`; investigator initiated studie waarvoor BMS de medicatie “schenkt” Astra zeneca betreft advisory board. |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Slingerland |
Internist-oncoloog LUMC |
Geen |
- Advisory board Lilly, Astra Zeneca en BMS |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; |
|
Spaander |
MDL-arts 1.0 Fte in Erasmus Universiteit MC (betaald) Voor 6 uur per week gedetacheerd aan de screeningorganisatie voor het BVO darmkanker (betaald) |
Voorzitter NVMDL en NVGE oncologie commissie (onbetaald) |
ZonMW: Gender differencees in Barrett Surveillance, projectleidersrol. Capsulomics: Biomarkers in Barrett slokdarm, projectleidersrol. Lucid: Non-ionvasive tool for Barrett surveillance. Microtech: New Esophageal stent. CELTIC: Blood test bij FIT +patiënten
|
Geen restrictie |
|
Meijer |
Patholoog, Amsterdam UMC |
Geen |
Geen |
Geen restrictie |
|
Peppelenbosch - Kodach |
Patholoog, NKI/AVL |
Geen |
Deelname studie inter-observer variabiliteit voor PD-L1 CPS in maagcarcinomen, gefinancierd door BMS, fee naar de werkgever AVL/NKI |
Geen restrictie |
|
Muijs |
Radiotherapeut-Oncoloog Universitaire Medisch Centrum Groningen |
Lid wetenschapscommissie DUCA (Gemandateerde NVRO) Lid werkgroep indicatie protocol protonen radiotherapie (NVRO) |
Project Leider Models Project (KWf funded): ontwikkelen en valideren predictiemodellen voor complicaties na CRT en resectie Principle investigator CLARIFY studie (KWF funded): Observationeel onderzoek naar pulmonale hupertensie als complicatie na thoracale RT Participatie in PROTECT studie (EU funded): RCT fase 3: fotonen vs protonen bij nCRT voor oesofaguscarcinoom Voortrekker protonen RT bij het oesofaguscarcinoom |
Geen restrictie |
|
Dik |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
|
Schippers |
[volgt] |
[volgt] |
[volgt] |
[volgt] |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van de Stichting voor Patiënten met kanker aan het Spijsverteringskanaal (SPKS). De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan SPKS en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
‘Chirurgische resectie na endoscopische behandeling vroegcarcinoom maag’ (maagcarcinoom) |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in juni 2021.
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze module is geprioriteerd door het cluster.
Voor de geprioriteerde modules zijn door het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Het cluster definieerde klinisch (patiënt) relevante verschillen, tenminste voor de cruciale uitkomstmaten.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen.
De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID).
Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Zoekverantwoording
Ontdubbelen
|
Database |
Aantallen treffers |
Aantallen treffers na ontdubbelen |
|
Medline 26 jun 2023 |
852 |
851 |
|
Embase 26 jun 2023 |
751 |
231 |
|
Totaal |
1603 |
1082 |
Aantal SRs: 61; aantal RCT’s: 85; aantal Observationele studies: 936.
OVID/Medline 26 juni 2023
Ovid MEDLINE(R) ALL <1946 to June 22, 2023>
|
1 |
Stomach Neoplasms/ or linitis-plastica.ti,ab,kf. or ((carcinoma* or neoplas* or adenoma* or adenocarcinoma* or tumor* or tumour* or cancer* or oncolog* or malignan* or carcinogen* or oncogen* or anticarcinogen* or squamous*) adj5 (stomach or gastric* or cardia or gastroesophag* or gastrooesophag* or oesogast* or esogast*)).ti,ab,kf. |
156252 |
|
2 |
(t1 or t1a or t1b or t-1 or t-1a or t-1b or n1 or n-1 or type-1 or type-1a or type-1b or ((early or earliest or first or 1st) adj3 (tumor* or tumour* or type or stage or stages or staging* or phase* or tnm))).ti,ab,kf. |
813964 |
|
3 |
Endoscopy/ or exp Laryngoscopy/ or exp Endoscopy, Gastrointestinal/ or (endoscop* or gastroscop* or laryngoscop*).ti,ab,kf. |
336017 |
|
4 |
Surgery.sh. or exp Surgical Procedures, Operative/ or (surger* or surgical* or operation* or operative* or resecti* or gastrectom*).ti,ab,kf. |
5067831 |
|
5 |
1 and 2 and 3 and 4 |
1623 |
|
6 |
5 not ((Adolescent/ or Child/ or Infant/) not Adult/) |
1617 |
|
7 |
6 not ((exp animals/ or exp models, animal/) not humans/) |
1603 |
|
8 |
7 not (comment/ or editorial/ or letter/ or Case Reports/) |
1327 |
|
9 |
limit 8 to yr="2000 -Current" |
1086 |
|
10 |
(systematic-review.pt. or (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.)) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
641137 |
|
11 |
9 and 10 |
50 |
|
12 |
exp randomized controlled trial/ or random*.ti,ab,kf. or ((pragmatic or practical) adj clinical trial*).ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1562198 |
|
13 |
(9 and 12) not 11 |
69 |
|
14 |
exp Epidemiologic Studies/ or (cohort or (case adj5 (control or controll* or comparison or referent)) or risk or causation or causal or odds-ratio or etiol* or aetiol* or natural-history or predict* or prognos* or outcome or course or retrospect* or followup or follow-up).ti,ab,kf. |
8510133 |
|
15 |
(9 and 14) not (11 or 13) |
733 |
Embase.com 26 juni 2023
|
No. |
Query |
Results |
|
#15 |
#9 AND #14 NOT (#11 OR #13) |
748 |
|
#14 |
'epidemiology'/de OR 'prospective study'/exp OR 'cohort analysis'/exp OR cohort:ti,ab,kw OR ((case NEAR/5 (control OR controll* OR comparison OR referent)):ti,ab,kw) OR risk:ti,ab,kw OR causation:ti,ab,kw OR causal:ti,ab,kw OR 'odds ratio':ti,ab,kw OR etiol*:ti,ab,kw OR aetiol*:ti,ab,kw OR 'natural history':ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw OR outcome:ti,ab,kw OR course:ti,ab,kw OR retrospect*:ti,ab,kw OR 'case control':ti,ab,kw OR 'multivariate':ti,ab,kw OR followup:ti,ab,kw OR 'follow up':ti,ab,kw |
11219517 |
|
#13 |
#9 AND #12 NOT #11 |
64 |
|
#12 |
'randomized controlled trial'/exp OR random*:ti,ab,kw OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab,kw) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab,kw) |
2063103 |
|
#11 |
#9 AND #10 |
58 |
|
#10 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
715688 |
|
#9 |
#7 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) AND [2000-2023]/py |
1116 |
|
#8 |
#7 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) |
1329 |
|
#7 |
#6 NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
2564 |
|
#6 |
#5 NOT (('adolescent'/exp OR 'child'/exp) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp)) |
2587 |
|
#5 |
#1 AND #2 AND #3 AND #4 |
2602 |
|
#4 |
'surgery'/exp OR surger*:ti,ab,kw OR surgical*:ti,ab,kw OR operation*:ti,ab,kw OR operative*:ti,ab,kw OR resecti*:ti,ab,kw OR gastrectom*:ti,ab,kw |
7289401 |
|
#3 |
'endoscopy'/de OR 'digestive tract endoscopy'/de OR 'esophagogastroduodenoscopy'/de OR 'gastrointestinal endoscopy'/de OR 'pharyngoscopy'/de OR 'laryngoscopy'/exp OR endoscop*:ti,ab,kw OR gastroscop*:ti,ab,kw OR laryngoscop*:ti,ab,kw |
509334 |
|
#2 |
t1:ti,ab,kw OR t1a:ti,ab,kw OR t1b:ti,ab,kw OR 't 1':ti,ab,kw OR 't 1a':ti,ab,kw OR 't 1b':ti,ab,kw OR n1:ti,ab,kw OR 'n 1':ti,ab,kw OR 'type 1':ti,ab,kw OR 'type 1a':ti,ab,kw OR 'type 1b':ti,ab,kw OR (((early OR earliest OR first OR 1st) NEAR/3 (tumor* OR tumour* OR type OR stage OR stages OR staging* OR phase* OR tnm)):ti,ab,kw) |
1149161 |
|
#1 |
'stomach tumor'/exp OR 'linitis plastica':ti,ab,kw OR (((carcinoma* OR neoplas* OR adenoma* OR adenocarcinoma* OR tumor* OR tumour* OR cancer* OR oncolog* OR malignan* OR carcinogen* OR oncogen* OR anticarcinogen* OR squamous*) NEAR/5 (stomach OR gastric* OR cardia OR gastroesophag* OR gastrooesophag* OR oesogast* OR esogast*)):ti,ab,kw) |
234154 |