Peroxygenatie
Uitgangsvraag
Wat is de waarde van peroxygenatie bij de vitaal bedreigde patiënt die buiten de operatiekamer geïntubeerd wordt?
Aanbeveling
Overweeg het toepassen van actieve of passieve peroxygenatie tijdens de apneufase van de intubatie van een vitaal bedreigde patiënt buiten de operatiekamer om daarmee desaturatie en de complicaties daarvan te voorkomen.
Houd bij de keuze voor een peroxygenatietechniek rekening met de (relatieve) indicaties en contra-indicaties (zie de tabel in de overwegingen).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek gedaan naar verschillende methodes van pre- en peroxygenatie bij vitaal bedreigde patiënten die geïntubeerd worden buiten de operatiekamer. Preoxygenatie is beschreven in de module preoxygenatie . De gunstige en ongunstige effecten van peroxygenatie werden vergeleken met standaard zorg zonder peroxygenatie. Omdat pre- en peroxygenatie vaak met elkaar verweven zijn, is in de analyse alleen gebruik gemaakt van publicaties waarin het effect van peroxygenatie kan worden onderscheiden. Er zijn vijf gerandomiseerde onderzoeken geïncludeerd. Op basis van de technieken gebruikt in de onderzoeken, heeft de werkgroep ervoor gekozen actieve en passieve peroxygenatie afzonderlijk te analyseren. Als cruciale uitkomstmaat werd incidentie van lage SpO2 meegenomen. Als belangrijke uitkomstmaten is gekeken naar laagste SpO2 tijdens intubatie hypotensie, hartstilstand, aspiratie en mortaliteit.
Actieve peroxygenatie, dat wil zeggen beademing met masker en ballon in de periode tussen inductie en laryngoscopie, lijkt de kans op een lage SpO2 te verminderen, maar geen verbetering van de laagste SpO2 tijdens intubatie te geven (lage bewijskracht). De uitkomstmaten mortaliteit, hypotensie, aspiratie en hartstilstand konden geen richting geven aan de besluitvorming door het ontbreken van data of een zeer lage bewijskracht.
Passieve peroxygenatie, dat wil zeggen zuurstoftoediening zonder beademing in de periode tussen inductie en tracheale intubatie, de zogenaamde apneu oxygenatie, lijkt de kans op een lage SpO2 te verminderen, maar geen verbetering van de laagste SpO2 tijdens intubatie te geven (lage bewijskracht). De uitkomstmaten mortaliteit, hypotensie, aspiratie en hartstilstand konden geen richting geven aan de besluitvorming door het ontbreken van data of een zeer lage bewijskracht. De bewijskracht van de cruciale uitkomstmaat is laag. Hier ligt een kennisvraag.
Op basis van de literatuur lijkt het wel voordelig om een vorm van peroxygenatie toe te passen, maar kan geen uitspraak gedaan worden welke techniek de voorkeur verdient. Het is belangrijk op te merken dat pre- en peroxygenatie in de studies niet strikt gescheiden zijn, omdat het voor sommige technieken logisch is die te continueren.
De meest efficiënte manier om zuurstof in de longen te krijgen wanneer een patiënt die tracheaal geïntubeerd wordt stopt met ademhalen, is door middel van positieve drukbeademing. Tegelijkertijd is positieve drukbeademing tijdens de apneufase een risicofactor voor aspiratie: lucht kan in de maag geblazen worden en vervolgens, indien de patiënt ‘niet nuchter’ is ,als de maag niet leeg is, leiden tot regurgitatie en, vanwege het afwezig zijn van luchtwegbeschermende reflexen, aspiratie. Voor wat betreft vitaal bedreigde patiënten was lange tijd de overheersende gedachte dat zij vanwege een vertraagde maagontlediging als ‘niet nuchter’ beschouwd dienen te worden en daarom bij voorkeur niet beademd tijdens de apneufase.
De studie van Casey laat echter zien dat met beademing in deze fase de kans op desaturatie significant lager is zonder dat dit gepaard gaat met een grotere kans op aspiratie.
Hierbij zijn twee kanttekeningen te plaatsen. Allereerst is het aantal patiënten in deze studie niet gepowerd op aspiratie zodat het nog steeds kan zijn dat beademing de kans op aspiratie verhoogt. Ten tweede zijn twee groepen patiënten geëxcludeerd: 1) de patiënten die volgens de geldende richtlijnen een indicatie hadden voor beademing tijdens de apneufase, namelijk patiënten met (ernstige) hypoxemie, patiënten met (ernstige) acidose en patiënten met een verhoogde intracraniële druk, en 2) de patiënten die een contra-indicatie hadden voor beademing vanwege een evident aspiratie risico: patiënten met een volle maag (recente maaltijd of ileus) of een bloeding van de bovenste tractus digestivus. De resultaten van onze analyse naar de rol van peroxygenatie door middel van beademing zijn dus niet van toepassing op deze twee groepen patiënten.
Tijdens de ontwikkelingsfase van deze module verschenen de resultaten van de PREOXI studie (Gibbs, 2024). In deze studie is in de interventiegroep NIV gebruikt ten behoeve van preoxygenatie maar vervolgens ook gecontinueerd als peroxygenatietechniek. De incidentie van desaturatie was in de NIV groep significant lager dan in de controlegroep die geen NIV kreeg en ook geen beademing tijdens de apneufase. Het lijkt aannemelijk dat er een gunstig effect is van zowel de preoxygenatie als de peroxygenatie met NIV, maar vanwege de opzet van de studie is de bijdrage aan elke fase niet te differentiëren. Wel laat deze studie zien dat NIV een optie is voor actieve peroxygenatie.
Apneu-oxygenatie, de andere techniek die gebruikt kan worden voor peroxygenatie, geeft geen (extra) verhoging van de kans op aspiratie en kan daardoor wel ingezet worden bij patiënten waarvan het aspiratierisico als hoog ingeschat wordt. Ook apneu-oxygenatie is echter niet algemeen toepasbaar. Zo is bij patiënten met aangezichtsfracturen of (verdenking op) een schedelbasisfractuur het plaatsen van een nasale zuurstofcanule ten behoeve van de zuurstoftoediening gecontra-indiceerd en kan er bij deze patiënten ook geen nasopharyngeale tube gebruikt worden om de luchtweg vrij te houden. Deze patiënten zijn daarom in de studies naar apneu-oxygenatie die wij geanalyseerd hebben geëxcludeerd.
Verder is in al deze studies onduidelijk hoe patiënten met (ernstige) hypoxemie, patiënten met (ernstige) acidose en patiënten met een verhoogde intracraniële druk behandeld zijn. Werden zij geëxcludeerd of werden zij volgens de geldende richtlijnen behandeld met positieve druk beademing tijdens de apneufase, al dan niet in combinatie met nasale zuurstoftoediening?
Het is evident dat apneu-oxygenatie onder bepaalde omstandigheden en bij bepaalde patiëntencategorieën de veilige apneu tijd fors kan verlengen (White, 2017). De fysiologie hiervan is dat tijdens apneu het volume zuurstof dat vanuit de alveoli naar het bloed diffundeert (veel) groter is dan het volume koolzuurgas dat vanuit het bloed naar de alveoli gaat (omdat CO2 veel beter oplosbaar is in bloed en weefsel). Hierdoor ontstaat er onderdruk in de alveoli en kan er, indien de luchtweg vrij is, zuurstof vanuit de hogere luchtwegen naar de alveoli stromen (Fayed, 2023). Essentieel voor maximale passieve oxygenatie is dan ook een vrije luchtweg gedurende de gehele apneufase, hetzij door het toepassen van een jaw thrust manoeuvre, hetzij door een nasopharyngeale tube. Tijdens de intubatie(poging) zelf draagt de laryngoscopie bij aan het vrijhouden van de luchtweg. Voor maximaal resultaat is tevens een goede preoxygenatie vereist (Fayed, 2023).
In de literatuur wordt gesuggereerd dat apneu-oxygenatie minder effectief is bij patiënten met hypoxisch respiratoir falen omdat bij deze patiënten de zuurstofdiffusie vanuit de alveoli naar het bloed gestoord is (White, 2017). Dierexperimenteel onderzoek laat echter zien dat bij gestoorde zuurstofdiffusie in de long apneu-oxygenatie nog steeds bijdraagt aan het verlengen van de tijd tot ernstige desaturatie (Engström, 2010).
De meeste winst van apneu oxygenatie is uiteraard te verwachten bij langere intubatieprocedures, zoals bij patiënten met een moeilijke luchtweg. Voor zover dat te voorspellen is, kan dat een extra argument zijn om apneu-oxygenatie toe te passen.
Al met al adviseert de werkgroep om de keuze voor een peroxygenatie techniek te laten afhangen van de kenmerken van de individuele patiënt. Onderstaande tabel met (relatieve) indicaties en contra-indicaties kan daarbij een hulpmiddel zijn.
Tabel Actieve en passieve peroxygenatietechnieken
|
PEROXYGENATIETECHNIEK |
Actief: beademing |
Passief: apneu oxygenatie |
|
Indicaties |
- kan bij elke intubatie toegepast worden tenzij gecontra-indiceerd - (ernstige) hypoxemie - (ernstige) acidose - verhoogde intracraniële druk |
- kan bij elke intubatie toegepast worden tenzij gecontra-indiceerd - verwachte langdurige/moeilijke intubatie |
|
Contra-indicaties |
- evident aspiratierisico zoals bij recente maaltijd, ileus of bloeding van de bovenste tractus digestivus |
- aangezichtsfracturen en/of (verdenking op) schedelbasisfractuur waardoor nasale canule onmogelijk of gecontra-indiceerd is |
|
Uitvoering |
- masker-ballon beademing of NIV - gebruik lage drukken en streef naar minimale thoraxexcursies |
- zuurstofflow minimaal 15 L/min - continueer HFNO indien al in gebruik vóór de intubatie - draag gedurende de gehele apneufase zorg voor een vrije doorgang van de toegediende zuurstof naar de trachea. Opties: jaw thrust manoeuvre, nasopharyngeale tube |
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het betreft hier een acute interventie in een levensbedreigende situatie. Het doel van peroxygenatie is het minimaliseren van de risico’s van de interventie, namelijk het luchtwegmanagement. In deze acute setting is het van belang dat de hulpverlener zelf de keuze voor de techniek van peroxygenatie maakt, op basis van wetenschappelijke bewijs, de beschikbaarheid van de materialen op de betreffende locatie en de ervaring van de zorgverleners. Een protocol voor een gestandaardiseerd methode van peroxygenatie die binnen het ziekenhuis bij de spoedintubatie van vitaal bedreigde patiënten gebruikt wordt, is voor de patiëntveiligheid belangrijk.
Kosten (middelenbeslag)
De geformuleerde adviezen zullen naar verwachting na implementatie leiden tot een uniformere manier van werken maar niet tot extra kosten ten aanzien van materialen of personele inzet.
Aanvaardbaarheid, haalbaarheid en implementatie
Voor het toepassen van peroxygenatie kunnen algemeen gangbare en beschikbare materialen gebruikt worden. Alleen indien ten behoeve van apneu-oxygenatie HFNO gebruikt wordt, is specifieke apparatuur en expertise noodzakelijk.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de literatuur lijkt het voordelig om een vorm van peroxygenatie toe te passen om de kans op desaturatie te verkleinen, maar kan geen uitspraak gedaan worden welke techniek de voorkeur verdient. De keuze tussen actieve peroxygenatie, dat wil zeggen beademing in de periode tussen inductie en laryngoscopie en passieve peroxygenatie, dat wil zeggen zuurstoftoediening zonder beademing in de periode tussen inductie en tracheale intubatie, dient te worden gebaseerd op de kenmerken van de individuele patiënt.
Onderbouwing
Achtergrond
Onder peroxygenatie verstaan we de technieken waarmee tijdens de apneufase, dat wil zeggen de periode tussen inductie en tracheale intubatie, zuurstof toegediend wordt om daarmee desaturatie en de complicaties daarvan te voorkomen. Enerzijds kan dat actief zijn, dat wil zeggen het toedienen van zuurstof door middel van positieve druk beademing; anderzijds passief (geen beademing) waarbij zuurstof wordt toegediend via een neussonde of neusbril, een techniek beter bekend als apnoe oxygenatie.
Er is een aanzienlijke praktijkvariatie in het al dan niet toepassen van deze peroxygenatietechnieken. Beademing wordt vaak in deze fase vermeden totdat de patiënt daadwerkelijk desatureert omdat het de kans op aspiratie verhoogt. Hoewel apneu oxygenatie onder bepaalde omstandigheid de veilige apneu duur aanzienlijk kan verlengen is het onduidelijk of dat ook geldt voor vitaal bedreigde patiënten.
Conclusies / Summary of Findings
Active oxygenation
Critical outcomes
|
Low GRADE |
Ventilation between induction and laryngoscopy may reduce incidence of low SpO2 during intubation (both <90% and <80%), when compared to usual care without ventilation in critically ill patients who are intubated outside the operating room.
Sources: Casey, 2019. |
Important outcomes
|
Low GRADE |
Ventilation between induction and laryngoscopy may have little to no effect on lowest SpO2 during intubation, when compared to usual care without ventilation in critically ill patients who are intubated outside the operating room.
Sources: Casey, 2019. |
|
No GRADE |
No evidence was found regarding the effect of ventilation between induction and laryngoscopy on hypotension, when compared to usual care without ventilation in critically ill patients who are intubated outside the operating room.
Source: - |
|
Very low GRADE |
The evidence is very uncertain about the effect of ventilation between induction and laryngoscopy on cardiac arrest, when compared to usual care without ventilation in critically ill patients who are intubated outside the operating room.
Source: Casey, 2019. |
|
Very low GRADE |
The evidence is very uncertain about the effect of ventilation between induction and laryngoscopy on aspiration, when compared to usual care without ventilation in critically ill patients who are intubated outside the operating room.
Source: Casey, 2019. |
|
Very low GRADE |
The evidence is very uncertain about the effect of ventilation between induction and laryngoscopy on mortality when compared to usual care without supplemental oxygen in critically ill patients who are intubated outside the operating room.
Sources: Casey, 2019. |
Passive oxygenation
Critical outcomes
|
Low GRADE |
Supplemental oxygen without ventilation during the interval between induction and tracheal intubation (apneic oxygenation) may reduce incidence of SpO2 <80% during intubation but may have little to no effect on incidence of SpO2 <90% during intubation when compared to usual care without supplemental oxygen in critically ill patients who are intubated outside the operating room.
Sources: Caputo, 2017; Jaber, 2016; Semler, 2016. |
Important outcomes
|
LOW GRADE |
Supplemental oxygen without ventilation during the interval between induction and tracheal intubation (apneic oxygenation) may have little to no effect on lowest SpO2 during intubation, when compared to usual care without supplemental oxygen in critically ill patients who are intubated outside the operating room.
Sources: Caputo, 2017; Jaber, 2016; Shahul Hameed, 2024; Semler, 2016. |
|
No GRADE |
No evidence was found regarding the effect of supplemental oxygen without ventilation during the interval between induction and tracheal intubation (apneic oxygenation) on hypotension, when compared to usual care without supplemental oxygen in critically ill patients who are intubated outside the operating room.
Source: - |
|
No GRADE |
No evidence was found regarding the effect of supplemental oxygen without ventilation during the interval between induction and tracheal intubation (apneic oxygenation) on cardiac arrest, when compared to usual care without supplemental oxygen in critically ill patients who are intubated outside the operating room.
Source: - |
|
Very low GRADE |
The evidence is very uncertain about the effect of supplemental oxygen without ventilation during the interval between induction and tracheal intubation (apneic oxygenation) on aspiration, when compared to usual care without supplemental oxygen in critically ill patients who are intubated outside the operating room.
Source: Jaber, 2016. |
|
Low GRADE |
Supplemental oxygen without ventilation during the interval between induction and tracheal intubation (apneic oxygenation) may reduce mortality when compared to usual care without supplemental oxygen in critically ill patients who are intubated outside the operating room.
Sources: Caputo, 2017; Jaber, 2016; Shahul Hameed, 2024; Semler, 2016. |
Samenvatting literatuur
Description of studies
Table 1 presents an overview of study characteristics of the included studies. One study (Casey, 2019) used an active form of apneic oxygenation, whereas the other four studies used passive oxygenation. The results of active and passive ventilation were analyzed separately.
Table 1. Study characteristics
|
|
|
|
|
|
INTERVENTION |
|
|
CONTROL |
|
|
Study |
Setting |
Population |
Comparison |
Before induction |
Between induction and intubation |
During intubation |
Before induction |
Between induction and intubation |
During intubation |
|
Casey, 2019 |
7 ICUs, USA |
N=401 Critically ill adults undergoing induction and tracheal intubation |
bag-mask ventilation from induction until the initiation of laryngoscopy vs. no ventilation |
any |
BVM (active oxygenation) |
none |
any |
none |
none |
|
Caputo, 2017 |
Single center, academic ED |
N=206 Adults (age > 18 years old) presenting to the ED requiring endotracheal intubation |
supplemental oxygen via nasal cannula at flush flow rate during laryngoscopy or no supplemental oxygen during laryngoscopy |
- |
nasal cannula ≥15 L/min + jaw thrust (passive oxygenation) |
nasal cannula ≥15 L/min (passive oxygenation) |
- |
none |
none |
|
Jaber, 2016 |
Single center, ICU, France |
N=49 Hypoxaemic respiratory failure |
preoxygenation with HFNO combined with NIV vs. preoxygenation with NIV only |
NIV + HFNO |
HFNO (passive oxygenation) |
HFNO (passive oxygenation) |
NIV |
none |
none |
|
Shahul Hameed, 2024 |
Single center, large tertiary care center ED, India |
N=76 Acute hypoxaemic respiratory failure |
Oxygenation through a nasopharyngeal cannula plus BVM preoxygenation vs. receiving standard BVM preoxygenation alone |
BVM + nasopharyngeal cannula 15 L/min |
nasopharyngeal cannula 15 L/min (passive oxygenation) |
nasopharyngeal cannula 15 L/min (passive oxygenation) |
BVM |
none |
none |
|
Semler, 2016 |
ICU |
N=150 Critically ill |
supplemental oxygen during apnea (HFNO) vs. usual care without supplemental oxygen |
- |
nasal cannula 15 L/min (passive oxygenation) |
nasal cannula 15 L/min (passive oxygenation) |
- |
none |
none |
BVM: bag-valve mask; ED, emergency department; HFNO: high flow nasal oxygen; ICU: intensive care unit; NIV: noninvasive ventilation; NRM: non-rebreathing mask
Results
Incidence of low SpO2 (critical outcome)
Active oxygenation
Casey (2019) reported SpO2<90% during intubation in 57/193 patients (29.5%) in the group with apnoeic oxygenation, versus 79/197 (40.1%) in the usual care group. The relative risk (RR) was 0.74 with a 95% confidence interval (CI) from 0.56 to 0.97. In addition, reported SpO2<80% in 21/193 (10.9%) patients with apnoeic oxygenation versus 45/197 (22.8%) in the control group, resulting in a RR of 0.48 (95% CI 0.30 to 0.77). Both differences were considered clinically relevant.
Passive oxygenation
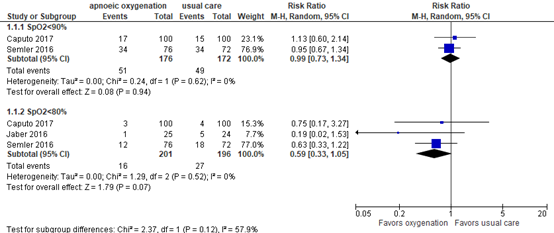
Two publications reported incidence of SpO2<90% during intubation with passive oxygenation. Taken together, with 51/176 patients (29.0%) in the apnoeic oxygenation group versus 49/172 patients (28.5%) in the control group, the pooled RR was 0.99 in favor of apnoeic oxygenation, with a 95% CI 0.73 to 1.34 (Figure 1).
Furthermore, three publications reported SpO2 during intubation <80%. Taken together, with 16/201 patients (8.0%) in the apnoeic oxygenation group versus 27/196 patients (13.8%) in the control group, the pooled relative risk (RR) was 0.59 (95% CI 0.33 to 1.05) in favor of apnoeic oxygenation. This was considered clinically relevant.
Figure 1. Incidence of low SpO2 during intubation after passive apneic oxygenation
Random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect
Lowest SpO2 during intubation
Five publications reported lowest SpO2 during intubation. Results are outlined in Table 2. Differences were not considered clinically relevant, neither with active nor with passive ventilation.
Table 2. Lowest SpO2 during intubation
|
Publication |
Definition |
Result |
|
Casey, 2019 (active oxygenation) |
Lowest SpO2, median (IQR) |
I: 96 (87-99) C: 93 (81-99) |
|
Caputo, 2017 |
Lowest SpO2 during the apnea period or in the 2 minutes after, mean (95% CI) |
I: 92 (91-93) C: 93 (92-94) |
|
Jaber, 2016 |
Lowest SpO2 during intubation, median (IQR) |
I: 100 (95–100) C: 96 (92–99) |
|
Semler, 2016 |
Lowest SpO2 during first attempt, median (IQR) |
I: 92 (84–99) C: 90 (80–96) |
|
Shahul Hameed, 2024 |
lowest SpO2 levels postintubation (0 min), median (IQR) |
I: 95.5 (80-99) C: 89 (76-98) |
Hypotension
One publication reported hypotension, but the definition was not in accordance with the definition formulated by the guideline development group. Casey (2019) reported new systolic blood pressure of <65 mmHg in 8/195 patients (4.1%) receiving apnoeic oxygenation versus 17/197 patients (8.6%) receiving usual care. The studies applying passive oxygenation did not report the outcome.
Cardiac arrest
One publication reported cardiac arrest. Casey (2019) reported cardiac arrest within 1 hour of intubation of 2 (1.0%) in the active oxygenation group versus 6 (2.0%) in the control group. The RR was 0.34 (95% CI 0.07 to 1.65) in favor of apnoeic oxygenation, which was considered clinically relevant. The studies applying passive oxygenation did not report the outcome.
Aspiration
Active oxygenation
Casey (2019) found operator-reported aspiration in 5/199 (2.5%) patients in the active oxygenation group versus 8/202 (4.0%) in the control group, with a RR of 0.63 and a 95% CI 0.21 to 1.91.
Passive oxygenation
Jaber (2016) reported aspiration. There were no incidences reported in either group.
Mortality
Active oxygenation
Casey (2019) reported in-hospital mortality of 71/199 patients in the apnoeic oxygenation group versus 72/202 in the control group, resulting in a RR of 1.00 (95% CI 0.77 to 1.30).
Passive oxygenation
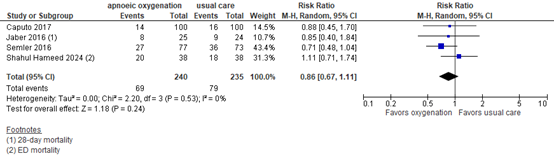
Four publications reported mortality (Figure 2). Taken together, with 69/240 patients (28.8%) in the apnoeic oxygenation group versus 79/235 patients (33.6%) in the usual care group, the RR was 0.86 (95% CI 0.67 to 1.11) in favor of apnoeic oxygenation. This was considered clinically relevant.
Figure 2. In-hospital mortality
Random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect
Level of evidence of the literature
The level of evidence regarding all outcome measures was based on randomized controlled studies and therefore started at high.
Active oxygenation
For the outcome measure incidence of low SpO2 during intubation, the level of evidence was downgraded by 2 levels to LOW due to limitations in study design (lack of blinding may have affected airway management, risk of bias, -1) and because the confidence interval crossed one limit of clinical decision-making (imprecision, -1).
For the outcome measure lowest SpO2 during intubation, the level of evidence was downgraded by two levels to LOW due to limitations in study design (lack of blinding may have affected airway management, risk of bias, -1) and the limited number of patients (imprecision, -1).
For the outcome measure hypotension, the level of evidence could not be determined due to differences in outcome definitions.
For the outcome measure cardiac arrest, the level of evidence was downgraded by 3 levels to VERY LOW because the confidence interval was very wide, due to the very limited number of events (imprecision, -3).
For the outcome measure aspiration, the level of evidence was downgraded by 3 levels to VERY LOW because the confidence interval was very wide, due to the very limited number of events (imprecision, -3).
For the outcome measure mortality, the level of evidence was downgraded by 3 levels to VERY LOW because the confidence interval crossed both limits of clinical decision-making (imprecision, -3).
Passive oxygenation
For the outcome measure lowest SpO2 during intubation, the level of evidence was downgraded by two levels to LOW due to limitations in study design (lack of blinding may have affected airway management, risk of bias, -1) and the limited number of patients (imprecision, -1).
For the outcome measure incidence of low SpO2 during intubation, the level of evidence was downgraded by 2 levels to LOW due to limitations in study design (lack of blinding may have affected airway management, risk of bias, -1) and because the confidence interval crossed one limit of clinical decision-making (imprecision, -1).
For the outcome measure hypotension, the level of evidence could not be determined due a lack of data.
For the outcome measure cardiac arrest, the level of evidence could not be determined due a lack of data.
For the outcome measure aspiration, the level of evidence was downgraded by 3 levels to VERY LOW because no events were reported (imprecision, -3).
For the outcome measure mortality, the level of evidence was downgraded by 3 levels to VERY LOW because the confidence interval crossed both limits of clinical decision-making (imprecision, -3).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the benefits and harms of peroxygenation compared to usual care in critically ill patients who are intubated outside the operating room?
| P: | Critically ill patients who are intubated outside the operating room |
| I: | Peroxygenation |
| C: | Usual care without supplemental oxygen or ventilation between induction and laryngoscopy |
| O: | Incidence of low SpO2, lowest SpO2 during intubation, hypotension, cardiac arrest, aspiration, mortality |
Relevant outcome measures
The guideline development group considered incidence of low SpO2 as a critical outcome measure for decision making; and lowest SpO2 during intubation, hypotension, cardiac arrest, aspiration and mortality as important outcome measures for decision making.
The threshold for low SpO2 was not defined a priori but was based on the findings reported in literature.
The working group defined 5% as a minimal clinically (patient) important difference for incidence of low SpO2, cardiac arrest and mortality (relative risk <0.95 or >1.05), and 10% for lowest SpO2 (mean difference) and aspiration (RR). For hypotension, a relative difference of 25% between groups was considered clinically relevant.
Search and select (Methods)
On the 9th of May 2023, a systematic search was performed in the databases Embase.com and Ovid/Medline for systematic reviews and RCTs on different methods of preoxygenation (see section Preoxygenation). An additional search for apneic oxygenation was performed on February 26, 2024. The detailed search strategy is depicted under the tab Methods. The additional search resulted in 58 unique hits. Studies were selected based on the following criteria: randomized controlled trials or systematic reviews thereof, comparing different modalities of peroxygenation in critically ill patients intubated outside the operating room. Twenty-nine studies were initially selected based on title and abstract screening. After reading the full text, twenty-four studies were excluded (see the table with reasons for exclusion in the Methods section), and five studies were included.
Results
Five RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Caputo N, Azan B, Domingues R, Donner L, Fenig M, Fields D, Fraser R, Hosford K, Iuorio R, Kanter M, McCarty M, Parry T, Raja A, Ryan M, Williams B, Sharma H, Singer D, Shields C, Scott S, West JR; Lincoln Airway Group. Emergency Department use of Apneic Oxygenation Versus Usual Care During Rapid Sequence Intubation: A Randomized Controlled Trial (The ENDAO Trial). Acad Emerg Med. 2017 Nov;24(11):1387-1394. doi: 10.1111/acem.13274. Epub 2017 Sep 23. PMID: 28791755.
- Casey JD, Janz DR, Russell DW, Vonderhaar DJ, Joffe AM, Dischert KM, Brown RM, Zouk AN, Gulati S, Heideman BE, Lester MG, Toporek AH, Bentov I, Self WH, Rice TW, Semler MW; PreVent Investigators and the Pragmatic Critical Care Research Group. Bag-Mask Ventilation during Tracheal Intubation of Critically Ill Adults. N Engl J Med. 2019 Feb 28;380(9):811-821. doi: 10.1056/NEJMoa1812405. Epub 2019 Feb 18. PMID: 30779528; PMCID: PMC6423976.
- Engström, J., Hedenstierna, G. & Larsson, A. Pharyngeal oxygen administration increases the time to serious desaturation at intubation in acute lung injury: an experimental study. Crit Care 14, R93 (2010). https://doi.org/10.1186/cc9027.
- Fayed M, Maroun W, Patel N, Galusca D. Apneic Oxygenation: A Summarized Review and Stepwise Approach. Cureus. 2023 Dec 21;15(12):e50916. doi: 10.7759/cureus.50916. PMID: 38249244; PMCID: PMC10799750.
- Gibbs KW, Semler MW, Driver BE, Seitz KP, Stempek SB, Taylor C, Resnick-Ault D, White HD, Gandotra S, Doerschug KC, Mohamed A, Prekker ME, Khan A, Gaillard JP, Andrea L, Aggarwal NR, Brainard JC, Barnett LH, Halliday SJ, Blinder V, Dagan A, Whitson MR, Schauer SG, Walker JE Jr, Barker AB, Palakshappa JA, Muhs A, Wozniak JM, Kramer PJ, Withers C, Ghamande SA, Russell DW, Schwartz A, Moskowitz A, Hansen SJ, Allada G, Goranson JK, Fein DG, Sottile PD, Kelly N, Alwood SM, Long MT, Malhotra R, Shapiro NI, Page DB, Long BJ, Thomas CB, Trent SA, Janz DR, Rice TW, Self WH, Bebarta VS, Lloyd BD, Rhoads J, Womack K, Imhoff B, Ginde AA, Casey JD; PREOXI Investigators and the Pragmatic Critical Care Research Group. Noninvasive Ventilation for Preoxygenation during Emergency Intubation. N Engl J Med. 2024 Jun 20;390(23):2165-2177. doi: 10.1056/NEJMoa2313680. Epub 2024 Jun 13. PMID: 38869091; PMCID: PMC11282951.
- Jaber S, Monnin M, Girard M, Conseil M, Cisse M, Carr J, Mahul M, Delay JM, Belafia F, Chanques G, Molinari N, De Jong A. Apnoeic oxygenation via high-flow nasal cannula oxygen combined with non-invasive ventilation preoxygenation for intubation in hypoxaemic patients in the intensive care unit: the single-centre, blinded, randomised controlled OPTINIV trial. Intensive Care Med. 2016 Dec;42(12):1877-1887. doi: 10.1007/s00134-016-4588-9. Epub 2016 Oct 11. PMID: 27730283.
- Semler MW, Janz DR, Lentz RJ, Matthews DT, Norman BC, Assad TR, Keriwala RD, Ferrell BA, Noto MJ, McKown AC, Kocurek EG, Warren MA, Huerta LE, Rice TW; FELLOW Investigators; Pragmatic Critical Care Research Group. Randomized Trial of Apneic Oxygenation during Endotracheal Intubation of the Critically Ill. Am J Respir Crit Care Med. 2016 Feb 1;193(3):273-80. doi: 10.1164/rccm.201507-1294OC. PMID: 26426458; PMCID: PMC4803060.
- Shahul Hameed IZ, Hazra D, Ganesan P, Prabhakar AKP. Does apneic oxygenation with nasopharyngeal cannula during intubation improve the oxygenation in patients with acute hypoxemic respiratory failure compared to the standard bag valve mask preoxygenation? An open-labeled randomized control trial. Turk J Emerg Med. 2024 Jan 8;24(1):33-40. doi: 10.4103/tjem.tjem_176_23. PMID: 38343515; PMCID: PMC10852139.
- White LD, Melhuish TM, White LK, Wallace LA. Apnoeic oxygenation during intubation: a systematic review and meta-analysis. Anaesth Intensive Care. 2017 Jan;45(1):21-27. doi: 10.1177/0310057X1704500104. PMID: 28072931.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
Research question: What are the benefits and harms of apnoeic oxygenation compared to usual care in critically ill patients who are intubated outside the operating room?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Caputo, 2017
ENDAO trial
NCT 02737917 |
Type of study: RCT
Setting and country: Single center, ED, USA
Funding and conflicts of interest: The authors have no relevant financial information or potential conflicts to disclose. |
Inclusion criteria: Any adult patient (age > 18 years old) presenting to the ED requiring endotracheal intubation was screened for inclusion into the study.
Exclusion criteria: Patients were excluded from the study if they were not preoxygenated to the standard RSI protocol of a goal of 3 minutes with 100% FiO2 by means of BVM, BiPAP, and/or NRB; if they were in cardiac or traumatic arrest; or if they were intubated without an apneic period (i.e., awake intubation). Patients who did not undergo preoxygenation were excluded to avoid a potential confounding variable.
N total at baseline: I: 104 C: 102
Important prognostic factors2: Age, mean: I: 54.2 C: 55.1
Sex: I: 58% M C: 59% M
ASA (mean I: 2.67 C: 2.69
Groups were comparable at baseline. |
Apnoeic oxygenation by nasal cannula
Supplemental oxygen via nasal cannula; (CareFusion AirLife) and NC EtCO2 (Phillips, Smart Capnoline), both at flush flow rates ≥15 LPM (providing intra and extra nasal oxygen) during laryngoscopy |
Usual care
No supplemental oxygen during laryngoscopy |
Length of follow-up: 24 hours
Loss-to-follow-up: None
Incomplete outcome data: N/A
|
Critical outcome measures Desaturation: lowest SpO2 Lowest SpO2 during the apnea period or in the 2 minutes after, mean, 95% CI I: 92, 91-93 C: 93, 92-94
Desaturation: incidence of low SpO2 Incidence of SpO2 <90%, no. (%) I: 17/100 (17%) C: 15/100 (15%)
Duration of SpO2 < 80% I: 3/100 (3%) C: 4/100 (4%)
Important outcome measures Hypotension Not reported
Cardiac arrest Not reported
Aspiration Not reported
Mortality Mortality at 24h, no. (%) I: 4/100, 4% C: 2/100, 2%
Total mortality, no. (%) (time not specified) I: 14/100, 14% C: 16/100, 16% |
Authors’ conclusions: this study demonstrated that in patients that are properly preoxygenated during rapid sequence intubation in the ED, the application of apneic oxygenation did not lead to any differences in lowest mean oxygen saturation, desaturation rates between the two groups, or intubation success without hypoxemia. |
|
Casey, 2019
PreVent
NCT 03026322 |
Type of study: RCT
Setting and country: Multicenter, USA, ICU
Funding and conflicts of interest: Supported by grants (UL1 TR000445 and UL1TR002243) from the National Center for Advancing Translational Sciences, National Institutes of Health (NIH), to the Vanderbilt Institute for Clinical and Translational Research. Dr. Casey was supported, in part, by a grant (2T32HL087738–12) from the NIH; Dr. Semler, by grants (K12HL133117 and K23HL143053) from the National Heart, Lung, and Blood Institute (NHLBI); Dr. Russell, by a grant (T32HL105346–07) from the NHLBI; and Dr. Rice, by a grant (R34HL105869) from the NIH. Dr. Self reports receiving advisory board fees from Cempra Pharmaceuticals, Ferring Pharmaceuticals, Biotest, and Merck and travel support from Gilead Pharmaceuticals and Pfizer; and Dr. Rice, receiving consulting fees and fees for serving as director of medical affairs from Cumberland Pharmaceuticals, consulting fees from Avisa Pharma, and fees for serving as chair of a data and safety monitoring board from Takeda Pharmaceuticals. No other potential conflict of interest relevant to this article was reported. |
Inclusion criteria: Adults (age, ≥18 years) undergoing induction and tracheal intubation.
Exclusion criteria: Patients were excluded if they were pregnant, were incarcerated, or had such an immediate need for tracheal intubation that randomization was precluded or if the treating clinicians had determined that ventilation between induction and laryngoscopy was either required (e.g., as a treatment for hypoxemia or severe acidemia) or contraindicated (e.g., because of an increased risk of aspiration from ongoing emesis, hematemesis, or hemoptysis).
N total at baseline: I: 199 C: 202
Important prognostic factors2: Age, median: I: 59 C: 60
Sex: I: 59% M C: 54% M
Body mass index, median, kg/m2 I: 27.1 C: 27.6
APACHE II, median I: 22 C: 22
Groups were comparable at baseline. |
Bag-mask ventilation
bag-mask ventilation was provided by treating clinicians during the interval from induction until the initiation of laryngoscopy. oxygen flow rates of at least 15 liters per minute, a valve attached to the expiratory port of the bag-mask device to generate a positive end-expiratory pressure of 5 to 10 cm of water, an oropharyngeal airway, a two-handed mask seal performed by the intubating clinician with a head-tilt and chin-lift maneuver, and ventilation at 10 breaths per minute with the smallest volume required to generate a visible chest rise |
No ventilation
For patients who were assigned to the no-ventilation group, bag-mask ventilation between induction and laryngoscopy was not permitted, except after a failed attempt at laryngoscopy, as treatment for hypoxemia (oxygen saturation, <90%), or at any point if the treating clinicians determined that such treatment was necessary for the safety of the patient.
All methods of preoxygenation, including noninvasive ventilation, were allowed in either group before induction |
Length of follow-up: Intubation procedure
Loss-to-follow-up: none
Incomplete outcome data: N/A
|
Critical outcome measures Desaturation: lowest SpO2 Lowest SpO2, median (IQR) I: 96 (87-99) C: 93 (81-99)
Desaturation: incidence of low SpO2 Incidence of SpO2 <90%, no. (%) I: 57/193 (29.5%) C: 79/197 (40.1%)
Duration of SpO2 < 70% I: 8/193 (4.1%) C: 20/197 (10.2%)
Important outcome measures Hypotension New systolic blood pressure of<65 mm Hg no. (%) I: 8/195 (4.1%) C: 17/197 (8.6%)
Cardiac arrest Within 1h of intubation no. (%) I: 2 (1.0%) C: 6 (2.0%)
Aspiration operator-reported aspiration I: 2.5%; 5/199 C: 4.0%; 8/202 RR 0.63 (95% CI 0.21 to 1.91)
Mortality Mortality on discharge, no. (%) I: 71 (35.7%) C: 72 (35.6%) |
Authors’ conclusions: in this multicenter, randomized trial involving critically ill adults undergoing tracheal intubation, patients receiving bag-mask ventilation during the interval between induction and laryngoscopy had higher oxygen saturations and lower rates of severe hypoxemia than those receiving no ventilation. |
|
Jaber, 2016
OPTINIV
NCT 02530957 |
Type of study: RCT
Setting and country:
Funding and conflicts of interest: |
Inclusion criteria: Patients admitted to the ICU and requiring mechanical ventilation through an orotracheal tube
Exclusion criteria: Patients fulfilling one or more of the following criteria were not included: age less than 18 years, pregnant or breastfeeding woman, protected person, intubation procedures in case of cardio-circulatory arrest, nasopharyngeal obstruction contraindicating the use of HFNC, and usual contraindications to NIV.
N total at baseline: I: 25 C: 24
Important prognostic factors2: Age, mean: I: 63 C: 61
Sex: I: 72% M C: 83% M
Body mass index, mean (SD), kg/m2 I: 24 C: 23
MACOCHA score <3 I: 92% C: 83%
Groups were comparable at baseline. |
4 min preoxygenation at 30° of head-up inclination with HFNC (humidified oxygen flow of 60 L/min, FiO2 = 100 %) combined with NIV (PS of 10 cmH2O, PEEP of 5 cmH2O, FiO2 = 100 %) |
4 min preoxygenation at 30° of head-up inclination with NIV only (same parameters as in the interventional group) without HFNC (nasal cannula positioned without any flow) |
Length of follow-up: Intubation procedure
Loss-to-follow-up: None
Incomplete outcome data: N/A
|
Critical outcome measures Desaturation: lowest SpO2 Lowest SpO2 during intubation, median (IQR) I: 100 (95–100) C: 96 (92–99)
Desaturation: incidence of low SpO2 Incidence of SpO2 <90% Not reported
Incidence of SpO2 < 80% I: 1/25 (4%) C: 5/24 (21%)
Important outcome measures Hypotension Not reported
Cardiac arrest Not reported
Aspiration I: 0% C: 0%
Mortality Day 28 I: 8/25, 32.0% C: 9/24, 37.5% |
Authors’ conclusions: HFNC combined with NIV, in comparison to NIV alone, allowed significantly higher minimal SpO2 values during the intubation procedure of severe hypoxaemic acute respiratory failure ICU patients. This proof-of-concept study has to be confirmed with a large multicentre randomised controlled trial. |
|
Shahul Hameed, 2024 |
Type of study: RCT
Setting and country: single‑center, ED, India
Funding and conflicts of interest: No funding.
No conflict of interest declared. |
Inclusion criteria: Patients aged 18 years and above, presenting to the ED with AHRF (defined as hypoxemia with PaO2 < 60 mmHg or a 20% drop in saturation from baseline with an indication for intubation).
Exclusion criteria: Relatives of patients unwilling or unable to provide consent for study participation, pregnant individuals, contraindications to nasopharyngeal cannula insertion (nasopharyngeal obstruction or blockage, nasal bone fractures, and base of skull fractures), and challenging airways characterized by limited neck mobility, restricted mouth opening, or a Mallampati score > 2.
N total at baseline: I: 38 C: 38
Important prognostic factors2: Age, mean±SD: I: 48±2.8 C: 44±2.5
Sex: I: 57.1% F C: 42.9% F
Groups were comparable at baseline. |
Oxygenation through a nasopharyngeal cannula (15 l) in conjunction with BVM preoxygenation |
Standard BVM preoxygenation alone
Both groups underwent a 3 min preoxygenation period before the initiation of apneic oxygenation |
Length of follow-up: ED discharge
Loss-to-follow-up: None
Incomplete outcome data: N/A |
Critical outcome measures Desaturation: lowest SpO2 lowest SpO2 levels postintubation (0 min), median (IQR) I: 95.5 (80-99) C: 89 (76-98)
Desaturation: incidence of low SpO2 Not reported
Duration of SpO2 < 80% Not reported
Important outcome measures Hypotension Not reported
Cardiac arrest Not reported
Aspiration Not reported
Mortality Mortality in ED, no. (%) I: 20/38 (52.6) C: 18/38 (47.7%) |
Authors’ conclusions: Our study involving 76 ED patients undergoing RSI found that the intervention group did not demonstrate a statistically significant decrease in the occurrence of hypoxia during intubation or the prevention of postintubation adverse events when contrasted with the control group.
NB. The study was conducted over 5 months, from April 2021 to August 2021, amid the COVID‑19 pandemic. Patients were enrolled without prior knowledge of their COVID‑19 infectivity status. |
|
Semler, 2016
FELLOW trial
NCT 02051816 |
Type of study: RCT
Setting and country: Single center, ICU, USA
Funding and conflicts of interest: Supported by NHLBI T32 award (HL087738 09). Data collection used the Research Electronic Data Capture (REDCap) tool developed and maintained with Vanderbilt Institute for Clinical and Translational Research grant support (UL1 TR000445 from National Center for Advancing Translational Sciences/National Institutes of Health). The funding institutions had no role in conception, design, or conduct of the study; collection, management, analysis, interpretation, or presentation of the data; or preparation, review, or approval of the manuscript. Author disclosures are available with the text of this article at atsjournals.org. |
Inclusion criteria: patients undergoing endotracheal intubation in the medical ICU. All patients 18 years or older being intubated by a pulmonary and critical care medicine fellow were eligible.
Exclusion criteria: Patients were excluded if awake intubation was planned, if intubation was required so emergently that randomization could not be achieved, or if the treating clinicians believed a specific approach to intraprocedural oxygenation or a specific laryngoscopy device was mandated for the safe performance of the procedure.
N total at baseline: I: 77 C: 73
Important prognostic factors2: Age, median (IQR): I: 60 (51–68) C: 60 (50–67)
Sex: I: 58% M C: 63% M
Body mass index, median (IQR), kg/m2 I: 28.6 (23.3–32.8) C: 28.6 (23.4–32.8)
APACHE II, median (IQR) I: 22 (16–27) C: 22 (17–27)
Groups were comparable at baseline. |
Apneic oxygenation
A high-flow nasal cannula (Comfort Soft Plus; Westmed, Inc., Tucson, AZ) set to 15 L/min flow of 100% oxygen was placed in the patient’s nares before induction and kept in place until intubation was complete. |
Usual care
Patients in the usual care group were intubated without supplemental oxygen during laryngoscopy. |
Length of follow-up: Hospital discharge
Loss-to-follow-up: None
Incomplete outcome data: N/A
|
Critical outcome measures Desaturation: lowest SpO2 Lowest SpO2 during first attempt, median (IQR) I: 92 (84–99) N=73 were included in intention-to-treat analysis for primary outcome C: 90 (80–96) N=77 were included in intention-to-treat analysis for primary outcome
Desaturation: incidence of low SpO2 Incidence of SpO2 <90%, no. (%) at first attempt I: 34 (44.7) C: 34 (47.2)
Duration of SpO2 < 80% no. (%) I: 12 (15.8) C: 18 (25.0)
Important outcome measures Hypotension Not reported
Cardiac arrest Not reported
Aspiration Not reported
Mortality Mortality on discharge, no. (%) I: 27 (35.1) C: 36 (49.3) |
Authors’ conclusions: The results of this clinical trial suggest that apneic oxygenation during endotracheal intubation of critically ill adults does not increase lowest arterial oxygen saturation compared with usual care. Routine use of apneic oxygenation during emergent intubation cannot be recommended. |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What are the benefits and harms of apnoeic oxygenation compared to usual care in critically ill patients who are intubated outside the operating room?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH |
|
Caputo, 2017 ENDAO trial |
Definitely yes
The sequence of study group assignments was generated via a computerized algorithm using permuted blocks of 4, 8, and 12. |
Definitely yes
Study group assignments were placed in a secured binder and sequentially numbered in opaque envelopes. |
Probably yes
The data collectors were blinded to our study design and outcome, and we feel that no bias was introduced by the use of these trained data collectors. |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Probably yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: No other problems noted |
LOW |
|
Casey, 2019 PreVent trial |
Definitely yes
Patients underwent randomization in a 1:1 ratio to undergo either bag-mask ventilation or no ventilation in permuted blocks of 2, 4, and 6, stratified according to trial site. |
Definitely yes
Trial-group assignments were placed in sequentially numbered opaque envelopes and remained concealed until after enrollment. |
Definitely no
Given the nature of the intervention, patients, clinicians, and research personnel were aware of trial-group assignments after randomization. |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Probably yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: No other problems noted |
SOME CONCERNS
knowledge of group assignment may have contributed to differences in preoxygenation technique between groups |
|
Jaber, 2016 OPTINIV trial |
Definitely yes
A computer-generated 1:1 randomisation was used, generated by a statistician who was not involved in determination of patient eligibility or outcome assessment. No stratification was performed. |
Definitely yes
Randomisation was accomplished by using opaque sealed envelopes. The randomisation envelopes contained a card stating the group to which the patient was randomised. |
Definitely yes
The study was blinded to the observer collecting the data. |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Probably yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: No other problems noted |
LOW |
|
Shahul Hameed, 2024 |
Definitely yes
We used the Block Permutation Statistical Analysis System 9.4, developed by North Carolina State University, to randomize treatment allocation in block sizes of 2, 4, and 6. Randomization was accomplished through computer‑generated block randomization. |
Definitely yes
Sequentially numbered opaque‑sealed envelopes were provided to patients for allocation into the intervention and control groups. |
Definitely no
Due to the nature of the intervention, blinding of the treating clinician, ED staff, and patients post-allocation was not feasible. |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Definitely no
Reason: Not all defined outcomes were reported in the results section. |
Probably yes
Reason: No other problems noted |
SOME CONCERNS
knowledge of group assignment may have contributed to differences airway management by the clinical team. Possible selective outcome reporting. |
|
Semler, 2016 FELLOW trial |
Definitely yes
Eligible patients were randomly assigned in a 1:1 ratio to receive apneic oxygenation or usual care. The sequence of study group assignments was generated via a computerized algorithm using permuted blocks of 4, 8, and 12. |
Definitely yes
Study group assignments were placed in sequentially numbered opaque envelopes that remained sealed until the decision had been made that a patient required intubation and was enrolled in the study. |
Definitely no
Because of the nature of the study intervention, clinicians and study personnel were aware of study group assignments after enrollment. |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Probably yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: No other problems noted |
SOME CONCERNS
knowledge of group assignment may have contributed to differences in approach to preoxygenation, induction and additional airway management equipment made by the clinical team. |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Baillard C, Prat G, Jung B, Futier E, Lefrant JY, Vincent F, Hamdi A, Vicaut E, Jaber S. Effect of preoxygenation using non-invasive ventilation before intubation on subsequent organ failures in hypoxaemic patients: a randomised clinical trial. Br J Anaesth. 2018 Feb;120(2):361-367. doi: 10.1016/j.bja.2017.11.067. Epub 2017 Nov 23. PMID: 29406184. |
Wrong comparison |
|
Baillard C, Fosse JP, Sebbane M, Chanques G, Vincent F, Courouble P, Cohen Y, Eledjam JJ, Adnet F, Jaber S. Noninvasive ventilation improves preoxygenation before intubation of hypoxic patients. Am J Respir Crit Care Med. 2006 Jul 15;174(2):171-7. doi: 10.1164/rccm.200509-1507OC. Epub 2006 Apr 20. PMID: 16627862. |
Wrong comparison |
|
Binks MJ, Holyoak RS, Melhuish TM, Vlok R, Hodge A, Ryan T, White LD. Apnoeic oxygenation during intubation in the intensive care unit: A systematic review and meta-analysis. Heart Lung. 2017 Nov-Dec;46(6):452-457. doi: 10.1016/j.hrtlng.2017.08.001. Epub 2017 Sep 12. PMID: 28912057. |
Original publications used |
|
Binks MJ, Holyoak RS, Melhuish TM, Vlok R, Bond E, White LD. Apneic oxygenation during intubation in the emergency department and during retrieval: A systematic review and meta-analysis. Am J Emerg Med. 2017 Oct;35(10):1542-1546. doi: 10.1016/j.ajem.2017.06.046. Epub 2017 Jun 24. PMID: 28684195. |
Original publications used |
|
Cabrini L, Landoni G, Baiardo Redaelli M, Saleh O, Votta CD, Fominskiy E, Putzu A, Snak de Souza CD, Antonelli M, Bellomo R, Pelosi P, Zangrillo A. Tracheal intubation in critically ill patients: a comprehensive systematic review of randomized trials. Crit Care. 2018 Jan 20;22(1):6. doi: 10.1186/s13054-017-1927-3. Erratum in: Crit Care. 2019 Oct 21;23(1):325. PMID: 29351759; PMCID: PMC5775615. |
Wrong comparison |
|
Cao L, Zheng H, Xie Y, Liu S, Liu K. [Effect of preoxygenation and apnoeic oxygenation during intubation in the critically ill patients: a network Meta-analysis]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2019 Oct;31(10):1236-1241. Chinese. doi: 10.3760/cma.j.issn.2095-4352.2019.10.011. PMID: 31771721. |
Wrong language |
|
Chua MT, Ng WM, Lu Q, Low MJW, Punyadasa A, Cove ME, Yau YW, Khan FA, Kuan WS. Pre- and apnoeic high-flow oxygenation for rapid sequence intubation in the emergency department (the Pre-AeRATE trial): A multicentre randomised controlled trial. Ann Acad Med Singap. 2022 Mar;51(3):149-160. doi: 10.47102/annals-acadmedsg.2021407. PMID: 35373238. |
Wrong comparison |
|
Chaudhuri D, Granton D, Wang DX, Einav S, Helviz Y, Mauri T, Ricard JD, Mancebo J, Frat JP, Jog S, Hernandez G, Maggiore SM, Hodgson C, Jaber S, Brochard L, Burns KEA, Rochwerg B. Moderate Certainty Evidence Suggests the Use of High-Flow Nasal Cannula Does Not Decrease Hypoxia When Compared With Conventional Oxygen Therapy in the Peri-Intubation Period: Results of a Systematic Review and Meta-Analysis. Crit Care Med. 2020 Apr;48(4):571-578. doi: 10.1097/CCM.0000000000004217. PMID: 32205604. |
Wrong comparison |
|
Cırıl MF, Akarca M, Unal Akoglu E, Cimilli Ozturk T, Onur Ö. High-Flow Nasal Cannula versus Bag Valve Mask for Preoxygenation during Rapid Sequence Intubation in the Emergency Department: A Single-Center, Prospective, Randomized Controlled Trial. Prehosp Disaster Med. 2024 Feb;39(1):45-51. doi: 10.1017/S1049023X23006684. Epub 2023 Dec 18. PMID: 38108139. |
Wrong comparison |
|
Fong KM, Au SY, Ng GWY. Preoxygenation before intubation in adult patients with acute hypoxemic respiratory failure: a network meta-analysis of randomized trials. Crit Care. 2019 Sep 18;23(1):319. doi: 10.1186/s13054-019-2596-1. PMID: 31533792; PMCID: PMC6751657. |
Wrong comparison |
|
Frat JP, Ricard JD, Quenot JP, Pichon N, Demoule A, Forel JM, Mira JP, Coudroy R, Berquier G, Voisin B, Colin G, Pons B, Danin PE, Devaquet J, Prat G, Clere-Jehl R, Petitpas F, Vivier E, Razazi K, Nay MA, Souday V, Dellamonica J, Argaud L, Ehrmann S, Gibelin A, Girault C, Andreu P, Vignon P, Dangers L, Ragot S, Thille AW; FLORALI-2 study group; REVA network. Non-invasive ventilation versus high-flow nasal cannula oxygen therapy with apnoeic oxygenation for preoxygenation before intubation of patients with acute hypoxaemic respiratory failure: a randomised, multicentre, open-label trial. Lancet Respir Med. 2019 Apr;7(4):303-312. doi: 10.1016/S2213-2600(19)30048-7. Epub 2019 Mar 18. PMID: 30898520. |
Wrong comparison |
|
Guitton C, Ehrmann S, Volteau C, Colin G, Maamar A, Jean-Michel V, Mahe PJ, Landais M, Brule N, Bretonnière C, Zambon O, Vourc'h M. Nasal high-flow preoxygenation for endotracheal intubation in the critically ill patient: a randomized clinical trial. Intensive Care Med. 2019 Apr;45(4):447-458. doi: 10.1007/s00134-019-05529-w. Epub 2019 Jan 21. PMID: 30666367. |
Wrong comparison |
|
Holyoak RS, Melhuish TM, Vlok R, Binks M, White LD. Intubation using apnoeic oxygenation to prevent desaturation: A systematic review and meta-analysis. J Crit Care. 2017 Oct;41:42-48. doi: 10.1016/j.jcrc.2017.04.043. Epub 2017 Apr 30. PMID: 28477509. |
Original publications used |
|
Higgs A, McGrath BA, Goddard C, Rangasami J, Suntharalingam G, Gale R, Cook TM; Difficult Airway Society; Intensive Care Society; Faculty of Intensive Care Medicine; Royal College of Anaesthetists. Guidelines for the management of tracheal intubation in critically ill adults. Br J Anaesth. 2018 Feb;120(2):323-352. doi: 10.1016/j.bja.2017.10.021. Epub 2017 Nov 26. PMID: 29406182. |
Wrong study design |
|
Jhou HJ, Chen PH, Lin C, Yang LY, Lee CH, Peng CK. High-flow nasal cannula therapy as apneic oxygenation during endotracheal intubation in critically ill patients in the intensive care unit: a systematic review and meta-analysis. Sci Rep. 2020 Feb 26;10(1):3541. doi: 10.1038/s41598-020-60636-9. PMID: 32103138; PMCID: PMC7044442. |
Original publications used |
|
Oliveira J E Silva L, Cabrera D, Barrionuevo P, Johnson RL, Erwin PJ, Murad MH, Bellolio MF. Effectiveness of Apneic Oxygenation During Intubation: A Systematic Review and Meta-Analysis. Ann Emerg Med. 2017 Oct;70(4):483-494.e11. doi: 10.1016/j.annemergmed.2017.05.001. Epub 2017 Jul 14. PMID: 28712606. |
Original publications used |
|
Pavlov I, Medrano S, Weingart S. Apneic oxygenation reduces the incidence of hypoxemia during emergency intubation: A systematic review and meta-analysis. Am J Emerg Med. 2017 Aug;35(8):1184-1189. doi: 10.1016/j.ajem.2017.06.029. Epub 2017 Jun 15. PMID: 28647137. |
Original publications used |
|
Russotto V, Cortegiani A, Raineri SM, Gregoretti C, Giarratano A. Respiratory support techniques to avoid desaturation in critically ill patients requiring endotracheal intubation: A systematic review and meta-analysis. J Crit Care. 2017 Oct;41:98-106. doi: 10.1016/j.jcrc.2017.05.003. Epub 2017 May 8. PMID: 28505486. |
Wrong comparison |
|
Simon M, Wachs C, Braune S, de Heer G, Frings D, Kluge S. High-Flow Nasal Cannula Versus Bag-Valve-Mask for Preoxygenation Before Intubation in Subjects With Hypoxemic Respiratory Failure. Respir Care. 2016 Sep;61(9):1160-7. doi: 10.4187/respcare.04413. Epub 2016 Jun 7. PMID: 27274092. |
Wrong comparison |
|
Tan E, Loubani O, Kureshi N, Green RS. Does apneic oxygenation prevent desaturation during emergency airway management? A systematic review and meta-analysis. Can J Anaesth. 2018 Aug;65(8):936-949. English. doi: 10.1007/s12630-018-1124-0. Epub 2018 Apr 23. PMID: 29687359. |
Original publications used |
|
Vaughan EM, Seitz KP, Janz DR, Russell DW, Dargin J, Vonderhaar DJ, Joffe AM, West JR, Self WH, Rice TW, Semler MW, Casey JD. Bag-Mask Ventilation Versus Apneic Oxygenation During Tracheal Intubation in Critically Ill Adults: A Secondary Analysis of 2 Randomized Trials. J Intensive Care Med. 2022 Jul;37(7):899-907. doi: 10.1177/08850666211058646. Epub 2021 Dec 13. PMID: 34898310; PMCID: PMC9149042. |
Original publications used |
|
Vourc'h M, Asfar P, Volteau C, Bachoumas K, Clavieras N, Egreteau PY, Asehnoune K, Mercat A, Reignier J, Jaber S, Prat G, Roquilly A, Brule N, Villers D, Bretonniere C, Guitton C. High-flow nasal cannula oxygen during endotracheal intubation in hypoxemic patients: a randomized controlled clinical trial. Intensive Care Med. 2015 Sep;41(9):1538-48. doi: 10.1007/s00134-015-3796-z. Epub 2015 Apr 14. PMID: 25869405. |
Wrong comparison |
|
White LD, Vlok RA, Thang CY, Tian DH, Melhuish TM. Oxygenation during the apnoeic phase preceding intubation in adults in prehospital, emergency department, intensive care and operating theatre environments. Cochrane Database Syst Rev. 2023 Aug 2;8(8):CD013558. doi: 10.1002/14651858.CD013558.pub2. PMID: 37531462; PMCID: PMC10419336. |
Original publications used |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-02-2025
Beoordeeld op geldigheid : 23-02-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor vitaal bedreigde patiënten die geïntubeerd worden buiten de OK.
Werkgroep
Dr. J.A.M. (Joost) Labout (voorzitter tot september 2023), intensivist, NVIC
Drs. J.H.J.M. (John) Meertens (interim-voorzitter), intensivist, NVIC
Drs. P. (Peter) Dieperink (interim-voorzitter), intensivist, NVIC
Drs. M.E. (Mengalvio) Sleeswijk (interim-voorzitter), intensivist, NVIC
Dr. F.O. (Fabian) Kooij, anesthesioloog/MMT-arts, NVA
Drs. Y.A.M. (Yvette) Kuijpers, anesthesioloog-intensivist, NVA
Drs. C. (Caspar) Müller, anesthesioloog/MMT-arts, NVA
Drs. M.E. (Mark) Seubert, internist-intensivist, NIV
Drs. S.J. (Sjieuwke) Derksen, internist-intensivist, NIV
Dr. R.M. (Rogier) Determann, internist-intensivist, NIV
Drs. H.J. (Harry) Achterberg, anesthesioloog-SEH-arts, NVSHA
Drs. M.A.E.A. (Marianne) Brackel, patiëntvertegenwoordiger, FCIC/IC Connect
Klankbordgroep
Dr. C.L. (Christiaan) Meuwese, cardioloog-intensivist, NVVC
Drs. J.T. (Jeroen) Kraak, KNO-arts, NVKNO
Drs. H.R. (Harry) Naber, anesthesioloog, NVA
Drs. H. (Huub) Grispen, anesthesiemedewerker, NVAM
Met ondersteuning van
dr. M.S. Ruiter, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
drs. I. van Dijk, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Caspar Müller |
Anesthesioloog/MMT-arts ErasmusMC |
Geen |
Geen |
Geen restricties. |
|
Fabian Kooij |
Anesthesioloog/MMT-arts, Amsterdam UMC |
Chair of the Board, European Trauma Course Organisation |
Geen |
Geen restricties. |
|
Harry Achterberg |
SEH-arts, Isala Klinieken, fulltime - 40u/w (~111%) |
Geen |
Geen |
Geen restricties. |
|
John Meertens |
Intensivist-anesthesioloog, Intensive Care Volwassenen, UMC Groningen |
Secretaris Commissie Luchtwegmanagement, Nederlandse Vereniging voor Intensive Care |
Geen |
Geen restricties. |
|
Joost Labout |
Intensivist |
Redacteur A & I |
Geen |
Geen restricties. |
|
Marianne Brackel |
Patiëntvertegenwoordiger Stichting FCIC en patiëntenorganisatie IC Connect |
Geen |
Voormalig voorzitter IC Connect |
Geen restricties. |
|
Mark Seubert |
Internist-intensivist, |
Waarnemend internist en intensivist |
Lid Sectie IC van de NIV |
Geen restricties. |
|
Mengalvio Sleeswijk |
Internist-intensivist, Flevoziekenhuis |
Medisch Manager ambulancedienst regio Flevoland Gooi en Vecht / TMI Voorzitter Commissie Luchtwegmanagement, Nederlandse Vereniging voor Intensive Care |
Geen |
Geen restricties. |
|
Peter Dieperink |
Intensivist-anesthesioloog, Intensive Care Volwassenen, UMC Groningen |
Lid Commissie Luchtwegmanagement, Nederlandse Vereniging voor Intensive Care |
Geen |
Geen restricties. |
|
Rogier Determann |
Intensivist, OLVG, Amsterdam |
Docent Amstelacademie en Expertcollege |
Geen |
Geen restricties. |
|
Sjieuwke Derksen |
Intensivist - MCL |
Geen |
Geen |
Geen restricties. |
|
Yvette Kuijpers |
Anesthesioloog-intensivist, CZE en MUMC + |
Geen |
Geen |
Geen restricties. |
|
Klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Christiaan Meuwese |
Cardioloog intensivist, Erasmus MC, Rotterdam |
Section editor Netherlands Journal of Critical Care (onbetaald) |
Extern gefinancierd onderzoek: - REMAP ECMO (Hartstichting) - PRECISE ECLS (Fonds SGS) |
Geen restricties. |
|
Jeroen Kraak |
KNO-arts & Hoofd-halschirurgie |
Geen |
Geen |
Geen restricties. |
|
Huub Grispen |
Anesthesiemedewerker Zuyderland MC |
Geen |
Geen |
Geen restricties. |
|
Harry Naber |
Anesthesioloog MSB Isala |
Geen |
Geen |
Geen restricties. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van FCIC/IC Connect voor de schriftelijke knelpunteninventarisatie en deelname aan de werkgroep. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. Ter onderbouwing van de module Aanwezigheid van naaste heeft IC Connect een achterbanraadpleging uitgevoerd. De conceptrichtlijn is tevens voor commentaar voorgelegd aan FCIC/IC Connect en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
|
Module |
Uitkomst raming |
Toelichting |
|
Module Peroxygenatie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor vitaal bedreigde patiënten die geïntubeerd worden buiten de OK. Tevens zijn er knelpunten aangedragen door verschillende stakeholders via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Cluster/richtlijn: NVIC Luchtwegmanagement bij de vitaal bedreigde patiënt buiten de OK-setting |
|
|
Uitgangsvraag/modules: UV3 Wat is de optimale methode van peroxygenatie bij de vitaal bedreigde patiënt die geïntubeerd wordt? |
|
|
Database(s): Embase.com, Ovid/Medline |
Datum: 26 februari 2024 |
|
Periode: vanaf 2017 |
Talen: geen restrictie |
|
Literatuurspecialist: Alies Oost |
Rayyan review: https://rayyan.ai/reviews/943732 |
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
→ Dit is een aanvullende search na UV2 (pre-oxygenatie). Er zijn al veel studies voor peroxygenatie gevonden bij UV2, daarom is het resultaat van deze search ontdubbeld t.o.v. dat van UV2. → Er is gezocht vanaf 2017 omdat er een systematic review is gevonden waarvoor is gezocht tot 2017. → De sleutelartikelen worden gevonden met deze search, maar zaten al in het resultaat van UV2. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase.com en Ovid/Medline is op 26 februari 2024 systematisch gezocht naar systematische reviews en RCTs over verschillende methoden van peroxygenatie. De literatuurzoekactie leverde 58 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld (ook ontdubbeld t.o.v. UV2) |
|
SR |
38 |
29 |
4 |
|
RCT |
163 |
124 |
54 |
|
Totaal |
201 |
153 |
58* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#1 |
'peroxygenase'/exp OR 'peroxygen'/exp OR peroxygen*:ti,ab,kw OR 'per oxygenat*':ti,ab,kw OR (((apnoeic OR apneic) NEAR/3 oxygen*):ti,ab,kw) OR 'peri intubat*':ti,ab,kw OR periintubat*:ti,ab,kw OR desaturat*:ti OR ((during NEAR/2 intubat*):ti,ab,kw) |
9514 |
|
#2 |
'manual emergency ventilator'/exp OR 'bag mask ventilation'/exp OR ((ambu NEAR/2 (bag* OR mask*)):ti,ab,kw) OR bvm:ti,ab,kw OR (('bag valve*' NEAR/3 (mask* OR device*)):ti,ab,kw) OR ((bag* NEAR/4 (resuscitat* OR ventilat*)):ti,ab,kw) OR 'non rebreath*':ti,ab,kw OR 'conventional oxygen therapy'/exp OR ((conventional NEAR/3 'oxygen therap*'):ti,ab,kw) OR cot:ti,ab,kw OR 'positive end expiratory pressure ventilation'/exp OR 'positive end expiratory pressure ventilator'/exp OR 'peep':ti,ab,kw OR 'positive end expiratory pressure':ti,ab,kw OR 'positive endexpiratory pressure':ti,ab,kw OR 'noninvasive ventilation'/exp OR ((('non invasive' OR noninvasive) NEAR/4 (ventilat* OR respir*)):ti,ab,kw) OR niv:ti,ab,kw OR nippv:ti,ab,kw OR 'nasal cannula therapy'/exp OR 'nasal cannula'/exp OR 'oxygen nasal cannula'/exp OR 'hfnc':ti,ab,kw OR 'hfno':ti,ab,kw OR ((('high flow' OR highflow OR hf) NEAR/3 (nasal OR oxygen*)):ti,ab,kw) OR (((nasal OR nasopharyngeal) NEAR/2 (cannula* OR prong* OR oxygen*)):ti,ab,kw) |
116110 |
|
#3 |
#1 AND #2 |
1184 |
|
#4 |
#3 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
598 |
|
#5 |
#4 AND [2017-2024]/py |
388 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
1003926 |
|
#7 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3976736 |
|
#8 |
#5 AND #6 - SR |
38 |
|
#9 |
#5 AND #7 NOT #8 - RCT |
163 |
|
#10 |
#8 OR #9 |
201 |
Ovid/Medline
|
# |
Searches |
Results |
|
1 |
(peroxygen* or 'per oxygenat*' or ((apnoeic or apneic) adj3 oxygen*) or 'peri intubat*' or periintubat*).ti,ab,kf. or desaturat*.ti. or (during adj2 intubat*).ti,ab,kf. |
6858 |
|
2 |
Oxygen Inhalation Therapy/ or Respiration, Artificial/ or (ambu adj2 (bag* or mask*)).ti,ab,kf. or bvm.ti,ab,kf. or ('bag valve*' adj3 (mask* or device*)).ti,ab,kf. or (bag* adj4 (resuscitat* or ventilat*)).ti,ab,kf. or 'non rebreath*'.ti,ab,kf. or (conventional adj3 'oxygen therap*').ti,ab,kf. or cot.ti,ab,kf. or 'exp Positive-Pressure Respiration/ or 'peep'.ti,ab,kf. or 'positive end expiratory pressure'.ti,ab,kf. or 'positive endexpiratory pressure'.ti,ab,kf. or exp Noninvasive Ventilation/ or (('non invasive' or noninvasive) adj4 (ventilat* or respir*)).ti,ab,kf. or niv.ti,ab,kf. or nippv.ti,ab,kf. or exp Cannula/ or 'hfnc'.ti,ab,kf. or 'hfno'.ti,ab,kf. or (('high flow' or highflow or hf) adj3 (nasal or oxygen*)).ti,ab,kf. or ((nasal or nasopharyngeal) adj2 (cannula* or prong* or oxygen*)).ti,ab,kf. |
98313 |
|
3 |
1 and 2 |
864 |
|
4 |
3 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
637 |
|
5 |
limit 4 to yr="2017 -Current" |
320 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
728276 |
|
7 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2694188 |
|
8 |
5 and 6 - SR |
29 |
|
9 |
(5 and 7) not 8 - RCT |
124 |
|
10 |
8 or 9 |
153 |