Voorkomen van postoperatieve wondinfecties (POWI’s) in de operatiekamer
Uitgangsvraag
Van welk luchtbehandelingsysteem moet een operatiekamer voorzien zijn om postoperatieve wondinfecties (POWI’s) zo veel mogelijk te voorkomen?
Aanbeveling
Om postoperatieve wondinfecties zoveel mogelijk te voorkomen is een operatiekamer klasse 1 of 2 voorzien van een luchtbehandelingsysteem dat (ongeacht het type luchtinblaassysteem) tenminste voldoet aan de minimale criteria genoemd in de module 'Criteria voor luchtkwaliteit in de operatiekamer'.
Voor electieve grote gewrichtsvervangende operaties (knie, heup, schouder) heeft de Nederlandse Orthopedische Vereniging de voorkeur voor het voortzetten van de bestaande praktijk om te opereren in een operatiekamer die voldoet aan de criteria van een operatiekamer klasse 1+ (module Criteria voor luchtkwaliteit in de operatiekamer).
Overwegingen
Kwaliteit van bewijs
De algehele kwaliteit van het bewijs is (zeer) laag vanwege het observationele karakter van de studies, de aanwezigheid van statistische heterogeniteit en de onzekerheid van de extrapoleerbaarheid van de studieresultaten naar de Nederlandse situatie.
Waarden en voorkeuren
Niet van toepassing, omdat de aanbevelingen niet op het niveau van de individuele patiënt zijn.
Kosten en middelen
Bij de kosten van luchtbehandelingsystemen wordt onderscheid gemaakt in operationele kosten en investeringskosten. Operationele kosten zijn de kosten om een luchtbehandelingsysteem operationeel te houden. Energiekosten en personeelskosten voor controle en onderhoud zijn hierbij de grootste kostenposten. In de WIP-richtlijn ‘Luchtbehandeling in operatiekamer en opdekruimte in operatieafdeling klasse 1’ uit 2014 concludeerde de expertgroep dat op basis van het beschikbare bewijs geen uitspraak kan worden gedaan over de kosten van een mengend ten opzichte van een verticaal UDF systeem. Ook de huidige werkgroep kan niet inschatten of er een verschil is in operationele kosten tussen het gebruik van een UDF en een mengend system, omdat de grootte van deze kostenposten afhangt van veel verschillende lokale factoren. Hetzelfde geldt ook voor de schatting van de investeringskosten.
Concluderend: op basis van het beschikbare bewijs kan de werkgroep geen uitspraak doen over de kosten van een mengend luchtbehandelingssysteem ten opzichte van andere luchtbehandelingsystemen.
Duurzaamheid
Van de twee meest toegepaste luchtinblaassystemen, mengend en verdringend, lijken er op het gebied van duurzaamheid voordelen voor gebruik van een mengend luchtinblaassysteem. Exacte gegevens hierover kunnen niet worden gegeven omdat de milieubelasting van meer factoren dan alleen het type luchtinblaassysteem afhangt. Wel leidt gebruik van een mengend systeem in de regel tot minder energieverbruik omdat de hoeveelheid ingeblazen lucht lager is.
Professioneel perspectief
Het luchtbehandelingsysteem kan niet los worden gezien van het gehele pakket aan maatregelen gericht op het voorkómen van POWI, zoals strenge naleving van werkafspraken, kledingvoorschriften, deurbeleid, juiste plaatsing operatielampen en andere apparatuur, gedisciplineerd gedrag op de operatiekamer en infectieregistratie en monitoring.
De luchtbehandelingsystemen dienen volgens vastgelegde criteria (zie de module 'Criteria voor luchtkwaliteit in de operatiekamer') periodiek gecontroleerd en onderhouden te worden om de kwaliteit te waarborgen. Dit wordt lokaal vastgelegd in een luchtbeheersplan (zie de module 'Luchtbeheersplan in de operatiekamer').
Algemene chirurgische ingrepen
Er is onvoldoende bewijs om een specifiek luchtbehandelingsysteem aan te bevelen.
Orthopedische implantaatchirurgie
Voor orthopedische implantaatchirurgie zijn in de onderzochte literatuur geen aanwijzingen gevonden dat het plaatsen van een prothese in een operatiekamer voorzien van een mengend systeem geassocieerd is met meer diepe postoperatieve wondinfecties dan wanneer een prothese geplaatst wordt in een operatiekamer voorzien van een UDF. De kwaliteit van bewijs ten faveure van een mengend of een verdringend luchtinblaassysteem ter preventie van POWI’s is (zeer) laag. Protheseregisterstudies lijken niet altijd betrouwbaar als databron voor prothese-infecties. De studie van Hooper (2011) laat bijvoorbeeld 0,09% infecties zien, terwijl wereldwijd minimaal 1% gezien wordt. Daarnaast blijkt het rapporteren door chirurgen van welk luchtinblaassysteem aanwezig is op de OK ook niet altijd betrouwbaar (gemiddeld in 12% van de totale heupvervangingen verkeerd gerapporteerd) (Langvatn 2019). In geval van infecties van implantaten, zoals bijvoorbeeld knie- en heupprotheses, zijn de consequenties van een POWI groot voor de patiënt en gaan POWI’s gepaard met hoge kosten. Het kan zijn dat een prothese verwijderd moet worden, lange ziekenhuisopnames nodig zijn en/of langdurige antibioticatherapie gegeven moet worden. POWI’s kunnen zelfs leiden tot weefseldestructie, amputatie en mortaliteit. De bewijskracht van de studies gebaseerd op de uitkomstmaat POWI is (zeer) laag. Derhalve wordt gesuggereerd dat het zinvol kan zijn in geval van implantaten te kijken naar een afgeleide uitkomstmaat als contaminatie van het wondgebied tijdens operaties. Theoretisch biedt een verdringend systeem bij goed gebruik hier voordelen. In de praktijk zijn er echter tijdens de operatie verstorende factoren aanwezig die dit theoretische voordeel zouden kunnen verminderen.
Voor electieve grote gewrichtsvervangende operaties (knie, heup, schouder) heeft de Nederlandse Orthopedische Vereniging de voorkeur voor het voortzetten van de bestaande praktijk om te opereren in een operatiekamer die voldoet aan de criteria van een operatiekamer met ultraschone lucht - klasse 1+ (zie module Criteria voor luchtkwaliteit in de operatiekamer), conform NICE (2020).
Er is geen literatuur gevonden voor andere implantaatchirurgie, zoals voor ingrepen in de urologie, plastische chirurgie of thoraxchirurgie.
Aanbevelingen ten aanzien van luchtbehandelingsysteem in internationale richtlijnen
Ook in de internationale richtlijnen WHO (2016), CDC (2017), NICE (2020) wordt geconstateerd dat het onderzoek op dit gebied ernstige tekortkomingen heeft en dat deze lage tot zeer lage bewijskracht een keuze voor het uitrusten van een operatiekamer met een UDF of een mengend systeem niet ondersteunt. Enkele voorbeelden van dergelijke aanbevelingen zijn te vinden in de bijlagen. Technische richtlijnen en wetenschappelijke onderzoeken naar luchtbehandelingsystemen zijn niet in het literatuuronderzoek betrokken.
Aanvaardbaarheid van de aanbeveling
In de aanbeveling wordt geen voorkeur uitgesproken voor een bepaald luchtinblaassysteem vanwege het ontbreken van overtuigend wetenschappelijk bewijs voor het ene of het andere luchtinblaassysteem. Verder zijn momenteel nieuwe luchtinblaassystemen verkrijgbaar die niet exact onder een van deze beide typen systeem kunnen worden geschaard. Derhalve is er voor gekozen dat ongeacht het type luchtinblaassysteem gebruik dient te worden gemaakt van een luchtbehandelingssysteem waarbij de luchtkwaliteit minimaal voldoet aan de criteria genoemd in de module 'Criteria voor luchtkwaliteit in de operatiekamer'.
Haalbaarheid van de te implementeren aanbeveling
De aanbeveling is haalbaar omdat deze aansluit op de huidige praktijk. Er wordt niet voorgeschreven dat er één bepaald luchtinblaassysteem moet zijn.
Kennishiaat
Er is geen gerandomiseerd onderzoek waarin het effect van de verschillende luchtbehandelingsystemen (inclusief systeemkarakteristieken) op postoperatieve wondinfecties vergeleken is ongeacht het type van de ingreep. Meer en vooral kwalitatief beter onderzoek naar het effect van verschillende luchtbehandelingsystemen op postoperatieve wondinfecties is dringend gewenst.
Rationale van de aanbeveling
Leidend bij het opstellen van de aanbevelingen was het feit dat in de literatuur geen bewijs is dat het gebruik van een verdringend systeem zich vertaalt in een lager aantal (diepe) postoperatieve wondinfecties. Hierbij was de bewijskracht van de literatuur zeer laag (retrospectieve observationele cohort studies). De werkgroep heeft geen gewicht toegekend aan de kosten, omdat deze afhangen van lokale factoren. De aanbevelingen zijn in lijn met veel van de internationale medische richtlijnen.
Onderbouwing
Achtergrond
Een zo schoon mogelijke chirurgische werkplek wordt in algemene zin van groot belang geacht ter voorkoming van postoperatieve wondinfecties (POWI’s). Luchtbehandeling is een van de mogelijkheden om luchtreinheid te beïnvloeden. Hoe groot de bijdrage van luchtbehandeling hieraan is, is - vergeleken met andere hygiënemaatregelen - niet bekend. Er zijn vele aanbieders van luchtbehandelingssystemen met verschillende (lucht)inblaastechnieken. Globaal is er onderscheid te maken tussen mengende en verdringende inblaassystemen. Het is van belang om te weten wat het effect is van de verschillende inblaassystemen op preventie van POWI’s. De keuze voor een systeem en de gebruikte luchtcirculatie heeft zowel organisatorische als klinische implicaties.
De gebruikte definities zijn te vinden in de Algemene inleiding.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Heupprothese
Diepe ‘surgical site’ infectie Het is onzeker of het plaatsen van een heupprothese in een operatiekamer voorzien van een UDF geassocieerd is met meer diepe ‘surgical site’ infecties in vergelijking met het plaatsten van een heupprothese in een operatiekamer voorzien van een mengend systeem.
Bron Bischoff et al., 2017; Pinder et al., 2016 |
|
Zeer laag GRADE |
Knieprothese
Diepe ‘surgical site’ infectie Er lijkt geen verschil te zijn in het optreden van diepe ‘surgical site’ infectie wanneer een knieprothese geplaatst wordt in een operatiekamer voorzien van een UDF of in een operatiekamer voorzien van een mengend systeem.
Bron Bischoff et al., 2017 |
|
Laag GRADE |
Orthopedische traumachirurgie
Diepe ‘surgical site’ infectie Het is onzeker of er minder diepe ‘surgical site’ infectie optreden wanneer orthopedische traumachirurgie verricht wordt in een operatiekamer voorzien van een mengend systeem.
Bron Bischoff et al., 2017 |
|
Zeer laag GRADE |
Abdominale chirurgie, open vasculaire chirurgie en dorsale spondylodese
Totale ‘surgical site’ infectie Er lijkt geen verschil te zijn in het optreden van totale ‘surgical site’ infectie wanneer schone ingrepen respectievelijk niet-schone ingrepen verricht worden in een operatiekamer voorzien van een UDF of van een mengend systeem.
Bron Bischoff et al., 2017; Gruenberg et al., 20014 |
|
__ |
Er werden geen studies geïdentificeerd die een UDF of mengend luchtbehandelingsysteem vergeleken hebben met een systeem op basis van een temperatuur gecontroleerde luchtstroom en POWI als uitkomstmaat. |
Samenvatting literatuur
Zie de evidence tabellen voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten. Voor gedetailleerde informatie over het risico op bias per studie zie de risk of bias tabellen.
De systematic review van Bischoff (2017) werd als uitgangspunt genomen en ge-update met twee recent gepubliceerde studies (Agarwal et al., 2017 en Pinder et al., 2016). Tevens werden door de werkgroep aan de review van Bischoff nog twee oudere studies toegevoegd (Gruenberg et al., 2004; Fitzgerald et al., 1992), die in de review van Bischoff geëxcludeerd werden. De redenen van exclusie door Bischoff et al. waren: de studie van Fitzgerald (1992) is weliswaar na 1990 gepubliceerd, echter voor 1990 uitgevoerd*. In de studie van Gruenberg (2004) is in de behandelarm UDF een additionele interventie toegevoegd, i.e. zogenaamde maanpakken waarbij volledige lichaam- en hoofdbedekking wordt gerealiseerd, in de controlegroep is deze additionele interventie niet toegevoegd (zie de evidence tabellen). De werkgroep besliste om deze twee oudere studies wel mee te nemen in tegenstelling tot de auteurs in de review van Bischoff. De redenen hiervoor waren dat de werkgroep het exclusiecriterium “publicatie voor 1990” strikter hanteerde en dat de werkgroep van mening was dat het in de literatuur bewezen is dat het toevoegen van de interventie “total body exhaust gowns” geen effect heeft op POWI. Ter info: het artikel van Fitzgerald was in Nederland niet verkrijgbaar en is daarom uiteindelijk niet meegenomen in de analyse.
* In de review van Bischoff werden studies die voor 1 januari 1990 gepubliceerd werden, geëxcludeerd.
In de review van Bischoff zijn de volgende 12 studies opgenomen: Bosanquet et al., 2013; Brandt et al., 2008; Breier et al., 2011; Dale et al., 2009; Hooper et al., 2011; Jeong et al., 2013; Kakwani et al., 2007; Miner et al., 2007; Namba et al., 2012; Namba et al.; 2013; Pedersen et al., 2010; Song et al., 2012.
Onderzoeksdesign
Alle 15 studies betreffen observationele cohortstudies. De meesten hiervan waren retrospectief.
Land waar studie is verricht
|
Studie verricht in |
Aantal studies |
|
Argentinië |
1 studie: Gruenberg et al.; 2004 |
|
Denemarken |
1 studie: Pedersen et al.,2010 |
|
Duitsland |
2 studies: Brandt et al., 2008; Breier et al., 2011 |
|
Nieuw-Zeeland |
1 studie: Hooper et al., 2011 |
|
Noorwegen |
1 studie: Dale et al., 2009 |
|
UK |
3 studies: Kakwani et al.; 2007; Pinder et al., 2016; Agarwal et al.; 2017 |
|
Verenigde Staten |
3 studies: Namba et al., 2012; Miner et al., 2007; Namba et al., 2013 |
|
Wales |
1 studie: Bosanquet et al., 2013 |
|
Zuid Korea |
2 studies: Song et al., 2012; Jeong et al., 2013 |
Studiepopulaties
De studies onderzochten patiënten die de volgende ingrepen ondergingen:
|
Ingreep |
Aantal studies |
|
Totale heupprothese |
9 studies: Brandt et al., 2008; Breier et al., 2011; Dale et al., 2009; Hooper et al., 2011; Kakwani et al., 2007; Namba et al., 2012; Pedersen et al., 2010; Pinder et al., 2016; Song et al., 2012. |
|
Totale knieprothese |
6 studies: Brandt et al., 2008; Breier et al., 2011; Hooper et al., 2011; Miner et al., 2007; Namba et al.; 2013; Song et al., 2012. |
|
Orthopedische traumachirurgie |
2 studies: Agarwal et al., 2017 en Pinder et al., 2016 |
|
Appendectomie |
1 studie: Brandt et al., 2008 |
|
Colonchirurgie |
1 studie: Brandt et al., 2008 |
|
Cholecystectomie |
1 studie: Brandt et al., 2008 |
|
Herniorafie |
1 studie: Brandt et al., 2008 |
|
Open vasculaire chirurgie |
1 studie: Bosanquet et al., 2013 |
|
Maagoperatie |
1 studie: Jeong et al., 2013 |
|
Dorsale spondylodese |
1 studie: Gruenberg et al., 2004 |
Interventies
Alle 15 studies vergeleken een UDF (interventie) met een niet-UDF (controle). De controlegroep werd in sommige studies beschreven als een conventionele (turbulente) luchtbehandeling. Drie studies rapporteerden de aanwezigheid van HEPA-filtratie in zowel de interventie- als de controlegroep (Brandt et al., 2008; Breier et al., 2011; Song et al., 2012). Geen van de auteurs rapporteerde de technische specificaties van de gebruikte luchtbehandelingsystemen.
Nieuwe systemen:
Temperatuurgecontroleerde luchtinblaas anders dan via een plenum: geen van de studies onderzocht een systeem op basis van temperatuurgecontroleerde luchtinblaas anders dan via een plenum.
Studiekarakteristieken van de 15 geïncludeerde studies
Studiekarakteristieken voor diepe ‘surgical site’ infectie
|
|
Aantal ingrepen (interventie/controle) |
Follow-up |
Puntschatter (95% BI) voor UDF
|
|
Totale heupprothese |
|||
|
Kakwani (2007) |
435 (212/223) |
1 jaar |
RR 0,06 (0,00–0,95)* |
|
Brandt (2008) |
28 623 (17 657/10 966) |
1 jaar |
OR 1,63 (1,06–2,52) |
|
Dale (2009) |
93 958 (45 620/48 338) |
dood / loss to follow-up/ revisie |
RR 1,3 (1,1–1,5) |
|
Pedersen (2010) |
80 756 (72 423/8333) |
dood / loss to follow-up/ revisie |
HR 0,9 (0,7–1,14) |
|
Breier (2011) |
41 212 (29 530/11 682) |
1 jaar |
Artrose OR 1,10 (0,56–2,17); Fractuur OR 1,28 (0,67–2,43) |
|
Hooper (2011) |
51 485 (16 990/34 495) |
6 maanden |
RR 2,42 (1,35–4,32)* |
|
Namba (2012) |
30 491 (8478/22 013) |
1 jaar |
HR 1,08 (0,77–1,53) |
|
Song (2012) |
3186 (2037/1149) |
1 jaar |
RR 1,2 (0,6–2,16)* |
|
Pinder (2016) |
98 064 (85 567/12 497) |
3 maanden |
Na installatie UDF: OR 1,55 (1,17 to 2,00) Altijd LAF: OR 1,45 (1,17 to 1,80) |
|
Totale knieprothese |
|||
|
Miner (2007) |
8288 (3513/4775) |
90 dagen |
RR 1,57 (0,75–3,31) |
|
Brandt (2008) |
9396 (5993/3403) |
1 jaar |
OR 1,76 (0,80–3,85) |
|
Breier (2011) |
20 554 (14 456/6098) |
1 jaar |
OR 0,95 (0,37–2,41) |
|
Hooper (2011) |
36 826 (13 994/22 832) |
6 maanden |
RR 1,92 (1,10–3,34)* |
|
Song (2012) |
3088 (2151/937) |
1 jaar |
RR 0,51 (0,29–0,89) † |
|
Namba (2013) |
56 216 (16 693/39 523) |
1 jaar |
HR 0,91 (0,71–1,16) |
|
Orthopedische traumachirurgie |
|||
|
Pinder (2016) |
660631 (555 884/104 747) |
3 maanden |
OR 0,71 (0,46–1,09) |
|
Agarwal (2017) |
159 (85/74) |
minstens 6 maanden |
OR 2,64 (0,11–65,92)* |
RR=relatief risico. HR=hazard ratio. OR=odds ratio. *Niet gecorrigeerd (puntschatter berekend met ruwe data, geen multivariate analyse). † Niet gecorrigeerd (relatief risico (RR) berekend met ruwe data, niet significant in multivariaat analyse).
Drie studies onderzochten alleen vroege prothese-infecties (follow-up korter dan een jaar) (Hooper et al., 2011; Pinder et al., 2016; Miner et al., 2007).
Studiekarakteristieken voor totale ‘surgical site’ infectie
|
|
Aantal ingrepen (interventie/controle) |
Follow-up |
Gecorrigeerde OR (95% BI) voor UDF |
|
Appendectomie |
|||
|
Brandt (2008) |
10 969 (7193/3776) |
1 jaar |
2,09 (1,08–4,02) |
|
Colonchirurgie |
|||
|
Brandt (2008) |
8696 (6201/2495) |
1 jaar |
1,17 (0,65–2,11) |
|
Cholecystectomie |
|||
|
Brandt (2008) |
20 676 (12 419/8257) |
1 jaar |
1,53 (0,9–2,45) |
|
Herniorafie |
|||
|
Brandt (2008) |
20 870 (12 667/8203) |
1 jaar |
1,67 (0,9–2,91) |
|
Open vasculaire chirurgie |
|||
|
Bosanquet 2013 |
170 (56/114) |
Niet gerapporteerd |
0,38 (0,12–1,19)* |
|
Maagoperatie |
|||
|
Jeong (2013) |
2091 (1919/172) |
1 maand |
0,13 (0,08–0,22)* |
|
Dorsale spondylodese |
|||
|
Gruenberg (2004) |
179 (40/139) |
> dan 2 jaar |
OR 0.08 (0.00–1.38)* |
OR=odds ratio. *Niet gecorrigeerd (puntschatter berekend met ruwe data, geen multivariate analyse).
Resultaten
Diepe ‘surgical site’ infectie na plaatsen heupprothese
In negen studies werd diepe ‘surgical site’ infectie als uitkomstmaat onderzocht. Pooling laat zien dat de kans op een diepe ‘surgical site’ infectie hoger is wanneer een heupprothese geplaatst wordt in een operatiekamer voorzien met een UDF (zie figuur 1).
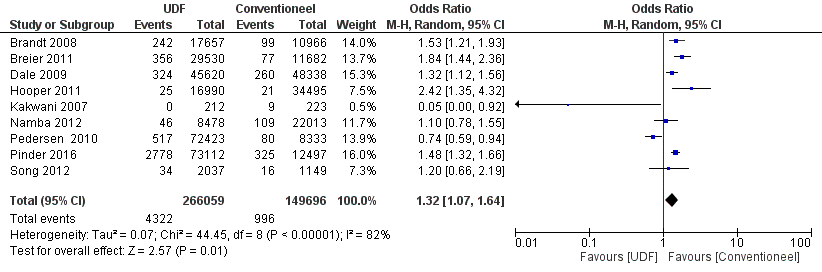
Figuur 1 Diepe ‘surgical site’ infectie na plaatsen heupprothese
Het vóórkomen van diepe ‘surgical site’ infectie neemt toe van 7 per 1000 naar 9 per 1000 wanneer een heupprothese geplaatst wordt in een operatiekamer voorzien met een UDF in plaats van met een mengend systeem.
Diepe ‘surgical site’ infectie na plaatsen knieprothese
In zes studies werd diepe ‘surgical site’ infectie als uitkomstmaat onderzocht. Pooling laat geen verschil zien in het aantal diepe ‘surgical site’ infecties tussen wanneer een knieprothese geplaatst wordt in een operatiekamer voorzien met een UDF of een mengend systeem (zie figuur 2).
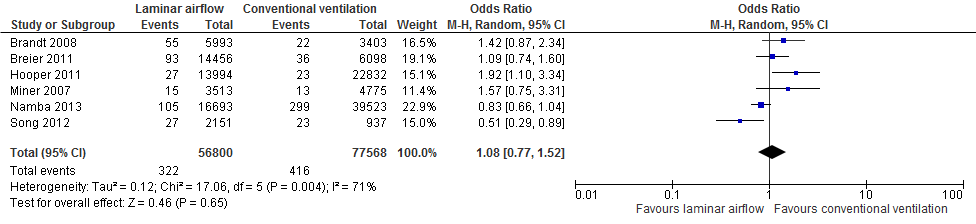
Figuur 2 Diepe ‘surgical site’ infectie na plaatsen knieprothese
Diepe ‘surgical site’ infectie na orthopedische traumachirurgie
In twee studies werd diepe ‘surgical site’ infectie als uitkomstmaat onderzocht. Pooling laat een (zeer) klein voordeel zien in het aantal diepe ‘surgical site’ infecties wanneer orthopedische traumachirurgie verricht wordt in een operatiekamer voorzien met een mengend systeem (zie figuur 3).
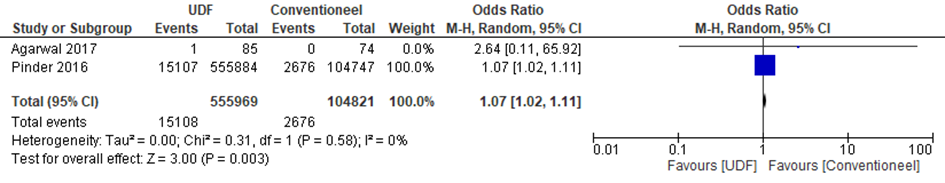
Figuur 3 Diepe ‘surgical site’ infectie na Orthopedische traumachirurgie
Totale POWI
In vier studies werd totale ‘surgical site’ infectie als uitkomstmaat onderzocht voor uiteenlopende chirurgische ingrepen (Brandt et al., 2008; Bosanquet et al., 2013; Jeong et al., 2013; Gruenberg et al., 2004). Pooling van schone ingrepen respectievelijk niet-schone ingrepen laat geen statistisch significant verschil zien in het totale aantal ‘surgical site’ infecties tussen wanneer deze ingrepen verricht worden in een operatiekamer voorzien met een UDF of een mengend systeem (zie figuur 4).
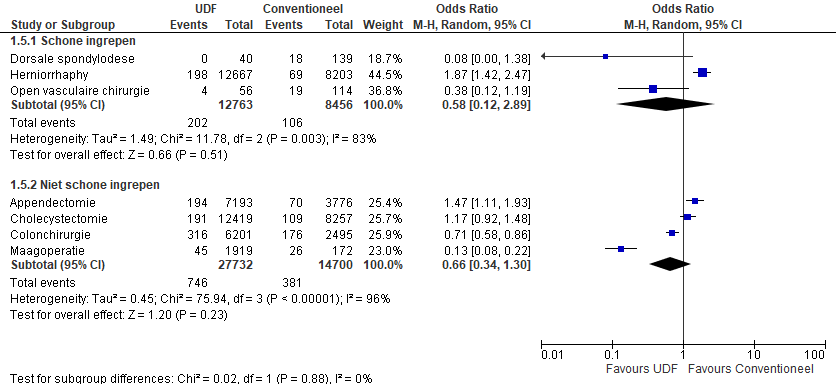
Figuur 4 Totale ‘surgical site’ infecties na abdominale chirurgie, open vasculaire chirurgie en dorsale spondylodese
Kwaliteit van bewijs
De werkgroep heeft de kwaliteit van bewijs beoordeeld volgens de GRADE-methodiek. Voor studies over interventies (het toepassen van een ander luchtbehandelingsysteem is een interventie) starten gerandomiseerde onderzoeken in de categorie hoog en observationele studies in de categorie laag. De evidence werd per uitkomstmaat getoetst aan de criteria beperkingen in onderzoeksopzet, inconsistentie, indirectheid, onnauwkeurigheid en publicatiebias.
Voor de uitkomstmaten diepe ‘surgical site’ infectie na plaatsen heupprothese / na plaatsen knieprothese / na orthopedische traumachirurgie; totale ‘surgical site’ infecties na abdominale chirurgie, open vasculaire chirurgie en dorsale spondylodese
Vanwege het observationele karakter van de onderzoeken start de kwaliteit van bewijs voor de uitkomstmaat diepe ‘surgical site’ infectie als laag. De bewijskracht werd afgewaardeerd van laag naar zeer laag vanwege de aanwezigheid van statistische heterogeniteit (inconsistentie) (I2 = 82%; 71%; 83% respectievelijk 96%). Daarnaast is het onzeker of de studieresultaten extrapoleerbaar zijn naar de Nederlandse situatie, omdat in Nederland de huidige eisen voor een mengend/verdringend systeem mogelijk anders zijn dan de eisen die in de studies werden toegepast.
Ter info: in de bijlagen kunt u de kwaliteitsbeoordeling van de individuele observationele studies zien.
Voor de uitkomstmaten diepe ‘surgical site’ infectie na orthopedische traumachirurgie
Vanwege het observationele karakter van de onderzoeken is de kwaliteit van bewijs voor de uitkomstmaat diepe ‘surgical site’ infectie laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep een systematische literatuuranalyse verricht met de volgende PICO-vraagstelling:
Wat is het verschil in effect van de verschillende luchtbehandelingsystemen (zie tabel 1) ten opzichte van elkaar op de uitkomstmaat postoperatieve wondinfectie (POWI) bij patiënten die een chirurgische ingreep ondergaan?
In de databases Medline (OVID), Embase and Cochrane is in april 2018 een systematische search verricht voor deze PICO-vraagstelling. Zie de zoekverantwoording.
Tabel 1 Selectiecriteria
|
Type studies |
|
|
Type patiënten |
|
|
Interventie/control |
versus
versus
|
|
Type uitkomstmaten* |
|
|
Type setting |
|
|
Exclusiecriteria |
|
* De werkgroep heeft de uitkomstmaat ‘contaminatie van de OK-lucht en de instrumenten’ niet meegenomen, omdat dit geen patiëntgerelateerde uitkomstmaat is en derhalve niet beslissend werd geacht bij het formuleren van de aanbeveling.
De literatuurzoekactie leverde 682 treffers op. Zesendertig studies werden geselecteerd op basis van titel en abstract. Na het lezen van de volledige artikelen voldeden hiervan uiteindelijk vijf studies aan de selectiecriteria en werden meegenomen in de literatuuranalyse (Bischoff et al., 2017; Agarwal et al., 2017; Pinder et al., 2016; Gruenberg et al., 2004; Fitzgerald et al., 1992), waaronder de systematic review van Bischoff (2017). In de exclusietabel staan de redenen van exclusie van de andere 31 studies vermeld.
Referentiecheck leverde geen extra artikelen op.
De systematic review van Bischoff (2017) voldeed aan de vereiste AMSTAR-kwaliteitscriteria (zie bijlagen). De systematic review van Evans (2011), die aanvankelijk geselecteerd werd, voldeed niet aan de vereiste AMSTAR-kwaliteitscriteria en werd daarom geëxcludeerd (zie exclusietabel).
Referenties
- Advies van de Hoge Gezondheidsraad nr. 8573. Aanbevelingen voor de beheersing van de postoperatieve infecties in het operatiekwartier. Mei 2013 – Update 23/07/2014
- Agarwal, S. K., et al. Hip fracture surgery in mixed-use emergency theatres: is the infection risk increased? A retrospective matched cohort study. Annals of the Royal College of Surgeons of England 2017. 99(8): 641-644.
- Bischoff, P., et al. Effect of laminar airflow ventilation on surgical site infections: a systematic review and meta-analysis. The Lancet Infectious Diseases 2017. 17(5): 553-561.
- CDC guideline for the Prevention of Surgical Site Infection, USA, 2017
- Fitzgerald RH Jr. Total hip arthroplasty sepsis. Prevention and diagnosis. Orthop Clin North Am 1992; 23: 259–64.
- Gruenberg MF, Campaner GL, Sola CA, Ortolan EG. Ultraclean air for prevention of postoperative infection after posterior spinal fusion with instrumentation: a comparison between surgeries performed with and without a vertical exponential fi ltered air-fl ow system. Spine 2004; 29: 2330–34.
- Langvatn H, Bartz-Johannessen C, Schrama JC, et al. Operating room ventilation - Validation of reported data on 108 067 primary total hip arthroplasties in the Norwegian Arthroplasty Register. J Eval Clin Pract. 2019;1-8 https://doi.org/ 10.1111/jep.13271.
- NICE guideline Surgical site infection, UK, 2013
- NICE guideline Joint replacement (primary): hip, knee and shoulder, UK, 2020
- Pinder E. M., et al. Does laminar flow ventilation reduce the rate of infection? an observational study of trauma in England. Bone & Joint Journal 2016. 98-B(9): 1262-1269.
- Robert Koch-Instituut. Prävention postoperativer Wundinfektionen Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut, 2018
- WHO Guideline for the Prevention of Surgical Site Infection, 2016
Evidence tabellen
AMSTAR-beoordeling review Bischoff
(Effect of laminar airflow ventilation on surgical site infections: a systematic review and meta-analysis. Lancet Infect Dis 2017)
|
Was an 'a priori' design provided? |
Yes The authors followed the PRISMA guidelines. |
|
Was there duplicate study selection and data extraction? |
Yes Two independent reviewers (PB and PG) screened the titles and abstracts of retrieved references for potentially relevant studies. The full text of all potentially eligible articles was obtained and then reviewed independently by two authors (PB and PG) or eligibility. Any disagreements were resolved through discussion or after consultation with NZK, when necessary. |
|
Was a comprehensive literature search performed? |
Yes We searched MEDLINE, Embase, Cochrane Central Register of Controlled Trials, and WHO regional medical databases. We used a comprehensive list of search terms—ie, “ventilation”, “surgical wound infection”, and “operating rooms”—including Medical Subject Headings (appendix pp 1, 2), for studies published between Jan 1, 1990, and Jan 31, 2014. We updated the search for MEDLINE for the period between Feb 1, 2014, and May 25, 2016. |
|
Was the status of publication (i.e. grey literature) used as an inclusion criterion? |
Unclear The authors did not report whether they searched for grey literature. Unpublished studies were not included in the analysis. |
|
Was a list of studies (included and excluded) provided? |
Partly The authors didn’t provide a list of the excluded studies and they didn’t reference the excluded studies in a clear way.
109 full-text articles were assessed for eligibility. The authors reported that 97 full-text articles were excluded. The reasons were: 89 studies were not relevant to PICO question; in 4 studies the intervention were combined with additional measures (ref: 41, 42, 43, 44), in 1 study the study period was out of date (ref 17), 1 review (ref?), 1 primary data not available (ref 45), 1 full text not available (ref?). |
|
Were the characteristics of the included studies provided? |
Yes See evidence tables in supplement. |
|
Was the scientific quality of the included studies assessed and documented? |
Yes Quality was assessed with the Newcastle–Ottawa Quality Assessment Scale (NOS) for cohort studies (appendix p 18). Any disagreements were resolved through discussion or after consultation with NZK, when necessary. |
|
Was the scientific quality of the included studies used appropriately in formulating conclusions? |
No The Grading of Recommendations Assessment, Development and Evaluation (GRADE) method (GRADEpro software) was used to assess the quality of evidence retrieved as appropriate.
The evidence for laminar airflow ventilation vs. conventional ventilation for patients undergoing THA and TKA, was graded very low (see Grade tables, supplement). However, in the conclusions the authors didn’t account for the level of evidence (i.e. very low). They should have stated that “laminar airflow compared to conventional ventilation may increase the risk of deep surgical site infection after total hip arthroplasty. However, we are unsure because the level of evidence is very low and we cannot exclude a null effect”.
They should have stated that “laminar airflow compared to conventional ventilation may not increase the risk of deep surgical site infection after total knee arthroplasty. However, we are unsure because the level of evidence is very low and we cannot exclude harm [appreciable harm (OR≥1.25) crosses the confidence interval (0.77-1.52)”. |
|
Were the methods used to combine the findings of studies appropriate? |
Yes Meta-analyses of available comparisons were done with RevMan (version 5.3) as appropriate. Crude estimates were pooled as odds ratios (ORs) with 95% CIs by use of a DerSimonian and Laird random eff ect model for each comparison. |
|
Was the likelihood of publication bias assessed? |
Yes Funnel plots were created to assess whether publication bias occurred. |
|
Was the conflict of interest included? |
Yes The authors have declared that no competing interests exist. |
AMSTAR-beoordeling review Evans 2011
(Current Concepts for Clean Air and Total Joint Arthroplasty: Laminar Airflow and Ultraviolet Radiation)
|
Was an 'a priori' design provided? |
No The author didn’t refer to an a priori protocol and there is no method paragraph.
The research question is unclear (comparator to LAF?; study design?) and there are no selection criteria reported.
Just the search strategy is presented. |
|
Was there duplicate study selection and data extraction? |
No There was just one author. |
|
Was a comprehensive literature search performed? |
Yes The author searched in several databases.
Remark: the string does not include the term “ventilation”. |
|
Was the status of publication (i.e. grey literature) used as an inclusion criterion? |
Unclear The authors did not report whether they searched for grey literature. Unpublished studies were not included in the analysis. |
|
Was a list of studies (included and excluded) provided? |
No
|
|
Were the characteristics of the included studies provided? |
No |
|
Was the scientific quality of the included studies assessed and documented? |
No
|
|
Was the scientific quality of the included studies used appropriately in formulating conclusions? |
No
|
|
Were the methods used to combine the findings of studies appropriate? |
No |
|
Was the likelihood of publication bias assessed? |
No
|
|
Was the conflict of interest included? |
Yes The author has received research support from Cubist Pharmaceuticals (Boston, MA) and is a consultant with DePuy (Warsaw, IN) and Smith and Nephew (Memphis, TN). |
Evidence tabellen
|
Authors (year) |
Design |
Objective |
Population, Type of surgery |
Setting, Scope |
Control, Intervention |
Methods |
Results |
Limitations |
|
Namba et al (2013) |
Retro-spective review of a pro-spectively followed cohort |
To evaluate risk factors associated with deep surgical site infection (SSI) following total knee arthroplasty in a large U.S. integrated health care system |
No. of Patients: Total: N=56216 Control group: N=39523 (70.3%) Intervention group: N=16693 (29.7%)
Patient characteristics: Adult patients: average age: 67.4 yrs
Procedures: Primary elective total knee arthroplasties only |
Location: 45 locations in 6 regions in the USA Dates: April 1, 2001 – Dec 30, 2009 Scope: mutlicentre
N=52034 patients (92.6%) received surgical antibiotic prophylaxis (SAP). |
Control group: Operating rooms (ORs) without laminar airflow (LAF)
Intervention group: Laminar airflow in the operating room. |
Definitions: The CDC definitions were used for identifying deep surgical site infections (dSSI). Superficial wound infections were not considered.
Statistical analysis: Chi-square test (or Fisher’s exact test) was used to compare patient, surgeon/ hospital and procedure characteristics between groups with or without dSSI. Continuous variables were compared by using t-test for two independent samples. Univariable Cox proportional hazard models (CpHm) of the association between variables and dSSI were built. All factors found to be independently associated with dSSI were included in the multivariable CpHm. Collinearity and potential confounding by covariables were assessed.
Data collected by a total joint replacement registry were combined with data from the patient’s electronic health records. |
Follow-up period: until the date of diagnosis of dSSI (CDC: 12 months) lost-to-follow-up: until date of termination of the insurance policy or death
Control group: dSSI: 299/39523 (0.8%) (calculated)
Intervention group: dSSI: 105/16693 (0.6%)
LAF: no dSSI: N=16588 (29.7%) (compared with total of no dSSI)
dSSI: N=105 (26%) (compared with total of dSSI), P= 0.102
Unvariable (CpHm): Hazard Ratio (HR): 0.83 (95% CI: 0.66-1.04), P=0.1
Multivariable (CpHm): Hazard Ratio (HR): 0.91 (95% CI: 0.71-1.16), P=0.436 |
Infection risk factors that are not collected in the registry cannot be evaluated (i.e. postoperative wound classification). The investigators did not provide additional information about the ventilation system of the ORs without LAF. Upon request they reported that they have regarded LAF as a “preventive measure” during the surgical procedure within their dataset. |
|
Namba et al (2012) |
Retro-spective review of a pro-spectively followed cohort |
To evaluate risk factors associated with dSSI following total hip replacement in a large U.S. integrated health care system |
No. of Patients: Total: N=30491 Control group: N=22013 (72.2%) Intervention group: N=8478 (27.8%)
Patient characteristics: Adult patients: average age: 65.5 yrs
Procedures: Primary elective total hip replacement only |
Location: 46 locations in 6 regions in the USA Dates: April 1, 2001 – Dec 30, 2009 Scope: mutlicentre
N=27943 patients (91.6%) received SAP. |
Control group: ORs without LAF
Intervention group: The use of LAF in the operating room. |
Definitions: The CDC definitions were used for identifying dSSI.
Statistical analysis: Chi-square test (or Fisher’s exact test) was used to compare patient, surgeon/ hospital and procedure characteristics between groups with or without dSSI. Continuous variables were compared by using t-test for two independent samples. Univariable CpHm of the association between variables and dSSI were built. All factors found to be independently associated with dSSI were included in the multivariable CpHm. Collinearity and potential confounding by covariables were assessed.
Data collected by a total joint replacement registry were combined with data from the patient’s electronic health records. |
Follow-up period: until the date of diagnosis of dSSI (CDC: 12 months) lost-to-follow-up: until date of termination of the insurance policy or death: Attrition rate of 2.7% (N=826)
Control group: dSSI: 109/22013 (0.5%) (calculated)
Intervention group: dSSI: 46/8478 (0.5%)
LAF: no dSSI: N=8432 (27.8%) (compared with total of no dSSI)
dSSI: N=46 (29.7%) (compared with total of dSSI) P= 0.602
Unvariable (CpHm): Hazard Ratio (HR): 1.08 (95% CI: 0.77-1.53) P=0.651 |
Infection risk factors that are not collected in the registry cannot be evaluated (i.e. postoperative wound classification). The investigators did not provide additional information about the ventilation system of the ORs without LAF. Upon request they reported that they have regarded LAF as a “preventive measure” during the surgical procedure within their dataset. |
|
Song et al (2012) |
Retro-spective cohort study |
To characterize and identify the risk factors for SSIs after total hip arthroplasty (THA) and total knee arthroplasty (TKA) in a nationwide survey using shared case detection and recording systems |
No. of Patients: Total: N=6848 THA: N=3422 TKA: N=3426
Patient characteristics: Mostly adult patients: average age: 67 yrs; range: 15 – 107 yrs
Procedures: Total hip arthroplasty and total knee arthroplasty |
Location: 26 hospitals (300 or more beds), Republic of Korea Dates: 2006 – 2009: total of 396 months Scope: multicentre
N=6341 patients (92.6%) received SAP. |
Group 1: HEPA filter and LAF ventilation
Group 2: HEPA filter and conventional turbulent ventilation
Group 3: no artificial ventilation
No. of interventions: THA: Group 1: N=2037 Group 2: N=1149 Group 3: N=236
TKA: Group 1: N=2151 Group 2: N=937 Group 3: N=338 |
Definitions: The CDC definitions were used for identifying SSIs.
Statistical analysis: Differences between patients with or without SSI were analyzed using the x²-test for categorical variables and the t-test for continuous variables. A stepwise multiple logistic regression model was used to identify independent risk factors for SSI. In univariable analysis variables with p<0.1 were included in further analysis. Significance threshold in multivariable analysis was p<0.05.
Data were provided by the Korean Nosocomial Infections Surveillance System.
|
Follow-up period: 12 months
Univariable Analysis: THA: Superficial AND deep SSIs: Total: N=78 Group 1: 50/78 (64%) “Reference” Group 2: 20/78 (26%) OR: 0.7 (95% CI: 0.47-1.19) Group 3: 8/78 (10%) OR: 1.39 (95% CI: 0.65-2.98)
TKA: Superficial AND deep SSIs: Total: N=83 Group 1: 37/83 (45%) “Reference” Group 2: 29/83 (35%) OR: 1.83 (95% CI: 1.12-2.99) Group 3: 17/83 (20%) OR: 3.03 (95% CI: 1.68-5.44)
Multivariable Analysis: TKA: Group 1: “Reference” Group 2: Not significant Group 3: Superficial AND deep SSIs: OR: 2.82 (95% CI: 1.45-5.49) DSSIs only: OR: 2.81 (95% CI: 1.30-6.07)
The author kindly provided data and numbers of dSSIs upon request for further calculation. |
The investigators considered “HEPA filter and LAF ventilation” as the reference ventilation system. Thus, they compared “no artificial ventilation” with “HEPA filter and LAF ventilation”. They did not compare “no artificial ventilation” with “conventional turbulent ventilation” in their analyses. Possible selection bias as smaller hospitals with <300 beds were excluded. No information about patients that were lost to follow-up/ attrition; 113 patients (of a total of N=6961 operations within the study) who did not complete the 1-year-follow-up period were not counted as attrition but excluded from the study.
|
|
Jeong et al (2013) |
Prospective cohort study |
To determine the incidence of and risk factors for SSI in patients undergoing gastric surgery |
No. of Patients: Total: N=2091
Patient characteristics: Adult patients: average age: 60.1 yrs (SSI group) 58.5 yrs (non-SSI group)
Procedures: Gastric surgery due to gastric tumor (99.5%), other (0.05%) |
Location: 10 hospitals (>500 beds; 9 tertiary care, 1 secondary hospital), Republic of Korea Dates: June 1, 2010 – Aug 31, 2011 Scope: multicentre
N=1998 patients (95.6%) received SAP
|
Hospital data about the operating room environment were evaluated for (1) presence of LAF ventilation, (2) presence of HEPA-filters and other variables.
Intervention group: N=1919 patients operated in ORs with LAF ventilation
|
Definitions: The CDC definitions were used for identifying SSIs.
Statistical analysis: All variables were compared between the SSI group and the non-SSI group either using the t-test or the chi-square test. The associated effects of various variables on SSIs were assessed by a logistic regression model. P<0.05 was considered statistically significant.
The authors reported results for the Mann-Whitney U test and Fisher’s exact but they did not include the tests in their methods section.
Data were provided by an SSI Surveillance Program. |
Follow-up period: 1 month
Presence of LAF:
no SSI: N=1874 (92.8%) (compared with total of no SSI)
SSI: N=45 (63.4%) (compared with total SSI) P<0.001
Multivariable analysis: Absence of LAF: OR: 2.45 (95% CI: 1.13-5.31) P=0.024 |
Almost all operations were performed in ORs with LAF ventilation (N=1919) and ORs equipped with HEPA filters (N=1963). The investigators did not provide additional information about the ventilation system of the ORs without LAF (N=172).
Possible selection bias as smaller hospitals with <500 beds) were excluded. No information about patients that were lost to follow-up/ attrition.
|
|
Bosanquet et al (2013) |
Retro-spective review of a pro-spectively maintained database |
To identify factors influencing the rate of infection after open vascular surgery. |
No. of Patients: Total: N=170 Control group: N=114 Intervention group: N=56
Patient characteristics: Adult patients: average age: 64.8 yrs (non-laminar flow group) 69.1 yrs (laminar flow group)
Procedures: Open vascular procedures (arterial and venous) including arterial bypasses |
Location: 1 hospital (570 beds), Wales, United Kingdom Dates: not reported Scope: single centre
All patients N=170 received SAP. Narrated that all patients underwent the same preparation procedure prior to surgery. Surgery was performed by the same surgeon and assisting team.
|
Surgery was performed in both LAF and conventional ORs with allocation randomly assigned via the waiting list. Surgery in LAF environment was considered as intervention. |
Definitions: The CDC definitions were used for identifying SSIs.
Statistical analysis: To compare both groups a two-tailed student’s t-test was used for continuous variables and a two tailed chi-square or Fisher’s exact test for categorical variables. The effects of various variables on SSIs were assessed by a logistic regression model. The Hosmer-Lemeshow test was used to assess model goodness of fit. p<0.05 was considered significant. |
Follow-up period: not reported
Control group: SSI: 19/114 (16.7%)
Intervention group: SSI: 4/56 (7.1%)
Of the 23 SSIs, 14 were superficial and 9 were deep infections. The investigators did not state how many of the superficial and deep SSIs were in the control or in the intervention group.
Comparison (SSI) between groups: P=0.1
Non-LAF room: no SSI: N=95 (64.6%) (compared with total of no SSI)
SSI: N=19 (82.6%) (compared with total SSI) P=0.108
Multivariable analysis: Absence of LAF: OR: 4.02 (95% CI: 1.18-13.69) P=0.026
Patients undergoing arterial graft insertion: Co: SSI: 15/46 (32.6%) In: SSI: 4/35 (11.4%) P=0.034
Non-LAF room: no SSI: N=31 (50%) (compared with total of no SSI)
SSI: N=15 (78.9%) (compared with total SSI) P=0.04
Multivariable analysis: Absence of LAF: OR: 3.47 (95% CI: 1.02-11.88) P=0.047 |
Very high SSI rate. Small number of patients and large confidence intervals. Most likely some SSIs were not detected because the study lacked of a defined follow-up period. The authors note that the case mix is heterogeneous and not equally matched between the two OR environments, i.e. all five axillary bypass procedures were undertaken in a non-LAF room. The percent of patients that received SAP differed by group. The investigators did not describe the number of patients that were lost to follow-up or the attrition rate.
|
|
Pedersen et al (2010)36 |
Population-based follow-up study using prospective data |
To examine potential patient- and surgery-related risk factors for revision due to infection after primary total hip arthroplasty (THA)
|
No. of Patients: Total: N=80756 THAs in N=74639 patients
Patient characteristics: Adult patients
Procedures: Revision following primary elective total hip arthroplasties due to infection only
|
Location: hospitals (N=52) in Denmark Dates: Jan 1 1995 – Dec 31 2008 Scope: multicentre |
Operations performed in ORs with a conventional ventilation system served as reference/ control.
Intervention group: Primary elective total knee arthroplasties performed in ORs with LAF ventilation.
|
Definitions: Infections were classified according to the International Classification of Diseases (ICD-8 up to 1995; ICD-10 after 1995). SSIs were identified by the surgeon.
Statistical analysis: Cox’s regression analysis was used to examine the association between variables and risk of revision due to infection. A hazard ratio was estimated as a measure of relative risk with 95% CI for each risk factor, crude and adjusted. Bilateral THAs were treated as 2 independent cases.
Data were obtained from the Danish Hip Arthroplasty Register. |
Follow-up period: average 5 yrs (range 0-14) Follow up started on the day of primary THA until death, emigration or the day of revision.
Revisions due to infection: Total: N=597/80756 (0.74%)
Control group: 80/8333 (0.96%) Crude and adjusted (adj) HR: 1 “reference”
Intervention group: 517/72423 (0.71%) Crude HR: 0.81 (95% CI: 0.64-1.03) Adj HR: 0.9 (95% CI: 0.7-1.14) |
The effect of prior surgical procedures and systemic antibiotics were not studied due to the small sample size and low number of revisions. No data on SSI in general: severe infections leading to revision operation were assessed. Some possible confounders related to risk factors and infection rate that were not available in the dataset (i.e. weight, height, smoking, alcohol intake, medication) may have influenced the risk estimates in this study. Lack of registration of revisions may have caused underestimation of the overall revision rate. Inconsistent coding practices may have introduced residual confounding. |
|
Dale et al (2009) |
Observa-tional cohort study |
To assess the risk factors for revision due to deep infection after primary total hip arthroplasty (THA) |
No. of Patients: Total: N=97344 THAs in N=79820 patients
Patient characteristics: Adult patients; males 30%, females 70 %
Procedures: Revision following primary elective total hip arthroplasties (cemented or not) due to infection only
|
Location: hospitals in Norway Dates: Sept 15, 1987 – Jan 1, 2008 Scope: multicentre
The endpoint in analysis was removal or exchange of the whole or parts of the prosthesis due to infection. If infections were cured with the prosthesis in situ (i.e. isolated soft tissue revision) it was not considered.
92% (1987-1992) to 100% (1993-2007) of the patients received SAP. |
Operations performed in ORs with (1) LAF and (2) in “green-house” environment were analyzed. Operations performed in ORs with a conventional ventilation system served as the reference for each variable.
|
Definitions: Definitions used for identifying dSSI were not reported.
The infection was reported by the surgeon.
Statistical analysis: As the follow-up period was 20 years, 4 time periods were compared. Revision rate ratios and p-values are relative to the first time period. It was adjusted for differences over time concerning various risk factors. Cox regression analyses with stratification factors were used to construct cumulative revision curves at mean values of the covariates, and to assess 5-year survival percentages. Risk ratio analyses were performed for the different risk factors. P<0.5 was considered significant.
Data were obtained from the Norwegian Arthroplasty Register.
|
Follow-up period: range 0-20 yrs Follow up was until death, emigration or the day of revision.
Revisions due to deep infection: Total: N=614/97344 (0.63%)
In analyses the variables are adjusted for all the other risk factors in addition to year of surgery:
Control group: The relative revision risk for operations performed in ORs with a conventional ventilation system was used as reference. 260/48338 (0.54%) RR: 1 “reference”
Intervention group: LAF 324/45620 (0.71%) RR: 1.3 95% CI: 1.1 – 1.5 P=0.006
“greenhouse” environment 30/3386 (0.89%) RR: 1.3 (95% CI: 0.9-2.0), P=0.2 |
Possible confounders related to risk factors and the infection rate which were not available in the dataset (i.e. obesity, diabetes) may have influenced the risk estimates in this study. ASA-score was only registered from 2005-2008. No data on SSI in general: severe infections leading to revision operation were assessed. Information about the AP application and possible changes over the years was not analyzed. |
|
Brandt et al (2008) |
Retro-spective cohort study |
To evaluate whether OR ventilation with LAF effects SSI rates. |
No. of Patients: Total: N=99230 THAs: N=28623 TKAs: N=9396 Appendectomy: N=10969 Cholecystectomy: N=20676 Colon surgery: N=8696 Herniorrhaphy: N=20870
Patient characteristics: not described but adjusted for patient characteristics in analysis
Procedures: Total hip arthroplasty (THA), Total knee arthroplasty (TKA), Appendectomy (App), Cholecystectomy (Chole), Colon surgery (Colon), Herniorrhaphy (Hern) |
Location: 63 surgical departments in 55 hospitals in Germany Dates: Jan 2000 – June 2004 Scope: multicentre
SAP administa-tion was not documented in the surveillance data for each patient, but the authors reported that SAP was routinely administered in Germany. In 2004 98.3% of patients undergoing THA and 98.2% of patients undergoing TKA received PAP.
|
Control group: Operations performed in ORs equipped with a conventional ventilation system
Intervention: Operations performed in ORs equipped with a LAF ventilation system
HEPA filters had been installed in both settings. |
Definitions: The CDC definitions were used for identifying SSIs.
Statistical analysis: Univariable analysis was performed and data were stratified by OR ventilation type. Comparison of these results by Fisher exact test. Multivariable analyses were performed using the generalized estimating equations method to control for potentially confounding variables. Separate multiple logistic regression analyses were carried out for each operative procedure.
Data were provided by the German National Nosocomial Infections Surveillance System. Additional data were obtained with a questionnaire in 08/2004. |
Follow-up period: until the date of SSI diagnosis (dSSI); CDC: 1 (12) month(s), but post discharge surveillance was not complete
Total SSI: 1901/99230 (1.92%)
THA: Control group: total SSI: N=144/10966 (1.31%) dSSI: N=99/10966 (0.9%) Intervention group: total SSI: N=326/17657 (1.85%) adj OR: 1.44 (95% CI: 0.93-2.23) dSSI: N=242/17657 (1.37%) adj OR: 1.63 (95% CI: 1.06-2.52)
TKA: Control group: total SSI: N=28/3403 (0.82%) dSSI: N=22/3,403 (0.65%) Intervention group: total SSI: N=80/5993 (1.33%) adj OR: 2.38 (95% CI: 0.89-6.33) dSSI: N=55/5993 (0.92%) adj OR: 1.76 (95% CI: 0.8-3.85)
App: Control group: total SSI: N=70/3776 (1.85%) dSSI: N=41/3776 (1.09%) Intervention group: total SSI: N=194/7193 (2.70%) adj OR: 2.09 (95% CI: 1.08-4.02) dSSI: N=95/7193 (1.32%) adj OR: 1.52 (95% CI: 0.91-2.53)
Chole: Control group: total SSI: N=109/8257 (1.32%) dSSI: N=40/8257 (0.48%) Intervention group: total SSI: N=191/12419 (1.54%) adj OR: 1.53 (95% CI: 0.95-2.45) dSSI: N=87/12419 (0.7%) adj OR: 1.37 (95% CI: 0.63-2.97)
Colon: Control group: total SSI: N=176/2495 (7.1%) dSSI: N=68/2495 (2.73%) Intervention group: total SSI: N=316/6201 (5.1%) adj OR: 1.17 (95% CI: 0.65-2.11) dSSI: N=158/6201 (2.55%) adj OR: 0.85 (95% CI: 0.49-1.49)
Hern: Control group: total SSI: N=69/8203 (0.84%) dSSI: N=29/8203 (0.35%) Intervention group: total SSI: N=198/12667 (1.56%) adj OR: 1.67 (95% CI: 0.95-2.91) dSSI: N=73/12667 (0.58%) adj OR: 1.48 (95% CI: 0.67-3.25) |
Whether SAP was administered was not documented individually for each patient in the surveillance data. Possible critical confounders such as smoking, obesity, intraoperative temperature, glycaemia or cautery, are also missing in the surveillance data. The investigators did not describe the number of patients that were lost to follow-up or the attrition rate.
|
|
Breier et al (2011) |
Retro-spective cohort study |
To determine the effect of LAF systems on SSI rates with emphasis on the size of the LAF ceiling.
|
No. of Patients: Total: N=61766 THAs due to arthrosis: N=33463 THAs due to fracture: N=7749 TKAs: N=20554
Patient characteristics: not described but adjusted for patient characteristics in analysis
Procedures: elective hip prosthesis procedures due to arthrosis, urgent hip prosthesis procedures due to fracture, knee prosthesis |
Location: 48 hospitals included in the final analysis for HIP-A, 41 for HIP-F, and 38 for TKA in Germany Dates: July 2004 – June 2009 Scope: multicentre
SAP administa-tion was not documented in the surveillance data for each patient, but the authors reported that SAP was routinely administered in Germany. In 2008, SAP was given for 99.2% of hip prosthesis procedures and for 99.4% of knee prosthesis procedures. |
Control group: Operations performed in ORs equipped with a conventional ventilation system
Intervention: Operations performed in ORs equipped with a LAF ventilation system
HEPA-filters had been installed in both settings. |
Definitions: The CDC definitions were used for identifying SSIs.
Statistical analysis: Univariable and multivariable analyses assessed the association of the following variables: sex, age, duration of operation, and American Association of Anesthesiologists (ASA) score. The size of the ceiling was considered in the group of hospitals with LAF (at least 3.2 m x 3.2 m vs less than 3.2 m x 3.2 m). In addition, large ceilings were compared with no LAF. For each operative procedure, separate multiple logistic regression analyses were performed with the generalized estimating equations method. Data were provided by the German National Nosocomial Infections Surveillance System. An online survey was sent to all departments to obtain information on the ventilation technology installed and routinely used in their ORs. The survey data on the ventilation techniques and the SSI surveillance data were merged.
|
Follow-up period: until the date of diagnosis of dSSI (CDC); 12 months, but post discharge surveillance was not complete
THAs due to arthrosis: Control group: dSSI: N=52/10446 (0.5%)
Intervention group: total dSSI: N=196/23017 (0.85%) LAF ceiling size <3.2 m x 3.2m: N=61/7291 (0.84%) LAF ceiling size ≥ 3.2 m x 3.2m: N=135/15726 (0.86%)
adj OR for LAF/dSSI: 1.10 (95% CI: 0.56-2.17)
THAs due to fracture: Control group: dSSI: N=25/1236 (2.02%) Intervention group: total dSSI: N=160/6513 (2.46%) LAF ceiling size <3.2 m x 3.2m: N=63/2326 (2.71%) LAF ceiling size ≥3.2 m x 3.2m: N=97/4187 (2.32%)
adj OR for LAF/dSSI: 1.28 (95% CI: 0.67-2.43)
TKA: Control group: dSSI: N=36/6098 (0.59%) Intervention group: total dSSI: N=93/14456 (0.64%) LAF ceiling size <3.2 m x 3.2m: N=23/4564 (0.5%) LAF ceiling size ≥ 3.2 m x 3.2m: N=70/9892 (0.71%)
adj OR for LAF/dSSI: 0.95 (95% CI: 0.37-2.41) |
Whether SAP was administered was not documented individually for each patient in the surveillance data. Possible critical confounders such as smoking, obesity, intraoperative temperature, glycaemia or cautery, are also missing in the surveillance data. The investigators did not describe the number of patients that were lost to follow-up or the attrition rate.
|
|
Hooper et al (2011) |
Retro-spective cohort study |
To determine, if the use of LAF and protective suits with hoods and self-contained exhaust systems (space suits) reduce the rate of early deep infections requiring revision procedures following total hip and knee replacement |
No. of Patients: Total: N=88311 THA: N=51485 TKA: N=36826
Patient characteristics: not reported but the investigators stated that there were no significant differences between the groups
Procedures: THA, TKA |
Location: 64 hospitals in New Zealand Dates: 1999 – 2008 Scope: multicentre
The registry indicated that in 96% of the procedures SAP was administered and in 60% of the procedures anti-microbial agents were used in the cement. |
Control group: 1: operation performed without space suit 2: operation performed in conventional ORs 3: operation performed in conventional ORs with no space suit
Intervention: 1: space suits used 2: operation performed in ORs equipped with a LAF ventilation system 3: space suits and LAF
LAF: all hospitals confirmed that they had a regular maintenance program for filters. |
Definitions: Any revision performed within 6 months of the initial operation for infection.
Statistical analysis: The Chi-squared test or Fisher’s exact test, when expected frequencies were low, were used to compare the percent of procedures in each group with revision for deep infection. A p-value of <0.05 was considered significant.
Data were obtained from the New Zealand Joint Registry. The registry captures 98% of both primary and revision arthroplasties performed in New Zealand and records revision procedures secondary to deep infection. |
Follow-up period: minimum 6 months
ORs equipped with LAF ventilation system were used for 33% of all THAs and for 38% of all TKAs.
Note: Authors only provide percentages; “n” was calculated for analyis.
THA: Early revision for deep infection: 46/51485 (0.089%)
Intervention 1- space suit: 0.186% Control 1- no space suit: 0.064% (P<0.0001)
Intervention 2 - LAF: 0.148% Control 2 - conventional ORs: 0.061% (P<0.003)
Intervention 3 - space suit + LAF: 0.198% Control 3 - no space suit + conventional ORs: 0.053% (P<0.001)
TKA: Early revision for deep infection: 50/36826 (0.136%)
Intervention 1- space suit: 0.243% Control 1- no space suit: 0.098% (P<0.001)
Intervention 2 - LAF: 0.193% Control 2 - conventional ORs: 0.100% (P<0.019)
Intervention 3 - space suit + LAF: 0.25% Control 3 - no space suit + conventional ORs: 0.087% (P<0.001) |
Authors only provide percentages; “n” was calculated. Infection risk factors that are not collected in the registry cannot be evaluated. The investigators did not describe the number of patients that were lost to follow-up or the attrition rate. |
|
Miner et al (2007) |
Retro-spective cohort study |
To assess the effects of LAF systems and body exhaust suits on the risk of deep infection after TKA |
No. of Patients: TKA: N=8288
Patient characteristics: not reported
Procedure: Unilateral primary TKA |
Location: 256 hospitals in Illinois, Ohio, North Carolina and Tennessee, USA Dates: January 1 – August 30, 2000 Scope: multicentre
The percent of procedures for which SAP was used was not reported
|
Control group: 1) Patients in hospitals that used exhaust suits at frequencies of “not at all”, “used in less than 26% of procedures,” “used in 26%-75% of procedures” 2) Patients in hospitals that used LAF at frequencies of “not at all”, “used in less than 26% of procedures,” “used in 26%-75% of procedures”
Intervention: 1: Patients in hospitals that used exhaust suits in more than 75% of procedures 2: Patients in hospitals that used LAF in more than 75% of procedures
Use of LAF and exhaust suit was distributed roughly independently among hospitals. Most hospitals reported that these methods were either part of their standard infection control practices (used>75% of time) or not at all. |
Definitions: International Classification of Diseases, Ninth revision (ICD-9) diagnosis and procedures codes for evidence of postoperative deep infection that required additional operative procedures. Reoperations within 90 days
Data were used from Medicare claims. |
Follow-up period: 90 days
Overall 90-day cumulative incidence of deep infection requiring reoperation: 28/8288 (0.34%)
1) Body exhaust suit Control group: dSSI N=18/4750 Intervention group: dSSI: N=10/3538
RR for use of body exhaust suit/dSSI: 0.75 (95% CI: 0.34-1.62)
2) LAF Control group: dSSI N=13/4775 Intervention group: dSSI: N=15/3513
RR for LAF/dSSI: 1.57 (95% CI: 0.75-3.31) |
Not adjusted for clustering of events within hospitals, because 22 of 25 hospitals with infections reported only one infection and because no hospital reported more than two infections. Very limited number of events. The focus of the investigators on the hospitals’ standard practice could have led to misclassification of individual procedures. Infections associated with hospitals that were classified as using one of the investigated techniques most of the time could have affected patients for whom the technique was not used. Limited information about each hospital’s case mix. The investigators did not provide additional information about the ventilation system of the ORs without LAF. The investigators did not describe the number of patients that were lost to follow-up or the attrition rate. |
|
Kakwani et al (2007) |
Cohort study |
To assess the difference in the re-operation rate following Austin-Moore hemi-arthroplasty between procedures performed under LAF to those performed in conventional (non-LAF) ORs |
No. of Patients: TKA: N=435
Patient characteristics: 337 females and 96 males Adults, mean age > 80 years
Procedure: Austin-Moore hemiarthroplasty |
Location: 1 hospital in the United Kingdom Dates: August 2000 – July 2004 Scope: single centre
SAP (three doses of intravenous cefuroxime, 1.5 g at induction and two post-operative doses of 750 mg at 8 and 16 h after the procedure) and water-impervious surgical gowns and drapes were used in all cases. |
Control group: Operations performed in ORs equipped with a conventional ventilation system
Intervention: Operations performed in ORs equipped with a LAF ventilation system |
Definitions: Any revision for infection.
Statistical analysis: The Fisher’s exact test and Wilcoxon test were used to evaluate the difference in outcomes between the groups |
Follow-up period: 1 year
Control group: Reoperation for infection: N=9/223 (4%)
Intervention group: Reoperation for infection: N=0/212 (0%) |
Very limited number of events. The investigators did not describe the number of patients that were lost to follow-up or the attrition rate. |
|
Pinder et al (2016) |
Retrospective review of a prospectively maintained database |
To determine how frequently orthopaedic trauma operations are performed in LF and PVtheatres in England; to identify any difference in the rate of SSI90 between these ventilation systems and to determine if the risk of SSI90 is altered following the installation of LF |
No. of Patients: Total N: 759134
Patient characteristics: Age: 45% 65+ Gender: 55% female
Procedure: Orthopaedic trauma operations; subgroupanalysis for hip hemiarthroplasty. |
Location: NHS hospitals providing adult trauma services in England
Dates: April 2008 – March 2013
Scope: Multicenter; 184 hospitals
No information on patients having received surgical antibiotic prophylaxis (SAP) was reported |
Control group: Plenum ventilation
Intervention: Operations per-formed in ORs equipped with a LAF ventilation system. LAF ventilation system was divided into four categories, taking into account the time of installation relative to the operation: always LAF; installed LAF-before; installed LAF-year of installment; installed LAF-after |
Definitions: International Classification of Diseases, Ninth revision (ICD-10): T814, T845-T847, and T857 was used to identify SSI.
Statistical analysis: Patient characteristics were compared across the groups using descriptive statistics. Simple comparisons of before versus after installation of LF are valid only in the absence of temporal trends in the rate of SSI90. Therefore tested for these trends in each group. Crude and adjusted odds ratios (OR) with 95% confidence intervals (CI) for the groups were derived using hierarchical logistic regression, with plenum ventilation acting as the reference group. Models were fitted with and without adjustment for financial year. |
Follow-up period: 90 days
Lost-to-follow-up: Not reported
Control group: All orthopaedic trauma surgery: SSI: 2.4%
Patients undergoing hemiarthroplasty: SSI: 2.6%
Intervention groups: All orthopaedic trauma surgery SSI: LAF group before install: 3.1% LAF group year of install: 3.0% LAF group after install: 2.9% Always LAF: 2.7%
OR after installation (regression analysis): 0.71 (0.46 to 1.09)
Hemiarthroplasty SSI: LAF group before install: 4.3% LAF group year of install: 4.4% LAF group after install: 3.9% Always LAF: 3.8%
OR after installation (regression-analysis): 1.55 (1.17 to 2.00)
OR always LAF (regression analysis): 1.45 (1.17 to 1.80) |
Private hospitals (n=89), those where < 20 hemiarthroplastiesperformed annually (n=67), elective hospitals (n=21), children’shospitals (n=7), treatment centres (n=6), non-orthopaedic hospital (n=1), hospital no longer exists (n=1), invalid hospital code (n=10) were excluded. Therefore, selection bias can not be excluded.
Only early infections were captured by the study design. |
|
Agarwal et al (2017) |
Retrospective matched cohort study |
Our null hypothesis is that patients who had their hip fracture surgery in a mixed-use plenum ventilated theatre have the same infection rate as those operated in an orthopaedic dedicated laminar flow operating theatre. We tested this by comparing the infection rate and other surrogate outcome measures with a matched group. |
No. of Patients: N=159 patients for surgery for a proximal femur fracture. Patients in the “CEPOD” group were preceded by drainage of an abscess, laparotomy or other ‘dirty case‘.
Patient characteristics: “CEPOD” group: age: 85.1y gender: 52/74 female
Matched group: age: 84.8y gender: 60/85 female
matching variables: age, American Society of Anesthesiologists (ASA) grade, abbreviated Mental Test score and residence status
Procedure: Surgery for a proximal femur fracture |
Location: 1 hospital in the UK
Dates: August 2010 and July 2014
Scope: Single centre
N=159 patients (100%) received surgical antibiotic prophylaxis to the standard protocol. |
Control group: Dedicated orthopaedic laminar flow theatre
Intervention (“CEPOD”-group): Shared emergency theatre without laminar flow |
Definitions: Any documentation of wound leakage, treatment with antibiotics and any microbiology culture or swabs from the hip, readmission or reoperation.
Statistical analysis: Chi-square test |
Follow period: At least 6 months
Lost-to-follow-up: Not reported
Control group: dSSI: 1/85 (repeat surgery)
Intervention group: dSSI: 0/74
|
Very limited number of events
No statistical analyses that corrected for known confounders were conducted. |
|
Gruenberg et al. (2004) |
Retrospective cohort study |
To evaluate if the use of ultraclean air technology could decrease the infection rate after posterior spinal arthro-desis with instrumentation |
No. of Patients: TOTAL N=179
Patient characteristics (according to type of operating room, conventional [c] or laminar flow [l]):
Age: 47.3[c] – 40.9y[l]
Females: 51[c]– 72.5%[I]
Preoperative diagnosis: trauma (37%[c]-8%[I]); degenerative conditions (41%[c]-13%[I])
Procedure: Posterior spinal arthrodesis with instrumentation |
Location: Italian Hospital of Buenos Aires, Buenos Aires, Argentina
Dates: May 1996 – December 2001
Scope: single centre
All patients received prophylactic intravenous antibiotics: 1 g cephalothin before skin incision and every 6 hours until drains were removed; those allergic to penicillin received 500 mg vancomycin before skin incision and every 12 hours until drains were removed |
Control group: conventional operating room
Intervention: Vertical exponential laminar flow operating room (Exflow 90, Howorth Airtech Ltd., BL, U.K.) in which the surgical team wore total body exhaust gowns (Kimberly Clark Corp., Roswell, GA). |
Definitions: Any patient with positive cultures from wound exploration or aspiration was considered infected. The same criteria were applied in patients with spontaneous dehiscence of incision with purulent drainage, both with or without positive cultures. Not distinguished between superficial or deep wound infection, because this can sometimes be difficult to determinate and they can both depend on intraoperative wound seeding.
Statistical analysis: Discrete variables were analyzed with the chi-squared test whereas continuous, nonparametric data were studied with the Mann-Whitney Utest. A P <0.05 was considered statistically significant. |
Follow-up period: 34.9 [c] - 28.4 months [l]
Lost-to-follow-up: Not reported
Control group: Wound infection (totale SSI): 12.9% (18/139) (calculated from table 1)
Intervention group: Wound infection (totale SSI): 0% (0/40) (calculated from table 1) There were no significant differences between both groups for age, diabetes, steroid therapy, previous surgeries, tumor cases, or previous radiotherapy. The number of levels fused, utilization of allograft, and operative time were significantly higher in the intervention group.
|
Very few events. No multivariate analysis controlling for confounders was conducted. |
|
Exclusie na discussie met werkgroepleden |
||||||||
|
Knobben et al. (2006) |
Before-after study |
The aim of this study was to evaluate whether behavioural and systems measures decrease intraoperative contamination as monitored during 207 total hip or knee replacements. The influence of these measures on subsequent prolonged wound discharge, superficial surgical site infection and deep periprosthetic infection was also investigated during an 18-month follow-up period |
No. of Patients: TKA, THA: N=207
Patient characteristics: not reported
Procedure: total hip or knee arthroplasty in patients with osteoarthritis or rheumatoid arthritis |
Location: University Medical Centre Groningen, Groningen, The Netherlands
Dates: July 2001 - January 2004
Scope: single centre
All patients received antimicrobial prophylaxis (cefazoline, 1000 mg intravenously) 20 min before the operation |
Control group: original conditions (among other things: old conventional airflow)
Intervention: 1. Correct use of plenum (Instrumentation unpacking in plenum ventilation alone, Instrumentation unpacking just before surgery, Instrumentation never leaves plenum, else considered unsterile, Head of patient always out of plenum) Old conventional airflow
2. Work up in preparation room, not in operating room (Anaesthetic work up, Shaving, Putting on blood bands and blankets, Positioning patient with leg support), Proper wearing of body coverage (No hair visible, No nose visible, Beard mask and safety glasses for people working in plenum, Renew mouth mask after every operation, Change clothes each time after leaving the operating complex) Limiting needless activity (Number of people in operating room kept to minimum, Opening of doors kept to minimum, Use only smallest door to washing room, Movement of people kept to minimum, No changing of personnel during an operation, If other equipment necessary, use intercom, All communication with world outside via intercom, Only conversation if needed for surgery) New laminar airflow |
Definitions: SSI definition of the Surgical Infection Study Group. This definition relies solely on clinical observations in the absence of microbiological confirmation; dSSI defined by an increase of infection parameters caused by the prosthesis site, as judged by the orthopaedic surgeon.
Statistical analysis: Pearson’s Chi-square test for categorical data was used to test differences between the experimental groups and the control group when all cells of the contingency table contained at least five people. Otherwise, Fisher’s Exact test was used. |
Follow-up period: 18 months
Lost-to-follow-up: None
Control group: superficial SSI: eight 11.4% (8/70)
deep periprosthetic infection: 7.1% (5/70)
Intervention group 1: superficial surgical site infection: 14.9% (10/67)
deep periprosthetic infection: 4.5% (3/67)
Intervention group 2: superficial surgical site infection: 1.4% (1/70)
deep periprosthetic infection: 1.4% (1/70) |
Limited number of events for outcome measure deep prosthetic infection.
No statistical analyses that corrected for known confounders were conducted.
|
|
Simsek Yavuz et al. (2006) |
Prospective cohort study |
To determine the incidence of and identify risk factors for sternal surgical site infection (SSI). |
No. of Patients: TOTAL N=991 CABG (n=748), other cardiac surgery (n=243)
Patient character-istics (according to presence [p] or absence [a] of SSI): Age: 56y [p]–57y [a]
Females: 46% [p]-27% [a]
BMI: 26 (both]
ASA 3 or 4: 68% [p]-58% [a]
Procedure: Cardiac surgery with sternotomy |
Location: Siyami Ersek Thoracic and Cardiovascular Surgery Hospital (Uskudar, Turkey)
Dates: January 1, 2002 - June 1, 2002
Scope: single centre
For antimicrobial prophylaxis, patients were given cefazolin (1 g every 8 hours) or, for patients who had hypersensitivity or suspected colonization with methicillin-resistant Staphylococcus aureus, vancomycin (1 g twice per day); prophylaxis was started at the induction of anesthesia and stopped 24-48 hours after the operation. |
Control group: plenum ventilation (which includes a positive pressure air supply from clean to less clean areas, with a total of 27 changes of high-efficiency filtered air per hour. Although the doors of the older operating theaters were automatic, they did not function properly any more and were generally left open.
Intervention: laminar-flow ventilation systems. The doors of the newer operating theaters were automatic and were always kept closed except, occasionally, when there was movement through them.
|
Definitions: SSI was defined according to the criteria established by the Centers for Disease Control and Prevention (CDC).
Statistical analysis: Comparison of means was done with Student’s t test. For categorical variables, the x2 test or Fisher’s exact test was used. Risk factors for sternal SSI were investigated by logistic regression analysis. All variables with a P value of <0.05 in the univariate analysis or that have been shown to be a risk factor for sternal SSI in the literature were included in logistic regression analysis. Discrete variables (eg, use of inotropic agents) were entered into the analysis only if they were present prior to the occurrence of the sternal SSI. Similarly, continuous variables (eg, duration of mechanical ventilation) were entered into the analysis according to duration of patient exposure to these variables before the onset of sternal SSI. |
Follow-up period: 3 months
Lost-to-follow-up: (9 patients died within 4 days after surgery)
Control group: Sternal SSI: 6.7% (30/445) (calculated from table 1)
Intervention group: Sternal SSI: 2.0% (11/546) (calculated from table 1)
Results from logistic regression analysis:
Surgery in older operating theater: OR=3.46 (95% CI: 1.72-7.11) controlled for other indepently associated factors: female sex, diabetes mellitus, duration of surgery > 5hr., and second surgery required
|
Some flaws in statistical procedures (p value in univariate analysis as a selection criterion for logistic regression was set too low).
|
|
Van Griethuysen 1996 |
Before-after study |
In this study we compared the results of an ongoing surveillance of postoperative wound infections (PWI) by an infection control nurse (ICN), during a nine-month period before and after moving to the new theatre. |
No. of Patients: General surgery: n=2905; Orthopedic surgery: n=873
Patient characteristics: not reported
Procedure: general (including vascular and thoracic) surgery or orthopedic surgery
|
Location: Canisius Wilhelmina Ziekenhuis, Nijmegen, The Netherlands.
Dates: 1 July 1991-16 April 1992; 1 July 1992 -16 April 1993
Scope: single centre
Antibiotic prophylaxis was given for generally accepted indications, mostly in non-clean and prosthetic surgery. It consisted of cefazolin 1 g 1 h preoperatively; this was repeated if surgery lasted longer than 4 h. Metronidazole was added in abdominal surgery. |
Control group: Theatre area was divided by a major hospital corridor. Coffee-room and changing rooms for personnel and recovery rooms for patients were separate from the theatre area.
Intervention: Rooms were connected, and staff were not allowed to leave the theatre area without changing from theatre-dress (except anaesthesists). In addition to the Howorth system, a partial body exhaust was applied using one tube attached to the inside of the surgical coat.
|
Definitions: PWI were defined according to CDC-guidelines. These include incisional and deep surgical wound infections. Incisional infection occurs at incision site within 30 days after surgery and involves skin, subcutaneous tissue, or muscle located above the fascial layer. Deep infection occurs at operative site within 30 days after surgery if no implant is left in place or within one year if implant is in place, and infection appears related to surgery and infection involves the tissues or spaces at or beneath fascial layer.
Statistical analysis: Results of the two periods were compared by a X2-test with Yates’ correction. The results of air sampling where analysed by the Mann-Whitney U-test. |
Follow-up period: 12 months (in case of involvement of protheses); one month in all other cases.
Lost-to-follow-up: Not reported
Control group: SSI in clean geneal surgery: 1.5% (28/1909)
SSI in clean orthopedic surgery: 1.2% (10/861)
SSI in all general surgery (clean; clean-cont., contaminated, dirty): 2.4% (70/2905)
dSSI in orthopedic prosthetic surgery: 0.4% (1/223)
Intervention: SSI in clean general surgery: 1.9% (35/1891)
SSI in clean orthopedic surgery: 1.6% (13/826)
SSI in all general surgery (clean; clean-cont., contaminated, dirty): 2.2% (64/2935)
dSSI in orthopedic prosthetic surgery: 0.4% (1/252) |
Few events No multivariate analysis controlling for confounders was conducted. |
CpHm: Cox proportional hazard model; adj: adjusted; dSSI: deep surgical site infections; LAF: laminar airflow; ORs: operating rooms; SSI: surgical site infection; THA: total hip arthroplasty; TKA: total knee arthroplasty; RR: relative risk; OR: odds ratio; CI: confidence interval; HEPA (filter): high efficiency particulate air (filter); “Greenhouse”: operating room environment that refers to the ultraclean ventilation systems with a tent within the room and body exhaust suits as described by Dr John Charnley in the 1960s.
Risk of bias table of the included studies
De kwaliteit werd beoordeeld met de ‘Newcastle-Ottawa Quality Assessment Scale (NOS)’ voor cohortonderzoeken (Wells GA, Shea B, O’Connell D, et al. The Newcastle–Ottawa Scale (NOS) for assessing the quality if nonrandomized studies in meta-analyses. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp.)
|
Authors (year) |
Selection 1) |
Selection 2) |
Selection 3) |
Selection 4) |
Comparability |
Comparability |
Outcome 1) |
Outcome 2) |
Outcome 3) |
Total/ overall |
|
Namba et al (2013) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
-- c) |
7 * |
|
Namba et al (2012) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
* b) |
8 * |
|
Song et al (2012) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
-- d) |
7 * |
|
Jeong et al (2013) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
-- d) |
7 * |
|
Bosanquet et al (2013) |
-- c) |
* a) |
* a) |
* a) |
* a) |
* b) |
* a) |
-- b) |
-- d) |
6 * |
|
Pedersen et al (2010) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
-- c) |
7 * |
|
Dale et al (2009) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
-- c) |
7 * |
|
Brandt et al (2008) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
-- d) |
7 * |
|
Breier et al (2011) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
-- d) |
7 * |
|
Hooper et al (2011) |
* b) |
* a) |
* a) |
-- b) |
-- |
-- |
* b) |
* a) |
-- d) |
5 * |
|
Miner et al (2007) |
* b) |
* a) |
* a) |
-- b) |
-- |
-- |
* b) |
* a) |
-- d) |
5 * |
|
Kakwani et al (2007) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* a) |
* a) |
-- d) |
7 * |
|
Pinder et al (2016) |
* b)1 |
* a) |
* a) |
-- b) |
* a)2 |
* b) |
* b) |
-- b)3 |
-- d) |
6 * |
|
Agarwal et al (2017) |
* b) |
--b) |
* a) |
-- b) |
* a) |
--4 |
* b) |
* a)5 |
-- d) |
5 * |
|
Gruenberg et al. (2004) |
* b) |
* a) |
* a) |
* a) |
-- |
-- |
* b) |
* a) |
-- d) |
6 * |
|
Exclusie na discussie met werkgroepleden |
||||||||||
|
Van Griethuysen et al. (1996) |
* b) |
* a) |
* a) |
-- b) |
-- |
-- |
* b) |
* a) |
-- d) |
5 * |
|
Knobben et al. (2006) |
* b) |
* a) |
* a) |
-- b) |
-- |
-- |
* b) |
* a) |
-- d) |
5 * |
|
Yavuz et al. (2006) |
* b) |
* a) |
* a) |
-- b) |
* a) |
* b) |
* b) |
* a) |
-- d) |
7 * |
If applicable, a rating point (*) was awarded for each category and added to the total per study.
- Sample pertains to NHS-hospitals. Note: also non-NHS hospitals offer orthopaedic surgical procedures.
- BMI was not taken into account but socio-economic level of deprivation was taken into account. Deprivation level is usually correlated with BMI and thus captures BMI to some extent.
- 90 days FU-duration was considered as being too short because late infections related to implants were missed.
- None of the following confounders was taken into consideration: BMI, operation duration and comorbidities.
- Minimum FU-period was six months. This was considered as being adequate. Authors did not report average follow-up duration.
Exclusietabel
|
Auteur |
|
Redenen van exclusie |
|
Babkin et al. (2007) |
Incidence and risk factors for surgical infection after total knee replacement. Scandinavian Journal of Infectious Diseases 2007; 39(10): 890-895. |
Er worden geen luchtbehandelingsystemen vergeleken. |
|
Blom et al. (2004) |
Infection after total knee arthroplasty. Journal of Bone & Joint Surgery - British 2004. 86(5): 688-691. |
Studie gaat niet over het effect van luchtbehandelingsystemen op SSI. |
|
Blood et al. (2017) |
Risk and Protective Factors Associated with Surgical Infections among Spine Patients. Surgical Infections 2017. 18(3): 234-249. |
In deze review is 1 artikel geïncludeerd dat over luchtbehandelingsystemen gaat (Ferry 2013). Narratieve review. |
|
Bosanquet et al. (2013) |
Laminar flow reduces cases of surgical site infections in vascular patients. Annals of the Royal College of Surgeons of England 2013. 95(1): 15-19. |
Dubbele referentie |
|
Breier et al. (2011) |
|
Dubbele referentie |
|
Cristina et al. (2016) |
Operating room environment and surgical site infections in arthroplasty procedures. Journal of Preventive Medicine and Hygiene 2016. 57(3): E142-E148. |
Er worden geen luchtbehandelingsystemen vergeleken. |
|
Evans (2011) |
Current concepts for clean air and total joint arthroplasty: laminar airflow and ultraviolet radiation: a systematic review. Clinical Orthopaedics & Related Research 2011. 469(4): 945-953. |
Geen systematic review: onduidelijke vraagstelling; geen selectiecriteria; geen methodologische beoordeling individuele studies; geen evidencetabellen (voldoet niet aan AMSTAR-criteria). |
|
Fitzgerald et al. (1992) |
|
Artikel is in Nederland niet verkrijgbaar. |
|
Fu Shaw et al. (2018) |
Factors influencing microbial colonies in the air of operating rooms. BMC Infectious Diseases 2018. 18 (1) (no pagination)(4). |
Studie gaat niet over het effect van luchtbehandelingsystemen op SSI. |
|
Gastmeier et al. (2012) |
Influence of laminar airflow on prosthetic joint infections: a systematic review. Journal of Hospital Infection 2012. 81(2): 73-78. |
In de systematic review van Bischoff zijn alle studies geïncludeerd die ook in de studie van Gastmeier opgenomen zijn. Gastmeier hanteerde striktere selectiecriteria dan Bischoff: “in order to exclude outdated technology, only studies published after 2000 were considered.” |
|
Graves et al. (2016) |
A cost-effectiveness modelling study of strategies to reduce risk of infection following primary hip replacement based on a systematic review. Health Technology Assessment (Winchester, England) 2016. 20(54): 1-144. |
Gaat over kostenanalyse van verschillende infectiepreventiemaatregelen, onder andere ook over luchtbehandelingsystemen. Kostenanalyse is gebaseerd op de review van Zheng (2014). |
|
Kapadia et al. (2012)
|
Prevention methodologies against infection after total joint arthroplasty. Current Orthopaedic Practice 2012. 23(6): 533-539. |
Geen systematic review: onduidelijke zoekstrategie; geen selectiecriteria; geen methodologische beoordeling individuele studies; geen evidencetabellen. |
|
Kapadia et al. (2013) |
Infection prevention methodologies for lower extremity total joint arthroplasty. Expert Review of Medical Devices 2013. 10(2): 215-224. |
Geen systematic review: onduidelijke vraagstelling; geen selectiecriteria; geen methodologische beoordeling individuele studies; geen evidencetabellen. |
|
Kelly et al. (1996) |
An audit of early wound infection after elective orthopaedic surgery. Journal of the Royal College of Surgeons of Edinburgh 1996. 41(2): 129-131. |
Geen toegang tot PDF. Ter info: deze studie is niet in de review van Bischoff geïncludeerd. |
|
Knobben et al. (2006) |
Evaluation of measures to decrease intra-operative bacterial contamination in orthopaedic implant surgery. J Hosp Infect 2006; 62: 174–80. |
Geen zuivere vergelijking van verschillende luchtbehandelingsystemen: “Old conventional airflow + correct use of plenum versus new laminar airflow + work up in preparation room + proper wearing of body coverage + limiting needless activity” Zie evidencetabel voor gedetailleerde informatie. |
|
Kramer et al. (2010) |
Importance of displacement ventilation for operations and small surgical procedures from the infection preventive point of view. Zentralblatt fur Chirurgie 2010. 135(1): 11-17. |
Geen systematic review |
|
Kramer et al. (2010) |
|
Dubbele referentie |
|
Lauvrak, V. and I. N. Norderhaug (2011) |
Knowledge Centre for the Health Services at The Norwegian Institute of Public Health (NIPH) NIPH Systematic Reviews 2011: Executive Summaries. |
Noors; gepubliceerd in 2011; auteurs geven aan dat ze het geïncludeerde rapport van Segadal (2011) over luchtbehandelingsystemen niet ge-updatet hebben. Studie gaat niet specifiek over luchtbehandelingsystemen. |
|
Lidwell et al. (1982) |
Effect of ultraclean air in operating rooms on deep sepsis in the joint after total hip or knee replacement: a randomised study. British medical journal (clinical research ed.)1982. 285, 10-14 |
Gepubliceerd vóór 1-1-1990 |
|
Lowbury, E. and O. Lidwell (1978) |
Multi-hospital trial on the use of ultraclean air systems in orthopaedic operating rooms to reduce infection: preliminary communication. Journal of the royal society of medicine 1978. 71, 800-806 |
Gepubliceerd vóór 1-1-1990 |
|
McHugh et al. (2015) |
Laminar airflow and the prevention of surgical site infection. More harm than good? Surgeon Journal of the Royal Colleges of Surgeons of Edinburgh & Ireland 2015. 13(1): 52-58. |
Geen systematic review: geen selectiecriteria; geen methodologische beoordeling individuele studies; geen evidencetabellen. Ter info: referentie-check leverde geen extra artikelen op. |
|
Murray et al. (2010) |
Surgical site infection in colorectal surgery: a review of the nonpharmacologic tools of prevention. Journal of the American College of Surgeons 2010. 211(6): 812-822. |
Gaat niet over het effect van luchtbehandelingsystemen. |
|
Oguz et al. (2017) |
Airborne bacterial contamination during orthopedic surgery: a randomized controlled pilot trial. Journal of Clinical Anesthesia 2017. 38, 160-164 |
SSI was geen uitkomstmaat. |
|
Parvizi et al. (2017) |
Environment of care: Is it time to reassess microbial contamination of the operating room air as a risk factor for surgical site infection in total joint arthroplasty? American Journal of Infection Control 2017. 45(11): 1267-1272. |
Studie gaat niet over het effect van luchtbehandelingsystemen op SSI. |
|
Peersman et al. (2001) |
Infection in total knee replacement: a retrospective review of 6489 total knee replacements. Clinical Orthopaedics & Related Research 2001. (392): 15-23. |
Er worden geen luchtbehandelingsystemen vergeleken. |
|
Sanderson, M. and G. Bentley (1976) |
Assessment of wound contamination during surgery: a preliminary report comparing vertical laminar flow and conventional theatre systems. British Journal of Surgery 1976. 63, 431-432 |
Gepubliceerd vóór 1-1-1990 |
|
Sandiford, N. A. and J. Skinner (2009) |
The prevention of infection in total hip arthroplasty. Orthopaedics and Trauma 2009. 23(1): 8-16. |
Geen originele studie en ook geen systmatic review (mini-symposium). |
|
Simsek Yavuz et al. (2006) |
Analysis of risk factors for sternal surgical site infection: emphasizing the appropriate ventilation of the operating theaters. Infect Control Hosp Epidemiol 2006; 27: 958–63. |
Geen zuivere vergelijking van verschillende luchtbehandelingsystemen: “plenum ventilation + generally doors were left open versus laminar-flow ventilation + the doors of the newer operating theaters were automatic and were always kept closed except, occasionally, when there was movement through them”. Zie evidencetabel voor gedetailleerde informatie. |
|
Simsek Yavuz et al. (2006) |
|
Dubbele referentie |
|
Stocks et al. (2011) |
Directed air flow to reduce airborne particulate and bacterial contamination in the surgical field during total hip arthroplasty. Journal of Arthroplasty 2011. 26, 771-776 |
SSI was geen uitkomstmaat. |
|
Stocks et al. (2011) |
|
Dubbele referentie en uitkomstmaat SSI ontbreekt |
|
van Griethuysen et al. (1996) |
Surveillance of wound infections and a new theatre: unexpected lack of improvement. J Hosp Infect 1996; 34: 99–106. |
Geen vergelijking UDF met een mengend system.
Zie evidencetabel voor gedetailleerde informatie. |
|
Watts et al. (2015) |
Surgical site infection (SSI) and airflow in spinal surgery-time for a national review? Spine Journal 2015. 1: S59. |
Alleen abstract beschikbaar (supplement van de abstracts van proceedings of the conference). |
|
Whyte et al. (1992) |
The relative importance of the routes and sources of wound contamination during general surgery. II. Airborne. Journal of Hospital Infection 1992. 22(1): 41-54. |
Studie gaat niet over het effect van luchtbehandelingsystemen op SSI. |
|
Wood et al. (2014) |
Infection control hazards associated with the use of forced-air warming in operating theatres. Journal of Hospital Infection 2014. 88(3): 132-140 |
Gaat niet over het effect van luchtbehandelingsystemen. |
|
Zheng et al. (2014) |
Control strategies to prevent total hip replacement-related infections: a systematic review and mixed treatment comparison. BMJ Open 2014. 4(3): e003978. |
In de volgende groepen in de review van Zheng worden luchtbehandelingsystemen vergeleken: 1) T2 versus T4: Salvati (1982); Fitzgerald (1992); Kelly (1996) Ter info: Bisschoff heeft de studies van Salvati en Fitzgerald geëxcludeerd, omdat de studies voor 1990 verricht zijn. Bisschoof heeft de studie van Kelly (1996) niet geïdentificeerd. 2) T6 versus T7: Brandt (2008) Brandt is opgenomen in de review van Bischoff. In de review van Bischoff zijn de studies van Fitzgerald (1992) en Kelly (1996) niet opgenomen. De studie van Brandt is in de review van Bischoff wel opgenomen. Wij updaten de review van Bischoff met de studies van Salvati en Fitzgerald. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-04-2022
Beoordeeld op geldigheid : 07-04-2022
Algemene gegevens
Regiehouder: Samenwerkingsverband Richtlijnen Infectiepreventie (SRI)
De richtlijnontwikkeling werd ondersteund door drs. B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en dr. M.A. Pols, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn heeft tot doel om aanbevelingen te doen over de luchtkwaliteit in operatiekamers, opdekruimten en zelfstandige behandelkamers in ziekenhuizen en particuliere klinieken. De richtlijn beschrijft de minimale criteria van de luchtkwaliteit op basis van wetenschappelijk bewijs en de kennis van experts.
Doelgroep
Deze richtlijn is primair geschreven voor medewerkers die beleid maken op het gebied van infectiepreventie, waaronder raden van bestuur van zorginstellingen, deskundigen infectiepreventie, artsen-microbiologen en internist-infectiologen, en alle medisch specialisten die interventies doen op operatiekamers en zelfstandige behandelkamers.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van specialismen die betrokken zijn bij de zorg voor patiënten die een ingreep ondergaan, medisch specialisten die interventies doen op operatiekamers en zelfstandige behandelkamers en (arts-)specialisten op het gebied van infectiepreventie.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. J.J. Duvekot (voorzitter), gynaecoloog-perinatoloog, Erasmus MC, Rotterdam
- Prof. Dr. J. Kluytmans, arts-microbioloog, Amphia Ziekenhuis/Molengracht, Breda; Julius Center for Health Sciences and Primary Care, Universitair Medisch Centrum Utrecht, Utrecht
- Prof. Dr. A. Voss, arts-microbioloog, Radboud Universitair Medisch Centrum en Canisius Wilhelmina Ziekenhuis, Nijmegen
- Dr. I.J.B. Spijkerman, arts-microbioloog, Amsterdam Universitair Medische Centra, locatie AMC, Amsterdam
- Dr. M.V. Joosse, oogarts, Haaglanden MC, Den Haag
- Prof. Dr. P.C. Jutte, orthopedisch chirurg, Universitair Medisch Centrum Groningen, Groningen
- Dr. F.O. Kooij, anesthesioloog, Amsterdam Universitair Medische Centra, locatie AMC, Amsterdam
- Dr. P.M.N.Y.H. Go, chirurg, St Antonius Ziekenhuis, Nieuwegein
- Dr. A.B. Steensma, gynaecoloog, Erasmus MC, Rotterdam
- Dr. M. Cromheecke, plastisch chirurg, Zipper Clinics, Enschede
- Dr. P. Segers, cardiothoracaal chirurg, Maastricht Universitair Medisch Centrum, Maastricht
- Dr. F. d’Ancona, uroloog, Radboud Universitair Medisch Centrum, Nijmegen
- Dr. Ir. L. Poot, klinisch fysicus, Isala, Zwolle
- Ir. R. Wientjes, klinisch fysicus, Universitair Medisch Centrum Utrecht, Utrecht
- Dhr. K. Ballemans, deskundige infectiepreventie, Unic Medical Services BV, Nieuwegein
- Dhr. P. Bergervoet, deskundige infectiepreventie, Tensen & Nolte Infectiepreventie, Nieuwe Niedorp
- Prof. dr. M.W. de Haan, interventieradioloog, Maastricht Universitair Medisch Centrum, Maastricht
- Prof. dr. M.J. Schalij, interventiecardioloog, Leids Universitair Medisch Centrum, Leiden
- Dr. G.A.M. Krekels, dermatoloog, MohsA, Venray
Met ondersteuning van
- Drs. B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, Deventer
- Dr. M.A. Pols, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
J.J. Duvekot |
Gynaecoloog-perinatoloog |
Directeur Medisch Advies en Expertise Bureau Duvekot |
geen |
geen |
Voorzitter Adviescommissie Richtlijnen FMS |
geen |
geen |
geen |
|
J. Kluytmans |
Arts-microbioloog Amphia Ziekenhuis Breda (0,6); onderzoeker UMC Utrecht (0,4) |
|
Geen directe belangen (beleg in aandelen zonder te beleggen in specifieke bedrijven, maar mogelijk wel als onderdeel van pakketten en sectoren). Oefen daar geen directe invloed op uit.
Lid advisory board 3M; Lid advisory board Destiny Farma. |
geen |
Voorzitter NVMM |
geen |
geen |
geen |
|
A. Voss |
Arts-microbioloog. CWZ; Hoogleraar infectiepreventieRadboud UMC |
|
geen |
geen |
geen |
geen |
geen |
geen |
|
I.J.B. Spijkerman |
Arts-microbioloog, AMC, Amsterdam |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
M.V. Joosse |
Oogarts, opleider |
|
Adviseur Micreos Human Health BV en opties. Micreos ontwikkelt geneesmiddelen en preparaten die bacteriofaagafgeleiden bevatten waarmee bacteriële infecties kunnen worden bestreden op de huid en in voedingsmiddelen. |
CEO van Micreos is broer van echtgenote. |
|
geen |
geen |
geen |
|
F.O. Kooij |
Anesthesioloog/ MMT arts |
|
geen |
geen |
Deelname aan de vorige expertgroep, nog onder WIP regie |
geen |
geen |
geen |
|
P.M.N.Y.H. Go |
Chirurg |
|
geen |
geen |
VMS St. Antonius ziekenhuis, Nieuwegein. |
geen |
geen |
geen |
| P.C. Jutte |
Orthopedisch chirurg |
|
geen |
geen |
Lid wetenschappelijke commissie Sarcoom patiënten vereniging |
ZonMW LEAK study. De beste behandeling van wondlekkage na heup of knieprothese |
geen |
geen |
|
A.B. Steensma |
Gynaecoloog |
|
geen |
Geen |
geen |
geen |
geen |
Eerder echo apparatuur (GE Kretz) geleend; dit heeft niet geleid tot inmenging in onderzoek dan wel aankoop echo apparatuur. |
|
M. Cromheecke |
Plastisch chirurg; DGA privekliniek Zipper Clinics |
|
geen |
Geen |
geen |
geen |
geen |
geen |
|
P. Segers |
Cardiothoracaal chirurg |
geen |
geen |
Geen |
geen |
geen |
geen |
geen |
|
F. d’Ancona |
Uroloog, Radboudumc |
|
geen |
Geen |
geen |
PI van tweetal door industrie gefinancierde klinische onderzoeken die in Radboudumc worden uitgevoerd: Storz; Neotract. |
geen |
geen |
|
L. Poot |
Klinisch Fysicus te Isala Zwolle |
|
geen |
Geen |
Voorzitter NVKF |
geen |
geen |
geen |
|
R. Wientjes |
Klinisch Fysicus, UMC Utrecht |
geen |
geen |
Geen |
geen |
geen |
geen |
geen |
|
K. Ballemans |
Deskundige infectiepreventie Unic Medical Services BV |
geen |
geen |
Geen |
geen |
geen |
geen |
geen |
|
P. Bergervoet |
Deskundige infectiepreventie bij Tensen en Nolte infectiepreventie |
geen |
geen |
Geen |
geen |
geen |
geen |
geen |
|
M.W. de Haan |
Interventieradioloog |
Voorzitter Centrale Opleiding Commissie Maastricht UMC+ (niet persoonsgebonden vergoeding aan afdeling radiologie) |
geen |
Geen |
Voorzitter Centrale Opleiding Commissie Maastricht UMC+ |
Principal investigator:
Deelname aan:
|
geen |
geen |
|
M.J. Schalij |
Hoofd Cardiologie UMC |
geen |
geen |
Geen |
geen |
geen |
geen |
geen |
|
G.A.M. Krekels |
Dermatoloog (80%)/ Bestuurder Stichting Mohsa/Mohs Expert (20%) |
geen |
Vertegenwoordig de NVDV als dermatoloog / lid, tevens bestuurder van een huidcentrum |
Geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
In het kader van de knelpuntanalyse was de Patiëntenfederatie Nederland uitgenodigd voor een invitational conference. Zij hebben laten weten hieraan niet deel te nemen vanwege het technische karakter van de richtlijn. Ook tijdens de commentaarfase is de Patiëntenfederatie Nederland gevraagd om input.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het implementatieplan). Hiertoe is het concept van de richtlijn met de belangrijkste stakeholders besproken in het kader van haalbaarheid alvorens de richtlijn ter becommentariëring naar de wetenschappelijke verenigingen te sturen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers et al., 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep, de werkgroepleden en de adviseurs de knelpunten: er is veel discussie over de WIP-richtlijn ‘Luchtbehandeling in operatiekamer en opdekruimte in operatieafdeling klasse 1 (2014)’. De discussie over deze richtlijn betrof met name het feit dat bepaalde operatiekamers, na metingen conform VCCN-RL 7 niet bleken te voldoen aan de gestelde prestatie-eisen voor het beschermde gebied.
Tevens zijn er via een invitational conference knelpunten aangedragen door vertegenwoordigers van de Inspectie voor de Gezondheidszorg, Nederlands Oogheelkundig Gezelschap, Nederlandse Orthopedische Vereniging, Nederlandse Vereniging voor Anesthesiologie, Nederlandse Vereniging voor Klinische Fysica, Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied, Nederlandse Vereniging voor Plastische Chirurgie, Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg, Nederlandse Vereniging van Ziekenhuizen, Radboud UMC, UMC Groningen, UMC Utrecht, LUMC, VUMC, Ziekenhuis Tergooi, TNO, Kalibra, Surgicube en Vereniging Contamination Control Nederland. Een verslag van de invitational conference kunt u vinden in de bijlagen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews in de databases Medline en Embase (vanaf het jaar 2000). Zie hiervoor de zoekverantwoording. Vervolgens werd voor de uitgangsvraag over welk type luchtbehandelingsysteem aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (vanaf het jaar 1990). Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk-of-bias tabel.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het formuleren van een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in module 5.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: Inspectie voor de Gezondheidszorg, Zorgverzekeraars Nederland, Zorginstituut Nederland, Samenwerkende Topklinische Ziekenhuizen, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Federatie van Universitair Medische Centra, Patiëntenfederatie Nederland, Nederlandse Vereniging voor Keel-Neus-Oorheelkunde en Heelkunde van het Hoofd-Halsgebied, Nederlandse Internisten Vereniging, Nederlandse Vereniging voor Neurochirurgie, Nederlands Huisartsen Genootschap, Nederlands Genootschap van Abortusartsen, Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde, NVMKA, TNO, VCCN. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuur
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ 2016;353:i2089.
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ 2010;182:E839-42.
Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008;336: 924-6.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) <1990 to 2018 April 17>
|
1 exp VENTILATION/ (5295) 2 (ventilatio* or airflow or temperature?controlled or opragon or "temperature controlled" or flow or laminar or unidirectional).tw. (742496) 3 (ventilatio* or airflow or temperature?controlled or opragon or "temperature controlled" or flow or laminar or unidirectional).kf. (25213) 4 1 or 2 or 3 (749732) 5 exp Environment, Controlled/ not exp VENTILATION/ (290429) 6 Air Pollution, Indoor/ (11829) 7 4 or 5 or 6 (1035173) 8 Surgical Wound Infection/ (33190) 9 (surgical wound infection? or ssi or surgical site infection?).tw. (11060) 10 (surgical wound infection? or ssi or surgical site infection?).kf. (1661) 11 8 or 9 or 10 (39194) 12 Operating Rooms/ (12474) 13 (operating adj3 (room? or theatre?)).tw. (27221) 14 (operating adj3 (room? or theatre?)).kf. (1077) 15 12 or 13 or 14 (33912) 16 7 and 11 and 15 (396) 17 (english or dutch or german or french or spanish).la. (25644477) 18 4 and 11 (833) 19 5 and 11 (195) 20 6 and 11 (19) 21 11 and 15 (1524) 22 4 and 21 (336) 23 19 or 20 or 22 (487) 24 17 and 23 (461) 25 24 (461) 26 limit 25 to yr="1990 -Current" (276) 27 18 or 19 or 20 (980) 28 17 and 27 (921) 29 28 (921) 30 limit 29 to yr="1990 -Current" (656) 31 Prosthesis-Related Infections/ (10491) 32 (prosthesis adj3 related adj3 infection?).tw. (59) 33 (prosthesis adj3 related adj3 infection?).kf. (56) 34 ((prosthesis?related adj3 infection?) or (prosthetic adj3 joint adj3 infection?) or PJI or (periprosthetic adj3 joint adj3 infection?)).tw. (2256) 35 ((prosthesis?related adj3 infection?) or (prosthetic adj3 joint adj3 infection?) or PJI or (periprosthetic adj3 joint adj3 infection?)).kf. (582) 36 or/31-35 (11491) 37 11 or 36 (49948) 38 7 and 15 and 37 (416) 39 (4 or 5 or 6) and 37 (1171) 40 4 and 37 and 15 (353) 41 38 or 39 or 40 (1171) 42 41 and 17 (1106) 43 limit 42 to yr="1990 -Current" (841) 44 "filter systematic reviews".ti. (0) 45 meta analysis.pt. (87335) 46 (meta-anal$ or metaanal$).af. (154666) 47 (quantitativ$ adj10 (review$ or overview$)).tw. (7438) 48 (systematic$ adj10 (review$ or overview$)).tw. (134528) 49 (methodologic$ adj10 (review$ or overview$)).tw. (9707) 50 (quantitativ$ adj10 (review$ or overview$)).kf. (40) 51 (systematic$ adj10 (review$ or overview$)).kf. (10808) 52 (methodologic$ adj10 (review$ or overview$)).kf. (54) 53 medline.tw. and review.pt. (69104) 54 (pooled adj3 analy*).tw. (14905) 55 (pooled adj3 analy*).kf. (160) 56 "cochrane$".fc_jour. (13621) 57 or/45-56 (277699) 58 "sensitief filter voor RCT's van Cochrane".ti. (0) 59 randomized controlled trial.pt. (458941) 60 controlled clinical trial.pt. (92334) 61 (randomized or randomised).ab. (489764) 62 placebo.ab. (188340) 63 drug therapy.fs. (2010219) 64 randomly.ab. (288984) 65 trial.ab. (425459) 66 groups.ab. (1786392) 67 or/59-66 (4198958) 68 67 not (exp animals/ not humans/) (3630499) 69 "filter observational studies Medline".ti. (0) 70 epidemiologic studies/ (7656) 71 exp case-control studies/ (909745) 72 exp cohort studies/ (1732640) 73 cross-sectional studies/ (263225) 74 (case adj3 control).af. (289176) 75 (cohort adj5 (study or studies or analy$)).af. (349527) 76 (follow-up adj5 (study or studies)).af. (630897) 77 (longitudinal or retrospective or prospective or (cross adj5 sectional)).af. (1962272) 78 (observational adj5 (study or studies)).af. (133712) 79 or/70-78 (2728683) 80 "filter obs Medline".ti. (0) 81 comparative study/ (1795652) 82 validation studies/ (88765) 83 79 or 81 or 82 (4197118) 84 43 and 57 (33) SR 85 (43 and 67) not 57 (192) trials 86 (43 and 83) not (57 or 67) (255) observat |
469 studies |
|
Embase <1990 to 2018 April 17> |
1 air conditioning/ (22844) 2 (ventilatio* or airflow or temperature?controlled or opragon or "temperature controlled" or flow or laminar or unidirectional).tw. (1002901) 3 (ventilatio* or airflow or temperature?controlled or opragon or "temperature controlled" or flow or laminar or unidirectional).kw. (107494) 4 1 or 2 or 3 (1024593) 5 (microclimate/ or room ventilation/) not air conditioning/ (10859) 6 indoor air pollution/ (12372) 7 4 or 5 or 6 (1044157) 8 surgical infection/ (38371) 9 (surgical wound infection? or ssi or surgical site infection?).tw. (15924) 10 (surgical wound infection? or ssi or surgical site infection?).kw. (2770) 11 8 or 9 or 10 (44680) 12 operating room/ (31374) 13 (operating adj3 (room? or theatre?)).tw. (37066) 14 (operating adj3 (room? or theatre?)).kw. (1341) 15 12 or 13 or 14 (49276) 16 7 and 11 and 15 (272) 17 (english or dutch or german or french or spanish).la. (29536030) 18 4 and 11 (1076) 19 5 and 11 (40) 20 6 and 11 (8) 21 11 and 15 (1700) 22 4 and 21 (254) 23 19 or 20 or 22 (281) 24 17 and 23 (266) 25 18 or 19 or 23 (1102) 26 17 and 25 (1053) 27 26 (1053) 28 limit 27 to yr="1990 -Current" (953) 29 "filter systematic reviews & meta-analyses Embase".ti. (0) 30 meta analysis/ (142836) 31 "systematic review"/ (165791) 32 (meta-analy$ or metaanaly$).tw. (166050) 33 (systematic$ adj4 (review$ or overview$)).tw. (162318) 34 (quantitativ$ adj5 (review? or overview?)).tw. (4216) 35 (methodologic adj5 (overview? or review?)).tw. (340) 36 (review$ adj3 (database? or medline or embase or cinahl)).tw. (21875) 37 (pooled adj3 analy$).tw. (22890) 38 (extensive adj3 review$ adj3 literature).tw. (3144) 39 (meta or synthesis or (literature adj8 database?) or extraction).tw. (1263404) 40 review.pt. (2360631) 41 39 and 40 (124035) 42 (systematic$ adj4 (review$ or overview$)).kw. (19550) 43 (quantitativ$ adj5 (review? or overview?)).kw. (53) 44 (pooled adj3 analy$).kw. (402) 45 or/30-38,41-44 (429112) 46 "filter rct embase".ti. (0) 47 controlled clinical trial/ or randomized controlled trial/ (680880) 48 randomization/ (77793) 49 Major Clinical Study/ (3083566) 50 random$.tw. (1293793) 51 Double Blind Procedure/ (148944) 52 or/47-51 (4271947) 53 "einde filter rct embase".ti. (0) 54 "filter observationele studies embase".ti. (0) 55 Clinical study/ (153962) 56 Case control study/ (124728) 57 Family study/ (25417) 58 Longitudinal study/ (111267) 59 Retrospective study/ (639274) 60 Prospective study/ (442166) 61 Randomized controlled trials/ (143882) 62 60 not 61 (437689) 63 Cohort analysis/ (364368) 64 (Cohort adj (study or studies)).tw. (218453) 65 (Case control adj (study or studies)).tw. (112357) 66 (follow up adj (study or studies)).tw. (57922) 67 (observational adj (study or studies)).tw. (123962) 68 (epidemiologic$ adj (study or studies)).tw. (96429) 69 (cross sectional adj (study or studies)).tw. (160060) 70 or/55-60,62-69 (2053445) 71 "filter observationele studies embase".ti. (0) 72 exp comparative study/ (1261818) 73 exp validation study/ (69359) 74 70 or 72 or 73 (3202170) 75 28 and 45 (35) 76 (28 and 52) not 45 (340) 77 *surgical infection/ (13542) 78 (surgical wound infection? or ssi or surgical site infection?).ti. (5103) 79 10 (2770) 80 77 or 78 or 79 (15745) 81 28 and 80 (318) 82 (81 and 52) not 45 (66) 83 (81 and 74) not (45 or 52) (29) 84 (28 and 74) not (45 or 52) (120) 85 (prosthesis adj3 related adj3 infection?).tw. (64) 86 (prosthesis adj3 related adj3 infection?).kw. (165) 87 ((prosthesis?related adj3 infection?) or (prosthetic adj3 joint adj3 infection?) or PJI or (periprosthetic adj3 joint adj3 infection?)).tw. (2496) 88 ((prosthesis?related adj3 infection?) or (prosthetic adj3 joint adj3 infection?) or PJI or (periprosthetic adj3 joint adj3 infection?)).kw. (730) 89 or/85-88 (2822) 90 11 or 89 (47294) 91 ((prosthesis?related adj3 infection?) or (prosthetic adj3 joint adj3 infection?) or PJI or (periprosthetic adj3 joint adj3 infection?)).ti. (1352) 92 88 or 91 (1669) 93 80 or 92 (17368) 94 7 and 15 and 93 (163) 95 94 and 17 (151) 96 limit 95 to yr="1990 -Current" (105) 97 96 and 45 (9) 98 (96 and 52) not 45 (20) 99 (96 and 74) not (45 or 52) (6) 100 7 and 15 and 90 (280) 101 100 (280) 102 limit 101 to yr="1990 -Current" (204) 103 102 and 45 (13) SR 104 (102 and 52) not 45 (42) trials 105 (102 and 74) not (45 or 52) (17) observat |
48 studies |
|
Cochrane Library (CENTRAL) < to 2018 April 17>
|
ID Search #1 (opragon or (temperature near/1 controlled near/1 airflow)):ti,ab #2 (ventilatio* or airflow or flow or laminar or unidirectional):ti,ab #3 (ventilatio* or airflow or flow or laminar or unidirectional):kw #4 MeSH descriptor: [Ventilation] explode all trees #5 #2 or #3 or #4 #6 MeSH descriptor: [Surgical Wound Infection] explode all trees #7 (surgical wound infection* or ssi or surgical site infection*):ti,ab #8 (surgical wound infection* or ssi or surgical site infection*):kw #9 MeSH descriptor: [Prosthesis-Related Infections] explode all trees #10 ((prosthesis-related near/3 infection?) or (prosthetic near/3 joint near/3 infection*) or PJI or (periprosthetic near/3 joint near/3 infection*)):ti,ab #11 #6 or #7 or #8 or #9 or #10 #12 #5 and #11 #13 MeSH descriptor: [Environment, Controlled] explode all trees #14 (#5 or #13) and #11 |
165 studies
|
Algemene zoekstrategie
Medline
Database: MEDLINE <1946 to 2018 February 14>
Search Strategy:
--------------------------------------------------------------------------------
1 "update WIP richtlijn luchtbehandeling operatiekamers".ti. (0)
2 Operating Rooms/ (12397)
3 (operating adj3 (room? or theatre? or department?)).tw. (27220)
4 (operating adj3 (room? or theatre? or department?)).kf. (1057)
5 (surgical adj3 suite?).tw. (492)
6 (surgical adj3 suite?).kf. (1)
7 or/2-6 (34096) setting
8 ((clean or ultraclean or indoor) adj3 air).tw. (7309)
9 ((clean or ultraclean or indoor) adj3 air).kf. (640)
10 (air adj3 (particle? or flow or ventilation or handling or counts)).tw. (8072)
11 (air adj3 (particle? or flow or ventilation or handling or counts)).kf. (78)
12 ((turbulen* or displacement) adj3 ventilation).tw. (73)
13 ((turbulen* or displacement) adj3 ventilation).kf. (1)
14 ((((ventilation or air) adj handling) or air-handling) adj3 system).tw. (34)
15 ((((ventilation or air) adj handling) or air-handling) adj3 system).kf. (0)
16 Ventilation/ (5273)
17 ((laminar adj3 flow) or (laminar adj3 airflow) or (conventional adj3 flow) or (conventional adj3 airflow)).tw. (4903)
18 ((laminar adj3 flow) or (laminar adj3 airflow) or (conventional adj3 flow) or (conventional adj3 airflow)).kf. (88)
19 ((conventional or ultraclean or plenum or hori?ontal or vertical) adj3 ventilat*).tw. (2408)
20 ((conventional or ultraclean or plenum or hori?ontal or vertical) adj3 ventilat*).kf. (16)
21 or/8-20 (26185) lucht kenmerken
22 7 and 21 (933) kenmerken in operatieruimte
23 ((air or airborne) adj3 bacteri*).tw. (1331)
24 ((air or airborne) adj3 bacteri*).kf. (154)
25 Air Microbiology/ (7065)
26 Air Pollution, Indoor/ (11714)
27 ((air or airborne) adj3 (microbiol* or pollution or pollutant? or contamination?)).tw. (25380)
28 ((air or airborne) adj3 (microbiol* or pollution or pollutant? or contamination?)).kf. (6143)
29 or/23-28 (44198) luchtkwaliteit
30 Surgical Wound Infection/ (32966)
31 ((surgical or postoperative or site) adj3 infection?).tw. (30567)
32 ((surgical or postoperative or site) adj3 infection?).kf. (1737)
33 ((exogenous or wound? or injur*) adj3 infect*).tw. (33267)
34 ((exogenous or wound? or injur*) adj3 infect*).kf. (1393)
35 or/30-34 (78438) infectie risico onderdeel
36 22 and 29 (428) kenmerken operatieruimte en luchtkwaliteit
37 35 and 36 (227) kenmerken operatieruimte en luchtkwaliteit en infectie risico
38 37 (227)
39 limit 38 to yr="2000 -Current" (75)
40 (dutch or german or english).la. (24416262)
41 39 and 40 (72) spec search
42 "bischoff$".fc_auts. and "effect of laminar airflow".fc_titl. (1)
43 41 and 42 (0)
44 Infection Control/ (21623)
45 Infection/pc [Prevention & Control] (145)
46 Bacterial Infections/pc [Prevention & Control] (8707)
47 35 or 44 or 45 or 46 (105550) infectie risico
48 36 and 47 (254) kenmerken operatieruimte en luchtkwaliteit
49 7 and 21 and 47 (402)
50 49 (402)
51 limit 50 to yr="2000 -Current" (163)
52 40 and 51 (153) specifieke search
53 "Hospital Design and Construction"/ (9592)
54 47 and (21 or 29) and 40 (1112)= infectie risico en lucht kenmerken of luchtkwaliteit
55 54 (1112)
56 limit 55 to yr="2000 -Current" (487)
57 guideline/ or practice guideline/ (30259)
58 (guideline? or protocol? or standard?).ti. (165993)
59 (guideline? or protocol? or standard?).kf. (17410)
60 57 or 58 or 59 (192870) richtlijnen
61 "filter systematic reviews".ti. (0)
62 meta analysis.pt. (84720)
63 (meta-anal$ or metaanal$).af. (150663)
64 (quantitativ$ adj10 (review$ or overview$)).tw. (7235)
65 (systematic$ adj10 (review$ or overview$)).tw. (130114)
66 (methodologic$ adj10 (review$ or overview$)).tw. (9507)
67 (quantitativ$ adj10 (review$ or overview$)).kf. (35)
68 (systematic$ adj10 (review$ or overview$)).kf. (10127)
69 (methodologic$ adj10 (review$ or overview$)).kf. (46)
70 medline.tw. and review.pt. (67440)
71 (pooled adj3 analy*).tw. (14519)
72 (pooled adj3 analy*).kf. (152)
73 "cochrane$".fc_jour. (13431)
74 or/62-73 (270752) SR
75 56 and 60 (20)= guidelines
76 (56 and 74) not 60 (20)= SR
77 42 and 47 (1)
78 (7 or 21 or 29) and 47 and 40 and 60 (106)= (operatie ruimte of lucht kenmerken of lucht kwaliteit ) en infectie risico en talen en richtlijnen
79 (7 or 21 or 29) and 47 and 40 and 74 (57) )= (operatie ruimte of lucht kenmerken of lucht kwaliteit ) en infectie risico en talen en SR
80 79 (57)
81 limit 80 to yr="2000 -Current" (55)
82 78 (106)
83 limit 82 to yr="2000 -Current" (64) guidelines vanaf 2000
84 78 (106)
85 79 not 78 (54)
86 85 (54)
87 limit 86 to yr="2000 -Current" (52) SR vanaf 2000
Embase
Database: Embase <1974 to 2018 February 14>
Search Strategy:
--------------------------------------------------------------------------------
1 bacteriological standards for air in ultraclean operating rooms.ti. (1)
2 *"air sampling"/ (4247)
3 operating room/ (30635)
4 (operating adj3 (room? or theatre? or department?)).tw. (36747)
5 (operating adj3 (room? or theatre? or department?)).kw. (1307)
6 (surgical adj3 suite?).tw. (640)
7 (surgical adj3 suite?).kw. (9)
8 ((clean or ultraclean or indoor) adj3 air).tw. (10717)
9 ((clean or ultraclean or indoor) adj3 air).kw. (2476)
10 (air adj3 (particle? or flow or ventilation or handling or counts)).tw. (11485)
11 (air adj3 (particle? or flow or ventilation or handling or counts)).kw. (327)
12 ((turbulen* or displacement) adj3 ventilation).tw. (131)
13 ((turbulen* or displacement) adj3 ventilation).kw. (17)
14 ((((ventilation or air) adj handling) or air-handling) adj3 system).tw. (49)
15 ((((ventilation or air) adj handling) or air-handling) adj3 system).kw. (0)
16 air conditioning/ (22739)
17 exp microclimate/ (49264)
18 ((laminar adj3 flow) or (laminar adj3 airflow) or (air adj3 condition*) or microclimate or (conventional adj3 flow) or (conventional adj3 airflow)).tw. (14935)
19 ((laminar adj3 flow) or (laminar adj3 airflow) or (air adj3 condition*) or microclimate or (conventional adj3 flow) or (conventional adj3 airflow)).kw. (900)
20 ((conventional or ultraclean or plenum or hori?ontal or vertical) adj3 ventilat*).tw. (3222)
21 ((conventional or ultraclean or plenum or hori?ontal or vertical) adj3 ventilat*).kw. (82)
22 or/3-7 (49072) operatie ruimte
23 or/8-21 (79517) lucht kenmerken
24 ((air or airborne) adj3 bacteri*).tw. (1590)
25 ((air or airborne) adj3 bacteri*).kw. (185)
26 microbiology/ or environmental microbiology/ (278101)
27 air sampling/ (13186)
28 indoor air pollution/ (12266)
29 ((air or airborne) adj3 (microbiol* or pollution or pollutant? or contamination?)).tw. (36821)
30 ((air or airborne) adj3 (microbiol* or pollution or pollutant? or contamination?)).kw. (10262)
31 or/24-30 (339143) lucht kwaliteit
32 surgical infection/ (37425)
33 ((surgical or postoperative or site) adj3 infection?).tw. (41170)
34 ((surgical or postoperative or site) adj3 infection?).kw. (3459)
35 ((exogenous or wound? or injur*) adj3 infect*).tw. (44606)
36 ((exogenous or wound? or injur*) adj3 infect*).kw. (2291)
37 wound infection/ (40718)
38 exp infectious complication/ (148840)
39 infection control/ (78408)
40 or/32-39 (260511)
41 40 and 22 (3801) )=infectie risico en operatie ruimte
42 40 and 22 and (23 or 31) (669)=infectie risico en operatie ruimte en lucht kenmerken of lucht kwaliteit )
43 "construction work and architectural phenomena"/ (7883)
44 hospital building/ (1533)
45 hospital design/ (9404)
46 (dutch or german or english).la. (27927468)
47 42 and 46 (584) infectie risico en operatie ruimte en lucht kenmerken of lucht kwaliteit ) en talen
48 limit 47 to yr="2010 -Current" (184)
49 "filter systematic reviews & meta-analyses Embase".ti. (0)
50 meta analysis/ (138059)
51 "systematic review"/ (156492)
52 (meta-analy$ or metaanaly$).tw. (159554)
53 (systematic$ adj4 (review$ or overview$)).tw. (155503)
54 (quantitativ$ adj5 (review? or overview?)).tw. (4078)
55 (methodologic adj5 (overview? or review?)).tw. (337)
56 (review$ adj3 (database? or medline or embase or cinahl)).tw. (21150)
57 (pooled adj3 analy$).tw. (22074)
58 (extensive adj3 review$ adj3 literature).tw. (3078)
59 (meta or synthesis or (literature adj8 database?) or extraction).tw. (1243154)
60 review.pt. (2328762)
61 59 and 60 (119814)
62 (systematic$ adj4 (review$ or overview$)).kw. (18697)
63 (quantitativ$ adj5 (review? or overview?)).kw. (52)
64 (pooled adj3 analy$).kw. (387)
65 or/50-58,61-64 (413604)sr
66 48 and 65 (16)
67 from 66 keep 1-16 (16)
68 practice guideline/ or health care quality/ or good clinical practice/ (533007)
69 (guideline? or protocol? or standard?).ti. (212896)
70 (guideline? or protocol? or standard?).kw. (51376)
71 or/68-70 (695692) richtlijnen
72 48 and 71 (22)
73 66 not 72 (12)
74 exp health care facility/ (1387651)
75 from 72 keep 1-22 (22)
76 from 73 keep 1-12 (12)
77 40 and 71 and 74 (3799)
78 77 (3799)
79 limit 78 to yr="2010 -Current" (2086)
80 79 and (31 or air.tw.) (111)
81 air monitoring/ or environmental monitoring/ (61869)
82 31 or 81 (391819)
83 40 and (22 or 74) and (23 or 82) and 46 and 71 (255)
84 83 (255)
85 limit 84 to yr="2010 -Current" (127)
86 85 not 72 (105)
87 (40 and (22 or 74) and (23 or 82) and 46 and 65) not (66 or 85) (40)
88 47 (584)
89 47 and 71 (51)
90 limit 89 to yr="2000 -Current" (45)
91 47 and 65 (17)
92 91 not 90 (13)
93 92 (13)
94 limit 93 to yr="2000 -Current" (12)
95 40 and (23 or 31) and (22 or 43 or 44 or 45) (755)
96 95 (755)
97 limit 96 to yr="2000 -Current" (383)
98 97 and 46 and 71 (63)
99 (97 and 46 and 65) not 71 (12)
100 46 and 47 and 71 (51)
101 100 (51)
102 limit 101 to yr="2000 -Current" (45)=guidelines
103 (46 and 47 and 65) not 71 (13)
104 103 (13)
105 limit 104 to yr="2000 -Current" (12)=SR
