Indicaties CT-scan hersenen kinderen
Uitgangsvraag
Welke kinderen komen in aanmerking voor een CT-scan hersenen na licht THL in de acute fase?
Aanbeveling
Bij kinderen < 2 jaar: Maak een CT-scan hersenen bij presentatie op de SEH < 24 uur na licht THL met minimaal 1 van de volgende symptomen:
- EMV-score < 15 (zie Tabel Pediatrische EMV-score)
- Verwardheid, agitatie, somnolentie
- Palpabele schedelfractuur
- Neurologische uitvalsverschijnselen
- Posttraumatisch epileptisch insult
Bij kinderen < 2 jaar: Maak een CT-scan hersenen of neem een kind op bij presentatie < 24 uur na licht THL bij minimaal 1 van de volgende symptomen:
- Gevaarlijk traumamechanisme (val vanaf > 1 meter, ‘focaal high impact’, hoogenergetisch traumamechanisme* etc.)
- Bewustzijnsverlies ≥ 5 seconden
- Schedelhematoom pariëtaal/temporaal/occipitaal
- Afwijkend gedrag volgens ouders (dit kan zowel een verandering zijn in bewustzijn als gedrag)
- Stollingsstoornissen**
*Onder hoogenergetisch traumamechanisme (HET) wordt verstaan: Hoog risico auto-ongeval (> 30cm indeuking aan zijde slachtoffer; > 45cm indeuking op andere plaats; uit voertuig geslingerd; overlijden in zelfde compartiment; telemetrie data passend bij ernstig letsel). Auto versus voetganger/fietser. Bestuurder/berijder gescheiden van transport medium met significante impact (bijv. motorfiets, paard). Overig trauma met vergelijkbare energie overdracht waar bij een leeftijd < 2 jaar een val van > 1m ook als een HET kan worden beschouwd.
Overweeg opname of een CT-scan als er geen ooggetuige van het trauma of bij onduidelijke toedracht. Dit is een toevoeging aan de PECARN-beslisregel.
Kies laagdrempelig voor een CT-scan hersenen als er meerdere van bovenstaande symptomen zijn, met name wanneer tijdens observatie het kind achteruitgaat en wanneer het kind jonger dan 3 maanden is.
Bij kinderen 2 jaar t/m 15 jaar: maak een CT-scan hersenen bij presentatie op de SEH < 24 uur na licht THL met minimaal 1 van de volgende symptomen:
- EMV-score < 15 (zie Tabel Pediatrische EMV-score)
- Verwardheid, agitatie, somnolentie
- Tekenen van schedelbasisfractuur
- Neurologische uitvalsverschijnselen
- Posttraumatisch epileptisch insult
Bij kinderen 2 jaar t/m 15 jaar: maak een CT-scan hersenen of neem een kind op bij presentatie < 24 uur na licht THL bij minimaal 1 van de volgende symptomen:
- Braken (2 of meer episodes)
- Gevaarlijk traumamechanisme (val vanaf > 1 meter, focaal high impact, hoogenergetisch traumamechanisme etc.)
- Ernstige hoofdpijn
- Bewustzijnsverlies
- Stollingsstoornissen**
Kies laagdrempelig voor een CT-scan hersenen als er meerdere van bovenstaande symptomen zijn of wanneer symptomen verslechteren of het kind achteruitgaat tijdens observatie.
Indien het traumamechanisme niet voldoende verklarend is voor de letsels of het traumamechanisme niet passend is bij de ontwikkelingsleeftijd van het kind overweeg dan ook een CT-scan hersenen.
Gebruik de flowcharts om te bepalen of een CT-scan hersenen gewenst is.
**Overleg altijd met een kinderarts-hematoloog als een kind een stollingsstoornis heeft of stollingsbeïnvloedende medicatie gebruikt.
Vermijd de ogen en het halsgebied bij het maken van een CT-scan hersenen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematische literatuuranalyse uitgevoerd naar de verschillende beslisregels voor het verrichten van een CT-scan hersenen bij kinderen met een licht THL in de acute fase. Naar mening van de werkgroep is het belangrijk om een beslisregel toe te passen, enerzijds om te zorgen voor uniformiteit van beleid, anderzijds om zorgverleners in de acute fase te ondersteunen in de besluitvorming omtrent het maken van een CT-scan hersenen.
De vraag welke beslisregel de voorkeur heeft, is een afweging van factoren. Er wordt enerzijds gestreefd naar een zo hoog mogelijke sensitiviteit, echter dit dient te worden afgewogen tegen het aantal kinderen dat een CT-scan hersenen (en dus straling) moet ondergaan. Voor het detecteren van afwijkingen waarvoor neurochirurgisch ingrijpen nodig is, dient de sensitiviteit zeer hoog te zijn (95%-100%), omdat het missen hiervan naar verwachting negatieve gezondheidseffecten heeft voor het kind. Wanneer het gaat om het opsporen van intracraniële afwijkingen in het algemeen, is het belang van een sensitiviteit van 100% minder groot, omdat dit vaak geen directe behandelconsequenties heeft voor het beleid op korte termijn, maar wel van invloed is op opnamebeleid. Bovendien zijn intracraniële afwijkingen wel degelijk geassocieerd met nadelige gevolgen op de lange termijn (Gardner, 2019; Königs, 2019). Er is geen definitie van relevante intracraniële afwijkingen, dit moet beschouwd worden als een kennislacune.
Op grond van de literatuur blijken twee beslisregels een sensitiviteit van 100% te hebben wanneer er gekeken wordt naar het opsporen van afwijkingen waarvoor neurochirurgisch ingrijpen geïndiceerd is, namelijk de UCD en de PECARN. Hierbij ligt de specificiteit voor UCD weliswaar iets hoger dan voor PECARN, maar het verschil is marginaal (0,65 vs. 0,59-0,61). Dit betekent dat bij gebruik van PECARN er verhoudingsgewijs bij iets meer kinderen een CT-scan hersenen gemaakt wordt, zonder dat dit leidt tot neurochirurgisch ingrijpen. Echter, de criteria om een CT-scan hersenen te maken zijn voor beide beslisregels op enkele factoren na vergelijkbaar. Wanneer er beoordeeld wordt op ‘level of evidence’, dan blijkt deze het hoogst te zijn bij de CATCH beslisregel. Bij deze beslisregel ligt de sensitiviteit echter beduidend lager (0,75-1), evenals de specificiteit (0,4 en 0,8).
Wanneer de UCD- en PECARN-beslisregels worden vergeleken met betrekking tot het detecteren van intracraniële afwijkingen, dan ligt de sensitiviteit in combinatie met de specificiteit het hoogst bij de PECARN (≥2 jaar sens 0,95-1, spec 0,46-0,8; < 2 jaar sens 0,87-1, spec 0,54-0,71). Hierbij is ‘level of evidence’ geduid als moderate. De sensitiviteit van de UCD verschilt weliswaar weinig (0,91 – 1,0), maar de specificiteit is opvallend lager (0,12 - 0,43). Bovendien is de PECARN-beslisregel in meer verschillende studies gevalideerd.
Daarnaast is er door Abid in 2021 een studie verricht waarbij de diagnostische impact van de PECARN-beslisregel onderzocht is. In deze studie werd de uitkomst bekeken van 1081 kinderen die wel en niet in aanmerking kwamen voor een CT-scan hersenen op basis van de CT-criteria. Hieruit bleek dat slechts bij 1 van de 514 kinderen (0.19%) die niet in aanmerking kwam voor een CT-scan hersenen alsnog sprake was van klinisch relevant hersenletsel.
De PECARN is een beslisregel welke gemakkelijk toepasbaar is in de Nederlandse situatie. Deze beslisregel berekent op basis van symptomen zoals EMV-score < 15, braken of bewustzijnsverlies, het risico op klinisch relevant traumatisch hersenletsel. Er wordt hierbij nog altijd onderscheid gemaakt tussen kinderen jonger dan 2 jaar en vanaf 2 jaar en er kan in bepaalde situaties gekozen worden voor óf een CT-scan hersenen óf opname ter observatie. Deze PECARN is gezien de combinatie van hoge sensitiviteit en relatief hoge specificiteit naar mening van de werkgroep de beste keuze uit de bestaande beslisregels.
Doordat we in de huidige richtlijn deze beslisregel toepassen zullen de CT-criteria enigszins anders zijn dan in de vorige richtlijn uit 2010: Er wordt in de huidige richtlijn alleen nog maar onderscheid gemaakt in kinderen jonger dan 2 jaar en vanaf 2 jaar. Er wordt geen apart onderscheid meer gemaakt in kinderen vanaf 6 jaar.
De werkgroep vindt het wel nodig om enkele verduidelijkingen aan te geven. In de vorige richtlijn werd bij kinderen jonger dan 2 jaar bij afwezigheid van ooggetuige of bij trauma van onduidelijke toedracht geadviseerd een CT-scan hersenen te maken of te kiezen voor een opname. Deze criteria komen niet terug in de PECARN-beslisregel. Ook de aanwezigheid van neurologische uitvalsverschijnselen of een doorgemaakt posttraumatisch insult staan niet expliciet genoemd. De werkgroep is van mening dat dit desalniettemin belangrijke criteria zijn en voegen deze dan ook toe in de CT-aanbevelingen. De CT-criteria zijn weergegeven in een flowchart.
In de PECARN-beslisregels wordt gesproken over een gevaarlijk trauma mechanisme. Naar de mening van de werkgroep vallen onder dit begrip zowel een hoogenergetisch traumamechanisme (HET) als een focaal high impact letsel. Bij een HET is er sprake van hoge energieoverdracht waardoor intracraniële afwijkingen of andere (inwendige) letsels kunnen optreden. Een strikte definitie is niet te geven. Voorbeelden genoemd in de PECARN-beslisregels zijn: enkele ongevalsmechanismen (zoals gemotoriseerd voertuig versus voetganger of fietser zonder helm, uit auto geslingerd). De werkgroep beschouwd een val vanaf > 1m bij kinderen als een gevaarlijk trauma mechanisme. Dit een afwijkingen van de PECARN-beslisregels waarbij een hoogte vanaf 1.5m bij kinderen > 2 jaar als risicofactor wordt beschouwd. De PECARN calculator app is hierdoor niet optimaal betrouwbaar.
Onder focaal high impact letsel wordt bijvoorbeeld verstaan: uitwendig zichtbaar letsel ten gevolge van een klap met een knuppel of fles op het hoofd, een golf/hockeybal met hoge snelheid tegen het hoofd.
Wat betreft het optreden van braken kan braken ook een uiting zijn van pijn of schrik. Daarom heeft de werkgroep besloten dat meerdere keren braken (2 of meer) kan beschouwd worden als een risicofactor bij kinderen van ³2 jaar. Dit is ook in overeenstemming met de gereviseerde NICE richtlijn Assessment of Head Injury 2023.
Bij neonaten en zuigelingen jonger dan 3 maanden kunnen ondanks intracranieel letsel weinig waarneembare symptomen hebben, en de werkgroep is van mening dat er laagdrempelig voor een CT-scan hersenen moet worden gekozen als er meerdere risicofactoren zijn of wanneer de zuigeling tijdens de observatie achteruitgaat.
Het gebruik van stollingsbeïnvloedende medicatie of bestaande stollingsstoornissen wordt niet meegenomen in de bestaande beslisregels. Dit omdat dit bij kinderen zelden voorkomt en hier bij kinderen geen literatuur over bestaat. In het geval dat een kind toch een stollingsstoornis heeft of stollingsbeïnvloedende medicatie gebruikt is ons advies altijd te overleggen met een kinderarts-kinderhematoloog om het risico op intracraniële afwijkingen of neurochirurgisch ingrijpen in te schatten en op basis hiervan te beslissen wel of geen CT-scan hersenen te maken. De werkgroep heeft daarom besloten om stollingsstoornissen als aparte risicofactor toe te voegen aan het flowdiagram.
Tot slot moet worden vermeld dat bij verdenking op niet accidenteel letsel (2016) het advies is om bij kinderen een MRI-scan hersenen (en myelum) in de subacute fase te verrichten om hiermee eerder ontstane traumatische (axonale) schade te kunnen aantonen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het is niet wenselijk en vaak niet goed mogelijk om de beslissing omtrent het maken van CT-scan hersenen bij het kind of zijn of haar ouders/verzorgers neer te leggen, omdat deze – zeker in een acute situatie- niet in staat zijn deze beslissing te overzien. In de praktijk hebben ouders/verzorgers vaak de wens dat er een CT-scan hersenen gemaakt wordt vanwege zorgen dat er traumatische afwijkingen zijn in de hersenen van hun kind. Echter, het is belangrijk hierin de beslisregel te volgen om zo onnodige stralingsbelasting te voorkomen. Het is belangrijk om een goede uitleg te geven over de overwegingen om een CT-scan te maken of juist waarom deze niet is verricht. Dit kan goed aan ouders uitgelegd worden. Samenspraak met de ouders is mogelijk wanneer er een keuze is om een CT-scan hersenen te maken of een kind ter observatie op te nemen op basis van aanwezige risicofactoren. Wanneer symptomen toenemen of het kind achteruitgaan tijdens SEH-observatie, dan kan de clinicus ervoor kiezen om toch een CT-scan hersenen te maken.
Kosten (middelenbeslag)
Het aantal CT-scans hersenen dat gemaakt wordt bij kinderen met licht THL is de laatste jaren steeds verder toegenomen, evenals de kosten die daarmee gepaard gaan. Het terugbrengen van deze kosten – bij kwalitatief gelijkblijvende zorg– is essentieel. Dit is de reden dat er bij de keuze voor een beslisregel niet alleen rekening is gehouden met de sensitiviteit van de verschillende beslisregels, maar ook met de specificiteit. Hierdoor wordt gepoogd het aantal onnodige scans zo laag mogelijk gehouden. De criteria die binnen de verschillende onderzochte beslisregels gebruikt worden zijn echter voor een deel anders dan de criteria die in de vorige versie van deze richtlijn gebruikt werden. Het is dan ook niet goed te voorspellen of deze nieuwe richtlijn daadwerkelijk tot een vermindering van het aantal CT-scans hersenen (en de begeleidende kosten) zal leiden. Een Nederlandse multicenter studie (Niele, 2020) heeft wel laten zien dat toepassing van PECARN-regels in de Nederlandse situatie zou kunnen leiden tot een aanzienlijke reductie van verrichtte CT-scan hersenen bij kinderen. Ook werd gevonden dat bij de keuze tot observatie of een CT-scan hersenen bij 81% gekozen wordt voor observatie. Het is niet duidelijk of dit beleid vervolgens gaat leiden tot meer opnames en dit moet worden beschouwd als een kennislacune.
Aanvaardbaarheid, haalbaarheid en implementatie
De PECARN-beslisregel die aangehouden wordt in deze richtlijn is makkelijk toepasbaar, er is nog wel onderscheid in CT-criteria voor kinderen < 2 jaar en ≥ 2 jaar. Echter in de vorige richtlijn bestonden er daarbij nog aparte CT-criteria voor kinderen vanaf 6 jaar. Dit is in deze richtlijn achterwege gelaten omdat de PECARN-beslisregel toepasbaar is tot de leeftijd van 18 jaar. In deze richtlijn wordt de beslisregel toegepast t/m de leeftijd van 16 jaar, vanaf 16 jaar wordt de volwassenen module aangehouden (Module Indicaties CT-scan hersenen volwassenen).
Rationale van de aanbeveling: weging van argumenten voor en tegen de diagnostische procedure
De werkgroep is – op basis van een systematisch onderzoek van de beschikbare literatuur – van mening dat de PECARN-beslisregel de beste keuze is voor de besluitvorming omtrent het uitvoeren van CT-scans hersenen bij kinderen met licht THL. Hierbij spelen de sensitiviteit, de specificiteit en de mate van validatie een rol. Een bijkomend voordeel is dat de PECARN-beslisregel onderscheid maakt tussen kinderen < 2 jaar en ≥ 2 jaar. Zie ook flowchart voor te bepalen of een CT-scan hersenen gewenst is.
Onderbouwing
Achtergrond
Indien beeldvorming in de acute fase van licht THL bij een kind gewenst is, zal in eerste instantie een CT-scan hersenen verricht worden. Het doel is om intracraniële afwijkingen te detecteren en te beoordelen of er een indicatie bestaat voor neurochirurgisch ingrijpen. Vroege detectie kan leiden tot betere begeleiding of eerdere interventie met een betere uitkomst. De beslisregels over de indicatie voor een CT-scan hersenen zijn gebaseerd op risicofactoren die zijn geassocieerd met de noodzaak tot neurochirurgisch ingrijpen en het optreden van intracraniële afwijkingen die leiden tot medisch beleid (opname, observaties, medicatie, poliklinische follow-up). Bij kinderen moet het risico op intracraniële afwijkingen echter afgewogen worden tegen de stralingsbelasting die een CT-scan hersenen met zich meebrengt. Het is de vraag in welke situatie een CT-scan hersenen (en de bijkomende stralingsbelasting) gerechtvaardigd is. Uit onderzoek is gebleken dat de vorige richtlijn resulteerde in het maken van te veel CT-scans (Lenstra 2017, Niele, 2019). Daarnaast was een knelpunt dat in de vorige richtlijn een indeling in drie leeftijdscategorieën is gemaakt met verschillende risicofactoren per leeftijdscategorie. De vraag is of deze indeling nog moet worden aangehouden. Voor kinderen is de leeftijd tot 16 jaar aangehouden. Vanaf deze leeftijd geldt de module CT-scan hersenen volwassenen.
Conclusies / Summary of Findings
Neurosurgery
1. University of California – Davis (UCD) rule; 2. The National Emergency X-Radiography Utilisation Study II (NEXUS II); 3. Children's Head injury Algorithm for the prediction of Important Clinical Events (CHALICE) rule; 4. Pediatric Emergency Care Applied Research Network (PECARN) rule
|
Low GRADE |
The diagnostic accuracy of the UCD, NEXUS II, CHALICE and the PECARN may be accurate for predicting neurosurgery.
Sources: Klemetti, 2009; Oman, 2006. |
5. Canadian Assessment of Tomography for Childhood Head injury (CATCH) rule
|
Moderate GRADE |
The diagnostic accuracy of the CATCH is likely accurate for predicting neurosurgery (sensitivity range 0.75 – 1.00; specificity range 0.54 – 0.85).
Sources: Babl, 2017; Easter, 2014; Osmond, 2006; Osmond, 2018. |
Intracranial injury
1. University of California – Davis (UCD) rule
|
Moderate GRADE |
The diagnostic accuracy of the UCD is likely accurate for predicting intracranial injury (sensitivity range 0.91 – 1.00; specificity range 0.09 – 0.45).
Sources: Klemetti, 2009; Palchak, 2003; Sun, 2007. |
2. The National Emergency X-Radiography Utilisation Study II (NEXUS II)
|
Low GRADE |
The diagnostic accuracy of the UCD may be accurate for predicting intracranial injury.
Sources: Klemetti, 2009; Oman, 2006. |
3. Children's Head injury Algorithm for the prediction of Important Clinical Events (CHALICE) rule
|
Moderate GRADE |
The diagnostic accuracy of the CHALICE is likely accurate for predicting intracranial injury (sensitivity range 0.64 – 0.98; specificity range 0.05 – 0.87).
Sources: Babl, 2017; Dunning, 2006; Easter, 2014; Klemetti, 2009; Thiam, 2016. |
4. Pediatric Emergency Care Applied Research Network (PECARN) rule
|
Moderate GRADE |
The diagnostic accuracy of the PECARN is likely accurate for predicting intracranial injury in children < 2 yrs (sensitivity range 0.97 – 1.00; specificity range 0.54 – 0.71). and in children 2-18 yrs (sensitivity range 0.95 – 1.00; specificity range 0.46 – 0.72).
Sources: Babl, 2017; Bozan, 2019; Easter, 2014; Ide, 2020; Kuppermann, 2009; Kuppermann, 2009 (2); Lorton, 2016; Schonfeld, 2014; Thiam, 2015. |
5. Canadian Assessment of Tomography for Childhood Head injury (CATCH) rule
|
Moderate GRADE |
The diagnostic accuracy of the CATCH is likely accurate for predicting intracranial injury (sensitivity range 0.47 – 1.00; specificity range 0.45 – 0.84).
Sources: Babl, 2017; Bozan, 2019; Easter, 2014; Osmond, 2006; Osmond, 2018; Thiam, 2015. |
Diagnostic impact studies
|
Very low GRADE |
The evidence is very uncertain about the impact of the PECARN on clinically important brain injury, traumatic brain injury on CT and skull fracture in patients with mTBI within 48h after the accident.
Source: Abid, 2021 |
|
No GRADE |
No evidence was found about the impact of the CHALICE, CATCH, UCD and NEXUS-II on patient important outcomes after mTBI within 48h after the accident.
Source: - |
Samenvatting literatuur
Description of studies
a. Diagnostic performance studies
Pandor (2011) described a systematic review about the diagnostic accuracy of clinical decision rules and individual characteristics for predicting intracranial injury, including need for neurosurgery in adults and children with mTBI. Also, a cross-sectional survey was performed to compare current practice in the NHS and an economic model was developed to estimate cost-effectiveness. A systematic literature search was performed in several electronic databases from inception to April 2009 and was updated in March 2010. Studies were included if 1) cohort studies included mTBI patients from which clinical decision rules were compared to a reference standard test; 2) controlled trials compared alternative strategies for mTBI. Methodological quality was assessed by the Quality Assessment of Diagnostic Accuracy Studies tool or criteria recommended by the Effective Practice and Organization of Care Review Group. In total, 93 papers were included in the systematic review. In the analyses, the diagnostic accuracy of individual clinical characteristics, biomarkers and clinical decision rules were assessed. In order to answer the question of this module, only the published clinical decision rules for identifying intracranial injury or the need for neurosurgery in children were extracted (n=14).
Babl (2017) performed a prospective cohort study on the diagnostic performance of the PECARN, CATCH and CHALICE head injury decision rules in children with head injury of any severity (n=20137).
Shavit (2019) performed a multicenter cohort study on the diagnostic performance of the PECARN rule and the Isreali Decision Algorithm for Identifying traumatic brain injury in children (IDITBIC) in children with a Glasgow coma score of <15 (n=18913).
Bozan (2019) performed a prospective cohort study on the diagnostic performance of the PECARN and CATCH clinical decision rules for identifying intracranial injury (defined as scalp fracture and/or intracranial bleeding) in children <18 years with an isolated blunt head trauma (GCS >13; n=256)
Easter (2014) performed a prospective cohort study on the diagnostic performance of the PECARN, CHALICE and CATCH decision rules for identifying intracranial injury (any injury on CT) and the need for neurosurgical intervention in children with a minor head injury (n=1062).
Ide (2020) performed a prospective cohort study on the diagnostic performance of the PECARN decision rule for identifying intracranial injury (clinically important traumatic brain injury) in children <16 with minor head trauma (n=6585).
Lorton (2016) performed a multicenter prospective study on the diagnostic performance of the PECARN decision rule for identifying intracranial injury (clinically important brain injury) in children <16 years who presented at the emergency department within 24h after a blunt head trauma (n=1499).
Osmond (2018) performed a multicenter cohort study on the diagnostic performance of the CATCH decision rule for identifying intracranial injury (brain injury on CT) and need for neurosurgical intervention in children with blunt head trauma and GCS 13-15 (n=4060).
Schonfeld (2014) performed a cross-sectional study on the diagnostic performance of the PECARN decision rule for identifying intracranial injury (clinically important traumatic brain injury) in children with minor blunt head trauma (n=2428)
Thiam (2015) performed a prospective observational cohort study on the diagnostic performance of the CATCH, CHALICE and PECARN decision rules for identifying intracranial injury (positive head CT finding) in children <16 years presenting complaints of head injury in the emergency department within 72 hours after injury (n=1179).
b. Diagnostic impact studies
Abid (2021) performed a secondary analysis of a prospective observational study about the impact of the PECARN decision rule by comparing patients who met the PECARN low-risk criteria for CT to patients who did not meet the PECARN low-risk criteria for CT (n=1081). The effects were evaluated on clinically important brain injury, traumatic brain injury on CT and skull fracture on CT.
c. Association studies
In total, three observational studies assessed the association between individual clinical (baseline) variables and presence of intracranial injury or the need for neurosurgical intervention in order to determine whether CT scanning is needed.
Di (2017) performed a retrospective study to identify the independent predictors of intracranial injuries in infants younger than 2 years old with mTBI (n=214). The results showed that characteristics of scalp hematomas and mechanism of injury were associated with intracranial injuries.
Obuchi (2017) performed a retrospective study to identify clinical predictors of intracranial injuries in infants <11 months with minor head trauma (n=549). Results showed that fall height, size and location of scalp hematoma were associated with intracranial injuries.
Bozan (2019) performed a prospective cohort study to determine computerized brain tomography indications for children <18 years that were referred to. The emergency department with minor blunt head trauma (n=256). The results showed that the indications from the PECARN decision rule and the CATCH decision rule were effective for determining the necessity of a computerized brain tomography in children with minor blunt head trauma.
Results
The inclusion and exclusion criteria for the selected clinical decision rules were shown in table 1.
Table 1. Inclusion- and exclusion criteria per clinical decision rule
|
Clinical decision rule |
Inclusion criteria |
Exclusion criteria |
|
Children's Head injury Algorithm for the prediction of Important Clinical Event |
Patients aged <16y with any history or signs of injury to the head. |
Refusal to consent. |
|
Canadian Assessment of Tomography for Childhood Head injury |
Patients aged <17y with all the following: initial GCS at least 13, injury within 24 hrs, blunt trauma with witnessed LOC, amnesia, witnessed disorientation, vomiting 2+ times at least 15 mins apart, persistent irritability if under 2 years old |
Penetrating skull injury, depressed skull fracture, focal neuro deficit, developmental delay, child abuse, re-eval after prior head injury, pregnant patient. |
|
Pediatric Emergency Care Applied Research Network |
Patients aged <18y present with 24h of head injury. |
Trivial mechanism defined by ground-level fall or walking or running into stationary objects and no signs or symptoms of head trauma other than scalp abrasions and lacerations; Penetrating trauma; Known brain tumors; Pre-existing neurological disorder complicating assessment; Neuroimaging at an outside hospital before transfer; Patient with ventricular shunt; Patient with bleeding disorder; GCS <14. |
|
University of California–Davis rule |
Patients aged <18y presenting to the pediatric ED after a history of nontrivial blunt head trauma with historical or physical examination findings consistent with head trauma. |
Not applicable. |
|
National Emergency X-Radiography Utilization Study II |
All blunt trauma patients undergoing cranial CT. |
Patients with penetrating trauma, those with delayed presentations (greater than 24 hours after injury), patients undergoing imaging for reasons unrelated to trauma.
|
a. Diagnostic performance studies
An overview of the clinical factors included in the selected clinical decision rules is presented in Table 2. Figure 1-11 show the diagnostic accuracy for each clinical decision rule.
Table 2. Overview of clinical factors included in clinical decision rules for requirement of head CT
|
|
CHALICE |
CATCH (high risk) |
CATCH (medium risk) |
UCD |
NEXUS-II |
PECARN < 2 yrs |
PECARN ≥ 2 yrs |
|
GCS score |
<14 or <15 when aged <1 |
<15 at 2 hrs after injury |
|
|
|
<15 |
<15 |
|
Vomiting |
>2 |
|
|
X |
X |
|
X |
|
Age |
|
|
|
|
|
|
|
|
Dangerous mechanism of injury |
X |
|
X |
|
|
X |
X |
|
Headache |
|
X |
|
X |
|
|
X |
|
Injury above clavicles |
|
|
|
|
|
|
|
|
Posttraumatic seizure |
X |
|
|
|
|
|
|
|
Coagulopathy |
|
|
|
|
X |
|
|
|
Focal neurological deficit |
X |
|
|
|
X |
|
|
|
Loss of consciousness |
>5 min |
|
|
|
|
≥5 min. |
any/suspected |
|
Scalp hematoma |
|
|
X |
in children ≤2 years |
X |
X |
|
|
Altered level of alertness |
|
|
|
|
X |
|
|
|
Abnormal behaviour/ mental status |
|
|
|
X |
X |
|
|
|
Any sign of basal skull fracture |
X |
|
X |
xX |
X |
|
X |
|
Suspected open or depressed skull fracture |
X |
X |
|
|
|
X |
|
|
Persistent anterograde amnesia |
>5 min |
|
|
|
|
|
|
|
Drowsiness |
X |
|
|
|
|
|
|
|
Non-accidental injury suspicion |
X |
|
|
|
|
|
|
|
Facial crepitus/serious facial injury |
X |
|
|
|
|
|
|
|
Bruise, swelling or laceration |
>5 cm if <1y |
|
|
|
|
|
|
|
Irritability on examination |
|
X |
|
|
|
|
|
|
Not acting normally |
|
|
|
|
|
X |
|
|
Other signs of altered mental status |
|
|
|
|
|
X |
X |
|
Palpable or unclear skull fracture |
|
|
|
|
|
X |
|
1. University of California – Davis (UCD) rule
Neurosurgery
For neurosurgery, sensitivity of the UCD rule was 1.00 (95% CI 0.88 – 1.00). Specificity was 0.64 (95% CI 0.62 – 0.66). Results are shown in Figure 1.

Figure 1. Sensitivity and specificity of the UCD rule for neurosurgery.
Intracranial injury
For intracranial injury, sensitivity of the UCD rule ranged between 0.91 and 1.00 (95% range was 0.84 - 1.00). Specificity ranged between 0.12 and 0.43 (95% CI range was 0.09 – 0.45). Results are shown in Figure 2.

Figure 2. Sensitivity and specificity of the UCD rule for intracranial injury.
2. The National Emergency X-Radiography Utilisation Study II (NEXUS II)
Neurosurgery
For neurosurgery, sensitivity nor specificity of the NEXUS-II was assessed.
Intracranial injury
For intracranial injury, sensitivity of the NEXUS II ranged between 0.96 and 0.99 (95% CI range 0.90 – 1.00). Specificity ranged between 0.15 and 0.21 (95% CI range 0.13 – 0.25). Results are shown in Figure 3.
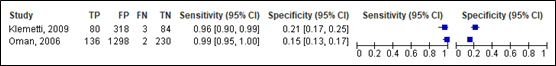
Figure 3. Sensitivity and specificity of the NEXUS II for intracranial injury
3. Children's Head injury Algorithm for the prediction of Important Clinical Events (CHALICE) rule
Neurosurgery
For neurosurgery, sensitivity of the CHALICE ranged between 0.60 and 0.98 (95% CI range was 0.15 and 1.00). Specificity ranged between 0.83 and 0.86 (95% CI range was 0.81 and 0.87). Results are shown in Figure 4.
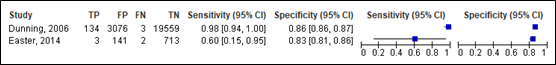
Figure 4. Sensitivity and specificity of the CHALICE rule for neurosurgery
Intracranial injury
For intracranial injury, sensitivity of the CHALICE ranged between 0.64 and 0.98 (95% CI range was 0.36 – 1.00). Specificity ranged between 0.05 and 0.87 (95% CI range was 0.03 – 0.88). Results are shown in Figure 5.
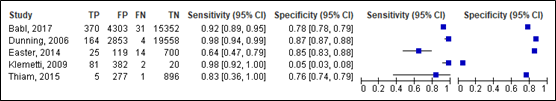
Figure 5. Sensitivity and specificity of the CHALICE rule for intracranial injury
4. Paediatric Emergency Care Applied Research Network (PECARN) rule
Neurosurgery (≥ 2 years, < 18 years)
For neurosurgery, sensitivity of the PECARN in children aged between 2 and 18 years was 1.00 (95% CI of 0.40 – 1.00). Specificity was 0.61 (95% CI of 0.58 – 0.64). Results are shown in Figure 6.

Figure 6. Sensitivity and specificity of the PECARN rule for neurosurgery
Neurosurgery (> 2 years)
For neurosurgery, sensitivity of the PECARN in children aged < 2 was 1.00 (95% CI 0.71 – 1.00). Specificity was 0.59 (95% CI 0.58 – 0.61). Results are shown in Figure 7.

Figure 7. Sensitivity and specificity of the PECARN rule for neurosurgery
Intracranial injury (≥ 2 years, < 18 years)
For intracranial injury, sensitivity of the PECARN rule in children aged between 2 and 18 years ranged between 0.95 and 1.00 (95% CI range was 0.54 – 1.00). Specificity ranged between 0.46 and 0.80 (95% CI range was 0.45 – 0.81). Results are shown in Figure 8.
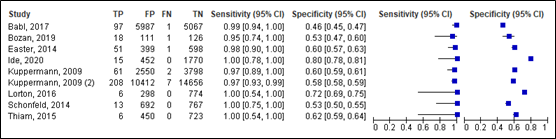
Figure 8. Sensitivity and specificity of the PECARN rule for intracranial injury
Intracranial injury (< 2 years)
For intracranial injury, sensitivity of the PECARN rule in children aged < 2 years ranged between 0.87 and 1.00 (95% CI range was 0.20 – 1.00). Specificity ranged between 0.54 (95% CI range was 0.52 – 0.73). Results are shown in Figure 9.
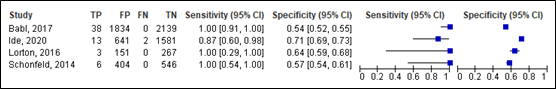
Figure 9. Sensitivity and specificity of the PECARN rule for intracranial injury
5. Canadian Assessment of Tomography for Childhood Head injury (CATCH) rule
Neurosurgery
For neurosurgery, sensitivity of the CATCH ranged between 0.75 and 1.00 (95% CI range was 0.19 – 1.00). Specificity ranged between 0.43 and 0.84 (95% range was 0.40 – 0.85). Results are shown in Figure 10.
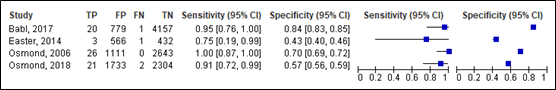
Figure 10. Sensitivity and specificity of the CATCH rule for neurosurgery.
Intracranial injury
For intracranial injury, sensitivity of the CATCH rule ranged between 0.47 and 1.00 (95% CI range was 0.24 – 0.95). Specificity ranged between 0.43 and 0.84 (95% CI range was 0.42 and 0.88). Results are shown in Figure 11.
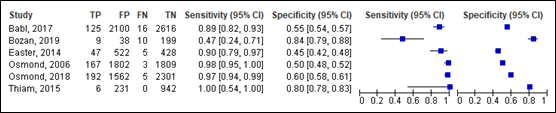
Figure 11. Sensitivity and specificity of the CATCH rule for intracranial injury
Level of evidence in the literature
Neurosurgery
The level of evidence in the literature started at high because it was based on diagnostic test accuracy studies. For the CATHCH, the level of evidence was downgraded due to methodological shortcomings only (-1, risk of bias). The final level is moderate. For the UCD, CHALICE, PECARN and the NEXUS-II, the level of evidence was downgraded by two levels due to methodological shortcomings (-1, risk of bias) and low number of included studies (-1, imprecision). The final level is low.
Intracranial injury
The level of evidence in the literature started at high because it was based on diagnostic test accuracy studies. For the UCD, CHALICE, PECARN and te CATHCH the level of evidence was downgraded due to methodological shortcomings only (-1, risk of bias). The final level is moderate. For the NEXUS-II, the level of evidence was downgraded by two levels due to methodological shortcomings (-1, risk of bias) and low number of included studies (-1, imprecision). The final level is low.
Conclusions
Neurosurgery
1. University of California – Davis (UCD) rule; 2. The National Emergency X-Radiography Utilisation Study II (NEXUS II); 3. Children's Head injury Algorithm for the prediction of Important Clinical Events (CHALICE) rule; 4. Pediatric Emergency Care Applied Research Network (PECARN) rule
|
Low GRADE |
The diagnostic accuracy of the UCD, NEXUS II, CHALICE and the PECARN may be accurate for predicting neurosurgery.
Sources: Klemetti, 2009; Oman, 2006. |
5. Canadian Assessment of Tomography for Childhood Head injury (CATCH) rule
|
Moderate GRADE |
The diagnostic accuracy of the CATCH is likely accurate for predicting neurosurgery (sensitivity range 0.75 – 1.00; specificity range 0.54 – 0.85).
Sources: Babl, 2017; Easter, 2014; Osmond, 2006; Osmond, 2018. |
Intracranial injury
- University of California – Davis (UCD) rule
|
Moderate GRADE |
The diagnostic accuracy of the UCD is likely accurate for predicting intracranial injury (sensitivity range 0.91 – 1.00; specificity range 0.09 – 0.45).
Sources: Klemetti, 2009; Palchak, 2003; Sun, 2007. |
- The National Emergency X-Radiography Utilisation Study II (NEXUS II)
|
Low GRADE |
The diagnostic accuracy of the UCD may be accurate for predicting intracranial injury.
Sources: Klemetti, 2009; Oman, 2006. |
- Children's Head injury Algorithm for the prediction of Important Clinical Events (CHALICE) rule
|
Moderate GRADE |
The diagnostic accuracy of the CHALICE is likely accurate for predicting intracranial injury (sensitivity range 0.64 – 0.98; specificity range 0.05 – 0.87).
Sources: Babl, 2017; Dunning, 2006; Easter, 2014; Klemetti, 2009; Thiam, 2016. |
- Pediatric Emergency Care Applied Research Network (PECARN) rule
|
Moderate GRADE |
The diagnostic accuracy of the PECARN is likely accurate for predicting intracranial injury in children < 2 yrs (sensitivity range 0.97 – 1.00; specificity range 0.54 – 0.71). and in children 2-18 yrs (sensitivity range 0.95 – 1.00; specificity range 0.46 – 0.72).
Sources: Babl, 2017; Bozan, 2019; Easter, 2014; Ide, 2020; Kuppermann, 2009; Kuppermann, 2009 (2); Lorton, 2016; Schonfeld, 2014; Thiam, 2015. |
- Canadian Assessment of Tomography for Childhood Head injury (CATCH) rule
|
Moderate GRADE |
The diagnostic accuracy of the CATCH is likely accurate for predicting intracranial injury (sensitivity range 0.47 – 1.00; specificity range 0.45 – 0.84).
Sources: Babl, 2017; Bozan, 2019; Easter, 2014; Osmond, 2006; Osmond, 2018; Thiam, 2015. |
- Diagnostic impact studies
Abid (2021) showed the impact of the PECARN by comparing patients who did not meet the PECARN low-risk criteria to patients who met the PECARN low-risk criteria on the following clinical outcome measures: clinically important brain injury, traumatic brain injury on CT and skull fracture on CT (n=1081). The differences in incidence were considered clinically relevant in favour of applying the PECARN. Results are shown in Table 3.
Table 3. Impact of the PECARN low risk criteria on patients’ outcomes (extracted from Abid, 2021)
|
|
Did not meet PECARN Low-Risk Criteria* |
Met PECARN Low-Risk Criteria* |
|
Clinically important brain injury |
24/567 (4.2%) |
1/514 (0.19%) |
|
Traumatic brain injury on CT |
93/436 (21.3%) |
10/197 (5.1%) |
|
Skull fracture on CT |
122/436 (28%) |
9/197 (4.6%) |
* Low-risk criteria include nonsevere mechanism of injury, Glasgow Coma Scale score of 15, absence of the following: other signs of altered mental status, palpable skull fracture, loss of consciousness ≤5 seconds, parental report of acting abnormally, and nonfrontal scalp hematoma.
The diagnostic impact of the CHALICE, CATCH, UCD and NEXUS-II was not assessed.
The level of evidence in the literature
The level of evidence regarding all outcome measures started at low because they were based on observational studies. The level of evidence was downgraded by two levels due to methodological shortcomings (-2, risk of bias). The final level is very low.
Conclusions
|
Very low GRADE |
The evidence is very uncertain about the impact of the PECARN on clinically important brain injury, traumatic brain injury on CT and skull fracture in patients with mTBI within 48h after the accident.
Source: Abid, 2021 |
|
No GRADE |
No evidence was found about the impact of the CHALICE, CATCH, UCD and NEXUS-II on patient important outcomes after mTBI within 48h after the accident.
Source: - |
- Association studies
From the three observational studies, the one variable (non-frontal hematoma) was found to be significantly associated with intracranial injury in addition to the criteria that were included in the clinical decision rules. Table 4.4 shows an overview of the included studies assessing clinical variables that are significantly associated with intracranial injury.
There were no clinical variables that were significantly associated with need for neurosurgical intervention.
Table 4. Additional criteria to clinical decision rules for CT scanning
|
Study |
Population |
Analysis |
All criteria significantly associated with outcome |
Criteria significantly associated with outcome, not included in clinical decision rules |
|
Intracranial injury |
||||
|
Di, 2017 |
Infants younger than 2 years old with mild TBI (n=214) |
Multivariate logistic regression analysis |
Mechanism of injury, scalp hematoma. |
- |
|
Obuchi, 2017 |
Infants with minor head trauma (0-11 months old) (n=549) |
Multivariable logistic regression analysis |
Scalp hematoma |
- |
|
Bozan, 2019 |
Children <18 yrs old with isolated blunt head trauma (GCS > 13) (n=256) |
Multivariate regression analyses |
Age, GCS, Non-frontal hematoma |
Non-frontal hematoma |
Abbreviations: TBI: traumatic brain injury; GCS: Glasgow Coma Scale.
Level of evidence of the literature
The level of evidence was not assessed because it is a descriptive overview of the literature. No GRADE assessment could be performed since no studies were included with at least internal validation of the prediction models.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the diagnostic accuracy of clinical decision rules for determining whether a CT scan is needed in pediatric patients with mTBI within 48h after the accident for identifying intracranial injury and/or need for neurosurgery?
| P: | Children (< 16 yrs) with mTBI within 48 hours after accident; |
| I: | Clinical decision rules: Children's Head injury Algorithm for the prediction of Important Clinical Events (CHALICE); Canadian Assessment of Tomography for Childhood Head injury (CATCH); Paediatric Emergency Care Applied Research Network (PECARN); University of California–Davis rule (UCD); National Emergency X-Radiography Utilization Study II (NEXUS II); |
| C: | CT scanning based on coincidence/decision by the doctor; |
| R: | CT scanning applied by all patients; |
| O: | Diagnostic accuracy (sensitivity, specificity, true positives, false negatives, false positives and true negative) for need for neurosurgery or intracranial injury. |
Timing and setting: emergency physician, radiologist, neurologist within 24 hours after mTBI.
Relevant outcome measures
The guideline development group considered sensitivity as a critical outcome measure for decision making and specificity as an important outcome measure for decision making. Sensitivity was considered clinically accurate when being as close to 100% as possible. No minimally clinical accuracy of specificity was determined.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched for systematic reviews with relevant search terms from 2000 until August 9th, 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 95 hits.
After selection of the systematic reviews, the observational studies published from 2010 until August 9th, 2022, were added to the results of the search. The detailed search strategy is depicted under the tab Methods. This resulted in an addition of 635 hits.
A total of 47 studies were initially selected based on title and abstract screening. After reading the full text, 33 studies were excluded (see the table with reasons for exclusion under the tab Methods), and fourteen studies were included.
Studies were divided into the following categories:
- Diagnostic performance studies about the performance of validated clinical decision rules to identify intracranial injury or neurosurgical intervention.
- Diagnostic impact studies about the impact of applying validated clinical decision rules on patient relevant outcome measures.
- Association studies about the relationship between clinical criteria and intracranial injury or neurosurgical intervention. The level of evidence was not assessed because it is a descriptive overview of the literature. No GRADE assessment could be performed since no studies were included with at least internal validation of the prediction models. Thus, no risk of bias nor evidence tables were included for this part of the literature overview.
Results
Clinical decision rules and additional criteria for CT scanning: Seven studies were included in the analysis of the literature:
- Diagnostic performance studies: One systematic review and nine observational cohort studies.
- Diagnostic impact studies: One observational study.
- Association studies: Three observational studies.
Referenties
- Bozan, Ö., Aksel, G., Kahraman, H. A., Giritli, Ö., & Eroğlu, S. E. (2019). Comparison of PECARN and CATCH clinical decision rules in children with minor blunt head trauma. European journal of trauma and emergency surgery: official publication of the European Trauma Society, 45(5), 849–855. https://doi.org/10.1007/s00068-017-0865-8
- Easter, J. S., Bakes, K., Dhaliwal, J., Miller, M., Caruso, E., & Haukoos, J. S. (2014). Comparison of PECARN, CATCH, and CHALICE rules for children with minor head injury: a prospective cohort study. Annals of emergency medicine, 64(2), 145–152.e1525. https://doi.org/10.1016/j.annemergmed.2014.01.030
- Gardner JE, Teramoto M, Hansen C. Factors Associated With Degree and Length of Recovery in Children With Mild and Complicated Mild Traumatic Brain Injury. Neurosurgery. 2019 Nov 1;85(5):E842-E850. doi: 10.1093/neuros/nyz140. PMID: 31058994.
- Ide, K., Uematsu, S., Hayano, S., Hagiwara, Y., Tetsuhara, K., Ito, T., Nakazawa, T., Sekine, I., Mikami, M., & Kobayashi, T. (2020). Validation of the PECARN head trauma prediction rules in Japan: A multicenter prospective study. The American journal of emergency medicine, 38(8), 1599–1603. https://doi.org/10.1016/j.ajem.2019.158439
- Königs M, Pouwels PJ, Ernest van Heurn LW, Bakx R, Jeroen Vermeulen R, Goslings JC, Carel Goslings J, Poll-The BT, van der Wees M, Catsman-Berrevoets CE, Oosterlaan J. Relevance of neuroimaging for neurocognitive and behavioral outcome after pediatric traumatic brain injury. Brain Imaging Behav. 2018 Feb;12(1):29-43. doi: 10.1007/s11682-017-9673-3. Erratum in: Brain Imaging Behav. 2019 Aug;13(4):1183. Carel Goslings J [corrected to Goslings JC]. PMID: 28092022; PMCID: PMC5814510.
- Lenstra JJ, Pikstra ARA, Fock JM, Metting Z, van der Naalt J. Influence of guidelines on management of paediatric mild traumatic brain injury: CT-assessment and admission policy. Eur J Paediatr Neurol. 2017 Nov;21(6):816-822. doi: 10.1016/j.ejpn.2017.07.019. Epub 2017 Aug 3. PMID: 28811137.
- Lorton, F., Poullaouec, C., Legallais, E., Simon-Pimmel, J., Chêne, M. A., Leroy, H., Roy, M., Launay, E., & Gras-Le Guen, C. (2016). Validation of the PECARN clinical decision rule for children with minor head trauma: a French multicenter prospective study. Scandinavian journal of trauma, resuscitation and emergency medicine, 24, 98. https://doi.org/10.1186/s13049-016-0287-3
- <p align="left">Niele N, van Houten MA, Boersma B, Biezeveld MH, Douma M, Heitink K, Ten Tusscher GW, Tromp E, van Goudoever JB, Plötz FB. Multi-centre study found that strict adherence to guidelines led to computed tomography scans being overused in children with minor head injuries. Acta Paediatr. 2019 Sep;108(9):1695-1703. doi: 10.1111/apa.14742. Epub 2019 Mar 4. PMID: 30721540.
- <p align="left">Niele, N., van Houten, M., Tromp, E., van Goudoever, J. B., & Plötz, F. B. (2020). Application of PECARN rules would significantly decrease CT rates in a Dutch cohort of children with minor traumatic head injuries. European journal of pediatrics, 179(10), 1597–1602. https://doi.org/10.1007/s00431-020-03649-w
- Niele N, Plötz FB, Tromp E, Boersma B, Biezeveld M, Douma M, Heitink K, Tusscher GT, van Goudoever HB, van Houten MA. Young children with a minor traumatic head injury: clinical observation or CT scan? Eur J Pediatr. 2022 Sep;181(9):3291-3297. doi: 10.1007/s00431-022-04514-8. Epub 2022 Jun 24. PMID: 35748958; PMCID: PMC9395303.
- Osmond, M. H., Klassen, T. P., Wells, G. A., Davidson, J., Correll, R., Boutis, K., Joubert, G., Gouin, S., Khangura, S., Turner, T., Belanger, F., Silver, N., Taylor, B., Curran, J., Stiell, I. G., & Pediatric Emergency Research Canada (PERC) Head Injury Study Group (2018). Validation and refinement of a clinical decision rule for the use of computed tomography in children with minor head injury in the emergency department. CMAJ: Canadian Medical Association journal = journal de l'Association medicale canadienne, 190(27), E816–E822. https://doi.org/10.1503/cmaj.170406
- Pandor, A., Goodacre, S., Harnan, S., Holmes, M., Pickering, A., Fitzgerald, P., Rees, A., & Stevenson, M. (2011). Diagnostic management strategies for adults and children with minor head injury: a systematic review and an economic evaluation. Health technology assessment (Winchester, England), 15(27), 1–202. https://doi.org/10.3310/hta15270
- Schonfeld, D., Bressan, S., Da Dalt, L., Henien, M. N., Winnett, J. A., & Nigrovic, L. E. (2014). Pediatric Emergency Care Applied Research Network head injury clinical prediction rules are reliable in practice. Archives of disease in childhood, 99(5), 427–431. https://doi.org/10.1136/archdischild-2013-305004
- Shavit, I., Rimon, A., Waisman, Y., Borland, M. L., Phillips, N., Kochar, A., Cheek, J. A., Gilhotra, Y., Furyk, J., Neutze, J., Dalziel, S. R., Lyttle, M. D., Bressan, S., Donath, S., Hearps, S., Oakley, E., Crowe, L., Babl, F. E., & Paediatric Research in Emergency Departments International Collaborative (PREDICT) (2020). Performance of Two Head Injury Decision Rules Evaluated on an External Cohort of 18,913 Children. The Journal of surgical research, 245, 426–433. https://doi.org/10.1016/j.jss.2019.07.090
- Thiam, D. W., Yap, S. H., & Chong, S. L. (2015). Clinical Decision Rules for Paediatric Minor Head Injury: Are CT scans a Necessary Evil? Annals of the Academy of Medicine, Singapore, 44(9), 335–341.
Evidence tabellen
a. Diagnostic performance studies
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Pandor, 2011 |
SR and meta-analysis of cohort studies.
Literature search up to March, 2010
A: Dunning, 2006 B: Klemetti, 2009 C: Kupperman, 2009 D: Kupperman, 2009 (2) E: Oman, 2006 F: Osmond, 2006 G: Palchak, 2003 H: Sun, 2007
Study design: cohort studies
Setting and Country: UK
Source of funding and conflicts of interest: Authors declared no competing interests; Funded by The National Institute for Health Research Health Technology Assessment programme.
|
Inclusion criteria SR:
Exclusion criteria SR: n.r.
8 studies included.
Important patient characteristics at baseline:
Patients with CT (n) A: 772 B: 485 C: 283 D: 8502 E: 1666 F: n.r. G: 2043 H: 283 |
Clinical decision rule
A: CHALICE B: CHALICE, NEXUS-II, UCD C: PECARN, NEXUS-II D: PECARN, NEXUS-II E: NEXUS-II, UCD F: CATCH G: UCD H: UCD
|
Reference standard used for intracranial injury.
A: All patients treated according to RCS guidelines. This recommends admission. for those at high risk and CT scan for those at highest risk B: Hospital records C: CT scans, medical records, and telephone follow-up. D: CT scans, medical records, and telephone follow-up. E: CT scan F: CT scan G: CT or performance of intervention H: CT scan
Reference standard used for neurosurgery: A: n.r. |
Endpoint of follow-up: n.r.
|
Intracranial injury Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: UCD B: 0.99 [0.93 – 1.00] / 0.12 [0.09 – 0.16]
Clinical decision rule: NEXUS II B: 0.96 [0.90 – 0.99] / 0.21 [0.17 – 0.25] E: 0.99 [0.95 – 1.00] / 0.15 [0.13 – 0.17]
Clinical decision rule: CHALICE A: 0.98 [0.94 – 0.99] / 0.87 [0.87 -0.88] B: 0.98 [0.92 – 1.00] / 0.05 [0.03 – 0.08]
Clinical decision rule: PECARN 2-18 years C: 0.97 [0.89 – 1.00] / 60 [0.59 – 0.61]
Clinical decision rule: CATCH F: 0.98 [0.95 – 1.00] / 0.50 [0.48 – 0.52]
Neurosurgery Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: CATCH F: 1.00 [0.87 – 1.00] / 0.70 [0.69 – 0.72]
Clinical decision rule: CHALICE A: 0.98 [0.94 – 1.00] / 0.86 [0.86 – 0.87]
Clinical decision rule: UCD G: 1.00 [0.88 – 1.00] / 0.64 [0.62 – 0.66]
|
Risk of bias A: verification bias and test review bias. |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention/Control
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Babl, 2017 |
Type of study: Prospective cohort study.
Setting and country: Multicentre, Australia/New Zealand.
Funding and conflicts of interest: The funders of this study had no role in study design; in the collection, analysis, and interpretation of data; in the writing of the report; or in the decision to submit the paper for publication. FEB, CM, KJ, and SDo had access. to the raw data. The corresponding author had full access to all the data in the study and had final responsibility for the decision to submit for publication; We declare no competing interests. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: PECARN <2 yrs: 4011 PECARN ≥ 3 yrs: 11152 CATCH: 4957 CHALICE: 20029
|
|
Length of follow-up: n.r.
Loss-to-follow-up: 10%
Reason: lost to telephone follow-up.
Incomplete outcome data: n.r.
|
Intracranial injury Defined as clinically important traumatic brain injury.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN <2 years 1.00 [0.92 – 1.00] / 0.59 [0.58 – 0.61]
Clinical decision rule PECARN 2-18 years 0.99 [0.95 – 1.00] / 0.52 [0.51 – 0.53]
Clinical decision rule: CATCH 0.92 [0.87 – 0.96] / 0.70 [0.70 – 0.71]
Clinical decision rule: CHALICE 0.93 [0.87 - 0.96] / 0.79 [0.78 – 0.79]
Neurosurgery Defined as
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN <2 years 1.00 [0.54 – 1.00] / 0.59 [0.57 – 0.60]
Clinical decision rule PECARN 2-18 years 1.00 [0.82 – 1.00] / 0.52 [0.51 – 0.52]
Clinical decision rule: CATCH 0.96 [0.79 – 1.00] / 0.70 [0.69 – 0.71]
Clinical decision rule: CHALICE 0.92 [0.73 – 1.00] / 0.78 [0.78 – 0.79]
|
Author’s conclusion The sensitivities of three clinical decision rules for head injuries in children were high when used as designed. The findings are an important starting point for clinicians considering the introduction of one of the rules. |
|
Bozan, 2019 |
Type of study: Prospective cohort study.
Setting and country: Single-centre, Turkey.
Funding and conflicts of interest: No competing interests. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 278
Important prognostic factors2: age (IQR): 3 (1 – 7.75) Sex: 59.8% M
Groups comparable at baseline? N.a. |
|
Length of follow-up: n.r.
Loss-to-follow-up: 22 (7.9%)
Incomplete outcome data: n.r.
|
Intracranial injury Defined by scalp fracture and/or intracranial bleeding in CBT.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN 0.95 [0.72 – 1.00] / 0.53 [0.47 – 0.60]
Clinical decision rule: CATCH 0.48 [0.25 – 0.71] / 0.83 [0.79 – 0.88]
|
Author’s conclusion The results of this study show that the implementation of clinical decision rules reduce the number of unnecessary CBT scans. While both PECARN and CATCH were found to be effective in determining the necessity of CBT for children with minor blunt head trauma, PECARN proved to be more useful for emergency services because of its higher sensitivity. The authors suggest that conducting a CBT scan based on clinical decision rules may be a suitable approach for early detection of the presence of intracranial acute pathologies in young children with minor blunt head trauma, GCS score is < 15 and non-frontal hematomas are present. |
|
Easter, 2014 |
Type of study: Prospective cohort study.
Setting and country: Single-centre, Colorado.
Funding and conflicts of interest: Contents are the authors’ sole responsibility and do not necessarily represent official NIH views. No authors had financial relationships with any organizations that might have an interest in the submitted work in the previous three years; Funding by JSE (K12HS019464) and JSH (K02HS017526) had financial support from the Agency for Healthcare Research and Quality (AHRQ) for the submitted work. JSE was also supported by NIH/NCATS Colorado CTSI Grant Number UL1 TR001082. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 1526
|
|
Length of follow-up: n.r.
Loss-to-follow-up: n.r.
Incomplete outcome data: n.r.
|
Intracranial injury Defined by any injury on CT.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN 0.98 [0.89 – 1.00] / 0.64 [0.61 – 0.67]
Clinical decision rule: CATCH 0.90 [0.79 – 0.97] / 0.45 [0.42 – 0.48]
Clinical decision rule: CHALICE 0.64 [0.47 – 0.79] / 0.86 [0.83 – 0.88]
Neurosurgery Defined by any injury requiring neurosurgical intervention.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN 1.00 [0.40 – 1.00] / 0.61 [0.58 – 0.64]
Clinical decision rule: CATCH 0.75 [0.19 – 0.99] / 0.43 [0.40 – 0.46]
Clinical decision rule: CHALICE 0.75 [0.19 – 0.99] / 0.84 [ 0.81 – 0.86]
|
Author’s conclusion In summary, for identifying clinically significant TBI in children presenting to an urban paediatric ED for minor closed head injury, PECARN and physician practice were the only approaches to identify all clinically important TBIs, with PECARN being slightly more specific. CHALICE was incompletely sensitive but the most specific of all rules. CATCH was incompletely sensitive and had the poorest specificity of all modalities. |
|
Ide, 2020 |
Type of study: Multicentre prospective study.
Setting and country: Multicentre, Japan.
Funding and conflicts of interest: This work was supported by the Foundation. for Growth Science (26-44) and MEXT KAKENHI JP16K11436; The authors have no conflicts of interest to disclose. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 2237
Age: Median (IQR) months <2yrs: 13 (7-18) ≥2yrs: 56 (37-90)
|
|
Length of follow-up: n.r.
Loss-to-follow-up: n.r.
Incomplete outcome data: n.r.
|
Neurosurgery Defined by any injury requiring neurosurgical intervention.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN < 2 years 0.87 [0.60 – 0.98] / 0.71 [0.69 – 0.73]
Clinical decision rule: PECARN ≥ 2 years 1.00 [0.63 – 1.00] / 0.80 [0.78 – 0.81]
|
Author’s conclusion The PECARN rules seemed to be safely applicable to children with minor head trauma in Japan. Further studies are required to show safety in the hospitals where physicians do not have expertise in managing. children. |
|
Lorton, 2016 |
Type of study: multicentre prospective study.
Setting and country: Multicentre, France.
Funding and conflicts of interest: Funding information is not available; The authors declare that they have no competing interests. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 1499
Age: Median (IQR) months 3 (1.7 – 6)
|
|
Length of follow-up: n.r.
Loss-to-follow-up: 66%
Incomplete outcome data: n.r.
|
Neurosurgery Defined by any injury requiring neurosurgical intervention.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN < 2 years 1.00 [0.29 – 1.00] / 0.64 [0.59 – 0.69]
Clinical decision rule: PECARN ≥ 2 years 1.00 [0.54 – 1.00] / 0.72 [0.69 – 0.75]
|
Author’s conclusion We conducted a prospective multicentre validation study of the PECARN clinical decision rule for detection of ciTBI in children with minor head trauma, according to the methodological standards. The PECARN rule successfully identified all of the patients with ciTBI, with a limited use of CT scans. A broad validation study with a large cohort is needed to allow sufficient statistical power before authorizing its implementation and generalization. Such a study is currently underway, with recruitment taking place in nine French general and paediatric EDs (ClinicalTrials. gov Identifier: NCT02357186). |
|
Osmond, 2018 |
Type of study: prospective multicentre cohort study
Setting and country: Multicentre, Canada.
Funding and conflicts of interest: No competing interests: This study was funded by a peer reviewed. grant from the Canadian Institutes of Health Research (CIHR funding reference no. MOP-43911). |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 4060
Age: Mean (SD) years 9.7 (4.8)
|
|
Length of follow-up: n.r.
Loss-to-follow-up: 434/4494 (9.7%)
Incomplete outcome data: n.r.
|
Neurosurgery Defined by any injury requiring neurosurgical intervention.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: CATCH 0.91 [0.72 – 0.99] / 0.57 [0.56 – 0.59]
Clinical decision rule: CATCH 0.98 [0.94 – 0.99] / 0.60 [0.58 – 0.61]
|
Author’s conclusion Among children presenting to the emergency department with the signs and symptoms of acute minor head injury, the CATCH rule was highly sensitive for identifying those children requiring. neurosurgical intervention and those with any brain injury on CT. The CATCH rule should be further validated in an implementation study designed to assess its clinical impact. |
|
Schonfeld, 2014 |
Type of study: Cross-sectional study.
Setting and country: Multicentre, USA, Italy.
Funding and conflicts of interest: No competing interests; Funding: Hood Childhood Research Grant, Boston Children’s Hospital House-officers Grant. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 2439
|
|
Length of follow-up: n.r.
Loss-to-follow-up: n.r.
Incomplete outcome data: n.r.
|
Intracranial injury Clinically important brain injury.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN < 2 years 1.00 [0.63 – 1.00] / .43 [0.40 – 0.46]
Clinical decision rule: PECARN ≥ 2 years 1.00 [0.79 – 1.00] / 0.48 [0.46 – 0.51]
|
Author’s conclusion In our external validation study, the PECARN TBI age-based clinical predication rules performed well by accurately identifying. children who are at very low risk for a clinically important TBI who can safely avoid a CT scan. These can be used to assist with clinical decision making for children with minor head trauma. Prospective implementation of the PECARN TBI rules must be carefully studied to determine the impact on CT rates as well as missed injuries. |
|
Shavit, 2020 |
Type of study: Evaluation of an external dataset (APHIRST)
Setting and country: Multicentre, New Zealand.
Funding and conflicts of interest: The study was funded by the National Health and Medical Research Council; The authors report no proprietary or commercial interest in any concept discussed in this article. The authors have no financial relationships to disclose. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 18913
|
|
Length of follow-up: 72h post-discharge.
Loss-to-follow-up: n.r.
Incomplete outcome data: n.r.
|
Intracranial injury Clinically important traumatic brain injury.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: PECARN < 2 yrs 1.00 [0.92 – 1.00] / 0.59 [0.58 – 0.61]
Clinical decision rule: PECARN 2 - 18 yrs 1.00 [0.95 – 1.00] / 0.52 [0.51 – 0.53]
|
Author’s conclusion The clinical decision rules demonstrated high accuracy in identifying ciTBI. As a screening tool, the PECARN rule outperformed IDITBIC. The findings suggest that clinicians should strongly consider directing children with GCS <15 at presentation to CT scan. |
|
Thiam, 2015 |
Type of study: Observational cohort study Setting and country: Single centre, Singapore
Funding and conflicts of interest: The ongoing prospective head injury surveillance is supported by the Paediatrics Academic Clinical Program (Paeds ACP) Young Researcher Pilot Grant. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: CATCH: 3866 CHALICE: 22 772 PECARN: 42 412
|
|
Length of follow-up: 72h post-discharge.
Loss-to-follow-up: n.r.
Incomplete outcome data: n.r.
|
Intracranial injury Clinically important brain injury.
Effect measure: Sensitivity [95% CI] / Specificity [95% CI]
Clinical decision rule: CATCH 1.00 [0.54 – 1.00] / 0.80 [0.78 – 0.83]
Clinical decision rule: CHALICE 0.83 [0.36 – 1.00] / 0.76 [0.74 – 0.79]
Clinical decision rule: PECARN high and intermediate risk 1.00 [0.54 – 1.00] / 0.62 [0.59 – 0.64]
Clinical decision rule: PECARN high-risk only 1.00 [0.54 – 1.00] / 0.97 [0.96 – 0.98] |
Author’s conclusion The CDRs demonstrated high accuracy in detecting. children with positive CT findings but its direct application would likely lead to a significant increase in unnecessary CT scans in our population. Clinical observation in most cases are a viable alternative. |
b. Diagnostic impact studies
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
|
Abid, 2021 |
Type of study: A phase II prospective, randomised study.
Setting and country: Multi-centre, United States.
Funding and conflicts of interest: By Annals policy, all authors are required to disclose any and all commercial, financial, and other relationships in any way related to the subject of this article as per ICMJE conflict of interest guidelines (see www.icmje.org). The authors have stated that no such relationships exist. The authors report this article did not receive any outside funding or support. |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 514 Control: 567
Important prognostic factors2: Age: <1 mo: 26.1%^ 1-2 mo: 41.2% 2-3 mo: 32.8%
Sex: 47.5% F
Groups comparable at baseline? Yes |
Patients who met the PECARN low-risk criteria that were developed for children younger than 2 years.
|
Patients who did not meet those PECARN low-risk criteria. |
Length of follow-up: ≥ 2 nights of hospitalisation.
Loss-to-follow-up: 65/1147 (5.7%)
Reason: PECARN low-risk variables missing.
Incomplete outcome data: 1/1147 (0.09%
Reason: missing clinically important traumatic brain injury data.
|
Clinically important traumatic brain injury Defined as death from the traumatic brain injury, traumatic brain injuries requiring neurosurgical procedures, intubation for at least 24 hours for the traumatic brain injury, or hospitalization for 2 or more nights because of head trauma and ongoing signs/symptoms in association with traumatic brain injury on CT.
Effect measure: n/N (%) I: 1/514 (0.19%) C: 24/456 (4.2%)
Traumatic brain injury on CT Defined as any acute traumatic intracranial findings or skull fractures depressed by at least the width of the table of the skull.
Effect measure: n/N (%) I: 10/197 (5.1%) C: 93/436 (21.3%)
Skull fracture on CT Defined as any skull fracture seen on CT, including basilar skull fractures, depressed skull fractures, and other fractures meeting the definition of traumatic brain injury on CT, or those requiring neurosurgical intervention (eg, depressed fractures requiring elevation).
Effect measure: n/N (%) I: 9/197 (4.6%) C: 122/436 (28%) |
Author’s conclusion In conclusion, the PECARN traumatic brain injury low risk criteria accurately identified infants younger than 3 months at low risk of clinically important traumatic brain injuries. However, infants at low risk for clinically important traumatic brain injuries remained at risk for traumatic brain injuries on CT, suggesting the need for a cautious approach in these youngest infants. |
Risk of bias tables
a. Diagnostic performance studies
Risk of bias table for systematic review of diagnostic test accuracy studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Pandor, 2011 |
Yes |
Yes |
Yes |
Yes |
Yes |
No Due to clinical heterogeneity and lack of studies (n<5) data was not suitable for pooling in a forest plot. |
Unclear |
No |
- Research question (PICO) and inclusion criteria should be appropriate (in relation to the research question to be answered in the clinical guideline) and predefined
- Search period and strategy should be described; at least Medline searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to the research question (PICO) should be reported
- Quality of individual studies should be assessed using a quality scoring tool or checklist (preferably QUADAS-2; COSMIN checklist for measuring instruments) and taken into account in the evidence synthesis
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, diagnostic tests (strategy) to allow pooling? For pooled data: at least 5 studies available for pooling; assessment of statistical heterogeneity and, more importantly (see Note), assessment of the reasons for heterogeneity (if present)? Note: sensitivity and specificity depend on the situation in which the test is being used and the thresholds that have been set, and sensitivity and specificity are correlated; therefore, the use of heterogeneity statistics (p-values; I2) is problematic, and rather than testing whether heterogeneity is present, heterogeneity should be assessed by eye-balling (degree of overlap of confidence intervals in Forest plot), and the reasons for heterogeneity should be examined.
- There is no clear evidence for publication bias in diagnostic studies, and an ongoing discussion on which statistical method should be used. Tests to identify publication bias are likely to give false-positive results, among available tests, Deeks’ test is most valid. Irrespective of the use of statistical methods, you may score “Yes” if the authors discuss the potential risk of publication bias.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for diagnostic accuracy studies (QUADAS II, 2011)
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Babl, 2017 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Unclear
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? Unclear
|
|
Bozan, 2019 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
Easter, 2014 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? No
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
Ide, 2020 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
Lorton, 2016 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
Osmond, 2018 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
Schonfeld, 2014 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
Shavit, 2020 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
Thiam, 2015 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Unclear
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? No
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
b. Diagnostic impact studies
Risk of bias table for interventions studies (cohort studies based on risk of bias tool by the CLARITY Group at McMaster University)
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables?
|
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Abid, 2021 |
Definitely yes
Reason: All participants derived from the PECARN prospective observational study. |
Definitely yes
Reason: Patients were randomized according to the result of the exposure (which was application of the PECARN clinical decision rule) |
Definitely yes
Reason: patients from which neuroimaging was already obtained were excluded from the cohort. |
Definitely no
Reason: Several infants with no symptoms or seemingly minor findings had important CT findings, which commonly occur in young children.
|
Probably no
Reason: Several infants with no symptoms or seemingly minor findings had important CT findings, which commonly occur in young children. The statistical analysis did not adjust for this.
|
Probably no
Reason: Ultrasound or MRI scanning may be more accurate for detecting clinically important brain injuries in children. |
Probably yes
Reason: Follow up was adequate. |
No information
|
Some concerns |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Alharthy, N., Al Queflie, S., Alyousef, K., & Yunus, F. (2015). Clinical manifestations that predict abnormal brain computed tomography (CT) in children with minor head injury. Journal of emergencies, trauma, and shock, 8(2), 88–93. https://doi.org/10.4103/0974-2700.155504 |
Wrong analysis (univariable association). |
|
Andrade, F. P., Montoro, R., Neto, Oliveira, R., Loures, G., Flessak, L., Gross, R., Donnabella, C., Puchnick, A., Suzuki, L., & Regacini, R. (2016). Pediatric minor head trauma: do cranial CT scans change the therapeutic approach?. Clinics (Sao Paulo, Brazil), 71(10), 606–610. https://doi.org/10.6061/clinics/2016(10)09 |
Wrong analysis (univariable association). |
|
Babl, F. E., Borland, M. L., Phillips, N., Kochar, A., Dalton, S., McCaskill, M., Cheek, J. A., Gilhotra, Y., Furyk, J., Neutze, J., Lyttle, M. D., Bressan, S., Donath, S., Molesworth, C., Jachno, K., Ward, B., Williams, A., Baylis, A., Crowe, L., Oakley, E., … Paediatric Research in Emergency Departments International Collaborative (PREDICT) (2017). Accuracy of PECARN, CATCH, and CHALICE head injury decision rules in children: a prospective cohort study. Lancet (London, England), 389(10087), 2393–2402. https://doi.org/10.1016/S0140-6736(17)30555-X |
Wrong study goal (decision rules compared with clinicians practice). |
|
Bazarian, J. J., Blyth, B. J., He, H., Mookerjee, S., Jones, C., Kiechle, K., Moynihan, R., Wojcik, S. M., Grant, W. D., Secreti, L. M., Triner, W., Moscati, R., Leinhart, A., Ellis, G. L., & Khan, J. (2013). Classification accuracy of serum Apo A-I and S100B for the diagnosis of mild traumatic brain injury and prediction of abnormal initial head computed tomography scan. Journal of neurotrauma, 30(20), 1747–1754. https://doi.org/10.1089/neu.2013.2853 |
Wrong comparison (healthy controls). |
|
Bazarian, J. J., Welch, R. D., Caudle, K., Jeffrey, C. A., Chen, J. Y., Chandran, R., McCaw, T., Datwyler, S. A., Zhang, H., & McQuiston, B. (2021). Accuracy of a rapid glial fibrillary acidic protein/ubiquitin carboxyl-terminal hydrolase L1 test for the prediction of intracranial injuries on head computed tomography after mild traumatic bain injury. Academic emergency medicine: official journal of the Society for Academic Emergency Medicine, 28(11), 1308–1317. https://doi.org/10.1111/acem.14366 |
Wrong comparison (rapid test versus CT scanning). |
|
Bouvier, D., Fournier, M., Dauphin, J. B., Amat, F., Ughetto, S., Labbé, A., & Sapin, V. (2012). Serum S100B determination in the management of pediatric mild traumatic brain injury. Clinical chemistry, 58(7), 1116–1122. https://doi.org/10.1373/clinchem.2011.180828 |
Wrong comparison (serum S100B present versus absent). |
|
Borg, J., Holm, L., Cassidy, J. D., Peloso, P. M., Carroll, L. J., von Holst, H., Ericson, K., & WHO Collaborating Centre Task Force on Mild Traumatic Brain Injury (2004). Diagnostic procedures in mild traumatic brain injury: results of the WHO Collaborating Centre Task Force on Mild Traumatic Brain Injury. Journal of rehabilitation medicine, (43 Suppl), 61–75. https://doi.org/10.1080/16501960410023822 |
Wrong study design (descriptive review). |
|
Bressan, S., Daverio, M., Martinolli, F., Dona', D., Mario, F., Steiner, I. P., & Dalt, L. D. (2014). The use of handheld near-infrared device (Infrascanner)for detecting intracranial haemorrhages in children with minor head injury. Child's nervous system: ChNS: official journal of the International Society for Pediatric Neurosurgery, 30(3), 477–484. https://doi.org/10.1007/s00381-014-2368-9 |
Wrong topic (infrascanner). |
|
Bressan, S., Eapen, N., Phillips, N., Gilhotra, Y., Kochar, A., Dalton, S., Cheek, J. A., Furyk, J., Neutze, J., Williams, A., Hearps, S., Donath, S., Oakley, E., Singh, S., Dalziel, S. R., Borland, M. L., Babl, F. E., & Paediatric Research in Emergency Departments International Collaborative (PREDICT) (2021). PECARN algorithms for minor head trauma: Risk stratification estimates from a prospective PREDICT cohort study. Academic emergency medicine: official journal of the Society for Academic Emergency Medicine, 28(10), 1124–1133. https://doi.org/10.1111/acem.14308 |
Wrong comparison (different numbers of risk predictors compared). |
|
Castellani, C., Bimbashi, P., Ruttenstock, E., Sacherer, P., Stojakovic, T., & Weinberg, A. M. (2009). Neuroprotein s-100B -- a useful parameter in paediatric patients with mild traumatic brain injury? Acta paediatrica (Oslo, Norway: 1992), 98(10), 1607–1612. https://doi.org/10.1111/j.1651-2227.2009.01423.x |
Univariable analysis and wrong comparison (S100B). |
|
Da Dalt, L., Marchi, A. G., Laudizi, L., Crichiutti, G., Messi, G., Pavanello, L., Valent, F., & Barbone, F. (2006). Predictors of intracranial injuries in children after blunt head trauma. European journal of pediatrics, 165(3), 142–148. https://doi.org/10.1007/s00431-005-0019-6 |
Wrong comparison (presence vs. absence of intracranial injury). |
|
Dunning, J., Batchelor, J., Stratford-Smith, P., Teece, S., Browne, J., Sharpin, C., & Mackway-Jones, K. (2004). A meta-analysis of variables that predict significant intracranial injury in minor head trauma. Archives of disease in childhood, 89(7), 653–659. https://doi.org/10.1136/adc.2003.027722 |
Wrong study goal (no clinical decision rules evaluated). |
|
Gravel, J., Gouin, S., Chalut, D., Crevier, L., Décarie, J. C., Elazhary, N., & Mâsse, B. (2015). Derivation and validation of a clinical decision rule to identify young children with skull fracture following isolated head trauma. CMAJ: Canadian Medical Association journal = journal de l'Association medicale canadienne, 187(16), 1202–1208. https://doi.org/10.1503/cmaj.150540 |
Wrong study goal (development and validation of a new clinical decision rule). |
|
Hansen, C., Waller, L. C., Brady, D., & Teramoto, M. (2022). Relationship Between CT Head Findings and Long-term Recovery in Children with Complicated Mild Traumatic Brain Injury. Brain injury, 36(1), 77–86. https://doi.org/10.1080/02699052.2022.2034947 |
Wrong outcome measures. |
|
Hennelly, K. E., Mannix, R., Nigrovic, L. E., Lee, L. K., Thompson, K. M., Monuteaux, M. C., Proctor, M., & Schutzman, S. (2013). Pediatric traumatic brain injury and radiation risks: a clinical decision analysis. The Journal of pediatrics, 162(2), 392–397. https://doi.org/10.1016/j.jpeds.2012.07.018 |
Wrong comparison (CT scan performed versus no CT scan performed). |
|
Kelmendi, F. M., Morina, A. A., Mekaj, A. Y., Blyta, A., Alimehmeti, R., Dragusha, S., Ahmeti, F., Morina, Q., & Kotori, A. (2018). Serum S100B Levels Can Predict Computed Tomography Findings in Paediatric Patients with Mild Head Injury. BioMed research international, 2018, 6954045. https://doi.org/10.1155/2018/6954045 |
Wrong analysis (univariable association). |
|
Maguire, J. L., Boutis, K., Uleryk, E. M., Laupacis, A., & Parkin, P. C. (2009). Should a head-injured child receive a head CT scan? A systematic review of clinical prediction rules. Pediatrics, 124(1), e145–e154. https://doi.org/10.1542/peds.2009-0075 |
Wrong population (not specified to acute mild brain injury). |
|
Manzano, S., Holzinger, I. B., Kellenberger, C. J., Lacroix, L., Klima-Lange, D., Hersberger, M., La Scala, G., Altermatt, S., & Staubli, G. (2016). Diagnostic performance of S100B protein serum measurement in detecting intracranial injury in children with mild head trauma. Emergency medicine journal: EMJ, 33(1), 42–46. https://doi.org/10.1136/emermed-2014-204513 |
Wrong comparison (presence vs. absence of S100B). |
|
Masoumi, B., Heydari, F., Hatamabadi, H., Azizkhani, R., Yoosefian, Z., & Zamani, M. (2017). The Relationship between Risk Factors of Head Trauma with CT Scan Findings in Children with Minor Head Trauma Admitted to Hospital. Open access Macedonian journal of medical sciences, 5(3), 319–323. https://doi.org/10.3889/oamjms.2017.071 |
Wrong comparison and outcome measures. |
|
Mastrangelo, M., & Midulla, F. (2017). Minor Head Trauma in the Pediatric Emergency Department: Decision Making Nodes. Current pediatric reviews, 13(2), 92–99. https://doi.org/10.2174/1573396313666170404113214 |
Wrong study design (not systematically searched and analyzed). |
|
Munivenkatappa, A., Deepika, A., Prathyusha, V., Devi, I., & Shukla, D. (2013). Can an abnormal CT scan be predicted from common symptoms after mild head injury in children? Journal of pediatric neurosciences, 8(3), 183–187. https://doi.org/10.4103/1817-1745.123659 |
Wrong analysis (univariable association). |
|
Naghibi, T., Rostami, M., Jamali, B., Karimimoghaddam, Z., Zeraatchi, A., & Rouhi, A. J. (2021). Predicting factors for abnormal brain computed tomography in children with minor head trauma. BMC emergency medicine, 21(1), 142. https://doi.org/10.1186/s12873-021-00540-1 |
Wrong analysis (univariable association). |
|
Niele, N., van Houten, M., Tromp, E., van Goudoever, J. B., & Plötz, F. B. (2020). Application of PECARN rules would significantly decrease CT rates in a Dutch cohort of children with minor traumatic head injuries. European journal of pediatrics, 179(10), 1597–1602. https://doi.org/10.1007/s00431-020-03649-w |
Wrong study design (observational study). |
|
Niele, N., van Houten, M. A., Boersma, B., Biezeveld, M. H., Douma, M., Heitink, K., Ten Tusscher, G. W., Tromp, E., van Goudoever, J. B., & Plötz, F. B. (2019). Multi-centre study found that strict adherence to guidelines led to computed tomography scans being overused in children with minor head injuries. Acta paediatrica (Oslo, Norway: 1992), 108(9), 1695–1703. https://doi.org/10.1111/apa.14742 |
Wrong clinical decision rule. |
|
Oman, J. A., Cooper, R. J., Holmes, J. F., Viccellio, P., Nyce, A., Ross, S. E., Hoffman, J. R., Mower, W. R., & NEXUS II Investigators (2006). Performance of a decision rule to predict need for computed tomography among children with blunt head trauma. Pediatrics, 117(2), e238–e246. https://doi.org/10.1542/peds.2005-1063 |
Wrong analysis (univariable association). |
|
Pandor, A., Harnan, S., Goodacre, S., Pickering, A., Fitzgerald, P., & Rees, A. (2012). Diagnostic accuracy of clinical characteristics for identifying CT abnormality after minor brain injury: a systematic review and meta-analysis. Journal of neurotrauma, 29(5), 707–718. https://doi.org/10.1089/neu.2011.1967 |
Wrong study goal (no clinical decision rules evaluated). |
|
Pickering, A., Harnan, S., Fitzgerald, P., Pandor, A., & Goodacre, S. (2011). Clinical decision rules for children with minor head injury: a systematic review. Archives of disease in childhood, 96(5), 414–421. https://doi.org/10.1136/adc.2010.202820 |
Review was less complete than the review from Pandor (2011). |
|
Valovich McLeod T. C. (2005). The Prediction of Intracranial Injury After Minor Head Trauma in the Pediatric Population. Journal of athletic training, 40(2), 123–125. |
Wrong study design (descriptive review). |
|
Schutzman, S. A., Barnes, P., Duhaime, A. C., Greenes, D., Homer, C., Jaffe, D., Lewis, R. J., Luerssen, T. G., & Schunk, J. (2001). Evaluation and management of children younger than two years old with apparently minor head trauma: proposed guidelines. Pediatrics, 107(5), 983–993. https://doi.org/10.1542/peds.107.5.983 |
Wrong study design (guideline). |
|
Simon-Pimmel, J., Lorton, F., Guiziou, N., Levieux, K., Vrignaud, B., Masson, D., Dupas, B., & Gras-Leguen, C. (2015). Serum S100β Neuroprotein Reduces Use of Cranial Computed Tomography in Children After Minor Head Trauma. Shock (Augusta, Ga.), 44(5), 410–416. https://doi.org/10.1097/SHK.0000000000000442 |
Wrong topic (modified PECARN rule combined with serum S100B protein). |
|
Tilma, I.S., Bekhof, J., Brand, P.L.P. (2015). Licht schedelhersenletsel bij kinderen: kunnen we intracraniële complicaties voorspellen? Ned. Tijdschr. Geneesk., 159; A8759. |
Wrong analysis (univariable association). |
|
Undén, J., Dalziel, S.R., Borland, M.L. et al. External validation of the Scandinavian guidelines for management of minimal, mild and moderate head injuries in children. BMC Med 16, 176 (2018). https://doi.org/10.1186/s12916-018-1166-8 |
Wrong clinical decision rule. |
|
Yang, K., Zhao, M., Sun, J., & Nie, X. (2021). Accuracy of PECARN decision rule in minor blunt head trauma in pediatric emergency department: A meta-analysis. International journal of clinical practice, 75(11), e14586. https://doi.org/10.1111/ijcp.14586 |
Outcome of the clinical decision rule is unclear. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 14-03-2025
Beoordeeld op geldigheid : 02-12-2024
Algemene gegevens
De herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met licht traumatisch hoofdhersenletsel.
Werkgroep
- prof. dr. J. (Joukje) van der Naalt (voorzitter), neuroloog, NVN
- dr. K. (Korné) Jellema, neuroloog, NVN
- dr. H.M. (Myrthe) Boss, neuroloog, NVN
- dr. K.A. (Kelly) Foks, AIOS-neurologie, NVN
- dr. M.C. (Marieke) Visser, neuroloog, NVN
- dr. M. (Maayke) Hunfeld, kinderneuroloog, NVN
- dr. J. (Jelte) Helfferich, kinderneuroloog, NVN
- drs. I.K. (Iain) Haitsma, neurochirurg, NVvN
- drs. B. (Bart) Dorgelo, radioloog, NVvR
- dr. L.M.M. (Loes) Braun, radioloog, NVvR
- drs. M. (Maartje) Terra, traumachirurg, NVvH
- prof. dr. C.A.M. (Coen) van Bennekom, revalidatiearts en hoogleraar, VRA
- drs. E.A. (Edwin) Goedhart, sportarts, VSG
- mr. M.A.C. (Michiel) Lindhout, beleidsmedewerker, Hersenletsel.nl
- S. (Sarita) van den Berg, verpleegkundig specialist kinderneurologie, V&VN VS
- dr. F.A. (Floris) van de Laar, huisarts, NHG
- dr. C.L. (Crispijn) van den Brand, SEH-arts, NVSHA
Met ondersteuning van
- drs. F. (Florien) Ham, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- drs. A.A. (Toon) Lamberts, senior adviseur, Kennisinstituut van Medisch Specialisten
- drs. L.H.M. (Linda) Niesink-Boerboom, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
- dr. M. (Mirre) den Ouden - Vierwind, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. J van der Naalt |
Neuroloog, UMCG. |
Geen. |
lid verband 'artsen voor veilig fietsen'. |
Geen restrictie. |
|
Dr. K. Jellema |
Neuroloog, Haaglanden Medisch Centrum. |
Onderzoek van o.a. neurotraumatologie (onbetaald), werkgroeplid voor het ontwikkelen van een EPA voor dokters op de SEH (vacatiegelden), Initiatiefnemer en docent bij hands on ABCDE-training Neurologic ALS (vacatiegelden), in het verleden voorzitter voor twee addenda op de richtlijn LTH (triviaal trauma en stollingsbeïnvloedende medicatie (vacatiegelden). |
Projectleider bij extern gefinancierd onderzoek (Roch Diagnostics) over de waarde van biomarker S100 B voor de inschatting van traumatisch intracranieel letsel (afgerond in 2019). |
Geen restrictie. |
|
Dr. H.M. Boss |
Neuroloog-somnoloog Ziekenhuis Gelderse Vallei. |
* Bestuurslid werkgroep slaapwaakstoornissen (niet betaald) * Mede-initiator denktank: artsen voor veilig fietsen (niet betaald) * Lid werkgroep richtlijn slaapstoornissen in de langdurige zorg (vacatiegelden). |
Mede-initiator van de denktank 'artsen voor veilig fietsen'. Met deze denktank willen we meer aandacht vragen voor preventie van hersenletsel en het gebruik van de fietshelm bij risicogroepen zoals e-bikers en kinderen stimuleren. |
Geen restrictie. |
|
Dr. K.A. Foks |
AIOS-neurologie Erasmus MC. |
Geen. |
Geen. |
Geen restrictie. |
|
Dr. M.C. Visser |
Neuroloog. |
Medisch expert bij Zorginstituut Nederland. |
Lid verband 'artsen voor veilig fietsen'. |
Geen restrictie. |
|
Dr. M. Hunfeld |
Kinderneuroloog EMC. |
Geen. |
Geen. |
Geen restrictie. |
|
Dr. J. Helfferich |
Kinderneuroloog |
Lid internationale 'acute flaccid myelitis' werkgroep (onbetaald) Commissielid jongerenvereniging EPNS (European pediatric neurology society) (onbetaald) |
Overheid (RIVM) Landelijk onderzoek naar het voorkomen van AFM in Nederland; dit heeft geen relevantie voor deze richtlijn. |
|
|
Drs. I.K. Haitsma |
Neurochirurg Erasmus MC. |
Neurochirurg Albert Schweitzer Ziekenhuis. |
1) Center-TBI: prospectief data verzameling voor analyse behandeling neurotrauma in Europa, gefinancierd door EU als lokale hoofdonderzoeker; 2) NetQuRe: prospectief data verzamelen voor behandeling en revalidatie neurotrauma in Nederland, gefinancierd door hersenstichting, center TBI, LUMC, Rijndam als lokale hoofd onderzoeker; 3) RESET ASDH: gerandomiseerde studie naar effect opereren Acuut subduraal hematoom bij ouderen, wordt een observationele studie, gefinancierd door the belgian health care knowledge centre (KCE) en ZonMw als lokale hoofd onderzoeker; 4) CIAO@TBI: effect behandeling complementremmer op traumatisch hersenletsel, gefinancierd door hersenstichting en Takeda Pharmaceutical Company als mede onderzoeker lokaal. |
Geen restrictie. |
|
Drs. B. Dorgelo |
Radioloog, Martini Ziekenhuis, Groningen. |
Geen. |
Geen. |
Geen restrictie. |
|
Dr. L.M.M. Braun |
Radioloog bij Antoni van Leeuwenhoek/ Nederlands Kanker Instituut. |
Geen. |
Geen |
Geen restrictie. |
|
Drs. M. Terra |
Traumachirurg MMT-arts. |
Geen. |
Thoraxdrainage onderzoek Medela |
Geen restrictie. |
|
Prof. dr. C.A.M. van Bennekom |
Revalidatiearts. |
Hoogleraar revalidatie en arbeid. |
Lid verband 'artsen voor veilig fietsen'. |
Geen restrictie. |
|
Drs. E. A. Goedhart |
Bondsarts KNVB/ Manager sportgeneeskunde. |
* Adviseur Stichting Hersenschudding (onbetaald). * Adviseur GetaheadBrainrecovery support (onbetaald). |
Geen. |
Geen restrictie. |
|
Mr. M.A.C. Lindhout |
Beleidsmedewerker bij patiëntenvereniging Hersenletsel.nl. |
Bestuurslid bij CVA-Kennisnetwerk, onbezoldigd. |
Als deelnemer vanuit de patiëntenvereniging is het mijn belang om de zaken voor mijn achterban zo goed mogelijk te regelen. Daar zal ik mij dan ook voor inzetten. In mijn optiek is dit ook wat een patiëntenvereniging behoort te doen. Derhalve zie ik dit niets als 'bescherming van reputatie" of iets van gelijke strekking. |
Geen restrictie. |
|
S. van den Berg |
Verpleegkundig specialist kinderneurologie Erasmus MC-Sophia. |
Bestuursvoorzitter van de Alumnivereniging van de HRO- onbetaald. |
Geen. |
Geen restrictie. |
|
Dr. F.A van der Laar |
* Huisarts, Academisch Gezondheidscentrum Thermion Lent (0,6) * Onderzoeker/ Principal Lecturer, Radboudumc, eerstelijnsgeneeskunde. |
* Hoofdredacteur Accredidact, betaald * Lid Autorisatiecommissie NHG, betaald * Lid richtlijncommissie PICS, onbetaald * Lid commissie Kwaliteit en Veiligheid Huisartsenpost Nijmegen e.o., betaald. |
Geen. |
Geen restrictie. |
|
Dr. C.L. van den Brand |
SEH-arts Erasmus MC. |
Voorzitter college van deskundigen Oranje Kruis (betaald) * lid bestuur SGO fonds (onbetaald) * lid denktank "Artsen voor veilig fietsen" (onbetaald) |
Lid verband 'artsen voor veilig fietsen'. |
Geen restrictie. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van een afgevaardigde van de patiëntenorganisatie Hersenletsel in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Indicaties CT-scan hersenen kinderen |
Geen financiële gevolgen |
Uitkomst 3 Geen financiële gevolgen. Hoewel het +/- 85.000 patiënten betreft hebben de aanbevelingen geen toename in het aantal FTE of toename in kwalificatie tot gevolg. Ook zijn er geen substantiële investeringen met de wijzigingen gemoeid. |
Implementatie
Implementatieplan
Inleiding
Dit plan is opgesteld ter bevordering van de implementatie van de richtlijn Licht traumatisch hoofd-/hersenletsel in de acute fase. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het toepassen en naleven van de aanbevelingen. Daarbij heeft de richtlijncommissie een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die voor verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
• per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
• de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
• randvoorwaarden om de aanbeveling te kunnen implementeren;
• mogelijk barrières om de aanbeveling te kunnen implementeren;
• mogelijke acties om de implementatie van de aanbeveling te bevorderen;
• verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbevelingen is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord. Er kan een onderscheid worden gemaakt tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de richtlijncommissie een duidelijke uitspraak over iets dat zeker wel of zeker niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld (bijvoorbeeld “Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe meer uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”. Bij elke module is onderstaande tabel opgenomen.
|
Aanbeveling |
Tijdspad voor implementatie: 1 tot 3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
|
|
|
|
|
|
|
|
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land met betrekking tot de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, et cetera.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type behandeling, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang. Echter, aangezien de richtlijn vaak enkel wordt geautoriseerd door de (participerende) wetenschappelijke verenigingen is het aan de wetenschappelijke verenigingen om deze problemen bij de andere partijen aan te kaarten.
Implementatietermijnen
Voor “sterk geformuleerde aanbevelingen” geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Voor de meeste “sterk geformuleerde aanbevelingen” betekent dat dat zij komend jaar direct geïmplementeerd moeten worden en dat per 2024 dus iedereen aan deze aanbevelingen dient te voldoen.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met licht traumatisch hoofdhersenletsel. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn licht traumatisch hoofdhersenletsel (NVN, 2010; en enkele modules uit 2017) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door Ambulancezorg Nederland (AZN), Ergotherapie Nederland (EN), het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF), het Nederlands Huisartsen Genootschap (NHG), de Nederlandse Vereniging voor Kindergeneeskunde (NVK), de Nederlandse Vereniging van Revalidatieartsen (VRA), de Vereniging voor Sportgeneeskunde (VSG) en de Nederlandse Vereniging voor Radiologie (NVvR) via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
er is hoge zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; het is zeer onwaarschijnlijk dat de literatuurconclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Redelijk |
er is redelijke zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; het is mogelijk dat de conclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Laag |
er is lage zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; er is een reële kans dat de conclusie klinisch relevant verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd. |
|
Zeer laag |
er is zeer lage zekerheid dat het ware effect van behandeling dichtbij het geschatte effect van behandeling ligt; de literatuurconclusie is zeer onzeker. |
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Richtlijn: NVN Licht THL in de acute fase |
|
|
Uitgangsvraag: Welke volwassen patiënten komen in aanmerking voor beeldvormende diagnostiek voor licht THL in de acute fase? |
|
|
Database(s): Medline (OVID), Embase |
Datum: 09-08-2022 |
|
Periode: >2000 |
Talen: Geen beperking |
|
Literatuurspecialist: Linda Niesink |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
→ Voor deze vraag is gezocht op de elementen licht-traumatisch hoofd-/hersenletsel (in het blauw) het maken van een CT-scan (in het groen) en een diagnostisch zoekfilter (in het oranje).
à In de zoekstrategie worden zowel volwassenen als kinderen meegenomen.
à De genoemde sleutelartikelen van Yuh (2021), Haydel (2000), Smits (2007) en Foks (2018) zitten in de zoekopbrengst. Stiell (2001) valt er buiten op studiedesign, maar zou anders wel gevonden worden.
à In eerste instantie waren alleen de systematische reviews uitgedraaid (=95), daarna zijn ook de observationele studies vanaf 2010 toegevoegd (=635). Die resultaten staan in Rayyan.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 09-08-2022 met relevante zoektermen gezocht vanaf 2000 naar systematische reviews, RCT’s, en observationele studiedesigns over het maken van een CT-scan bij patiënten met (acuut) licht-traumatisch hersenletsel. De literatuurzoekactie leverde … unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
76 |
64 |
95 |
|
RCTs |
447 |
206 |
|
|
Observationele studies |
668 |
458 |
635 |
|
Totaal |
1191 |
728 |
|
Zoekstrategie
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Brain Injuries, Traumatic/ or exp Brain Concussion/ or exp Head Injuries, Closed/ or ((head or brain or cerebral or intracranial or cranial or craniocerebral or tbi) adj3 (injur* or trauma* or tbi) adj3 (mild or minor or light)).ti,ab,kf. or concussion.ti,ab,kf. (34624) 2 exp Tomography, X-Ray Computed/ or ('computed tomograph*' or 'ct scan*').ti,ab,kf. (671661) 3 exp "Sensitivity and Specificity"/ or (Sensitiv* or Specific*).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or Validation Study/ (7481202) 4 1 and 2 and 3 (1465) 5 limit 4 to yr="2000 -Current" (1266) 6 5 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (1229) 7 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) (582374) 8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2289907) 9 Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) (5220189) 10 6 and 7 (64) – SRs 11 (6 and 8) not 10 (206) - RCTs 12 (6 and 9) not (10 or 11) (458) – observationele studies 13 10 or 11 or 12 (728)
|
