Photodynamic therapy bij polypoidale choroidale vasculopathie
Uitgangsvraag
Is photodynamic therapy – al dan niet in combinatie met anti-VEGF injecties – effectiever dan enkel anti-VEGF therapie bij polypoidale choroidale vasculopathie (PCV)?
Aanbeveling
Start bij een bekende diagnose polypoidale choroidale vasculopathie (PCV) met subfoveale poliepen met anti-VEGF therapie en overweeg direct toevoegen van PDT.
Overweeg toevoegen van PDT bij onvoldoende effect van anti-VEGF therapie bij een uitgestelde diagnose PCV met subfoveale poliepen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Polypoidale choroidale vasculopathie (PCV) is een variant van neovasculaire LMD waarvoor de behandeling met anti-VEGF monotherapie, ter bestrijding van lekkage en behoud van visus, mogelijk iets minder effectief lijkt te zijn dan een combinatie van anti-VEGF met photodynamic therapy (PDT). Bewijs daarvoor is echter zeer laag. Wel lijkt PDT effectiever in het permanent laten verdwijnen van de poliepen (Koh, 2012 [EVEREST I]; Koh, 2017 [EVEREST II]; Lai, 2018; Lee, 2018 [PLANET]; Lim, 2012; Oishi, 2013 [LAPTOP]).
Bovengenoemde studies hadden allen betrekking op subfoveale lokalisatie van de poliepen. Bij extrafoveale lokalisatie behoort ook thermale laser therapie tot de mogelijkheden, zie module Thermische laserbehandeling.
Na een grondige literatuur analyse konden zes RCT’s worden geïncludeerd voor deze richtlijn. Deze beschreven het effect van PDT monotherapie of combinatie therapie PDT plus anti-VEGF, vergeleken met anti-VEGF monotherapie. Deze RCT’s zijn de resultaten op verschillende follow-up momenten van drie grote studies, namelijk: EVEREST, PLANET en LAPTOP. Deze drie studies verschillen echter aanzienlijk in hun studie opzet en rapportage.
Bij de gepoolde data werd geen significant verschil gevonden in de cruciale uitkomstmaat visus, maar studies rapporteerden deze uitkomst op verschillende manieren en op verschillende tijdstippen. De resultaten gaven een trend aan ten gunste van de combinatie anti-VEGF plus PDT. De studie van Wong (2019) toont verrassend genoeg echter geen toegevoegde waarde aan van PDT als rescue therapie na start met monotherapie anti-VEGF (Aflibercept).
De kwaliteit van het bewijs is echter zeer laag, omdat er niet duidelijk beschreven is hoe de randomisatie heeft plaatsgevonden, er in de meeste studies niet geblindeerd was en de patiënten aantallen relatief klein waren in de studies. Hetzelfde gebrek aan bewijskracht geldt ook voor de belangrijke uitkomstmaten dikte van de retina (geen significant verschil), behandel interval (gemiddeld aantal anti-VEGF injecties nam af na PDT) en poliep regressie (gemiddeld hoger percentage poliep regressie na PDT). De overall bewijskracht is daarom zeer laag en hier ligt zeker een kennislacune.
De belangrijkste studies voor de praktijk zijn de studies, die de langste follow up van deze drie grote trials (LAPTOP, PLANET en EVEREST) beschrijven.
LAPTOP
Oishi (2013) beschrijft de 24 maanden resultaten van de LAPTOP studie. Deze studie vergelijkt PDT monotherapie met ranibizumab monotherapie bij 97 patiënten. De ranibizumab monotherapie groep liet een visusverbetering zien terwijl er in de PDT monotherapie groep gemiddeld geen verbetering in visus was. Er waren wel patiënten die verbeterde in de PDT monotherapie groep maar ongeveer 15% had een visusdaling van meer dan 6 regels. De retinadikte was niet significant verschillend tussen de groepen.
PLANET
Wong (2019) beschrijft de 96 maanden resultaten van de PLANET studie. De PLANET studie onderzocht aflibercept monotherapie versus aflibercept plus toevoegen PDT (rescue PDT) bij patiënten met “treatment failure” volgens bepaalde criteria na starten van behandeling met anti-VEGF alleen. Gebaseerd op deze studie is er geen toegevoegde waarde van PDT als rescue therapie; van de totale studie populatie van 318 patiënten voldeden er 54 (17%) aan de criteria voor failure en kregen 25 patiënten sham PDT en 29 patiënten verteporfin PDT, naast de gecontinueerde anti-VEGF.
EVEREST
Lim (2020) beschrijft de 24 maanden resultaten van de EVEREST studie waarin ranibizumab monotherapie is vergeleken met ranibizumab plus prompt PDT als combinatie therapie, met als belangrijkste conclusie een gemiddelde visuswinst van 4.1 letters in de combinatie therapie groep (n=168) ten opzichte van de monotherapie groep (n=154). Tevens was de poliep regressie in de combinatie groep 56.6% ten opzichte van 27.6% in de monotherapie groep. De combinatie therapie groep had gemiddeld 50% minder intravitreale injecties nodig over de periode van 24 maanden.
Samenvattend:
- PDT als monotherapie is niet zinvol vergeleken met anti-VEGF monotherapie bij de diagnose PCV met subfoveale poliepen. (LAPTOP)
- Toevoegen van PDT na start met anti-VEGF (aflibercept) monotherapie bij onvoldoende respons is niet beter dan continueren van anti-VEGF monotherapie (alfibercept) bij diagnose PCV met subfoveale poliepen. (PLANET)
- Starten met combinatie anti-VEGF (ranibizumab) met PDT geeft betere resultaten qua visus, retina dikte, poliep regressie en aantal injecties bij PCV met subfoveale poliepen. (EVEREST)
- Bij patiënten met diagnose PCV en extrafoveale poliepen kunnen deze laatste ook met thermische laser behandeld worden in combinatie met anti-VEGF injecties, ndien anti-VEGF therapie en PDT onvoldoende effect hebben gehad en de behandelaar ervaring heeft met deze procedure.
Op basis van bovenstaande literatuur en de klinische ervaring van de werkgroep is het toevoegen van PDT aan de anti-VEGF behandeling bij aanvang van de behandeling bij een patiënt met een duidelijke diagnose PCV zeker te overwegen. Veelal is de diagnose PCV echter niet altijd gelijk duidelijk bij start van de behandeling. Deze patiënten zullen dan eerst behandeld worden met anti-VEGF monotherapie. Pas bij onvoldoende effect zal dan de diagnose PCV gesteld worden met aanvullend onderzoek (FAG /ICG). Toevoegen van PDT lijkt dan echter minder zinvol zijn gebaseerd op de resultaten van de PLANET studie (Wong, 2019). Hierbij moet echter opgemerkt worden dat de patiënten in deze studie behandeld werden met aflibercept waardoor de situatie anders is dan in Nederland waar gestart wordt met bevacizumab.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het doel van het toevoegen van PDT aan de behandeling met anti-VEGF injecties is een afname van retinale lekkage en verbetering of stabilisatie van de visus. Daarnaast kan het de frequentie van de anti-VEGF injecties reduceren. PDT is een semi-invasieve behandeling, maar in de praktijk zien we dat patiënten PDT als weinig belastend ervaren. Het nadeel van toevoegen van PDT is het mogelijke verlies aan visus dat een gevolg kan zijn van de behandeling. Dit moet afgewogen worden tegen het mogelijk additieve effect van PDT bij anti-VEGF monotherapie.
Kosten (middelenbeslag)
Over de kosteneffectiviteit van PDT behandelingen bij PCV zijn geen berekeningen bekend.
Aanvaardbaarheid, haalbaarheid en implementatie
PDT is al vele jaren in gebruik in de oogheelkundige praktijk. De behandeling is zeker aanvaard, maar de haalbaarheid kent enige beperkingen.
PDT is alleen mogelijk in een aantal gespecialiseerde centra verspreid over Nederland, die naast de mogelijkheid voor uitvoering PDT (vereist een aparte laser) ook beschikking moeten hebben over ICG, hierdoor moeten patiënten voor PDT behandeling veelal verwezen worden. Dit kan leiden tot een doctor’s- danwel patient’s delay voor de PDT behandeling.
In 2021 is er wereldwijde schaarste van Visudyne®(verteporfine) voor PDT ontstaan door aanhoudende productieproblemen bij de fabrikant. Visudyne is een kritisch geneesmiddel, er zijn momenteel geen alternatieven beschikbaar. Het Nederlands Oogheelkundig Gezelschap heeft daarom een prioriteringsschema opgesteld om de beschikbare verteprofine te verdelen over de behandelcentra in tijden van schaarste.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Hoewel de beschikbare onderbouwing mager is (very low evidence) lijkt een combinatie van PDT met anti-VEGF therapie in die gevallen waar de diagnose PCV bij aanvang reeds gesteld is te overwegen. Bij patiënten waarbij de diagnose later wordt gesteld en waar anti-VEGF monotherapie onvoldoende effectief is gebleken, lijkt toevoegen van PDT aan de anti-VEGF behandeling (met aflibercept) minder zinvol op basis van de literatuur.
Op basis van klinische ervaring adviseert de werkgroep om bij uitgestelde diagnose PCV met onvoldoende respons op anti-VEGF wel PDT toe te voegen aan de behandeling. Zie ook module Photodynamic therapy bij non-responders op anti-VEGF therapie.
Onderbouwing
Achtergrond
Photodynamic therapy (PDT) als monotherapie bij neovasculaire LMD is niet meer geïndiceerd, maar kan nog wel een toegevoegde waarde hebben bij patiënten die onvoldoende reageren op anti-VEGF therapie. Dit geldt veelal voor de varianten PCV, RAP, combinaties van cCSC/pachychoroid met type 1 MNV en bij non-responders. Anti-VEGF injecties zijn de eerste keuze therapie vanwege hun effectiviteit en veiligheid. Veelal zal in de praktijk dan ook gestart worden met anti-VEGF behandeling ongeacht de diagnose. Bij de genoemde varianten zou het echter zinvol kunnen zijn PDT ofwel toe te voegen direct bij aanvang van de behandeling ofwel bij gebleken onvoldoende respons op anti-VEGF mono-therapie. Beantwoording van de vraag of, en wanneer, PDT een toegevoegde waarde heeft is dan ook belangrijk voor de klinische praktijk.
Conclusies / Summary of Findings
Polypoidal choroidal vasculopathy (PCV)
Visual acuity (crucial)
|
Very low GRADE |
The evidence is very uncertain about the effect of PDT with or without anti-VEGF on visual acuity when compared with anti-VEGF monotherapy in patients with PCV.
Sources: Koh, 2012 [EVEREST I]; Koh, 2017 [EVEREST II]; Lai, 2018; Lee, 2018 [PLANET]; Lim, 2012; Oishi, 2013 [LAPTOP] |
Retinal thickness (important)
|
Very low GRADE |
The evidence is very uncertain about the effect of PDT with or without anti-VEGF on retinal thickness when compared with anti-VEGF monotherapy in patients with PCV.
Sources: Koh, 2012 [EVEREST I]; Koh, 2017 [EVEREST II]; Lai, 2018; Lee, 2018 [PLANET]; Lim, 2012; Oishi, 2013 [LAPTOP] |
Treatment interval (important)
|
Very low GRADE |
The evidence is very uncertain about the effect of PDT with or without anti-VEGF on treatment interval when compared with anti-VEGF monotherapy in patients with PCV.
Sources: Koh, 2012 [EVEREST I]; Koh, 2017 [EVEREST II]; Lai, 2018; Lee, 2018 [PLANET]; Lim, 2012 |
Polyp regression rate (important)
|
Very low GRADE |
The evidence is very uncertain about the effect of PDT with or without anti-VEGF on polyp regression rate when compared with anti-VEGF monotherapy in patients with PCV.
Sources: Koh, 2012; Koh, 2017 [EVEREST II]; Lai, 2018; Lee, 2018 [PLANET] |
Samenvatting literatuur
Description of studies
Systematic reviews
Chi (2021) performed a systematic review with network meta‑analysis, with studies that compared the effects of PDT monotherapy, anti-VEGF monotherapy, early combination therapy, and late combination therapy in treating PCV in terms of best-corrected visual acuity (BCVA) improvement, anatomical changes, and safety in patients with polypoidal choroidal vasculopathy (PCV). Inclusion criteria were (1) RCT or prospective study design; (2) study of patients with active PCV; (3) use of interventions with PDT, anti-VEGF, or a combination of PDT and anti-VEGF, and exclusion criteria were: (1) studies with unreported outcomes, for BCVA, proportion of patients with complete polyp regression, central retinal thickness (CRT) decrease, rates of adverse or ocular adverse events; (2) gray literature lacking a detailed report. They searched the databases Cochrane Library, EMBASE, and New PubMed, up to February 2020. They included 11 studies, including 7 RCTs and 4 prospective cohort studies. Six RCTs met our PICO and were included in our analyses (Lai, 2018; Lee, 2018 (PLANET); Lim, 2012; Koh, 2012 (EVEREST I); Koh, 2017 (EVEREST II); Oishi, 2013 (LAPTOP)). The number of included patients/eyes ranged from 34 to 318 patients per study. The included studies compared PDT plus anti-VEGF (ranibizumab, aflibercept or bevacizumab), with anti-VEGF monotherapy or ant-VEGF with sham PDT (see further details in the Evidence table). The follow-up period ranged from 6 to 13 months.
Zhao (2020) performed a systematic review and meta-analysis, with studies that recruited patients with PCV, and evaluated different interventions for PCV on polyp regression rate and treatment prognosis. Inclusion criteria were: (1) research studies described the complete regression rate of polyps in PCV patients and (2) the studies included at least one of the following items: baseline characteristics of PCV, the regression rate of PED, best-corrected visual acuity (BCVA) improvement rate, the rate of BCVA gain or loss more than 3 lines, dry macula, and polyp recurrence. The time-point of the prognosis evaluation was set at post-treatment 12 months, and the exclusion criteria were (1) articles without information about polyp regression rate; (2) articles with sample size less than 10; (3) reviews, commentary articles, animal studies or case reports; and (4) redundant publications. The meta-analysis included 104 studies, of which 2 RCTs met our PICO and were not included in Chi (2021) (Takahashi, 2018 [EVEREST II]; Wong, 2019 [PLANET]). The number of included patients ranged from 84 to 318 per study. The included studies compared PDT plus anti-VEGF (aflibercept or ranibizumab) with anti-VEGF monotherapy. The follow-up period ranged from 12 to 24 months.
RCT
Lim (2020) [EVEREST II] performed a multi-center RCT in Singapore, with 322 patients, of which 168 received Ranibizumab (0.5mg) + vPDT and 154 patients received Monotherapy ranibizumab (0.5mg) + sham PDT. The follow-up period was 24 months, and reported outcomes were visual acuity, retinal thickness and number of injections. Studies within the EVEREST II are also included in the included systematic reviews.
Table 1 – Overview of included studies
|
Study name |
First publication |
Second publication |
Third publication |
|
PLANET |
Lee (2018) 13 months FU |
Wong (2019) 24 months FU |
Ogura (2021) subgroup of Japanese patients (excluded) |
|
EVEREST I |
Koh (2012) 6 months FU |
|
|
|
EVEREST II |
Koh (2017) 12 months FU |
Takahashi (2018) 12 months FU |
Lim (2020) 24 months FU |
|
LAPTOP |
Oishi (2013) 12 months FU |
|
|
FU = follow-up
Results
Visual acuity
Six studies reported on visual acuity. The follow-up period was 6 months in one study (Koh, 2012), 12 months in six studies (Koh, 2017; Lai, 2018; Lee, 2018; Lim, 2012; Oishi, 2013; Takahashi, 2018), 24 months in one study (Lim, 2020) and 96 weeks in one study (Wong, 2019). Due to the heterogeneity of presentation of results, data was not pooled.
Three studies reported mean change in BCVA, of which one study had 6 months follow-up (Koh, 2012), and two studies had 12 months follow-up (Koh, 2017; Lee, 2018) (Figure 1).
Figure 1. Outcome mean change in BCVA
Z: p-value of pooled effect; df: degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
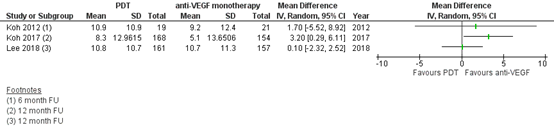
Koh (2012) also reported results for the PDT monotherapy group. The mean change in BCVA from baseline to 6 months follow-up was 7.5 (sd 10.7) letters.
Lim (2012) only described the results of visual acuity in figures and text (data was not reported). They reported that comparisons by treatment modality showed no statistically significant difference in BCVA (p = 0.691) between the anti-VEGF monotherapy and PDT+anti-VEGF groups.
Oishi (2013) reported the changes in logMAR BCVA from baseline to month 12. In the PDT monotherapy group the proportion of patients who gained 0.2 logMAR units (10 letters of ETDRS chart), demonstrated no change, or lost 0.2 logMAR units was 17.0%, 55.3%, and 27.7%, respectively. In the anti-VEGF group, the proportion of patients who gained 0.2 logMAR units (10 letters of ETDRS chart), demonstrated no change, or lost 0.2 logMAR units was 30.4%, 60.9%, and 10.9%. They reported that the results were significantly better in the ranibizumab arm (P = .039). When we judged the change of VA by 0.3 logMAR units (15 letters of ETDRS chart), the superiority of ranibizumab remained the same (P = 0.024).
Lai (2018) reported the changes in mean logMAR at different timepoints up to 12 months follow-up. In the PDT+anti-VEGF group the mean logMAR was 0.94 ± 0.55 at baseline, and 0.72 ± 0.44 at 12 months follow-up. This mean is equal to 11 letters of ETDRS chart. In the PDT monotherapy group the mean logMAR was 0.90 ± 0.52 at the baseline and 0.75 ± 0.57 at 12 months follow-up, which is equal to a difference of 7.5 letters of ETDRS chart. In the anti-VEGF monotherapy group the mean logMAR was 0.96 ± 0.58 at baseline and 0.77 ± 0.41 at 12 months follow-up, which is equal to a difference of 9.5 letters of ETDRS chart.
Retinal thickness
Six studies reported on retinal thickness. Due to heterogeneity of the presentation of results, data was not pooled, and results were only described in text.
Two studies reported on central retinal thickness (CRT) (Koh, 2012; Oishi, 2013). Koh (2012) reported the mean change in CRT from baseline to 6 months follow-up. The mean change in CRT was −145.6 ± 119.0 µm for the PDT+anti-VEGF group, −98.1 ± 104.3 µm for the PDT monotherapy group and −65.7 ± 114.3 µm for the anti-VEGF monotherapy group. Oishi (2013) reported the CRT at baseline and 12 months follow-up. In the PDT group CRT decreased from 366.8 μm to 289.1 μm, and in the anti-VEGF group CRT decreased from 418.9 μm to 311.2 μm. Both arms demonstrated significant improvement at the initial visit after treatment and maintained the effect throughout the study period. The change of CRT was not significantly different between the 2 arms (P=0.115).
Two studies reported on central subfield thickness (CSFT), which we assume to be identical to the CRT in the previous papers (Koh, 2017; Lee, 2018). Koh (2017) reported the mean change in CSFT from baseline to 12 months follow-up. In the PDT group, this was −164.9 μm, and in the anti-VEGF group, this was −113.4 μm (P<0.001). Lee (2018) reported the mean change in CSFT from baseline to 12 months follow-up. In the PDT group, this was −143.5 μm, and in the anti-VEGF group, this was −137.7 μm. The mean difference was 1.1 (95% CI: −9.2 to 11.3; P = 0.84).
Two studies reported on central foveal thickness (CFT), which we again assume to be identical to the CRT, and the CSFT in the previous papers (Lai, 2018; Lim, 2012). Lai (2018) reported CFT from baseline to 12 months follow-up, on different time points. In the PDT+anti-VEGF group the CFT was 522.63 ± 288.40 μm at the and 328.44 ± 103.25 at 12 months follow-up. In the PDT monotherapy group, the CFT was 478.04 ± 156.70 μm at baseline and 366.43 ± 148.28 μm at 12 months follow-up. In the anti-VEGF monotherapy group, the CFT was 527.5 ± 195.90 μm at the baseline and 373.17 ± 134.88 μm at 12 months follow-up. Lim (2012) only described the results of CFT over 12 months in figures and text (data was not reported). They reported that there was no statistically significant between-group difference at any follow-up visit (P = 0.176).
Treatment interval
Five studies reported the number of anti-VEGF injections, of which one study had a follow-up period of 5 months (Koh, 2012), and four had a follow-up period of 12 months (Koh, 2017; Lai, 2018; Lee, 2018; Lim, 2012).
The results of Koh (2012), Koh (2017) and Lai (2018) are shown in Figure 2.
Figure 2. Outcome treatment interval
Z: p-value of pooled effect; df: degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
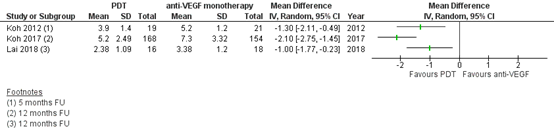
Lee (2018) reported that the mean number of injections was 8.1 in the PDT group, and 8.0 in the anti-VEGF group, but did not report standard deviations. Lim (2012) only described the number of anti-VEGF injections in text: the addition of PDT did not reduce the number of anti-VEGF injections (p=1.00).
Polyp regression rate
Four studies reported the complete polyp regression rate (Koh, 2012; Koh, 2017 [EVEREST II]; Lai, 2018; Lee, 2018 [PLANET]).
The number of patients in the study of Koh (2012) that reported complete polyp regression in the PDT plus anti-VEGF group was 15/18 (83.3%), compared to 18/21 (85.7%) in the PDT plus sham injection, and in 9/21 (42.9%) patients in the monotherapy anti-VEGF group at six months follow-up.
The number of patients in the study of Koh (2017) [EVEREST] that reported complete polyp regression in the PDT plus anti-VEGF group was 116/168 (69.3%), compared to 53/154 (34.7%) in the monotherapy anti-VEGF group at twelve months follow-up.
The number of patients in the study of Lai (2018) that reported complete polyp regression in the PDT plus anti-VEGF group was 6/16 (37.5%), compared to 14/23 (60.87%) in the PDT monotherapy group, and 4/18 (22.22%) in the monotherapy anti-VEGF group at twelve months follow-up.
The number of patients in the study of Lee (2018) [PLANET] that reported complete polyp regression in the PDT plus intravitreal aflibercept injection group was 72/161 (44.8%), compared to 61/157 (38.9%) in the intravitreal aflibercept group at thirteen months follow-up.
Level of evidence of the literature
Visual acuity (crucial)
The certainty of the evidence started high, as the evidence originated from RCTs. The level of evidence regarding the outcome measure visual acuity was downgraded by one level for risk of bias (for some studies the method of randomization was unclear or not reported, in most studies no blinding was applied), and two levels for imprecision (number of included patients). The level of evidence was therefore graded as very low.
Retinal thickness (important)
The certainty of the evidence started high, as the evidence originated from RCTs. The level of evidence regarding the outcome measure retinal thickness was downgraded by one level for risk of bias (for some studies the method of randomization was unclear or not reported, in most studies no blinding was applied), and two levels for imprecision (number of included patients). The level of evidence was therefore graded as very low.
Treatment interval (important)
The certainty of the evidence started high, as the evidence originated from RCTs. The level of evidence regarding the outcome measure treatment was downgraded by one level for risk of bias (for some studies the method of randomization was unclear or not reported, in most studies no blinding was applied), and two levels for imprecision (number of included patients). The level of evidence was therefore graded as very low.
Polyp regression rate (important)
The certainty of the evidence started high, as the evidence originated from RCTs. The level of evidence regarding the outcome measure treatment was downgraded by one level for risk of bias (for some studies the method of randomization was unclear or not reported, in most studies no blinding was applied), and two levels for imprecision (number of included patients). The level of evidence was therefore graded as very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of Photodynamic Therapy (PDT), with or without anti-VEGF compared to anti-VEGF monotherapy on visual acuity, retinal thickness, treatment interval and polyp regression in patients with polypoidal choroidal vasculopathy (PCV)?
P: patients with polypoidal choroidal vasculopathy (PCV)
I: Photodynamic Therapy (PDT), with or without anti-VEGF
C: anti-VEGF monotherapy
O: visual acuity, retinal thickness, treatment interval, polyp regression
Relevant outcome measures
The guideline development group considered visual acuity as a crucial outcome measure for decision making; and retinal thickness and treatment interval as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
- Visual acuity: Number of letters on a Snellen / ETDRS eye chart, mean difference in best corrected visual acuity (BVCA) compared to baseline
- Retinal thickness: measured with Optical Coherence Tomography (OCT), expressed as micrometer compared to baseline
- Treatment interval: number of anti-VEGF injections per year
The working group defined minimal clinically (patient) important differences per outcome:
- Visual acuity: treatment failure (decline of more than 5 letters on an eye chart)
- Retinal thickness: 0.5 standard deviation
- Treatment interval: 0.5 standard deviation
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2013 until May 3rd, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 255 hits. Studies were selected based on the following criteria: study design is a systematic review of randomized controlled trials (RCTs) or RCT, included patients with PCV, RAP, CCSC or MNV, compared PDT with or without anti-VEGF with anti-VEGF monotherapy, and reported at least one outcome of interest.
Thirty-seven SRs were initially selected based on title and abstract screening. After reading the full text, 35 SRs were excluded (see the table with reasons for exclusion under the tab Methods), and 2 SRs were included. Five RCTs were initially selected after the search data of the latest SR. After reading the full-text, 4 RCTs were excluded and 1 RCT was included.
Results
Two systematic reviews (SRs) (including eight RCTs) and one RCT after the search date of the SRs were included in the analysis of the literature on patients with PCV. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Arias, L., Gómez-Ulla, F., & Ruiz-Moreno, J. M. (2016). Ranibizumab in monotherapy and combined with photodynamic therapy for retinal angiomatous proliferation. Clinical Ophthalmology (Auckland, NZ), 10, 861.
- Chi, S. C., Kang, Y. N., & Huang, Y. M. (2021). Systematic review with network meta-analysis of antivascular endothelial growth factor use in managing polypoidal choroidal vasculopathy. Scientific reports, 11(1), 1-9.
- Koh, A., Lee, W. K., Chen, L. J., Chen, S. J., Hashad, Y., Kim, H., ... & Lim, T. H. (2012). EVEREST study: efficacy and safety of verteporfin photodynamic therapy in combination with ranibizumab or alone versus ranibizumab monotherapy in patients with symptomatic macular polypoidal choroidal vasculopathy. Retina, 32(8), 1453-1464.
- Koh, A., Lai, T. Y., Takahashi, K., Wong, T. Y., Chen, L. J., Ruamviboonsuk, P., ... & EVEREST II study group. (2017). Efficacy and safety of ranibizumab with or without verteporfin photodynamic therapy for polypoidal choroidal vasculopathy: a randomized clinical trial. JAMA ophthalmology, 135(11), 1206-1213.
- Lai, K., Li, Y., Zhou, L., Zhong, X., Huang, C., Xu, F., ... & Jin, C. (2018). Comparison of the effects of photodynamic therapy, intravitreal ranibizumab and combination for polypoidal choroidal vasculopathy under 1+ PRN regimen. BMC ophthalmology, 18(1), 1-9.
- Lee, W. K., Iida, T., Ogura, Y., Chen, S. J., Wong, T. Y., Mitchell, P., ... & Planet Investigators. (2018). Efficacy and safety of intravitreal aflibercept for polypoidal choroidal vasculopathy in the PLANET study: a randomized clinical trial. JAMA ophthalmology, 136(7), 786-793.
- Lim, J. Y., Lee, S. Y., Kim, J. G., Lee, J. Y., Chung, H., & Yoon, Y. H. (2012). Intravitreal bevacizumab alone versus in combination with photodynamic therapy for the treatment of neovascular maculopathy in patients aged 50 years or older: 1?year results of a prospective clinical study. Acta ophthalmologica, 90(1), 61-67.
- Lim, T. H., Lai, T. Y., Takahashi, K., Wong, T. Y., Chen, L. J., Ruamviboonsuk, P., ... & EVEREST II Study Group. (2020). Comparison of ranibizumab with or without verteporfin photodynamic therapy for polypoidal choroidal vasculopathy: the EVEREST II randomized clinical trial. JAMA ophthalmology, 138(9), 935-942.
- Ogura, Y., Iida, T., Lee, W. K., Cheung, C. M. G., Mitchell, P., Leal, S., ... & Ishibashi, T. (2021). Efficacy and safety of intravitreal aflibercept for polypoidal choroidal vasculopathy: 96-week outcomes in the Japanese subgroup of the PLANET study. Japanese Journal of Ophthalmology, 65, 344-353.
- Oishi, A., Kojima, H., Mandai, M., Honda, S., Matsuoka, T., Oh, H., ... & Negi, A. (2013). Comparison of the effect of ranibizumab and verteporfin for polypoidal choroidal vasculopathy: 12-month LAPTOP study results. American journal of ophthalmology, 156(4), 644-651.
- Takahashi, K., Ohji, M., Terasaki, H., Honda, S., Margaron, P., Guerin, T., & Yuzawa, M. (2018). Efficacy and safety of ranibizumab monotherapy versus ranibizumab in combination with verteporfin photodynamic therapy in patients with polypoidal choroidal vasculopathy: 12-month outcomes in the Japanese cohort of EVEREST II study. Clinical Ophthalmology, 1789-1799.
- Wong, T. Y., Ogura, Y., Lee, W. K., Iida, T., Chen, S. J., Mitchell, P., ... & Planet Investigators. (2019). Efficacy and safety of intravitreal aflibercept for polypoidal choroidal vasculopathy: two-year results of the aflibercept in polypoidal choroidal vasculopathy study. American Journal of Ophthalmology, 204, 80-89.
- Zhao, X. Y., Meng, L. H., Liu, S. Z., & Chen, Y. X. (2021). Efficacy and safety of different agents, dosages and strategies of anti?vascular endothelial growth factor treatment for neovascular age?related macular degeneration: a network meta?analysis of randomized controlled trials. Acta Ophthalmologica, 99(7), e1041-e1050
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control I
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Chi, 2021
PS., study characteristics and results are extracted from the SR or individual studies |
SR and meta-analysis of RCT and prospective cohort studies, with network meta-analysis of RCTs.
Only the RCTs were included in our analyses.
Literature search up to February 2020.
A: Koh, 2012 (EVEREST) B: Koh, 2017 (EVEREST II) C: Lai, 2018 D: Lee, 2018 (PLANET) E: Lim, 2012 F: Oishi, 2013 (LAPTOP)
Study design: RCT
Setting and Country: A: Hong Kong, Singapore, South Korea, Taiwan, Thailand B: Hong Kong, Japan, South Korea, Malaysia, Singapore, Taiwan, and Thailand C: China D: Asia (not further specified), Germany, Hungary E: Korea F: Japan
Source of funding and conflicts of interest: SR: No funding, the authors declare no competing interests. |
Inclusion criteria SR: (1) RCT or prospective study design; (2) study of patients with active PCV; (3) use of interventions with PDT, anti-VEGF, or a combination of PDT and anti-VEGF.
Exclusion criteria SR: (1) studies with unreported outcomes, for BCVA, proportion of patients with complete polyp regression, central retinal thickness (CRT) decrease, rates of adverse or ocular adverse events; (2) gray literature lacking a detailed report.
11 studies included, of which 6 were included in our analyses
Important patient characteristics at baseline:
N A: I(1): 19, I(2): 21, C: 21 B: I: 168, C: 154 C: I: 16, C: 18 D: I: 161, C: 157 E: I: 23; C: 18 F: I: 48; C: 47
Age A: I(1): 63.8 ± 8.30, I(2): 62.2 ± 9.77, C: 69.3 ± 8.27 B: I: 68.0 (8.5), C: 68.2 (9.0) C: I: 61.06 ± 9.12, C: 64.67 ± 8.52 D: I: 70.4 (8.0); C: 70.8 (8.4) E: I: 66.3 (range: 50–85), C: 70.9 (59–86) F: I: 75.0 (8.0); C: 75.4 (6.9)
Sex n/N (%) male A: I-1: 11/19 (58%); I-2: 15/21 (71%); C 15/21 (71%) B: I: 109/168 (65%); C: 116/154 (75%) C: I-1: 10/16 (63%), I-2: 14/23 (61%), C: 12/18 (67%) D: I: 112/161 (70%); C: 110/157 (70%) E: 13/18 (72%), C: 15/23 (65%) F: 32/47 (68%); C: 28/46 (61%)
Patients/eyes A: One eye was selected and treated as study eye. B: not reported C: patients (one eye per patient) D: patients (one eye per patient) E: patients F: patients (only 1 eye per patient was included in the Study)
Groups comparable at baseline? A: slight numerical difference was observed with respect to the baseline mean CRT (highest for the combination group) and mean BCVA (lowest in the ranibizumab monotherapy group B: yes C: yes D: yes E: not reported F: yes |
PDT with or without anti-VEGF
A-1: verteporfin PDT (6 mg/m2) + ranibizumab 0.5 mg. A-2: verteporfin PDT (6 mg/m2) + sham injection PDT protocol: Standard fluence 6 mg/m2 689-nm wavelengths 600 mW/cm2 irradiance, 83 s
B: vPDT + ranibizumab, 0.5 mg PDT protocol: Standard fluence 6 mg/m2 689-nm wavelengths 600 mW/cm2 irradiance, 83 s
C-1: verteporfin PDT + ranibizumab C-2: vPDT monotherapy PDT protocol: Standard fluence 6 mg/m2 689-nm wavelengths 600 mW/cm2 irradiance, 83 s
D: PDT + intravitreal aflibercept injection PDT protocol: According to the current Visudyne package labeling
E: PDT + bevacizumab PDT protocol: not reported
F: Verteporfin PDT PDT protocol: Standard fluence 6 mg/m2 689-nm wavelengths 600 mW/cm2 irradiance, 83 s
|
Anti-VEGF monotherapy
A: monthly ranibizumab 0.5 mg x 3 + sham PDT
B: monthly ranibizumab, 0.5 mg x 3
asculopathmab 0.5 mg x 1
D: intravitreal aflibercept injection 2mg x 3 + sham PDT
E: bevacizumab 0.05 ml every 6 weeks
F: monthly ranibizumab 0.5 mg x 3
|
End-point of follow-up: A: 6 months B: 12 months C: 12 months D: 13 months E: 12 months F: 12 months
For how many participants were no complete outcome data available? (intervention/control) A: 1 (I1)/1 (I2) B: 10/18 C: not reported D: 7/12 E: 6/47 F: 3/7
|
Visual acuity Defined as
A: mean change in BCVA from baseline to 6 month FU I-1: 10.9 ± 10.9 letters I-2: 7.5 ± 10.7 letters C: 9.2 ± 12.4 letters
B: mean change in BCVA from baseline to 12 month FU C: 5.1 letters Mean difference: 3.2 (95% CI: 0.4 to 6.1) letters
C: changes in logMAR VA during the 12-month follow-up I-1: the mean logMAR VA significantly increased from 0.94 ± 0.55 at the baseline to 0.81 ± 0.43, 0.72 ± 0.44, 0.68 ± 0.45, 0.68 ± 0.43, 0.69 ± 0.42, 0.72 ± 0.44 at follow-up of month 1, 2, 3, 6,9 and 12, respectively. I-2: the mean logMAR VA significantly increased from 0.90 ± 0.52 at the baseline to 0.85 ± 0.55 (month 1), 0.76 ± 0.52 (month 2), 0.71 ± 0.55 (month 3), 0.69 ± 0.54 (month 6), 0.75 ± 0.60 (month 9), and 0.75 ± 0.57 (month 12), respectively C: the baseline logMAR VA was 0.96 ± 0.58, which improved to 0.87 ± 0.61, 0.79 ± 0.54, 0.70 ± 0.51, 0.72 ± 0.45, 0.72 ± 0.43, 0.77 ± 0.41 at month 1, 2, 3, 6,9, and 12, respectively.
D: mean change in BCVA from baseline to 12 month FU I: 10.8 (10.7) C: 10.7 (11.3) 95% CI: −2.9 to 1.6
E: Only described in figures/text: Comparisons by treatment modality (Fig. 1A, B) showed no statistically significant difference in BCVA (p = 0.691) between the anti-VEGF monotherapy and PDT+anti-VEGF groups.
F: changes in logMAR from baseline to month 12 I: The proportion of patients who gained 0.2 logMAR units, demonstrated no change, or lost 0.2 logMAR units was 17.0%, 55.3%, and 27.7%. C: The proportion of patients who gained 0.2 logMAR units, demonstrated no change, or lost 0.2 logMAR units was 30.4%, 60.9%, and 10.9%. Results were significantly better in the ranibizumab arm (P = .039). When we judged the change of VA by 0.3 logMAR units, the superiority of ranibizumab remained the same (P = .024).
Retinal thickness Defined as
A: mean change in CRT from baseline to Month 6 (µm) I(1) −145.6 ± 119.0 I(2) −98.1 ± 104.3 C −65.7 ± 114.3
B: mean Central Subfield Thickness (CSFT) Change from baseline to month 12. I: −164.9 μm C: −113.4 μm P<0.001
C: Central foveal thickness (CFT) was the average value of the vertical and horizontal foveal thickness which were measured manually from the inner retinal surface to the RPE line. I-1: 522.63 ± 288.40 μm at the baseline to 342.13 ± 106.82 μm, 320.13 ± 106.94 μm, 320.75 ± 112.60 μm, 312.75 ± 89.15 μm, 324.56 ± 94.77 μm, and 328.44 ± 103.25 μm at time-point of month 1, 2, 3, 6, 9, and 12, respectively in the combination group (all P < 0.05 at each time-point of follow-up). I-2: CFT at baseline was 478.04 ± 156.70 μm, which decreased significantly to 382.35 ± 145.68 μm (month 1, P < 0.01), 352.91 ± 140.81 μm (month 2, P < 0.01), 343.74 ± 144.79 μm (month 3, P < 0.01), 346.09 ± 144.79 μm (month 6, P < 0.01), 361.65 ± 154.18 μm (month 9, P < 0.01), and 366.43 ± 148.28 μm (month 12, P < 0.05), respectively. C: 527.5 ± 195.90 μm at the baseline to 415.78 ± 205.93 μm (P < 0.05), 334.5 ± 126.99 μm (P < 0.01), 329.17 ± 106.27 μm (P < 0.01), 350.67 ± 130.6 μm, 350.11 ± 115.89 μm (P < 0.01), and 373.17 ± 134.88 μm (P < 0.01) at time-point of month 1, 2, 3, 6, 9, and 12, respectively.
D: reduction in central subfield thickness (CST) from baseline to week 52 I: −143.5 μm C: −137.7 μm Difference: 1.1; 95% CI, −9.2 to 11.3; P = 0.84)
E: changes in central foveal thickness (CFT) over 12 months. Only described in text/figures: There was no statistically significant between-group difference at any follow-up visit (CFT: p = 0.176).
F: central retinal thickness (CRT) with 12 month FU I: CRT decreased from 366.8 μm to 289.1 μm. C: CRT decreased from 418.9 μm to 311.2 μm. Both arms demonstrated significant improvement at the initial visit after treatment and maintained the effect throughout the study period. The change of CRT was not significantly different between the 2 arms (P=0.115).
Treatment interval Defined as
A: mean number (sd) of ranibizumab/sham treatment from baseline to Month 5 I(1): 3.9 (1.4) I(2): 4.2 (1.2) C: 5.2 (1.2)
B: mean (sd) number of ranibizumab injections administered up to month 12 I: 5.2 (2.49) C: 7.3 (3.32)
C: mean (sd) numbers of the intravitreal injections during the 12-month follow-up (including the loading phase). I-1: 2.38 (1.09) I-2: 0 C: 3.83 (1.20) (P < 0.01)
D: mean number of IAIs over 52 weeks I: 8.0 C: 8.1
E: Only reported in text: the addition of PDT did not reduce the number of bevacizumab injections either among all patients (n = 41, p = 1.000).
F: not reported.
Complete polyp regression rate
A: I (1): 15/18 (83.3%) I (2): 18/21 (85.7%) C: 9/21 (42.9%)
B: I: 116/168 (69.3%) C: 53/154 (34.7%) C: I (1): 6/16 (37.5%) I (2): 14/23 (60.87%) C: 4/18 (22.22%)
D I: 72/161 (44.8%) C: 61/157 (38.9%)
Partial regression rate
A: I (1): 7/16 (43.75%) I (2): 4/23 (17.39%) C: 4/18 (22.22%)
|
Brief description of author’s conclusion This network meta-analysis revealed that early combination therapy exhibited better efficacy related to anatomical outcomes than other therapies. Nonetheless, no significant differences related to BCVA change could be detected between anti-VEGF and late combination therapy.
Excluded Gomi (2015): comparison of Early combination therapy (ECT) with Late combination therapy (LCT)
Lai (2018) had a third arm: Verteporfin PDT monotherapy (this arm was not included in our analyses). |
|
Zhao, 2020
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to January 2020
RCTs that were not included in Chi (2021):
A: Wong, 2019 (PLANET) B: Takahashi, 2018 (EVEREST II)
Study design: RCT
Setting and Country: A: Asia and non-asian (not specified) B: Asia (not specified)
Source of funding and conflicts of interest: No conflict of interest declared. Source of funding not reported.
|
Inclusion criteria SR: (1) research studies described the complete regression rate of polyps in PCV patients (2) the studies included at least one of the following items: baseline characteristics of PCV, the regression rate of PED, best-corrected visual acuity (BCVA) improvement rate, the rate of BCVA gain or loss more than 3 lines, dry macula, and polyp recurrence.
Exclusion criteria SR: 1) articles without information about polyp regression rate; (2) articles with sample size less than 10; (3) reviews, commentary articles, animal studies or case reports; (4) redundant publications.
104 studies included, of which 2 were included in our analyses (2 RCTs that met our PICO and were not included in Chi (2021)) Important patient characteristics at baseline: N, mean age±SD A: 72.9 ± 7.4 B: 70.6 ± 8.2
Sex (M/F): A: 222/96 B: 66/18
Patients/eyes A: 318/318 B: 84/84
Groups comparable at baseline? A: Yes B: Yes |
PDT with or without anti-VEGF
A: intravitreal aflibercept 3 every 1 month/photodynamic therapy PRN B: intravitreal ranibizumab 3 + pro re nata/photodynamic therapy 1+ pro re nata |
Anti-VEGF monotherapy
A: intravitreal aflibercept B: intravitreal ranibizumab 3+ pro re nata / shame
|
End-point of follow-up: A: 24 months B: 12 months
For how many participants were no complete outcome data available? A: not reported B: not reported
|
Visual acuity A: mean change from baseline, at week 96 I: +9.1 letters C: +10.7 letters least-squares mean [LSM] difference 0.9 (95% CI –1.7 to 3.6); P = .48
B: mean change from baseline at month 12 I: +8.5 (±11.14) letters C: +6.4 (±9.82) letters
Retinal thickness A: Not reported B: Not reported
Treatment interval A: Proportion of patients with ≥1 treatment interval extended to ≥10 weeks, at week 96 I: 80/154 (51.9%) C: 84/145 (57.9%)
Proportion of patients with ≥1 treatment interval extended to ≥12 weeks, at week 96 I: 57/154 (37.0%) C: 60/145 (41.2%)
B: Not reported
Complete regression rate
A: I: 72/161 (44.8%) C: 61/157 (38.9%)
B: I: 116/168 (69.3%) C: 53/154 (34.7%)
Difference: -6.0 (95% CI -17.8 to 5.9) |
Author’s conclusion: Wong (2019): AI monotherapy was noninferior to IAI with rescue PDT up to 96 weeks, and functional and anatomical improvements achieved at 52 weeks were maintained. Few patients required rescue PDT, which provided no additional visual benefit.
Takahashi (2018): The results from the Japanese cohort were in agreement with the EVEREST II study. Combination therapy was effective in improving BCVA and achieving a higher rate of complete polyp regression with a lower number of ranibizumab injections than monotherapy. No new safety signals were reported, and safety events were comparable between both arms over 12 months.
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias tables
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Chi, 2021 |
Yes |
Yes |
No.
Included studies were described, but excluded studies were not described. |
Yes |
Not applicable |
Yes.
GRADE assessment. |
Unclear |
No |
Yes |
|
Zhao, 2021 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes.
Newcastle-Ottawa scale |
Unclear |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies
(randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Lim, 2020 |
Probably yes
Reason: A randomization list will be produced using a validated system that automates the random assignment of treatment arms to randomization numbers in the specified ratio. |
Probably yes
Reason: A randomization list will be produced using a validated system that automates the random assignment of treatment arms to randomization numbers in the specified ratio. |
Probably yes
Reason: patients, data collectors, outcome assessors were blinded. Healthcare providers were not blinded. It was not clear whether data analysts were blinded. |
…
Reason: |
Definitely yes
Reason: all relevant outcomes were reported |
Definitely no
Reason: role and involvement of sponsor: In conjunction with the EVEREST II study group, Novartis Pharma AG participated in the design of the study; analysis and interpretation of the data; preparation, review, and approval of the manuscript; the decision to submit the manuscript for publication; the conduct of the study; and oversight of the collection and management of data.
Patients randomized in the monotherapy group were eligible to switch to combination therapy in year 2 for ethical reasons to offer therapeutic benefit. Fourteen of 41 eligible patients (of 154 in monotherapy arm) switched. Analyses were performed intention-to-treat. |
High
|
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Amoaku (2015) |
Wrong study design (narrative review) |
|
Anantharaman (2018) |
Wrong publication type (guideline) |
|
Ba (2015) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Chaikitmongkol (2021) |
Wrong study design (retrospective observational study) |
|
Chen (2020) |
Wrong publication type (consensus report) |
|
Elshout (2018) |
Does not match PICO (no comparison with anti-VEGF mono-therapy), outcome is costs |
|
Gao (2018) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
George (2014) |
Does not match PICO (no comparison of PDT vs anti-VEGF) |
|
Han (2017) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Hikichi (2021) |
Wrong study design (retrospective observational study) |
|
Jian (2013) |
Wrong study design (narrative review) |
|
Kim (2017) |
Wrong study design (narrative review) |
|
Koh (2013) |
Wrong study design (report of expert meeting) |
|
Kolomeyer (2018) |
Full-text not available |
|
Miki (2021) |
Wrong study design (retrospective observational study) |
|
Lindsley (2016) |
Does not match PICO (no comparison of PDT vs anti-VEGF) |
|
Liu (2015) |
Does not add studies to (de SR die we kiezen om uit te werken) |
|
Liu (2017) |
Included only non-randomized studies |
|
Liu (2018) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Pron (2014) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Qian (2018) |
Does not add studies to (de SR die we kiezen om uit te werken) |
|
Sartini (2020) |
Full-text not available |
|
Sivaprasad (2013) |
Wrong study design (narrative review) |
|
Solomon (2019) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Su (2018) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Tang (2015) |
Does not add studies to (de SR die we kiezen om uit te werken) |
|
Thomas (2013) |
Wrong study design (narrative review) |
|
Tranos (2013) |
Wrong study design (narrative review) |
|
Tsai (2017) |
Wrong study design (narrative review) |
|
Velez-Montoya (2013) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Wang (2013) |
Chinese language |
|
Wang (2014) |
Wrong comparison (PDT + anti-VEGF vs. PDT alone) |
|
Wei (2018) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Wong (2015) |
Full-text not available |
|
Xu (2013) |
Wrong study design (narrative review) |
|
Yong (2015) |
Does not add studies to Chi (2021) and Zhao (2020) |
|
Zhang (2018) |
Wrong study design (protocol article) |
|
Zhao (2017) |
Does not match PICO (no comparison with anti-VEGF mono-therapy) |
|
Zhao (2021) |
Does not add studies to Chi (2021) and Zhao (2020) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-08-2023
Beoordeeld op geldigheid : 17-07-2023
Algemene gegevens
De herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Werkgroep
- Dr. R. van Leeuwen, oogarts, Universitair Medisch Centrum Utrecht, Utrecht (NOG, voorzitter)
- Prof. dr. C.C.W. Klaver, oogarts en hoogleraar, Erasmus Medisch Centrum, Rotterdam (NOG)
- Dr. P.H.B. Kok, oogarts, Bergman Clinics, Amsterdam (NOG)
- Dr. J.J.C. van Lith-Verhoeven, oogarts, Elisabeth-TweeSteden Ziekenhuis, Tilburg (NOG)
- Dr. F.D. Verbraak, oogarts, Amsterdam Universitair Medisch Centrum, Amsterdam (NOG)
- Dr. A.C. Lambooij, oogarts, Reinier de Graaf Gasthuis, Delft (NOG)
- Drs. E.A. Huiskamp, oogarts, Universitair Medisch Centrum Groningen, Groningen (NOG)
- Drs. O.A.M. Tigchelaar-Besling, oogarts, Amphia Ziekenhuis, Breda (NOG)
- Drs. L.J. Noordzij, oogarts, Oog Op Zuid, Rotterdam (NOG)
Klankbordgroep
- M.E. Diepman-Leerdam, optometrist, Bergman Clinics, Doetichem (OVN)
- H.J. Jansen-Molenaar, adviseur oogzorg (Oogvereniging) (tot 01-09-2022)
- P. Kortenhoeven, waarnemend coördinator oogzorg (Oogvereniging) (vanaf 01-09-2022)
- H.M.M.J. Schoots, voorzitter MaculaVereniging (MaculaVereniging)
Met ondersteuning van
- Dr. A. van der Hout, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. B.L. Gal-de Geest, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen acties |
|
van Leeuwen * |
Oogarts, netvliesspecialist, in het UMC Utrecht. |
Bestuur Vitreoretinale werkgroep, onbetaald Voorzitter Projectgroep Duurzame Oogheelkunde Vertegenwoordiger namens NOG in Landelijke Netwerk Groene OK, onbetaald |
* Ik doe op dit moment niet mee aan door industrie gesponsorde studies. Wel begeleid ik op dit moment wetenschappelijk onderzoek naar LMD welke betaald wordt door een particulier fonds (Stichting AmphoraEst). Deze stichting heeft geen belang bij het advies of de richtlijn, anders dan optimale zorg voor LMD patiënten. Ik heb geen intellectuele of reputatie belangen bij deze richtlijn commissie, anders dan erkenning als professional. * Ik zet mij actief en publiekelijk in voor verduurzaming van de gezondheidszorg, zowel binnen mijn eigen ziekenhuis als landelijk. Hierbij zijn er raakvlakken met de onderhavige richtlijn. * In het verleden heb ik een financiële vergoeding voor presentaties op gesponsord symposium of nascholing ontvangen. Sinds 2018 niet meer. |
Geen restricties |
|
Noordzij |
Werkzaam als oogarts o.a. in het zelfstandig behandelcentrum Oog op Zuid Oogkliniek. Lid van de Coöperatie Oogheelkunde op Zuid U.A. en voorzitter van het bestuur van de Coöperatie Oogheelkunde op Zuid U.A. Bestuurder bij de Stichting Oogheelkunde op Zuid. Medisch directeur bij het zelfstandig behandel Oog op Zuid Oogkliniek. |
De afgelopen maanden in samenwerking met Novartis een enquete opgesteld voor uirvragen hoe er in Nederland intravitreaal geïnjecteerd wordt. Names het Maasstad Ziekenhuis lid van de werkgroep "Santeon dure geneesmiddelen maculadegeneratie". Lid FMS/ NOG werkgroep Cluster Oog (onbetaald). |
Het Maasstad Ziekenhuis nam deel aan de Raven studie van Novartis to 2020. Ik was daarvan voor de locatie Maasstad ziekenhuis de principal investigator. |
Geen restricties |
|
Verbraak |
Oogarts, Amsterdam Universitair Medisch Centrum |
Voorzitter stuurgroep FRB!NL, niet betaald.Ik ben onbezoldigd voorzitter FRB!NL, een project dat gesteund wordt door Bayer, waar nu alleen nog financiering gaat naar advocaten kantoor (via Oogfonds) voor uitwerking agreement tussen deelnemende NL centra en universiteit van Sydney (SSR project). |
Betaald adviseur: Bayer, Novartis, IDxDR, UCB. vergoeding voor deelname (voorzitter) aan werkgroep die de toekomst van oogheelkunde in kaart wil brengen, project van Novartis, dit beslaat gehele oogheelkunde. Ontwikkeling Qualiteit van Visueel Functioneren questionair, AUMC, grant van Bayer. Ik werk mee aan project om een computer assisted test toe te passen als maat voor kwaliteit van leven/visus bij patiënten, die anti-VEGF injecties krijgen, dit wordt gesteund door Bayer, PI is Ruth van Nispen, onderzoekster wordt (deels) betaald. |
Uitgesloten van besluitvorming bij modules over anti-VEGF. Novartis project over toekomst oogheelkunde: geen belangenverstrengeling. |
|
Van Lith-Verhoeven |
Oogarts ETZ (medisch manager oogheelkunde ETZ) |
Lasik centrum Boxtel: ooglidcorrecties |
Adviescommissie Novartis, Bayer en allergan Organisatie congres Novartis en Bayer Honarium voor eigen presentatie Bayer. 1 advies bijeenkomst oogvitaal bv 1 advies bijeenkost horus pharma (betaald) 1 advies bijeenkomst Roche 1 advies bijeenkomst Roche en co-auteur aan expert opinion T & E.
Extern gefinancierd onderzoek: Novartis, Roche, Chengdu Kanghong biological science, Bayer. Het zijn studies van verschillende sponsoren met verschillende medicijnen, zowel op gebied AMD, DME en RVO. We hebben maar enkele deelnemers per studie. Het geld wat we ontvangen gedurende de studieduur gebruiken we om de studie coordinator (trial nurse) en de medewerkers (TOA's, optometristen) te betalen voor de tijd die ze in het onderzoek stoppen. Dat verekenen we dus met het ziekenhuis.
1 advies bijeenkomst oogvitaal bv 1 advies bijeenkost horus pharma (betaald) 1 advies bijeenkomst Roche 1 advies bijeenkomst Roche en co-auteur aan expert opinion T & E. |
Uitgesloten van besluitvorming bij modules over anti-VEGF.
|
|
Huiskamp |
Oogarts, netvliesspecialist in het Universitair Medisch Centrum Groningen |
Geen |
*Annexin Pharmaceuticals, Onderzoek naar moleculair imaging bij patiënten met retinale veneuze occlusie of diabetische retinopathie. SIGHT studie. Kosten voor de afdeling oogheelkunde worden gefinancierd door Annexin Pharmaceuticals. Deelname als onderzoeker aan deze studie (geen projectleider). * Bayer, Multicenter onderzoek naar medicijn voor diabetische retinopathie. NEON-NPDR studie. Kosten voor de afdeling oogheelkunde worden gefinancierd door Bayer. Deelname als onderzoeker aan deze studie (geen projectleider). * Heidelberg Engineering, Onderzoek naar moleculair imaging bij patiënten met neovasculaire LMD. LEAF studie. Financiering door het UMCG zelf. Apparatuur is voor deze studie ter beschikking gesteld door Heidelberg Engineering. Deelname als onderzoeker aan deze studie (geen projectleider). |
Geen restricties |
|
Kok |
Oogarts, medisch retina speciliast Bergamn Clinics Ogen Amsterdam UMC |
Geen |
Geen |
Geen restricties |
|
Lambooij |
Oogarts, Reinier de Graaf ziekenhuis Delft |
Gastdocent TOA opleiding Dutch Health Tec Academy Utrecht, betaald |
Geen |
Geen restricties |
|
Tigchelaar |
Oogarts |
Consultent oogarts bij visio R&A, betaald Consultent oogarts bij visio school, betaald Werkgroep FRB, onbetaald Eenmalige meet the expert bijeenkomst, uren vergoeding Voor novartis voorafgaand introductie van broculizumab. Broculizumab wordt gebruikt bij amd, in het voorstadium van de introductie was een meet the expert bijeenkomst om van een oogarts in het veld te horen wat overwegingen zijn voor beslissingen in de praktijk. Introductie in nederland in 2020. Honorering was alleen uren vergoeding. |
Geen |
Uitgesloten van besluitvorming bij modules over anti-VEGF, mocht wel meelezen als er geen andere experts waren. |
|
Klaver |
Erasmus MC, 0.6FTE, Hoogleraar Radboudumc, 0.4FTE, Oogarts University of Basel (locatie IOB, Basel), 0.15FTE, Hoogleraar |
Lid bestuur van Euretina, Europese vereniging voor retina specialisten, onbetaald Lid bestuur Landelijke Stichting voor Blinden en Slechtzienden (LSBS), onbetaald Lid bestuur Rotterdamse Oogheelkundig Onderzoek Stichting (ROOS), onbetaald Lid bestuur Collaborative Ophthalmic Research Rotterdam (CORR), onbetaald,
Betaald op projectbasis: Consultant voor TheaPharma Consultant voor Bayer |
* Ik maak geen deel uit van onderzoek geïnitieerd door het bedrijfsleven. Wel financiert Bayer een deel van de ontwikkeling van AI algoritmen die wij gebruiken voor het beoordelen van oogheelkundige beelden in ons EyeNED reading center. Bayer heeft geen invloed op deze algoritmen. Algoritmen hebben deels betrekking op LMD. Echter, Bayer is geen producent/leverancier van AI software. * Ik heb geen persoonlijk gewin bij, ander dan persoonlijke erkenning van mijn expertise als clinicus en als wetenschappelijk onderzoeker in dit vakgebied. De LSBS is een slechtziendenstichting die weinig patiënten met maculadegenratie als lid heeft. Mijn grootste inbreng voor de commissie is mijn expertise op het gebied van genetica, voeding en leefstijl. * Ik organiseer 1x per jaar nascholingsdagen voor de werkgroep Medische Retina. Deze nascholingen worden door Bayer gefinancierd. Bayer heeft geen invloed op de inhoud van deze nascholing. Ik geef 1x per jaar lezingen die georganiseerd worden door de firma Thea Pharma voor Europese oogartsen. Deze lezingen gaan over dieet adviezen voor maculadegeneratie. *Het IOB instituut in Basel is opgericht als een samenwerking tussen de Universiteit van Basel, het universiteitsziekenhuis van Basel, en Novartis. Novartis heeft geen zeggenschap over de wetenschappelijke koers en de onderzoeken die IOB uitvoert. Werknemers van IOB hebben geen financiele relatie met Novartis en leggen geen verantwoording af aan deze partij. |
Uitgesloten van besluitvorming bij modules over anti-VEGF.
|
|
Diepman-Leerdam |
Optometrist werkzaam bij Berman Clinics Doetinchem |
Niet van toepassing |
Geen |
Geen restricties |
|
Jansen Molenaar |
Adviseur oogzorg |
Niet van toepassing |
Geen |
Geen restricties |
|
Schoots-Wilke |
Voorzitter MD |
Vrienden van Walstede - onbetaald |
Voorzitter patiëntenvereniging |
Geen restricties |
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Symptomen van LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Fasering diagnostiek van LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module OCT |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module FAG |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module ICG-angiografie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module OCT-angiografie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Indicaties en contra-indicaties voor anti-VEGF behandeling bij neovasculaire LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Keuze van anti-VEGF middel |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Chirurgie bij submaculaire bloeding |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij polypoidale choroidale vasculopathie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij retinale angiomateuze proliferatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij chronische centrale sereuze chorioretinopathie met subretinale neovascularisatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij non-responders op anti-VEGF therapie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Thermische laserbehandeling |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cataractextractie bij patiënt met neovasculaire LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Behandelstrategie voor anti-VEGF medicatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Instructies aan patiënt voor herkennen reactivatie van maculaire neovascularisatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Criteria om te stoppen met anti-VEGF behandeling |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Criteria voor het veranderen van anti-VEGF middel |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Voedingsadvies ter preventie van LMD progressie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Leefstijladviezen ter preventie van LMD progressie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Bloedverdunners bij LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Advies aan familieleden van een patiënt met LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Intravitreale injecties |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Verwijzing naar oogarts |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Verwijzing voor hulpmiddelen en revalidatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informed Consent |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informed consent voor de behandeling met off-label bevacizumab (Avastin®) |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informatievoorziening aan patiënten en naasten |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Rol van de patiëntenvereniging |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland, MaculaVereniging en Oogvereniging voor de schriftelijke knelpuntenanalyse en het afgevaardigde patiëntenverenigingen in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de MaculaVerening en Oogvereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met leeftijdsgebonden maculadegeneratie (LMD). De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijnmodule (NOG, 2014]) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de IGJ, Zorginstituut, OVN en Oogvereniging via enquête.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zou de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J [corrected to Schünemann, Holger J]. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Literature search strategy
Embase
|
No. |
Query |
Results |
|
#13 |
#10 OR #11 OR #12 |
509 |
|
#12 |
#6 AND #9 NOT (#10 OR #11) = observationeel |
282 |
|
#11 |
#6 AND #8 NOT #10 = RCT |
162 |
|
#10 |
#6 AND #7 =‘SR |
65 |
|
#9 |
'major cli’ical st‘dy'/de OR 'cli’ical st‘dy'/de OR 'case co’trol st‘dy'/de OR 'f’mily st‘dy'/de OR 'longitu’inal st‘dy'/de OR 'retrospe’tive st‘dy'/de OR 'prospe’tive st‘dy'/de OR 'compar’tive st‘dy'/de OR 'coho’t analysis'/de OR ((cohort NEAR/1 (study OR studies)):a‘,ti) OR (('c’se control' NEAR/1 (study OR studies)):a‘,ti) OR (’'follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):a‘,ti) OR (('cros’ sectional' NEAR/1 (study OR studies)):ab,ti) |
64‘5735 |
|
#8 |
('cli’ical tri‘l'/exp OR 'ra’domizati‘n'/exp OR 'single blin’ procedu‘e'/exp OR 'double blin’ procedu‘e'/exp OR 'crossove’ procedu‘e'/exp ’R 'place‘o'/exp OR 'prospe’tive study'/exp OR rct:ab,ti OR random‘:ab,ti OR 's’ngle blind‘:ab,ti OR 'randomised contr’lled trial‘:ab,ti OR 'randomized contr’lled trial'/exp OR placebo*:‘b,ti) NOT 'conferen’e abstract':it |
250‘470 |
|
#7 |
('me’a analys‘s'/exp OR 'meta analy’is (topic)'/exp OR metaanaly‘:ti,ab OR '’eta analy*':ti,ab OR metanaly‘:ti,ab OR 'system’tic rev‘ew'/de OR 'cochrane database of systema’ic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR u‘brella OR 'structured’literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR da‘abase* OR ’data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database‘:ti,ab OR ’data base*':ti‘ab)) OR (('data’extraction‘:ti,ab OR 'd’ta source*':‘i,ab) AND 'stud’ selection':‘i,ab) OR ('sear’h strategy'‘ti,ab AND 'selecti’n criteria':‘i,ab) OR ('d’ta source*'‘ti,ab AND 'dat’ synthesis':ti,ab) OR medline:ab OR pubmed:ab OR emasculopOR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR datab‘se*:ab OR ’data base*':ab)) OR metasynthes‘:ti,ab OR 'me’a synthes*':ti‘ab) NO’ (('anim‘l'/exp OR 'animal’experime‘t'/exp OR 'a’imal mod‘l'/exp O’ 'nonhuman‘/exp)’NOT 'human'‘exp) NOT ('conferen’e abstr‘ct'/it OR 'confer’nce rev‘ew'/it OR’'editor‘al'/it’OR 'let‘er'/’t OR 'note'/it) |
533576 |
|
#6 |
#4 AND #5 AND [2013-202‘]/py NOT ('conferen’e abstr‘ct'/it OR’'editor‘al'/it’OR 'let‘er'/’t OR 'note'/i‘) |
752 |
|
#5 |
'photodyna’ic therapy'‘exp/mj OR 'photodynamic the’apy device'‘exp/mj OR 'photosensit’zing agent'‘exp/mj OR '’erteporfin'/exp OR ((photodynamic NEAR/2 (therap* OR treatment*)):ti,ab,kw) OR pdt:ti,ab,kw OR photosensiti*:t‘,ab,kw OR 'v’rteporfin*':t‘,ab,kw O’ 'visudyne':ti,ab,kw |
69857 |
|
#4 |
#1 OR #2 OR #3 |
‘4684 |
|
#3 |
'subretinal neovasc’larization'/exp/mj OR (((choroidal OR subretinal OR retinal) NEAR/2 (neovasculari‘ation* OR 'neo-vascu’ari*ation*')):ti‘ab,kw) OR 'pachychoroid neov’sculopathy'‘exp/mj OR 'pachychoroid neov’sculopath*':t‘,ab,kw OR 'central serous ’etinopathy'‘exp/mj OR 'centasculopath ’etinopath*':t‘,ab,kw OR 'centrasculopathyathyo’etinopath*':ti,‘b,kw OR (('age related macular d’generati‘n'/exp OR 'wet macular d’generation'/exp OR amd:t‘,ab,kw OR 'macular d’generation':ti,ab,kw) AND (neovascular:t‘,ab,kw OR 'n’o-vascular':ti,ab,kw))‘ |
20381 |
|
#2 |
'retinal angiomatous pr’liferati‘n'/exp OR 'retinal angiomatous pr’liferation':ti,ab,kw OR rap:ti,ab,k‘ |
7888 |
|
#1 |
'polypoidal choroidal v’sculopat‘y'/exp OR 'polypoidal choroidal v’sculopath*':t‘,ab,kw OR 'polypoidal choroidal neo-vascu’ari*ation*':t‘,ab,kw OR 'polypoidal choroidal neovascu’ari*ation*':ti,ab,kw OR pcv:t‘,ab,kw OR 'pol’poidal cnv':ti,ab,kw |
10028 |
Ovid/Medline
|
# |
Searches |
Results |
|
14 |
11 or 12 or 13 |
501 |
|
13 |
(7 and 10) not (11 or 12) = observationeel |
329 |
|
12 |
(7 and 9) not 11 = RCT |
118 |
|
11 |
7 and 8 = SR |
54 |
|
10 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort*.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3850793 |
|
9 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trIal, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2294846 |
|
8 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematicasculop or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or “mbrella or "structure” literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,“b,kf. or (("dat” ext“action" or "”ata so“rce*") and "stu”y selection").ti“ab,kf. or ("sea”ch st“ategy" and "select”on criteria").ti“ab,kf. or ("”ata s“urce*" and "da”a synthesis").ti,ab,kf. or (medline or pubmed oasculop or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
517003 |
|
7 |
limit 6 to yr=2013-current |
743 |
|
6 |
4 and 5 |
2522 |
|
5 |
exp Photochemotherapy/ or exp Photosensitizing Agents/ or exp Verteporfin/ or (photodynamic adj2 (therap* or treatment*)).ti,ab,kf. or PDt.ti,ab,kf. or photosensiti*.t‘,ab,kf. or '’erteporfin*'.t‘,ab,kf. ’r 'visudyne'.ti,ab,kf. |
68232 |
|
4 |
1 or 2 or 3 |
38037 |
|
3 |
exp Choroidal Neovascularization/ or exp Retinal Neovascularization/ or ((choroidal or subretinal or retinal) adj2 (neovascular‘*ation* or 'neo-vasc’lari*ation*')).ti,ab,kf. or exp Central Serous Chorioreti‘opathy/ or 'pachychoroid neo’asculopath*'.t‘,ab,kf. or 'cenasculopaths’retinopath*'.t‘,ab,kf. or 'centasculopathyathyi’retinopath*'.ti,ab,kf. or ((Macular Degeneration/ or Wet Macular Degeneration/ or AMd.t‘,ab,kf. or 'macular ’egeneration'.ti,ab,kf.) and (neo‘ascular or '’eo-vascular').ti,ab,kf.‘ |
17052 |
|
2 |
('retinal angiomatous p’oliferation' or rap).ti,ab,kf. |
5135 |
|
1 |
exp *Choroid D‘seases/ or 'polypoidaasculopathy ’asculopath*'.t‘,ab,kf. or 'polypoidal choroidal neo-vasc’lari*ation*'.t‘,ab,kf. or 'polypoidal choroidal neovasc’lari*ation*'.ti,ab,kf. or pcv.t‘,ab,kf. or 'po’ypoidal cnv'.ti,ab,kf. |
21938 |
