Hoofdstuk 6 Voorbehandelen
Uitgangsvraag
Heeft medicamenteuze behandeling met ‘gonadotropin-releasing hormone agonist’ (GnRHa) voorafgaand aan een laparoscopische hysterectomie (LH) in verband met uterus myomatosus invloed op de klinische uitkomsten?
Aanbeveling
Overweeg voorbehandeling met GnRHa bij een LH wegens uterus myomatosus ter volumereductie van de uterus om de kans op complicaties mogelijk te verminderen. Patienten dienen in ieder geval gecounseld te worden voor de voorbehandeling met GnRHa en de bijwerkingen.
Evalueer aan het einde van de voorbehandeling met GnRHa opnieuw of de
gekozen operatiemethode nog de juiste is.
Voorbehandeling met GnRHa dient minstens 3 maanden te bedragen om een effect te bewerkstelligen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Bij de interpretatie van bovenstaande conclusies moet men zich realiseren dat de hoeveelheid beschikbare literatuur voorhanden op dit onderwerp zeer beperkt is. Veel artikelen maken geen onderscheid tussen laparoscopische, laparotomische en vaginale ingrepen, wat de interpretatie met betrekking tot deze richtlijn moeilijk maakt. In het algemeen lijkt het standaard toepassen van een voorbehandeling voorafgaand aan een LH bij een uterus myomatosus een brug te ver aangezien de aangetoonde voordelen op dit moment marginaal zijn.
Daarentegen is de volumereductie substantieel (47%) (Donnez et al. 2012) en kan deze op theoretische gronden bijdragen aan minder conversies en minder lastige ingrepen. Er dient dus een afweging gemaakt te worden tussen het verwachte effect van de GnRHa (bijvoorbeeld bij twijfel of een VH of LH haalbaar is) en de bijwerkingen en kosten van dit medicijn. Derhalve dienen patienten gecounseld te worden over de behandeling en bijwerkingen. Ook kunnen andere preoperatieve parameters een rol spelen (bijvoorbeeld ernstige anemie door hevig menstrueel bloedverlies onderdrukken voor OK om de patiënt in een betere conditie te krijgen). Voorschrijven van GnRHa voorafgaand aan een hysterectomie dient dus geïndividualiseerd te worden. Op basis van de literatuur concludeert de werkgroep dat wanneer besloten wordt tot voorbehandeling over te gaan, deze minimaal 3 maanden gegeven moet worden om een effect te bewerkstelligen. De termijn van 3 maanden is gebaseerd op verschillende studies ten aanzien van dit onderwerp. Langer voorbehandelen dan 3 maanden lijkt geen extra voordelen te hebben, echter de literatuur hierover is zeer beperkt.
De overwegingen zullen in detail hierna besproken worden per klinische uitkomst.
Complicaties
Serrachioli et al. (2003) laat een absoluut verschil van 0/31 in de groep die voorbehandeld is versus 7/31 complicaties in de niet behandelde groep zien. Dit is een aanzienlijk verschil, maar hierbij gaat het bij 4 patiënten om een temperatuur >38 graden waarbij de klinische relevantie wellicht minder is. Bij de andere 3 patiënten gaat het om een bloedtransfusie wat mogelijk iets zegt tav de hoeveel peroperatief bloedverlies, echter dit wordt niet in detail beschreven in deze studie.
Lethaby (2017) beschrijft een verschil in complicaties van 12.4% in de voorbehandelde groep versus 19.4% in de controlegroep. Helaas is er geen informatie beschikbaar over het type complicaties.
Een verschil in complicaties (tussen wel en niet voorbehandelen) moet men beschouwen als een klinische (zeer) belangrijke uitkomst, helaas wordt er in de studies geen onderscheid gemaakt tussen het type hysterectomie en het type complicaties wat goede interpretatie van de resultaten lastig maakt.
Voor een patiënte kan het risico op het wel of niet krijgen van een complicatie een belangrijke factor/overweging zijn om wel of niet te besluiten voor voorbehandeling (ongeacht de bijwerkingen van de voorbehandeling).
Conversies
In de studie van Serrachioli et al. (2003) is het wel opvallend dat in de groep die niet voorbehandeld is 3 conversies naar laparotomie plaatsvonden terwijl in de groep met GnRHa dit niet voorkwam. Dit conversiepercentage van 9,7% is hoger dan over het algemeen wordt beschreven in de literatuur (4,6%) (Blikkendaal et al. 2013; Twijnstra et al. 2013; Twijnstra et al. 2012). De aantallen zijn te klein om hier harde conclusies uit te trekken maar hier zal in de toekomst, met grotere studies verder naar gekeken moeten worden. Toch is vanuit de praktijk de grootte van de uterus vaak de reden om een conversie toe te passen. Bij volumereductie kan dit percentage mogelijk omlaag gebracht worden, zoals -niet significant- ook gedemonstreerd wordt in de kleine studie van Serrachioli (2003). Toekomstig onderzoek zal hier duidelijkheid in moeten brengen.
Operatieduur
Het verkorten van de operatieduur met 30 minuten bij patiënten die voorbehandeld worden
met GnRHa zou een mogelijk voordeel kunnen zijn (Seracchioli et al. 2003). Dit verschil
wordt niet als zodanig gevonden in de systematic review van Lethaby et al. (2001). Hier
wordt een significant verschil gevonden van 10 minuten tussen beide groepen. Er is echter gekozen voor een verschil van 20min als klinisch relevant, derhalve is de verkorting van operatieduur niet klinisch relevant. Bovendien zijn de resultaten lastig te interpreteren, omdat er geen verschil wordt gemaakt tussen LH, AH en VH. Derhalve zijn er geen eenduidige conclusies te trekken met betrekking tot reductie van operatieduur. In de studie van Serrachioli et al. (2003) wordt er een gemiddeld verschil in operatieduur van 30 minuten gezien ten gunste van de groep die voorbehandeld is met GnRHa. In de literatuur is ook aangetoond dat grotere uteri geassocieerd zijn met een langere operatieduur (richtlijn Laparoscopische hysterectomie voor benigne indicaties, hoofdstuk 7 (Driessen et al. 2016a)). Ook is het belangrijk om naar een zo kort mogelijke operatieduur te streven (Hanwright et al. 2013) waardoor voorbehandeling van toegevoegde waarde zou kunnen zijn. Echter, gezien de kleine aantallen in de studie van Serrachioli et al. (2003) specifiek voor LH, is het niet mogelijk om hier verdere conclusies uit te trekken, maar net zoals bij de uitkomstmaat ‘complicatie’ zal dit in de toekomst verder bestudeerd moeten worden.
Bloedverlies peroperatief
Gezien de verschillende methoden van het gemeten bloedverlies en de heterogeniteit tussen de studies werd besloten om de data in de studie van Lethaby (2017) niet te poolen.
Daarbij is er in deze studie geen onderscheid gemaakt tussen laparoscopische, laparotomische en vaginale ingrepen. Derhalve is deze conclusie moeilijk te extrapoleren naar enkel de LH. Er werd echter wel een absoluut verschil in bloedverlies gezien in 4 studies (range 25-148ml). Men kan zich afvragen wat de klinische relevantie van dit verschil in bloedverlies is. Het andere artikel van Serrachioli et al. (2003), gaat niet over bloedverlies, maar over Hb daling. Hier lijkt een klinisch relevant verschil te bestaan tussen wel of niet voorbehandelen. Wel moet in gedachten gehouden worden dat bij deze studie specifiek gekeken wordt naar patiënten met klachten bij een grote uterus myomatosus (> AD 16-20wk), de resultaten zijn om die reden mogelijk niet toepasbaar op patiënten met een kleinere symptomatische uterus myomatosus. Voorbehandeling zou wel kunnen leiden tot een hoger preoperatief Hb ten gevolge van amenorroe, dit valt echter buiten de zoekstrategie.
Kosten
Bij de keuze voor medicamenteuze dan wel chirurgische therapie dient iedere arts de kosten
en baten tegen elkaar af te wegen. Dit werd in het artikel van Farquar et al. (2002) verder
geanalyseerd. Ook hier dient wederom de kanttekening gemaakt te worden dat er geen
onderscheid wordt gemaakt in de verschillende invasieve ingrepen. Ook waren er maar
enkele studies die patiënten met een uterus myomatosus met fundus conform 14 weken
zwangerschap bestudeerden. Mogelijk hebben patiënten met een grote uterus myomatosus
meer voordeel van voorbehandeling met GnRHa wat de kosten zou kunnen rechtvaardigen.
GnRHa vs. Ulipristal en Relugolix
Gezien er geen indicatie meer is voor Ulipristal preoperatief is er voor gekozen om Ulipristal niet in deze module te behandelen. Tevens is Relugolix niet geregistreerd als voorbehandeling voor een LH, derhalve wordt het gebruik hiervan alleen in studieverband aanbevolen.
Add-back therapie bij GnRHa
Het wel of niet adviseren van add-back therapie was geen onderdeel van deze literatuursearch. Dit is echter wel een dagelijks klinisch dilemma, derhalve hebben wij besloten de conclusie van de huidige Cochrane (Moroni et al, 2015) over dit onderdeel mee te nemen in de overwegingen van deze module.
Het toevoegen van add-back therapie zou een gunstig effect kunnen hebben op de vasomotorisch klachten en de botdensiteit, een nadeel zou zijn dat het uterus volume minder afneemt tijdens behandeling met add-back therapie.
Belangrijk hierin is dat de geïncludeerde studies veelal een follow up van 6 maanden beschrijven en niet van enkel 3 maanden behandeling met GnRHa en add-back. Derhalve is het niet met zekerheid te zeggen of bovenstaande uitkomsten ook voor de korte behandelduur van 3 maanden gelden. De voor- en nadelen van het wel of niet toevoegen van add-back therapie voor de relatief korte behandelduur van 3 maanden GnRHa dienen besproken te worden met patiënte en indien gewenst voorgeschreven te worden.
Onderbouwing
Achtergrond
Bij sommige patiënten met uterus myomatosus wordt besloten tot een definitieve oplossing in de vorm van een hysterectomie. Mede door de grote omvang die sommige myomen kunnen bereiken is de ingreep niet altijd eenvoudig laparoscopisch uit te voeren. Door preoperatief myomen medicamenteus te behandelen met GnRH agonisten, is de gedachte, dat door de afname in volume een laparotomie (c.q. conversie) voorkomen zou kunnen worden of een TLH/VH zal kunnen worden uitgevoerd.
Het doel van deze PICO is om te onderzoeken of GnRHa voorafgaand aan LH, de kans op een laparotomie (c.q. conversie) verkleint, de mogelijkheid tot TLH/VH vergroot, de kans op complicatie verkleint, het bloedverlies verlaagt en de operatieduur verkort.
Conclusies / Summary of Findings
Crucial outcome measures
|
Low GRADE |
GnRHa might reduce postoperative complications in women undergoing LH for uterine myomas, although evidence is uncertain.
Sources: Seracchioli, 2003 & Lethaby, 2017 |
|
Very low GRADE |
The effect of GnRH pretreatment versus no pretreatment on conversion to laparotomy in women undergoing LH for uterine myomas is unclear.
Sources: Seracchioli, 2003 & Lethaby, 2017 |
Important outcome measures
|
Low GRADE |
GnRH might reduce operative time in women undergoing LH for uterine myomas, although the difference was not clinical relevant. Sources: Seracchioli, 2003 & Lethaby, 2017 |
|
Very low GRADE |
The effect of GnRH pretreatment versus no pretreatment on perioperative blood loss in women undergoing LH for uterine myomas is unclear. |
|
No GRADE |
None of the studies reported on costs. |
Samenvatting literatuur
Description of studies
Seracchioli (2003) performed a randomized prospective study with the objective to assess if uterine shrinkage induced by GnRHa in women with symptomatic myomas (size 16-20 weeks gestational age) may facilitate total LH. Inclusion criteria were: symptomatic myomas with uterine volume between 16 and 20 weeks gestational age, absence of pelvic pathologies and no therapy with GnRHa agonists or progestational agents or danazol in the past 6 months. A total of 62 patients were assigned at a ratio 1:1 by random selection to receive triptorelin depot injection (Decapeptyl 11.25 mg; Ispen, Milan, Italy) for three months, starting in the midluteal phase, or to no therapy. Demographic values did not differ with mean age and BMI of 47.6 ± 3.5 years and 23.1 ± 2.7 kg/m2 compared to 48.4 ± 4.6 years and 24.4 ± 3.6 kg/m2 in the treatment and control group respectively. These values were not significantly different. Surgical procedures performed were hysterectomy or hysterosalpingo-oophorectomy. No length of follow-up was reported.
The Cochrane review by Lethaby (2017) is an update of the previous version (2001), but with a broadened scope compared to the previous version (see Search and select (Methods)). The objective of the study was to assess effectiveness and safety of medical treatments prior to surgery for uterine fibroids. Inclusion criteria were randomized comparisons of medical treatment versus placebo, no treatment or other medical treatments. For the comparison GnRHa versus no treatment or placebo in women undergoing surgery, 27 studies were included. For comparison 2, GnRHa versus no treatment or placebo in women undergoing hysterectomy and intra/postoperative outcomes, 12 studies were included. 9 studies compared GnRHa to no treatment (Balasch, 1995; Gerris, 1996; Golan, 1993; Hudecek, 2012; Nikolov, 1999; Seracchioli, 2003; Shaw, 1989; Stovall, 1994; Vercellini 1998) and 3 studies compared GnRHa to placebo (Benagiano, 1996; Lumsden, 1994 and Shaw, 1996). For comparison 2, all outcomes were assessed during the procedure (intraoperative) or immediately postoperative.
Results
Crucial outcome measures
- Complications
Seracchioli (2003) reported intra- and postoperative complications in women undergoing laparoscopic hysterectomy. The study did not find cases of intra- or postoperative complications (0/31) in the pretreatment group compared to seven cases in the control group (7/31). Of these cases, four were diagnosed with febrile morbidity (fever >38°C) and three with blood transfusion.
Table 1. Complications, comparison with and without GnRH pretreatment in women undergoing laparoscopic hysterectomy
|
GnRH |
No GnRH |
Odds ratio (95%CI) |
||
|
Events |
Total |
Events |
Total |
|
|
0 |
31 |
7 |
31 |
0.05 (0-0.95) |
Seracchioli, 2003
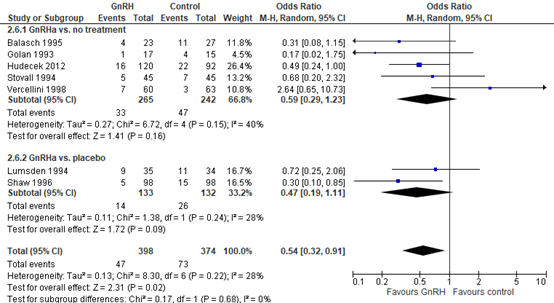
The SR by Lethaby (2017) reported the proportion of postoperative complications in women undergoing hysterectomy. Results were separately assessed for GnRHa versus no treatment and GnRHa versus placebo. In five studies comparing to no treatment, complications were reported in 33/265 (12,4%) in the pretreatment group versus 47/242 (19,4%) in the control group. The pooled analysis showed an OR of 0.59 (95% CI 0.29 to 1.23) (p= 0.16). In two studies comparing to placebo, complications were reported in 14/133 (10,5%) in the pretreatment group versus 26/132 (19,7%) in the placebo group. The pooled OR of placebo-controlled studies was 0.47 (0.19-1.11). The pooled OR of all studies was 0.54 (0.32-0.91). The review did not give detailed information on the type of postoperative complications.
Figure 1. Complications, comparison with and without GnRH pretreatment in women undergoing hysterectomy
Source: Lethaby (2017)
- Conversion to laparotomy
Seracchioli (2003) reported no cases of conversion in the pretreatment group (0/31) versus three women of in the control group (3/31=9.7%).
The systematic review by Lethaby (2017) did not report on this outcome.
Important outcome measures
- Operative time
Seracchioli (2003) reported mean operative time from skin incision and pneumoperitoneum to closure. Seracchioli found a mean difference of 30 minutes in favour of GnRH pretreatment (85 ± 29.1 vs 115 ± 38 min, n=62, p <0.001).
Table 2. Operative time, comparison with and without GnRH pretreatment in women undergoing laparoscopic hysterectomy
|
GnRH |
No GnRH |
Mean difference (95%CI) |
||
|
|
||||
|
Mean (min) |
SD |
Mean (min) |
SD |
|
|
85 |
29 |
115 |
38 |
30 (13 to 47) |
Source: Seracchioli, 2003
The SR by Lethaby (2017) reported the duration of surgery in minutes in women undergoing hysterectomy. The review reported large heterogeneity in the way hysterectomy was performed (vaginal, abdominal or laparoscopic), as well as the way duration of surgery was measured and reported, therefore pooled results should be interpreted with caution.
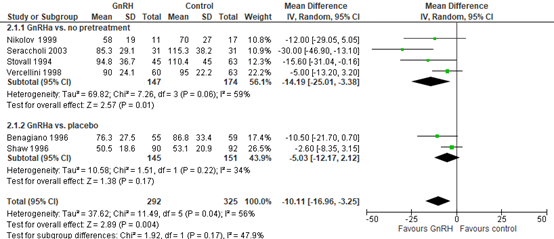
Results were separately assessed for GnRHa versus no treatment and GnRHa versus placebo. In four studies comparing to no treatment (including Seracchioli), average hysterectomy duration was ranged from 58-90 minutes in the pretreatment group versus 70-115 minutes in the control group (MD (95%CI) -14.19 (-25.01 to -3.38). In two studies comparing to placebo, average hysterectomy duration was ranged from 50-76 minutes in the pretreatment group versus 53-87 minutes in the placebo group (MD (95%CI) -5.03 (-12.17 to 2.12). Pooled results were mean difference (95%CI) -10.11 (-16.96,-3.25) in favour of pretreatment. Overall time improvement was estimated at 10 minutes, although heterogeneity among studies was moderate, and results could differ per procedure approach (abdominal, vaginal, laparoscopic), therefore results should be taken with caution. With the predefined minimal clinical important difference of 20 minutes, the difference is found of limited clinical relevance.
Figure 2. Operative time (minutes), comparison with and without GnRH pretreatment in women undergoing hysterectomy
Source: Lethaby (2017)
- Perioperative blood loss
Seracchioli (2003) did not report on perioperative blood loss.
The SR by Lethaby (2017) reported on intraoperative blood loss in women undergoing hysterectomy. Estimated blood loss was measured by the weight of the swabs, and the volume of blood collected in rejectables such as aspiration bottles. Because of large differences in measurement methods and heterogeneity between study results, it was decided not to pool data.
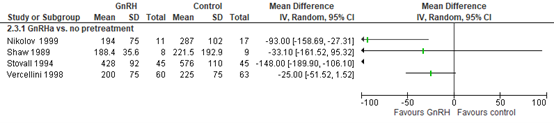
In four studies comparing GnRHa to no pretreatment, blood loss ranged from 188-428 ml versus 221-576 in the control group. All studies reported reduction which ranged from 25-148 ml. Results could not be pooled (described above).
Figure 3. Intraoperative blood loss (mL), comparison with and without GnRH pretreatment in women undergoing hysterectomy
Source: Lethaby (2017)
- Costs
No studies reported on the outcome measure costs.
Level of evidence of the literature
Systematic reviews of randomized controlled trials and randomized controlled trials start at high GRADE.
The level of evidence regarding the outcome measure complications started at a high GRADE and was downgraded to a low GRADE due to risk of bias (see risk of bias table) and indirectness (not only laparoscopic approach).
The level of evidence regarding the outcome measure conversion to laparotomy started at a
high GRADE and was downgraded to a very low GRADE due to risk of bias (see risk of bias table) and two levels for imprecision (only 3 events recorded among only 62 participants).
The level of evidence regarding the outcome measure operative time started at a high GRADE and was downgraded to a low GRADE due to risk of bias and indirectness (not only laparoscopic approach).
The level of evidence regarding the outcome measure perioperative blood loss started at a high GRADE and was downgraded to a very low GRADE due to risk of bias (see risk of bias table, substantial heterogeneity and indirectness (not only laparoscopic approach).
The outcome costs was not reported.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effect of pretreatment with GnRH agonists versus no pretreatment on surgical outcomes in women undergoing LH for uterine myomas?
P: patients: Women undergoing LH for uterine myomas.
I: index test: Pretreatment with GnRH agonists.
C: control test: No pretreatment.
O: outcomes: Complications, avoiding conversion to laparotomy, perioperative blood loss, operative time and costs.
Relevant outcome measures
The guideline development group considered complications and avoiding conversion to laparotomy and as crucial outcome measures for decision making; and perioperative blood loss, operative time and costs as important outcome measures for decision making.
The outcome avoiding conversion laparotomy was defined as the possibility for a laparoscopic procedure after pretreatment, therefore avoiding a laparotomic procedure.
The working group did not define the other important outcome measures listed above but used the definitions used in the studies.
The working group defined the following limits as a minimal clinically important difference:
- complications: any clinically important difference reported in studies
- conversion to laparotomy: any clinically important difference reported in studies
- perioperative blood loss: difference of more than 200 ml
- operative time: difference of more than 20 minutes
- costs: cost-efficiency
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from March 1st 2016 until July 20th, 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 145 hits. Studies that met the following criteria were eligible for selection:
- Systematic reviews, RCTs and observational studies that used original study data.
- Reporting on pretreatment with gonadotrophin-releasing hormone agonists in patients with uterine myomas before for laparoscopic hysterectomy.
Five studies were initially selected based on title and abstract screening. After reading the full text, three studies were excluded (see Table of excluded studies), and two studies were included.
The Cochrane review by Lethaby (2017), an update of the previous version (Lethaby, 2001), investigated preoperative medical treatments (GnRHa, progestins and selective
progesterone-receptor modulators) for uterine fibroids. In 2001, only GnRH was assessed as a preoperative treatment. In 2017, the scope was broadened to include all different preoperative treatments. For the comparison GnRHa versus no GnRHa prior to surgery, 19 articles were included.
Among these was the prospective randomized study by Seracchioli (2003) specifically focused on GnRHa prior to laparoscopic hysterectomy. This study was included in the previous version of this module in 2016.
After this review one additional study, the retrospective study by Torng (2019) was published, also focusing on GnRHa prior to laparoscopic hysterectomy, but in a retrospective non-randomized design.
The retrospective study by Torng (2019) included more women with leiomyoma in the treatment group (64% versus 35%), while the control group consisted of more women with adenomyosis (24% versus 13%) or both. More severely affected women were in the pretreatment group. Because of unbalanced baseline factors, no correction for confounding and inconsistent results, it was decided to exclude the study for risk of bias.
The study of Seracchioli is regarded as a RCT, because of the randomization procedure. But the study of Seracchioli (2003) was prone too high risk of bias as well (poor reporting of selected outcomes and failing of the blinding procedure), therefore it was decided to use the systematic review of Lethaby (2017) to validate the results found in Seracchioli (2003). This, even though the studies included by Lethaby (2017) are prone to indirectness, because other surgical routes, besides the laparoscopic approach, were also included. In total the study included 19 articles about GnRHa versus no treatment or placebo in women undergoing hysterectomy (comparison 2 in the review). The methodology is comparable to the previous version of this module in 2016.
Results
One randomized prospective study (Seracchioli, 2003) and one systematic review (Lethaby, 2017) were included in the systematic literature analysis. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Lethaby, A., Puscasiu, L., & Vollenhoven, B. (2017). Preoperative medical therapy before surgery for uterine fibroids. Cochrane Database of Systematic Reviews, (11).
- Moroni RM, Martins WP, Ferriani RA, Vieira CS, Nastri CO, Candido Dos Reis FJ, Brito LG. Add-back therapy with GnRH analogues for uterine fibroids. Cochrane Database Syst Rev. 2015 Mar 20;2015(3):CD010854.
- Seracchioli, R., Venturoli, S., Colombo, F. M., Bagnoli, A., Vianello, F., Govoni, F., ... & Gualerzi, B. (2003). GnRH agonist treatment before total laparoscopic hysterectomy for large uteri. The Journal of the American Association of Gynecologic Laparoscopists, 10(3), 316-319.
- Torng, P. L., Pan, S. P., Hsu, H. C., Chen, I. H., & Hwang, J. S. (2019). GnRHa before single-port laparoscopic hysterectomy in a large barrel-shaped uterus. JSLS: Journal of the Society of Laparoendoscopic Surgeons, 23(3).
Evidence tabellen
Research question: What is the effect of pretreatment with GnRH agonists versus no pretreatment on surgical outcomes in women undergoing LH for uterine myomas?
RCT
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Seracchioli, 2003 |
Type of study: randomized prospective study (Laparoscopic hysterectomy with vs without GnRHa treatment)
Setting and country:
Funding and conflicts of interest: |
Inclusion criteria: Uterine volume between 16 and 20 weeks gestational age, absence of pelvic pathologies and no therapy with GnRHa agonists or progestational agents or danazol in the past 6 months. Exclusion criteria: Medical conditions requiring hospital monitoring (diabetes mellitus, heart disease), previous abdominal surgery requiring longitudinal laparotomy, or absolute contraindications to operative laparoscopy. N total at baseline: Intervention: 31 Control: 31
Important prognostic factors2: age ± SD: I: 47.6 ± 3.5 C: 48.4 ± 4.6
BMI: I: 23.1 ± 2.7 C: 24.4 ± 3.6 n.s.
Groups comparable at baseline? Yes. |
Describe intervention (treatment/procedure/test):
Triptorelin depot injection (Decapeptyl 11.25 mg; Ispen, Milan, Italy) for three months, starting in the midluteal phase.
|
Describe control (treatment/procedure/test):
No pre-treatment with GnRHa. |
Length of follow-up: Not reported.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Not applicable.
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Perioperative blood loss Not reported
2. Complications (n, %) I: 0 (0) C: 7 (2.2)
3. Operative time (min) I: 85.3 ± 29.1 C: 115.3 ± 38.2 4. Conversion to laparotomy I: No conversion occurred. C: Three conversions occurred.
5. Costs Not reported.
|
Authors conclusion: “In our series, mean operating time was significantly reduced (~20 min, 26% of total operating time) in women who received GnRH agonists. The increased hematologic index, reduced uterine volume and weight, shorter mean operating time, and postoperative hemoglobin level induced by the agents may all facilitate laparoscopic surgery. It is relevant that no intraoperative complications were recorded in group A, whereas in group B three conversions were performed and three patients required blood transfusion.”
|
N.S. Not significant.
Systematic review
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Lethaby, 2017
|
SR and meta-analysis of RCTs
Literature search up to June 2017
A: Balasch, 1995 B: Benagiano, 1996 C: Gerris, 1996 D: Golan, 1993 E: Hudecek, 2012 F: Lumsden, 1994 G: Nikolov, 1999 H: Seracchioli, 2003 I: Shaw, 1989 J: Shaw, 1996 K: Stovall, 1994 L: Vercellini, 1998
Study design: (Randomized) (placebo) controlled trials
Setting and Country: A: Single centre, Barcelona, Spain B: Multicentre, Denmark, the Netherlands, Spain, Finland, Norway, Scotland, Portugal, Northern Ireland and Italy C: Multicentre, Belgium, the Netherlands, Portugal, Sweden, UK D: Single centre, Israel E: Single centre, Czech Republic F: Multicentre, Edinburgh, Glasgow and Newcastle, UK G: Single centre, Sofia, Bulgaria H: Single centre, Italy I: Single centre, UK J: Multicentre study, 23 centres, UK (21), Israel (2) K: Single centre, Tennessee, USA L: Multicentre (4 centres), Italy
Source of funding and conflicts of interest: A: Unclear B: Pharmaceutical company C: Pharmaceutical company D: Unclear E: Unclear F: Unclear G: Unclear H: Unclear I: Unclear J: Pharmaceutical company K: Pharmaceutical company L: Unclear |
Inclusion criteria SR: - controlled trials - medical interventions prior to surgery - women with fibroids - reporting on GnRHa agents before surgery
Exclusion criteria SR: - no preoperative treatment - add-back studies - no control group - mixed populations with data on women with fibroid not available
12 studies included
Number of participants (intervention/control) A: 23/27 B: Group 1: 55 Group 2: 54 Control: 59 C: 127/127 D: Intervention: - Hysterectomy: 17 - Myomectomy: 12 Control: - Hysterectomy: 15 - Myomectomy: 9. E: 120/92 F: 35/6 G: Intervention: - Hysterectomy: 11 - Myomectomy: 6 Control: - Hysterectomy: 17 H: 31/31 I: 32 (unclear per group) J: 98/98 K: 45/45 L: 62/65
Important patient characteristics at baseline: A: Groups not comparable at baseline (measurements of uterine volume and pretreatment haemoglobin and haematocrit lower in the treatment than in the control group). volumes and haemoglobin concentrations. C: No comments. D: No comments. E: No comments. F: No comments. G: No comments. I: Data not provided for uterine volume before surgery. J: No comments. K: Subgroup analysis performed in 2 separate treatment and control groups: women with uterine size 14 to 18 gestational weeks and women with uterine size > 18 gestational weeks. Vaginal hysterectomy attempted if uterus mobile and f 14 weeks in gestational size. L: Hysterectomy was by both the vaginal and abdominal route but data not provided separately for these groups so separate analysis not possible. |
Describe intervention:
A: Intramuscular decapeptyl 3.75 mg every 4 weeks for 2 injections before hysterectomy B: Group 1: Goserelin acetate depot 3.6 mg once monthly + iron 600 mg/day before hysterectomy Group 2: Goserelin acetate depot 3.6 mg once monthly + placebo iron C: Subcutaneous goserelin 3.6 mg monthly before hysterectomy D: Intramuscular D-Trp LHRH 3.2 mg micro capsules (Decapeptyl) monthly before surgery E: Goserelin acetate 3.6 mg SC 3 times once every 4 weeks F: Subcutaneous goserelin 3.6 mg monthly before hysterectomy G: Subcutaneous goserelin 3.6 mg monthly before hysterectomy surgery H: Triptorelin depot 11.25 mg starting in midluteal phase 3 months before surgery I: Goserelin depot 3.6 mg before surgery J: Buserelin 3.6 mg monthly (intramuscular) K: Either subcutaneous leuprolide acetate 0.5 mg daily or intramuscular depot leuprolide acetate 3.75 mg monthly before hysterectomy L: Intramuscular triptorelin depot injections 3.75 mg (Decapeptyl) monthly before hysterectomy |
Describe control:
A: Abdominal hysterectomy within 4 weeks of randomisation B: Sham injection once monthly + iron 600 mg/day before hysterectomy C: No treatment before hysterectomy D: No preoperative treatment E: No pretreatment before surgery F: Subcutaneous placebo monthly before hysterectomy G: No treatment before hysterectomy surgery H: No therapy I: No treatment before surgery J: Placebo monthly K: No preoperative treatment before hysterectomy L: Immediate surgery |
End-point of follow-up: Not applicable, all studies post-surgery.
For how many participants were no complete outcome data available? (intervention/control) A: Low risk - No missing data, no participants withdrew from the study B: Low risk - “All analyses were performed on an intention-to-treat basis”. 185 participants were recruited, 17 withdrew with reasons given. C: High risk - Attrition unbalanced between groups - higher in treatment than control group. D: Unclear risk - It is not reported whether any participants dropped out during the study E: Unclear risk - Not reported but stated as ITT. F: Low risk - Intention-to-treat analysis, “all randomised patients recruited into the study for whom data were available were included in the efficacy analysis”. Three women in each group withdrew, with details reported on each and it appears they were included in the analyses. G: Unclear risk - It seems there were no losses to follow up. In the treatment group 6 women had myomectomy and 11 had hysterectomy, while in the control group all 17 had hysterectomy. H: Unclear risk - Unclear whether all participants were included in analysis. I: High risk - 32 women were included in the analysis. It is not stated how many were recruited or randomised, or if there were any withdrawals. J: Unclear risk - 210 women randomised, 196 women intention-to-treat analysis, 164 subjects per-protocol analysis. Both analyses presented and reasons given for withdrawals. K: Low risk - It appears there were no withdrawals from the study by checking the percentages recorded for dichotomous outcomes. L: Low risk - Four women withdrew after randomisation and before surgery, two from each arm. These 4 participants were also included in the efficacy analysis. “The inclusion of the four withdrawn patients in the analysis did not modify the appreciably the above estimates”. All women operated on attended the follow-up evaluation.
|
Outcome measure-1 Complications Defined as the proportion of postoperative complications in women undergoing hysterectomy.
Effect measure: OR [95% CI]: Pretreatment vs no pretreatment: A: 0.31 [0.08,1.15] D: 0.17 [0.02,1.75] E: 0.49 [0.24,1] K: 0.68 [0.2,2.32] L: 2.64 [0.65,10.73]
Pretreatment vs placebo: F: 0.72 [0.25,2.06] J: 0.3 [0.1,0.85]
Pooled effect (random effects model): 0.54 [95% CI 0.32 to 0.91] favouring GnRH Heterogeneity (I2): 27.7%
Outcome measure-2 Conversion to laparoscopy Not reported.
Outcome measure-3 Operative time Defined as the duration of surgery in minutes in women undergoing hysterectomy.
Pretreatment vs no pretreatment: G: -12 [-29.05,5.05] H: -30 [-46.9,-13.1] K: -15.6 [-31.04,-0.16] L: -5 [-13.2,3.2]
Pretreatment vs placebo: B: -10.5 [-21.7,0.7] J: -2.6 [-8.35,3.15]
Pooled effect (random effects model): -10.11 [95% CI -16.96 to 3.25] favouring GnRH Heterogeneity (I2): 56.48%
Outcome measure-4 Perioperative blood loss Defined as intraoperative blood loss in women undergoing hysterectomy.
Pretreatment vs no pretreatment G: -93 [-158.69,-27.31]sa I: -33.1 [-161.52,95.32] K: -148 [-189.9,-106.1] L: -25 [-51.52,1.52]
Data not pooled because of different measurement methods and large heterogeneity between studies.
Outcome measure-5 costs Not determined.
|
Facultative: Authors’ conclusion: There is clear evidence from randomised controlled trials (RCTs) that preoperative gonadotropin-hormone releasing analogues (GnRHa) can reduce both uterine and fibroid volume and improve haemoglobin levels, although at the expense of increased adverse effects such as hot flushes, before surgery. Rates of vertical incision and blood loss are also reduced (in women undergoing hysterectomy or myomectomy) and women are more likely to have a vaginal procedure and less likely to have postoperative complications when undergoing hysterectomy. However, there is inadequate evidence to support the use of GnRHa for all women with fibroids undergoing hysterectomy or myomectomy. GnRHa could be considered for preoperative use in women with greatly enlarged uteri, preoperative anaemia or where a midline rather than transverse incision was planned. In addition, some women undergoing hysterectomy would benefit from a less invasive vaginal rather than an abdominal procedure. There was insufficient evidence of benefit for other patient or surgical outcomes, such as duration of surgery or hospital stay.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question: low study quality and substantial heterogeneity so results from duration of surgery and amount of blood loss could not be pooled.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading: very low for duration of surgery and blood loss, low for the other crucial outcomes.
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question: sub groups were described where possible.
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroup analysis): see above. |
Risk of bias tables
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded? Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
Low Some concerns High |
|
Seracchioli, 2003 |
Probably yes.
Reason: patients were randomly assigned at a 1:1 ratio. No further details given. |
Probably no.
Reason: no details given. |
Probably no.
Reason: blinding is not mentioned in the manuscript. It is assumed that patients, health care providers were not blinded. Unclear if outcome assessors were not blinded. |
Probably yes.
Reason: loss to follow-up was not described and unclear if intention to treat analysis. |
Probably no.
Reason: adverse events and changes in uterine volume/weight only reported in the intervention group before surgery - no comparison was made with control. The introduction mentions assessing outcome measure ‘costs’. However, this outcome is not reported.
|
Definitely yes.
Reason: no other problems noted. |
High |
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable? Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Lethaby, 2017 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Table of quality assessment derived from Lethaby (2017)*
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Yes, unclear, no |
Was the allocation adequately concealed?
Yes, unclear, no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Yes, unclear, no |
Was loss to follow-up (missing outcome data) infrequent?
Yes, unclear, no |
Are reports of the study free of selective outcome reporting?
Yes, unclear, no |
Was the study apparently free of other problems that could put it at a risk of bias?
Yes, unclear, no |
Overall risk of bias
Low Some concerns High |
|
Balasch, 1995
|
Unclear |
Unclear |
Yes |
Unclear |
Yes |
Yes |
Some concerns |
|
Benagiano, 1996
|
Unclear |
Yes |
Yes |
Unclear |
Yes |
No |
Some concerns |
|
Gerris, 1996
|
Unclear |
Unclear |
Unclear |
Unclear |
No |
Yes |
Some concerns |
|
Golan, 1993
|
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
No |
High |
|
Hudecek, 2012
|
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
Yes |
Some concerns |
|
Lumsden, 1994
|
Yes |
Yes |
Yes |
Unclear |
Yes |
Yes |
Low |
|
Nikolov, 1999
|
Unclear |
Yes |
Unclear |
Unclear |
Unclear |
Unclear |
Some concerns |
|
Seracchioli, 2003
|
Unclear |
Unclear |
Unclear |
Unclear |
Unclear |
No |
High |
|
Shaw, 1989
|
Unclear |
Unclear |
Unclear |
Unclear |
No |
No |
High |
|
Shaw, 1996
|
Yes |
Yes |
Yes |
Unclear |
Unclear |
Yes |
Low |
|
Stovall, 1994
|
Unclear |
Unclear |
Yes |
Unclear |
No |
No |
High |
|
Vercellini, 1998
|
Yes |
Yes |
No |
No |
Yes |
Yes |
Low |
*Data derives from Lethaby (2017), but only the studies that were included in our analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Ali, 2018 |
SR discussing medical therapies to avoid surgery |
|
Badmaeva, 2019 |
No hysterectomy |
|
Bartels, 2016 |
SR overview of studies and findings narratively, among which preoperative treatment with GnRH but no comparison or data given |
|
Bezhenar, 2019 |
No hysterectomy and comparison ulipristal, GnRH antagonist and no hormonal therapy |
|
Chong, 2016 |
No hysterectomy |
|
Correa, 2020 |
No hysterectomy |
|
De Milliano, 2017 |
No hysterectomy |
|
De Milliano, 2020 |
No hysterectomy and comparison ulipristal vs GnRHa antagonist |
|
De Milliano, 2020 |
No hysterectomy and comparison ulipristal vs GnRHa antagonist |
|
Favilli, 2018 |
No hysterectomy |
|
Fernandez, 2017 |
Tests effect of ulipristal pretreatment |
|
Ferrero, 2019 |
Tests effect of ulipristal pretreatment |
|
Gurusamy, 2016 |
More general analysis of the role of medical therapies for fibroids, both before surgery and when used alone, also described in Lethaby 2017 |
|
Hartmann, 2017 |
Does not match the PICO |
|
Hodgson, 2017 |
Protocol for a Cochrane review about the use of GnRH in treatment of fibroids, not as pretreatment for hysterectomy |
|
Irahara, 2020 |
No hysterectomy, effect of ulipristal |
|
Javidan, 2017 |
No hysterectomy |
|
Kalampokas, 2016 |
Tests effect of ulipristal for management uterine fibroids |
|
Kashani, 2016 |
Narrative review about treatement options |
|
Laberge, 2019 |
Wrong design. Guideline for treatment |
|
Lagana, 2021 |
Wrong design. Narrative review |
|
Li, 2018 |
No hysterectomy |
|
Li, 2020 |
No hysterectomy & comparison between 2 hormone treatments |
|
Liao, 2021 |
Comparison between hormone treatment and ultrasound treatment |
|
Luketic, 2017 |
Tests effect of ulipristal pretreatment |
|
Ming, 2021 |
No hysterectomy |
|
Murji, 2018 |
Tests effect of ulipristal pretreatment |
|
Park, 2017 |
No hysterectomy |
|
Potapov, 2019 |
No hysterectomy |
|
Sancho, 2016 |
No hysterectomy & comparison between 2 hormone treatments |
|
Sandberg, 2017 |
Wrong design. Clinical practice guideline about LH |
|
Sangha, 2016 |
No hysterectomy |
|
Sayyah-Melli, 2016 |
Comparison between vaginal danazol and diphereline |
|
Shin, 2017 |
No hysterectomy |
|
Takeda, 2022 |
Oral vs injection of GnRH antagosist pre-operativeley |
|
Teo, 2020 |
No hysterectomy |
|
Torng, 2019 |
High risk of bias, wrong patient group and unbalanced baseline factors. |
|
Vitale, 2020 |
Tests effect of ulipristal pretreatment |
|
Xia, 2021 |
No hysterectomy |
|
Yu, 2018 |
Does not match the PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 05-12-2023
Beoordeeld op geldigheid : 30-10-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met vergroot ovarium en laparoscopische hysterectomie voor benigne indicaties.
Stuurgroep cluster Benigne Gynaecologie
(Voorzitter) Timmermans A. (Anne), gynaecoloog, AmsterdamUMC, Amsterdam, NVOG
Breijer M.C. (Merel), gynaecoloog, Adrz, Goes en Vlissingen, NVOG
Lips D.J. (Daan), gastrointestinaal/oncologisch chirurg met HPB specialisatie, MST, Enschede, NVvH
Radder C.M. (Celine), gynaecoloog, OLVG, Amsterdam, NVOG
Schrijvers module LH voorbehandelen
Driessen S.R.C. (Sara), AIOS gynaecologie en obstetrie, HMC, Den Haag, NVOG
Sandberg E.M. (Evelien), AIOS gynaecologie en obstetrie, LUMC, Leiden, NVOG
Wilms F.F. (Femke), gynaecoloog, ETZ, Tilburg, NVOG
Meelezers module LH voorbehandelen
Geomini P.M.A.J. (Peggy), gynaecoloog, MMC, Veldhoven, NVOG
Twijnstra A.R.H. (Dries), gynaecoloog, LUMC, Leiden, NVOG
van Schrojenstein Lantman E.S. (Esther), klinisch fysicus, Albert Schweitzer ziekenhuis, Dordrecht , NVKF
Met ondersteuning van
Labeur Y.J. (Yvonne), adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Schultink J.M. (Janneke), adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Stuurgroep
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Timmermans* |
Gynaecoloog, Amsterdam UMC (0.5 fte) |
Commissie kwaliteitsdocumenten NVOG (onbetaald); projectgroep Gynae Goes Green NVOG (onbetaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
13-2-2021 |
Geen restricties |
|
Breijer |
Gynaecoloog Maasziekenhuis Pantein |
Lid commissie kwaliteitsdocumenten NVOG namens pijler gynaecologie, onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
28-6-2021 |
Geen restricties |
|
Lips |
Chirurg, Chirurgencoöperatie Oost-Nederland Enschede, Medisch Spectrum Twente |
NVGIC werkgroep robot-chirurgie, onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
21-5-2021 |
Geen restricties |
|
Radder |
Gynaecoloog te OLVG in Amsterdam, 1.0 fte |
Registratiecommissie Obstetrie en Gynaecologie van NVOG, onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
6-7-2021 |
Geen restricties |
Expertisegroep module LH Voorbehandelen
Schrijvers
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Driessen |
AIOS gynaecologie en obstetrie, HMC, Den Haag |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
10-3-2023 |
Geen restricties |
|
Sandberg |
AIOS gynaecologie en obstetrie, LUMC, Leiden |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
2-4-2023 |
Geen restricties |
|
Wilms |
Gynaecoloog, Elisabeth-TweeSteden ziekenhuis |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
26-3-2023 |
Geen restricties |
Meelezers
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Geomini |
Gynaecoloog MMC |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Geen restricties |
|
Twijnstra |
Gynaecoloog 0.9 FTE aan het Leids Universitair Medisch Centrum te Leiden |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
8-3-2023 |
Geen restricties |
|
Van Schrojenstein Lantman |
Klinisch fysicus in Albert Schweitzer ziekenhuis voor 1fte en hiervan voor 0,1 fte gedetacheerd bij Rivas Zorggroep |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Zie boven |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door patiëntvertegenwoordigers in het cluster te laten deelnemen. De verkregen input is meegenomen bij schrijven van de overwegingen en aanbevelingen van de module. De conceptmodule is tevens voor commentaar voorgelegd aan de deelnemende patiëntverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module
|
Uitkomst raming |
Toelichting |
|
Module LH Voorbehandelen |
Geen financiële gevolgen |
GnRHa kan mogelijk complicaties bij LH verminderen en operatieduur verkorten, hierdoor wegen de kosten van de medicatie op tegen de baten bij de individuele patiënt met uterus myomatosus. Uiteindelijk is de keuze aan de behandeld arts en patiënt om de individuele afweging te maken voor de individuele patiënt. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Onderstaande stakeholders zijn benaderd voor de need for update ronde-1 in februari-mei 2022.
Het betreffen:
- Beroepsvereniging Verzorgenden Verpleegkundigen (V&VN)
- Endometriose Stichting (ES)
- Inspectie Gezondheidszorg en Jeugd (IGJ)
- KBO-PCOB
- Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
- Nederlandse Vereniging van Ziekenhuizen (NVZ)
- Nederlandse Vereniging voor Anesthesiologie (NVA)
- Nederlandse Vereniging voor Bekkenfysiotherapie (NVFB) (subvereniging van KNGF)
- Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
- Nederlandse Vereniging voor Heelkunde (NVvH)
- Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC)
- Nederlandse Vereniging voor Klinische Fysica (NVKF)
- Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
- Nederlandse Vereniging voor Psychiatrie (NVvP)
- Nederlandse Vereniging voor Radiologie (NVvR)
- Nederlandse Vereniging voor Urologie (NVU)
- Nederlandse Vereniging voor Vulva Pathologie (NVvVP)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVVS)
- Patiënten Federatie Nederland (PFN)
- Patiëntenvereniging Poi-Pof (inmiddels opgeheven)
- Stichting Bekkenbodem4All
- Vereniging van Klinische Genetica Nederland (VKGN)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Vuurvrouw
- Zelfstandige Klinieken Nederland (ZKN)
- Zorginstituut Nederland (ZiNL)
- Zorgverzekeraars Nederland (ZN)
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansloten bij één of meerdere richtlijnen behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze modules zijn geprioriteerd door de clusterexpertiseleden, die door de verenigingen waren afgevaardigd. Uiteindelijk zijn er drie modules uit gekomen die konden worden herzien/nieuw ontwikkeld. Hiervoor zijn bovenstaande werkgroepen (zie Samenstelling van de werkgroep) gevormd, die de definitieve uitgangsvragen hebben vastgesteld.
De partijen die hebben deelgenomen aan deze werkgroepen zijn (zie ook Titelpagina en Samenstelling van de werkgroep):
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) (stuur- en expertisegroep)
- Nederlandse Vereniging voor Heelkunde (NVvH) (stuurgroep)
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC) (expertisegroep)
- Nederlandse Vereniging voor Klinische Fysica (NVKF) (expertisegroep)
- Nederlandse Vereniging voor Radiologie (NVvR) (expertisegroep)
- Stichting Bekkenbodem4All (expertisegroep)
Schrijfgroep en meeleesgroep
Bij de ontwikkeling van de modules is de expertisegroep per module opgesplitst in schrijfgroepjes en meeleesgroepjes. De schrijfgroep is bij alle stappen die onderstaand beschreven worden aanwezig geweest. Zij hebben de overwegingen en aanbevelingen opgesteld. De meeleesgroep was aanwezig bij de startbijeenkomst, heeft geholpen bij het opstellen van het raamwerk, de uitkomstmaten, en het aanleveren van eventuele zoektermen en/of ‘key articles’ voor de zoekstrategie. Vervolgens heeft de meeleesgroep de module nog verschillende keren meegelezen tijdens de ontwikkelfase. De schrijf- en meeleesgroep vormen samen de werkgroep per module.
Uitkomstmaten
Na het opstellen van de definitieve klinische uitgangsvraag, hebben de clusterexpertiseleden de zoekvraag opsteld, en geïnventariseerd welke uitkomsten voor de patiënt relevant zijn, kijkend naar zowel gewenste als ongewenste effecten. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming) of belangrijk (maar niet cruciaal). Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.3 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering hoog) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers
|
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Search date: 20-7-2022
Hits: 145 hits
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 (exp Hysterectomy/ and laparoscop*.ti,ab,kf.) or exp Uterine Myomectomy/ or (laparoscop* adj4 (hysterectom* or 'uterine removal')).ti,ab,kf. or ((uterine or uterus) adj3 (myomat* or leiomyomat*)).ti,ab,kf. or myomectom*.ti,ab,kf. or myomatectom*.ti,ab,kf. or myomotom*.ti,ab,kf. or vasopressin*.ti,ab,kf. or (surgery adj3 (uterine or uterus) adj3 fibroid*).ti,ab,kf. (46978) 2 exp Gonadotropin-Releasing Hormone/ or (gonadorelin or gonadotropin* or gnrh*).ti,ab,kf. (81755) 4 1 and 2 (886) 5 limit 4 to yr="2016 -Current" (147) 6 5 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (125) 7 meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. (609208) 8 exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. (2484923) 9 Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) (5218194) 10 6 and 7 (13) – SRs 11 (6 and 8) not 10 (18) - RCTs 12 (6 and 9) not (10 or 11) (21) - observationeel 13 10 or 11 or 12 (52)
|