Verwerking tot plaatjes-arm-plasma (PPP) bij analyse bloedingsneiging
Uitgangsvraag
Welke centrifugestappen (snelheid en temperatuur) zijn noodzakelijk voor de bereiding van plaatjes-arm plasma?
Aanbeveling
De afgenomen bloedbuizen dienen gecontroleerd te worden op de aanwezigheid van bloedstolsels door de bloedafname buis voorzichtig te kantelen waardoor de stolsels makkelijk te observeren zijn.
De aanbevolen trombocytenconcentratie van trombocyten arm plasma (PPP) is < 10*109/L d.m.v. de volgende centrifugatie condities te gebruiken: minimaal 1500x g voor 5 á 10 min bij kamertemperatuur.
De centrifugatie condities van het laboratorium dienen gevalideerd te worden en er dient gebruik gemaakt te worden van rotors met uitzwaaiende buishouders.
De centrifuge instellingen moeten elke 12 maanden gecontroleerd worden of na elke aanpassing van de het centrifugeproces om zo steeds gestandaardiseerd PPP te krijgen.
Koude centrifugatie (4 en 12 °C) wordt niet aanbevolen, omdat dit kan leiden tot activatie van FVII en FVIII en degradatie van vWF.
Andere centrifugatie condities waarbij de het materiaal bij hogere centrifugale snelheden voor kortere tijd wordt gecentrifugeerd zijn toegestaan mits onderbouwd door literatuurstudies en/of validaties.
Onderbouwing
Conclusies / Summary of Findings
|
Bereiding plaatjes-arm-plasma (PPP) |
Conclusies (gradatie, aantal studies) |
|
PT |
De afgenomen bloedbuizen dienen gecontroleerd te worden op de aanwezigheid van bloedstolsels. (CLSI H21-A5)
De aanbevolen trombocytenconcentratie van trombocyten arm plasma (PPP) is < 10*109/L. (3B, 3 n=4)
Aanbevolen wordt om de volgende centrifugatie condities te gebruiken: 1500x g voor 5 á 10 min bij kamertemperatuur. (3B, n=3)
De CLSI raadt aan om de centrifugatie condities in het laboratorium te valideren en gebruik te maken van rotors met uitzwaaiende buishouders. (3B, n=3)
Daarnaast adviseert de CLSI dat deze centrifugestappen elke 6 maanden gecontroleerd moeten worden of na elke aanpassing van de het centrifugeproces om zo steeds gestandaardiseerd PPP te krijgen. (CLSI H21-A5)
Koude centrifugatie (4 en 12 °C) wordt niet aanbevolen, omdat dit kan leiden tot activatie van FVII en FVIII en degradatie van vWF. (3B, n=7)
Het gebruik van centrifugale rem wordt afgeraden. (3B, n=3)
Trombocytenconcentratie van < 200*109/L heeft geen effect op routine stollingstesten wanneer er vers plasma gebruikt wordt. (3B, n=5)
Door de CLSI wordt gedoogd, en dit wordt ondersteund door literatuur, om gebruikt te maken van andere centrifugatie condities waarbij de het materiaal bij hogere centrifugale snelheden voor kortere tijd wordt gecentrifugeerd. (3B, n=6) |
|
aPTT |
|
|
D-dimeren |
|
|
Fibrinogeen |
|
|
Stollingsfactoren |
|
|
vWF |
|
|
Trombinetijd |
|
|
ROTEM |
N.v.t., volbloed test. |
|
TEG |
N.v.t., volbloed test. |
|
LTA |
N.v.t., wordt uitgevoerd in plaatjes-rijk-plasma (PRP). |
|
PFA |
N.v.t., volbloed test. |
Samenvatting literatuur
De standaard routine stollingstesten, zoals fibrinogeen, PT, stollingsfactor bepaling, aPTT, TT, Ddimeren en vWF worden bepaald in trombocyten (plaatjes) arm plasma (PPP)(Magnette et al., 2016). Om aan de criteria van PPP te voldoen, moet het bloed zodanig verwerkt worden, dat er een trombocytenconcentratie van onder de 10*109/L wordt gemeten in plasma (CLSI, 2008: H21-A5; Magnette et al., 2016; Brien et al, 1993; Tripodi et al, 2003). Voor het verkrijgen van PPP wordt het bloed gecentrifugeerd. Lippi et al. (2007, 2006) observeerde dat de optimale centrifugetijd bedraagt tussen de 5 á 10 minuten bedraagt bij een centrifugesnelheid van 1500g bij kamertemperatuur. De CLSI (2008: H21-A5) beveelt aan dat laboratoria zelf de snelheid en centrifugetijd moeten testen en valideren in hun eigen laboratoriumsetting. Daarnaast raadt de CLSI aan om centrifugerotors te gebruiken die gebruik maken van uitzwaaiende buishouders waarin de afnamebuis geplaatst kan worden. Op deze wijze wordt het plasma op de juiste manier gescheiden van erytrocyten, leukocyten, en trombocyten en is contaminatie met deze cellen minimaal. (CLSI, 2008: H21-A5, Magnette et al., 2016; McCraw et al., 2010). Lippi et al. (2006) observeerde dat naast kamertemperatuur, er ook prima gecentrifugeerd kan worden bij temperaturen van 4 en 12 °C, waarbij geen grote effecten te zien zijn op routine stollingstesten (PT, aPTT, fibrinogeen en D-dimeren), en zonder klinische relevantie. Een limitatie van deze studie is dat de effecten van deze temperaturen niet onderzocht zijn voor gespecialiseerde stollingstesten zoals vWF, FVII en FVIII, sinds deze testen extreem gevoelig zijn voor koudere temperaturen (CLSI, 2008: H21-A5; Adcock et al., 2012; Bohm et al., 2006; Kattlove en Alexander, 1971; Palmer en Gralnick, 1982; Favaloro et al., 2004; Lippi et al., 2006). Echter, een recent onderzoek door Yazar et al. (2018) concludeerde dat routine stollingstesten (PT/INR en aPTT) niet gecentrifugeerd kunnen worden bij lagere temperaturen. Zoals aangegeven in de module 'Transport temperatuur en duur' kunnen lagere temperaturen leiden tot koude activatie van FVII en degradatie van vWF. Men kan hieruit concluderen dat er meer onderzoek gedaan moet worden naar het effect van centrifugeren bij andere temperaturen en kunnen de aanbevelingen om bij kamertemperatuur te centrifugeren gehandhaafd blijven. De CLSI heeft geen duidelijk handvatten voor het gebruik van een centrifugale rem bij het centrifugeren. Het gebruik ervan wordt afgeraden door Daves et al. (2014), sinds dit een mogelijk effect kan hebben op de PT en fibrinogeen concentratie (Magnette et al., 2016; McCraw et al., 2010). Daarnaast adviseert de CLSI dat deze centrifugestappen elke 6 maanden gevalideerd moeten worden of na elke aanpassing van het centrifugeproces, om zo steeds gestandaardiseerd PPP te krijgen. Ook adviseert de CLSI (2008: H21A5) dat er gebruik mag worden gemaakt van een extra centrifugestap om er zeker van te zijn dat er geen trombocyten in het plasma aanwezig zijn. Echter, het is wel aangetoond door enkele studies dat een trombocytenconcentratie onder de 200*109/L geen invloed heeft wanneer de PT/INR, aPTT, TT, D-dimeren en fibrinogeen gemeten zijn in vers plasma (CLSI, 2008: H21-A5; Magnette et al., 2016; Barnes en Lukoszyk, 2002; Carroll et al., 2001; Suchsland et al., 2014). De CLSI beschrijft wel dat deze plasmamonsters niet geschikt zijn voor het bepalen van lupus anticoagulantia en het monitoren van heparinetherapie, en wanneer het plasmamonster voor heranalyse wordt ingevroren, dient het plasma vrij te zijn van trombocyten (< 10*109/L)(CLSI, 2008: H21-A5). Suchsland et al. (2014) heeft de effecten van een extra centrifugestap beschreven. Het centrifugeren van stollingsmonsters bij 3280 g gedurende 5 minuten leiden bij alle monsters tot een trombocytenconcentratie onder de 200*109/L, waarbij ongeveer 70% van de plasmamonsters onder de 10*109/L kwam na een tweede centrifugestap. Daarnaast werden er geen significante effecten geobserveerd in het analyseren van de PT, aPTT en FVIII na de eerste en tweede centrifugestap. Het centrifugeren bij hogere snelheden en voor kortere tijd wordt gedoogd door de CLSI omdat er vergelijkbare resultaten gevonden werden (Pappas et al., 1991; Nelson et al., 1994; Boudaoud et al., 2006; Sultan, 2010). Pappas et al. (1991) was een van de eerste onderzoekers die experimenteerde met hogere centrifugesnelheden voor kortere duur. In dit onderzoek werd het effect van 11.000x g gedurende 2 minuten onderzocht in 90 routine patiëntenmonsters en vergeleken met centrifugatie bij 1000x g gedurende 10 minuten. Er werden geen significante verschillen geobserveerd voor de PT, aPTT en fibrinogeenconcentratie wanneer er bij hoge snelheid en in korter tijdbestek wordt gecentrifugeerd. Vergelijkbare resultaten werden aangetoond door Nelson et al. (1994) die geen significante verschillen observeerde in de PT, aPTT, fibrinogeen, D-dimeren en antitrombine bij dezelfde centrifugecondities. Ook Boudaoud et al. (2006) vond dat centrifugeren bij 4440x g gedurende 2 minuten geen problemen geeft bij het bepalen van de PT, aPTT en het fibrinogeen. Sultan (2010) vond vergelijkbare resultaten bij een snelheid van 3000 g gedurende 5 minuten. Het voordeel van het centrifugeren bij hogere snelheden in een kortere tijd is dat het bloed sneller verwerkt kan worden waardoor de doorlooptijd van de monsters bevorderd wordt (CLSI, 2008: H21-A5; Magnette et al., 2016). De enige studie in contrast met deze bevindingen is een studie van Lippi et al. (2013). Hier werd geobserveerd dat lagere centrifugesnelheden (< 1500x g) niet geschikt zijn voor het analyseren van routinestollingstesten in ontdooide plasmamonsters. Daarnaast concluderen de auteurs dat centrifugatie bij 3000x g gedurende 15 minuten mogelijk niet geschikt is voor het bepalen van FVIII en FIX-activiteit.
Zoeken en selecteren
De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Zie de zoekverantwoording voor de uitgebreide zoekstrategieën per module.
Referenties
- Adcock Funk DM, Lippi G, Favaloro EJ. Quality standards for sample processing, transportation, and storage in hemostasis testing. Semin Thromb Hemost. 2012;38(6):576-85.
- Barnes PWE, C.S. Lukoszyk, M. Residual platelet counts in plasma prepared for routine coagulation testing with the Beckman Coulter power processor. Lab Hematol. 2002;8:205-9.
- Bohm M, Taschner S, Kretzschmar E, Gerlach R, Favaloro EJ, Scharrer I. Cold storage of citrated whole blood induces drastic time-dependent losses in factor VIII and von Willebrand factor: potential for misdiagnosis of haemophilia and von Willebrand disease. Blood Coagul Fibrinolysis. 2006;17(1):39-45.
- Boudaoud L, Divaret G, Marie P, Bezeaud A. [Rapid centrifugation for routine coagulation testing]. Ann Biol Clin (Paris). 2006;64(4):315-7.
- Brien WF, Schaus MR, Cooper KE, O'Keefe BT, Inwood M. Lupus anticoagulant testing: effect of the platelet count on the activated partial thromboplastin time. Br J Biomed Sci. 1993;50(2):114-6.
- Carroll WE, Wollitzer AO, Harris L, Ling MC, Whitaker WL, Jackson RD. The significance of platelet counts in coagulation studies. J Med. 2001;32(1-2):83-96.
- Cattaneo M, Cerletti C, Harrison P, Hayward CP, Kenny D, Nugent D, Nurden P, Rao AK, Schmaier AH, Watson SP, Lussana F, Pugliano MT, Michelson AD. Recommendations for the standardization of light transmission aggregometry: a consensus of the working party from the Platelet Physiology Subcommittee of SSC/ISTH. J Thromb Haemost. 2013 Apr 10.
- Cattaneo M, Lecchi A, Zighetti ML, Lussana F. Platelet aggregation studies: autologous platelet-poor plasma inhibits platelet aggregation when added to platelet-rich plasma to normalize platelet count. Haematologica. 2007;92(5):694-7.
- CLSI. Platelet function testing by aggregometry; approved guideline. CLSI Document H58-A. Wayne, PA: Clinical and Laboratory Standards Institute; 2008.
- CLSI. Collection, transport, and processing of blood specimens for testing plasma-based coagulation assays and molecular hemostasis assays; approved guideline – fifth edition. CLSI Document H21-A5. Wayne, PA: Clinical and Laboratory Standards Institute; 2008.
- Daves M, Giacomuzzi K, Tagnin E, Jani E, Adcock Funk DM, Favaloro EJ, Lippi G. Influence of centrifuge brake on residual platelet count and routine coagulation tests in citrated plasma. Blood Coagul Fibrinolysis. 2014;25(3):292-5.
- Favaloro EJ, Soltani S, McDonald J. Potential laboratory misdiagnosis of hemophilia and von Willebrand disorder owing to cold activation of blood samples for testing. Am J Clin Pathol. 2004;122(5):686-92.
- Femia EA, Pugliano M, Podda G, Cattaneo M. Comparison of different procedures to prepare platelet-rich plasma for studies of platelet aggregation by light transmission aggregometry. Platelets. 2012;23(1):7-10.
- Hammerling JA. A review of medical errors in laboratory diagnostics and where we are today. Lab Med. 2012;43(2):41-4.
- Harrison P, Mackie I, Mumford A, Briggs C, Liesner R, Winter M, Machin S; British Committee for Standards in Haematology. Guidelines for the laboratory investigation of heritable disorders of platelet function. Br J Haematol. 2011;155(1):30-44.
- Hayward CPM, Moffat KA. Platelet Aggregation. 2013:559-80.
- Holmsen H, Day HJ, Setkowsky CA. Secretory mechanisms. Behaviour of adenine nucleotides during the platelet release reaction induced by adenosine diphosphate and adrenaline. Biochem J. 1972;129(1):67-82.
- Kattlove HE, Alexander B. The effect of cold on platelets. I. Cold-induced platelet aggregation. Blood. 1971;38(1):39-48.
- Linnemann B, Schwonberg J, Mani H, Prochnow S, Lindhoff-Last E. Standardization of light transmittance aggregometry for monitoring antiplatelet therapy: an adjustment for platelet count is not necessary. J Thromb Haemost. 2008;6(4):677-83.
- Lippi G, Rossi R, Ippolito L, Zobbi V, Azzi D, Pipitone S, Favaloro EJ, Funk DM. Influence of residual platelet count on routine coagulation, factor VIII, and factor IX testing in postfreeze-thaw samples. Semin Thromb Hemost. 2013;39(7):834-9.
- Lippi G, Salvagno GL, Montagnana M, Manzato F, Guidi GC. Influence of the centrifuge time of primary plasma tubes on routine coagulation testing. Blood Coagul Fibrinolysis. 2007;18(5):525-8.
- Lippi G, Salvagno GL, Montagnana M, Poli G, Guidi GC. Influence of centrifuge temperature on routine coagulation testing. Clin Chem. 2006;52(3):537-8.
- Magnette A, Chatelain M, Chatelain B, Ten Cate H, Mullier F. Pre-analytical issues in the haemostasis laboratory: guidance for the clinical laboratories. Thromb J. 2016;14:49.
- Mani H, Luxembourg B, Klaffling C, Erbe M, Lindhoff-Last E. Use of native or platelet count adjusted platelet rich plasma for platelet aggregation measurements. J Clin Pathol. 2005;58(7):747-50.
- McCraw A, Hillarp A, Echenagucia M. Considerations in the laboratory assessment of haemostasis. Haemophilia. 2010;16 Suppl 5:74-8.
- Merolla M, Nardi MA, Berger JS. Centrifugation speed affects light transmission aggregometry. Int J Lab Hematol. 2012;34(1):81-5.
- Nelson S, Pritt A, Marlar RA. Rapid preparation of plasma for 'Stat' coagulation testing. Arch Pathol Lab Med. 1994;118(2):175-6.
- Palmer RN, Gralnick HR. Cold-induced contact surface activation of the prothrombin time in whole blood. Blood. 1982;59(1):38-42.
- Pappas AA, Palmer SK, Meece D, Fink LM. Rapid preparation of plasma for coagulation testing. Arch Pathol Lab Med. 1991;115(8):816-7.
- Podczasy JJ, Lee J, Vucenik I. Evaluation of whole-blood lumiaggregation. Clinical and Applied Thrombosis/Hemostasis. 1997;3(3):190-5.
- Richtlijn LTA-VHL t.b.v. analyse bloedingsneiging (24-1-2016). http://de-vhl.nl/docs/hemostaseb/Richtlijn%20LTA-VHL%20t.b.v.%20analyse%20bloedingsneiging.pdf
- Riess H, Braun G, Brehm G, Hiller E. Critical evaluation of platelet aggregation in whole human blood. Am J Clin Pathol. 1986;85(1):50-6.
- Suchsland J, Friedrich N, Grotevendt A, Kallner A, Ludemann J, Nauck M, Petersmann A. Optimizing centrifugation of coagulation samples in laboratory automation. Clin Chem Lab Med. 2014;52(8):1187-91.
- Sultan A. Five-minute preparation of platelet-poor plasma for routine coagulation testing. East Mediterr Health J. 2010;16(2):233-6.
- Tripodi A, Valsecchi C, Chantarangkul V, Battaglioli T, Mannucci PM. Standardization of activated protein C resistance testing: effect of residual platelets in frozen plasmas assessed by commercial and home-made methods. Br J Haematol. 2003;120(5):825-8.
- van der Stelt CA, van Werkum JW, Seesing TH, Berg JM, Hackeng CM. To adjust or not to adjust the platelet count in light transmission aggregometry in patients receiving dual aspirin/clopidogrel treatment. Platelets. 2007;18(7):550-3.
- Yazar H, Ozdemir F, Kose E. Effect of centrifuge temperature on routine coagulation tests. Acta Haematol. 2018;139(3):158-63.
- Zhou L, Schmaier AH. Platelet aggregation testing in platelet-rich plasma. Am J Clin Pathol. 2005;123(2):17283.
- Zucker MB. Platelet aggregation measured by the photometric method. Methods Enzymol. 1989;169:117-33.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-11-2020
Beoordeeld op geldigheid : 05-11-2020
Voor het beoordelen van de actualiteit van deze richtlijn wordt (een deel van) de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De NVKC is regiehouder van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module).
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
- Het opstellen van laboratorium technische adviezen, voor zover mogelijk Evidence-Based met betrekking tot de pre-analyse van minimaal 10 testen die veel gebruikt worden in Nederland en die noodzakelijk zijn voor de analyse, diagnose en behandeling van patiënten met bloedingsneiging.
- Een bijdrage leveren aan de standaardisatie van hemostase testen en de grotere uitwisselbaarheid van uitslagen en hemostase laboratoriumdiagnostiek tussen ziekenhuislaboratoria.
- Een handreiking geven van de bekende literatuur op het gebied van de pre-analytische fase op het gebied van hemostase (t/m juli 2018).
Doelgroep
Deze richtlijn is een handreiking voor alle laboratoriumspecialisten klinische chemie (NVKC/VHL) die nauw in contact staan met de medisch specialist, waarbij de klinisch chemicus op het gebied van analyse bloedingsneigingen consultaties geeft en (eind)verantwoordelijk is voor de bloedafname, analyse en rapportage van stollingstesten. Indirecte gebruikers van deze voorschriften kunnen artsen en verpleegkundigen zijn, die de diagnose stellen en/of bloed afnemen ten behoeve van stollingsonderzoek. Hierbij kan onderscheid gemaakt worden tussen de huisartsen die basale testen aanvragen en aanvragers van het uitgebreide stollingspakket zoals internisten, internist-hematologen, gynaecologen, anesthesisten, kinderartsen, radiologen, tandartsen, en (kaak)chirurgen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een werkgroep ingesteld. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr.ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie, Maastricht UMC+, Maastricht (voorzitter), namens NVKC/VHL
- Dr. Dr. M.L.J (Mike) Jeurissen, onderzoeker, Maastricht UMC+, Maastricht, namens NVKC
- Dr. A.K. (An) Stroobants, laboratoriumspecialist klinische chemie, Amsterdam UMC, locatie AMC, Amsterdam, namens NVKC/VHL
- Dr. M.P.M. (Moniek) de Maat, biochemicus, Erasmus MC, Rotterdam, namens VHL
- C.A.M. (Caroline) Klopper, vakanalist, Amsterdam UMC, locatie AMC, namens NVTH werkgroep Hemostase
- P.W.M. (Paul) Verhezen, vakanalist, Maastricht UMC+, Maastricht, namens NVTH werkgroep Hemostase
- Dr. K.M.T. (Kim) de Bruyn, laboratoriumspecialist klinische chemie, Tergooi, Hilversum, Blaricum, namens NVKC/VHL
- Dr. R.W.L.M. (René) Niessen, laboratoriumspecialist klinische chemie, OLVG, Amsterdam, namens NVKC/SKML
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben. Een overzicht van de belangen van werkgroepleden is in onderstaande tabel weergegeven; er zijn geen restricties m.b.t. deelname aan de werkgroep.
|
Naam |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Y. Henskens |
Klinisch chemicus |
Lid LGR Sanquin Voorzitter gebruikersraad Sanquin ZON/Limburg Voorzitter concilium NVKC (opleiding) Lid Kennisplatform Transfusiegeneeskunde ZO Bestuurslid VHL Lid werkgroep Hemostase VHL (allen onbetaald) Richtlijn commissie Antitrombotisch beleid FMS/NIV namens NVKC Richtlijn werkgroep FMS Bloedtransfusie (massaal bloedverlies) (vacatiegeld) |
Voor alle studies in het kader van MUMC+ onderzoekslijn “laboratory predictors of bleeding” worden IVD gebruikt die geheel of gedeeltelijk worden gesponsord door IVD firma’s |
Geen: het betreft geen IVD in het kader van preanalyse |
|
M. Jeurissen |
Onderzoeker |
Geen |
Geen |
Geen |
|
A. Stroobants |
Klinisch chemicus |
Bestuurslid VHL Voorzitter werkgroep Hemostase VHL Richtlijn commissie Antitrombotisch beleid FMS/NIV namens NVKC |
Geen |
Geen |
|
M. de Maat |
Biochemicus |
Lid RvT ECAT (vacatievergoeding) Lid Council International Fibrinogen Research (onbetaald) |
Geen |
Geen |
|
C. Klopper |
Vakanalist |
Lid WHD: Werkgroep Hemostase Diagnostiek NVTH (onbetaald) |
Geen |
Geen |
|
P. Verhezen |
Vakanalist |
Lid WHD: Werkgroep Hemostase Diagnostiek NVTH (onbetaald) |
Geen |
Geen |
|
K. de Bruyn |
Klinisch chemicus |
ISO 15189 auditor (betaald) |
Geen |
Geen |
|
R. Niessen |
Klinisch chemicus |
Bestuurslid: SKML sectie Hematologie Sectie SKS-SKML FNT (allen onbetaald) |
Geen |
Geen |
Inbreng patiëntenperspectief
De richtlijn richt zich voornamelijk op de bloedstollingstesten die ingezet kunnen worden bij patiënten die verdacht worden van een congenitale (stollingsfactoren, trombopathie) of verworven (anticoagulantia, massaal bloedverlies) bloedingsneiging. In samenspraak met de Nederlandse Vereniging van Hemofilie Patiënten (NVHP) is uitleg opgesteld voor patiënten waarbij bloed wordt afgenomen voor stollingsonderzoek. De uitleg is op B1 niveau geformuleerd, met kernbegrippen waarop een patiënt zelf verder kan zoeken, indien gewenst.
Methode ontwikkeling
Evidence based
Implementatie
Tijdens de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is opgenomen bij de aanverwante producten.
Werkwijze
Knelpuntenanalyse
Tijdens de voorbereidende fase werden de knelpunten geïnventariseerd en een lange lijst van uitgangsvragen opgesteld. Tijdens een bijeenkomst werd door alle werkgroepleden een prioritering ingevuld van de verzamelde uitgangsvragen. De vragen met de hoogste prioriteit werden vervolgens gebruikt voor deze richtlijn.
Uitgangsvragen
De werkgroep heeft de volgende uitgangsvragen geprioriteerd:
- Welke patiënten kenmerken (biologische status) kunnen de uitkomsten van bloedstollingstesten beïnvloeden?
- Welke factoren kunnen invloed hebben op de (kwaliteit van de) bloedafname en hebben daardoor invloed op de uitkomsten van bloedstollingstesten?
- Welke factoren kunnen invloed hebben op het transport van patiëntmateriaal waardoor ze hebben de uitkomst van bloedstollingstesten kunnen beïnvloeden?
- Welke factoren kunnen invloed hebben op de verwerking van patiëntmateriaal tot plasma of plaatjes-rijk plasma waardoor ze de uitkomst van bloedstollingstesten kunnen beïnvloeden?
- Hoe lang kan volbloed en plasma bewaard worden, zonder de uitkomst van bloedstollingstesten te beïnvloeden?
Strategie voor zoeken en selecteren van literatuur
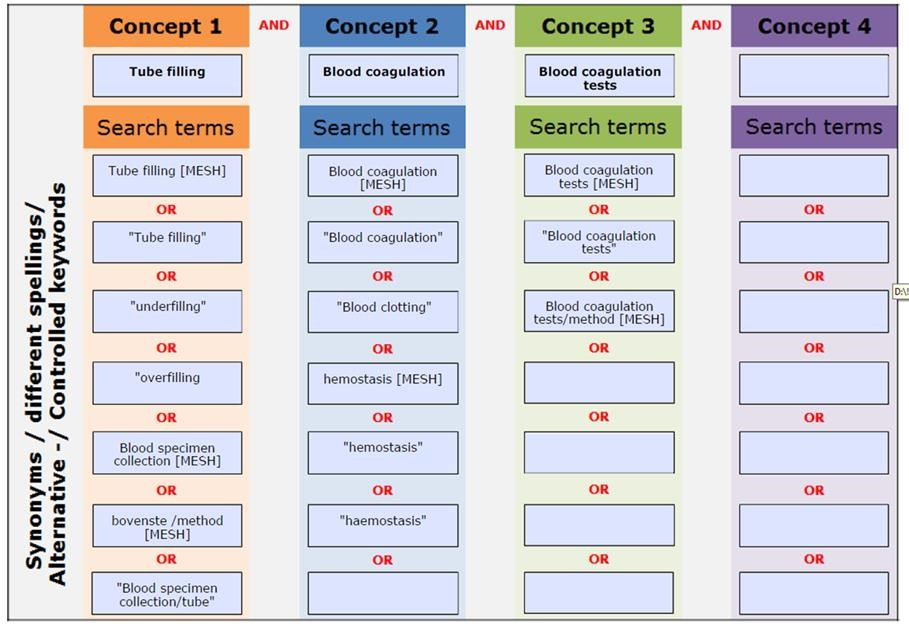
De zoekstrategieën die zijn verricht in het kader van de uitgangsvragen zijn systematisch uitgevoerd. De zoekstrategieën hebben plaats gevonden in het database Pubmed en/of Medline. Enkele zoektermen die veelvoudig zijn gebruikt zijn: blood coagulation, blood coagulation tests, blood clotting, hemostasis, blood collection, blood specimen. Deze zoektermen werden in combinatie gebruikt met specifiekere zoektermen gericht op het onderwerp. Zie de zoekverantwoording voor de uitgebreide zoek strategieën per module.
Samenvatten van de literatuur
De belangrijkste bevindingen uit de wetenschappelijke literatuur zijn beschreven in de samenvatting van de literatuur.
De intentie voor het graderen van literatuur voor deze richtlijn was om gebruik te maken van GRADE. De beschikbare stollingstesten om de primaire en secondaire hemostase te analyseren zijn sterk afhankelijk van pre-analytische variabelen, die de uitslagen van deze testen sterk kunnen beïnvloeden. De literatuur biedt geen consensus in de optimale pre-analytische omstandigheden waarbij bloedstolling testen uitgevoerd kunnen worden. Om kwaliteit en de sterkte van aanbevelingen te kwantificeren werd eerst onderzocht of het GRADE-systeem implementeerbaar is in deze richtlijn. De vraag die wij ons hierbij eerst gesteld hebben is: is GRADE toepasbaar in een pre-analytische setting van de laboratoriumdiagnostiek? Bij GRADE wordt de kwaliteit van de studie per uitkomstmaat bepaald, geformuleerd via het PICO-principe. Vijf factoren bepalen de kwaliteit per uitkomstmaat: publicatiebias, beperking in studieopzet, imprecisie, indirectheid en inconsistentie (Guyatt et al., 2011, Boluyt et al., 2012). Om te kijken of GRADE toepasbaar is hebben we een kleine zoekopdracht uitgevoerd, waarbij gekeken is naar de interferentie van hemolyse op bloedstollingstesten om knelpunten van GRADE te identificeren. Knelpunten werden gevonden in de formulering van de PICO; keuze van populatie (patiënt en gezond), aangezien pre-analytische variaties in elke populatie kan voorkomen en daarbij de keuze van de juiste uitkomstmaat. De zoekopdracht resulteerde in drie studies die de juiste uitkomstmaat gebruikte uit een selectie van ±600 hits. Daarbij toonde de gekozen studies grote verschillen in apparatuur, reagentia, en methode van inductie en definitie van hemolyse. Op basis van de criteria volgens GRADE zou deze uitkomstmaten een zeer lage of geen gradatie krijgen. Onze conclusie was dat de PICO’s binnen GRADE zeer klinisch en patiëntgericht zijn waarbij voornamelijk gekeken wordt naar interventies; daardoor is GRADE niet toepasbaar binnen een preanalytische setting.
Op basis hiervan werd de literatuur gegradeerd m.b.v. het gradatiesysteem dat gebruikt is in de aanverwante richtlijn “Diagnostiek en behandeling van hemofilie en aanverwante hemostasestoornissen 2009”. Het gradatiesysteem dat in deze richtlijn wordt beschreven is gebaseerd op de US Agency for Health Care Policy and Research”. Zie voorbeeld in de onderstaande tabellen.
Tabel 1: Indeling van de literatuur naar mate van bewijskracht
|
Bewijskracht |
Soort bewijs |
|
Graad 1 |
Bewijs verkregen van meta-analyse van gerandomiseerd gecontroleerde onderzoeken (1a) of ten minste één geblindeerd gerandomiseerd gecontroleerd onderzoek (1b) |
|
Graad 2 |
Bewijs verkregen uit ten minste een goed gedefinieerd gecontroleerd onderzoek, zonder randomisatie (2a) of een cohort- of patiëntcontrole-onderzoek van goede kwaliteit (2b) of een systematisch review zonder meta-analyse |
|
Graad 3 |
Bewijs verkregen uit goed gedefinieerde, niet experimentele beschrijvende onderzoeken, zoals vergelijkende onderzoeken, correlatieonderzoeken of patiëntcontroleonderzoeken van slechte kwaliteit |
|
Graad 4 |
Bewijs verkregen van expertpanels of opinies van deskundigen |
Tabel 2: Niveau van aanbeveling
|
Niveau |
Soort bewijs |
|
A |
Een onderzoek van graad 1a of 1b |
|
B |
Ten minste twee onderzoeken van graad 2a, 2b of graad 3 |
|
C |
Berustend op bewijs van graad 4 |
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt gewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje ‘Overwegingen’.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast wetenschappelijke publicaties ook andere aspecten belangrijk om te worden meegewogen, zoals de expertise van de werkgroepleden, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld onder het kopje ‘Overwegingen’.
Kennislacunes
Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van de aanbevelingen voor nader/vervolgonderzoek is opgenomen onder het kopje ‘Kennislacunes’ (bij Aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de leden van de NVKC, VHL, SKML subcommissie stolling, NIV en aan Patiëntenfederatie Nederland voorgelegd ter commentaar. De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De autorisatieversie van de richtlijn is ter stemming gebracht tijdens de algemene ledenvergadering van de NVKC, en voorgelegd aan Patiëntenfederatie Nederland ter autorisatie c.q. instemming.
Literatuur
Boluyt N, Rottier BL, Langendam MW. [Guidelines are made more transparent with the GRADE method: considerations for recommendations are explicit in the new method]. Ned Tijdschr Geneeskd. 2012; 156: A4379.
Guyatt G, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, Norris S, Falck-Ytter Y, Glasziou P, DeBeer H, Jaeschke R, Rind D, Meerpohl J, Dahm P, Schünemann HJ. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol. 2011; 64: 383-394.
Zoekverantwoording
De zoekstrategieën die zijn verricht in het kader van de voorschriften zijn systematisch uitgevoerd. De zoekstrategieën hebben plaats gevonden in het database Pubmed en/of Medline. Enkele zoektermen die veelvoudig zijn gebruikt zijn: blood coagulation, blood coagulation tests, blood clotting, hemostasis, blood collection, blood specimen. Deze zoektermen werden in combinatie gebruikt met specifiekere zoektermen gericht op het onderwerp.
Zoekopdrachten apart uitvoeren en vervolgens in een EndNote file gezet.
Bloed collectie systemen: (("Phlebotomy"[Mesh]) OR "Phlebotomy") OR "Blood Collection"
Kinderen: ("capillary sampling") OR "skin puncture"
Bloedafname: (((("Blood Specimen Collection"[Mesh]) OR "Blood Specimen Collection") OR "Blood Specimen Collection/standards"[Mesh]) OR "Blood Specimen Collection/adverse effects"[Mesh]) OR "Blood Specimen Collection/methods"[Mesh]
Buisvulling: ((((((Blood coagulation [MESH]) OR "Blood coagulation") OR "Blood clotting") OR hemostasis [MESH]) OR "hemostasis") OR "haemostasis")
Citraatconcentratie: (Citrates [MESH]) OR "Citrates"
Hematocrit: ("Hematocrit"[Mesh]) OR "Hematocrit"
Hemolyse: ((("Hemolysis"[Mesh]) OR "Hemolysis") OR "Haemolysis") OR "Free hemoglobin"
Transport: (("Transport") OR "Car") OR "Box"
Temperature and storage: ("Temperature") OR "Storage"
Pneumatic tube system: Pneumatic tube system
Centrifuge: ((("Centrifugation"[Mesh]) OR "Centrifugation") OR "Centrifugation/standards"[Mesh]) OR "Centrifugation/methods"[Mesh]
|
Search |
Query |
Items found |
|
#5 |
((((((("Centrifugation"[Mesh]) OR "Centrifugation") OR "Centrifugation/standards"[Mesh]) OR "Centrifugation/methods"[Mesh]))) AND |
242 |
|
|
(((((((((("Blood Coagulation"[Mesh]) OR "Blood Coagulation") OR "Blood Clotting") OR "Hemostasis"[Mesh]) OR "Hemostasis") OR "Haemostasis")))))) AND ((((((("Blood Coagulation Tests"[Mesh]) OR "Blood Coagulation Tests") OR "Blood Coagulation Tests/methods"[Mesh]))))) Sort by: Best Match |
|
|
#4 |
((((((("Centrifugation"[Mesh]) OR "Centrifugation") OR "Centrifugation/standards"[Mesh]) OR "Centrifugation/methods"[Mesh]))) AND (((((((((("Blood Coagulation"[Mesh]) OR "Blood Coagulation") OR "Blood Clotting") OR "Hemostasis"[Mesh]) OR "Hemostasis") OR "Haemostasis")))))) AND ((((((("Blood Coagulation Tests"[Mesh]) OR "Blood Coagulation Tests") OR "Blood Coagulation Tests/methods"[Mesh]))))) |
200 |
|
#3 |
Search ((((("Blood Coagulation Tests"[Mesh]) OR "Blood Coagulation Tests") OR "Blood Coagulation Tests/methods"[Mesh]))) |
38981 |
|
#2 |
Search (((((((("Blood Coagulation"[Mesh]) OR "Blood Coagulation") OR "Blood Clotting") OR "Hemostasis"[Mesh]) OR "Hemostasis") OR "Haemostasis"))) |
173094 |
|
#1 |
Search ((("Centrifugation"[Mesh]) OR "Centrifugation") OR "Centrifugation/standards"[Mesh]) OR "Centrifugation/methods"[Mesh] |
92380 |
